生物高分子材料因其在食品工业领域的优势及潜在应用而受到广泛关注。生物高分子材料形成的膜是一类很好的载体,能够结合功能性成分如抗氧化剂、抗菌剂等各种添加剂,有效延长食品的货架期。应用最多的生物高分子材料通常是来自于天然的蛋白类(如明胶)和多糖类(如淀粉、壳聚糖和纤维素等)以及它们的复合物。
明胶(gelatin,G)是动物的皮、骨头、筋腱等胶原蛋白经过酸、碱和酶水解后形成的产物,具有良好的成膜性、可降解性、生物相容性,无毒和廉价易得等优点[1-2],但将明胶膜应用于含水量高的食品时,薄膜与水接触后可能膨胀、溶解或者分解。因此,需对明胶膜进行改性,以制备满足特定需求的食品包装产品。改善明胶基薄膜性能的方法主要包括物理改性法、化学改性法以及生物改性法。物理改性法通常采用超声波、辐照射线、超高压处理等提高明胶基薄膜的机械性能和疏水性能,但物理改性法存在专用设备耗资巨大、改性效率偏低、技术壁垒高等劣势。相比物理改性法,化学改性法则通过引入化学基团实现对蛋白质的修饰改性,外源化学基团的空间斥力和静电力会诱导蛋白质分子结构舒展,促进蛋白质三维网络结构的形成,以达到增强机械性能的目的。常见化学交联剂包括甲醛、乙二醛、戊醛、二异氰酸酯等,但这些交联剂存在生理毒性,在食品中的安全问题使其应用受到限制。生物改性法则是通过向明胶膜中添加生物来源的改性剂或者改性多糖晶体使明胶膜获得生物活性,进而改善其机械性能。董宇豪等[3]通过共混改性技术增强甜菜果胶/明胶膜的机械性能;也有研究采用氧化淀粉或改性淀粉晶体改善复合膜的力学性能。相比众多生物添加剂以及改性多糖晶体,磷酸化淀粉晶和百里香精油因其独特的化学结构和卓越的理化特性而成为当前明胶改性研究的热点。
磷酸化淀粉晶(phosphorylated starch crystals,PSC)是原淀粉通过酸水解和磷酸化复合修饰后得到的产物。与一般的淀粉不同,其含有疏水性的磷酸基团,可与明胶中的活性基团之间发生静电相互作用,增加明胶复合膜组分间的致密性,改善明胶膜的疏水性[4]。而百里香精油(thyme essential oil,TEO)是最具防腐功效的精油之一,其分子结构中含有较多的活性羟基,可作为电子供体,有效清除自由基,具有较强的抗氧化活性,并且TEO可在低浓度下对细菌的亚显微结构进行破坏,比如细胞壁、细胞膜、蛋白质、DNA、RNA及某些与代谢相关的酶等,导致细菌内容物流出,诱导细菌死亡[5]。有研究表明,向明胶/淀粉中添加精油等生物改性剂可赋予复合膜出色的抗氧化和抗菌活性,并可极大地拓展复合膜的应用领域(如延长蔬菜瓜果的货架期),但精油会弱化体系内蛋白质分子间的相互作用,致使体系的结构变得较粗疏,导致终产物的力学性能和屏蔽性能下降[6]。然而,可采用复合调控技术,通过向明胶膜中添加改性淀粉晶,并调控百里香精油的添加量,以制备出兼具优良屏蔽性能和生物活性的多功能食品保鲜膜。
本研究以明胶为基料,采用磷酸化淀粉晶作为增强剂改性明胶膜,并通过调控百里香精油的添加量,探究其对明胶/磷酸化淀粉晶成膜结构和理化特性的影响,通过复合调控技术,以期获得多功能明胶基食品保鲜膜,为明胶基抗菌复合膜在食品贮藏与保鲜领域的应用奠定理论基础。
1 材料与方法
1.1 材料和试剂
明胶(分析纯),西陇科学有限公司;蜡质玉米淀粉(食品级),普罗星淀粉厂;百里香精油(分析纯),上海源叶生物有限公司;甘油、Na2CO3,均为分析纯,阿拉丁生化技术有限公司;多聚磷酸钠(分析纯),天津市科密欧化学试剂开发中心;盐酸(分析纯),国药集团化学试剂有限公司;NaCl(分析纯),西陇科学股份有限公司;素琼脂(分析纯),北京鼎国昌盛生物技术有限责任公司;营养琼脂、营养肉汤(均为分析纯),北京路桥技术股份有限公司;其余试剂均为国产分析级。
1.2 仪器与设备
Avanti-J-26 sxp型高速冷冻离心机,美国Beckman公司;DF-101S型集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;PHSJ-4A型pH计,上海雷磁仪器厂;KM5200DE超声波清洗器,昆山美美超声仪器有限公司;FDU-1000型真空冷冻干燥机,东京理化器械独资工厂;TENSOR27型傅里叶变换红外光谱仪,德国布鲁克公司;NanoBrook Omni型激光粒度仪,美国布鲁克海文仪器公司;Cintra-1010型紫外分光光度计,澳大利亚科学设备有限公司;TCS-2000型拉伸测试机,中国试验机有限公司;JEM-7610-F型扫描电子显微镜,日本电子公司;DSA100型接触角测量仪,德国Kruss公司;SLI-700型恒温培养箱,东京理化器械独资工厂。
1.3 实验方法
1.3.1 淀粉晶的制备
参考SHANG等[7]的方法稍作改进。称取30 g蜡质玉米淀粉与600 mL盐酸(1.15 mol/L)混合在烧瓶中,在40 ℃水浴环境下搅拌7 d。反应结束后,对悬浮液采用蒸馏水多次离心水洗至中性,充分洗去盐酸,所得沉淀,冷冻干燥48 h,命名为SC。
1.3.2 磷酸化淀粉晶的制备
根据XIE等[8]的方法稍作改进。将50 g淀粉晶加入到100 mL蒸馏水的烧杯中,同时加入1 g Na2CO3、2.5 g NaCl和2 g多聚磷酸钠,将含有混合物的烧杯转移至50 ℃水浴环境中搅拌80 min。反应结束后,用HCl溶液(1 mol/L)调节溶液pH至 6.5,3 000 r/min离心10 min去除上清液,采用蒸馏水洗涤离心,重复5次,得到的沉淀经冷冻干燥后过筛(100目),得到的产物命名为PSC。
1.3.3 G/PSC/TEO复合膜的制备
根据先前所做的实验结果,添加质量分数为10%(相对于干基总质量)的淀粉与明胶制成的复合膜性能最优[9]。精确称取明胶2.7 g、磷酸化淀粉晶0.3 g和甘油0.45 g,将其均匀混合在含有45 mL蒸馏水的烧杯中,并向其中分别添加质量分数为4%、6%、8%(相对于干基总质量)的TEO,于70 ℃水浴环境中搅拌40 min,反应结束后,超声脱气15 min,将复合膜溶液转移至聚四氟乙烯模具中,置于60 ℃干燥箱中烘干48 h,得到复合膜。根据G/PSC/TEO复合膜的成分与TEO在G/PSC/TEO复合膜中的质量分数,将所得复合膜分别命名为G、G/PSC、G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%。
1.3.4 傅里叶变换红外光谱测定
参照BI等[10]的方法,采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪,对SC、PSC、G/PSC、G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%复合膜的结构进行分析,扫描波数范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3.5 ζ-电位和粒径的测定
参照CHEN等[11]的方法,稍作修改。将SC和PSC分别配制成20 mg/mL溶液,利用激光粒度仪测定粒径和ζ-电位,每个样品重复测量3次。
1.3.6 复合膜的紫外光谱测定
参照KWAK等[12]的方法,采用紫外可见分光光度计,在紫外和可见光范围(200~800 nm)下测量复合膜G、G/PSC、G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%的紫外光透过率。
1.3.7 复合膜的拉伸强度
参照WANG等[9]的方法,将薄膜分别切成2 cm×6 cm的矩形,拉伸强度根据ASTM D-3822《单纤维拉伸性能的测试》中的方法使用拉伸测试机进行分析。初始距离为100 mm,每个样品在室温下以50 mm/min的应变率进行3次测试。
1.3.8 微观结构测定
参照CHEN等[11]的方法,将复合膜切割成0.5 cm×0.5 cm的矩形,固定于导电胶,喷金,扫描电镜在15 kV下观察复合膜的表面微观形态。
1.3.9 接触角测定
参照KWAK等[12]的方法,将明胶复合膜切割成3 cm×3 cm的矩形,并放置在一个平面支架上,采用微型注射器将1滴(2 μL)蒸馏水轻轻滴到薄膜表面。在25 ℃下测量接触角,获得图像。
1.3.10 迁移动力学实验
参照S NCHEZ-GONZ
NCHEZ-GONZ LEZ等[13]的方法,略有修改。将复合膜切割成20 mm×20 mm的矩形,常温条件下,将其浸没在含有100 mL蒸馏水的烧杯中,每隔特定的时间取样,测定其在波长276 nm处的吸光度。遵循菲克第二定律,其扩散方程如公式(1)所示:
LEZ等[13]的方法,略有修改。将复合膜切割成20 mm×20 mm的矩形,常温条件下,将其浸没在含有100 mL蒸馏水的烧杯中,每隔特定的时间取样,测定其在波长276 nm处的吸光度。遵循菲克第二定律,其扩散方程如公式(1)所示:
![]() =ktn
=ktn
(1)
式中:mt,在t时释放的化合物的质量;m∞,释放的平衡化合物的质量;k,释放速率常数;n,释放指数。n<0.5表示Fick扩散,0.45<n<0.89表示非Fick扩散,n>0.89表示侵蚀机制。
1.3.11 DPPH自由基清除能力
参照JOUKI等[14]的方法。将1.3.3节烘干后的膜溶于45 mL的蒸馏水,在40 ℃水浴中搅拌10 min,在5 000 r/min离心5 min,取2 mL样品的上清液与2.5 mL 0.1 mol/L(1×10-4 mol/L)的DPPH乙醇溶液充分混合,室温下避光放置30 min后,将所得溶液8 000 r/min离心5 min,取上清液3 mL,测定其在波长517 nm处的吸光度,每个样品测定3次平行。DPPH自由基清除率计算如公式(2)所示:
DPPH清除率![]()
(2)
式中:Aa,DPPH乙醇溶液的吸光度值,Ab,样品溶液和DPPH溶液反应后的吸光度值。
1.3.12 抑菌效果测定
抑菌圈:新鲜膜溶液的抑菌性参照王枫林等[15]的方法稍作改进。牛津杯、培养基等实验用品121 ℃高压灭菌20 min。将超净工作台用紫外杀菌20 min后,取0.1 mL金黄色葡萄球菌菌液(1×106 CFU/mL),均匀涂布于营养琼脂平板上,利用牛津杯在培养基上打孔,将0.2 mL新鲜制备的膜溶液加入到孔中,37 ℃培养12 h,观察抑菌圈效果并拍照记录。
抑菌率:参照BI等[10]的方法,稍作改进。将1.3.3节烘干后的G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%膜溶于45 mL的蒸馏水,进行金黄色葡萄球菌抑菌率测试,均在液体LB培养基中培养。超净工作台用紫外杀菌20 min后,在无菌条件下,将1 mL细菌悬液(1×107CFU/mL)、3 mL复溶后的膜溶液和50 mL的LB肉汤培养基培养24 h。然后用紫外分光光度计测定其在波长600 nm处的吸光度值,抑菌率计算如公式(3)所示:
抑菌率![]()
(3)
式中:OD1,不加样品含有菌液的液态培养基的吸光度;OD2,含有样品和菌液的液态培养基的吸光度;OD3,含有样品不含有菌液的液态培养基的吸光度。
1.4 数据统计与分析
试验重复3次,取平均值,用 SPSS 21软件进行 Duncan 单因素方差分析,采用Origin 9.1作图。
2 结果与分析
2.1 磷酸化淀粉结构分析
2.1.1 FTIR
如图1所示,SC和PSC之间有相似的特征峰,在3 389 cm-1处的宽峰是由于—OH的伸缩振动所致。而2 750~3 000 cm-1处的尖峰是因为H—C—H的不对称C—H拉伸振动引起的。相比于SC红外光谱图,PSC在1 082和928 cm-1处的吸收峰,分别归因于P—OH键和P—O—C键的伸缩振动,而出现在1 246 cm-1处的峰,可能是P![]() O键的不对称伸缩振动引起的[16]。结果表明,多聚磷酸钠通过离子键成功吸附在淀粉晶体表面。
O键的不对称伸缩振动引起的[16]。结果表明,多聚磷酸钠通过离子键成功吸附在淀粉晶体表面。
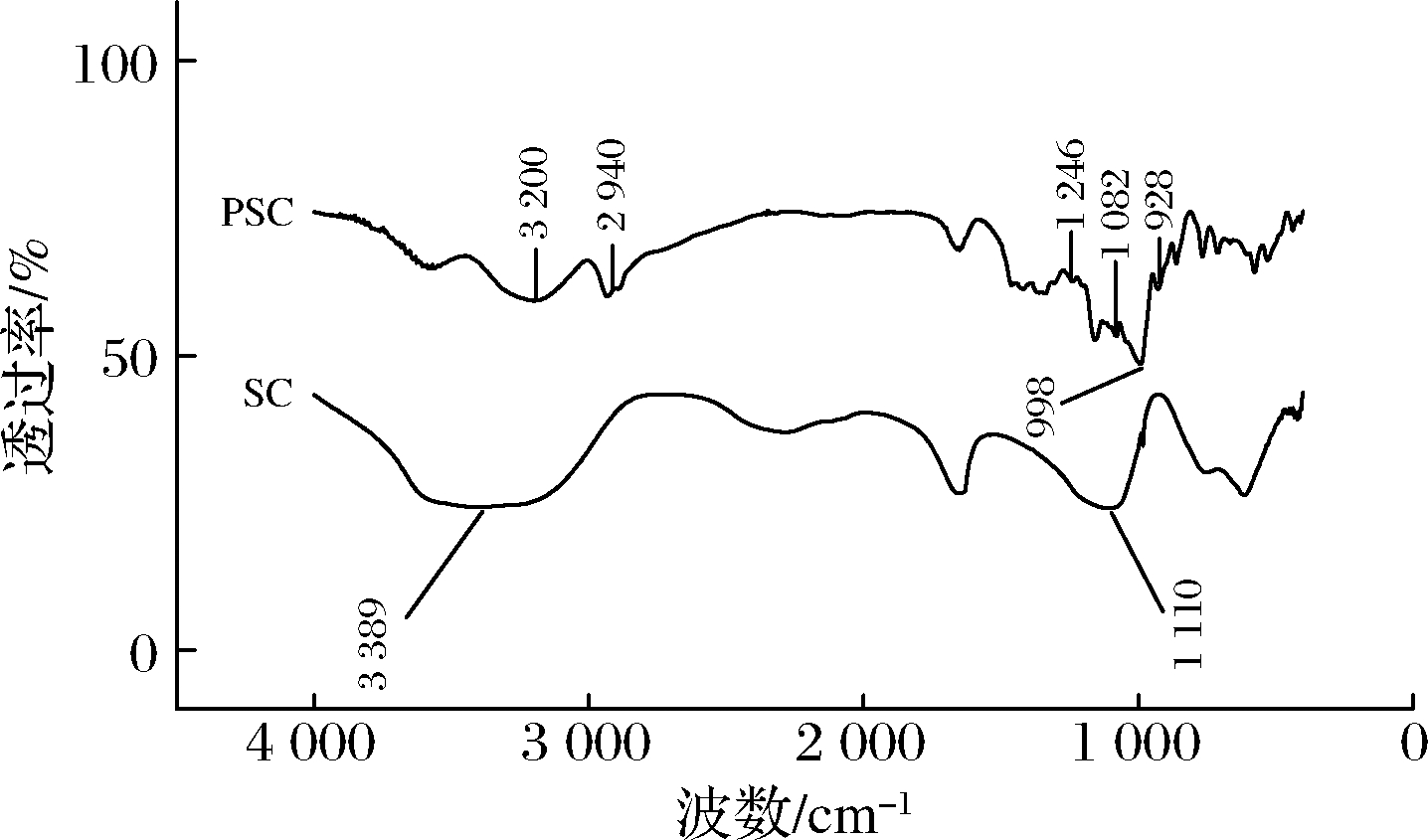
图1 SC和PSC的傅里叶变换红外光谱图
Fig.1 Fourier transform infrared spectra of SC and PSC
2.1.2 ζ-电位和粒径分析
ζ-电位是粒子的表面电荷,电位绝对值越高,表示悬浮液分散体系越稳定[17]。图2-a结果表明,SC经过磷酸化改性后ζ-电位的绝对值增大,可能是磷酸基团与SC中的活性基团发生了静电相互作用,促使PSC电位绝对值变大[18]。SC和PSC的粒径如图2-b所示,结果表明,SC经过多聚磷酸钠的修饰,结晶结构进一步被侵蚀,导致粒径减小。因此,SC经过磷酸化修饰后其亲水性羟基与磷酸基团之间发生离子相互作用生成PSC,相比于SC,PSC表现出较大的电位绝对值和较小的粒径,其稳定性得到了进一步的改善。

a-ζ-电位;b-粒径
图2 SC和PSC的ζ-电位和粒径
Fig.2 Zeta potential and particle size of SC and PSC
注:不同小写字母表示0.05水平下组间有显著性差异(下同)。
2.2 磷酸化淀粉晶/明胶/百里香精油结构表征
红外光谱可以有效表征复合物内部组分之间的相互作用。如图3-a所示,位于3 000~3 500 cm-1处的宽峰是由于—OH伸缩振动引起的,相比于G和G/PSC复合膜,添加TEO后,G/PSC/T复合膜在3 000~3 500 cm-1处的吸收峰强度随着精油含量的增加而增大,波数发生了不同程度的红移或蓝移,峰形逐渐变宽,而位于2 936 cm-1处的吸收峰(脂肪族—CH3的C—H拉伸振动)也随着精油含量的增加发生了位移,可能是明胶分子中的活性基团与PSC中的羟基以及TEO中的酚羟基之间产生了分子间相互作用(如氢键、静电相互作用和疏水相互作用)所致。

a-波数400~4 000 cm-1;b-波数1 000~2 000 cm-1
图3 复合膜的傅里叶变换红外光谱图
Fig.3 FTIR of composite films
G、G/PSC、G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%复合膜位于1 000~2 000 cm-1的红外局部放大图如图3-b所示。位于1 660、1 540、1 245 cm-1左右处的峰分别表示酰胺I(C![]() O拉伸/氢键与COO耦合的伸缩振动引起的)、酰胺II(NH基团和CN基团的伸缩振动引起)和酰胺III(CN基团和NH基团的平面弯曲振动或甘氨酸的CH2基团的振动引起的)。相比于G膜,添加PSC后,复合膜的酰胺I和II的波数向短波方向移动,可能是PSC中的磷酸化基团与明胶分子结构中的—NH2发生了静电相互作用所致。然而相比于G/PSC复合膜,添加TEO后,复合膜的酰胺I、II和III均发生了不同程度的偏移,表明精油中的羟基和明胶中的氨基、巯基以及磷酸化淀粉羟基之间发生了分子间相互作用(如疏水相互作用、静电相互作用等)。
O拉伸/氢键与COO耦合的伸缩振动引起的)、酰胺II(NH基团和CN基团的伸缩振动引起)和酰胺III(CN基团和NH基团的平面弯曲振动或甘氨酸的CH2基团的振动引起的)。相比于G膜,添加PSC后,复合膜的酰胺I和II的波数向短波方向移动,可能是PSC中的磷酸化基团与明胶分子结构中的—NH2发生了静电相互作用所致。然而相比于G/PSC复合膜,添加TEO后,复合膜的酰胺I、II和III均发生了不同程度的偏移,表明精油中的羟基和明胶中的氨基、巯基以及磷酸化淀粉羟基之间发生了分子间相互作用(如疏水相互作用、静电相互作用等)。
2.3 磷酸化淀粉晶/明胶/百里香精油理化特性表征
2.3.1 复合膜的光学性能分析
如图4所示,明胶膜在200~400 nm的透光率高于其他复合膜组,表明明胶的紫外屏蔽能力较弱。添加磷酸化淀粉晶后,PSC/G复合膜在200~400 nm区域内的透光率低于明胶膜,这是因为磷酸化淀粉晶体中的磷酸基与明胶中的氨基残基反应形成杂环衍生物,可以有效地吸收紫外线[12]。然而,随着百里香精油质量分数的增加,G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%复合膜在200~400 nm的透光率逐渐降低,这可能是百里香精油引起的紫外光线散射所致[19]。张群利等[20]以鱼鳞明胶和壳聚糖为原料,添加薰衣草精油制备复合膜,表明添加壳聚糖和精油均能降低复合膜的透光率,且随着精油含量增大,复合膜透光率越低,本文研究结果与其一致。综上,本文通过添加PSC和TEO均能有效降低复合膜的透光率,且PSC/G/T-8%复合膜具有最低的紫外透过率,表明其在食品的包装应用时可以有效屏蔽紫外线,延缓食品氧化。
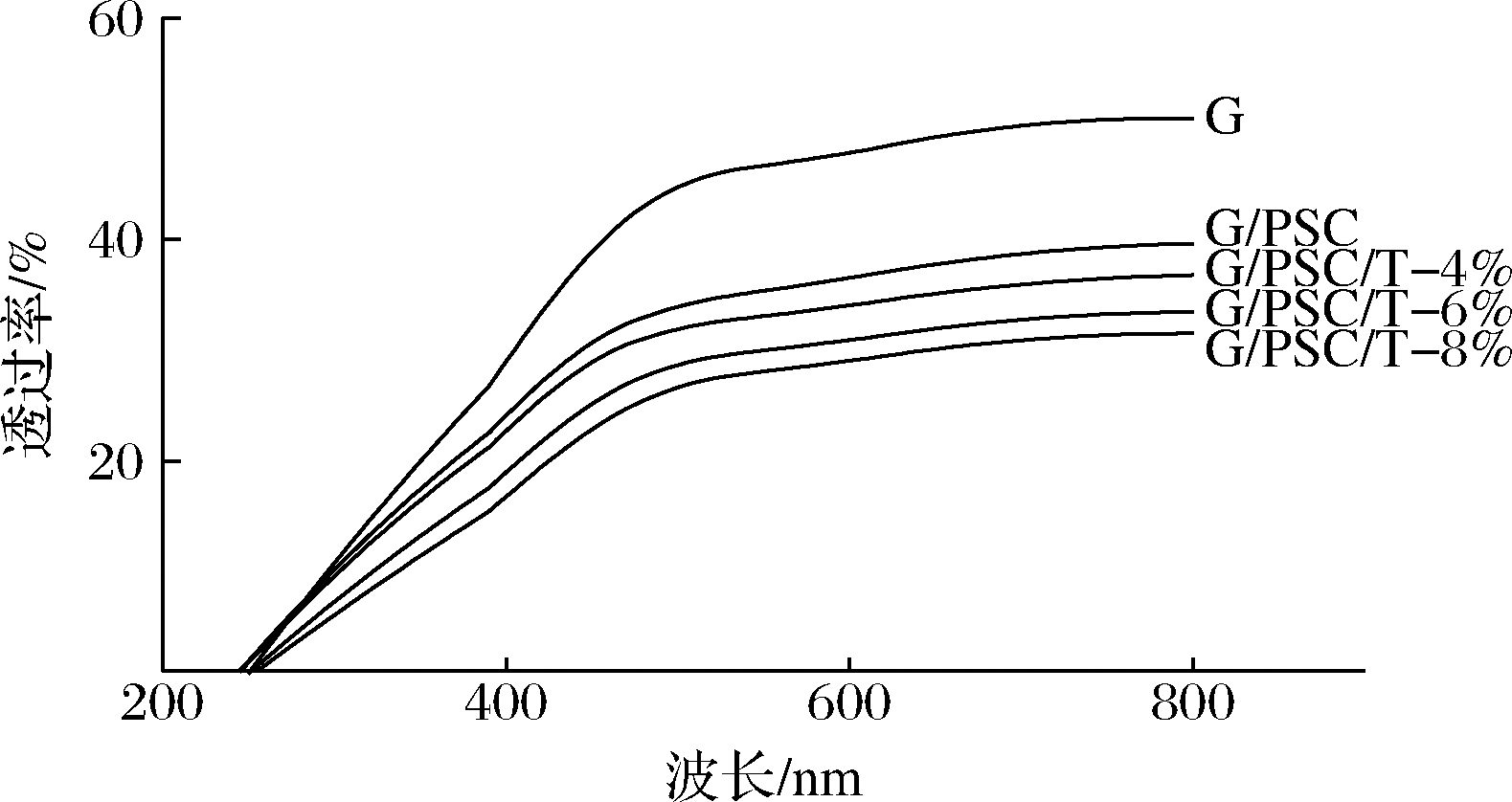
图4 复合膜的紫外可见光谱
Fig.4 UV-vis spectra of the composite film
2.3.2 复合膜的拉伸强度(tensile strength,TS)
食品包装膜的机械强度和柔韧性对薄膜结构的完整性具有重要意义,包装材料需要较强的拉伸强度以承受流动过程中的压力[21]。如图5所示,明胶膜具有较低的抗拉伸强度(9.7 MPa),这可能是由于其固有的脆性所致。添加PSC后,复合膜拉伸强度增加到(18.45 MPa)。随着TEO的加入,薄膜的抗拉伸强度逐渐降低,但仍高于明胶膜。PSC/G/4%-T的薄膜TS值最大(15 MPa),PSC/G/8%-T的薄膜TS值最小(10.6 MPa)。精油的加入充当增塑剂的作用,疏水化合物油脂的扩散增加了聚合物分子间相互作用的难度,从而使内聚力降低,导致复合膜的抗拉强度降低[22]。李鑫等[23]在研究不同精油对鱼明胶膜影响时,结果表明精油的添加也会导致明胶膜拉伸性能降低。本实验采用磷酸化淀粉晶与明胶共混由于PSC分子中的—OH与明胶分子中的—NH2的相互作用,使明胶的拉伸强度提高,采用复配调控技术添加百里香精油,在赋予明胶复合膜生物活性的同时,也缓解了精油对复合膜机械性能的削弱效应。
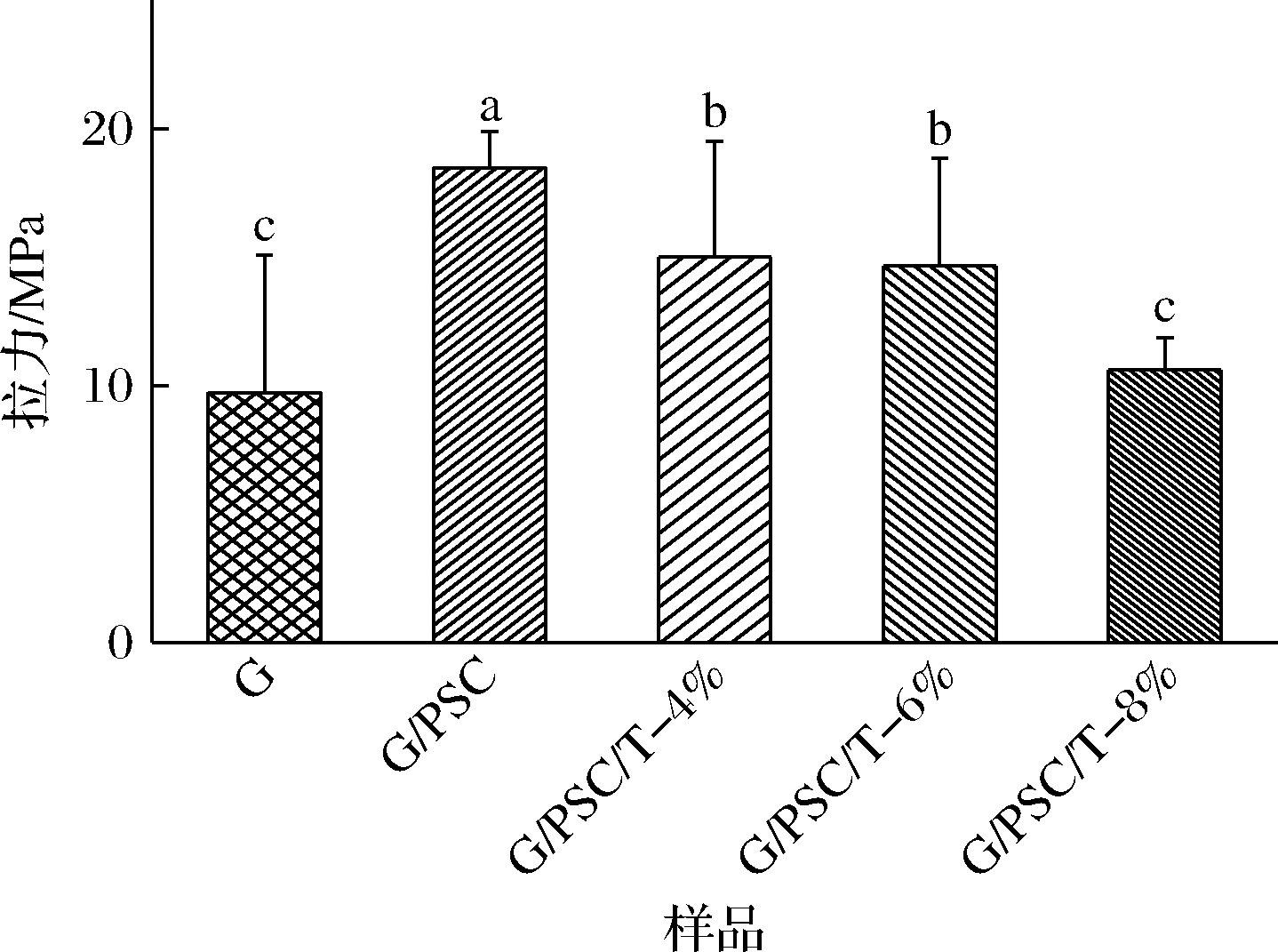
图5 复合膜的拉伸强度
Fig.5 Tensile strength of composite film
2.3.3 复合膜的接触角
复合膜的疏水性在食品包装中发挥着重要作用,可通过测定接触角来评价复合膜的疏水性[24]。当接触角θ<90°时,表面呈亲水性,当接触角θ>90°时,表面呈疏水性。复合膜的水接触角如图6所示,图6-a中明胶膜的接触角θ<90°,表明其表面呈亲水性,这可能是明胶亲水性氨基酸基团(如丝氨酸、苏氨酸、天冬氨酸和谷氨酸等)与水分子相互作用引起的。而在添加了PSC后,G/PSC复合膜的接触角增加到112.04°,是由于PSC与明胶发生交联相互作用,提高了复合膜的疏水性(图6-b)。当复合膜中TEO的质量分数为4%和6%时,复合膜的接触角分别降低到101.44°和91.24°,较低质量分数的TEO虽在一定程度上降低了复合膜的表面疏水性能,但相比于明胶膜,仍表现出较强的疏水性能。但当TEO质量分数增加到8%时(图6-e),复合膜的接触角为86.15°,是由于TEO的添加量达到阈值,使复合膜的三维结构变得较为稀疏,表面呈亲水性。因此,质量分数较高的TEO会削弱复合膜体系间的相互作用,导致内聚力变差,与水分子间的相互作用增强,疏水性能减弱。相关研究表明,当复合膜负载精油浓度达到临界阈值时,会削弱体系内部分子间相互作用,降低复合膜的疏水性[25]。因此,相比于明胶膜,添加PSC的复合膜,其体系致密性增加,疏水性增强;添加较低质量分数的TEO时,体系致密性有所减弱,但仍表现出较强的疏水性能,当TEO添加量为8%时,复合膜呈现出亲水性。李鑫等[23]在研究添加生姜精油、大蒜精油、肉桂精油、薄荷精油和百里香精油对明胶膜的水溶解性影响时发现,精油会使明胶膜结构变得疏松,并降低复合膜的疏水性。因此,本研究通过调控磷酸化淀粉晶和百里香精油的过程参数,可以在一定程度上缓解精油对复合膜疏水性的削弱效应。
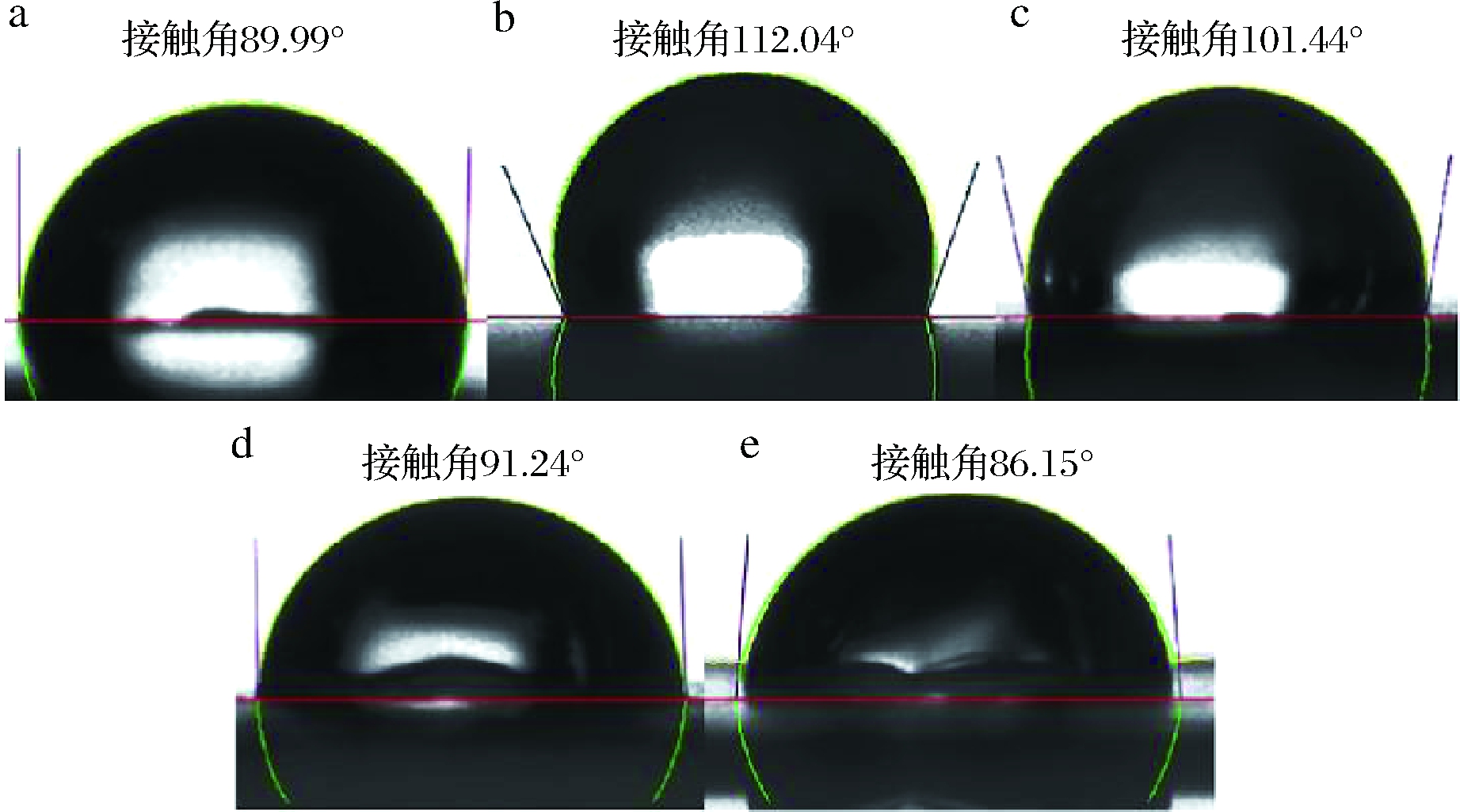
a-G复合膜;b-G/PSC复合膜;c-G/PSC/T-4%复合膜;d-G/PSC/T-6%复合膜;e-G/PSC/T-8%复合膜
图6 复合膜接触角
Fig.6 Contact angle of composite films
2.3.4 复合膜的表观形态
复合膜的表观形态与其微观结构和组成密切相关。如图7所示,G膜与G/PSC膜和G/PSC/T膜在表观性能上存在一定差异,G膜呈现纤维结构。相比于G膜,由于G和PSC的交联相互作用,G/PSC膜呈现紧凑和光滑的表面,而加入TEO后,G/PSC/T-4%和G/PSC/T-6%复合膜表面可观察到许多颗粒,变得比较粗糙,呈纤维状散射分布。当TEO质量分数增加至8%时,复合膜表面有许多明显可见气孔,是由于精油添加量达到了临界阈值,导致体系内组分间的相互作用减弱。TURAL等[26]也发现添加TEO会降低蛋白复合膜体系间的相互作用,减弱其致密性。

图7 复合膜的扫描电镜图
Fig.7 SEM images of composite films
2.3.5 复合膜的迁移动力学
G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%复合膜在水溶液中精油的释放过程如图8所示。复合膜中精油的释放会受到多种因素的影响,如精油的浓度、模拟溶剂的极性、生物聚合物与精油之间的相互作用、复合膜的结构和体系的温度等。图8的结果显示,TEO质量分数越高,其在水溶液中释放量(mt/m∞)越大,与之前ALMASI等[27]的研究一致。为了评估TEO从薄膜中释放的机制,复合膜在水体环境中的扩散指数n和速率常数k如表1所示,复合膜的扩散指数n值均小于0.5,表明精油在水中的释放规律符合菲克第二定律[28]。在释放的初始阶段,水分子逐渐进入膜基质导致复合膜膨胀和溶解,复合膜基质间的界面体系失稳,随着复合膜中TEO质量分数的增加,其释放速率k值显著增大(P<0.05),百里香精油也由突释阶段转向平缓期,实现了百里香精油的长效控释。因此,通过调控PSC和TEO在明胶复合膜体系内的过程参数,可实现百里香精油的长效控释,为多功能保鲜膜的制备奠定理论基础。
表1 在不同的精油含量下的扩散指数n和速率常数k
Table 1 Diffusion index n and rate constant k at different essential oil levels
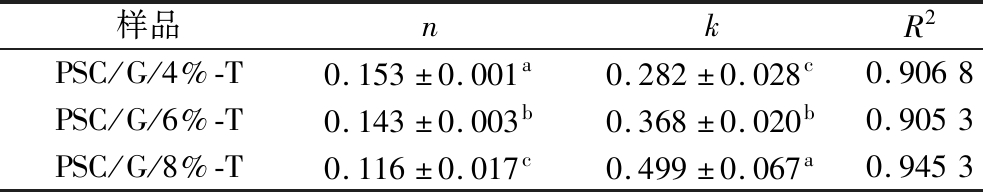
样品nkR2PSC/G/4%-T0.153±0.001a0.282±0.028c0.9068PSC/G/6%-T0.143±0.003b0.368±0.020b0.9053PSC/G/8%-T0.116±0.017c0.499±0.067a0.9453
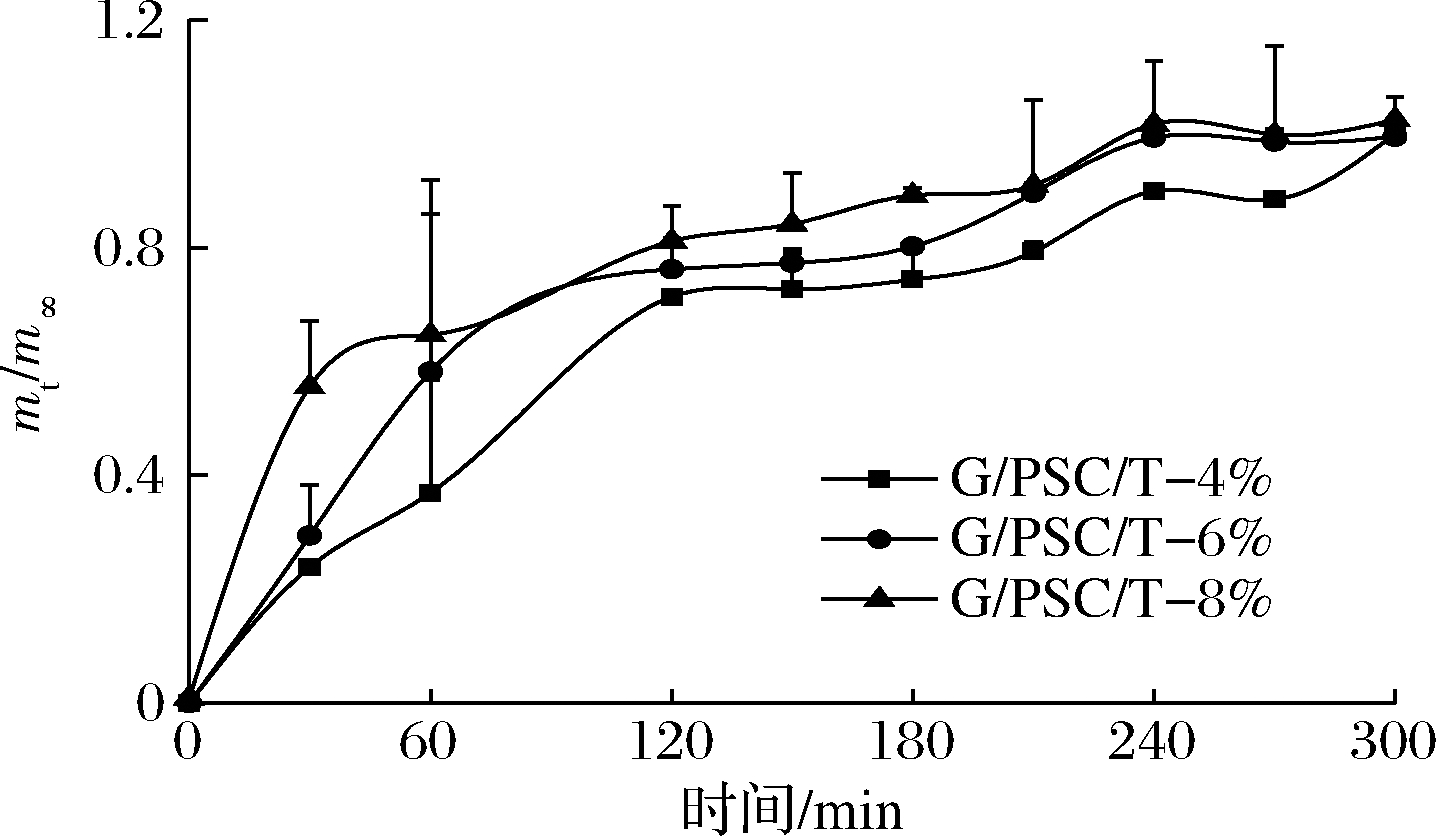
图8 添加不同TEO的复合膜在蒸馏水中的释放
Fig.8 Release of the functional film with different TEO in distilled water
2.4 磷酸化淀粉晶/明胶/百里香精油功能特性表征
2.4.1 复合膜的DPPH自由基清除率
DPPH是一种稳定的自由基,广泛用于表征提取物的体外抗氧化能力[29]。如图9所示,空白明胶膜的DPPH清除率为14.12%,由于明胶分子中含有游离的甘氨酸和脯氨酸,进而赋予明胶一定的抗氧化活性,但这些游离氨基酸作为电子供体,中和DPPH的能力有限,导致明胶的抗氧化活性较弱。添加PSC后,G/PSC复合膜的DPPH清除率为35.91%,相比于明胶膜,其抗氧化活性均有所增强,因为磷酸化后的淀粉晶,其供氢能力增加,增大了复合膜的抗氧化活性[16]。然而,G/PSC复合膜的抗氧化活性仍不能满足多功能食品保鲜的需求。向G/PSC中添加TEO后,G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%复合膜的自由基清除活性分别为46.73%、57.93%和72.85%,含有TEO的复合膜其抗氧化活性均显著提高(P<0.05),TEO中的活性酚羟基作为供电子基团,将活泼氢原子传递给自由基,诱导DPPH生成稳定的自由基基团。

图9 DPPH自由基清除率
Fig.9 DPPH clearance rate
相比于程珊等[30]的研究,将羧甲基纤维素与胶原制备复合膜以提高复合膜的稳定性,本研究在提高明胶膜的稳定性的同时,再添加TEO赋予明胶膜较强抗氧化活性,为开发多功能性食品保鲜膜提供了理论基础。
2.4.2 复合膜的抗菌性分析
金黄色葡萄球菌是导致众多食品变质的腐败菌之一,通过研究制备的膜溶液和膜复溶后的溶液对金黄色葡萄球菌的抑制作用,进一步评价复合膜的抗菌性能,结果如图10所示。

a-复合膜制备的成膜溶液抑菌圈;b-膜复溶的溶液抑菌率
图10 复合膜对金黄色葡萄球菌的抑制效果
Fig.10 Inhibitory effect of the functional film on Staphylococcus aureus
图10-a结果表明,纯明胶膜的抑菌性能很差;添加PSC后仍没有抑菌性;而含有TEO的复合膜呈现出良好的抑菌效果,当TEO质量分数为4%和6%时,复合膜均呈现出良好的抑菌效果,随着TEO质量分数的增大,其对金黄色葡萄球菌的抑制效果越明显,当TEO质量分数为8%时,G/PSC/T复合膜对金黄色葡萄球菌抑制效果最佳。但考虑到烘干后的膜会因为精油的蒸发损失,抑菌圈不能定量分析复合膜的抑菌效果,对G/PSC/T-4%、G/PSC/T-6%和G/PSC/T-8%的复合膜进行抑菌率定量测定。结果如图10-b所示,添加4%、6%和8%TEO的复合膜抑菌率分别为31.02%、59.27%和69.96%。结果表明,随着TEO质量分数增大,复合膜对金黄色葡萄球菌的抑制效果越明显(P<0.05)。相比于PARK等[31]利用海藻酸钠二醛对明胶交联改性,可以提高其机械性能以及赋予较高的抗氧化活性,而本研究选择添加TEO不仅可以提高抗氧化活性,还能增强薄膜的抑菌性能。当TEO质量分数为8%时,G/PSC/T复合膜对金黄色葡萄球菌抑制效果最佳,高浓度的TEO会诱导金黄色葡萄球菌细胞膜破损溶解,导致细胞皱缩,致使细胞内容物外漏,引起细菌死亡。
3 讨论与结论
明胶作为一种蛋白来源的可降解生物材料,具有较好的成膜能力和生物相容性,但明胶生物功效单一、延展性以及抗水性差,极大地限制了其在食品工业领域的应用。可通过生物改性法增强其抗氧化性、抗菌性以及力学性能,从而拓宽其在肉制品、水产品等领域的保鲜应用。传统的生物改性法,效果单一,使膜的性能提升有限。先前已有研究将柑橘精油[6]用于提高明胶膜的生物活性,将普鲁兰多糖[32]用于提高明胶的机械性能,但传统精油改性或多糖改性的明胶复合膜,所得终产品的功能特性提高有限,难以满足市场需求。本研究采用复配调控技术,向明胶中同时添加PSC和TEO,通过调控TEO的添加量,赋予明胶复合膜生物活性的同时改善其理化性能。结果表明,添加PSC后,明胶基复合膜的致密性、疏水性和机械性能得到改善,但抗氧化性和抗菌活性仍不能满足多功能食品复合膜的要求。相比于G/PSC膜,添加4%的TEO后,复合膜兼具良好的疏水性、抗菌和抗氧化活性;当TEO质量分数增加到8%时,复合膜呈现出较强紫外线屏蔽性能、抗菌和抗氧化活性,且G/PSC/T复合膜均可在水体环境中实现百里香精油的长效控释。因此,可根据食品原料属性的差异性,通过向明胶中添加磷酸化淀粉晶和百里香精油,采用复配调控技术构筑三元交联网络体系,从而制备多功能食品保鲜膜,为明胶基多功能食品保鲜膜的开发奠定理论基础。
[1] 杨晖,马良,韩霜,等.甘油添加量对兔皮明胶膜性能与结构的影响[J].食品科学,2016,37(17):14-18.
YANG H,MA L,HAN S,et al.Effect of glycerol content on properties and structure of rabbit skin gelatin film[J].Food Science,2016,37(17):14-18.
[2] 陈婷,赵九阳,刘玉梅.明胶-壳聚糖抗菌膜中啤酒花提取物的释放行为[J].食品科学,2020,41(3):151-158.
CHEN T,ZHAO J Y,LIU Y M.Release behavior of incorporated hop extract from gelatin-chitosan antibacterial film[J].Food Science,2020,41(3):151-158.
[3] 董宇豪,陈浩,刘世永,等.甜菜果胶-鱼明胶复合可食膜的制备及特性研究[J].食品科学技术学报,2019,37(2):88-93;101.
DONG Y H,CHEN H,LIU S Y,et al.Preparation and properties of sugar beet pectin-fish gelation edible composite film[J].Journal of Food Science and Technology,2019,37(2):88-93;101.
[4] 张立娟,李昕,杨深怡,等.磷酸化协同超声波处理对玉米淀粉改性的研究[J].食品研究与开发,2021,42(15):124-131.
ZHANG L J,LI X,YANG S Y,et al.Modification of corn starch by combining phosphorylation and ultrasonication[J].Food Research and Development,2021,42(15):124-131.
[5] 王颖,王亮,李冬雪,等.调味香料麻椒及花椒属植物精油的研究进展综述[J].中国调味品,2021,46(8):174-179.
WANG Y,WANG L,LI D X,et al.Review on the research progress of essential oils from flavoring spices pepper and Zanthoxylum plants[J].China Condiment,2021,46(8):174-179.
[6] 张金磊,陈兴煌.明胶柑橘精油复合膜对草莓保鲜效果的影响[J].农产品加工,2021(19):17-20;24.
ZHANG J L,CHEN X H.Effect of gelatin and citrus essential oil composite film on strawberry preservation[J].Farm Products Processing,2021(19):17-20;24.
[7] SHANG Y Q,CHAO C,YU J L,et al.Starch spherulites prepared by a combination of enzymatic and acid hydrolysis of normal corn starch[J].Journal of Agricultural and Food Chemistry,2018,66(25):6357-6363.
[8] XIE Y,ZHANG B,LI M N,et al.Effects of cross-linking with sodium trimetaphosphate on structural and adsorptive properties of porous wheat starches[J].Food Chemistry,2019,289:187-194.
[9] WANG P K,WANG Y,HONG P Z,et al.Di-aldehyde starch crystal:A novel bio-crosslinker for strengthening the structure and physio-chemical properties of gelatin-based films[J].Food Bioscience,2021,43:101308.
[10] BI J R,TIAN C,ZHANG G L,et al.Novel procyanidins-loaded chitosan-graft-polyvinyl alcohol film with sustained antibacterial activity for food packaging[J].Food Chemistry,2021,365:130534.
[11] CHEN Y,HAO Y C,TING K,et al.Preparation and emulsification properties of dialdehyde starch nanoparticles[J].Food Chemistry,2019,286:467-474.
[12] KWAK H W,LEE H,PARK S,et al.Chemical and physical reinforcement of hydrophilic gelatin film with di-aldehyde nanocellulose[J].International Journal of Biological Macromolecules,2020,146:332-342.
[13] S NCHEZ-GONZ
NCHEZ-GONZ LEZ L,CH
LEZ L,CH FER M,GONZ
FER M,GONZ LEZ-MART
LEZ-MART NEZ C,et al.Study of the release of limonene present in chitosan films enriched with bergamot oil in food simulants[J].Journal of Food Engineering,2011,105(1):138-143.
NEZ C,et al.Study of the release of limonene present in chitosan films enriched with bergamot oil in food simulants[J].Journal of Food Engineering,2011,105(1):138-143.
[14] JOUKI M,ALI MORTAZAVI S,YAZDI F T,et al.Characterization of antioxidant-antibacterial quince seed mucilage films containing thyme essential oil[J].Carbohydrate Polymers,2014,99:537-546.
[15] 王枫林,王秀华,张宇哲,等.杀鱼假交替单胞菌2515的抗弧菌效果及在对虾养殖中的应用[J].中国水产科学,2021,28(7):903-913.
WANG F L,WANG X H,ZHANG Y Z,et al.Anti-vibrio effect of Pseudoalteromonas piscicida 2515 and its application in shrimp culture[J].Journal of Fishery Sciences of China,2021,28(7):903-913.
[16] XIA S L,ZHAI Y C,WANG X,et al.Phosphorylation of polysaccharides:A review on the synthesis and bioactivities[J].International Journal of Biological Macromolecules,2021,184:946-954.
[17] FARDOUS J,OMOSO Y,JOSHI A,et al.Development and characterization of gel-in-water nanoemulsion as a novel drug delivery system[J].Materials Science &Engineering.C,Materials for Biological Applications,2021,124:112076.
[18] 戴理民.淀粉纳米晶的高效制备及其复合涂膜的构建与应用研究[D].杭州:浙江大学,2020.
DAI L M.Efficient preparation of starch nanocrystals and construction and application of its composite coating[D].Hangzhou:Zhejiang University,2020.
[19] TONGNUANCHAN P,BENJAKUL S,PRODPRAN T.Physico-chemical properties,morphology and antioxidant activity of film from fish skin gelatin incorporated with root essential oils[J].Journal of Food Engineering,2013,117(3):350-360.
[20] 张群利,罗灏,崔琳琳,等.鱼鳞明胶/壳聚糖/薰衣草精油抗菌复合膜的制备及性能[J].精细化工,2022,39(11):2259-2267.
ZHANG Q L,LUO H,CUI L L,et al.Preparation and properties of fish scale gelatin/chitosan/lavender essential oil antibacterial composite membrane[J].Fine Chemicals,2022,39(11):2259-2267.
[21] 周文艺,蔡文韬,吴泽玲,等.植物精油壳聚糖基活性包装膜的制备及保鲜效果研究[J].食品与发酵工业,2022,48(24):157-165.
ZHOU W Y,CAI W T,WU Z L,et al.Study on preparation and preservation effect of chitosan-based active packaging film of plant essential oil[J].Food and Fermentation Industries,2022,48(24):157-165.
[22] ACEVEDO-FANI A,SALVIA-TRUJILLO L,ROJAS-GRAÜ M A,et al.Edible films from essential-oil-loaded nanoemulsions:Physicochemical characterization and antimicrobial properties[J].Food Hydrocolloids,2015,47:168-177.
[23] 李鑫,涂宗财,沙小梅,等.添加不同来源精油对鱼明胶复合膜抗菌性质及物理性能的影响[J].食品与发酵工业,2020,46(20):33-39.
LI X,TU Z C,SHA X M,et al.Effects of adding different essential oils on antimicrobial activity and physical properties of fish gelatin composite films[J].Food and Fermentation Industries,2020,46(20):33-39.
[24] KARIM M,FATHI M,SOLEIMANIAN-ZAD S.Incorporation of zein nanofibers produced by needle-less electrospinning within the casted gelatin film for improvement of its physical properties[J].Food and Bioproducts Processing,2020,122:193-204.
[25] LI X X,YANG X,DENG H,et al.Gelatin films incorporated with thymol nanoemulsions:Physical properties and antimicrobial activities[J].International Journal of Biological Macromolecules,2020,150:161-168.
[26] TURAL S,TURHAN S.Properties and antioxidant capacity of anchovy (Engraulis encrasicholus) by-product protein films containing thyme essential oil[J].Food Technology and Biotechnology,2017,55(1):77-85.
[27] ALMASI H,AZIZI S,AMJADI S.Development and characterization of pectin films activated by nanoemulsion and Pickering emulsion stabilized marjoram (Origanum majorana L.) essential oil[J].Food Hydrocolloids,2020,99:105338.
[28] MEHRAN M,MASOUM S,MEMARZADEH M.Microencapsulation of Mentha spicata essential oil by spray drying:Optimization,characterization,release kinetics of essential oil from microcapsules in food models[J].Industrial Crops and Products,2020,154:112694.
[29] 胡清宇,罗爱国,岳羽艳.核桃枝多酚含量测定及体外抗氧化活性研究[J].广州化工,2021,49(18):25-27;30.
HU Q Y,LUO A G,YUE Y Y.Antioxidant activity of walnut branch polyphenols in vitro[J].Guangzhou Chemical Industry,2021,49(18):25-27;30.
[30] 程珊,王稳航,滕安国,等.羧甲基纤维素强化胶原纤维膜的制备及其性能分析[J].食品科学,2019,40(3):194-201.
CHENG S,WANG W H,TENG A G,et al.Preparation and property analysis of carboxymethyl cellulose-reinforced collagen fiber film[J].Food Science,2019,40(3):194-201.
[31] PARK J,NAM J,YUN H,et al.Aquatic polymer-based edible films of fish gelatin crosslinked with alginate dialdehyde having enhanced physicochemical properties[J].Carbohydrate Polymers,2021,254:117317.
[32] 高丹丹,徐学玲,江连洲,等.普鲁兰多糖-明胶可食性膜的特性[J].食品科学,2014,35(1):69-73.
GAO D D,XU X L,JIANG L Z,et al.Properties of pullulan-gelatin composite films[J].Food Science,2014,35(1):69-73.