黄豆苷元(daidzein,DAI),即4′,7-二羟基异黄酮,又称大豆苷元,是从豆科植物中提取的一种异黄酮,在大豆中含量尤为丰富;具有抗炎、抗癌、预防和治疗心血管疾病等多种生理活性[1]。葛根素(puerarin,PUE),即8-β-D-葡萄吡喃糖-4′,7-二羟基异黄酮,是从豆科植物野葛根或甘葛藤中分离出来的主要活性成分,其生理活性多样,包括抗氧化、抗癌、抗血栓等,也是Ⅱ型糖尿病的潜在抑制剂[2]。PUE还具有抑制轮状病毒的作用,可调节因轮状病毒感染导致的炎症反应[3]。然而,DAI和PUE口服利用度低,限制了其在食品和医药行业中的应用。药代动力学试验表明,PUE在机体内的代谢时间短,大鼠灌服10 mg/kg后的血药质量浓度仅为140~230 μg/L[4]。小鼠试验表明,DAI混悬液口服利用度仅为6.1%[5]。可见,改善DAI和PUE的生物利用度是亟待解决的问题。
将生物大分子经过适宜的构建形成纳米粒子、凝胶、乳液等,用于负载和包埋活性小分子,是改善其生物利用度的有效途径[6]。据报道,经β-环糊精、甲基-β-环糊精、γ-环糊精负载后,DAI的溶解性改善[7-8]。以胰蛋白酶酶解后的大米蛋白为原料构建的大米蛋白酶解物-DAI复合纳米粒子对DAI具有较好的载荷性[9]。以卵磷脂为基质构建的DAI纳米混悬剂的溶解度、体外小肠吸收量、生物利用度分别是游离DAI的5.33倍、1.62倍、5.53倍[10]。此外,经微乳化给药系统负载后,再添加羟丙基甲基纤维素和十二烷基硫酸钠共稳定剂制成的纳米混悬剂提高了DAI的水溶性和生物利用度[11]。热诱导蛋白质水凝胶是PUE的良好载体[6]。PUE与β-环糊精、羟丙基-β-环糊精和甲基-β-环糊精形成复合物后,溶解度和热稳定性得到改善,抗氧化性也优于游离PUE[12]。PUE与脱氧胆酸盐/磷脂形成混合胶束后,水溶性提高了22.3倍[13]。可见,生物大分子负载与包埋可有效提高DAI和PUE的溶解性和生物利用度。
乳清蛋白是牛乳中存在的一类蛋白质,主要由α-乳白蛋白、β-乳球蛋白、牛血清白蛋白以及免疫球蛋白组成[14]。乳清蛋白具有诸多出色的功能特性,可作为食品增稠剂、凝胶剂、稳定剂、乳化剂,以及微胶囊壁材、疏水活性成分的运载基质等[15]。经乳清蛋白负载后,姜黄素的DPPH自由基清除活性显著提高;在模拟胃肠液条件下,乳清蛋白纳米纤维可以控制姜黄素的释放,提高其生物利用度[16]。然而,乳清蛋白对DAI、PUE的负载机制及其复合物性质研究较少。
本文以乳清蛋白为基质,以DAI/PUE为配体,制备乳清蛋白-DAI(whey protein-daidzein,WD)、乳清蛋白-葛根素(whey protein-puerarin,WP)复合物,利用荧光光谱法解析乳清蛋白与DAI/PUE的作用机理;采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X-射线衍射(X-ray diffractometer,XRD)、粒径分析等手段表征复合物结构;进而分析了复合物的热稳定性、抗氧化性,并评价了模拟胃肠消化过程中复合物对DAI、PUE的释放特性。研究结果可为DAI和PUE生物利用度提升提供理论基础和参考依据。
1 材料与方法
1.1 材料与试剂
黄豆苷元、葛根素、DPPH、ABTS、胃蛋白酶(15 000 U/mg)、胰蛋白酶(2 500 U/mg)、猪胆盐,上海麦克林生化科技有限公司;乳清蛋白(>80%),合肥博美生物科技有限责任公司;其他试剂均为分析纯。
1.2 仪器与设备
RF-5301PC荧光分光光度计、S-3400N扫描电子显微镜,日本日立仪器有限责任公司;Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;XD3型X射线多晶衍射仪,北京普析通用仪器有限责任公司;STA 449 F5型同步热分析仪,德国耐驰仪器制造有限公司;NAI-GZJ型实验室小型喷雾干燥机,上海那艾精密仪器有限公司;BT-Zeta100纳米粒度分析仪,丹东百特仪器有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司。
1.3 实验方法
1.3.1 WP/WD复合物制备
准确称取0.5 g乳清蛋白,溶于去离子水中,室温下搅拌4 h,放入4 ℃冰箱中水化过夜,之后定容至250 mL,终质量浓度为2 g/L。配制4 mmol/L DAI或PUE乙醇溶液。将不同体积DAI和PUE溶液加入10 mL乳清蛋白溶液中,补充适量乙醇,使总添加量为250 μL,DAI/PUE终浓度分别为0、20、40、60、80、100 μmol/L。使用涡流混合器将混合物混合30 s,然后分别在298、310和318 K下加热20 min,于室温下冷却,即为WD或WP复合物,用于DAI或PUE与乳清蛋白作用机理研究。采用上述方法制备DAI/PUE浓度为0、200、600和1 000 μmol/L的复合物并喷雾干燥收集粉末分别记为WD、WD200、WD600、WD1000和WP、WP200、WP600、WP1000,用于结构及性质研究。
1.3.2 荧光光谱分析
用荧光分光光度计测定样品荧光光谱,在290~700 nm记录发射光谱,激发波长为280 nm,激发和发射狭缝为5 nm[17]。利用Stern-Volmer方程计算乳清蛋白与DAI或PUE的荧光猝灭类型,如公式(1)所示:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中:F0和F,加入猝灭剂(DAI或PUE)前后蛋白质的荧光强度;Ksv,Stern-Volmer的动态猝灭常数;Kq,双分子猝灭过程的速率常数;[Q],猝灭剂浓度;τ0,没有猝灭剂时荧光分子的平均寿命(10-8 s)。
用双对数方程计算乳清蛋白与DAI或PUE的结合常数Ka和结合位点数n,如公式(2)所示:
lg(F0-F)/F=lgKa+nlg[Q]
(2)
式中:Ka是结合常数;n是结合位点数。
由Van’t Hoff方程计算乳清蛋白与DAI或PUE结合过程的热力学参数,如公式(3)、公式(4)、公式(5)所示:
lnKa=-ΔH/RT+ΔS/R
(3)
ΔG=-RTlnKa
(4)
ΔG=ΔH-TΔS
(5)
式中:R是理想气体常数,为8.314 J/mol/K;T是热力学温度;ΔH、ΔS和ΔG分别是焓变、熵变和吉布斯自由能变。
1.3.3 粒径分析
使用粒度仪测定复合物溶液粒度分布。
1.3.4 FTIR分析
将少量复合物粉末放于ATR元件上,采集红外图谱,扫描范围4 000~400 cm-1,仪器分辨率为2 cm-1。参考文献[18]的方法,对酰胺Ⅰ带进行二级结构分析。
1.3.5 XRD分析
参照QIN等[17]的方法,将复合物粉末用X射线多晶衍射仪在Cu Kα辐射下进行XRD扫描。
1.3.6 SEM分析
取适量复合物粉末置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用扫描电子显微镜观察,电压12.0 kV。
1.3.7 热稳定性分析
参照QIN等[17]的方法,使用同步热分析仪进行差示扫描量热(differential scanning calorimetry,DSC)、热重(thermogravimetry,TG)、微商热重(differential thermal gravity,DTG)分析,测定复合物粉末的热稳定性。
1.3.8 抗氧化性分析
分别将2 mL浓度为200、400、600、800、1 000 μmol/L的DAI/PUE溶液加入到2 mL 5×10-5 mol/L DPPH乙醇溶液中,振荡均匀,室温避光静置20 min。再将混合物于4 000 r/min下离心10 min,于517 nm处测量上清液的吸光值,记为A1;用等体积乙醇溶液替代DPPH溶液,记为A2;等体积水代替样品溶液,记为A0。等体积水和乙醇混合溶液调零。DPPH自由基清除率按公式(6)计算:
清除率/%=[1-(A1-A2)/A0]×100
(6)
配制ABTS阳离子自由基工作液,在暗环境下放置12~16 h。测定时,取2.5 mL工作液,用pH 7.4的磷酸缓冲液稀释,使其在734 nm处的吸光值在(0.70±0.02)范围内(记为A0),即可使用。取60 μL复合物溶液,加入3 mL ABTS稀释液,室温下反应6 min,测定734 nm处的吸光度值A。清除率按公式(7)计算:
清除率/%=(1-A/A0)×100
(7)
1.3.9 体外模拟胃肠消化性分析
将150 mg复合物粉末分散在2 mL pH 1.2的蒸馏水中,装于透析袋中(1 kDa截留分子质量);加入2.0 mL混合模拟胃液,含2 g/L NaCl、7 mL/L HCl和3.2 g/L胃蛋白酶,pH(1.2)。将透析袋置于含有150 mL释放液烧杯中,释放液由75 mL乙醇和75 mL无酶模拟胃液组成。然后,置于水浴恒温振荡器37 ℃、100 r/min振荡2 h。调节混合液pH至7.5,加入模拟肠液4 mL(由6.8 g/L KH2PO4和10 g/L胰蛋白酶组成,pH 7.5)。将透析袋置于含有150 mL释放液的烧杯中,释放液由75 mL乙醇和75 mL无酶模拟肠液组成,在相同条件下振荡4 h。在每个指定点收集3 mL透析介质,用3 mL新鲜介质替换。采用紫外可见分光光度计在波长250或249 nm下测定DAI或PUE的释放量,并根据相同释放介质中制备的DAI或PUE标准曲线计算其释放量。
1.4 数据统计分析
所有试验重复3次,试验数据采用Excel 2021处理并用平均数±标准偏差表示,用Origin Pro 9.0作图,用SPSS 22进行差异显著性分析,数据间差异显著分析采用Duncan法。
2 结果与分析
2.1 乳清蛋白与黄豆苷元/葛根素相互作用分析
2.1.1 荧光光谱分析
如图1所示,乳清蛋白在333 nm处具有最大荧光吸收,该处荧光值随DAI或PUE添加量的增大而降低,说明DAI或PUE对乳清蛋白具有荧光猝灭效应,二者形成复合物。DAI对乳清蛋白荧光的猝灭程度与PUE相当,表明二者与乳清蛋白结合作用强度相似。
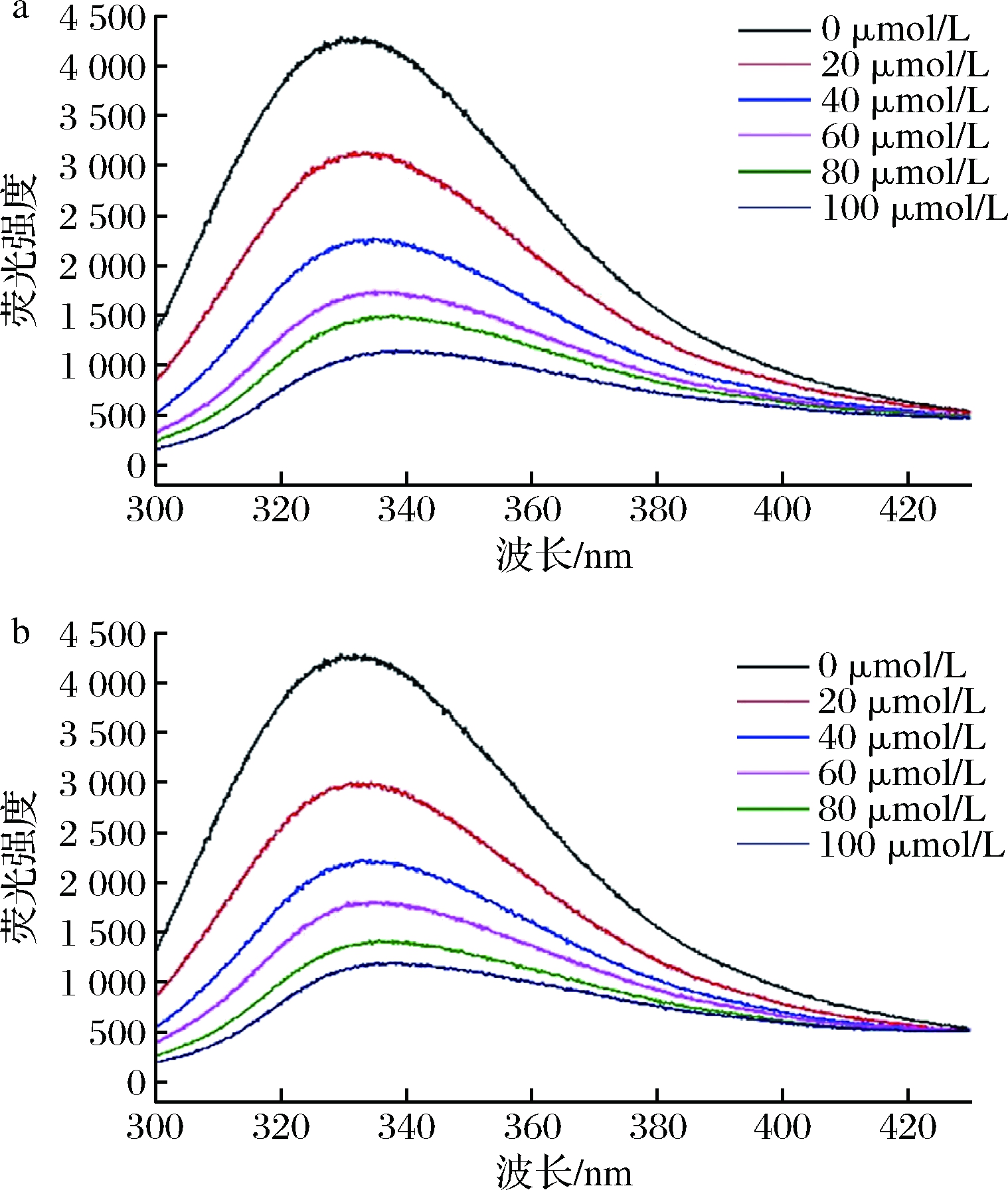
a-WD;b-WP
图1 WD、WP复合物的荧光光谱图
Fig.1 Fluorescence spectra of WD and WP complexes
利用Stern-Volmer方程对WD和WP荧光光谱进行计算,获得的猝灭速率常数见表1。DAI/PUE对乳清蛋白的荧光猝灭速率常数Kq高于猝灭剂对生物大分子的最大扩散碰撞常数,2.0×1010 L/(mol·s),说明DAI/PUE对乳清蛋白的荧光猝灭是静态猝灭过程,即二者形成稳定的静态复合物[17]。
表1 DAI或PUE与乳清蛋白结合过程的相关参数
Table 1 The binding parameters of whey protein by PUE and DAI

样品T/KKq/[L/(mol·s)]Ka/(L/mol)nΔH/(kJ/mol)ΔG/(kJ/mol)ΔS/[J/(mol·K)]WP2982.550×10121.5479×1051.20043102.099×10126.3287×1041.1228-52.71±4.05-28.70±0.673181.790×10123.9891×1041.0885-77.78±0.25WD2982.145×10122.6804×1041.02893102.078×10126.2501×1041.121754.71±0.46-28.11±2.203181.846×10121.0724×1051.1922268.33±0.03
2.1.2 结合常数和结合位点数分析
根据双对数方程计算不同温度下PUE和DAI与乳清蛋白的结合常数Ka及结合位点n,见表1。从表中可以看出,DAI/PUE与乳清蛋白的结合常数Ka均大于104 L/mol,表明乳清蛋白对DAI/PUE具有较强的结合作用。PUE与乳清蛋白的Ka随温度的升高而降低,说明结合过程放热,而DAI与乳清蛋白的Ka随温度的升高而增大,表明DAI与乳清蛋白之间的结合是吸热反应。根据文献报道,β-胡萝卜素、木糖醇和紫甘薯花色苷与乳清蛋白的Ka分别为5.20×103 L/mol(pH 7.0,298 K)、1.695×105L/mol(298 K)和1.66×105 L/mol(298 K)[19-21]。乳清蛋白对不同小分子的结合常数有差异的原因一方面可能是相互作用类型不同,另一方面是由于活性分子自身的大小、形状(柔顺性)和结构(例如所含羟基数量)等不同。乳清蛋白对DAI和PUE的结合位点数n约为1,说明DAI和PUE在乳清蛋白上只有单个结合位点。
2.1.3 热力学参数分析
DAI和PUE与乳清蛋白结合过程的热力学参数如表1所示。DAI和PUE与乳清蛋白结合过程的ΔG分别为(-28.11±2.20)和(-28.70±0.67) kJ/mol,说明DAI和PUE与乳清蛋白之间自发结合。PUE与乳清蛋白结合过程的ΔH和ΔS均小于零,说明结合作用力主要为氢键和范德华力,并且结合过程是放热的,与Ka随温度变化趋势一致[22]。然而,DAI与乳清蛋白的ΔH和ΔS均大于零,表明DAI与乳清蛋白间主要以疏水作用结合,且结合过程吸热,与Ka随温度变化趋势一致。
据报道,DAI与胰蛋白酶结合作用力主要为疏水作用[23],与本研究中DAI与乳清蛋白的主要作用力一致。PUE为DAI的糖苷衍生物,含有较多羟基,更易于与乳清蛋白形成氢键而结合[6]。另外,分子对接显示,PUE与α-乳白蛋白、牛血清白蛋白以及乳铁蛋白间主要形成氢键[6]。
2.2 乳清蛋白与黄豆苷元/葛根素复合物结构分析
2.2.1 粒径分析
如图2所示,乳清蛋白粒度呈单峰分布。加入200~600 μmol/L DAI后,复合物粒度大小无显著变化;当DAI添加量达到1 000 μmol/L时,复合物粒度增大。然而,PUE的结合增大了乳清蛋白的粒径,但其变化量与PUE添加量关系不大。DAI与乳清蛋白以疏水作用结合,其结合过程中促使水分子被排开,使蛋白质结构收紧,因此乳清蛋白粒径变化不大;当DAI结合量较大时,由于DAI具有一定的体积,而且分子之间可形成π-π堆积作用,促使复合物粒径增大。PUE与乳清蛋白以氢键和范德华力结合,且PUE分子体积大于DAI,因此结合PUE后乳清蛋白粒径增大。据报道,β-乳球蛋白与阿魏酸、表没食子儿茶素没食子酸酯结合后,粒径增大[24];乳清蛋白与花青素结合后,粒径由(381±11) nm增大到(881±30) nm[25]。本研究结果与文献的差异可能在于活性分子添加量不同。
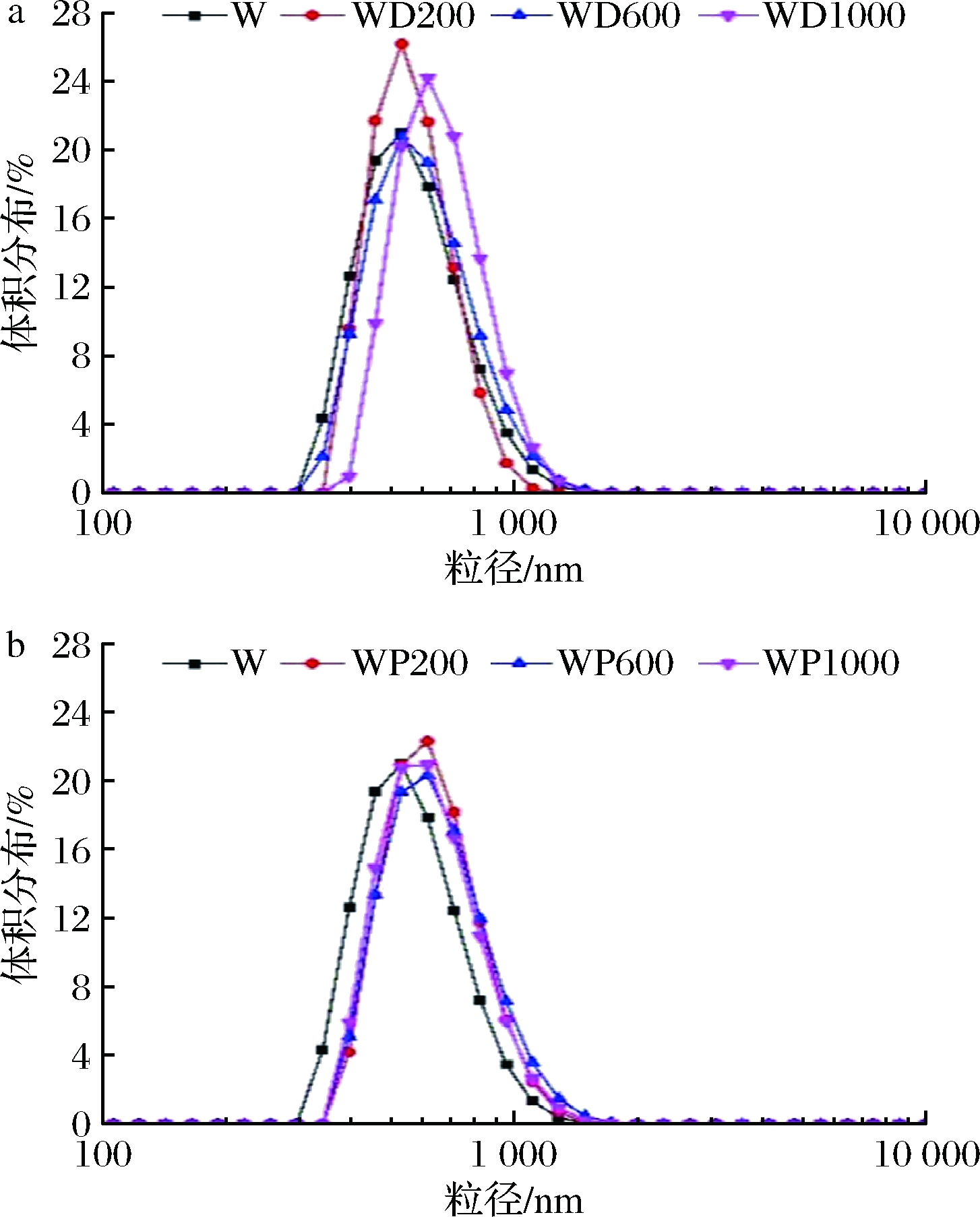
a-WD;b-WP
图2 WD、WP复合物粒度分布
Fig.2 Size distribution of WD and WP complexes
注:W为乳清蛋白(下同)。
2.2.2 FTIR分析
如图3所示,其中复合物在1 600~1 400 cm-1处为芳香环的吸收峰,1 630 cm-1处为羰基吸收峰;PUE在3 312 cm-1处、DAI在3 150 cm-1为羟基伸缩振动峰;DAI在1 235和1 278 cm-1处为C—O伸缩振动峰[26]。就乳清蛋白与PUE/DAI的固体混合物而言,其在500~1 500 cm-1处的吸收峰明显与复合物不同,说明简单物理混合物没有形成相互作用,再次证实了DAI/PUE与乳清蛋白经过处理后形成了复合物。与游离DAI和PUE相比,复合物的FTIR图中DAI/PUE的部分特征吸收峰消失,说明其与乳清蛋白产生了相互作用,形成了复合物。

a-WD;b-WP;c-二级结构变化
图3 WD、WP复合物FTIR图及二级结构含量
Fig.3 FTIR spectra of WD,WP complexes and their secondary structure contents
注:不同大写字母表示不同浓度WP同一二级结构含量间差异显著;不同小写字母表示WD同一二级结构含量间差异显著
与PUE结合后,乳清蛋白酰胺Ⅰ带1 633 cm-1(C![]() O拉伸振动)和酰胺II带1 516 cm-1(C—N拉伸和N—H弯曲振动)未发生变化,但酰胺Ⅲ带(C—N和N—H平面振动)从1 237 cm-1(W)红移到1 249 cm-1(WP1000)。与DAI结合后,乳清蛋白的酰胺带均未发生明显移动。
O拉伸振动)和酰胺II带1 516 cm-1(C—N拉伸和N—H弯曲振动)未发生变化,但酰胺Ⅲ带(C—N和N—H平面振动)从1 237 cm-1(W)红移到1 249 cm-1(WP1000)。与DAI结合后,乳清蛋白的酰胺带均未发生明显移动。
如图3-c所示,乳清蛋白含有(39.73±0.17)%的β-折叠,(36.44±0.23)%转角,(23.83±0.06)%无规卷曲,不含α-螺旋结构。与DAI/PUE结合后,乳清蛋白二级结构发生了显著变化,其变化程度与DAI/PUE的添加量有关。WD600与WD1000的二级结构相似(P>0.05)。当PUE添加量为1 000 μmol/L、DAI添加量为600和1 000 μmol/L时,形成了α-螺旋结构。本团队前期研究发现,乳清蛋白与槲皮素结合后,其α-螺旋结构含量增加,与本研究结果相似[27]。与PUE结合后,乳清蛋白的无规卷曲结构含量降低。众多文献表明,乳清蛋白、β-乳球蛋白与多酚,如矢车菊苏-3-O-葡萄糖苷、蓝莓花青素结合后,其二级结构变化较为明显[28-29]。可见,多酚对乳清蛋白二级结构影响较大。
2.2.3 XRD分析
XRD分析如图4所示,乳清蛋白出现较宽的峰,为无定型结构。游离DAI和PUE分子出现窄而尖锐的峰,为典型的晶体结构;与乳清蛋白结合后,其晶体峰消失,说明DAI/PUE与乳清蛋白产生相互作用,形成复合物。在DAI/PUE与乳清蛋白的物理混合物中,DAI/PUE的个别晶体峰依然存在,证实二者仅为物理混合,无相互作用。

a-WD;b-WP
图4 WD、WP复合物XRD图
Fig.4 XRD patterns of WD and WP complexes
2.2.4 SEM分析
如图5所示,游离DAI为块状,表面凹凸不平,PUE呈不规则形。喷干的乳清蛋白及WD、WP复合物为葡萄干状,粒径约2~4 μm。显然,与DAI和PUE结合未改变乳清蛋白的形貌,且复合物粒径与乳清蛋白粒径相当,这可能是因为DAI/PUE添加量较少。

a-WP;b-DAI;c-PUE;d-WD200;e-WP200;f-WD600;g-WP600;h-WD1000;i-WP1000
图5 WD和WP复合物SEM图
Fig.5 SEM images of WD and WP complexes
2.3 乳清蛋白与黄豆苷元/葛根素复合物性质分析
2.3.1 热稳定性分析
由图6-a、6-b可以看出,DAI和PUE分别在335.6和206.6 ℃出现吸热峰,该温度为二者的熔点。与乳清蛋白结合后,DAI/PUE的吸热峰消失,复合物在220 ℃附近出现较宽的放热峰,在310 ℃附近出现小的吸热峰。而且,复合物的DSC曲线与乳清蛋白的DSC曲线相似,但与乳清蛋白和DAI/PUE物理混合物的DSC曲线显著不同,表明复合物中DAI/PUE与乳清蛋白产生相互作用。随着PUE的添加,310 ℃附近的吸热峰面积增大,这是因为PUE与乳清蛋白间形成的氢键断裂需要额外的能量。
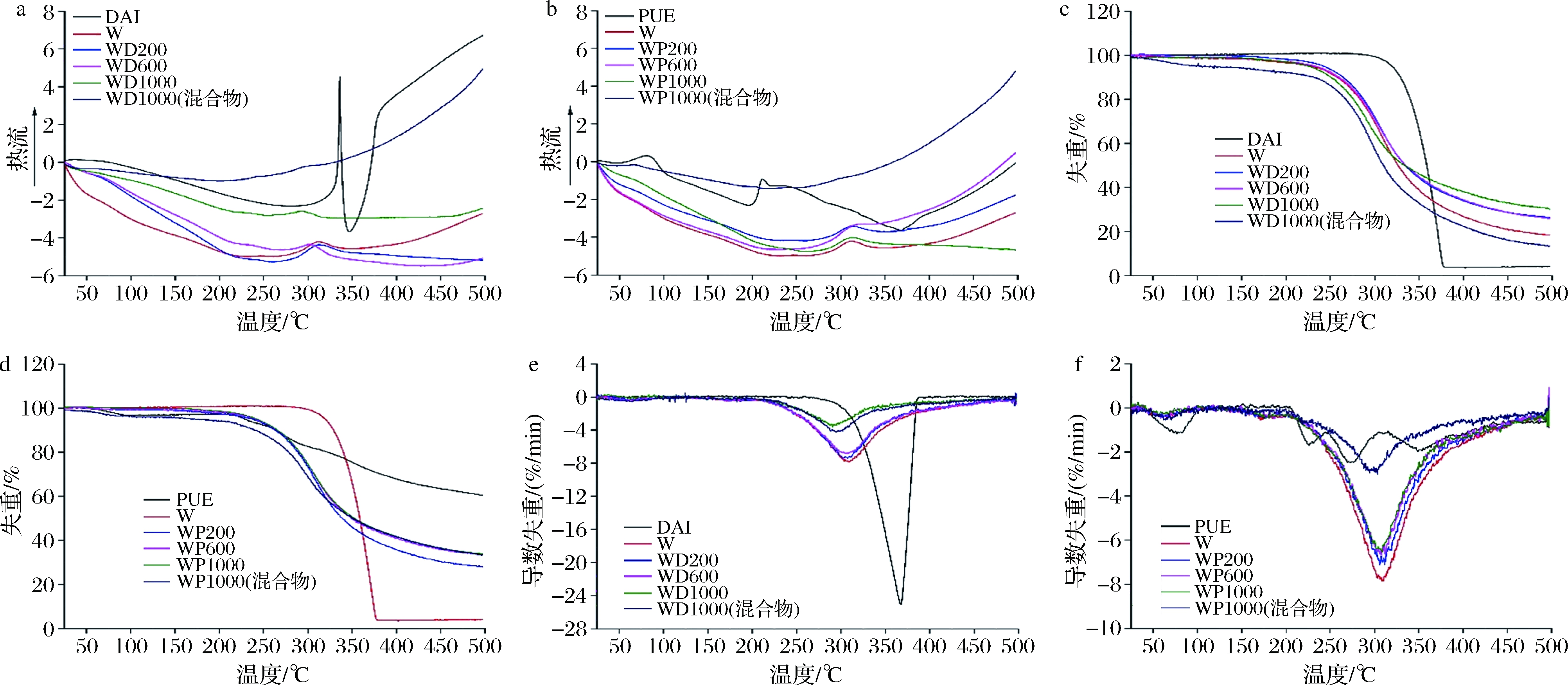
a-WD复合物的DSC;b-WP复合物的DSC;c-WD复合物的TG;d-WP复合物的TG;e-WD复合物的DTG;f-WP复合物的DTG
图6 WD、WP复合物DSC、TG和DTG曲线
Fig.6 DSC,TG,and DTG curves of WD and WP complexes
TG曲线如图6-c、图6-d所示,所有样品均经历2次失重,第1次是在80 ℃左右,为水分蒸发;第2次失重出现在250~400 ℃,为乳清蛋白及DAI/PUE降解。游离PUE的TG曲线与DAI差异显著,主要是因为二者分子结构及分子间作用力不同所致。WD和WP复合物TG曲线与乳清蛋白相似,但复合物失重速率均低于乳清蛋白,且其残余质量高于乳清蛋白,表明DAI/PUE与乳清蛋白间具有相互作用。
复合物的DTG曲线如图6-e、图6-f所示。乳清蛋白的分解温度约为307 ℃,WP的分解温度与乳清蛋白相似。但是,WD分解温度随着DAI添加量的增加而降低。尽管DAI与乳清蛋白间形成了疏水作用,但该作用削弱了乳清蛋白分子内及分子间相互作用。另外,PUE与乳清蛋白结合过程为放热反应,而DAI与乳清蛋白结合为吸热反应(表1),说明PUE与乳清蛋白间形成的氢键强于DAI与乳清蛋白间的疏水作用。综上,WD复合物的分解温度较乳清蛋白低。
2.3.2 抗氧化性分析
由图7-a、图7-b可以看出,水溶液中游离PUE的ABTS阳离子自由基清除率大于游离DAI,但二者在乙醇溶液中的ABTS阳离子自由基清除率相当。WD的ABTS阳离子自由基清除率随着DAI浓度的增加而显著增大(P<0.05),且其相当于乳清蛋白和水溶液中游离DAI对ABTS阳离子自由基清除率的加和。本团队前期试验发现,槲皮素与乳清蛋白复合物的ABTS阳离子自由基清除率与游离槲皮素和乳清蛋白清除率的加和相当[27],与本研究结果一致。就WP而言,其ABTS阳离子自由基清除率低于乳清蛋白和游离PUE的加和。ABTS阳离子自由基清除率用于评价抗氧化剂在水溶液中的供氢能力[17]。可见,与乳清蛋白结合后,PUE的供氢能力减弱,与二者间形成氢键有关。
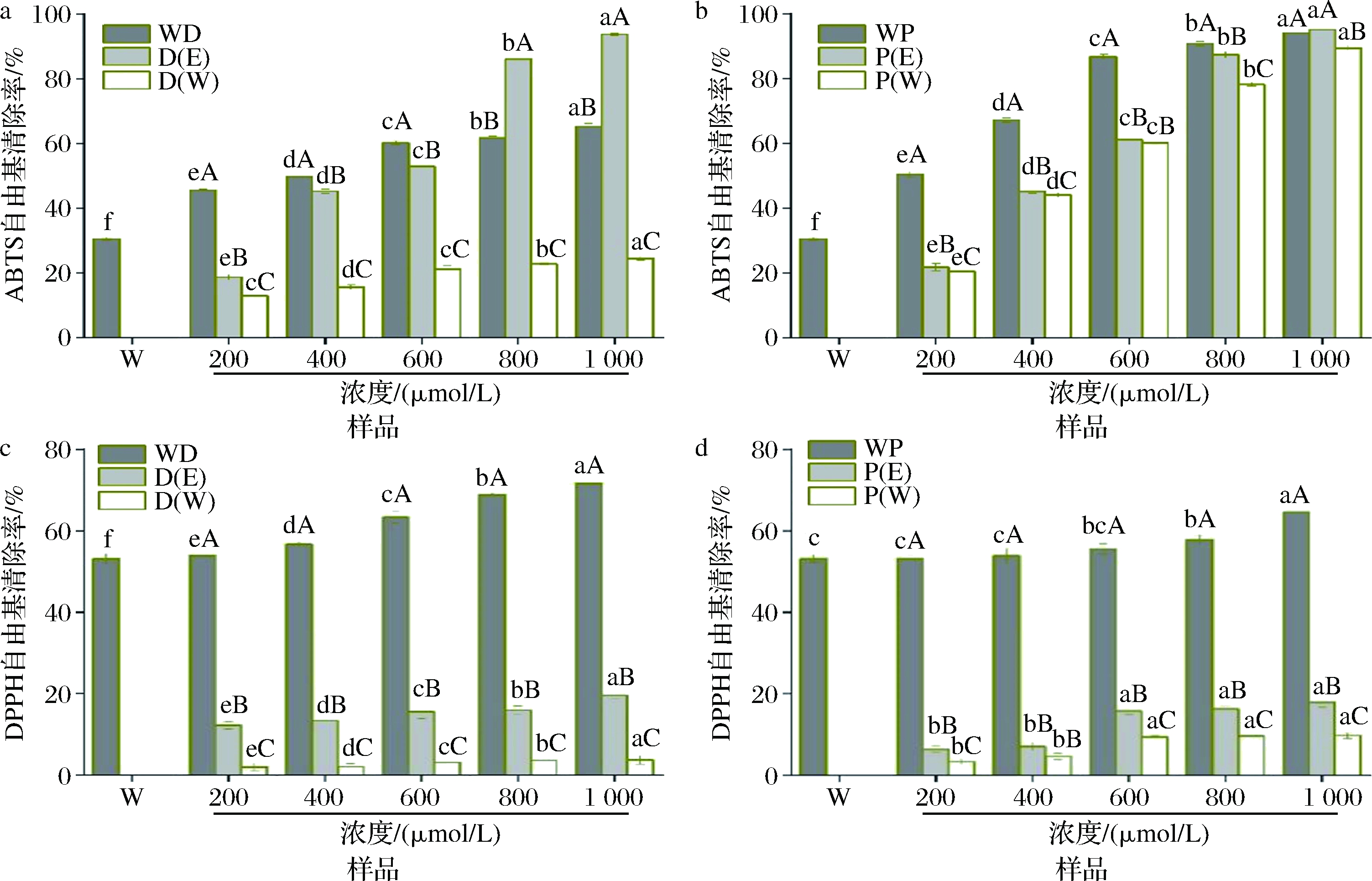
a-WD复合物的ABTS;b-WP复合物的ABTS;c-WD复合物的DPPH;d-WP复合物的DPPH
图7 WD和WP复合物的ABTS、DPPH自由基清除能力
Fig.7 ABTS and DPPH radical scavenging activities of WD and WP complexes
注:D(E)为黄豆苷元的乙醇溶液;D(W)为黄豆苷元的水溶液;P(E)为葛根素的乙醇溶液;P(W)为葛根素的水溶液;不同大写字母表示同一浓度不同样品间差异显著;不同小写字母表示同一样品不同浓度间差异显著。
由图7-c、图7-d可知,乙醇溶液中游离PUE的DPPH自由基清除率与DAI相当,但其水溶液中的DPPH自由基清除率强于DAI,这是因为PUE的水溶性较DAI好。WD复合物的DPPH自由基清除率随着DAI浓度的增加而显著增大(P<0.05),且其清除率大于乳清蛋白和水溶液中游离DAI清除率的加和,表明与乳清蛋白结合改善了DAI的DPPH自由基清除能力,这可能是因为与乳清蛋白结合改善了DAI的溶解性所致。然而,WP的DPPH自由基清除率低于游离PUE和乳清蛋白清除率的加和。由此可见,多酚与蛋白质复合物的抗氧化性受到多种因素的影响,如相互作用类型、多酚的溶解性等。
2.4 乳清蛋白与黄豆苷元/葛根素复合物体外模拟释放分析
如图8所示,在模拟胃肠消化过程中,PUE的释放率大于DAI,这是因为PUE的水溶性较DAI好。在模拟胃液消化2 h时,1 000 μmol/L游离DAI及WD中DAI的累积释放率分别为(4.38±0.28)%、(3.91±0.003)%;游离PUE及WP中PUE的累积释放率分别为(51.86±0.69)%、(21.03±0.34)%。消化6 h后,游离DAI及WD中DAI的释放率分别为(28.17±3.11)%、(9.26±0.06)%,游离PUE及WP中PUE的累积释放率分别为(61.87±1.64)%、(35.60±0.31)%。由此可见,与乳清蛋白复合显著抑制了DAI和PUE在肠道中的释放速率,有利于提升其生物利用度。另外,复合物中DAI/PUE的释放率表现出浓度依赖性,其浓度越大,释放速率越慢;推测原因可能是DAI/PUE含有多个可以与蛋白链上的氨基酸残基相互作用的基团,大量DAI/PUE分子可在乳清蛋白链上不同氨基酸残基之间形成交联网络结构,因此延缓了DAI/PUE的释放;具体原因有待进一步验证。本团队前期研究发现,DAI/PUE与酪蛋白胶束结合后,其胃肠释放速率降低[30],与本文研究结果一致。
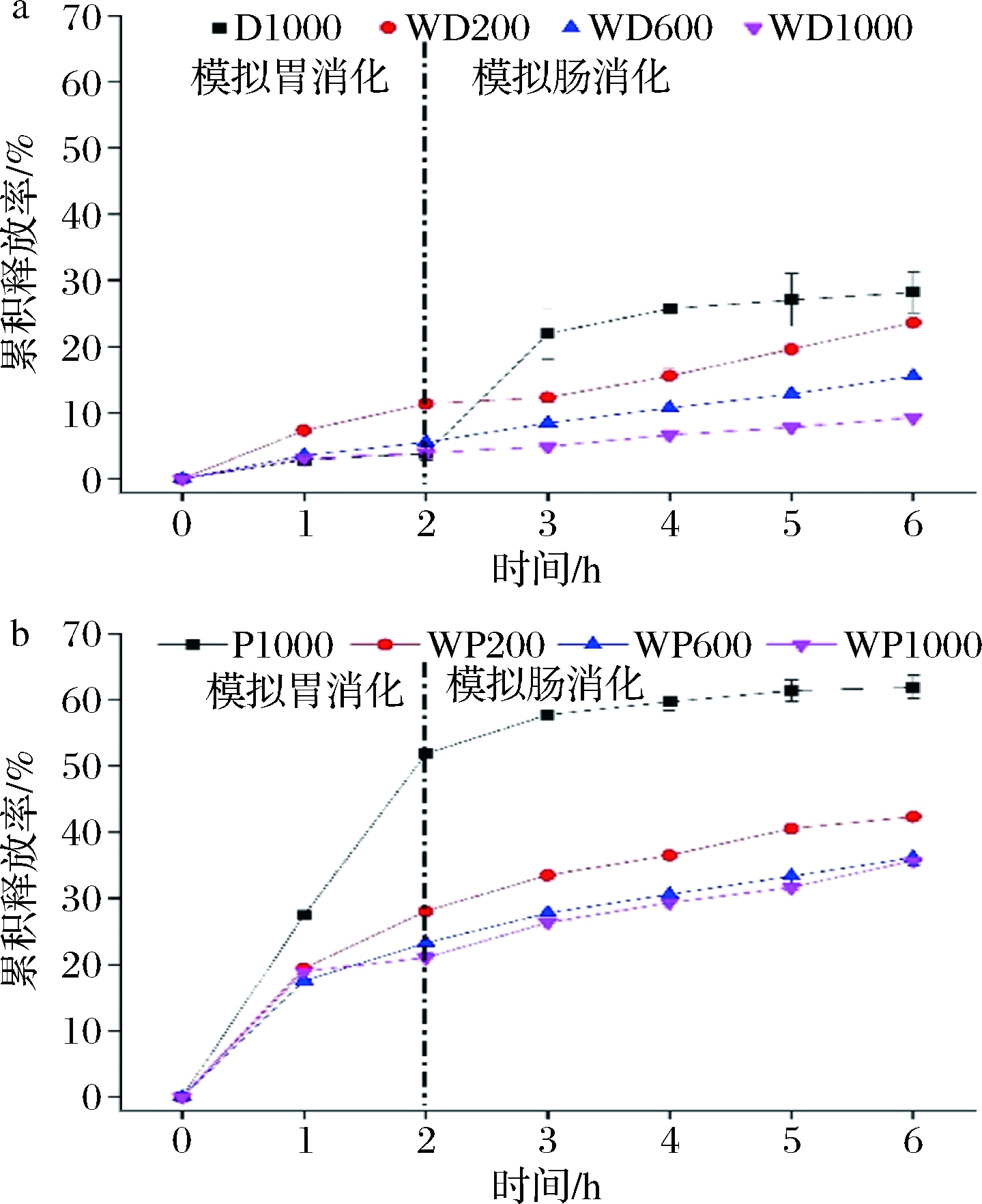
a-DAI;b-PUE
图8 复合物中DAI和PUE的模拟胃肠消化释放曲线
Fig.8 Cumulative release of DAI and PUE from complexes in simulated gastrointestinal digestion
3 结论
采用荧光光谱法分析了乳清蛋白与DAI和PUE的相互作用,发现DAI主要以疏水作用与乳清蛋白结合,而PUE主要以氢键和范德华力与乳清蛋白结合;二者结合过程均为自发过程。FTIR、XRD分析均表明,DAI/PUE与乳清蛋白间形成复合物;与DAI/PUE结合后,乳清蛋白二级结构发生了变化,且热稳定性改善。与乳清蛋白结合改善了DAI的DPPH自由基清除活性,但削弱了PUE的ABTS自由基清除活性。另外,与乳清蛋白结合延缓了DAI/PUE的肠道模拟释放率,有利于提高其生物利用度。
[1] WANG H,XIAO Y,WANG H,et al.Development of daidzein nanosuspensions:Preparation,characterization,in vitro evaluation,and pharmacokinetic analysis[J].International Journal of Pharmaceutics,2019,566:67-76.
[2] OJO O A.Puerarin as a potential drug candidate for the management of Type-2 diabetes:molecular docking and pharmacophore modeling studies[J].Biointerface Research in Applied Chemistry,2020,11(2):8751-8759.
[3] CHEN T,LIN Y J,CAO Z Q,et al.Network pharmacology analysis and experimental study strategy reveals the potential mechanism of puerarin against rotavirus[J].Annals of Translational Medicine,2022,10(1):14.
[4] ANUKUNWITHAYA T,POO P,HUNSAKUNACHAI N,et al.Absolute oral bioavailability and disposition kinetics of puerarin in female rats[J].BMC Pharmacology &Toxicology,2018,19(1):25.
[5] MA Y R,ZHAO X Y,LI J,et al.The comparison of different daidzein-PLGA nanoparticles in increasing its oral bioavailability[J].International Journal of Nanomedicine,2012,7:559-570.
[6] ZHONG Y J,ZHAO J C,DAI T T,et al.The effect of whey protein-puerarin interactions on the formation and performance of protein hydrogels[J].Food Hydrocolloids,2021,113:106444.
[7] PAHARI B,SENGUPTA B,CHAKRABORTY S,et al.Contrasting binding of fisetin and daidzein in γ-cyclodextrin nanocavity[J].Journal of Photochemistry and Photobiology B:Biology,2013,118:33-41.
[8] 于湛,李天乐,韩东旭,等.2,6-二甲基-β-环糊精增溶大豆苷元的机理研究[J].沈阳师范大学学报(自然科学版),2019,37(1):15-19.
YU Z,LI T L,HAN D X,et al.Mechanism study of water solubility enhancement of daidzein by 2,6-di-methyl-β-cyclodextrin[J].Journal of Shenyang Normal University (Natural Science Edition),2019,37(1):15-19.
[9] 陈秀文,焦叶,崔波,等.大米蛋白酶解物:大豆苷元复合纳米粒子的构建[J].食品与机械,2021,37(2):42-46;110.
CHEN X W,JIAO Y,CUI B,et al.Fabrication of rice protein hydrolysate-daidzein composite nanoparticles[J].Food &Machinery,2021,37(2):42-46;110.
[10] 黄尊.基于纳米混悬技术的黄豆苷元胶囊的制备及评价[D].上海:上海交通大学,2017.
HUANG Z.Preparation and evaluation of daidzein capsules based on nanosuspension technology[D].Shanghai:Shanghai Jiao Tong University,2017.
[11] SHEN Q,LI X,YUAN D,et al.Enhanced oral bioavailability of daidzein by self-microemulsifying drug delivery system[J].Chemical &Pharmaceutical Bulletin,2010,58(5):639-643.
[12] LI S J,YUE J Z,ZHOU W,et al.An investigation into the preparation,characterization and antioxidant activity of puerarin/cyclodextrin inclusion complexes[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2015,82(3):453-460.
[13] 何典鸿,韩立炜,王媛,等.以胆盐/磷脂混合胶束制备技术提高葛根素溶解度的研究[J].中国中药杂志,2010,35(11):1395-1398.
HE D H,HAN L W,WANG Y,et al.Improvement of solubility of puerarin through deoxycholate/phospholipid mixed micelle preparing technology[J].China Journal of Chinese Materia Medica,2010,35(11):1395-1398.
[14] HA H K,RANKIN S A,LEE M R,et al.Development and characterization of whey protein-based nano-delivery systems:A review[J].Molecules (Basel,Switzerland),2019,24(18):3254.
[15] HELLER K J.Dairy Microbiology Handbook:The Microbiology of Milk and Milk Products,3rd ed[M].Chichester:John Wiley and Sons Limited,2002.
[16] MOHAMMADIAN M,SALAMI M,MOMEN S M,et al.Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J].Food Hydrocolloids,2019,87:902-914.
[17] QIN J J,YANG M,WANG Y C,et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry,2021,349:129154.
[18] HUSSAIN R,GAIANI C,ABERKANE L,et al.Multiscale characterization of casein micelles under NaCl range conditions[J].Food Biophysics,2011,6(4):503-511.
[19] GONG S X,YANG C Y,ZHANG J H,et al.Study on the interaction mechanism of purple potato anthocyanins with casein and whey protein[J].Food Hydrocolloids,2021,111:106223.
[20] KONG F H,KANG S M,TIAN J L,et al.Interaction of xylitol with whey proteins:Multi-spectroscopic techniques and docking studies[J].Food Chemistry,2020,326:126804.
[21] ALLAHDAD Z,VARIDI M,ZADMARD R,et al.Binding of β-carotene to whey proteins:Multi-spectroscopic techniques and docking studies[J].Food Chemistry,2019,277:96-106.
[22] YANG M,WEI Y M,ASHOKKUMAR M,et al.Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J].Ultrasonics Sonochemistry,2020,62:104861.
[23] ZENG H J,WANG Y P,YANG R,et al.Inhibitory effects of daidzein and genistein on trypsin:Insights from spectroscopic and molecular docking studies[J].International Journal of Biological Macromolecules,2016,89:336-343.
[24] JIA J J,GAO X,HAO M H,et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry,2017,228:143-151.
[25] ZANG Z H,CHOU S R,GENG L J,et al.Interactions of blueberry anthocyanins with whey protein isolate and bovine serum protein:Color stability,antioxidant activity,in vitro simulation,and protein functionality[J].LWT,2021,152:112269.
[26] UGUR KAPLAN A B,CETIN M,ORGUL D,et al.Formulation and in vitro evaluation of topical nanoemulsion and nanoemulsion-based gels containing daidzein[J].Journal of Drug Delivery Science and Technology,2019,52:189-203.
[27] JI W,YANG F M,YANG M.Effect of change in pH,heat and ultrasound pre-treatments on binding interactions between quercetin and whey protein concentrate[J].Food Chemistry,2022,384:132508.
[28] HE W J,MU H B,LIU Z M,et al.Effect of preheat treatment of milk proteins on their interactions with cyanidin-3-O-glucoside[J].Food Research International,2018,107:394-405.
[29] KHALIFA I,NIE R Z,GE Z Z,et al.Understanding the shielding effects of whey protein on mulberry anthocyanins:Insights from multispectral and molecular modelling investigations[J].International Journal of Biological Macromolecules,2018,119:116-124.
[30] WANG Y C,YANG M,QIN J J,et al.Interactions between puerarin/daidzein and micellar casein[J].Journal of Food Biochemistry,2022,46(2):e14048.