现代社会的发展对能源的依赖越来越强,能量危机越来越严重,在利用化石能源的同时对环境造成了极大的无法挽回的损害,利用可再生能源替代化石燃料是解决这个问题的有效方法之一[1-2]。半纤维素作为目前存量第二大,丰富的可再生资源,其利用一直广受研究者关注[3-4]。半纤维素是一类复合聚糖的总称,其单糖组成包括包括木聚糖、阿拉伯聚糖、葡萄糖等[5-6]。目前已有的研究主要包括化学法(酸水解)、生物法(直接发酵或酶水解)及物理方法(超声场/微波等)辅助化学/生物法等[7-8]。各方法特点、优势均有显著差异,其中酶催化水解可以实现对木聚糖在绿色温和体系下的高效转化,且可以实现产物转化的调节和定向,是目前和未来半纤维利用的主要方法之一。但目前已有的研究更多地聚焦于木聚糖酶催化性质及产物特异性方面,而关于底物层面如何作用及影响酶催化效能机理的研究较少[9]。本研究利用乙醇分级沉淀高温高压蒸煮液的木聚糖[10-11],以确定各个组分的结构特征,并对分级沉淀得到的不同结构的木聚糖进行初步的酶解实验,初步探究木聚糖结构对酶解阻碍效果的机理。
1 材料与方法
1.1 材料与试剂
乙腈,分析纯,mreda公司;甘露糖、糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖标品,Megazyme公司,1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、乙醇等,均为国产分析纯。
1.2 实验仪器与设备
pH计,梅特勒-托利多仪器有限公司;RE300旋转蒸发器,Stuart 公司;Allegra X-30R离心机,BECKMAN COULTER公司;1260-HPLC高效液相,Agilent 公司;超高效凝胶渗透色谱,Waters 公司;iS50 FT-IR,Thermo Scientific公司;HH-4恒温水浴锅,江苏金坛宏华仪器厂;DSHZ-300AH恒温水浴摇床,太仓实验设备厂。
1.3 方法
1.3.1 高温高压蒸煮液中木聚糖的乙醇分级分离
高温高压蒸煮液制备[10]:称取干燥的粒度为100~150目的玉米芯50 g于高温高压反应釜中,加入500 mL蒸馏水,密封,待反应釜的温度到达174 ℃时,停止加热,使其自然降温,直至温度降至100 ℃时,打开放气阀,取出蒸煮液,于冷水浴中快速降温。
蒸煮液经过离心除去杂质,取185 mL离心后的蒸煮液,用体积分数3%的HCl溶液调节pH值到1.5~2.0,沉淀下来的木素通过离心除去,上清液再用KOH溶液将pH值调节到5.5左右,然后倒入等体积的95%乙醇中。在乙醇溶液中沉淀下来的木聚糖通过离心分离出来,分离出来的木聚糖通过冷冻干燥得到木聚糖粉末(分离的流程图见图1)[10-11]。离心后的上清液在旋转蒸发仪中减压浓缩,蒸发掉加入的乙醇以及部分的水分,第1次浓缩到100 mL,然后加入到2倍体积95%的乙醇中,重复以上的操作。然后依次浓缩到70、50、30 mL 分别倒入3倍体积,5倍体积和7倍体积的乙醇中。用7倍体积乙醇沉淀后的上清液减压浓缩到20 mL后直接冷冻干燥。用 1、2、3、5、7 倍体积乙醇沉淀的半纤维素分别记为R1、R2、R3、R5、R7。
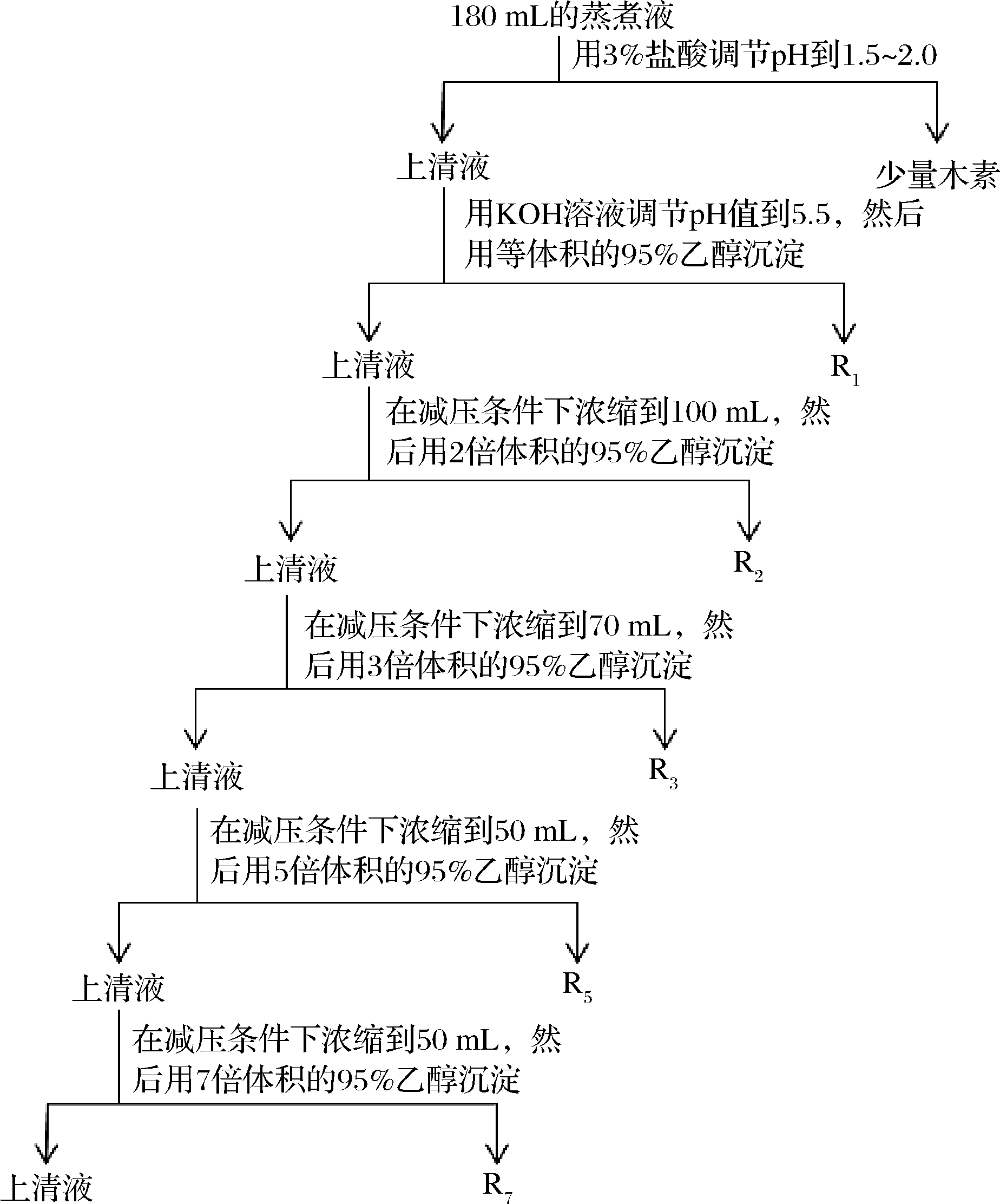
图1 蒸煮液中木聚糖的乙醇分级沉淀分离流程
Fig.1 Flow chart for isolation of xylan by fractional ethanol precipitation from the cooking liquor
1.3.2 高温高压蒸煮液中木聚糖含量的测定
采用地衣酚-盐酸法测定高温高压蒸煮液中木聚糖含量。将5 mL蒸煮液加入到5 mL HCl溶液(4 mol/L)中,置于25 mL具塞试管内密封后于100 ℃水浴中,水解2 h,冷却后用滤纸过滤,收集滤液,适当稀释,备用。取适当体积上述稀释液于15 mL具塞试管中,补加蒸馏水至3 mL,然后依次加入0.3 mL 地衣酚-无水乙醇溶液(体积分数1%)和3 mL FeCl3-浓盐酸溶液(体积分数0.1%),盖塞,混合均匀,沸水浴30 min,去除试管冷却至室温,在分光光度计上,分别于670、580 nm双波长下测定吸光值。标曲的制作参照辛瑞璞[12]在研究谷物戊聚糖含量时的测定方法。木聚糖含量计算如公式(1)所示:
木聚糖含量/g=C×n×0.88×10-6
(1)
式中:C,由标准曲线得到的木糖值;n,滤液稀释倍数;0.88,转换系数。
而各个木聚糖组分得率为各组分质量在分离得到的木聚糖总质量中的占比。
1.3.3 木聚糖中糖基的测定
样品的制备:取制备的木聚糖10 mg,在室温下加入5 mL体积分数5%的H2SO4溶液,密闭,置入105 ℃烘箱中,每隔一段时间振荡1次,2 h后将其取出,冷却,中和,然后稀释到100 mL,用0.22 μm的水系膜过滤。
柱前衍HPLC法测定糖基。
单糖衍生过程[13]:取200 μL标准品溶液或水解液,置于5 mL具塞试管中,加入0.3 mol/L NaOH 溶液120 μL,0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮甲醇溶液120 μL,使用漩涡混匀器混匀,将样品置于70 ℃水浴中,反应2 h,每隔15 min振荡1次,直至反应结束,静置冷却到室温,然后加入一定量的 HCl溶液中和,加入2 mL氯仿充分振荡,静置,弃下层有机相,重复萃取3次,去除反应体系中未反应的1-苯基-3-甲基-5-吡唑啉酮,收集上层水相,用0.45 μm 滤膜过滤,滤液备用,进行高效液相分析。
色谱条件:采用Agilent 1260色谱系统,紫外检测器,色谱柱:Hypersil BDS-C18(250 mm×4.6 mm,5 μm);流动相:20 mmol/L 磷酸盐缓冲液(pH 6.7)-乙腈(体积比为82∶18);流速1 mL/min;检测波长250 nm;柱温30 ℃;进样量10 μL;等梯度洗脱。
1.3.4 木聚糖分子质量的测定
木聚糖的分子质量用凝胶渗透色谱(gel permeation chromatography,GPC)联用多角度激光散射仪测定。GPC系统由 Waters公司的Waters p-lsocratic Solvent Manager Pump、Waters Sample Manager进样器、Waters 2414示差折光检测器组成。色谱柱:Waters 公司的 ACQUITY APC 200、ACQUITY APC 250 和 ACQUITY APC 400(三柱串联);DAWN HELEOS-Ⅱ多角度激光散射仪,Wyatt 公司。流动相:20 mmol/L NaNO3溶液;流速:0.35 mL/min;柱温:35 ℃;进样量:20 μL。
1.3.5 木聚糖的红外谱图
使用红外光谱仪分析木聚糖红外谱图。取少量干燥的样品加入到 KBr 中在玛瑙研钵中研磨,然后在压片机中压成薄而透明的薄片,再在光谱仪上测定,扫描的波数范围为 4 000~400 cm-1。
1.3.6 动力学参数的测定
采用各个组分为底物,经反复预测定,调节底物浓度为0.5~2.0 Km,然后在 0.05 mol/L、pH 7.5 的PBS缓冲液中 55 ℃测定酶反应速率。采用二硝基水杨酸(dinitrosalicylic acid,DNS)法,紫外可见分光光度计来测定540 nm 处的吸光度值,以 D-木糖作标准曲线,计算酶活力。根据 Line Weaver-Burk 作图法,使用“GraphPad Prism 5”分析软件求得米氏常数 Km、最大反应速度Vmax。
2 结果与讨论
2.1 各个木聚糖组分的得率
乙醇浓度对各个木聚糖组分得率的影响如表1所示。不同乙醇浓度沉淀下来的木聚糖得率不同,随着乙醇浓度的增加,易溶于水的木聚糖分子逐渐沉淀下来,3倍体积乙醇时,木聚糖的得率达到最大,为48.67%,之后得率越来越小。5倍和7倍乙醇沉淀出来的那部分木聚糖,是最易溶于水的部分,在蒸煮过程中因原料受到严重的损害所得,属于低聚合度木聚糖,分子质量应较小。
表1 蒸煮液中各木聚糖组分的得率
Table 1 The yield of each xylan fraction from the cooking liquor

组分R1R2R3R5R7质量/g0.39541.64943.66620.93060.8910得率/%5.2521.9048.6712.3511.83
2.2 各个组分糖基的测定
水热预处理结合乙醇分级沉淀获得各木聚糖组分含量如表2所示。各木聚糖组分主要的糖基成分为葡萄糖和木糖分别占15.80%~52.39%和25.46%~55.74%。葡萄糖来源于在蒸煮过程中部分短链的纤维素,由于蒸煮温度高,导致部分纤维素降解成小分子的短链纤维素,溶于蒸煮液中。甘露糖是第二大组分,占8.71%~13.62%。聚半乳糖阿拉伯糖的溶解性较好,热水抽提可得到含半乳糖基的木聚糖,从而各组分都含有一定量的半乳糖[14]。此外,还有少量的糖醛酸和阿拉伯糖,分别占4.70%~8.77%和2.26%~4.62%。在草类植物中,木糖和阿拉伯糖的摩尔比值是表示木聚糖的分支度的大小的一个比较关键的值,其反映了半纤维素主链的取代程度[15-16]。由表2可以看出随乙醇从等体积稀释到3倍体积稀释,木糖和阿拉伯糖的比值(Xyl/Ara)逐渐减小,也就是随着乙醇体积分数增加,所得半纤维素的分支度减小,与PENG等[15]结论相矛盾,推测可能与木聚糖的分子质量有关。如果木聚糖的分子质量很大,在水中的溶解度就会越低,在乙醇溶液中就很容易被沉淀出来,因此推测 R1中的木聚糖是支链比较多、分子质量比较大的聚合物。其他组分的木聚糖的分支度虽然比较相近,但是在不同乙醇浓度下沉淀出来,可能是由于其分子质量的原因,导致其沉淀的顺序有差异;R2到R7组分糖醛酸含量不断增加,主要是因为糖醛酸较好的溶解性,赋予了糖醛酸侧链较多的木聚糖分子较好的溶解度,从而导致其在后来沉淀中出现。
表2 各木聚糖组分中糖基和糖醛酸的含量
Table 2 The content of monosaccharide composition and uronic acids in each xylan fraction
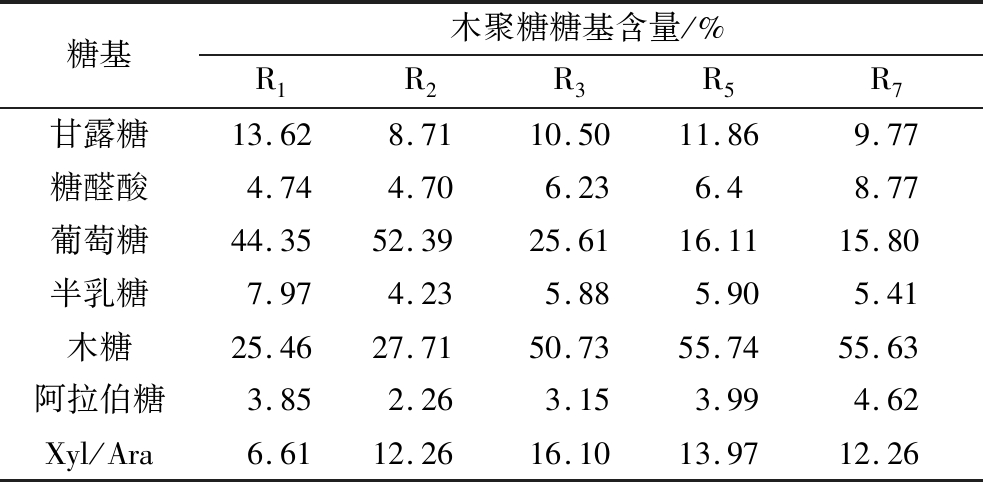
糖基木聚糖糖基含量/%R1R2R3R5R7甘露糖13.628.7110.5011.869.77糖醛酸4.744.706.236.48.77葡萄糖44.3552.3925.6116.1115.80半乳糖7.974.235.885.905.41木糖25.4627.7150.7355.7455.63阿拉伯糖3.852.263.153.994.62Xyl/Ara6.6112.2616.1013.9712.26
注:Xyl /Ara,木糖和阿拉伯糖的摩尔比值。
2.3 各个组分木聚糖分子质量的测定
经过高温高压蒸煮,木聚糖的糖苷键以及支链在高温条件下会被断开,分子质量降低。通过凝胶渗透色谱可以得到每个组分的分子质量分布图,以及分支度的不同,从而更好地了解高温高压蒸煮液中木聚糖的组成和结构。
蒸煮液中各个组分木聚糖的分子质量情况如表3 所示。木聚糖的重均分子质量随着乙醇浓度的增加而逐渐减少(分子质量由1.344×105 g/mol逐渐减到1.218×103 g/mol)。从得率上可以看出来,在高温高压蒸煮液中大分子质量的木聚糖只占5.25%;分子质量主要分布在1.247×104~3.168×103 g/mol,占木聚糖总量70.57%,木聚糖的糖苷键在蒸煮过程中被破坏了;R5、R7的分子质量很低,说明此部分在蒸煮过程中受到了更为严重的损害。对于 R1来说,其分支度要比其他组分高,而且其分子质量比其他组分大得多,所以能在低浓度的乙醇溶液中沉淀下来,后面4个组分的分支度比较相近,主要由于分子质量的不同而被分级沉淀下来,这与之前的糖基的检测结果可以相互验证。由此可得木聚糖在沉淀时,主要受到木聚糖分子质量和分支度2个因素的影响,在不同的分子质量范围,这2个因素的决定比重不同。由各组分的多分散性指数可得,各个组分的分子质量都比较集中。而这种多分散性指数小于3的多聚糖在商业上有很大的应用潜力[17-18]。
表3 各木聚糖组分的分子质量分布情况
Table 3 The molecular weight distribution of each xylan fraction

组分R1R2R3R5R7MN/(g/mol)1.222×1057.598×1032.587×1031.3×1038.81×102MW/(g/mol)1.344×1051.247×1043.168×1031.645×1031.218×103MW/MN1.1011.6411.2241.2651.383
注:MN为数均分子质量,MW为重均分子质量,MW/MN为多分散性。
2.4 各个组分红外光谱分析
乙醇分级沉淀获得的木聚糖的FTIR图如图2所示。在1 616 cm-1处水的吸收峰同糖醛酸上—COO—的反对称吸收峰叠加在一起,而1 422 cm-1是糖醛酸上—COO—的对称吸收峰。半纤维素中的C—H 伸缩振动,OH 或—C—O—(酯键中)分别出现在1 384和1 244 cm-1处。在1 044 cm-1处的强吸收峰是由木聚糖的C—O,C—C 伸缩振动或C—OH弯曲振动引起的。900 cm-1是 C—1基团频率振动和环频率振动产生的,是糖单元之间的β—糖苷键的特征吸收峰[4,19-20]。由图2还可知,各组分单元结构非常相似,与之前糖基的测定结果相一致。
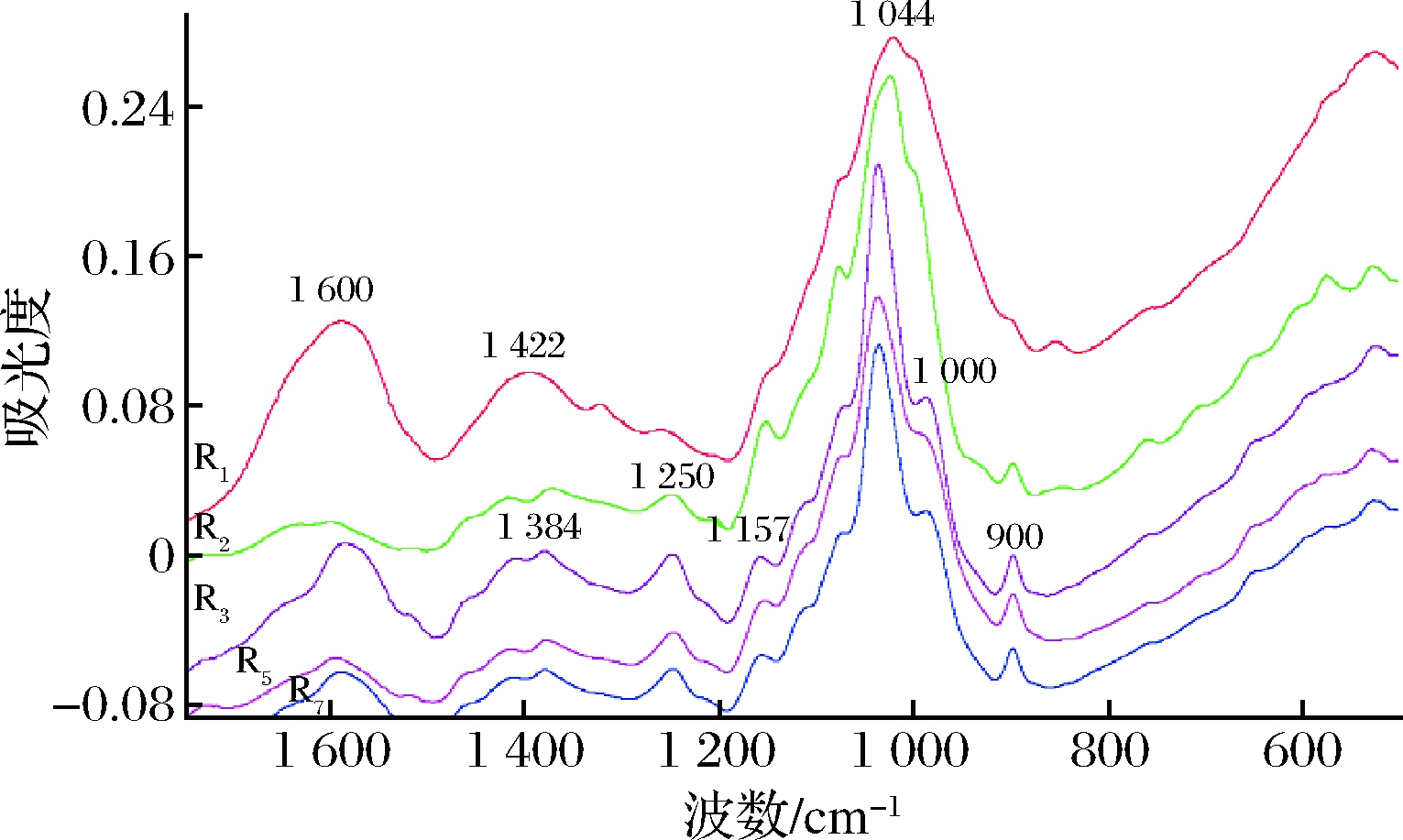
图2 各木聚糖组分的FT-IR谱图
Fig.2 FT-IR spectra of each xylan fraction
2.5 酶对于各组分的动力学参数测定
米式常数是酶的特征性常数,它只与酶的特性有关,而与酶的浓度无关,Km值与底物种类、反应条件(pH、温度等)有关,在一定条件下同一种酶对不同底物的Km 值不同,Km越小,表示底物越容易与酶结合,酶与底物的亲和力越强[21]。本研究以不同组分为底物,考察了真菌 Talaromyces thermophilus F1208 所产木聚糖酶的动力学特性。测得的5种组分的动力学数据如表4所示。
表4 各木聚糖组分的酶促反应动力学参数
Table 4 Enzymatic kinetic parameters of each xylan fraction
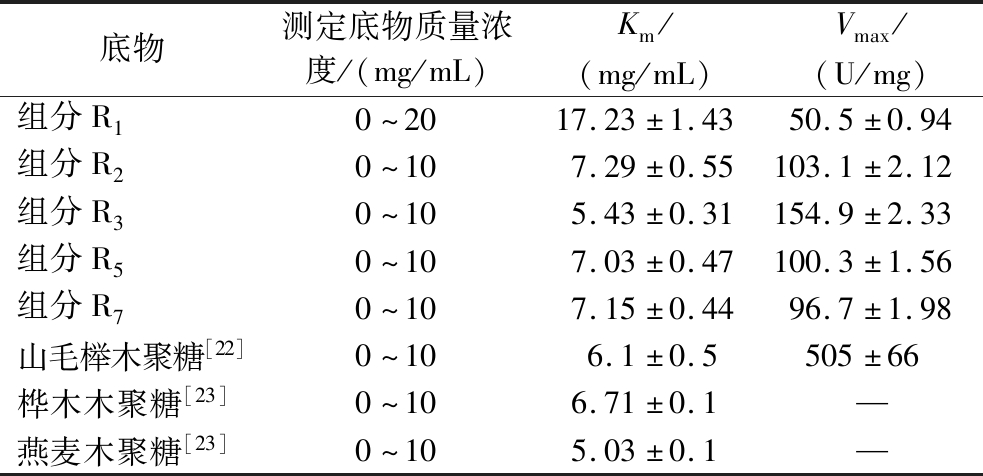
底物测定底物质量浓度/(mg/mL)Km/(mg/mL)Vmax/(U/mg)组分R10~2017.23±1.4350.5±0.94组分R20~107.29±0.55103.1±2.12组分R30~105.43±0.31154.9±2.33组分R50~107.03±0.47100.3±1.56组分R70~107.15±0.4496.7±1.98山毛榉木聚糖[22]0~106.1±0.5505±66 桦木木聚糖[23]0~106.71±0.1—燕麦木聚糖[23]0~105.03±0.1—
本研究以R2、R3、R5、R7为底物所测定的F1208木聚糖酶的Km值相近且与已报道的F1208木聚糖酶水解其他商用木聚糖的Km值相当[22-23],酶对R3组分的亲和力最高,水解速率也最高;而对其他组分R2、R5、R7亲和力相当,水解速率也比较接近。但对组分R1的亲和力比较低、水解效率也相对最低,R1组分相对于其他组分,分子质量最大,达到105的分子质量,说明木聚糖的分子质量太大,糖链长,不容易被水解。对于分子质量比较接近的R3、R5、R7组分,R3组分的支链度是最小的,其他2个组分的分支度高,结合前面结果分析可能是由于支链阻碍了酶与底物的结合位点的结合而阻碍了酶解效率。
3 结论
通过水热预处理结合乙醇分级沉淀对玉米芯木聚糖进行分离,由于在蒸煮的过程中木聚糖长链受到了不同程度的破坏,分离得到R1、R2、R3、R5、R7 5种分子质量集中的木聚糖组分,并分别对这5种组分相关结构进行了测定,结果显示:R1、R2的分子质量较高,R3、R5、R7 的分子质量较小。R1组分由于分支度最高,分子质量最大,使其更快地从乙醇中沉淀下来。R2~R7:分支度相近,R2的分子质量远大于R7,阻碍了酶的水解;R5~R7:分子质量相近,R7分支度大,支链多,阻碍了酶与底物的接触;R3、R5、R7:3个组分分子质量和分支度都不同,R3的分子质量最大,但酶与其亲和力最强,说明在分子质量处于较低水平时,影响酶解效率的决定因素为分支度。同时检测到R1、R2组分中含有纤维素的成分,也可能阻碍酶对其的水解效率。
本研究通过探究玉米芯半纤维素结构中木聚糖结构变化影响酶解效率的机理,拟从分子层面寻求解除水解障碍方法,为提高富含木聚糖的农业废弃物再利用-高效制备低聚木糖提供了新的思路和理论依据。
[1] LIU H M,FENG B,SUN R C.Acid:Chlorite pretreatment and liquefaction of cornstalk in hot-compressed water for bio-oil production[J].Journal of Agricultural and Food Chemistry,2011,59(19):10524-10531.
[2] CHEN T Y,LI Z W,ZHANG X M,et al.Effects of hydrothermal pretreatment on the structural characteristics of organosolv lignin from Triarrhena lutarioriparia[J].Polymers,2018,10(10):1157.
[3] SMITA M.Microbial xylanases:Tool for biotechnology and industry[J].Journal of Basic and Applied Mycology,2016,12(1):1-11.
[4] 樊洪玉,卫民,赵剑,等.玉米芯木聚糖的提取及其相对分子质量分布研究[J].生物质化学工程,2019,53(3):24-32.
FAN H Y,WEI M,ZHAO J,et al.Extraction and relative molecular mass distribution of corncob xylan[J].Biomass Chemical Engineering,2019,53(3):24-32.
[5] PENG X P,BIAN J,YAO S Q,et al.Effects of P-coumarate 3-hydroxylase downregulation on the compositional and structural characteristics of lignin and hemicelluloses in poplar wood (Populus alba ×Populus glandulosa)[J].Frontiers in Bioengineering and Biotechnology,2021,9:790539.
[6] PENG F,PENG P,XU F,et al.Fractional purification and bioconversion of hemicelluloses[J].Biotechnology Advances,2012,30(4):879-903.
[7] BARUAH J,NATH B K,SHARMA R,et al.Recent trends in the pretreatment of lignocellulosic biomass for value-added products[J].Frontiers in Energy Research,2018,6:141.
[8] 周瑾琨,尹志慧,赵玮.玉米皮纤维素提取工艺优化及结构表征[J].食品工业科技,2019,40(5):207-212.
ZHOU J K,YIN Z H,ZHAO W.Optimization of extraction technique and structure characterization of cellulose from corn bran[J].Science and Technology of Food Industry,2019,40(5):207-212.
[9] 滕超,鹿发展,范光森,等.木聚糖酶的研究进展及其在食品领域的应用[J].生物产业技术,2019(4):34-41.
TENG C,LU F Z,FAN G S,et al.Advances in xylanase and its application in food industry[J].Biotechnology &Business,2019(4):34-41.
[10] SHI J B,YANG Q L,LIN L,et al.Fractionation and characterization of physicochemical and structural features of corn stalk hemicelluloses from yellow liquor of active oxygen cooking[J].Industrial Crops and Products,2013,44:542-548.
[11] SHI J B,YANG Q L,LIN L.Structural features and thermal characterization of bagasse hemicelluloses obtained from the yellow liquor of active oxygen cooking process[J].Polymer Degradation and Stability,2013,98(2):550-556.
[12] 辛瑞璞.谷物中戊聚糖含量测定方法[D].郑州:河南工业大学,2012.
XIN R P.The determination of pentosans in cereal[D].Zhengzhou:Henan University of Technology,2012.
[13] GÜLSEREN  ,GÜZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
,GÜZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
[14] 周彦强,吴光斌,陈发河.PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成[J].食品科学,2019,40(4):266-271.
ZHOU Y Q,WU G B,CHEN F H.Analysis of monosaccharide composition of polysaccharides from okra by pre-column derivatization high performance liquid chromatography[J].Food Science,2019,40(4):266-271.
[15] PENG F,REN J L,XU F,et al.Comparative studies on the physico-chemical properties of hemicelluloses obtained by DEAE-cellulose-52 chromatography from sugarcane bagasse[J].Food Research International,2010,43(3):683-693.
[16] 张嘉茜,刘思源,王鹏杰,等.两种分子质量水溶性半纤维素的制备及其对淀粉消化抑制作用研究[J].食品与发酵工业,2023,49(9):150-157.
ZHANG J X,LIU S Y,WANG P J,et al.Preparation of two molecular weight water-souble hemicellulose and its inhibition on starch digestion[J].Food and Fermentation Industries,2023,49(9):150-157.
[17] YANG H Y,SONG X L,YUAN T Q,et al.Fractional characterization of hemicellulosic polymers isolated from Caragana korshinskii Kom[J].Industrial &Engineering Chemistry Research,2011,50(11):6877-6885.
[18] 施建斌.玉米秆活性氧蒸煮过程中半纤维素的结构变化及其机理的研究[D].广州:华南理工大学,2013.
SHI J B.Study on structural changes and mechanism of hemicellulose during active oxygen cooking of corn stalk[D].Guangzhou:South China University of Technology,2013.
[19] CHAIKUMPOLLERT O,METHACANON P,SUCHIVA K.Structural elucidation of hemicelluloses from Vetiver grass[J].Carbohydrate Polymers,2004,57(2):191-196.
[20] MA X J,YANG X F,ZHENG X,et al.Degradation and dissolution of hemicelluloses during bamboo hydrothermal pretreatment[J].Bioresource Technology,2014,161:215-220.
[21] 谭海刚,宫春波,李静.微生物生理学[M].济南:山东科学技术出版社,2009:84-109.
TAN H G,GONG C B,LI J.Microbial Physiology[M].Jinan:Shandong:Shandong Science and Technology Press,2009:84-109.
[22] FAN G S,WU Q H,LI Q,et al.Impact of the disulfide bond on hydrolytic characteristics of a xylanase from Talaromyces thermophiles F1208[J].International Journal of Biological Macromolecules,2020,164:1748-1757.
[23] LI Q,SUN B G,XIONG K,et al.Improving special hydrolysis characterization into Talaromyces thermophilus F1208 xylanase by engineering of N-terminal extension and site-directed mutagenesis in C-terminal[J].International Journal of Biological Macromolecules,2017,96:451-458.