使柑橘类水果呈现红色的色素类型有脂溶性的类胡萝卜素类和水溶性的花青素类。血橙是典型的因花青素着色的品种[1],花青素也是其抗氧化活性的主要组成成分[2]。血橙花青素的形成受果实成熟度和温度的影响,即需达到一定成熟期,并在低温下才可形成[3]。采前果实成熟度和光照、土壤及气候等环境因素[4]、采后温度和贮藏时间都与果实花色苷的合成密切相关。
近年来,果实成熟过程中色素的区域性分布受到越来越多的关注。研究发现,塔罗科血橙“血色”形成期间不同部位果肉存在明显的着色差异[5]。血橙采前色素的区域性形成过程大多是从果顶部位开始,同时受品种及贮藏环境等因素的影响[6]。虽然血橙的果皮、果肉都是由花色苷着色,但果皮和果肉中花色苷的种类存在差异[7],因而猜测血橙果皮、果肉组织中的花色苷合成积累过程可能是相对独立的[8]。植物中花色苷的积累受编码生物合成关键酶基因和一些转录因子的调控。目前已知的3种类型转录因子R2R3-MYB、bHLH和WD40最有可能通过形成MBW复合物[9]共同作用,而其中的MYB转录因子被证明可以独立于MBW复合物发挥调节花色苷生物合成的作用[10],在成熟苹果果实中,MdMYB1的转录与果实红色果皮部位的花青素合成相关[11]。
此外,研究发现,果实的各种营养素,特别是糖酸等基础物质含量的变化与其色素含量有一定相关性。张义等[12]发现“大红李”和“黑宝石”2个品种李果实的花色苷与其可溶性糖含量呈显著正相关,与酸的含量呈显著负相关,二者的类胡萝卜素含量都与其可溶性糖含量呈显著正相关。张淑文等[13]发现杨梅果实的a*/b*与其可溶性糖含量呈极显著正相关,与柠檬酸含量呈极显著负相关。宋哲等[14]发现“富士”苹果果皮的花色苷含量与其可溶性固形物(total soluble solids,TSS)含量、可溶性糖含量呈极显著正相关。MU等[15]发现蓝莓果皮中的花色苷含量与果实的总糖、总酸、糖酸比呈显著正相关。MdMYB6可以通过调节MdTMT1降低一些糖的含量来抑制花青素的生物合成[16],这说明在果实色泽分布的不同区域中可能存在不同的调节机制,其机制涉及糖酸的基础代谢过程,而糖酸含量在果实中也存在区域性分布的情况,因此系统研究塔罗科血橙着色期间糖酸等基础营养物质分布规律及其与果肉色泽形成的关系,对明确塔罗科血橙果肉特异性着色机理具有重要意义。基于此,本研究以重庆万州所产塔罗科血橙果实为试验对象,选取不同着色程度塔罗科血橙果实,通过对不同着色程度血橙的果肉色素及糖酸的分布规律,及糖酸含量与着色关系进行分析,以期为塔罗科血橙果实果肉不同部位着色差异的机理研究提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
塔罗科血橙,采自重庆万州,选择大小一致、无机械伤、无病虫害的成熟果实,清水洗去表面污垢,于室温下过夜晾干、备用。
1.1.2 实验仪器与设备
PAL-1手持数显糖度计,日本Atago公司;3H16R1智能高速冷冻离心机,湖南赫西仪器装备有限公司;TGL-18MS冷冻离心机,上海卢湘仪离心机仪器有限公司;UV1000紫外可见分光光度计,上海仪电科学仪器股份有限公司;SYNERGY H1多功能酶标仪,美国伯腾仪器有限公司;ZLS-1真空离心浓缩仪,上海精学科学仪器有限公司;DZF-6051真空干燥箱,上海齐欣科学仪器有限公司;QP2010 PLUS气质联用仪,日本岛津公司;DB-5MS气相色谱柱,安捷伦公司。
1.2 实验方法
1.2.1 果实分级及取样方法
血橙果肉红色随其成熟程度不断加深[17],根据果肉转色情况对血橙进行分级,果肉红色占整个果肉比例0~30%为A级,30%~60%为B级,60%~100%为C级。
果实分2批进行取样,纵向组和横向组。每组每个等级挑选30个果实,共180个果实。纵向组果肉在果蒂、赤道、果顶3个部位进行取样(图1右切面),横向组果肉在果蒂、赤道、果顶3个部位的内外侧进行取样(图1左切面)。所有果肉样本收集完成后立即用液氮进行冷冻,保存至-80 ℃冰箱中备用。
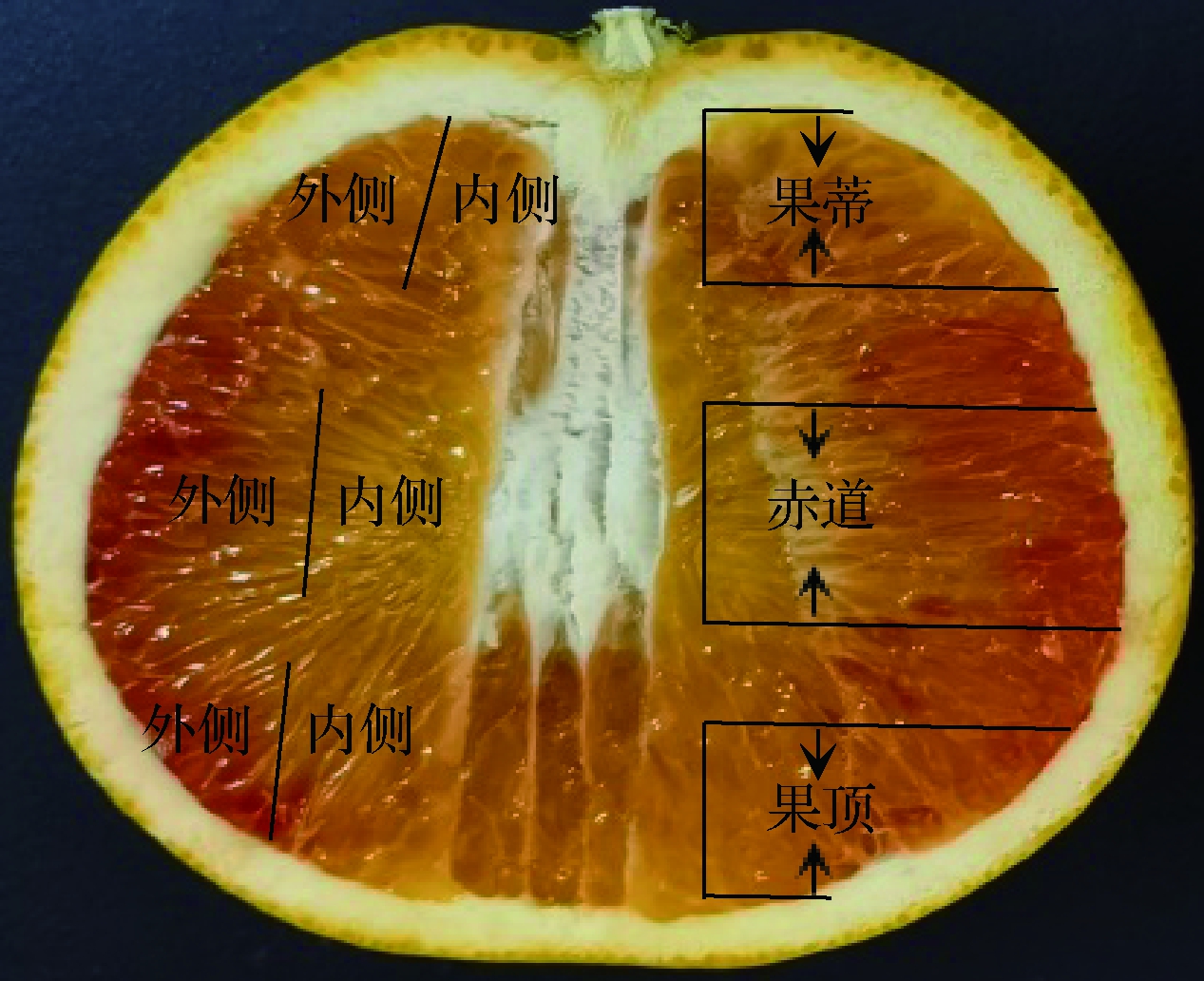
图1 不同部位取样示意图
Fig.1 Sampling diagram of different parts
1.2.2 TSS含量测定
将果实的果蒂、赤道、果顶部位的果肉分别切出,每3个血橙果肉为1组,打成匀浆,纱布过滤后,使用手持数显糖度计测定,用%表示测定结果。
1.2.3 可滴定酸(titrable acid,TA)含量测定
参考曹建康等[19] 的方法并略加修改,采用酸碱中和滴定法测定,用质量分数来表示。
1.2.4 花色苷含量测定
采用pH示差法,具体操作参考文献[17]和[20]的方法并略加修改。
1.2.5 总类胡萝卜素含量的测定
参考陶俊等[21] 的方法进行测定,使用丙酮溶液提取,利用紫外可见分光光度计在350~700 nm范围扫描并记录470、645、662 nm处的吸光值,计算总类胡萝卜素含量。
1.2.6 还原糖含量的测定
参考曹建康等[19] 的方法并略加修改,采用3,5-二硝基水杨酸法测定。利用紫外分光光度计测定样品在500 nm波长下的吸光度。采用葡萄糖制作标曲。用质量分数表示测定结果。
1.2.7 糖酸含量的测定
根据DING等[22]的方法提取血橙果肉中的可溶性糖和有机酸成分并进行衍生化,采用气相色谱-质谱联用来分析鉴定各种可溶性糖和有机酸成分,通过将检索结果与标准图谱库NIST 08对照进行定性分析,采用内标法进行定量分析。测定条件如下:
色谱柱为DB-5 MS石英毛细管柱(30 m×0.25 mm×0.25 μm,Agilent);载气为高纯He(99.999%),流速1.0 mL/min;样品进样量1 μL,分流比10∶1;进样口温度250 ℃,离子源温度230 ℃,接口温度250 ℃;扫描范围(m/z):45~600;程序升温:初始100 ℃开始,保持1 min;以3 ℃/min的速度升至175 ℃并保持1 min;以2 ℃/min的速度升至184 ℃;再以0.5 ℃/min的速度升至190 ℃并保持1 min;最后以7 ℃/min的速度升至280 ℃并保持5 min。
1.2.8 数据的处理分析
所有试验重复3次。使用Excel 2019整理数据,使用GraphPad Prism 8.0绘制相关图表,SPSS 26进行单因素方差分析,采用邓肯氏法(α=0.05)进行差异显著性检验,采用皮尔逊相关系数进行相关性分析。
2 结果与分析
2.1 不同着色程度塔罗科血橙果肉着色特性
2.1.1 不同着色程度塔罗科血橙果肉表观着色特性
如图2所示,花色苷是塔罗科血橙着色差异的关键因素,塔罗科血橙果肉花色苷的分布呈现明显的区域分布特性,花色苷积累的大致趋势是从果顶向果蒂延伸,从果肉的外侧向果肉的内侧延伸。
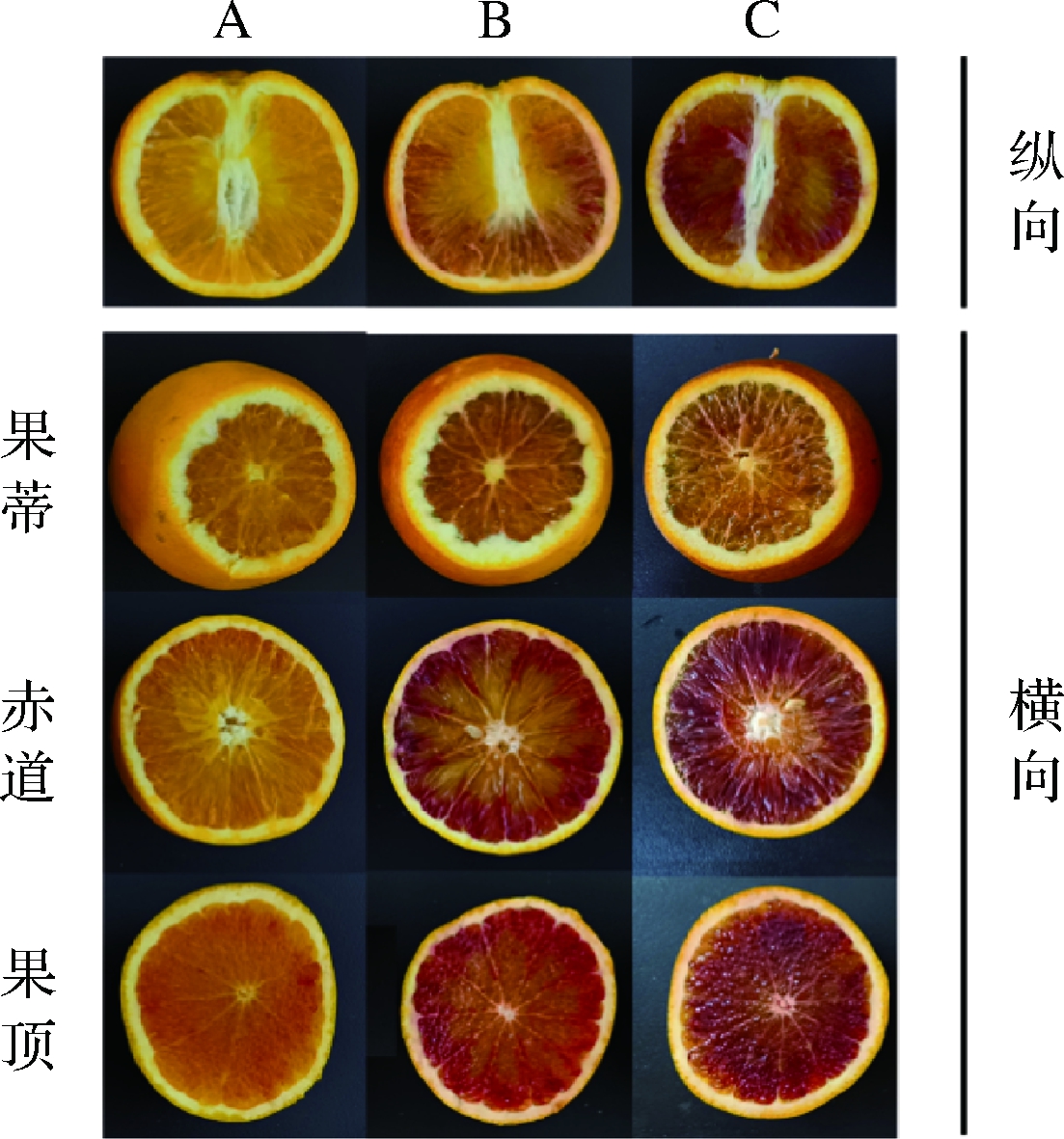
图2 不同着色程度塔罗科血橙果肉着色特性(纵向+横向)
Fig.2 Coloration characteristics of Tarocco blood orange (vertical + horizontal)
2.1.2 不同着色程度塔罗科血橙花色苷分布
由图3-a可知,血橙果肉从A等级到B等级的变化过程中果蒂、赤道、果顶3个部位的花色苷含量逐渐增加。由图3-b、图3-c可知,无论是果肉内侧还是外侧,3个部位的花色苷含量分布始终是:果顶>赤道>果蒂。由图3-d~图3-f可知,外侧果肉花色苷含量大于内侧果肉,与图2表观结果一致。

a-果肉;b-内侧果肉;c-外侧果肉;d-果蒂;e-赤道;f-果顶
图3 不同着色程度塔罗科血橙果肉花色苷含量
Fig.3 Anthocyanin content in different parts of flesh of Tarocco blood orange
注:图中同一指标下的不同字母表示存在显著性差异(P<0.05)(下同)。
2.1.3 不同着色程度塔罗科血橙总类胡萝卜素分布
类胡萝卜素也是塔罗科血橙中重要的呈色色素。由图4可知,随血橙果肉红色的增加,其果蒂、赤道、果顶3个部位的总类胡萝卜素含量都逐渐增加,且赤道部位外侧果肉的总类胡萝卜素含量显著低于内侧果肉(P<0.05),与花青素分布规律相反。
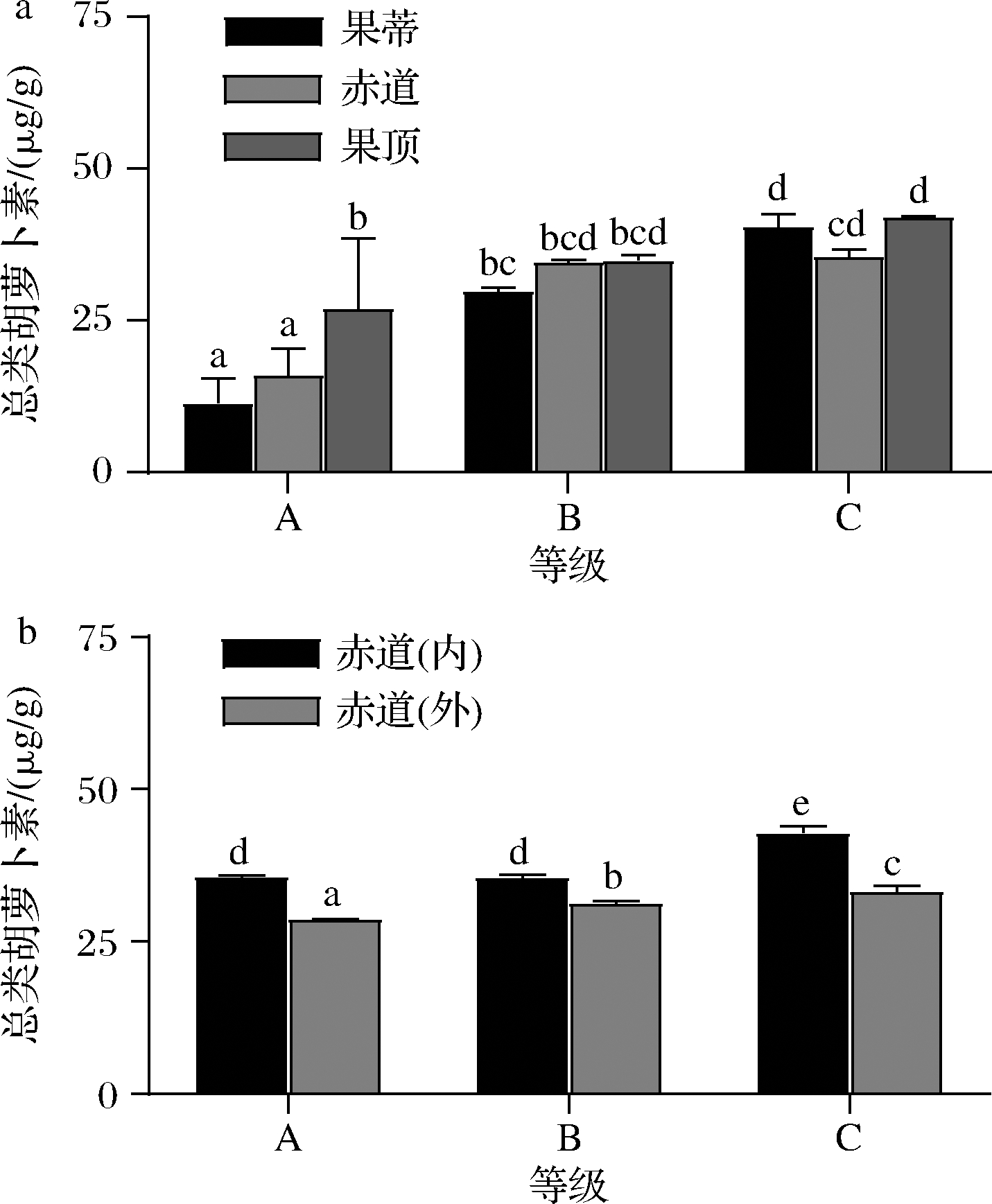
a-果肉3个部位;b-赤道内外侧果肉
图4 不同着色程度塔罗科血橙果肉总类胡萝卜素含量
Fig.4 Total carotenoid content in different parts of flesh of Tarocco blood orange
2.2 不同着色程度塔罗科血橙TSS分布规律
由图5-a可知,在血橙果实中,随着果肉红色增加,其TSS含量也逐渐增加。由图5-b、图5-c,无论是内侧果肉还是外侧果肉,3个部位果肉的TSS含量呈现的都是相同的趋势,且在同一果实不同部位含量分布的特点为:果蒂<赤道<果顶。由图5-d~图5-f可知,外侧TSS含量高于内侧含量。
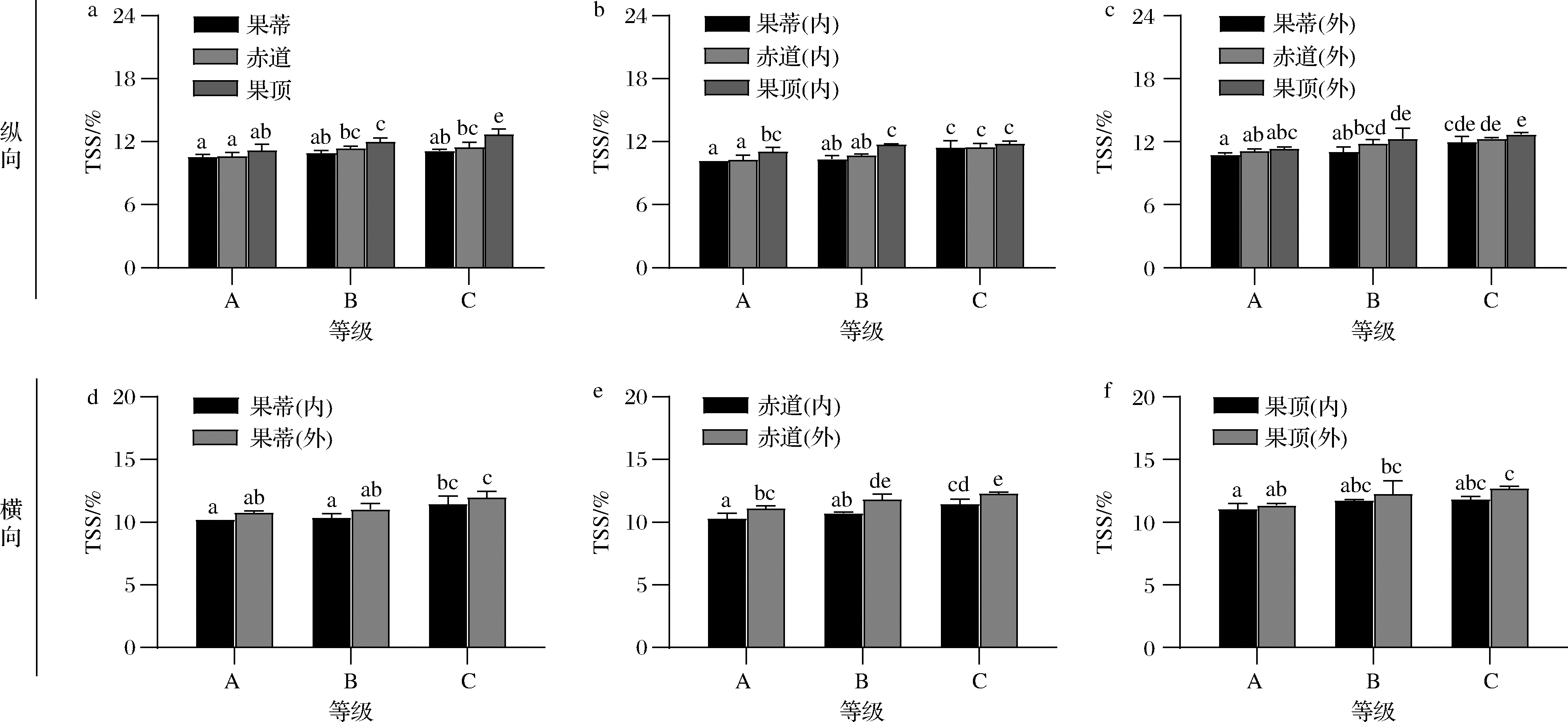
a-果肉;b-内侧果肉;c-外侧果肉;d-果蒂;e-赤道;f-果顶
图5 不同着色程度塔罗科血橙果肉TSS含量
Fig.5 Total soluble solids in different parts of flesh of Tarocco blood orange
2.3 不同着色程度塔罗科血橙糖分布规律
2.3.1 不同着色程度塔罗科血橙果肉还原糖分布
由图6-a可知,随着果肉红色增加,果实的果蒂、赤道、果顶3个部位的还原糖含量逐渐增加,由图6-b、图6-c在果实的内外侧均是相同的趋势。另外,由图6-a可知,在同一果实不同部位还原糖含量分布的特点为:果蒂<赤道<果顶。由图6-d~图6-f可知,3个部位的果肉内侧的还原糖含量均低于外侧,且B和C等级血橙赤道部位内侧果肉的还原糖含量显著低于外侧(P<0.05)。

a-果肉;b-内侧果肉;c-外侧果肉;d-果蒂;e-赤道;f-果顶
图6 不同着色程度塔罗科血橙果肉不同部位的还原糖含量的差异
Fig.6 Difference of reducing sugars in different parts of flesh of Tarocco blood orange
2.3.2 不同着色程度塔罗科血橙果肉可溶性糖分布
柑橘中含有的可溶性糖主要包括果糖、葡萄糖、蔗糖[23]。由图7-a可知,血橙果肉中的果糖含量随果肉红色增加而增加,在不同部位的变化趋势是一致的;而图7-b中葡萄糖含量在果蒂部位逐渐上升,在赤道部位先上升后下降,在果顶部位逐渐下降;图7-c中蔗糖含量在果蒂和赤道部位先上升后下降,在果顶部位逐渐上升。另外,由图7-d~图7-e可知,B等级赤道外侧的果糖含量和B、C等级的葡萄糖含量显著高于内侧(P<0.05)。由图7-f可知,赤道内外侧蔗糖含量差异不显著。
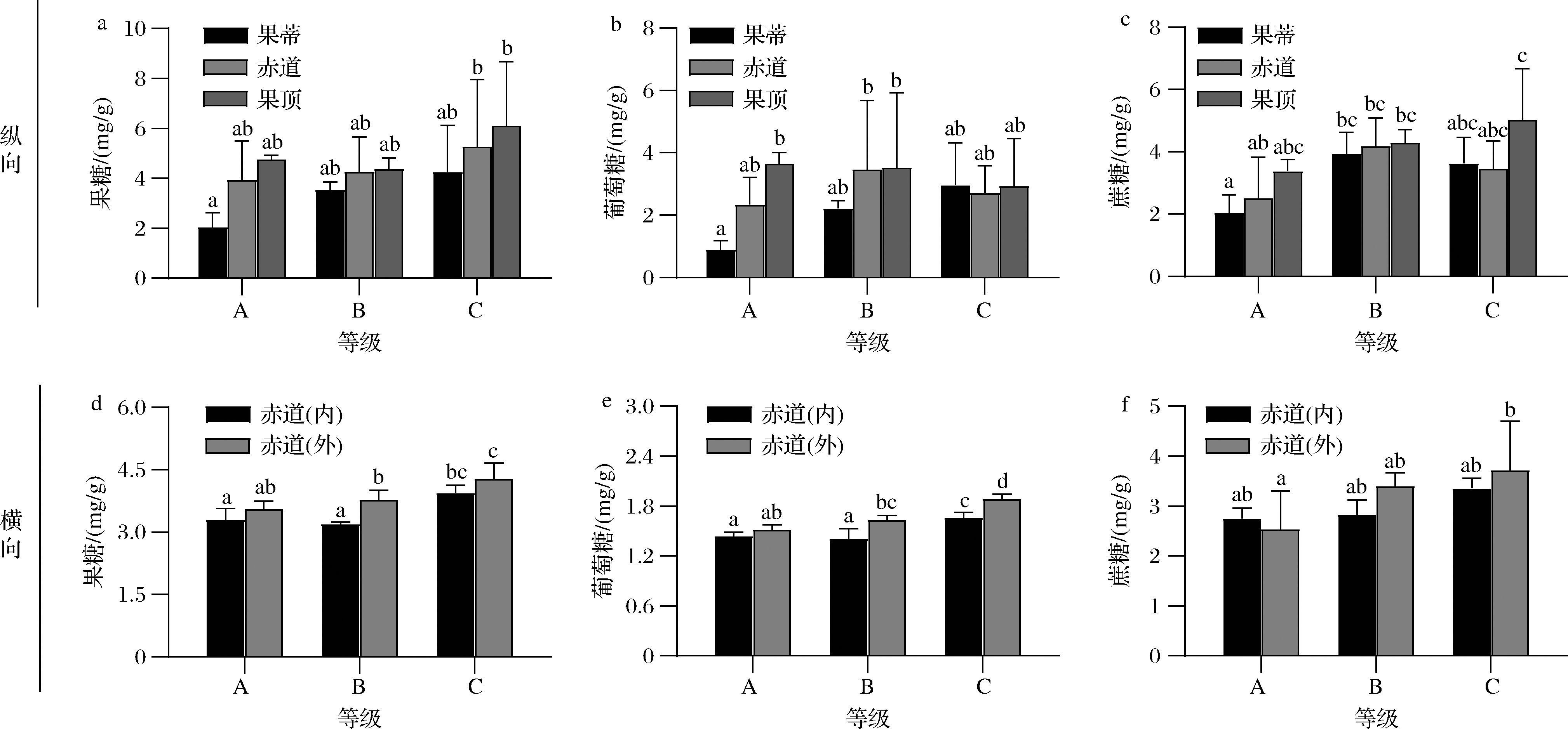
a-果肉3个部位的果糖含量;b-果肉3个部位的葡萄糖含量;c-果肉3个部位的蔗糖含量;d-赤道内外侧果肉的果糖含量;e-赤道内外侧果肉的葡萄糖含量;f-赤道内外侧果肉的蔗糖含量
图7 不同着色程度塔罗科血橙果肉不同部位的可溶性糖含量的差异
Fig.7 Difference of soluble sugars in different parts of flesh of Tarocco blood orange
2.4 不同着色程度塔罗科血橙酸分布规律
2.4.1 不同着色程度塔罗科血橙果肉TA分布
由图8-a可知,随着果肉红色增加,血橙果实的果蒂、赤道、果顶3个部位的TA含量都有一定减少,且果肉中3个部位的TA含量比较接近,由图8-b、图8-c可知在果实的内外侧均是相同的趋势。另外从图8-d~图8-f中也可以看出,3个部位的果肉内侧的TA含量显著高于外侧(P<0.05)。

a-果肉;b-内侧果肉;c-外侧果肉;d-果蒂;e-赤道;f-果顶
图8 血橙果肉不同部位的TA含量的差异
Fig.8 Difference of TA content in different parts of flesh of blood orange
2.4.2 不同着色程度塔罗科血橙果肉柠檬酸和苹果酸分布
果实中有机酸的积累过程非常复杂,受有机酸的合成、降解和贮藏利用等影响[24]。柑橘以柠檬酸为主要积累类型,柠檬酸的含量直接影响柑橘中总有机酸含量。如图9-b所示,塔罗科血橙果肉柠檬酸含量随着果肉红色的增加先增加后降低,柑橘果肉的成熟和颜色变化一般是同时发生的[25],这也验证了前人研究中发现的柑橘果实中的柠檬酸含量在果实发育的前期积累升高后期降低的现象[17]。由图9-a可知,果蒂和赤道部位血橙果肉中的苹果酸含量均随果肉红色增加呈现出下降的趋势,在果顶部位无显著变化;从图9-c、9-d中可看出,在B、C等级的血橙果肉中,赤道内侧苹果酸含量高于赤道外侧,而3个等级的血橙果肉中,赤道内侧柠檬酸含量均高于赤道外侧。

a-果肉3个部位的苹果酸含量;b-果肉3个部位的柠檬酸含量;c-赤道内外侧果肉的苹果酸含量;d-赤道内外侧果肉的柠檬酸含量
图9 血橙果肉不同部位的有机酸含量的差异
Fig.9 Difference of organic acids in different parts of flesh of Tarocco blood orange
2.5 不同着色程度塔罗科血橙果肉糖酸含量与着色的相关性分析
2.5.1 果蒂部位果肉糖酸含量与着色的相关性分析
由图10可知,塔罗科血橙果蒂部位果肉中花色苷含量和蔗糖含量呈显著正相关,相关系数为0.763(P<0.05),总类胡萝卜素含量与TSS、果糖、葡萄糖、蔗糖含量的正相关系数分别为0.837(P<0.01)、0.786、0.739、0.758(P<0.05),说明可溶性糖的积累可能会促进花色苷合成和总类胡萝卜素的积累。另外,血橙果蒂果肉中某些有机酸含量与花色苷、总类胡萝卜素的含量也有相关性,其中苹果酸和总类胡萝卜素含量呈显著负相关,相关系数为-0.780(P<0.05),柠檬酸和花色苷含量、总类胡萝卜素含量呈显著正相关,相关系数分别为0.710、0.797(P<0.05),但血橙果实中的苹果酸和花色苷含量相关性不显著(P>0.05)。

图10 血橙果蒂果肉中各种营养物质含量的皮尔逊相关性分析
Fig.10 Pearson correlation analysis heatmap of various nutrient content in flesh of the stem position of blood orange
注:**在0.01水平上(双侧)上表示极显著相关;*在0.05水平(双侧)上表示显著相关(下同)。
2.5.2 赤道部位果肉糖酸含量与着色的相关性分析
由图11可知,赤道部位果肉中花色苷含量和TSS含量呈显著正相关,相关系数为0.809(P<0.05),和还原糖含量呈极显著正相关,相关系数为0.872(P<0.01),总类胡萝卜素含量和TSS含量呈显著正相关,相关系数为0.795(P<0.05),和还原糖含量呈极显著正相关,相关系数为0.933(P<0.01)。苹果酸和花色苷、总类胡萝卜素含量呈负相关,相关系数分别为-0.779(P<0.05)、-0.934(P<0.01),柠檬酸和花色苷含量、总类胡萝卜素含量呈正相关,相关系数分别为0.821(P<0.05)、0.953(P<0.01),其中总类胡萝卜素含量和苹果酸、柠檬酸含量之间呈极显著相关(P<0.01),其在赤道部位的合成和积累有可能和这些有机酸含量关系更大。

图11 血橙赤道果肉中各种营养物质含量的皮尔逊相关性分析
Fig.11 Pearson correlation analysis heatmap of various nutrient content in flesh of the equator position of blood orange
2.5.3 果顶果肉糖酸含量与着色的相关性分析
由图12可知,不同着色程度塔罗科血橙在果顶部位的果肉中花色苷含量和还原糖含量呈显著正相关,相关系数为0.720(P<0.05),总类胡萝卜素含量与TSS含量的正相关系数分别为0.775(P<0.05)。苹果酸和花色苷、总类胡萝卜素含量没有显著相关性(P>0.05),柠檬酸和花色苷含量呈极显著正相关,相关系数为0.905(P<0.01)。
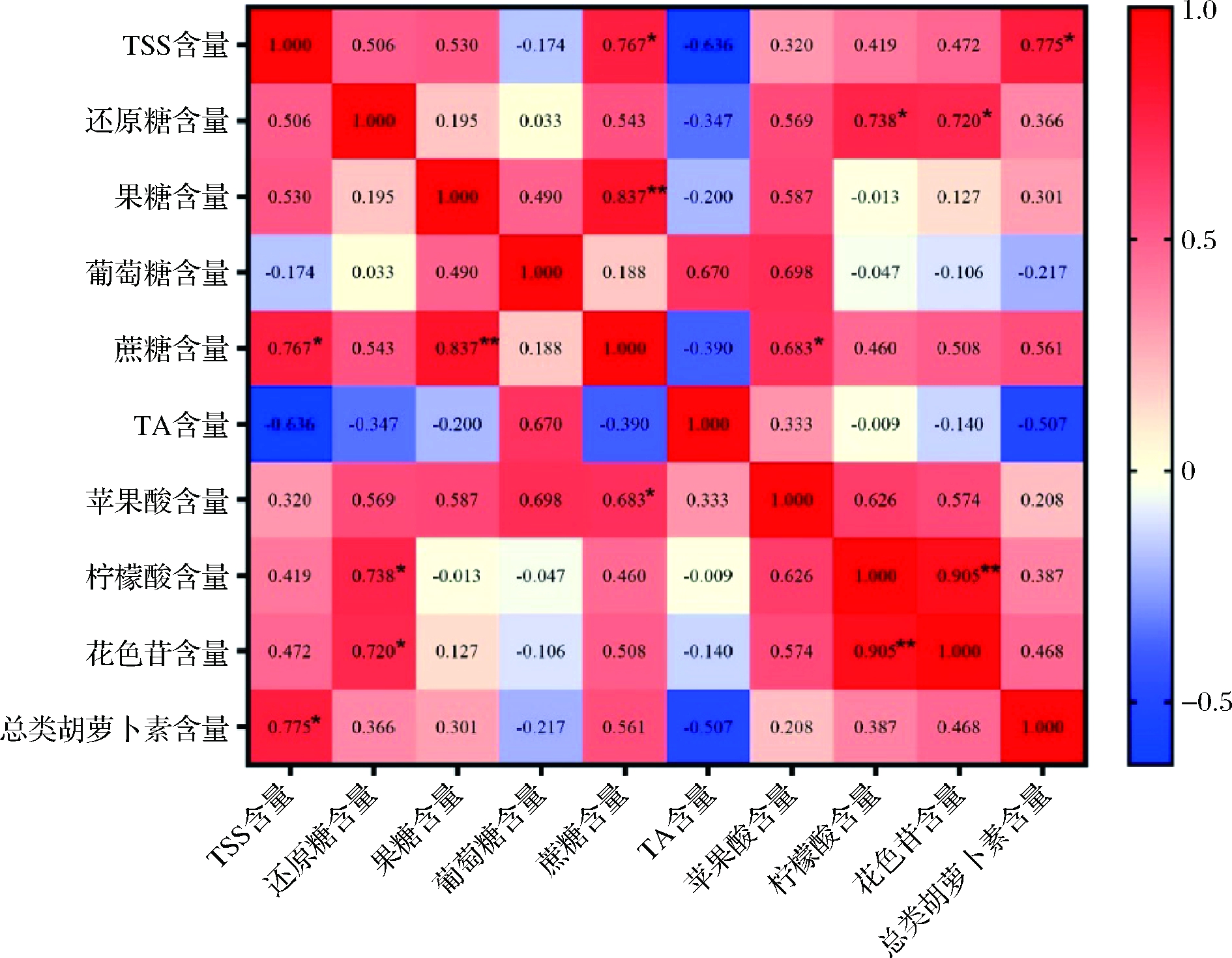
图12 血橙果顶果肉中各种营养物质含量的皮尔逊相关性分析
Fig.12 Pearson correlation analysis heatmap of various nutrient content in flesh of the top position of blood orange
3 讨论与结论
近年来,果蔬及花卉色泽形成过程中色素的区域性分布特性受到越来越多的关注。DENG等[26]研究发现蜜橘采后经过褪绿处理后,其果实不同部位存在明显着色差异,乙烯褪绿处理果实的着色从果蒂部位逐渐向果顶延伸。本研究结果表明,塔罗科血橙果顶部位果肉着色快于赤道部位,赤道部位快于果蒂部位;外侧果肉着色快于内侧果肉,表明花青素和类胡萝卜素的调控存在差异。
糖、酸含量与果蔬风味密切相关,糖酸既参与果实的基础代谢进行能量供给,也是合成花色苷、类胡萝卜素等色素的原料。糖是花色苷合成的前体物质[27],也是1种信号分子[28],通过激活己糖激酶信号来调控与花色苷合成相关基因的表达从而诱导花色苷的生物合成和积累[29]。有机酸也会影响花色苷的合成[30],pH值的变化可以影响花色苷的稳定性,改变其颜色,而有机酸可以通过改变液泡的pH值、改变酶的活性,从而影响花色苷的稳定性和合成代谢[31]。本研究中血橙果肉的营养物质含量在不同部位的分布具有特异性,色素(花色苷、总类胡萝卜素)、TSS、还原糖、可溶性糖(果糖、葡萄糖、蔗糖)含量均呈现果蒂<赤道<果顶的趋势,且3个部位内外侧的含量也有差异,除了总类胡萝卜素含量内侧>外侧之外,以上其他营养物质含量均表现为内侧<外侧,而TA在3个部位的含量相近,苹果酸在果蒂的含量>在赤道和果顶的含量,柠檬酸在果蒂的含量小于在赤道和果顶的含量,并且TA、苹果酸和柠檬酸在内外侧的含量均表现为内侧大于外侧。另外,花色苷作为血橙果实中主要的呈色色素,在不同部位的果肉中,与花色苷含量具有显著相关性的营养物质不同,在果蒂部位的果肉中,与花色苷含量呈显著正相关的是蔗糖,而在赤道、果顶部位,与花色苷含量显著相关的分别是TSS和还原糖、还原糖。一些己糖激酶的抑制剂、钙通道阻滞剂[32]、蛋白激酶抑制剂[28]等可以削弱蔗糖对花色苷积累的调控,由此推断赤道和果顶部位的花色苷积累机制和果蒂部位可能不同;与花色苷含量有显著相关性的苹果酸只在赤道部位呈现出显著负相关,在果蒂和果顶部位并没有显著相关性。
本研究结果表明,塔罗科血橙果肉中各种营养物质在不同部位的含量分布可能会影响花色苷的合成和类胡萝卜素的积累,从而造成血橙在不同部位的着色差异,为今后对其调控机理的研究提供一定基础。
[1] 徐娟,邓秀新.柑橘类果实汁胞的红色现象及其呈色色素[J].果树学报,2002,19(5):307-313.
XU J,DENG X X.Red juice sac of Citrus and its main pigments[J].Journal of Fruit Science,2002,19(5):307-313.
[2] PALMA A,D’AQUINO S,VANADIA S,et al.Cold quarantine responses of ‘Tarocco’ oranges to short hot water and thiabendazole postharvest dip treatments[J].Postharvest Biology and Technology,2013,78:24-33.
[3] 陈良珠.血橙在浙南的适应性调查[J].浙江柑桔,1985(3):29-31.
CHEN L Z.Investigation on adaptability of blood orange in south Zhejiang[J].Zhejiang Ganju,1985(3):29-31.
[4] LO PIERO A R.The state of the art in biosynthesis of anthocyanins and its regulation in pigmented sweet oranges[(Citrus sinensis) L.osbeck[J].Journal of Agricultural and Food Chemistry,2015,63(16):4031-4041.
[5] 冯桂蓉,王小容,谢姣,等.塔罗科血橙采后花色苷合成规律、挥发性物质组分及含量变化分析[J].食品与发酵工业,2019,45(17):234-239.
FENG G R,WANG X R,XIE J,et al.Synthesis of anthocyanins and changes in volatile components and contents in Tarocco orange during postharvest storage[J].Food and Fermentation Industries,2019,45(17):234-239.
[6] CARMONA L,ALQUÉZAR B,MARQUES V V,et al.Anthocyanin biosynthesis and accumulation in blood oranges during postharvest storage at different low temperatures[J].Food Chemistry,2017,237:7-14.
[7] 曹少谦.血橙花色苷结构及其在加工过程中的降解机制研究[D].武汉:华中农业大学,2009.
CAO S Q.Studies on structure of anthocyanins from blood orange and related degradation mechanism during processing[D].Wuhan:Huazhong Agricultural University,2009.
[8] 杨海健,周心智,张云贵,等.光照对血橙果实内外着色调控的影响[J].南方农业学报,2019,50(9):2015-2021.
YANG H J,ZHOU X Z,ZHANG Y G,et al.Effects of light on the regulation of coloration in blood orange peel and pulp[J].Journal of Southern Agriculture,2019,50(9):2015-2021.
[9] GAO Y F,LIU J K,CHEN Y F,et al.Tomato SlAN11 regulates flavonoid biosynthesis and seed dormancy by interaction with bHLH proteins but not with MYB proteins[J].Horticulture Research,2018,5:27.
[10] GONZALEZ A,ZHAO M Z,LEAVITT J M,et al.Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex in Arabidopsis seedlings[J].The Plant Journal:for Cell and Molecular Biology,2008,53(5):814-827.
[11] TAKOS A M,JAFFE F W,JACOB S R,et al.Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J].Plant Physiology,2006,142(3):1216-1232.
F W,JACOB S R,et al.Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J].Plant Physiology,2006,142(3):1216-1232.
[12] 张义,刘敏.不同颜色李果实成熟期果皮色素的变化及与糖酸含量的相关性[J].北方园艺,2012(10):16-19.
ZHANG Y,LIU M.Pericarp pigment changes and correlations with soluble sugar and titratable acid content in plum fruits with different colors during maturation[J].Northern Horticulture,2012(10):16-19.
[13] 张淑文,梁森苗,郑锡良,等.杨梅果实生长指标的数学模型及各指标间的相关性分析[J].核农学报,2020,34(5):1020-1027.
ZHANG S W,LIANG S M,ZHENG X L,et al.Mathematical model and correlation analysis of Chinese bayberry fruit growth indexes[J].Journal of Nuclear Agricultural Sciences,2020,34(5):1020-1027.
[14] 宋哲,李天忠,徐贵轩.“富士”苹果着色期果皮花青苷与果实糖份及相关酶活性变化的关系[J].中国农学通报,2008,24(4):255-260.
SONG Z,LI T Z,XU G X.Studies on the relationship among the anthocyanin sugar and related enzymes activity during the coloring stage of ‘Fuji’ apple[J].Chinese Agricultural Science Bulletin,2008,24(4):255-260.
[15] MU C H,YUAN Z B,OUYANG X Q,et al.Non-destructive detection of blueberry skin pigments and intrinsic fruit qualities based on deep learning[J].Journal of the Science of Food and Agriculture,2021,101(8):3165-3175.
[16] XU H F,ZOU Q,YANG G X,et al.MdMYB6 regulates anthocyanin formation in apple both through direct inhibition of the biosynthesis pathway and through substrate removal[J].Horticulture Research,2020,7:72.
[17] 喻最新,王日葵,贺明阳,等.‘塔罗科’血橙成熟过程中花色苷积累及其与糖酸含量相关性[J].食品科学,2020,41(15):105-114.
YU Z X,WANG R K,HE M Y,et al.Correlation between anthocyanin accumulation and sugar and acid contents in ‘Tarocco’ blood oranges during ripening[J].Food Science,2020,41(15):105-114.
[18] YAN S J,LI L,HE L H,et al.Maturity and cooling rate affects browning,polyphenol oxidase activity and gene expression of ‘Yali’ pears during storage[J].Postharvest Biology and Technology,2013,85:39-44.
[19] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
CAO J K,JIANG W B,ZHAO Y M.Guidance of Physiological and Biochemical Experiments on Postharvest Fruits and Vegetables[M].Beijing:China Light Industry Press,2007.
[20] CRIF T,PETRONE G,CICERO L L,et al.Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J].Journal of Agricultural and Food Chemistry,2012,60(1):476-481.
T,PETRONE G,CICERO L L,et al.Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J].Journal of Agricultural and Food Chemistry,2012,60(1):476-481.
[21] 陶俊,张上隆,张良诚,等.MPTA对柑橘果皮类胡萝卜素形成的影响[J].植物生理与分子生物学学报,2002,28(1):46-50.
TAO J,ZHANG S L,ZHANG L C,et al.Effect of MPTA on carotenoid biosynthesis in peel of citrus(Citrus succosa hort.ex Tanaka) fruit[J].Acta Photophysiologica Sinica,2002,28(1):46-50.
[22] DING Y D,CHANG J W,MA Q L,et al.Network analysis of postharvest senescence process in citrus fruits revealed by transcriptomic and metabolomic profiling[J].Plant Physiology,2015,168(1):357-376.
[23] ZHOU Y,HE W Z,ZHENG W L,et al.Fruit sugar and organic acid were significantly related to fruit Mg of six citrus cultivars[J].Food Chemistry,2018,259:278-285.
[24] 卢晓鹏,李菲菲,谢深喜.柑橘果实柠檬酸积累调控基因研究进展[J].果树学报,2018,35(1):118-127.
LU X P,LI F F,XIE S X.Citrate accumulation in citrus fruit:A molecular perspective[J].Journal of Fruit Science,2018,35(1):118-127.
[25] CERC S M,SOLER G,IGLESIAS D J,et al.Global analysis of gene expression during development and ripening of citrus fruit flesh.A proposed mechanism for citric acid utilization[J].Plant Molecular Biology,2006,62(4):513-527.
S M,SOLER G,IGLESIAS D J,et al.Global analysis of gene expression during development and ripening of citrus fruit flesh.A proposed mechanism for citric acid utilization[J].Plant Molecular Biology,2006,62(4):513-527.
[26] DENG L L,YUAN Z Y,XIE J,et al.Sensitivity to ethephon degreening treatment is altered by blue LED light irradiation in mandarin fruit[J].Journal of Agricultural and Food Chemistry,2017,65(30):6158-6168.
[27] BAN Y,KONDO S,UBI B E,et al.UDP-sugar biosynthetic pathway:Contribution to cyanidin 3-galactoside biosynthesis in apple skin[J].Planta,2009,230(5):871-881.
[28] VITRAC X,LARRONDE F,KRISA S,et al.Sugar sensing and Ca2+-calmodulin requirement in Vitis vinifera cells producing anthocyanins[J].Phytochemistry,2000,53(6):659-665.
[29] NETA S I,SHOSEYOV O,WEISS D.Sugars enhance the expression of gibberellin-induced genes in developing petunia flowers[J].Physiologia Plantarum,2000,109(2):196-202.
[30] 刘玉莲,车飞,王海,等.苹果果实中糖、酸和花青苷的组分及含量特征分析[J].西北林学院学报,2016,31(6):236-242.
LIU Y L,CHE F,WANG H,et al.Characteristics of the components and contents of soluble sugars,organic acids and anthocyanins in apple fruit[J].Journal of Northwest Forestry University,2016,31(6):236-242.
[31] 杜纪红.桃果实花青苷和糖酸含量变化及其与套袋关系研究[D].南京:南京农业大学,2007.
DU J H.The change of anthocyanin and sugar and acid in peach fruit and the effect of bagging on them[D].Nanjing:Nanjing Agricultural University,2007.
[32] ZHAI R,WANG Z G,YANG C Q,et al.PbGA2ox8 induces vascular-related anthocyanin accumulation and contributes to red stripe formation on pear fruit[J].Horticulture Research,2019,6:137.