菠萝是我国重要的热带经济作物,在我国广东、海南、广西、云南、台湾等地都有着大规模的种植[1]。2019年末,我国菠萝种植面积约为6.5万hm2[2]。菠萝叶是菠萝采收过程中产生的农业固体废弃物,种植1 hm2菠萝可产生100 t菠萝叶。当前菠萝叶因无法有效利用,造成大量的资源浪费和环境污染。充分利用菠萝叶进行高值化产品开发是实现菠萝种植业可持续发展的重要途径之一[3-4]。
生物乙醇是重要的可再生资源,随着化石资源的不断消耗,生物乙醇的开发备受关注。在原料的选择上,美国最常见的原料是玉米,加拿大广泛使用玉米和小麦,巴西以甘蔗为主要生产原料,在欧洲,乙醇工业最常用的原料是谷物和甜菜[5-8]。这些高质量原料的投入不需要预处理就能获得相对较高的乙醇产量。在中国,主要采用玉米和小麦等陈化粮作为原料,但是由于陈化粮的不断减少和食品价格的不断攀升,原料占据了整个燃料酒精成本的70%~80%[9-10]。寻找廉价、充足的原料是保证中国生物乙醇工业规模化发展的关键。
菠萝叶含水量达87%,出汁率达75%,汁液中糖类物质含量高,营养成分较为丰富,具有生产生物乙醇的潜质。目前关于利用菠萝叶制备生物乙醇的研究较少,相关技术有待开发。本研究以鲜菠萝叶榨取的叶汁为原料,通过过程控制,探究酿酒酵母对菠萝叶汁进行乙醇发酵的过程参数,助力菠萝叶的资源化利用和菠萝种植产业的可持续发展。
1 材料与方法
1.1 实验材料
1.1.1 菌种
酿酒酵母(Saccharomyces cerevisiae)分离自安琪酿酒高活性酵母粉,保存于实验中心。
1.1.2 原料
菠萝叶采集于广东湛江菠萝种植田。新鲜菠萝叶去除表面污物后,真空包装,贮存于-20 ℃冰箱。使用时在室温下解冻,用榨汁机压榨分离叶汁和叶渣。叶汁经4层纱布过滤和真空抽滤后得澄清叶汁,叶渣(主要是纤维材料)在60 ℃烘箱烘干,室温下保存。
1.1.3 培养基
酵母浸出粉蛋白胨葡萄糖培养基(YPD,g/L):葡萄糖20、蛋白胨20、酵母提取物10。
高糖YPD培养基(g/L):葡萄糖30、蛋白胨20、酵母提取物10。
菠萝叶汁培养基:榨取的鲜菠萝叶汁。
以上培养基均在115 ℃高温下灭菌20 min。
1.1.4 主要仪器与设备
高效液相色谱,沃特世公司;GC—2010气相色谱仪,岛津企业管理(中国)有限公司;L3可见分光光度计,上海仪电仪器分析有限公司;H1650-W台式离心机,湖南湘仪实验室仪器开发有限公司;HYC-C组合式摇床,济南好宝来医疗器械有限公司;BH-IIS燃烧热测定装置,南大万和科技有限公司。
1.2 实验方法
1.2.1 种子培养
取一环平板活化的酿酒酵母于YPD培养基中,30 ℃、200 r/min摇床培养12 h。
1.2.2 有氧培养
按1%(体积分数)接种量向菠萝叶汁培养基、高糖YPD培养基和YPD培养基中接入酿酒酵母种子菌液,30 ℃、200 r/min摇床培养24 h。分别于0、3、6、9、12、24 h测定OD值、单糖、总糖含量。
1.2.3 厌氧发酵
将在菠萝叶汁培养基中有氧培养了12 h的菌液按10%(体积分数)的接种量接入菠萝叶汁培养基,30 ℃厌氧静置发酵24 h,分别于0、3、6、9、12、24 h测定单糖、总糖、乙醇含量。发酵时使用橡皮塞封口三角瓶,并在橡皮塞上插一注射器针孔,释放厌氧发酵过程中产生的CO2。
1.2.4 单因素试验
如表1所示,通过调整温度、初始pH和接种量等发酵参数,厌氧静置条件下培养24 h,测定其乙醇含量和糖醇转化率。
表1 单因素试验表
Table 1 Single factor experiment table

因素温度/℃初始pH接种量/%(体积分数)Ⅰ26、30、34、38、424.010Ⅱ304.0、4.5、5.0、5.5、6.010Ⅲ304.05、7.5、10、12.5、15
1.3 分析方法
1.3.1 单糖含量测定
取发酵液在8 000 r/min、4 ℃离心5 min,取上清液稀释一定倍数后,经0.22 μm微孔滤膜过滤,得样液待检。配制0.4、0.8、1.2、1.6、2.0 g/L葡萄糖、木糖和果糖溶液作为标液,采用高效液相色谱仪测定。色谱条件为:Waters氨基柱(150 mm×4.6 mm),示差折光检测器,V(乙腈)∶V(水)=70∶30作为流动相,柱温40 ℃,检测器温度40 ℃,流速0.4 mL/min,进样量15 μL。
1.3.2 总糖含量测定
采用蒽酮比色法[11]并稍作修改。配制20、40、60、80、100 μg/mL的葡萄糖溶液作为标液。取1 mL标液或稀释一定倍数后的样液,在25 mL比色管中加入4 mL蒽酮试剂,快速混匀,沸水浴10 min后立即冷却,在620 nm处测定吸光度。
1.3.3 乙醇含量测定
采用气相色谱法测定,具体参考吴丽荣等[12]的方法。检测条件:安捷伦DB-WAX石英毛细管色谱柱(30.0 m×0.25 mm,0.25 μm),载气N2(纯度>99.99%),进样口温度200 ℃,压力63.93 kPa,进样量1 μL,分流比20∶1,氢火焰离子化检测器温度250 ℃,H2流量30 mL/min,N2流量40 mL/min,空气流量300 mL/min。
1.3.4 纤维成分和燃烧热测定
纤维成分(纤维素、半纤维素和木质素)分析根据美国可再生能源实验室(NREL)标准程序进行[13]。干燥纤维材料总热值采用BH-IIS燃烧热测定装置测定[14]。
1.3.5 干酵母菌体含量测定
将发酵液分装入50 mL离心管中,6 000 r/min离心10 min,除去上清液后,将离心管放入60 ℃烘箱中干燥至恒重,最后称重减去离心管质量即为干酵母菌体质量。
1.3.6 糖醇转化率计算
糖醇转化率按公式(1)计算:
糖醇转化率![]()
(1)
式中:m1,发酵结束乙醇生成量,g;m2,初始发酵液中总糖含量,g;m3,发酵结束后剩余总糖含量,g。
2 结果与分析
2.1 菠萝叶汁组分分析
经榨汁机分离后,叶汁和纤维材料得率分别为75%和20%(质量分数),榨汁过程中约有5%(质量分数)的净损失。图1为叶汁中葡萄糖、果糖和木糖分析HPLC图,湛江源菠萝叶含有葡萄糖和果糖,不含木糖或含量极微。叶汁的pH为4.1~4.3,总糖含量为33.97 g/L,经HPLC分析得其中可被酿酒酵母直接利用的葡萄糖和果糖分别为14.26和16.09 g/L,占总糖的89.34%。前期研究发现,叶汁中含有丰富的粗蛋白(9 g/L)、粗脂肪(2.3 g/L)以及微生物生长所需的钾、钙、镁、铁、锌和锰等矿物质(6 g/L)[15]。
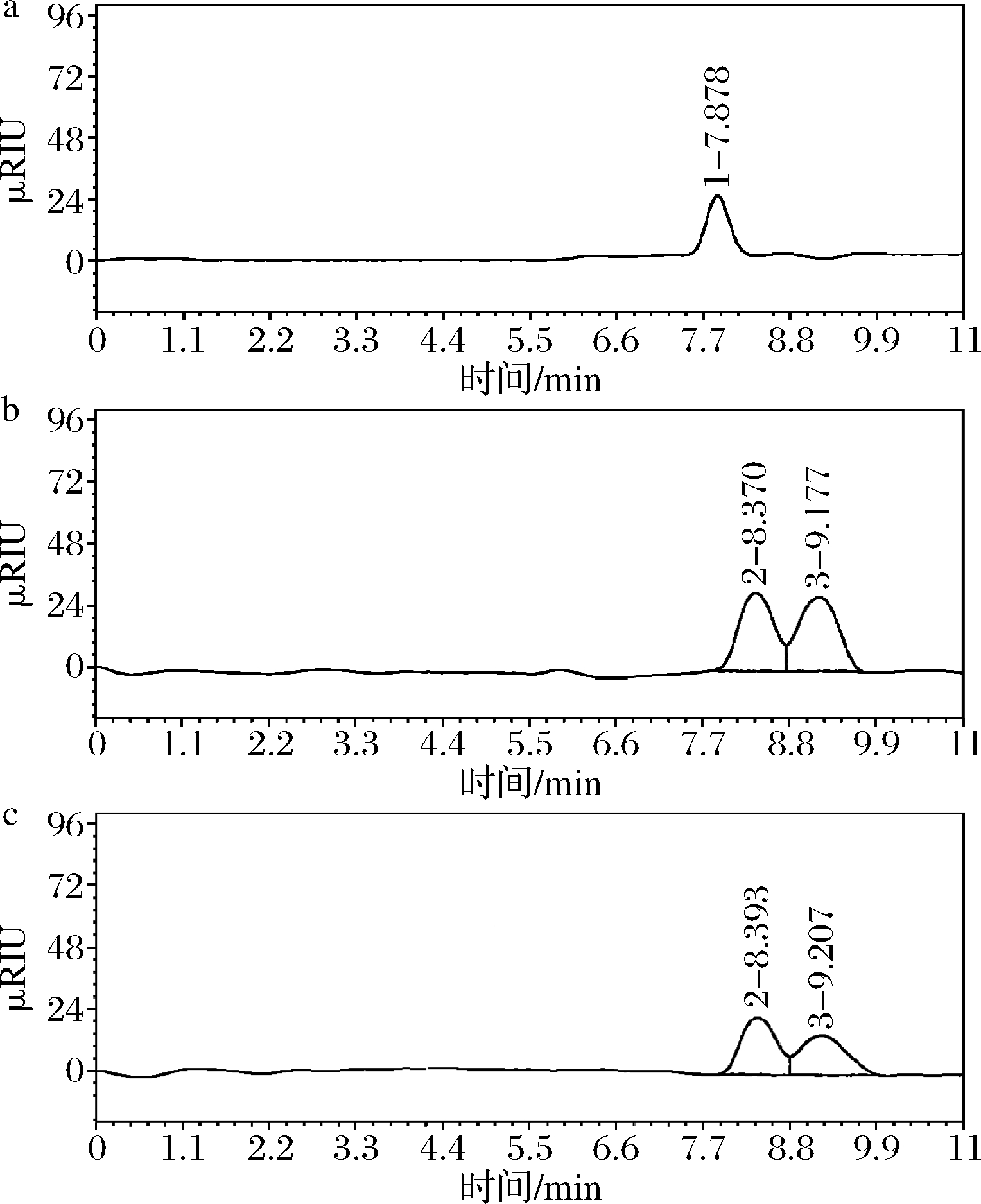
1-木糖;2-果糖;3-葡萄糖
a-木糖标准品;b-果糖和葡萄糖标准品;c-菠萝叶汁单糖
图1 菠萝叶汁单糖成分高效液相色谱图
(标准品及样品分析)
Fig.1 HPLC chromatogram of monosaccharides in pineapple leaf juice (standard and sample)
2.2 纤维材料组分分析
纤维材料是菠萝叶压榨后的另一产物,干燥后得率为初始鲜菠萝叶的12%(质量分数)。经测定,烘干后的纤维材料含有35%的纤维素、30%的半纤维素和7%的木质素(以干物质计)。该材料具有较高的燃烧热值20.1 kJ/g,接近原煤燃烧热值20.9 kJ/g,可替代化石资源用于热能发电。
2.3 有氧条件下酿酒酵母的生长
实验选取YPD及高糖YPD作为对照,考察菠萝叶汁作为种子培养基的可行性。如图2所示,酿酒酵母在菠萝叶汁中的整体生长趋势与YPD和高糖YPD无显著差异,接种后约3 h进入对数生长期,并持续至9 h。至发酵终点24 h时,3种培养基的OD值相近,菠萝叶汁中剩余总糖3.31 g/L无法被消耗,表明对数生长后期制约酿酒酵母生长的因素为非碳源因素。随着碳源物质的逐渐消耗,酿酒酵母数量逐渐增加,在酿酒酵母的生长过程中优先利用葡萄糖,再利用果糖,分别在9 h和12 h时葡萄糖和果糖消耗完全。实验结果与JOHNSTON等[16]报道结果一致,即酿酒酵母在生长阶段对于葡萄糖的吸收利用优于果糖。本实验结果表明,在无外源营养物质添加情况下,菠萝叶汁中营养成分可以保障酿酒酵母的正常生长增殖。
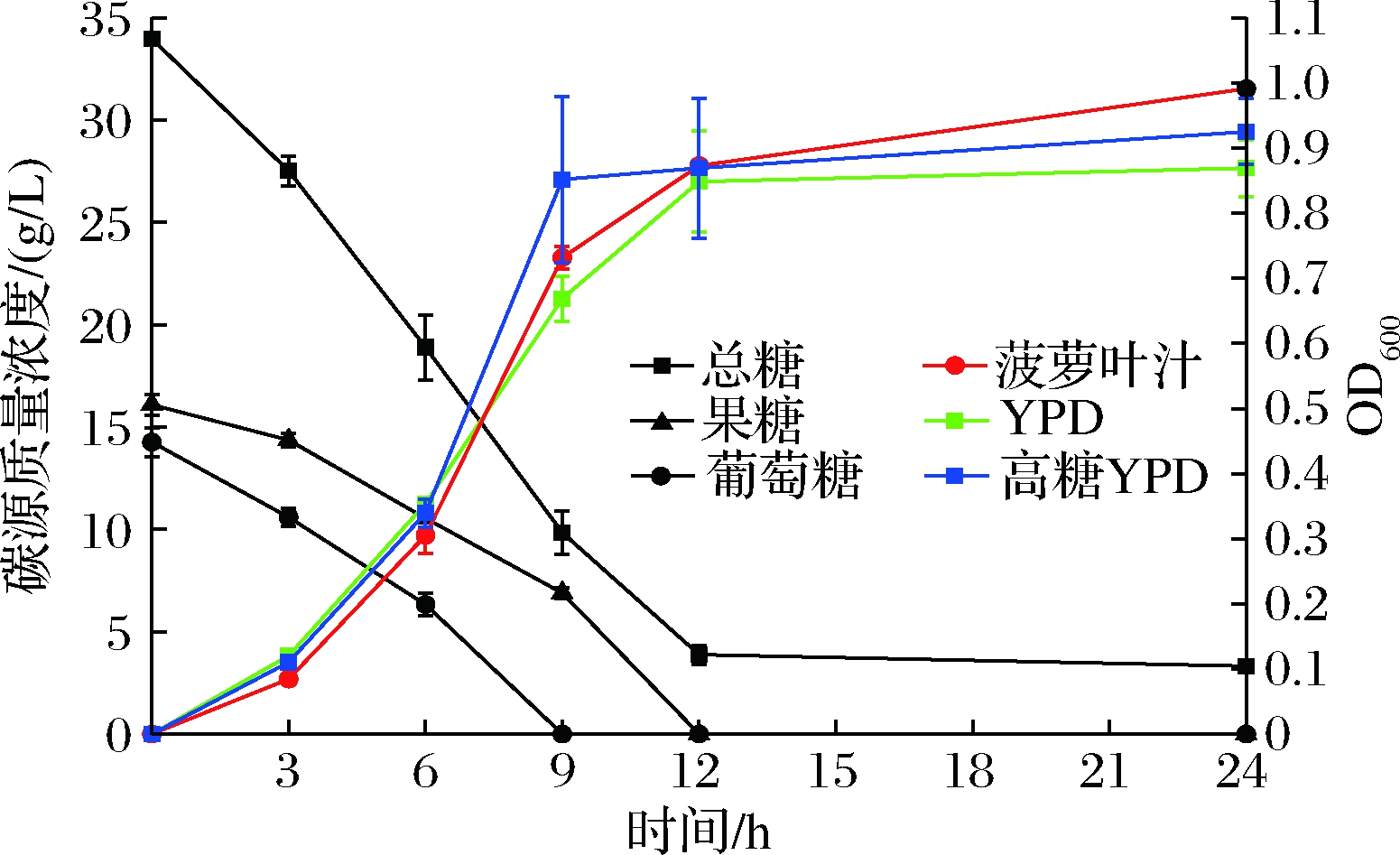
图2 有氧培养下菠萝叶汁碳源含量变化及酿酒酵母在不同培养基中生长情况
Fig.2 Carbon source content of pineapple leaf juice under aerobic culture and growth of S. cerevisiae in different media
2.4 酿酒酵母厌氧发酵生产乙醇过程优化
如图3所示,发酵温度、初始pH和接种量对酿酒酵母发酵菠萝叶汁产乙醇具有不同程度的影响。在发酵温度26~42 ℃的范围内,乙醇含量和糖醇转化率随着温度的提高先增后降(图3-a)。适宜的温度下,酿酒酵母才能发挥最大的发酵性能,过高的温度,抑制发酵性能的同时可能加速乙醇的挥发。在30 ℃时乙醇含量和糖醇转化率达到最高。

a-温度;b-初始pH;c-接种量
图3 温度、初始pH、接种量对于乙醇发酵的影响
Fig.3 Effects of temperature,initial pH,and inoculun size on ethanol fermentation
如图3-b所示,在初始pH为4.0~6.0范围内,乙醇含量和糖醇转化率随着pH的增加逐渐降低。在初始pH为4.0时,乙醇含量和糖醇转化率达到最高。初始pH增加至5.0后,乙醇含量和糖醇转化率变化不明显,较高的pH抑制了酿酒酵母利用菠萝叶汁中营养成分的活性。如图3-c所示,在接种量5%~15%(体积分数)的范围内,乙醇含量和糖醇转化率随着接种量的增加而先增后降,在接种量达到10%(体积分数)时,乙醇含量和糖醇转化率达到最高。接种量过小或过大均不利于乙醇发酵,接种量过小导致系统中酿酒酵母数量较少,延滞期增长,酿酒酵母发酵性能下降;接种量过大导致更多的碳源被用于酿酒酵母自身的生长,用于转化为乙醇的糖大大减少。试验结果表明,酿酒酵母利用菠萝叶汁发酵乙醇的适宜条件为温度30 ℃,初始pH 4.0,接种量10%(体积分数),此时乙醇含量和糖醇转化率达到最高,分别为12.88 g/L,0.42 g/g。
2.5 最优条件下酿酒酵母分批发酵菠萝叶汁产乙醇
如图4所示,在温度30 ℃、初始pH 4.0、接种量10%(体积分数)的条件下,酿酒酵母可以在不添加其他营养成分的菠萝叶汁中,有效利用其中的葡萄糖和果糖产出乙醇。在发酵阶段,酿酒酵母优先利用葡萄糖,葡萄糖和果糖分别在6和12 h消耗完全。菠萝叶汁中含有一定的复杂碳水化合物,无法被酵母菌利用,菠萝叶汁中总糖由33.97 g/L消耗至3.31 g/L。乙醇质量浓度达到最大为12.88 g/L,糖醇转化率为0.42 g/g。糖醇转化率略低于理论转化率,菌体的生长消耗一定的糖类物质,乙醇浓度的提高会加快酿酒酵母消耗葡萄糖,一定程度上抑制了发酵性能[17]。在发酵过程中,酿酒酵母利用菠萝叶汁的营养成分进行一定程度的生长增殖,菠萝叶汁中还可产生3.83 g/L的酿酒酵母干菌体。
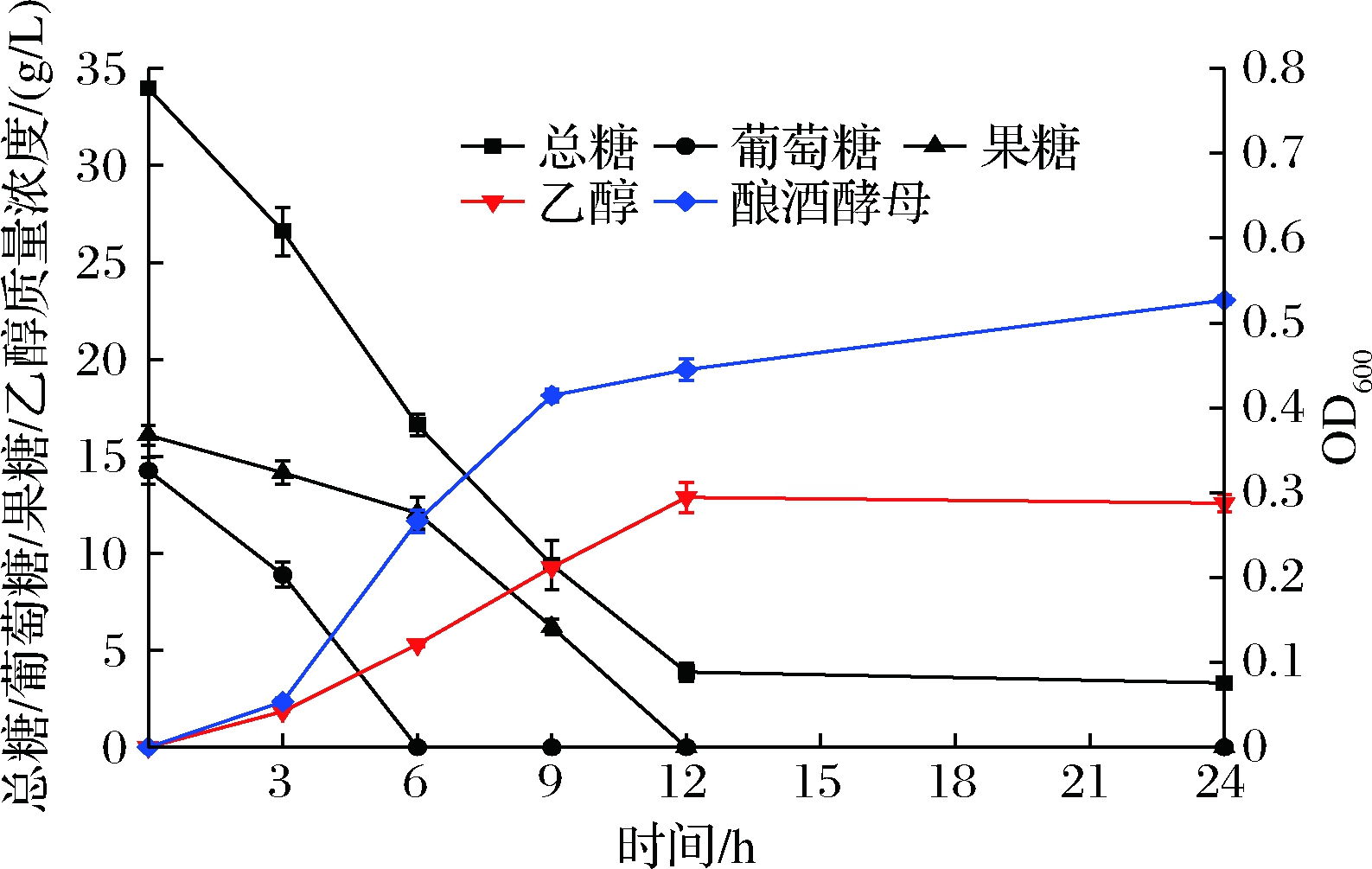
图4 厌氧发酵下菠萝叶汁中各组分变化情况
Fig.4 Changes of components in pineapple leaf juice under anaerobic fermentation
3 结论与讨论
由于含糖量高,菠萝叶采后堆积除占用大量农田外,还将滋生大量苍蝇,迫切需要新的方法将大量菠萝叶变废为宝,发展绿色菠萝种植业。本研究开发了一种简单、高效的菠萝叶转化生物乙醇、酵母蛋白质和纤维材料方法。新鲜菠萝叶通过机械压榨产生叶汁和纤维材料,得率可达0.75 t/t叶汁和0.12 t/t干纤维。叶汁接种酿酒酵母,厌氧发酵生产乙醇和酵母蛋白质,可收获12.88 g/L乙醇,3.83 g/L干酵母粉。依据上述实验结果,理论上我国每年可利用菠萝叶生产生物乙醇62 790 t,干酵母粉18 671 t,干纤维780 000 t。将传统的以处理为导向的研究初衷转变为以利用为导向,研究结果为菠萝叶高值化利用奠定了研究基础。
经文献调研[18-20]和市场调研,将菠萝叶乙醇与我国传统的玉米乙醇生产进行经济效益对比分析。3 t玉米产1 t乙醇,玉米单价按3 000元/t市场价格计,采用玉米发酵产生物乙醇的物料成本为9 000元/t乙醇。本研究中新鲜菠萝叶100 t产1 t乙醇,菠萝叶为农业废弃物,物料成本可忽略不计。采用菠萝叶生产生物乙醇,一方面可解决环境污染问题,另一方面不会造成“与人争粮”的粮食安全问题,具有长远的发展前景和潜力。
但相较于玉米乙醇,目前菠萝叶乙醇的产出效率较低。本试验仅从摇瓶培养阶段探究了乙醇生产情况,后续将重点研究高密度发酵过程控制,探究酿酒酵母对菠萝叶汁发酵生产生物乙醇的过程参数和动态调整规律,建立5~100 L连续发酵标准操作流程,提高乙醇转化率,推动菠萝叶乙醇工业化生产进程。对于原料的采集处理,一方面需要设计相应的大型收割机器和枝叶榨取机器,提高收集处理效率;另一方面需要政府相关政策的宣传和支持,提高当地种植户资源利用意识。以期菠萝叶高值化利用能够更好地促进菠萝业的绿色可持续发展。
[1] SHU H Y,SUN W,XU G Y,et al.The situation and challenges of pineapple industry in China[J].Agricultural Sciences,2019,10(5):683-688.
[2] 刘传和,贺涵,何秀古,等.我国菠萝品种结构与新品种自主选育推广[J].中国热带农业,2021(4):13-15;76.
LIU C H,HE H,HE X G,et al.Pineapple cultivar structure and extension of new independent breeding pineapple cultivars in China[J].China Tropical Agriculture,2021(4):13-15;76.
[3] 汪泽,崔丽虹,付调坤,等.菠萝叶的化学成分及生物活性研究进展[J].化工新型材料,2016,44(11):258-260.
WANG Z,CUI L H,FU T K,et al.Research progress in chemical component and biological activity of pineapple leaf[J].New Chemical Materials,2016,44(11):258-260.
[4] 何运燕,欧仕益.菠萝茎营养成分的测定[J].现代食品科技,2008,24(10):1061-1062;972.
HE Y Y,OU S Y.Determination of nutrients in pineapple peduncle[J].Modern Food Science and Technology,2008,24(10):1061-1062;972.
[5] SOMMA D,LOBKOWICZ H,DEASON J P.Growing America’s fuel:An analysis of corn and cellulosic ethanol feasibility in the United States[J].Clean Technologies and Environmental Policy,2010,12(4):373-380.
[6] WEINBERG Z G,KHANAL P,YILDIZ C,et al.Effects of stage of maturity at harvest,wilting and LAB inoculant on aerobic stability of wheat silages[J].Animal Feed Science and Technology,2010,158(1-2):29-35.
[7] KARP S G,MEDINA J D C,LETTI L A J,et al.Bioeconomy and biofuels:The case of sugarcane ethanol in Brazil[J].Biofuels,Bioproducts and Biorefining,2021,15(3):899-912.
[8] KEIL M,KLENK I,KUNZ M,et al.European bioethanol from grain and sugarbeet from an economic and ecological viewpoint (summary of Parts 1-3)[J].Zuckerindustrie Sugar Industry,2009,134(2):127-130.
[9] 蔡柳,曾璐,张婷婷,等.薯类原料生物转化燃料乙醇研究进展[J].中国酿造,2011,30(3):1-5.
CAI L,ZENG L,ZHANG T T,et al.Review on fuel ethanol production from tuber crop[J].China Brewing,2011,30(3):1-5.
[10] 马欢,刘伟伟,张无敌,等.燃料乙醇的研究进展及存在问题[J].能源工程,2006(2):29-33.
MA H,LIU W W,ZHANG W D,et al.Present situation and existing problem of fuel alcohol[J].Energy Engineering,2006(2):29-33.
[11] 王秀奇.基础生物化学实验[M].2版.北京:高等教育出版社,1999.
WANG X Q.Basic Biochemistry experiment edition[M].2nd ed.Beijing:Higher Education Press,1999.
[12] 吴丽荣,陈肇娜,苏丽婷,等.DB-WAX毛细管柱气相色谱法检查藿香正气水中乙醇量[J].化学与粘合,2020,42(2):150-152.
WU L R,CHEN Z N,SU L T,et al.The determination of ethanol amount in huoxiangzhengqi liquid by gas chromatographic method(GC) with DB-WAX capillary column[J].Chemistry and Adhesion,2020,42(2):150-152.
[13] SLUITER A,HAMES B,RUIZ R,et al.Determination of Structural Carbohydrates and Lignin in Biomass Laboratory Analytical Procedure (LAP)[EB/OL](2008-04-25)[2022-05-16] https://www.nrel.gov/docs/gen/fy13/42618.pdf.
[14] 陶庭先.工科化学实验[M].北京:化学工业出版社,2015.
TAO T X.Engineering Chemistry Experiment[M].Beijing:Chemical Industry Press,2015.
[15] CHEN A N,GUAN Y J,BUSTAMANTE M,et al.Production of renewable fuel and value-added bioproducts using pineapple leaves in Costa Rica[J].Biomass and Bioenergy,2020,141:105675.
[16] JOHNSTON J H,BARFORD J P.Continuous growth of Saccharomyces cerevisiae on a mixture of glucose and fructose[J].The Journal of General and Applied Microbiology,1991,37(2):133-140.
[17] BERTHELS N J,CORDERO OTERO R R,BAUER F F,et al.Correlation between glucose/fructose discrepancy and hexokinase kinetic properties in different Saccharomyces cerevisiae wine yeast strains[J].Applied Microbiology and Biotechnology,2008,77(5):1083-1091.
[18] CRAGO C L,KHANNA M,BARTON J,et al.Competitiveness of Brazilian sugarcane ethanol compared to US corn ethanol[J].Energy Policy,2010,38(11):7404-7415.
[19] 杨铮.我国乙醇产业发展概述[J].化学工业,2021,39(4):44-48;75.
YANG Z.A review of ethanol industry in China[J].Chemical Industry,2021,39(4):44-48;75.
[20] 郭孝孝,武国庆.玉米燃料乙醇技术进展[J].生物产业技术,2017(1):95-99.
GUO X X,WU G Q.Technology progress of global fuel ethanol industry[J].Biotechnology &Business,2017(1):95-99.