吲哚美辛(indomethacin,IDM)和阿西美辛(acemetacin,ACM),均为非甾体抗炎药,临床上主要用于风湿性关节炎、类风湿性关节炎、术后疼痛等疾病的治疗[1-2]。阿西美辛为吲哚美辛的羧甲基酯衍生物,口服后的阿西美辛能迅速被机体吸收并经肝脏生物转化为吲哚美辛;在临床和实验室研究中,阿西美辛的抗炎作用与吲哚美辛相当,研究者普遍认为这至少部分归因于阿西美辛在体内生物转化为吲哚美辛;相对吲哚美辛,阿西美辛的胃耐受性更好,其具体机理尚无定论[3-6]。
我国食品安全法明确规定,保健食品为食品,不可以添加化学药物。但个别不法分子面对市场诱惑,为使抗风湿类保健食品的功效显著,向其中非法添加吲哚美辛的现象时有发生[7-9]。田甜等[7]采用高效液相色谱-串联质谱法对抗风湿类食品及保健食品中11种抗风湿类化学药物的非法添加进行测定,82%的样品检出抗风湿类药物,非法添加了吲哚美辛、地塞米松、双氯芬酸钠或布洛芬;赵琪等[8]采用超高效液相色谱-二极管阵列检测器法检测抗风湿保健食品及中成药中非法添加的19个化学物质,吲哚美辛的检出率为30%,检出量为1.4~1.7 mg/g。由于保健食品中非法添加的化学药物成分不明,不良反应不明,剂量无法得到控制,消费者在不知情的情况下长期服用,会对身体健康带来不可预知的严重危害。
目前,抗风湿类保健食品中抗风湿类化学药物的非法添加检测研究,对吲哚美辛的关注度较高,阿西美辛尚未引起关注。针对保健食品中吲哚美辛非法添加的检测方法主要有高效液相色谱法[8,10]和液相色谱-质谱联用法[7,11],具有准确、灵敏、精确度好等优点,但存在设备昂贵、样品前处理复杂、操作技术要求高等缺点,难以满足现场及大批量样品的检测需求。免疫分析法具有灵敏、快速、经济等优点,作为仪器检测方法的有益补充,是食品安全保障的重要支撑[12-13]。目前,国内外关于吲哚美辛免疫检测方法的研究报道仅有寥寥数篇,主要针对环境水样中的残留检测,尚未有关于保健食品中吲哚美辛的免疫检测方法的报道[14-16]。近年来保健食品中非法添加的化学药物开始逐步呈现新态势,出现了添加具有相似功效的前体药物、结构改造物或衍生物以规避检查的现象[7,17]。阿西美辛为吲哚美辛的羧甲基酯衍生物,两者均具有抗炎镇痛作用,而且阿西美辛便宜易得,可能会成为不法分子非法添加的备选药物,单独或与吲哚美辛同时被添加到抗风湿类保健食品中。鉴于此,建立保健食品中吲哚美辛和阿西美辛同时检测的免疫检测方法很有必要。
本研究以吲哚美辛和阿西美辛作为半抗原,通过人工抗原的制备和动物免疫,筛选获得了可同时识别吲哚美辛和阿西美辛的兔多克隆抗体,建立了可同时检测两者的间接竞争酶联免疫吸附检测(indirect competitive enzyme-linked immunosorbent assay,ic-ELISA)法,并用于抗风湿类保健食品中非法添加吲哚美辛和阿西美辛的检测,检测结果用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法确证。
1 材料与方法
1.1 材料与试剂
吲哚美辛(99%),天津希恩思生化科技有限公司;阿西美辛(98%),上海安耐吉化学有限公司;甲醇(色谱纯)、甲酸(色谱纯),上海阿拉丁生化科技股份有限公司;3,3′,5,5′-四甲基联苯胺,上海源叶生物科技有限公司;辣根过氧化物酶标记的羊抗兔IgG抗体,美国Earthox公司;牛血清白蛋白(bovine serum albumin,BSA),>98%、卵清白蛋白(ovalbumin,OVA),>98%,上海昂一生物科技有限公司;弗氏完全和不完全佐剂,美国sigma公司;96孔微孔板,厦门怡佳美实验器材有限公司;针筒式有机过滤器(0.22 μm),天津市津腾实验设备有限公司;其他试剂均为分析纯;实验用水为超纯水。无特定病原体雌性纯种新西兰大白兔购于广东省医学实验动物中心。保健食品购于国内互联网商店。
1.2 仪器与设备
LCMS-8050超高效液相色谱串联三重四级杆质谱仪,日本岛津公司;SP-Max 2300A2光吸收型全波长酶标仪,上海闪谱生物科技有限公司;TOM-3PW自动洗板机,上海托莫斯科学仪器有限公司;Neofuge 13R高速冷冻离心机,上海力申科学仪器有限公司;UNIQUE-R20实验室多功能纯水系统,锐思捷科学仪器有限公司。
1.3 实验方法
1.3.1 人工抗原的合成与鉴定
采用活泼酯法[18],将吲哚美辛和阿西美辛分别与BSA和OVA偶联,制备免疫原IDM-BSA、ACM-BSA和包被原IDM-OVA、ACM-OVA(图1)。人工抗原采用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MADLI-TOF/MS)法[19]判定是否偶联成功并计算偶联比。
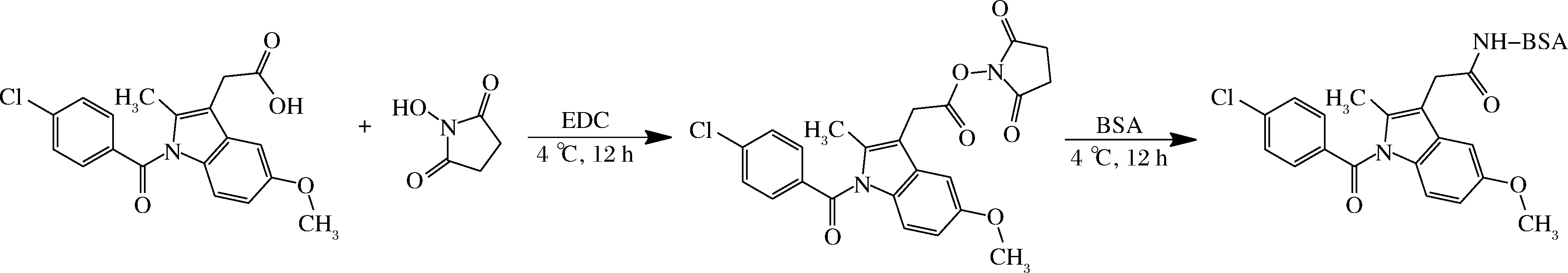
图1 人工抗原合成技术路线图(IDM-BSA为例)
Fig.1 Scheme for preparation of artificial antigen (take IDM-BSA as an example)
1.3.2 动物免疫与抗体特性评价
按照文献[20]的免疫方案,将制备的免疫原分别免疫2只2.5 kg雌性新西兰大白兔。第4次免疫1周后采集抗血清,-20 ℃下保存备用。根据文献[21]所述的ic-ELISA试验的操作步骤,测定并计算不同包被模式下,抗血清的效价和抑制率,计算如公式(1)所示:
抑制率![]()
(1)
1.3.3 ic-ELISA法的建立
根据文献[22]的步骤,通过棋盘滴定法确定最佳包被原浓度及抗体稀释倍数;通过单因素试验,确定最佳反应体系、缓冲液pH值、缓冲液离子浓度、二抗稀释倍数和二抗反应时间。以目标分析物浓度的对数值为横坐标,吸光值A450nm为纵坐标,绘制抑制曲线,计算曲线的最大吸光值Amax、半抑制浓度IC50及两者比值Amax/IC50。选取Amax较大、IC50较小、Amax/IC50较大且曲线拟合度好的反应条件作为最佳工作条件。
1.3.4 样品检测
固体样品(片剂、硬胶囊)取10次服用剂量用研钵研磨后,过30目筛;液体样品(软胶囊)取10次服用剂量的内容物混匀。准确称取1次服用剂量的样品于50 mL容量瓶中,加入40 mL甲醇超声提取20 min,冷却后甲醇定容,过0.22 μm有机相滤膜,得提取液。用磷酸盐缓冲液(phosphate buffered saline,PBS,pH 6.4,5 mmol/L)或甲醇稀释后分别用于ic-ELISA法和LC-MS/MS法测定。
1.3.5 LC-MS/MS法确证
色谱条件:流动相A为乙腈、B为0.1%甲酸水溶液;柱温40 ℃;进样量5 μL;流速0.3 mL/min。梯度洗脱程序:0~1 min,30%~30% B;1~1.5 min,30%~70% B;1.5~4 min,70%~70% B;4~4.5 min,70%~30% B;4.5~5 min,30%~30% B。
质谱条件:电喷雾离子源正离子模式;雾化气流量3 L/min;加热气流量10 L/min;干燥气流量10 L/min;加热块温度400 ℃;接口电压4.0 KV;接口温度300 ℃;DL温度250 ℃;多反应选择监测模式(multiple reaction monitoring,MRM)。主要质谱参数见表1。
表1 吲哚美辛和阿西美辛主要质谱参数
Table 1 MS/MS parameters of IDM and ACM

化合物保留时间/min母离子(m/z)子离子(m/z)碰撞电压/eV吲哚美辛2.72358139.05∗/111.05/174.219/49/12阿西美辛3.05416139∗/111.1/312.222/49/14
注:*定量离子。
2 结果与分析
2.1 人工抗原合成与鉴定
鉴于吲哚美辛和阿西美辛分子结构中含有活性羧基,实验直接选择2种待测物作为半抗原,与载体蛋白偶联制备人工抗原。采用MADLI-TOF/MS法测定载体蛋白和人工抗原的分子质量(图2)。BSA、OVA、IDM-BSA、IDM-OVA、ACM-BSA、ACM-OVA的相对分子质量分别为66 433、44 411、68 168、44 944、68 224、45 052。人工抗原的相对分子质量大于载体蛋白,说明偶联成功。BSA与吲哚美辛通过酰胺键连接,BSA上偶联1个吲哚美辛分子,相对分子质量增加339.07,计算得IDM-BSA的偶联比为5.1。同理得IDM-OVA、ACM-BSA和ACM-OVA的偶联比分别为1.6、4.5和1.6。
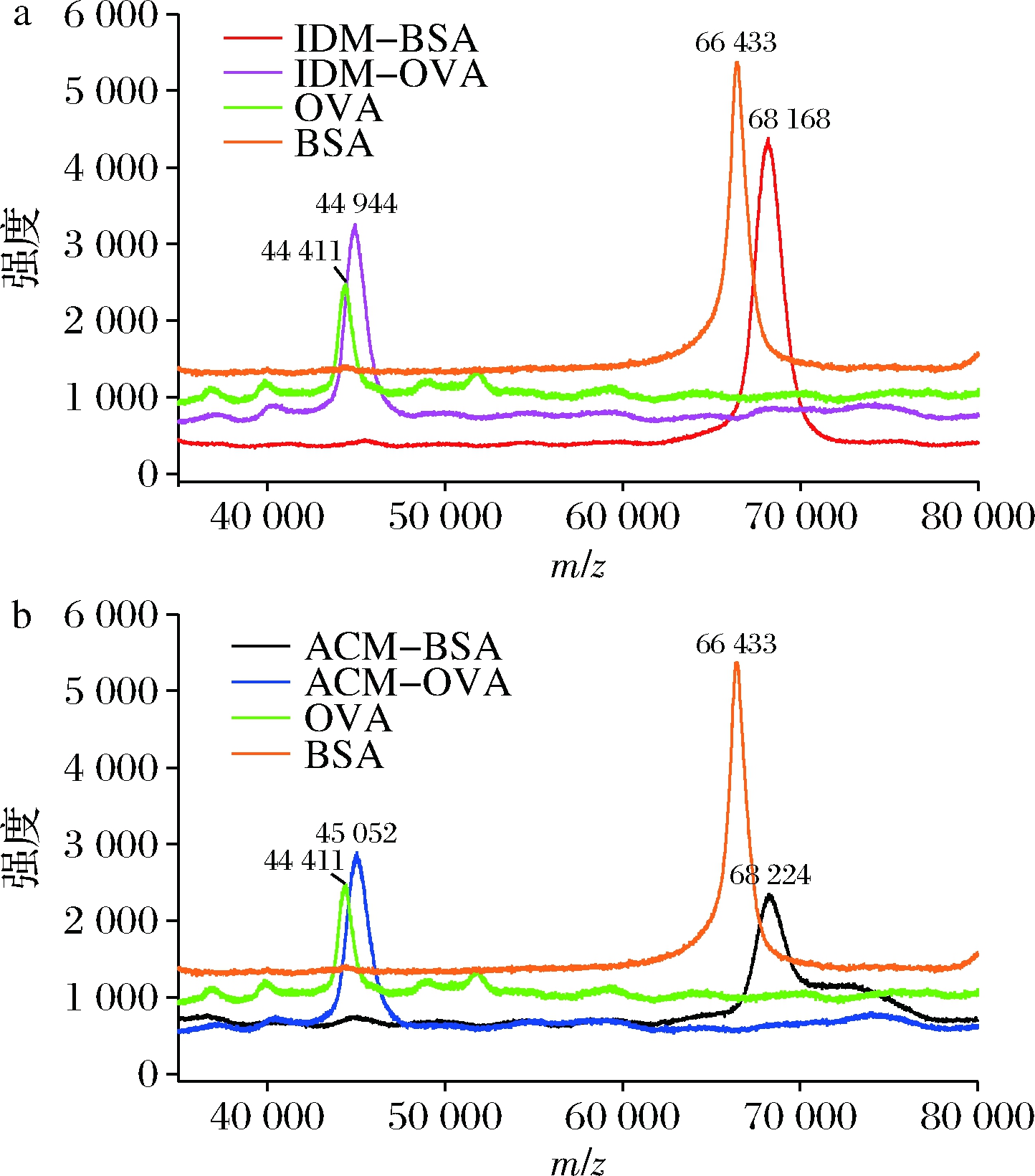
a-IDM-BSA和IDM-OVA;b-ACM-BSA和ACM-OVA
图2 人工抗原质谱图
Fig.2 Mass spectrogram of artificial antigens
2.2 抗体特性评价
以IDM-BSA、ACM-BSA作为免疫原免疫兔子获得的抗血清分别记作PAb-IDM和PAb-ACM。实验测定了不同包被模式下,抗血清的效价和抑制率(表2),其中包被原质量浓度和待测物质量浓度均为1 μg/mL。
表2 不同包被模式下抗体效价和抑制率测定结果
Table 2 Evaluation of antiserum binding ability to free IDM and ACM under homologous and heterologous coating format
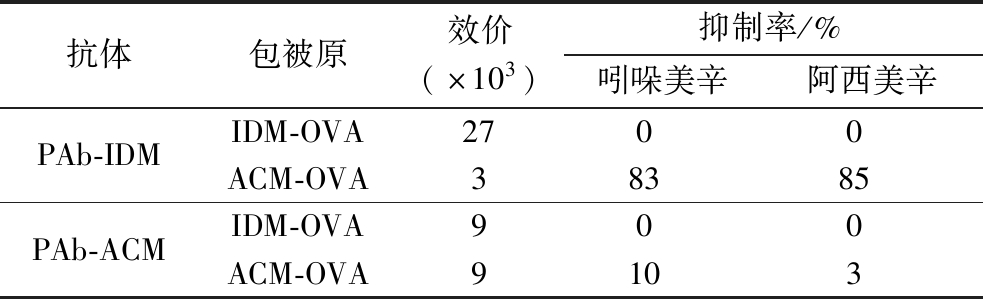
抗体包被原效价(×103)抑制率/%吲哚美辛阿西美辛PAb-IDMIDM-OVA2700ACM-OVA38385PAb-ACMIDM-OVA900ACM-OVA9103
在同源及异源包被模式下,抗血清PAb-ACM的效价均为9 000,但都无法识别游离的吲哚美辛和阿西美辛(抑制率不超过10%)。在同源包被模式下,抗血清PAb-IDM呈现了高效价(27 000),但同样无法识别游离的吲哚美辛和阿西美辛;而在异源包被模式下,其效价为3 000,对游离吲哚美辛呈现了较好的亲和力(抑制率达83%),对游离阿西美辛也呈现了较好的异源亲和、识别能力(抑制率达85%)。后续实验以抗血清PAb-IDM、包被原ACM-OVA建立ic-ELISA法。
2.3 ic-ELISA法的建立
最佳工作条件为包被质量浓度1.25 μg/mL,抗血清稀释倍数1∶9 000,缓冲体系PBS(pH 6.4,5 mmol/L),二抗稀释3 000倍,竞争反应时间40 min,二抗反应时间20 min。在最佳条件下建立吲哚美辛和阿西美辛的标准曲线(图3)。方法对吲哚美辛的检出限IC10为0.3 ng/mL,IC50为5.6 ng/mL,线性范围IC20~IC80为0.9~32.9 ng/mL;对阿西美辛的检出限IC10为1.1 ng/mL,IC50为7.4 ng/mL,线性范围IC20~IC80为2.2~24.3 ng/mL。
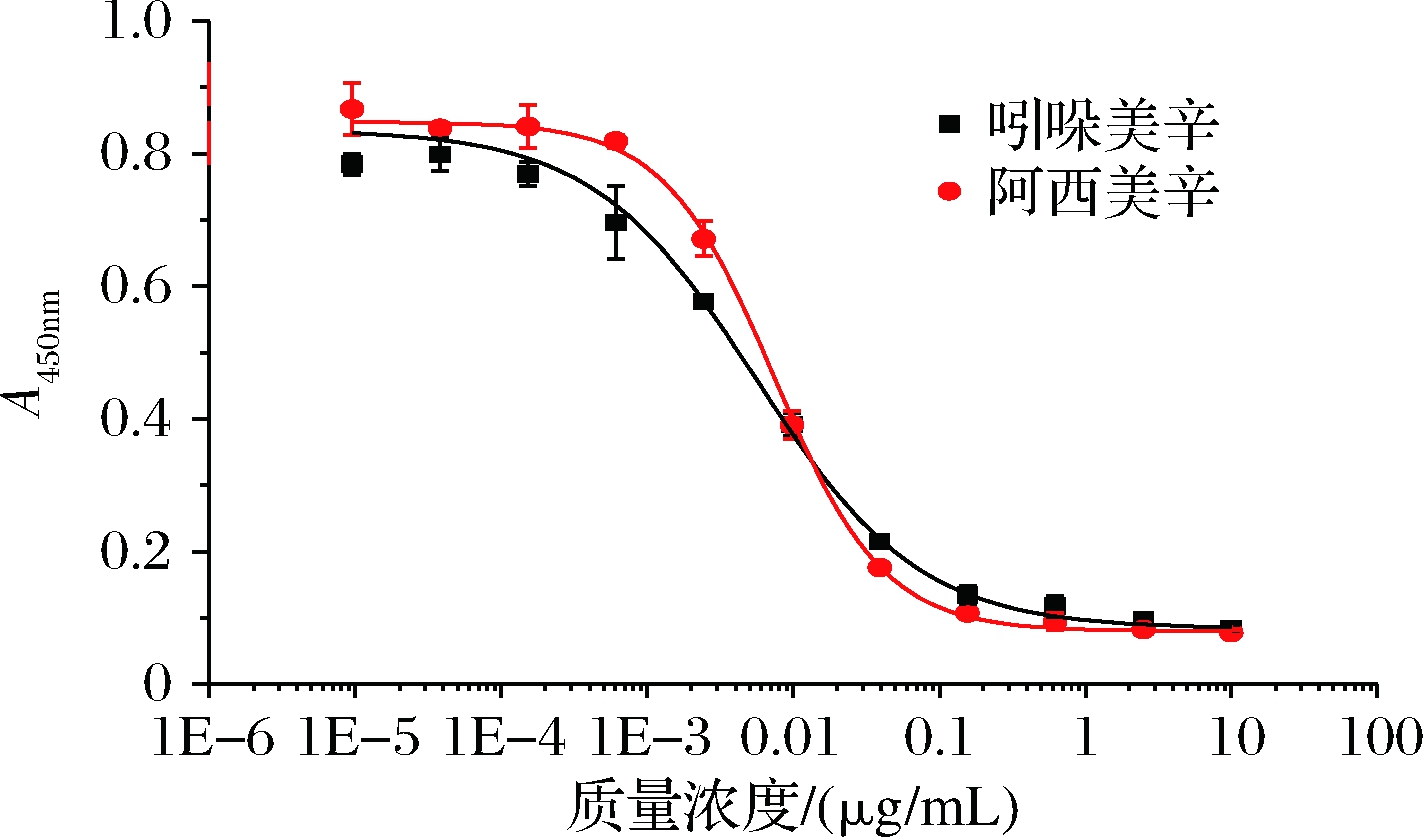
图3 ic-ELISA法检测吲哚美辛和阿西美辛的标准曲线
Fig.3 Standard curves for indirect competitive enzyme-linked immunosorbent assay (ic-ELISA) analysis of IDM and ACM
2.4 方法特异性评价
以交叉反应率(cross-reaction ratio,CR)评价方法的特异性,CR越小,方法的特异性越强。选取与吲哚美辛和阿西美辛同为非甾体抗炎药的结构类似物作为竞争药物,进行ic-ELISA试验,根据公式(2)计算CR。
(2)
式中:IC50(IDM),竞争物为吲哚美辛时的半抑制质量浓度;IC50(交叉反应物),竞争物为交叉反应物时的半抑制质量浓度。
如表3所示,方法与布洛芬、卡洛芬、萘普生、芬布芬、双氯芬酸钠、吡罗昔康、奥沙普秦和美洛昔康8种结构类似物均不存在交叉反应(CR<0.1%),说明实验建立的ic-ELISA法对吲哚美辛和阿西美辛具有良好特异性。
表3 ic-ELISA法对吲哚美辛和阿西美辛及其结构类似物的交叉反应率
Table 3 Cross-reactivity (CR) of IDM,ACM and its analogs by ic-ELISA method
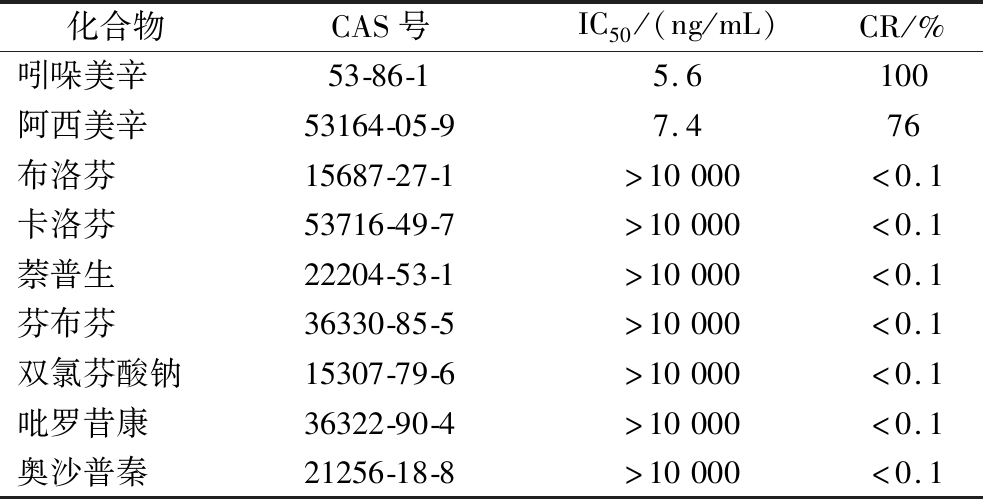
化合物CAS号IC50/(ng/mL)CR/%吲哚美辛53-86-15.6100阿西美辛53164-05-97.476布洛芬15687-27-1>10000<0.1卡洛芬53716-49-7>10000<0.1萘普生22204-53-1>10000<0.1芬布芬36330-85-5>10000<0.1双氯芬酸钠15307-79-6>10000<0.1吡罗昔康36322-90-4>10000<0.1奥沙普秦21256-18-8>10000<0.1
2.5 基质效应的消除
消除基质效应是建立定量分析方法的重要步骤,直接影响到方法的准确性。由于药物要达到一定剂量之后,才能有效发挥药效,故保健食品中的化学药物添加量一般较大。目前文献报道的保健食品和中成药中吲哚美辛的检出量为1.4~118.2 mg/g[7-11]。本实验建立的ic-ELISA法,对吲哚美辛、阿西美辛的IC50分别为5.6、7.4 ng/mL,灵敏度远远高于其在保健食品中的实际含量水平,故实验尝试采用PBS对样品提取液进行一定程度稀释以消除其基质效应。目前市面上销售的抗风湿类保健食品主要有片剂、硬胶囊和软胶囊3种剂型,鉴于不同剂型的辅料一般差别较大,实验同时考察了上述3种剂型的基质消除情况。将样品提取液用PBS稀释100倍后作为标准品稀释液绘制抑制曲线,其曲线与标准曲线基本重合(图4),基本不存在基质效应。故实验将样品提取液用PBS稀释至少100倍后用于ic-ELISA测定。

a-片剂;b-硬胶囊;c-软胶囊
图4 基质抑制曲线和标准曲线的比较
Fig.4 Analysis of matrix effect by diluting the sample extract solution with PBS buffer
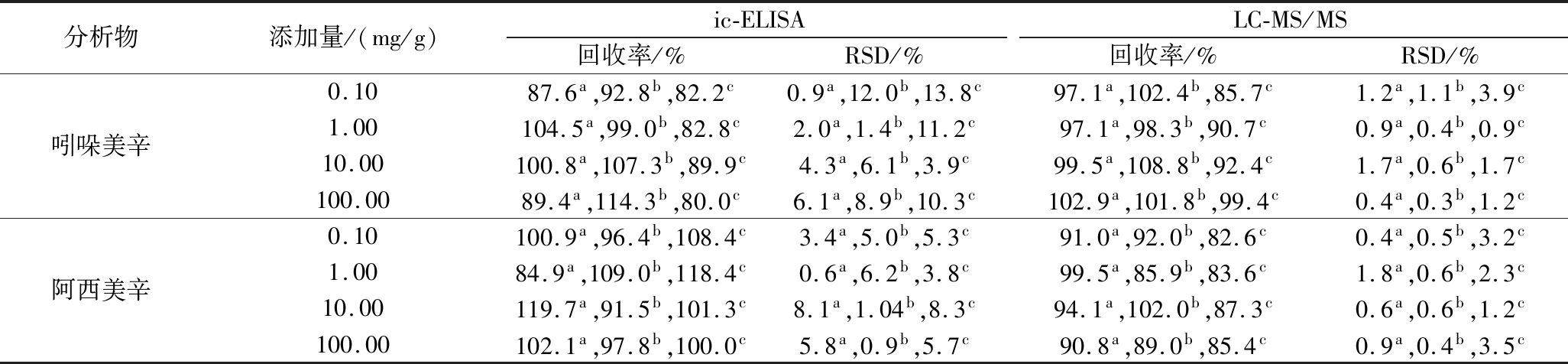
2.6 添加回收率的测定
以信噪比(S/N)为3计算,LC-MS/MS法对吲哚美辛、阿西美辛的检出限均为0.01 ng/mL,在1~50 ng/mL内,呈线性关系。控制加标浓度与样品中待测物的浓度接近,添加回收试验设置为0.1、1、10、100 mg/g 4个浓度水平。片剂、硬胶囊和软胶囊3种剂型的抗风湿类保健食品的添加回收率见表4,ic-ELISA法对吲哚美辛和阿西美辛的平均回收率分别为80.0%~114.3%和84.9%~119.7%,相对标准偏差(relative standard deviation,RSD)低于15%;LC-MS/MS法的平均回收率分别为85.7%~108.8%和82.6%~102.0%,RSD低于5%。2种检测方法对吲哚美辛和阿西美辛检测结果的相关系数r分别为0.993和0.992(图5),说明建立的ic-ELISA法准确可靠。
表4 ic-ELISA法和LC-MS/MS法对吲哚美辛和阿西美辛的样品添加回收率比对(n=3)
Table 4 Comparison of recoveries of IDM and ACM in spiked samples determined by ic-ELISA and LC-MS /MS (n=3)
分析物添加量/(mg/g)ic-ELISALC-MS/MS回收率/%RSD/%回收率/%RSD/%吲哚美辛0.1087.6a,92.8b,82.2c0.9a,12.0b,13.8c97.1a,102.4b,85.7c1.2a,1.1b,3.9c1.00104.5a,99.0b,82.8c2.0a,1.4b,11.2c97.1a,98.3b,90.7c0.9a,0.4b,0.9c10.00100.8a,107.3b,89.9c4.3a,6.1b,3.9c99.5a,108.8b,92.4c1.7a,0.6b,1.7c100.0089.4a,114.3b,80.0c6.1a,8.9b,10.3c102.9a,101.8b,99.4c0.4a,0.3b,1.2c阿西美辛0.10100.9a,96.4b,108.4c3.4a,5.0b,5.3c91.0a,92.0b,82.6c0.4a,0.5b,3.2c1.0084.9a,109.0b,118.4c0.6a,6.2b,3.8c99.5a,85.9b,83.6c1.8a,0.6b,2.3c10.00119.7a,91.5b,101.3c8.1a,1.04b,8.3c94.1a,102.0b,87.3c0.6a,0.6b,1.2c100.00102.1a,97.8b,100.0c5.8a,0.9b,5.7c90.8a,89.0b,85.4c0.9a,0.4b,3.5c
注:a,片剂;b,硬胶囊;c,软胶囊。
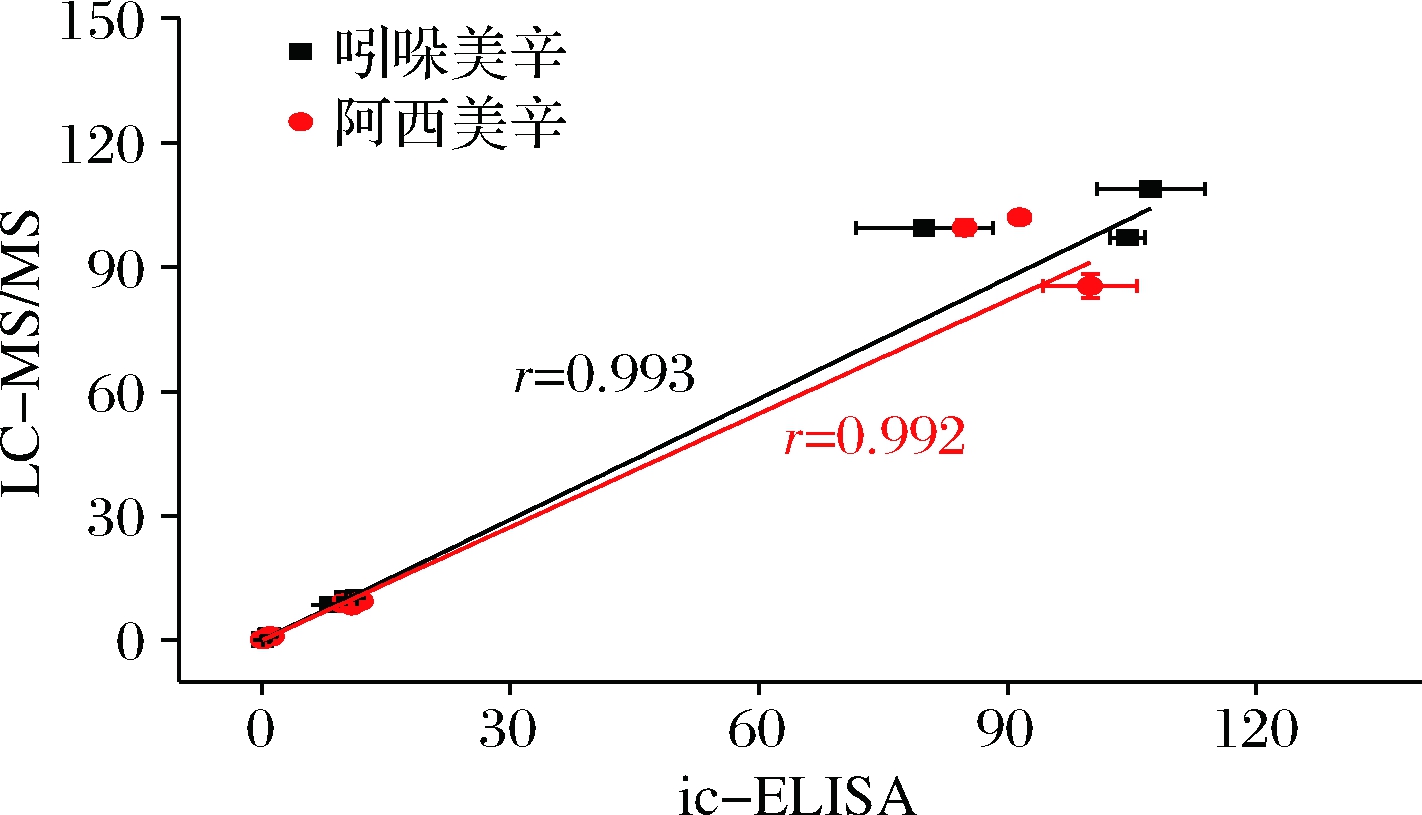
图5 ic-ELISA法和LC-MS/MS法测定结果相关性曲线
Fig.5 Correlation of LC-MS/MS results with ic-ELISA results
2.7 盲样检测
对市售10份不同剂型(3份片剂、4份硬胶囊和3份软胶囊)的抗风湿类保健食品,同时采用ic-ELISA法和LC-MS/MS法进行检测,均未检出吲哚美辛和阿西美辛。
3 结论
本研究制备了可同时识别吲哚美辛和阿西美辛的兔多克隆抗体,并建立了可同时检测两者的ic-ELISA法,对吲哚美辛和阿西美辛的检出限分别为0.3、1.1 ng/mL。抗风湿类保健食品经甲醇提取,用标准稀释液稀释法即用PBS稀释100倍消除基质效应,2种待测物的添加回收率均在80%~120%,RSD低于15%,检测结果与LC-MS/MS法结果一致性良好。本研究建立的ic-ELISA法可满足抗风湿类保健食品中吲哚美辛和阿西美辛定量检测的需求,快速、经济、前处理简单、高通量,为保健食品安全监管提供了方法选择。
[1] MOAAZ E M,ABDEL-MOETY E M,REZK M R,et al.Eco-friendly chromatographic methods for determination of acemetacin and indomethacin;greenness profile assessment[J].Journal of AOAC INTERNATIONAL,2021,104(6):1485-1491.
[2] 张家鑫,胡立冬,冀肖健,等.阿西美辛治疗强直性脊柱炎在真实世界研究中的疗效和安全性评价[J].解放军医学院学报,2022,43(3)259-263;276.
ZHANG J X,HU L D,JI X J,et al.Effectiveness and safety of Acemetacin in treatment of ankylosing spondylitis:A real-world study[J].Academic Journal of Chinese Pla Medical School,2022,43(3):259-263;276.
[3] CH VEZ-PI
VEZ-PI A A E,VONG L,MCKNIGHT W,et al.Lack of effects of acemetacin on signalling pathways for leukocyte adherence may explain its gastrointestinal safety[J].British Journal of Pharmacology,2008,155(6):857-864.
A A E,VONG L,MCKNIGHT W,et al.Lack of effects of acemetacin on signalling pathways for leukocyte adherence may explain its gastrointestinal safety[J].British Journal of Pharmacology,2008,155(6):857-864.
[4] CH VEZ-PI
VEZ-PI A A E,MCKNIGHT W,DICAY M,et al.Mechanisms underlying the anti-inflammatory activity and gastric safety of acemetacin[J].British Journal of Pharmacology,2007,152(6):930-938.
A A E,MCKNIGHT W,DICAY M,et al.Mechanisms underlying the anti-inflammatory activity and gastric safety of acemetacin[J].British Journal of Pharmacology,2007,152(6):930-938.
[5] CH VEZ-PI
VEZ-PI A A E,FAVARI L,CASTA
A A E,FAVARI L,CASTA EDA-HERN
EDA-HERN NDEZ G.Pharmacokinetics of acemetacin and its active metabolite indomethacin in rats during acute hepatic damage and liver regeneration[J].Annals of Hepatology,2009,8(2):141-147.
NDEZ G.Pharmacokinetics of acemetacin and its active metabolite indomethacin in rats during acute hepatic damage and liver regeneration[J].Annals of Hepatology,2009,8(2):141-147.
[6] WADA Y,NAKAMURA M,KOGO H,et al.Inhibitory effect of acemetacin,a prodrug of indomethacin,on prostaglandin E2 release from inflamed synovial tissue[J].Japanese Journal of Pharmacology,1984,34(4):468-470.
[7] 田甜,覃艳淑,赵德恩,等.食品和保健食品中非法添加药物的筛查探究[J].食品安全质量检测学报,2021,12(3):1200-1208.
TIAN T,QIN Y S,ZHAO D E,et al.Research of screening of illegal added drugs in food and health food[J].Journal of Food Safety &Quality,2021,12(3):1200-1208.
[8] 赵琪,钱叶飞,贾昌平,等.UPLC-DAD快速筛查抗风湿类保健食品及中成药中非法添加的19个化学物质[J].药物分析杂志,2019,39(12):2171-2177.
ZHAO Q,QIAN Y F,JIA C P,et al.Rapid determination of illegally added chemical drugs in anti-rheumatic Chinese traditional patent medicine and health foods by UPLC-DAD[J].Chinese Journal of Pharmaceutical Analysis,2019,39(12):2171-2177.
[9] 魏志雄,刘丹丹,蓝明雄,等.抗风湿镇痛类健康产品中吲哚美辛的快速筛查方法[J].中国当代医药,2022,29(4):41-44.
WEI Z X,LIU D D,LAN M X,et al.Detection of Indometacin in antirheumatic pain relieving health products by rapid screening method[J].China Modern Medicine,2022,29(4):41-44.
[10] 何睿偲,黄艳婷,雷毅,等.HPLC法快速筛查抗风湿类中成药或保健食品中21种非法添加化学成分[J].分析测试学报,2016,35(11):1486-1490.
HE R S,HUANG Y T,LEI Y,et al.Rapid determination of 21 adulterants in anti-rheumatic Chinese patent drugs or dietary supplements by HPLC[J].Journal of Instrumental Analysis,2016,35(11):1486-1490.
[11] 陈晓颙,涂奇军,覃桂,等.超高效液相色谱-四级杆-飞行时间串联质谱法测定中药及保健食品中17种非法添加的解热镇痛及止咳类药物[J].中国药师,2021,24(10):1938-1941.
CHEN X Y,TU Q J,QIN G,et al.Rapid determination of 17 anti-inflammatory,analgesic and antitussive chemicals illegally added to herbal products and dietary supplements by ultra-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry[J].Transactions of Nonferrous Metals Society of China,2021,24(10):1938-1941.
[12] 张开惠,刘源,崔艳,等.广谱性抗体的制备及其在食品安全快速检测中的应用进展[J].食品与发酵工业,2022,48(22):311-318.
ZHANG K H,LIU Y,CUI Y,et al.The preparation of broad-spectrum antibodies and their application in the rapid detection of food safety[J].Food and Fermentation Industries,2022,48(22):311-318.
[13] VILLA C,MOURA M B M V,COSTA J,et al.β-Lactoglobulin versus casein indirect ELISA for the detection of cow’s milk allergens in raw and processed model meat products[J].Food Control,2022,135:108818.
[14] HUO S M,YANG H,DENG A P.Development and validation of a highly sensitive ELISA for the determination of pharmaceutical indomethacin in water samples[J].Talanta,2007,73(2):380-386.
[15] LI D W,WEI S,YANG H,et al.A sensitive immunochromatographic assay using colloidal gold-antibody probe for rapid detection of pharmaceutical indomethacin in water samples[J].Biosensors and Bioelectronics,2009,24(7):2277-2280.
[16] 宋炎博,赵贵山,汝晓飞,等.吲哚美辛人工抗原及其多克隆抗体的制备[J].畜牧与兽医,2019,51(10):44-48.
SONG Y B,ZHAO G S,RU X F,et al.Preparation of artificial antigen and polyclonal antibody of indomethacin[J].Animal Husbandry &Veterinary Medicine,2019,51(10):44-48.
[17] 赫文龙,宫国强,刘斌,等.常用保健食品中可能的非法添加物质分析[J].食品安全质量检测学报,2019,10(6):1438-1444.
HE W L,GONG G Q,LIU B,et al.Analysis of possible illegal substances in common health foods[J].Journal of Food Safety &Quality,2019,10(6):1438-1444.
[18] XU Z L,SHEN Y D,SUN Y M,et al.Novel hapten synthesis for antibody production and development of an enzyme-linked immunosorbent assay for determination of furaltadone metabolite 3-amino-5-morpholinomethyl-2-oxazolidinone (AMOZ)[J].Talanta,2013,103:306-313.
[19] 李树莹,唐云飞,盛建武,等.恩诺沙星完全抗原的合成及间接竞争ELISA方法的建立[J].环境科学学报,2017,37(8):2904-2910.
LI S Y,TANG Y F,SHENG J W,et al.Preparation of complete antigen and development of an indirect competitive ELISA for the detection of enrofloxacin in water samples[J].Acta Scientiae Circumstantiae,2017,37(8):2904-2910.
[20] WU J,SHEN Y D,LEI H T,et al.Hapten synthesis and development of a competitive indirect enzyme-linked immunosorbent assay for acrylamide in food samples[J].Journal of Agricultural and Food Chemistry,2014,62(29):7078-7084.
[21] LIN L,SONG S S,WU X L,et al.A colloidal gold immunochromatography test strip based on a monoclonal antibody for the rapid detection of triadimefon and triadimenol in foods[J].Food and Agricultural Immunology,2020,31(1):475-488.
[22] BARTOSH A V,URUSOV A E,PETRAKOVA A V,et al.Highly sensitive lateral flow test with indirect labelling for Zearalenone in baby food Food and Agricultural Immunology,2020,31(1):653-666.