在我国,花椒不仅是人们日常生活中重要的调味品,也是一种药食同源的中药材。研究表明,麻味物质、挥发性物质及生物碱、三萜、甾醇等是花椒果皮主要的活性化学成分。其中,麻味物质是一类以山椒素为代表的链状不饱和脂肪酸酰胺,挥发性物质中含有萜烯类、醇类和酯类等物质[1-2]。花椒具有抗炎抑菌、麻醉镇痛、调节糖脂代谢及保护胃肠道等功效[3-5]。国内花椒种植区主要集中于四川、陕西、甘肃、重庆等省市,甘肃武都是我国花椒最佳适生区之一,2020年的种植面积达178 780 hm2,产值达51亿元,花椒已成为当地人民脱贫攻坚与乡村振兴的支柱产业。
近年来,相关学者的研究工作主要集中于花椒果皮的麻味物质[6-7]和挥发性物质[8-9]的提取分离和分析鉴别,而对花椒果皮风味物质在生长过程中的动态变化研究鲜见报道。本研究以相同种植环境和气候条件下白龙江武都区段的狮子头、茂汶大红袍、实生大红袍花椒为对象,采用反相高效液相色谱法(reversed phase-high performance liquid chromatography,RP-HPLC)测定生长发育过程中花椒果皮羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒为代表的麻味物质含量,采用电子鼻(E-nose)以及GC-MS对生长发育过程中花椒果皮挥发性物质的组成和含量进行检测,分析比较3个品种花椒果皮的麻味物质和挥发性物质含量的动态变化,并以成熟期花椒麻味物质与挥发性物质含量为指标,采用主成分分析法综合评价花椒品质的优劣,为武都花椒的质量评价以及品种的鉴别提供参考。
1 材料与方法
1.1 实验材料生境条件
花椒种质资源基因库设在白龙江武都区段,海拔1 410 m,年日照长达1 872 h,年平均气温13.9~15 ℃,平均降水量400~900 mm,相对湿度60%~70%,年太阳总辐射2 013.9 MJ/m2,土壤pH 7.32,昼夜温差大,适宜花椒种植。
1.2 样品采摘期与试剂
狮子头、茂汶大红袍、实生大红袍样品由陇南市经济林研究院花椒研究所马街镇花椒种质资源库提供,其中狮子头、茂汶大红袍的品种引进地分别为陕西韩城、四川茂县。3个品种的采摘时间从5月25日开始,每隔10 d采样1次直至花椒成熟。花椒酰胺对照品溶液(100 μg/mL),由西南大学阚建全教授实验室提供;石油醚、乙醚(分析纯),天津大茂试剂厂;甲醇(色谱纯),天津市康德科技有限公司。
1.3 仪器与设备
FL2200-2型高效液相色谱仪,浙江福立分析仪器股份有限公司;TRACE 1300 ISQ气相色谱-质谱联用仪,美国Thermo scientific;SZC-D型脂肪测定仪,广州沪瑞明仪器有限公司;PEN3.5电子鼻分析仪(配有10个金属氧化物传感器,如表1所示),德国AIRSENSE。
表1 电子鼻传感器名称与性能
Table 1 E-nose sensor name and performance
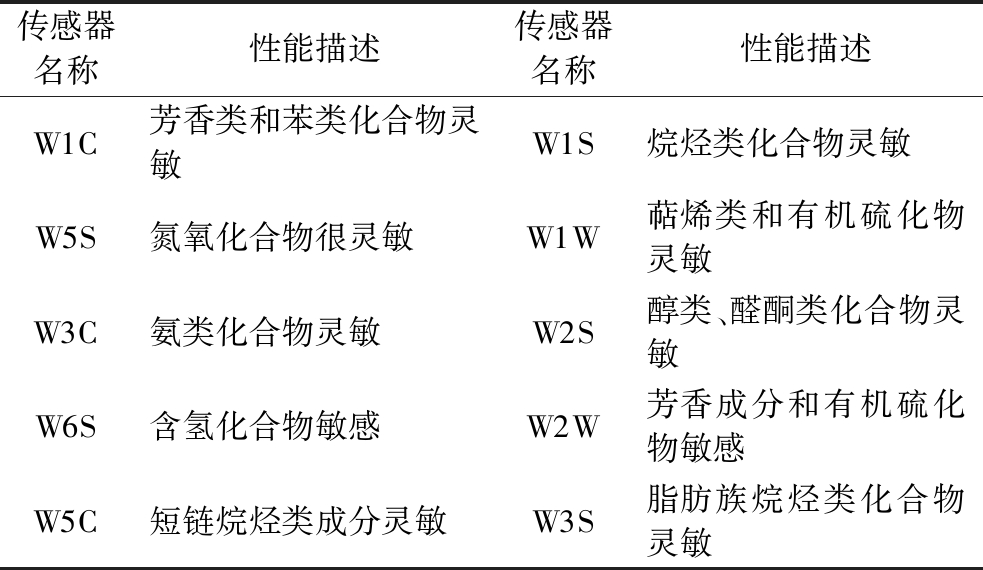
传感器名称性能描述传感器名称性能描述W1C芳香类和苯类化合物灵敏W1S烷烃类化合物灵敏W5S氮氧化合物很灵敏W1W萜烯类和有机硫化物灵敏W3C氨类化合物灵敏W2S醇类、醛酮类化合物灵敏W6S含氢化合物敏感W2W芳香成分和有机硫化物敏感W5C短链烷烃类成分灵敏W3S脂肪族烷烃类化合物灵敏
1.4 花椒麻味物质的RP-HPLC检测
1.4.1 供试品的制备
称取花椒果皮粉末约1.000 g,用滤纸包装后置于脂肪测定仪,量取50 mL乙醚于溶出杯中,50 ℃下回流提取3 h,回收乙醚,用甲醇溶解提取物,并定容于50 mL容量瓶中,密封,冷藏待测,平行提取3次。
1.4.2 RP-HPLC分析条件
本实验在254 nm处进行检测,使用Diamonsil Plus ODS C18色谱柱(4.6 mm×250 mm,5 μm),其固定相为十八烷基键合硅胶,流动相为甲醇和水[V(甲醇)∶V(水)=60∶40],流速1 mL/min,柱温35 ℃,进样量20 μL。
1.4.3 标准曲线的绘制
分别精确吸取100 μg/mL的花椒酰胺对照品溶液,用甲醇溶解定容,稀释质量浓度为0、5、10、15、20、25、30、40、50 μg/mL,按1.4.2节中的色谱条件依次进样,平行测定3次,得到花椒酰胺对照品溶液的响应值(3个峰的峰面积总和),以花椒酰胺质量浓度对总峰面积作图,绘制标准曲线,获得回归方程。
1.4.4 供试品的含量测定
吸取20 μL经适当稀释的不同生长发育时期的花椒麻味物质为供试品溶液,按1.4.2节中的色谱条件进样分析,分别测定3种花椒样品麻味物质的响应值,依据回归方程计算各个采摘期花椒麻味物质的含量。平行测定3次。
1.5 花椒挥发性物质的E-nose和GC-MS检测
1.5.1 供试品的E-nose检测
称取3种花椒果皮粉末约1.000 g置于顶空瓶,密封静置30 min,顶空瓶内富集气体达到稳定后,连接活性炭过滤器,以洁净空气为载气,流速1 mL/min,连接花椒样品5 s,采样间隔1 s,数据采集60 s,零点调节10 s,清洗60 s,每个样品重复检测3次,以信号响应值的平均值作为花椒挥发性物质分析的参考值。
1.5.2 供试品的GC-MS检测
1.5.2.1 供试品的制备
称取约3.000 g不同生长发育时期的花椒于安瓿瓶中,用10 mL石油醚浸泡、120 W超声波提取15 min,倾出浸提液,无水Na2SO4脱水后,5 000 r/min离心5 min,过滤后取上清液检测分析。
1.5.2.2 供试品的GC-MS分析条件
GC条件:TR-5MS弹性石英毛细管色谱柱(30 m×0.25 mm,0.25 μm),进样量1 μL,分流比为200∶1,进样口温度280 ℃,载气流速为1 mL/min。程序升温:50 ℃保持1 min,再以3 ℃/min升温到100 ℃,保持2 min,最后以8 ℃/min升温到250 ℃,保持2 min。
MS条件:溶剂延迟3 min,离子源温度250 ℃,扫描范围50~650 m/z,NIST 2011版质谱数据库。
1.6 数据分析
用Origin 2018软件绘制折线图和雷达图,用SPSS 22.0软件对实验数据进行主成分分析。
2 结果与分析
2.1 花椒果皮麻味物质的RP-HPLC分析
2.1.1 回归方程的建立
以花椒酰胺对照品质量浓度对相应的响应值(3个峰的峰面积总和)作图并进行线性回归分析,得到回归方程y=0.000 1x-0.259 5,相关系数R2=0.999 2,表明本实验建立的花椒果皮麻味物质标准曲线在麻味物质质量浓度5~50 μg/mL具有良好的线性关系,可以据此对花椒果皮中麻味物质含量在成熟过程中的动态变化进行定量分析。
2.1.2 生长发育过程中花椒果皮麻味物质含量的动态变化
由图1可知,3种花椒果皮麻味物质含量在生长发育过程中都呈现逐渐增加的趋势,这与ZHU等[10]所研究的四川汉源花椒生长发育过程中麻味物质由椒叶逐渐转移到果皮,并逐渐积累的结果一致,说明3种花椒麻味物质含量的积累与当地花椒的采收时间相吻合。麻味物质在3种花椒之间存在着含量和增长关键期的差异性,其含量由高到低依次为茂汶大红袍(167.34 mg/g)、狮子头(106.64 mg/g)和实生大红袍(100.1 mg/g)。花椒果皮麻味物质的含量越高,其麻味越强烈,麻度级别也越高[11]。3种花椒麻味物质增长的关键期也存在明显的差异,茂汶大红袍麻味物质关键增长时期在6月25日到7月7日之间,增长量达78.04 mg/g,增长率为87.00%;6月5日到6月15日之间是狮子头麻味物质关键增长期,增长量为46.03 mg/g,增长率为300.01%;实生大红袍麻味物质关键增长期在6月15日到6月25日之间,增长量为70.20 mg/g,增长率为263.72%。在相同的种植环境和气候条件下,3种花椒麻味物质含量及增长趋势在同一生长时期存在差异的原因可能与花椒的遗传背景有关[12]。本研究所测麻味物质的含量高于ZHANG等[13]研究的陕西韩城狮子头麻味物质含量(97.62 mg/g)和四川茂县茂汶大红袍麻味物质含量(95.59 mg/g),均高于阚建全等[14]研究的141份全国花椒样品麻味物质的平均含量,这可能与陇南气候条件更适合花椒的栽培有关[15]。
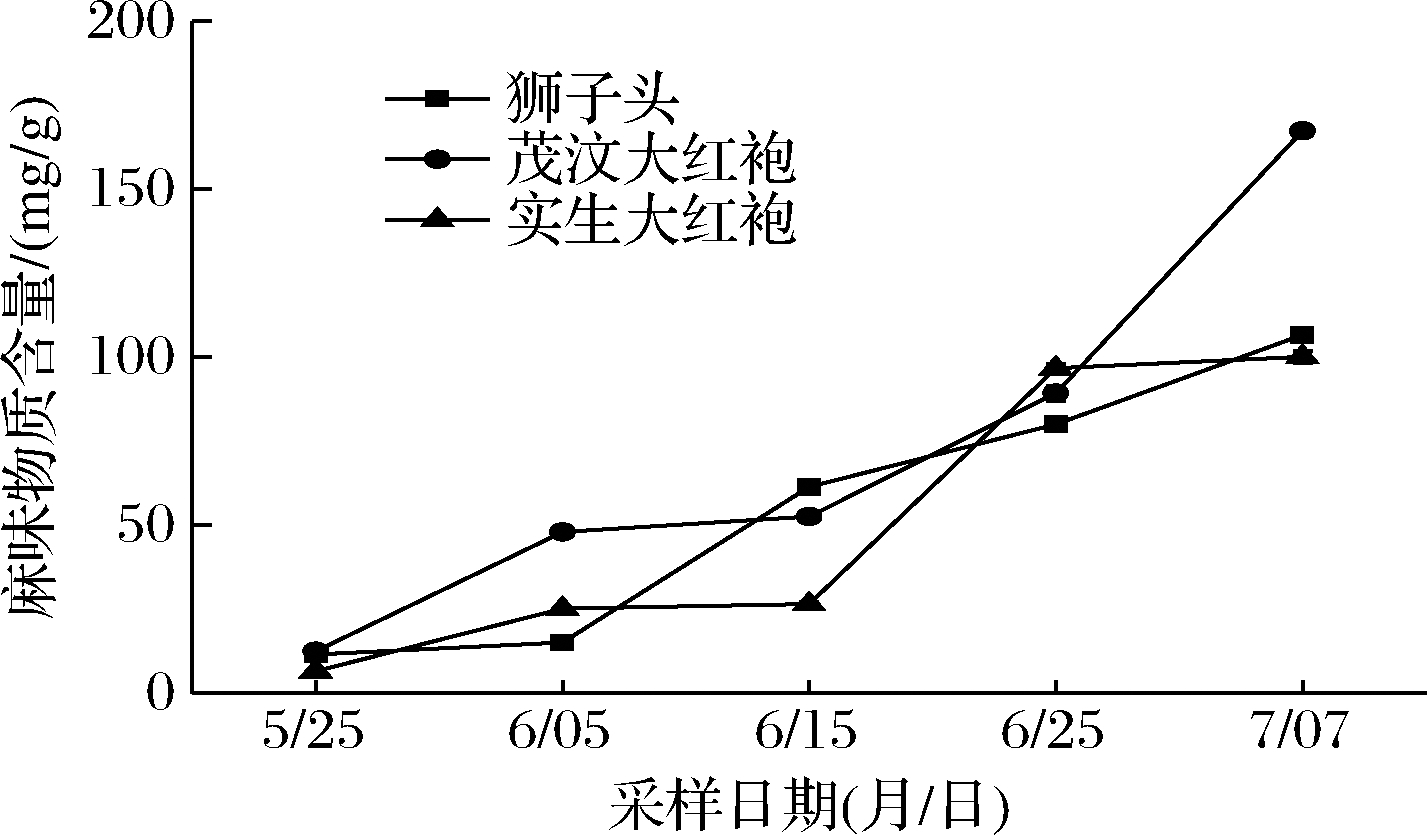
图1 不同品种花椒麻味物质含量的累积变化趋势
Fig.1 Cumulative trend of the contents of numb-taste components in different kinds of Zanthoxylum bungeanum
2.2 花椒果皮挥发性物质的E-nose分析
狮子头、茂汶大红袍、实生大红袍果皮挥发性物质的累积变化如图2所示,图中不同颜色代表3个品种花椒的不同采摘日期。5个传感器(W2W、W1W、W2S、W1S、W5S)响应值在不同生长发育阶段的3种花椒果皮中差异较大,说明传感器W2W、W1W、W2S、W1S、W5S对3种花椒顶空气体的信号响应敏感,尤其是W1W和W2W。其他5个传感器(W1C、W3C、W6S、W5C、W3S)对花椒挥发性物质的信号响应值差异较小,灵敏度较低,这与张正武等[16]利用电子鼻辨别陇南花椒品种的研究结果一致。

图2 不同品种花椒挥发性物质的累积变化3D条状图
Fig.2 3D bar chart of cumulative changes for volatile substances of different kinds of Z.bungeanum
2.3 花椒果皮挥发性物质的GC-MS分析
狮子头、茂汶大红袍和实生大红袍生长发育过程中被连续检出的果皮挥发性物质共有成分分别为11、10和7种(表2)。其中,有7种挥发性物质为3种花椒的主要共有成分,烯烃类、醇类和酯类化合物在3种花椒生长发育中的种类和含量居多,都能被电子鼻嗅闻到,且含量高于阈值,本实验分析了这些关键挥发性成分随生长发育的动态变化。
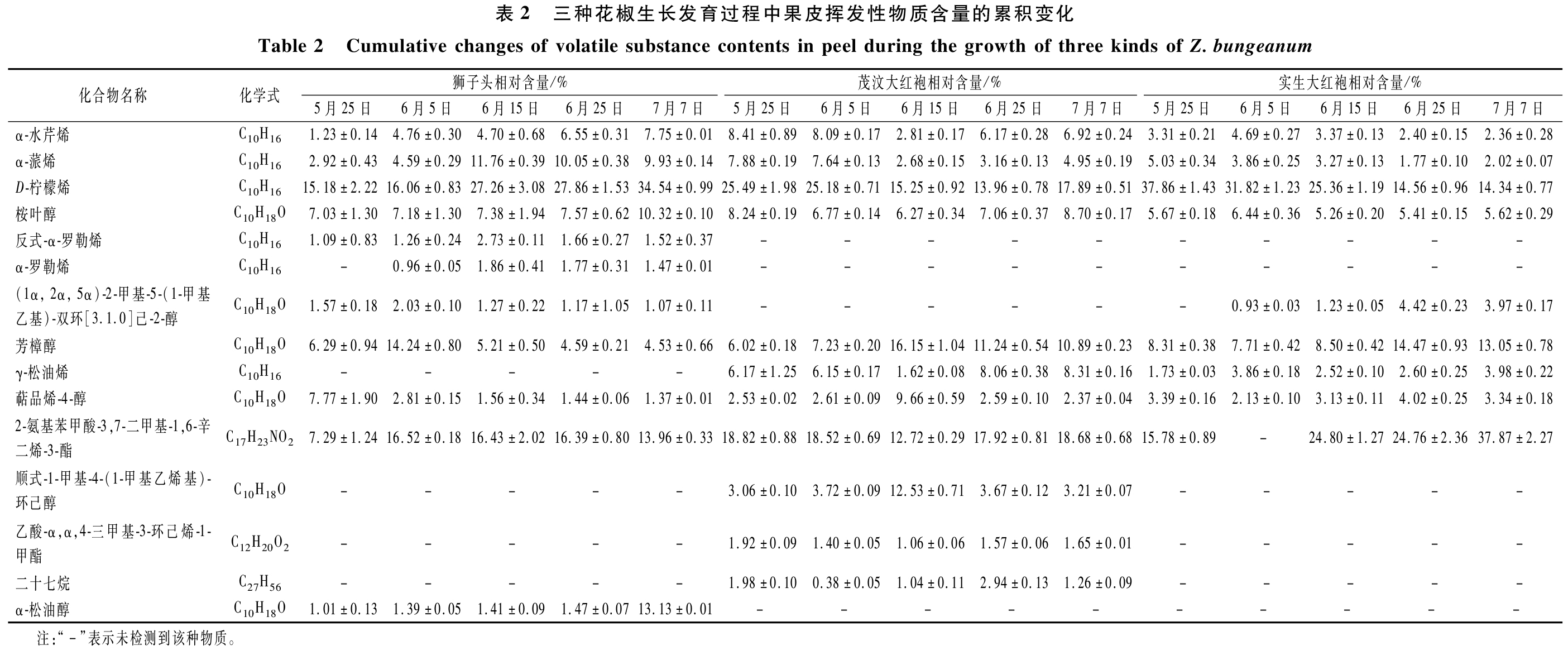
2.3.1 醇类
桉叶醇、芳樟醇、萜品烯-4-醇等在狮子头、茂汶大红袍和实生大红袍生长发育过程中均被连续性检出,其中桉叶醇和芳樟醇在3种花椒生长发育过程中的含量都较高,对花椒的香味具有一定的贡献。但醇类物质在3种花椒中含量及变化趋势差异明显,芳樟醇含量在狮子头和茂汶大红袍中都呈现先升高后降低的趋势,而实生大红袍在成熟的后期含量较高,为14.47%;狮子头和茂汶大红袍果皮的桉叶醇含量均在7月7日达到最高,分别为10.32%和8.7%,呈现逐步增加或先降低后增加的趋向,而在实生大红袍中的变化趋势不明显。狮子头特有的α-松油醇呈现不断增加的变化趋势,其余醇类的含量变动幅度相对较小,这与电子鼻中的W2S传感器(对醇类、醛酮类化合物)所测的响应值相对应。
2.3.2 烯烃类
D-柠檬烯、α-水芹烯、α-蒎烯在狮子头、茂汶大红袍和实生大红袍生长发育过程中均有连续性检出,烯烃类物质被检出的种类较多,且含量百分比较高。其中,D-柠檬烯含量在狮子头中7月7日达到最高值(34.54%),在茂汶大红袍中5月25日达到最高值(25.49%),在实生大红袍中5月25日达到最高值(37.86%),分别呈现为不断增加、不断降低及不断降低的变化趋势,D-柠檬烯在3种花椒的烯烃类物质中含量均最高,且对花椒香味贡献最大[17];狮子头和茂汶大红袍的α-蒎烯分别在6月15日和5月25日达到最高含量,分别为11.76%和7.88%,并呈现为先升高后降低和先降低后增高的趋向,而在实生大红袍中呈现不断降低的趋势;α-水芹烯在狮子头中呈逐渐增加的趋势,在茂汶大红袍中呈现先降低后增加的趋势,而在实生大红袍中呈现先升高后降低的趋势,这说明不同品种的花椒由于基因型的差异,其挥发性成分变化趋势差异较大[18],这与电子鼻雷达图所测W1W(对萜烯类和有机硫化物灵敏)的响应值相一致。
2.3.3 酯类
2-氨基苯甲酸-3,7-二甲基-1,6-辛二烯-3-酯在狮子头、茂汶大红袍和实生大红袍的生长发育过程中均有连续性检出,狮子头于6月5日含量最高(16.52%),并呈现先升高再降低的趋向;茂汶大红袍在5月25日含量最高(18.82%),呈现先降低后升高的趋向;实生大红袍在7月7日含量最高(37.87%),呈现逐渐增加的趋向,这与电子鼻雷达图W2W传感器(对芳香成分和有机硫化物)所测的响应值相一致。
2.3.4 烷烃类
茂汶大红袍在生长发育过程中检出二十七烷,含量较低且变化趋势不明显,但根据电子鼻雷达图所测W1S传感器(对烷烃类化合物敏感)可知,对花椒的呈香贡献较大。在花椒生长发育的过程中,结合电子鼻和GC-MS所测结果,3种花椒在生长发育过程中既有挥发性物质的消失,也有新挥发性物质的产生,虽含量相对较少,但阈值可能相对较大,对花椒的挥发性贡献也可能较大。
花椒果皮挥发性物质以烯烃类、醇类和酯类的种类和含量居多,在生长发育过程中,各挥发性物质含量动态变化差异明显,整体上呈无规律变化累积,这与JIANG等[18]研究日本未成熟花椒、成熟花椒和干燥花椒挥发性物质主要成分变化相似,可能是因为花椒香味物质主要成分由香味物质形成前体和香味物质调控基因决定[19-21]。3种花椒挥发性物质中烯烃类成分占总组分的50%以上,其中主要呈香物质包括柠檬烯、芳樟醇、α-蒎烯、乙酸芳樟酯等成分。本研究所测狮子头的芳樟醇、柠檬烯等挥发性物质含量高于乐薇等[22]用石油醚热浸法提取陕西大红袍花椒油挥发性物质的相对含量,也高于王利平等[23]研究陕西韩城大红袍花椒油挥发性物质的相对含量。茂汶大红袍的柠檬烯、乙酸芳樟酯、α-蒎烯、α-水芹烯含量高于乔明锋等[24]所测茂县花椒挥发性成分的相对含量,说明白龙江武都区段的生境适合花椒的栽培,有利于花椒产业的发展,与霍归国等[25]的研究结论一致。
2.4 花椒品质优劣差异分析
以成熟期麻味物质与挥发性物质(电子鼻检测值)为花椒品质优劣评价指标进行主成分分析,以特征值>1为原则,提取出2个主成分,第一主成分和第二主成分的特征值分别为8.491和2.509,前2个主成分的累积贡献率达100%,能反应全部指标的信息。因此,构建主成分表达式并计算各主成分得分F1和F2,以每个主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重计算主成分综合评价得分F(表3),综合排名依次为茂汶大红袍、狮子头和实生大红袍,这表明在所研究的武都花椒中,品质最好的是茂汶大红袍,其次为狮子头和实生大红袍。
表3 武都3个品种花椒综合得分及排名
Table 3 Comprehensive score and ranking of three kinds of Z. bungeanum in Wudu

花椒编号花椒名称F1F2F排序1茂汶大红袍2.121.421.9612实生大红袍-3.320.29-2.5033狮子头1.21-1.710.542
3 结论
对种植于白龙江武都区段的3个品种花椒的麻味物质和挥发性物质进行连续性检测,发现麻味物质含量从高到低依次为茂汶大红袍、狮子头和实生大红袍,且都呈现不断积累的趋势,这与当地的采收时间相吻合。在生长发育过程中,3个品种花椒各挥发性物质含量动态变化差异明显,整体上呈无规律性变化累积,花椒挥发性物质中贡献较大的物质为烯烃类、醇类和酯类,其中芳樟醇、柠檬烯等挥发性物质相对含量较高。白龙江武都区段的生境适合花椒的栽培,以成熟期麻味物质与挥发性物质为品质优劣评价指标,花椒品质最好的是茂汶大红袍,其次为狮子头和实生大红袍。
本实验只对白龙江武都区段3个品种花椒进行了分析研究,下一步将对白龙江陇南区域花椒进行整体性分析研究,以期为扩大武都花椒适生区范围提供理论支撑。
[1] 边甜甜,司昕蕾,曹瑞,等.花椒挥发油提取、成分分析及药理作用研究概述[J].中国中医药信息杂志,2018,25(8):129-132.
BIAN T T,SI X L,CAO R,et al.Review of extraction,component analysis and pharmacological effects of volatile oil in Zanthoxyli pericarpium[J].Chinese Journal of Information on Traditional Chinese Medicine,2018,25(8):129-132.
[2] 朱妞.花椒活性成分研究现状及发展前景[J].粮食与油脂,2020,33(4):4-6.
ZHU N.Current situation and development prospect of active components of Zanthoxylum bungeanum Maxim[J].Cereals &Oils,2020,33(4):4-6.
[3] NOOREEN Z,TANDON S,YADAV N P,et al.Zanthoxylum:A systematic review of its traditional uses,naturally occurring constituents and pharmacological properties[J].Current Organic Chemistry.2019,23(12):1307-1341.
[4] 王秋亚,景晓卉.花椒精油化学成分、提取方法及抑菌活性研究进展[J].中国调味品,2018,43(12):187-190;195.
WANG Q Y,JING X H.Research progress of the chemical compositions,extraction methods and antibacterial activities of essential oil from Zanthoxylum bungeanum[J].China Condiment,2018,43(12):187-190;195.
[5] 赵二劳,徐未芳,刘乐,等.花椒抑菌作用研究进展[J].中国调味品,2019,44(3):185-188.
ZHAO E L,XU W F,LIU L,et al.Research progress of the bacteriostasis of Zanthoxylum bungeanum[J].China Condiment,2019,44(3):185-188.
[6] 郭静,阚建全.高效液相色谱(HPLC)定量检测花椒麻味物质含量方法的建立[J].中国食品添加剂,2019,30(2):142-147.
GUO J,KAN J Q.Determination of the numb-taste components from Zanthoxylum by HPLC[J].China Food Additives,2019,30(2):142-147.
[7] 杨清山,翟彦伟,栗星,等.花椒及其提取物中花椒麻素的HPLC测定方法[J].食品工业,2019,40(8):328-332.
YANG Q S,ZHAI Y W,LI X,et al.The determination method of sanshool in Sichuan pepper and its extract by HPLC[J].The Food Industry,2019,40(8):328-332.
[8] ZHANG X X,ZHOU X Q,XI Z Y,et al.Surfactant-assisted enzymatic extraction of the flavor compounds from Zanthoxylum bungeanum[J].Separation Science and Technology,2020,55(9):1667-1676.
[9] 朱羽尧,张国琳,钱骅,等.采收后加工对大红袍花椒中芳香成分和麻味物质含量及组成的影响[J].中国调味品,2018,43(10):74-80.
ZHU Y Y,ZHANG G L,QIAN H,et al.Effect of post-harvest processing on the content and composition of aromatic components and pungent substances in Zanthoxylum bungeanum[J].China Condiment,2018,43(10):74-80.
[10] ZHU L,WANG L,CHEN X,et al.Comparative studies on flavor substances of leaves and pericarps of Zanthoxylum bungeanum Maxim.at different harvest periods[J].Tropical Journal of Pharmaceutical Research,2019,18(2):279.
[11] 张凤芳,马力.花椒麻度量化分级及麻味食品生产工艺研究[J].中国调味品,2015,40(9):72-74;80.
ZHANG F F,MA L.Study on quantitative and classification of numb-taste degree of pepper and production process of numb-taste food[J].China Condiment,2015,40(9):72-74;80.
[12] FEI X T,SHI Q Q,YANG T X,et al.Expression stabilities of ten candidate reference genes for RT-qPCR in Zanthoxylum bungeanum maxim[J].Molecules (Basel,Switzerland),2018,23(4):802.
[13] ZHANG L L,ZHAO L,WANG H Y,et al.The relationship between alkylamide compound content and pungency intensity of Zanthoxylum bungeanum based on sensory evaluation and ultra-performance liquid chromatography-mass spectrometry/ mass spectrometry (UPLC-MS/MS) analysis[J].Journal of the Science of Food and Agriculture,2019,99(4):1475-1483.
[14] 阚建全,陈科伟,任廷远,等.花椒麻味物质的生理作用研究进展[J].食品科学技术学报,2018,36(1):11-17;44.
KAN J Q,CHEN K W,REN T Y,et al.Review on physiological function of alkylamide compounds from Zanthoxylum bungeanum[J].Journal of Food Science and Technology,2018,36(1):11-17;44.
[15] 肖志强,李小军,焦素慧,等.陇南山区特色农业气候适宜性区划研究[J].现代农业科技,2017(21):215-216;219.
XIAO Z Q,LI X J,JIAO S H,et al.Study on climatic suitability regionalization of characteristic agriculture in Longnan mountainous area[J].Modern Agricultural Science and Technology,2017(21):215-216;219.
[16] 张正武,王勃,林云,等.基于电子鼻技术的陇南花椒品种区分[J].经济林研究,2019,37(4):188-193.
ZHANG Z W,WANG B,LIN Y,et al.Identification of Longnan pepper cultivars based on electronic nose technology[J].Non-Wood Forest Research,2019,37(4):188-193.
[17] 陈茜,陶兴宝,黄永亮,等.花椒香气研究进展[J].中国调味品,2018,43(1):189-194.
CHEN Q,TAO X B,HUANG Y L,et al.Research progress on the aroma of Chinese prickly ash[J].China Condiment,2018,43(1):189-194.
[18] JIANG L H,KUBOTA K.Differences in the volatile components and their odor characteristics of green and ripe fruits and dried pericarp of Japanese pepper (Xanthoxylum piperitum DC.)[J].Journal of Agricultural and Food Chemistry,2004,52(13):4197-4203.
[19] LIU Y L,WEI A Z.The complete chloroplast genome sequence of an economically important plant,Zanthoxylum bungeanum (Rutaceae)[J].Conservation Genetics Resources,2017,9(1):25-27.
[20] HU Y,TIAN L,SHI J W,et al.Genetic structure of cultivated Zanthoxylum species investigated with SSR markers[J].Tree Genetics &Genomes,2018,14(6):89.
[21] FENG S J,LIU Z S,CHEN L,et al.Phylogenetic relationships among cultivated Zanthoxylum species in China based on cpDNA markers[J].Tree Genetics &Genomes,2016,12(3):45.
[22] 乐薇,吴士筠,高欣.大红袍花椒挥发油的提取及化学成分的气相色谱-质谱分析[J].食品科学,2014,35(2):261-265.
LE W,WU S J,GAO X.Extraction and composition analysis by gas chromatography-mass spectrometry of volatile oil from Zanthoxylum bungeanum Maxim[J].Food Science,2014,35(2):261-265.
[23] 王利平,李占杰.陕西韩城大红袍花椒挥发油化学成分的研究[J].食品工业科技,2003(12):20-23.
WANG L P,LI Z J,Study on the chemical constituents of the volatile oil of Zanthoxylum bungeanum from Hancheng Dahongpao,Shanxi Province[J].Science and Technology of Food Industry,2003(12):20-23.
[24] 乔明锋,刘阳,袁小钧,等.茂县花椒化学成分分析及抑菌活性研究[J].中国调味品,2017,42(4):59-63;73.
QIAO M F,LIU Y,YUAN X J,et al.Study on chemical constituents and antibacterial activity of Zanthoxylum bungeanum in Maoxian[J].China Condiment,2017,42(4):59-63;73.
[25] 霍归国,梁婷玉,史金涵,等.武都‘大红袍’花椒品质研究[J].中国农学通报,2021,37(22):120-125.
HUO G G,LIANG T Y,SHI J H,et al.Study on the quality of Zanthoxylum bungeanum ‘Dahongpao’ from Wudu[J].Chinese Agricultural Science Bulletin,2021,37(22):120-125.