鲜食农产品包括生鲜果蔬以及生鲜肉类,是人体维生素、膳食纤维和蛋白质等重要营养物质的主要来源[1]。目前,消费者对具有良好营养价值的有机生鲜产品的兴趣在上升,市场需求不断增大[2-3]。但鲜食农产品在运输、贮藏、销售过程中易发生酶促褐变;其次,受到储存的环境条件限制,鲜食农产品极易腐烂变质和被食源性致病菌感染[4]。其腐败变质的原因主要是鲜食农产品中含有利于微生物生长的营养物质,引起细菌或霉菌的生长。这增加了人类食源性疾病的风险,对公共健康构成危害[5]。在过去的十年里,关于鲜食农产品中食源性疾病报道时有发生,给人类的健康和经济的发展带来巨大的影响[6]。根据世界卫生组织2020年[7]的报告,全球有6亿种食源性疾病,常见的有食物中毒、肠道传染病、人畜共患传染病、寄生虫病等,每年导致42万人死亡,其中,12.5万名为5岁以下儿童。在中国每6.5人中就有1人因摄入被病原体污染的食物而患上食源性疾病[8]。因此,食源性致病菌对鲜食农产品和人体的危害巨大,需要科学的检测方法。
以传统检测为主的食源性致病菌国家检测标准,因其操作繁琐、耗费时间长,无法满足快速检测的要求。目前,已有很多针对致病菌的快速检测技术,主要包括以核酸为基础[9-10]、以免疫蛋白为基础[11]以及以特异初级、次级代谢产物为基础[12]的快速检测方法,为了使过程易于操作且结果清晰准确,开发了可视化快速检测技术,如三磷酸腺苷(adenosine triphosphate,ATP)发光技术[13]、双重聚合酶链式反应-酶联免疫吸附法(polymerase chain reaction-enzyme linked immunosorbent assay,PCR-ELISA)[14]、量子点荧光探针法等。ATP 发光法可在几分钟内完成检测,但易受盐、游离-ATP因素干扰,且荧光素酶成本较高[13];双重PCR-ELISA法灵敏度高、可重复性强,但是需要使用大型精密仪器且容易交叉污染[14]。量子点(quantum dots,QDs)是能够产生荧光的纳米级半导体颗粒,以其优良的荧光性能为食源致病菌的快速检测开启了一扇新的大门[15]。它摆脱了耗时长、稳定性差等缺点,能够实现高效、灵敏、甚至可多次激发后对食源性致病菌的快速检测[16]。本文从量子点的理化性质、制备方法及其在检测鲜食农产品中食源性致病菌的应用3个方面进行综述,以期为鲜食农产品检测的快速化、准确化提供理论依据。图1显示的是目前主要应用方向。
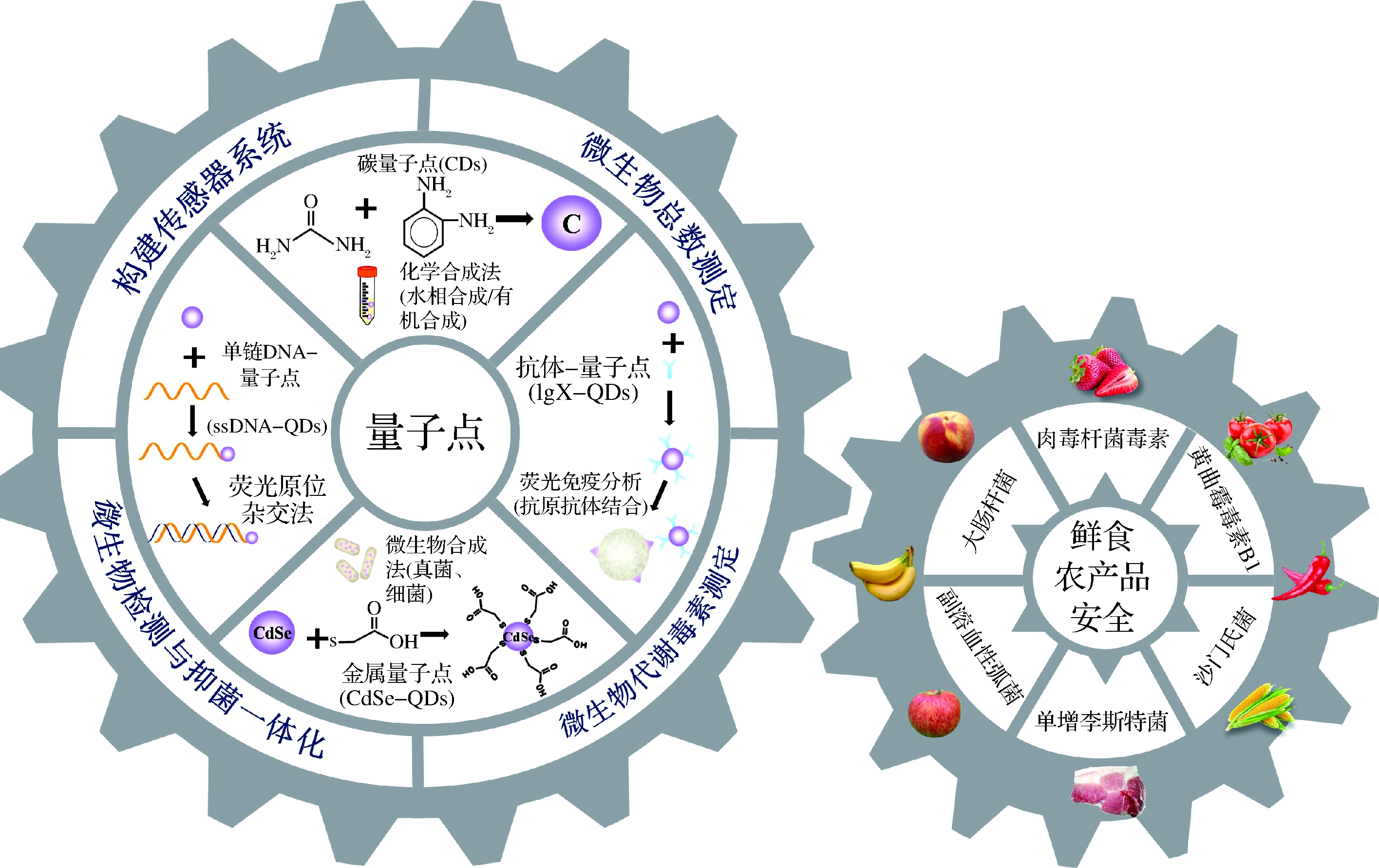
图1 量子点合成方法及食源性致病菌检测机制在鲜食农产品中的应用
Fig.1 Application of quantum dot synthesis and foodborne pathogens detection mechanism in fresh agricultural products
1 量子点的理化性质
量子点是一类荧光纳米晶体,主要由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成。在20世纪80年代初由俄罗斯物理学家Alexander Efros发现[17],其直径在1~10 nm,具有与正常原子相似的离散能级[18],在受到外界光源刺激后可以发射荧光,称为光致发光。光致发光的原理如图2所示,即当光线照射到量子点的导带上,光子被吸收,价带上的电子跃迁至导带上,同时导带上的电子也会跃迁至价带上,再次放出光子;但当电子进入电子陷阱后,其跃迁形式会发生变化,只有极少数的电子可以放出光子跃迁至价带或者以非辐射形式回到导带,而大多数电子则会以非辐射形式猝灭[19]。
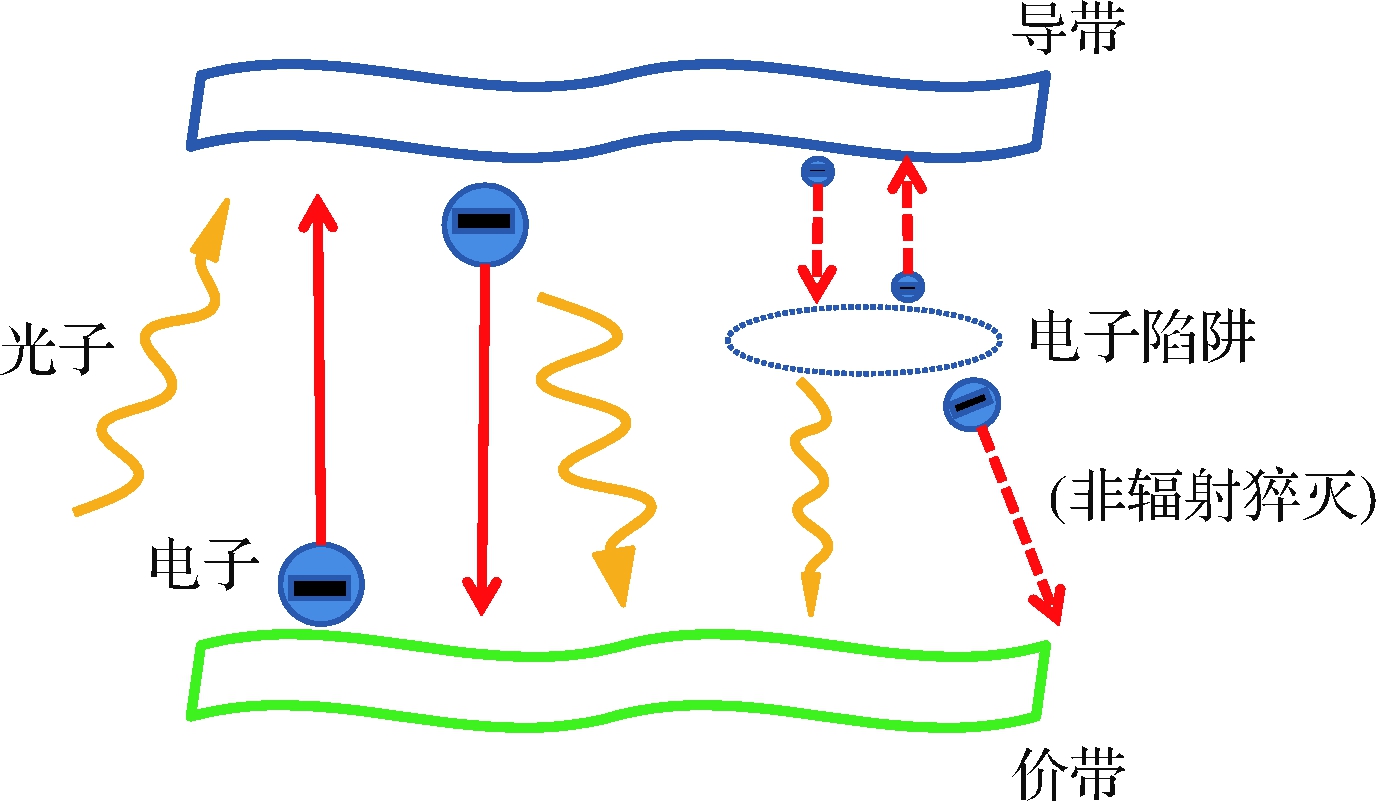
图2 量子点光致发光原理图
Fig.2 Schematic diagram of quantum dot photoluminescence
注:虚线为非辐射形式。
量子点具有优良的荧光特性:具有宽激发范围、窄发射带,发射光谱可依据量子点尺寸和组成进行调控[17],可利用同一束光来激发不同发射波长的量子点,实现对不同待测物的同时检测[15];具有高荧光量子产率、耐光漂白、具有长时间的荧光强度,是多路复用实验的理想选择[20-21]。在过去10年,具有优良荧光性能的量子点在多个学科中已被广泛应用,包括生物、光学、生物医学和能源工程[22]。
2 量子点的制备
在实际生产应用中,量子点的主要制备方法分为化学合成法和微生物合成法。
2.1 化学合成法
化学合成法制备量子点的原料通常分为前驱体和稳定剂。前驱体是量子点形成的核心,稳定剂的存在主要是为了阻止量子点的聚合和变形,以调整量子点颗粒的形貌,从而有效地保护量子点表面,减缓其生长速度[23]。在化学合成法制备过程中,量子点的形成要依次经历快速成核和缓慢生长2个阶段。根据制备过程中所采用的溶剂种类的不同,高质量荧光量子点的化学制备方法主要有有机合成法和水相法。有机合成法主要依赖前驱体在高沸点的有机溶剂中热解来制备,有机试剂本身具有毒性,且合成产物亲水性差,表面缺乏与生物分子反应的化学基团,应用与发展受到了限制[24]。徐传粉[25]以十八烯为溶剂,采用完全无膦化的方法在低温条件下合成了产率高达60%,低成本的CdTe量子点,虽解决了有机试剂无毒的问题,但其量子点的生长速率慢,很难得到粒径较大的量子点。与之相对应,水相合成法制备量子点操作简单、产物无毒、水溶性和生物相容性强,可灵活地加入其他元素增强荧光,适应各种应用。周蓓莹等[26]采用水相回流法合成了ZnS核壳CdSe量子点,不仅发光强度明显增大,而且稳定性显著提高。李丽娜等[27]以亚碲酸钠(Na2TeO3)为Te源,CdCl2为Cd源,利用水相合成了CdTe量子点,并成功测定了海藻中的微量碲,并增强了荧光效应。
2.2 微生物合成法
量子点的另一种制备方法是微生物合成法,与传统化学纳米合成技术相比,此法具有清洁无毒、环境友好、反应条件温和等优点,可用在无毒化学环境和恶劣条件下生产各种材料[28]。微生物体内富含蛋白质、脂类等生物物质,赋予量子点良好的生物相容性。微生物合成法主要包括胞外和胞内生物合成两大类,通常采用细菌和真菌这两大类微生物合成量子点。KOMINKOVA等[29]利用大肠杆菌胞外生物合成程序制备的量子点,评估了所得量子点的毒性。张亚楠等[30]在金黄色葡萄球菌活细胞内合成了ZnSe量子点,并对其进行表征。此外,高效的量子点细菌合成方法,可以直接依赖于大肠杆菌分泌蛋白,利用蛋白质辅助生物合成[31]。由此可见,已有大量学者对微生物合成量子点进行了广泛研究,且合成的量子点能够产生多方面的应用。
总而言之,量子点的化学合成法和微生物合成法都有其独特的优势,可以根据科研需要利用不同的合成方法制备量子点荧光材料。不同种类的量子点需要不同的原料来制备,以满足不同的应用需求。
3 量子点在检测鲜食农产品中食源性致病菌的应用
常引发鲜食农产品安全事件的食源性致病菌包括单核增生李斯特菌、副溶血性弧菌、大肠杆菌、沙门氏菌、金黄色葡萄球菌等。典型的例子如食用被产志贺氏毒素的大肠杆菌(Shiga toxin-producing Escherichia coli,STEC)污染的食品,尤其是牛肉和农产品,会对人类健康构成严重威胁[32]。不少研究已经表明量子点可以快速并精准检测食源性致病菌。在量子点成功用于检测大肠杆菌O157[33]、分支杆菌属[34]以及同时鉴定2种食源性菌株[35]后,HUANG等[36]使用量子点作为荧光标记,建立了敏感和特异的寡核苷酸微阵列,用来检测11种常见的食源性致病菌。现今食源性致病菌污染概率不断升高,因此检测技术的升级刻不容缓。量子点具有优良的光学性质,可用于构建传感器检测食源性致病菌、荧光免疫分析、代谢毒素检测以及附带抗菌作用等。
3.1 构建传感器系统
传统的以量子点作为荧光标记直接进行检测食源性致病菌的方法,在日益严重的食品安全问题面前,显得相对薄弱。因此在量子点的基础上,构建传感器系统,量子点在传感过程中点亮了检测信号,这有助于目标菌株的定量分析和荧光成像,可以更加快速且准确地对食源性致病菌进行筛查和检测,并可减少复杂食品样品中其他化合物的干扰。
随着科技的飞速发展,生物传感器的应用越来越广泛,特别是在食品安全领域,其原理是生物分子识别元件将目标细菌识别和捕获后,通过信号转换器将生物信号转换成光信号、电信号等,并转换为目标细菌的浓度[37]。将生物传感器与材料科学、生物学、电化学等相关学科技术有机融合,能够充分发挥其优良的检测性能[38]。人们在生物信号增强方面做出不懈努力后,各种生物传感器的灵敏度也在不断提高,越来越多的荧光生物传感器被用于检测食品中的致病菌。XU等[39]利用便携式分析仪结合基于量子点的荧光适形传感器同时检测了生菜、虾和碎牛肉中的大肠杆菌O157∶H7、单核增生李斯特菌和鼠伤寒沙门氏菌。这项技术能够实现对畜禽肉、蔬菜、水产品中多种食源性致病菌的快速、现场检测,方便了对食源性疾病的实时监控和预警,从而有效地提升了食品安全的管理水平。
除此之外,碳量子点得益于其优异的荧光性能及易于化学修饰和功能化的特点,通过开发为荧光探针,从而杂交结合到菌体的蛋白等代谢物质或核酸,实现对细菌或真菌的检测[40],已有研究表明,碳量子点因其荧光发射作为探针构成绿色制剂的纳米材料而被用作检测大肠杆菌 O157∶H7的纳米传感器[41];而石墨烯量子点以其独特的光学性质,在荧光检测中作为荧光探针非常有前景,同时也被用作检测金黄色葡萄球菌和大肠杆菌的光致发光传感器[42]。由于高灵敏度和低检测限的进一步研究,基于量子点制备成的传感器日渐作为多种食源性致病菌株的多功能检测工具,从而能够显著提高在食品安全领域检测致病菌的能力。
3.2 荧光免疫分析
近年来,量子点用于微生物总数检测的报道相继出现,依据量子点结合方式不同分为化学结合法、荧光免疫分析法和原位杂交法。这些方法具有检出限低,检测时长短的优势,见表1。
表1 不同量子点在微生物总数快速测定上的应用
Table 1 Application of different quantum dots in rapid determination of total number of microorganisms

方法量子点菌株检出限/(CFU/mL)检测时间/min参考文献化学结合法CdSe-QDs大肠杆菌、鼠伤寒沙门氏菌1.0×10210~60[43]Colis-QDs大肠杆菌2.8×10115[44]荧光免疫分析法CdTe:Zn/ZnS-QDs彭氏变形杆菌3.8×103210[45]EcoRⅡ-QDs大肠杆菌1.0×10215[46]CdSe/ZnS-QDs副溶血性弧菌1.0×101120[47]MPA-QDs大肠杆菌5.0×10220[48]抗体-QDs肠炎沙门氏菌、金黄色葡萄球菌、大肠杆菌1.0×10230[49]荧光原位杂交法SnO2-QDs霍乱弧菌3.2×102mg/L(DNA)—[50]ssDNA-QDs幽门螺杆菌4.6×10-13mol/L(DNA)20[51]
其中,荧光免疫分析法值得我们深入研究。多年以来,各种免疫分析方法常被用来检测食品中的致病菌,如传统的酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)具有高通量、快速检测和自动操作等特点,常被用于食品分析和临床诊断。然而,其灵敏度较低,检测限约为104 CFU/mL,检测效率低下,亟待探索更加快速精准的免疫分析检测方法。而荧光免疫分析是一种以高特异性的抗原抗体反应为基础,加入具有发光效应量子点的方法。其原理是量子点首先连接致病菌的抗体形成特异性荧光探针,之后与致病菌进行特异性抗原抗体结合,形成荧光免疫复合物。随着量子点的形态变化,可发生荧光猝灭、荧光复现等现象,根据荧光强度变化完成定量检测,此类方法具有检测快速[46]、灵敏度高的优点,因而被广泛用于食源性致病菌的检测。WANG等[52]研究了基于量子点作为荧光标记物的快速、选择性荧光连接免疫分析方法,用于检测鸡蛋壳上的肠炎沙门氏菌。HU等[53]基于相对快速和选择性强的优点,将量子点和免疫磁性纳米珠用作免疫分析中的荧光标记,对食品样品中金黄色葡萄球菌的检测进行了初步探索。与此同时,还有研究者利用量子点较宽的激发带以及随量子点形态大小可变的发射波长特性,实现了单光源激发多量子点的荧光免疫法定性和定量测定。WANG等[49]将多色量子点与不同抗体偶联,对504、577和604 nm波长处发射荧光强度进行测定,可一次性完成对肠炎沙门氏菌、金黄色葡萄球菌和大肠杆菌快速定量检测。此外,在荧光免疫的基础上,基于抗体的微阵列技术利用抗体-抗原反应的高度特异性和敏感性,在满足细菌检测方法的许多重要标准方面具有巨大潜力[54-55]。SANVICENS等[56]采用量子点共轭抗-IgG作为抗体阵列检测系统用来检测大肠杆菌 O157∶H7,与ELISA相比,检测限增加了3个数量级,且能够明显缩短检测时间,为基于量子点的微阵列技术检测食源性致病菌奠定了理论基础。
除检测微生物自身,量子点在分子水平上,也被应用于致病菌代谢毒素检测,如肉毒杆菌毒素[57]、赭曲霉毒素A[58]、T-2毒素[59]、黄曲霉毒素B1[60]。检测致病菌毒素主要原理与荧光免疫分析相同,利用抗原与抗体量子点特异性结合,测定荧光强度。量子点荧光技术比传统的毒素检测方法的截断值更低、毒素交叉反应性更弱[58]。FOUBERT等[61]将3种抗体分别偶联量子点作为荧光标记,开发了可识别3种霉菌毒素的多重横向流动免疫分析试纸,在检测定性时不使用任何精密设备只需等待15 min即可完成。
3.3 微生物检测与抗菌一体化
量子点不仅具有良好的发光性能,还对致病菌具有抑制作用[62],可在抗菌过程中实现对细菌含量的同步监测,但目前该方向鲜有研究报道。量子点可以将能量传递给附近的氧分子,从而诱导活性氧(reactive oxygen species,ROS)的形成,会对细菌细胞膜、DNA、RNA、蛋白质造成氧化损伤,导致细菌死亡[63]。其次,利用量子点与抗生素药物协同,可产生“1+1>2”抗菌效应[64]。LUO等[64]将头孢曲松钠通过静电吸附聚集在CdTe量子点表面,形成了抗菌效果明显高于单一材料的CdTe量子点-头孢曲松钠复合抗菌基团,此荧光复合物在488 nm处的荧光强度与大肠杆菌的光密度值呈良好的线性关系,可检测大肠杆菌总浓度。与此同时,复合抗菌量子点可高效诱导ROS的产生,对细菌造成更大的氧化损伤;还能抑制抗氧化基因的表达,导致抗氧化酶的低水平翻译,降低清除ROS的能力,实现了抗菌过程中细菌总浓度的动态监测,即定量检测与抑菌一体化。
3.4 基于量子点检测的其他应用
除了以上所总结的常见的基于量子点检测食源性致病菌的应用外,还有多数学者在吸纳了量子点的长期光稳定性、高量子产率、宽吸收光谱等诸多优点后,研究出了一些新型的检测方法,用来分析和表征农产品及其他食品样品中的食源性致病菌,以保卫食品安全和人类健康。要想充分发挥量子点的优良特性,就要最大限度地减少对其荧光的抑制,增强检测信号,达到最佳检测效果。磁珠对量子点的荧光有抑制作用,WANG等[65]首次将化合物[(1-乙基-3-3-二甲氨基丙基)碳化二亚胺盐酸盐]与蛋白质A作交联,移除磁珠,采用无珠隔离方法,将量子点标记技术与无珠荧光测量相结合,成功检测了碎牛肉中的大肠杆菌O157∶H7和沙门氏菌,且检测信号增加了4倍。
金黄色葡萄球菌现被列为第二常见食源性病原体,而耐甲氧西林金黄色葡萄球菌更是被归类为“超级细菌”,能够导致多种食源性疾病甚至败血症,严重威胁人类的生命健康。因此,能够快速并灵敏地对其进行检测并控制至关重要。CHEN等[66]以量子点为指示剂,开发了一种新型双标记PCR免疫层析测试条,用以检测奶粉和肉类样品中的金黄色葡萄球菌。另外,YAN等[67]利用细胞内的生化反应耦合,使活的枯草芽孢杆菌细胞可控地生物合成CdSe量子点,通过检测枯草芽孢杆菌和金黄色葡萄球菌相互作用的信号进而直观分析微生物之间的行为表现。这些新型方案的提出都可能有助于筛查和监测食品中的金黄色葡萄球菌污染,并有助于促进食源性病原体引起的传染病的预防和控制。
检测食源性致病菌,基于抗原—抗体的特异性识别机理是最为人熟知的,但是,利用抗体法对细菌进行分析检测是有限制的,而用来识别的抗原往往不能在单个细胞内得到完整的表达,从而明显地影响灵敏度并产生假阳性信号。而适配体易于合成、价格低廉,最重要的是其具有高亲和力和特异性,能够打破传统抗原—抗体特异性结合模式,代替抗体识别目标分子,通过流式细胞术,使用量子点作为荧光标记物,结合适配体作为分子识别元件,成功构建一个双功能平台,可同时检测鼠伤寒沙门氏菌和副溶血性弧菌[68]。本研究不但可以对食品致病菌进行特异性检测,而且也可以为适配体结合量子点应用于流式细胞术提供一种新的研究平台。
综上所述,基于量子点的方法识别和检测食源性致病菌的应用已经渗透到方方面面,不仅是农产品,其他食品样品中使用量子点也能达到很好的检测效果,从而能够减少食源性致病菌的危害,减轻食品安全的负担。
4 总结与展望
鲜食农产品安全不仅关系到人民健康,而且更关系到一个国家的前途命脉,其快速检测技术的开发具有重要战略意义。量子点灵敏度高,可视性强,能有效快速地检测微量的食源性致病菌及其代谢毒素,还能在定量检测的同时对致病菌产生抑制作用,加上本文对其理化性质和制备的充分概述,因此能够被应用于检测鲜食农产品中存在的食源性致病菌,从而降低致病菌对食品安全及人类健康的危害。
但是,量子点的研究仍有许多需要深入探究和改进的地方:(1)量子点对活体具有潜在的毒性,目前开发的量子点大多含有重金属Hg、Cd、Te等有害元素,在检测技术上受到国家标准限制,应多开发生物相容性好、无毒非金属元素为主的量子点,如灵敏度高且无毒的碳量子点,在国家允许的安全范围内使用。(2)由于食物中干扰成分过多且储存条件严格,影响检测材料的稳定性,量子点检测技术对于目标细菌的识别容易混淆,灵敏度降低,不能够精准检测,应进一步挖掘特异性强、连接方式紧密的量子点,选择出能够与量子点高特异性结合的物质分子,并简化量子点构建过程,实现超灵敏快速检测。(3)将量子点作为荧光材料与抗原或抗体偶联是荧光免疫分析的必备条件,但量子点与抗体偶联的连接方式强度较低且难构建,易断裂即会影响定量检测,实现快速检测应向此方向深入探究。(4)虽然量子点可视化技术检测已经涉及微生物检测与抗菌一体化领域,但还并未成熟应用,在鲜食农产品从农田到餐桌的整个过程中,病原微生物无处不在,因此深入开发微生物检测与抑菌一体化的量子点复合物对于食品安全检测及人类健康具有重要意义。
[1] 左映平,孙国勇.生物散斑激光技术及在生鲜农产品品质控制中的应用[J].江苏农业科学,2021,49(5):45-50.
ZUO Y P,SUN G Y.Biological speckle laser technology and its application in quality control of fresh agricultural products[J].Jiangsu Agricultural Sciences,2021,49(5):45-50.
[2] LI L L,ZHANG M,ADHIKARI B,et al.Recent advances in pressure modification-based preservation technologies applied to fresh fruits and vegetables[J].Food Reviews International,2017,33(5):538-559.
[3] BUMGARNER N R,SCHEERENS J C,KLEINHENZ M D.Nutritional yield:A proposed index for fresh food improvement illustrated with leafy vegetable data[J].Plant Foods for Human Nutrition,2012,67(3):215-222.
[4] PERERA N,GAMAGE T V,WAKELING L,et al.Colour and texture of apples high pressure processed in pineapple juice[J].Innovative Food Science &Emerging Technologies,2010,11(1):39-46.
[5] HAN J W,ZUO M,ZHU W Y,et al.A comprehensive review of cold chain logistics for fresh agricultural products:Current status,challenges,and future trends[J].Trends in Food Science &Technology,2021,109:536-551.
[6] RAMIREZ-HERNANDEZ A,GALAGARZA O A, LVAREZ RODRIGUEZ M V,et al.Food safety in Peru:A review of fresh produce production and challenges in the public health system[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(6):3323-3342.
LVAREZ RODRIGUEZ M V,et al.Food safety in Peru:A review of fresh produce production and challenges in the public health system[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(6):3323-3342.
[7] World Health Organization.Food safety[R/OL].WHO,(2020)[2022-04-30].https://www.who.int/NEWS-ROOM/FACT-SHEETS/DETAIL/FOOD-SAFETY.
[8] LIU Y,GAO Y,WANG T,et al.Detection of 12 common food-borne bacterial pathogens by Taq Man Real-Time PCR using a single set of reaction conditions[J].Frontiers in Microbiology,2019,10.DOI:10.3389/fmicb.2019.00222.
[9] DONG J,LU X,GUO W,et al.Research progress on isothermal amplification technology in the detection of foodborne pathogens[J].Food and Fermentation Industries,2021,(8):256-260.
[10] XIN L,ZHANG L W.Recent progress in nucleic acid-microfluidic chips used for detection of foodborne pathogens:A review[J].Food Science,China,2020,41(23):266-272.
[11] POLTRONIERI P,DE BLASI M D,D’URSO O F.Detection of Listeria monocytogenes through real-time PCR and biosensor methods[J].Plant Soil and Environment,2009,55(9):363-369.
[12] JADHAV S R,SHAH R M,KARPE A V,et al.Detection of foodborne pathogens using proteomics and metabolomics-based approaches[J].Frontiers in Microbiology,2018,9:3132.
[13] 李海月,黄继红,张新武,等.ATP生物发光法快速检测食源性致病菌的研究[J].河南工业大学学报(自然科学版),2016,37(1):67-71;128.
LI H Y,HUANG J H,ZHANG X W,et al.Study on rapid detection of food-borne pathogen by ATP bioluminescence method[J].Journal of Henan University of Technology (Natural Science Edition),2016,37(1):67-71;128.
[14] HU J Q,HUANG R N,WANG Y,et al.Development of duplex PCR-ELISA for simultaneous detection of Salmonella spp.and Escherichia coli O157:H7 in food[J].Journal of Microbiological Methods,2018,154:127-133.
[15] 李萌立,李忠海,李节,等.量子点荧光探针技术在食源性致病菌检测中的应用[J].食品与机械,2013,29(5):241-244.
LI M L,LI Z H,LI J,et al.Application of quantum dots on detection of food borne pathogen[J].Food &Machinery,2013,29(5):241-244.
[16] 杨倩雯,刘晓风,曾海娟,等.基于纳米材料的电化学免疫传感器及其在蛋白质检测中的研究进展[J].食品科学,2021,42(21):347-354.
YANG Q W,LIU X F,ZENG H J,et al.Electrochemical immunosensors and their application in the detection of proteins:A literature review[J].Food Science,2021,42(21):347-354.
[17] ABDEL-SALAM M,OMRAN B,WHITEHEAD K,et al.Superior properties and biomedical applications of microorganism-derived fluorescent quantum dots[J].Molecules,2020,25(19):1-5.
[18] XUE J P,WANG X F,JEONG J H,et al.Fabrication,photoluminescence and applications of quantum dots embedded glass ceramics[J].Chemical Engineering Journal,2020,383:123082.
[19] 覃爱苗,赵路路,杜为林,等.近红外量子点的发光机理研究[J].光谱学与光谱分析,2016,36(7):2059-2065.
QIN A M,ZHAO L L,DU W L,et al.Luminescence mechanism of near-infrared quantum dots[J].Spectroscopy and Spectral Analysis,2016,36(7):2059-2065.
[20] RESCH-GENGER U,GRABOLLE M,CAVALIERE-JARICOT S,et al.Quantum dots versus organic dyes as fluorescent labels[J].Nature Methods,2008,5(9):763-775.
[21] LIU B,JIANG B,ZHENG Z P,et al.Semiconductor quantum dots in tumor research[J].Journal of Luminescence,2019,209:61-68.
[22] JUZENAS P,CHEN W,SUN Y P,et al.Quantum dots and nanoparticles for photodynamic and radiation therapies of cancer[J].Advanced Drug Delivery Reviews,2008,60(15):1600-1614.
[23] 高杨晨,王猛,张晓梅,等.量子点荧光纳米材料的化学合成及其在潜手印显现中的应用[J].合成材料老化与应用,2013,42(2):40-46.
GAO Y C,WANG M,ZHANG X M,et al.Chemical synthesis of quantum dots fluorescent nanomaterials and their applications in development of latent fingerprints[J].Synthetic Materials Aging and Application,2013,42(2):40-46.
[24] 杜晴晴,施科如,王倩,等.荧光量子点的生物合成方法研究进展[J].微生物学通报,2017,44(2):449-457.
DU Q Q,SHI K R,WANG Q,et al.Advance of approaches for fluorescent quantum dots biosynthesis[J].Microbiology China,2017,44(2):449-457.
[25] 徐传粉.有机相中CdTe和ZnTe量子点的无膦化合成与性质表征[D].上海:华东师范大学,2013.
XU C F.Phosphate-free synthesis and characterization of CdTe and ZnTe quantum dots[D].Shanghai:East China Normal University,2013.
[26] 周蓓莹,王明辉,江莞.水相制备CdSe量子点及其ZnS核壳结构量子点[J].中国材料进展,2017,36(5):389-394.
ZHOU B Y,WANG M H,JIANG W.Preparation of CdSe and CdSe/ZnS core-shell quantum dots in aqueous phase[J].Materials China,2017,36(5):389-394.
[27] 李丽娜,陈雯,王舸泓,等.水相合成CdTe量子点测定海藻中微量碲[J].分析试验室,2021,40(12):1414-1418.
LI L N,CHEN W,WANG G H,et al.Determination of trace tellurium in seaweed by synthesis of CdTe quantum dots in aqueous phase[J].Chinese Journal of Analysis Laboratory,2021,40(12):1414-1418.
[28] AKBARI M,RAHIMI-NASRABADI M,POURMASUD S,et al.CdTe quantum dots prepared using herbal species and microorganisms and their anti-cancer,drug delivery and antibacterial applications:A review[J].Ceramics International,2020,46(8):9979-9989.
[29] KOMINKOVA M,MILOSAVLJEVIC V,VITEK P,et al.Comparative study on toxicity of extracellularly biosynthesized and laboratory synthesized CdTe quantum dots[J].Journal of Biotechnology,2017,241:193-200.
[30] 张亚楠,杨玲玲,涂家薇,等.金黄色葡萄球菌活细胞合成ZnSe量子点[J].高等学校化学学报,2018,39(6):1158-1163.
ZHANG Y N,YANG L L,TU J W,et al.Live-cell synthesis of ZnSe quantum dots in Staphylococcus aureus[J].Chemical Journal of Chinese Universities,2018,39(6):1158-1163.
[31] BAO H F,LU Z S,CUI X Q,et al.Extracellular microbial synthesis of biocompatible CdTe quantum dots[J].Acta Biomaterialia,2010,6(9):3534-3541.
[32] LAMOUREUX L,ADAMS P,BANISADR A,et al.An optical biosensor for detection of pathogen biomarkers from Shiga toxin-producing Escherichia coli in ground beef samples[C]//SPIE BiOS.Proc SPIE 9310,Frontiers in Biological Detection:From Nanosensors to Systems VII,San Francisco,California,USA.2015,9310:7-14.
[33] HAHN M A,TABB J S,KRAUSS T D.Detection of single bacterial pathogens with semiconductor quantum dots[J].Analytical Chemistry,2005,77(15):4861-4869.
[34] GAZOULI M,LIANDRIS E,ANDREADOU M,et al.Specific detection of unamplified mycobacterial DNA by use of fluorescent semiconductor quantum dots and magnetic beads[J].Journal of Clinical Microbiology,2010,48(8):2830-2835.
[35] ZHAO Y,YE M Q,CHAO Q G,et al.Simultaneous detection of multifood-borne pathogenic bacteria based on functionalized quantum dots coupled with immunomagnetic separation in food samples[J].Journal of Agricultural and Food Chemistry,2009,57(2):517-524.
[36] HUANG A H,QIU Z G,JIN M,et al.High-throughput detection of food-borne pathogenic bacteria using oligonucleotide microarray with quantum dots as fluorescent labels[J].International Journal of Food Microbiology,2014,185:27-32.
[37] DU H,WANG X M,YANG Q L,et al.Quantum dot:Lightning invisible foodborne pathogens[J].Trends in Food Science &Technology,2021,110:1-12.
[38] 乔敏.基于纳米材料的生物传感器在食品安全检测中的应用研究[J].粘接,2021,47(9):72-74;164.
QIAO M.Research on the application of biosensors based on nanomaterials in food safety detection[J].Adhesion,2021,47(9):72-74;164.
[39] XU L Z,LU Z,CAO L L,et al.In-field detection of multiple pathogenic bacteria in food products using a portable fluorescent biosensing system[J].Food Control,2017,75:21-28.
[40] 周环宇,乔楠,于大禹.碳量子点荧光探针在致病菌检测中的应用[J].化工新型材料,2022,50(5):21-26;31.
ZHOU H Y,QIAO N,YU D Y.Application of CQDs fluorescent probe in detection of pathogenic microorganism[J].New Chemical Materials,2022,50(5):21-26;31.
[41] CARVALHO F,GEORGE J,SHEIKH H M A,et al.Advances in screening,detection and enumeration of Escherichia coli using nanotechnology-based methods:A review[J].Journal of Biomedical Nanotechnology,2018,14(5):829-846.
[42] SAFARDOUST-HOJAGHAN H,SALAVATI-NIASARI M,AMIRI O,et al.Preparation of highly luminescent nitrogen doped graphene quantum dots and their application as a probe for detection of Staphylococcus aureus and E.coli[J].Journal of Molecular Liquids,2017,241:1114-1119.
[43] CRESPO R F,PEREZ O J P,RAMIREZ C.Total count of Salmonella typhimurium coupled on water soluble CdSe quantum dots by fluorescence detection[J].Journal of Electronic Materials,2018,47(8):4379-4384.
[44] CARRILLO-CARRI N C,SIMONET B M,VALC
N C,SIMONET B M,VALC RCEL M.Colistin-functionalised CdSe/ZnS quantum dots as fluorescent probe for the rapid detection of Escherichia coli[J].Biosensors and Bioelectronics,2011,26(11):4368-4374.
RCEL M.Colistin-functionalised CdSe/ZnS quantum dots as fluorescent probe for the rapid detection of Escherichia coli[J].Biosensors and Bioelectronics,2011,26(11):4368-4374.
[45] 徐焕焕,余锦露,孙雅静,等.基于CdTe:Zn/ZnS量子点快速检测变形杆菌荧光免疫分析法的建立[J].分析试验室,2019,38(9):1065-1069.
XU H H,YU J L,SUN Y J,et al.Establishment of fluorescence immunoassay method for rapid detection of proteus based on CdTe:Zn/ZnS quantum dots[J].Chinese Journal of Analysis Laboratory,2019,38(9):1065-1069.
[46] RENUKA R M,ACHUTH J,CHANDAN H R,et al.A fluorescent dual aptasensor for the rapid and sensitive onsite detection of E.coli O157∶H7 and its validation in various food matrices[J].New Journal of Chemistry,2018,42(13):10807-10817.
[47] LIU Y S,ZHAO C,FU K Y,et al.Selective turn-on fluorescence detection of Vibrio parahaemolyticus in food based on charge-transfer between CdSe/ZnS quantum dots and gold nanoparticles[J].Food Control,2017,80:380-387.
[48] CHEN R,HUANG X L,LI J,et al.A novel fluorescence immunoassay for the sensitive detection of Escherichia coli O157:H7 in milk based on catalase-mediated fluorescence quenching of CdTe quantum dots[J].Analytica Chimica Acta,2016,947:50-57.
[49] WANG B B,WANG Q,CAI Z X,et al.Simultaneous,rapid and sensitive detection of three food-borne pathogenic bacteria using multicolor quantum dot probes based onmultiplex fluoroimmunoassay in food samples[J].LWT-Food Science and Technology,2015,61(2):368-376.
[50] PATEL M K,SINGH J,SINGH M K,et al.Tin oxide quantum dot based DNA sensor for pathogen detection[J].Journal of Nanoscience and Nanotechnology,2013,13(3):1671-1678.
[51] LIU Z P,SU X G.A novel fluorescent DNA sensor for ultrasensitive detection of Helicobacter pylori[J].Biosensors and Bioelectronics,2017,87:66-72.
[52] WANG B B,HUANG X,MA M H,et al.A simple quantum dot-based fluoroimmunoassay method for selective capturing and rapid detection of Salmonella Enteritidis on eggs[J].Food Control,2014,35(1):26-32.
[53] HU Y H,WANG C C,BING B,et al.Detection of Staphylococcus aureus using quantum clots as fluorescence labels[J].International Journal of Agricultural and Biological Engineering,2014,7(1):77-83.
[54] ANGENENDT P.Progress in protein and antibody microarray technology[J].Drug Discovery Today,2005,10(7):503-511.
[55] WINGREN C,BORREBAECK C A.Antibody-based microarrays[J].Methods in Molecular Biology (Clifton,N.J.),2009,509:57-84.
[56] SANVICENS N,PASCUAL N,TERESA FERNANDEZ-ARGUEELLES M,et al.Quantum dot-based array for sensitive detection of Escherichia coli[J].Analytical and Bioanalytical Chemistry,2011,399(8):2755-2762.
[57] WANG Y,SCHILL K M,FRY H C,et al.A quantum dot nanobiosensor for rapid detection of botulinum neurotoxin serotype E[J].ACS Sensors,2020,5(7):2118-2127.
[58] ZHOU J M,YANG Q B,LIANG C,et al.Detection of ochratoxin A by quantum dots-based fluorescent immunochromatographic assay[J].Analytical and Bioanalytical Chemistry,2021,413(1):183-192.
[59] LI Y F,XU L,FU X C,et al.A competitive immunoassay based on engineered magnetic/fluorescent nanoparticles and biolayer interferometry-based assay for T-2 toxin determination[J].Microchimica Acta,2020,187(9):514.
[60] WANG C Q,ZHANG W H,QIAN J,et al.A FRET aptasensor for sensitive detection of aflatoxin B1 based on a novel donor-acceptor pair between ZnS quantum dots and Ag nanocubes[J].Analytical Methods:Advancing Methods and Applications,2021,13(4):462-468.
[61] FOUBERT A,BELOGLAZOVA N V,GORDIENKO A,et al.Development of a rainbow lateral flow immunoassay for the simultaneous detection of four mycotoxins[J].Journal of Agricultural and Food Chemistry,2017,65(33):7121-7130.
[62] RESHMA V G,SYAMA S,SRUTHI S,et al.Engineered nanoparticles with antimicrobial property[J].Current Drug Metabolism,2017,18(11):1040-1054.
[63] KLOEPFER J A,MIELKE R E,NADEAU J L.Uptake of CdSe and CdSe/ZnS quantum dots into bacteria via purine-dependent mechanisms[J].Applied and Environmental Microbiology,2005,71(5):2548-2557.
[64] LUO Z H,WU Q S,ZHANG M,et al.Cooperative antimicrobial activity of CdTe quantum dots with rocephin and fluorescence monitoring for Escherichia coli[J].Journal of Colloid and Interface Science,2011,362(1):100-106.
[65] WANG L X,WU C S,FAN X D,et al.Detection of Escherichia coli O157:H7 and Salmonella in ground beef by a bead-free quantum dot-facilitated isolation method[J].International Journal of Food Microbiology,2012,156(1):83-87.
[66] CHEN X X,GAN M,XU H,et al.Development of a rapid and sensitive quantum dot-based immunochromatographic strip by double labeling PCR products for detection of Staphylococcus aureus in food[J].Food Control,2014,46:225-232.
[67] YAN Z Y,AI X X,SU Y L,et al.Intracellular biosynthesis of fluorescent CdSe quantum dots in Bacillus subtilis:A strategy to construct signaling bacterial probes for visually detecting interaction between Bacillus subtilis and Staphylococcus aureus[J].Microscopy and Microanalysis,2016,22(1):13-21.
[68] DUAN N,WU S J,YU Y,et al.A dual-color flow cytometry protocol for the simultaneous detection of Vibrio parahaemolyticus and Salmonella typhimurium using aptamer conjugated quantum dots as labels[J].Analytica Chimica Acta,2013,804:151-158.