甘薯[Ipomoea batatas(L.)Lam.]为旋花科(Convolvulaceae)植物,又称甜薯、红薯、地瓜,是我国产量排名第4的农作物。2019年,我国甘薯种植面积达237.4万hm2,占世界甘薯种植面积的1/3,块根年产量约为5 200万t,占世界甘薯产量的一半以上[1]。甘薯产量在世界粮食作物中排名第7,世界上很多国家都广泛食用甘薯,包括印度、南非、马来西亚等。由于含有丰富的营养价值和生物活性化合物,甘薯被美国“公共利益科学中心”(Center for Science in the Public Interest)认为是“超级食物”[2]。同时,甘薯作为一种适应性强,抗旱、耐贫瘠、抗风、抗寒的高产稳产作物,具有良好的保障我国粮食安全、抵御自然灾害的能力。
甘薯在加工为淀粉的过程中会产生大量甘薯渣。生产1 t甘薯淀粉所产生的鲜薯渣约有6 t,我国每年因生产淀粉产生的甘薯渣干重高达550万t[3]。鲜薯渣中的含水量较高、运输及存储困难,大部分甘薯渣被当作废弃物直接丢弃,少部分被当作低价值的动物饲料[4]。研究发现,甘薯渣中含有丰富的淀粉、膳食纤维、可溶性糖、果胶、蛋白质等营养与保健成分,对延缓衰老、预防心血管疾病、减肥调脂、降血糖等有一定的功效[5]。如何合理有效地利用甘薯渣中这些成分,成为实现甘薯种植加工向着生态友好型发展的关键问题。
随着生物与化学技术的不断发展,甘薯渣的综合利用出现了许多新的可能。其中利用微生物发酵甘薯渣生产高值化产品作为一种绿色可持续发展的处理方式受到很多关注[6]。由于甘薯渣中含有的淀粉、纤维素等大分子物质微生物很难直接利用,通常需要对甘薯渣进行酶水解。酶水解可分为直接酶解与预处理(包括物理法、化学法、生物法)后酶解。预处理的目的是使酶与底物更好的接触以实现更短的时间获得更多的可发酵糖[7]。目前,已有酵母菌、霉菌、乳酸菌等微生物实现了以甘薯渣为碳源的发酵生产,并成功制备出有机酸、乙醇、蛋白质、可溶性膳食纤维等。这些物质有望在高蛋白饲料、食品添加剂、医学等领域实现甘薯渣的高值化利用。除此之外,直接提取甘薯渣中的膳食纤维进行食品加工、改性后制备吸附材料、固体燃料等也为薯渣的高值化利用提供了许多新的思路(图1)。本文对国内外甘薯渣的高值化利用研究进展进行了综述,并对存在的问题和未来的发展方向进行了分析与展望。希望可以为相关研究人员提供一定的参考和借鉴。
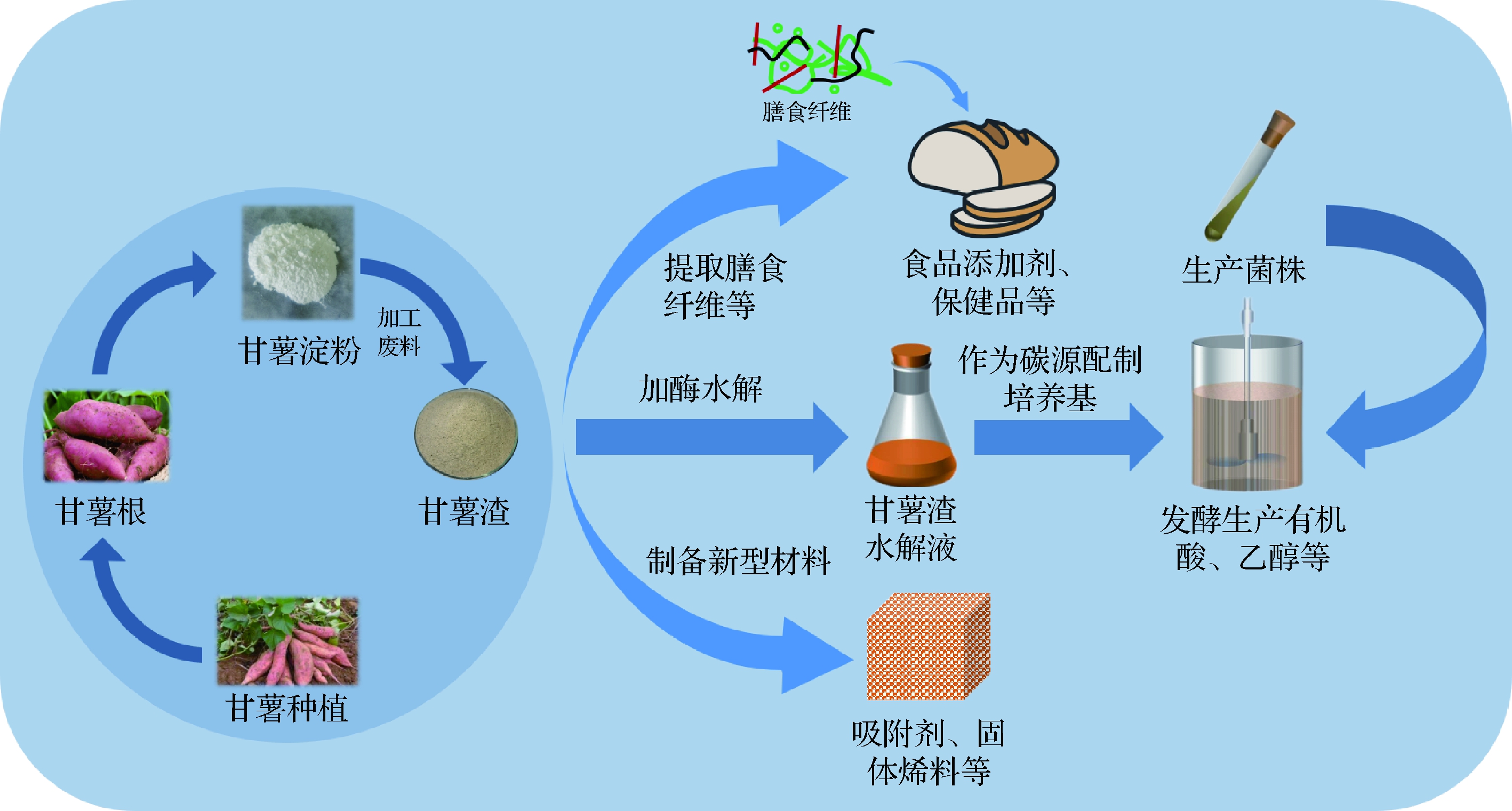
图1 甘薯渣综合利用示意图
Fig.1 Schematic diagram of comprehensive utilization of sweet potato residue
1 甘薯渣酶水解处理
对甘薯渣中的大分子物质进行糖化处理是利用其作为碳源进行微生物发酵的关键步骤。利用传统的酸法水解进行糖化处理容易腐蚀设备产生抑制发酵的物质对生态环境造成污染。相比之下,酶法水解条件温和、排放污水少、效率高,更加适合大规模生产。其中最常使用的几种酶有α-淀粉酶、糖化酶、纤维素酶等。α-淀粉酶和糖化酶主要水解甘薯渣中的淀粉,α-淀粉酶破坏淀粉的(α1→4)糖苷键,糖化酶破坏(α1→4)和(α1→6)糖苷键,最终将其水解为葡萄糖。纤维素由于外面包裹着一层木质素不易与酶接触,因此通常对其进行预处理。
1.1 直接酶解
PAGANA等[8]通过淀粉酶水解甘薯渣使其中83.6%的淀粉转化为葡萄糖。单一酶水解对纤维素的利用率非常低,实验优化后纤维素的转化率也仅仅为4.52%[9]。用糖化酶、纤维素酶、果胶酶3种酶混合水解甘薯渣,在料液比为1∶4时葡萄糖质量浓度最高为168.4 g/L,总体转化率为70.8%[10]。韩业君等[11]从高温菌中分离出的粗酶液与甘薯渣以一定比例混合后在60~80 ℃水解10~20 h,最终使甘薯渣中的淀粉和纤维素水解率超过90%。
1.2 预处理后酶解
由于纤维素被木质素及半纤维素等物质包裹,纤维素酶很难与之接触,预处理可使纤维素暴露出来加快水解速度(图2)[7]。

图2 甘薯渣预处理及酶水解机制图
Fig.2 Mechanism of pretreatment and enzymatic hydrolysis of sweet potato residue
SUN等[12]的研究表明,在pH 11.5的条件下利用稀H2O2处理麦草木质素可以大幅提高木质素的分离率。YANG等[13]也在碱性环境下,使木质素的分离率提高到83.68%。李平等[14]又发现使用超声波结合10 g/L NaOH溶液预处理的甘薯渣水解效果最好。XIA等[15]比较了H2SO4、NaOH、H2O2 3种试剂的预处理效果,结果NaOH 预处理后的甘薯渣用纤维素酶、木聚糖酶和果胶酶水解,纤维素转化率最高达到96.2%。采用酸、碱法进行预处理后需消耗大量的水进行洗涤,且废水需要经过中和处理否则容易造成环境污染[16]。随着亚临界水法等新型预处理方法的出现,原料的转化率会越来越高且污染更低。虽然这些技术仍处于实验室研究阶段,但其为甘薯渣预处理提供了一种更加高效环保的可能。
2 甘薯渣为碳源发酵生产高值化产品
2.1 甘薯渣发酵生产有机酸
有机酸是一类具有酸性的有机化合物,大部分的有机酸都具有生物活性。甘薯渣水解液中含有大量的可发酵糖可供微生物发酵生产有机酸。目前,以甘薯渣为原料生产的有机酸包括柠檬酸、乳酸、醋酸等。柠檬酸的生产菌株主要有黑曲霉、酵母菌等。这些菌株在有氧发酵过程中糖酵解途径结束后,丙酮酸在辅酶A和丙酮酸脱氢酶等的作用下生成乙酰辅酶A,再经过草酰乙酸和柠檬酸合成酶的催化生成柠檬酸。乳酸则是微生物在无氧发酵过程中糖酵解途径后,丙酮酸直接转化为乳酸(如图3)[17-18]。
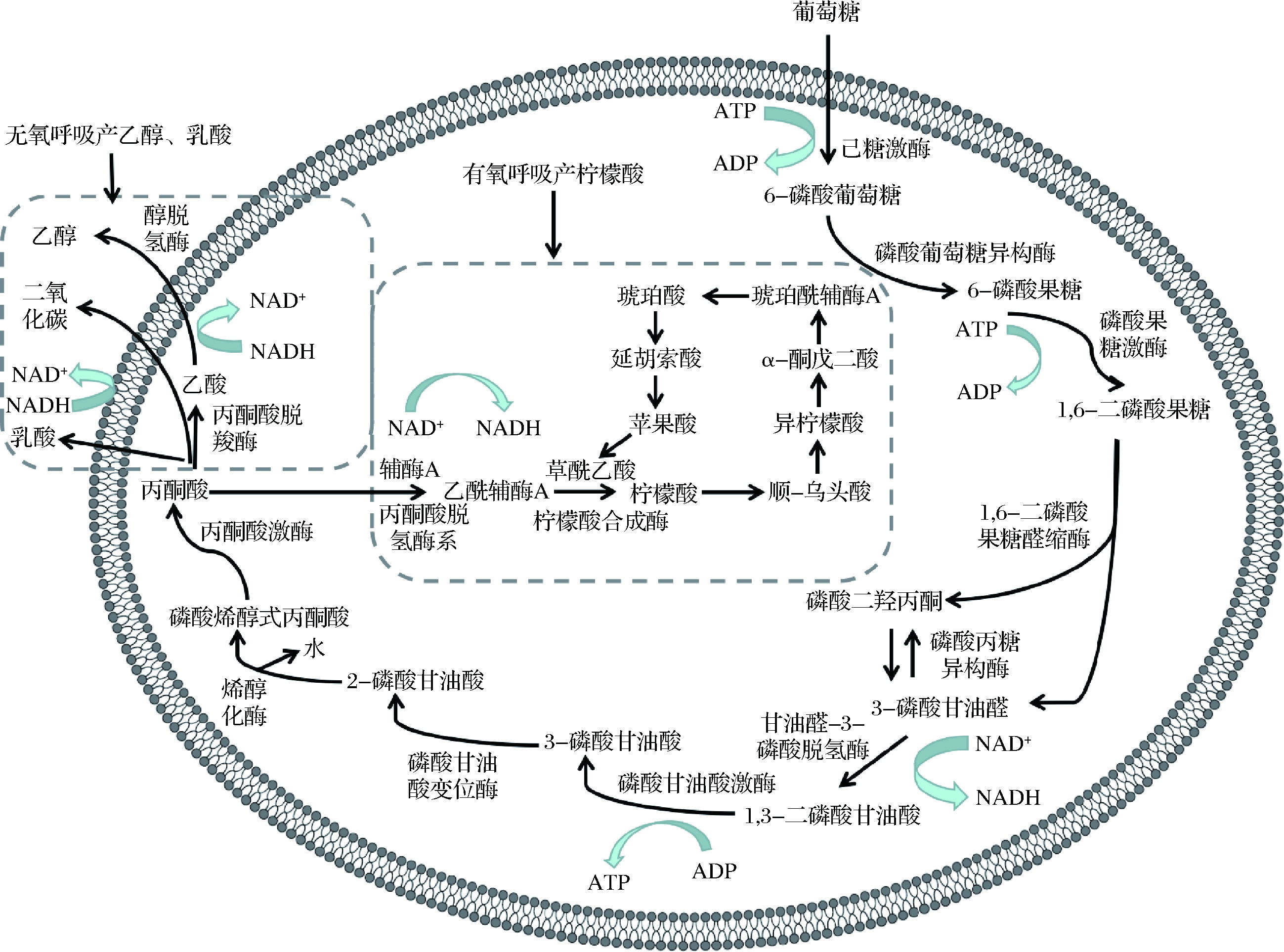
图3 有机酸及乙醇的合成机制图
Fig.3 Diagram of synthesis mechanism of organic acids and ethanol
ABOYEJI等[19]利用黑曲霉以甘薯渣水解液为碳源生产柠檬酸,最终在碳源质量分数为97.25%、氮源质量分数1.25%、发酵时间7 d、pH 6.5的条件下得到最高柠檬酸产量为3.22 g/L。BINDUMOLE等[20]分别用甘薯粉和甘薯渣水解液为原料以黑曲霉作为生产菌发酵制备柠檬酸,2种碳源最终的柠檬酸产量分别为15.5和6.8 g/L。PAGANA等[8]对3株乳酸菌(德氏乳杆菌德氏亚种、德氏乳杆菌保加利亚亚种和鼠李糖乳杆菌)在甘薯渣水解液中的生长及乳酸生产能力进行评估,发现鼠李糖乳杆菌是乳酸生产的最佳菌株。刘玉婷等[21]对甘薯渣水解液为原料鼠李糖乳杆菌发酵制备乳酸进行了工艺优化,最终乳酸发酵效率达92.39%,残糖浓度低至0.59 g/L。2018年,沈寿国等[22]以甘薯渣为原料利用米根霉PW352固态发酵生产L(+)—乳酸,发现向甘薯渣中补充部分氮源与速效碳源可以使产量提高。最终确定最优氮源为硫酸铵,速效碳源的最优添加量为0.5%。
以甘薯渣水解液为原料利用酵母菌和醋酸菌进行混菌发酵,可获得一种新保健型醋。其中酵母菌发酵生产乙醇浸提薯渣水解液中的花色苷,醋酸菌发酵生产醋酸。最终产物中乳酸含量4.0~6.5 g/L、总酸含量45~70 g/L、花色苷含量60~100 mg/L、保存率达60%~90%[23]。这种新型醋具有挥发酸含量低、乳酸含量及花色苷保留率高、色香味俱全、保健作用强等优点。目前,利用生物发酵法生产的有机酸不仅成本低、产量高、危害小,还可以广泛用作食品添加剂、防腐剂、金属离子螯合剂等。
2.2 甘薯渣发酵生产乙醇
乙醇作为新型能源在许多领域都有应用,与化石能源相比其燃烧产物清洁环保。随着化石能源的不断减少,乙醇作为替代能源需求量日益增高。以往玉米、木薯和小麦等农作物被用于发酵生产乙醇(图3),丙酮酸在无氧呼吸条件下经过丙酮酸脱羧酶等酶的催化生成乙醇[24-25]。为了进一步降低乙醇的生产成本,采用价格更加低廉的甘薯渣作为发酵原料是个很好的选择。
朱许慧[26]利用甘薯渣水解液发酵生产乙醇,在最适条件下乙醇的产量达到 24.0 g/100 g甘薯渣。徐雨濛等[27]通过超声波辅助甘薯渣预处理后进行发酵生产,在最佳工艺条件下乙醇产率达21.4%,较传统工艺产率提高13.8%。王贤等[28]以密选1号甘薯渣为原料加酶水解,通过酵母菌发酵的方式生产生物乙醇,并对糖化酶的添加量、接种质量分数、发酵温度进行了响应面优化。最终确定糖化酶用量150.7 U/g、接种质量分数为0.3%、发酵温度36.1 ℃时的乙醇产量最高,其平均体积分数为17.15%。但在对发酵工艺再次优化中,乙醇的产量未见明显提升[29-30]。以甘薯渣水解液为碳源微生物发酵生产乙醇,不仅原料成本更低,还可以通过同步糖化发酵的方法减少发酵能耗及时间,降低高糖浓度对酶的抑制作用进而获得较高的乙醇产量。
2.3 甘薯渣发酵生产低聚糖
低聚糖是一种功能性糖原,由3~20个单糖通过糖苷键连接而成。其具有促进双歧杆菌增殖、预防龋齿、控制血糖、抑制金黄色葡萄球菌生长等生理特性,被广泛应用于食品、保健品、饮料、医药等领域[31]。目前,低聚糖的生产主要有酶法和生物发酵2种方法。相较酶法而言,生物发酵法制备低聚糖具有成本低、稳定性高等优点,可用于生产低聚糖的微生物有黑曲霉、米曲霉、芽孢杆菌等。
2014年,李燕[32]用纤维素琼脂培养基从土壤中分离出10株降解菌,经过初筛、复筛之后找到低聚糖产量最高的X1菌株,在对其进行生理生化分析后初步确认菌株X1为链霉菌属白孢类群。这是国内首篇利用甘薯渣进行低聚糖生产的报导。王允祥等[33]以甘薯渣为原料用X1菌株发酵生产低聚糖,通过单因素试验对接种量、起始pH、发酵时间、料液比、发酵温度进行研究。以低聚糖产量为响应值,通过Box-Behnken中心组合设计优化实验,最终使低聚糖产量达到6.29 μg/mL。利用甘薯渣为碳源进行低聚糖的发酵生产已有实验证明其可行性,其可能原因是生产菌中含有的一些酶使薯渣中含有的大分子物质和可发酵糖的糖苷键发生了转换。
2.4 甘薯渣发酵生产其他物质
除了以上所提到的,甘薯渣还被用于发酵生产四环素、膳食纤维、蛋白质等,表1是利用甘薯渣发酵生产高值化产品的文献小结。
表1 甘薯渣发酵制品研究小结
Table 1 Summary of sweet potato residue in fermentation for bioproducts

产物产量/(g/100g干重)菌种发酵方式温度/℃时间/d参考文献柠檬酸6.80黑曲霉菌液态发酵307[21]总酸45醋酸菌液态发酵3220[24]L(+)-乳酸38.36乳酸菌固态发酵363[23]乙醇28.60酵母菌液态发酵361.5[29]低聚糖0.006链霉菌液态发酵294.4[33]可溶性膳食纤维29.80乳酸菌液态发酵284[38]蛋白质22.95米曲霉固态发酵302[44]四环素0.006绿色链霉菌固态发酵205[34]氢气1.07产气肠杆菌液态发酵301.3[35]
1986年,YANG等[34]以甘薯渣为碳源利用链霉菌发酵生产四环素是甘薯渣首次被用于微生物发酵,四环素的产量为0.006 g/100 g干重。YOKOI等[35]以甘薯渣为原料用丁酸梭菌、产气肠杆菌反复分批发酵处理制备H2,最终H2产量为2.4 mol H2/mol葡萄糖。与H2和四环素不同,甘薯渣生产膳食纤维、蛋白质等的产量相对较高。目前,甘薯渣发酵制备膳食纤维分为固态和液态发酵2种。利用裂褶菌进行固态发酵甘薯渣制备膳食纤维,最终产物里总膳食纤维达到70.5%,可溶性膳食纤维达到15.9%[36]。邬建国等[37]利用裂褶菌液态发酵甘薯渣,其中还加入0.8%(质量分数)的麸皮使可溶性膳食纤维在总膳食纤维中的占比提高了7.6%。灵芝菌、乳酸菌等也被用于发酵生产膳食纤维,灵芝菌发酵后膳食纤维含量达到14.73 g/L,乳酸菌发酵后不溶性膳食纤维提取率为15.96%[38-39]。甘薯渣发酵生产的蛋白质主要用于提升牲畜饲料的营养价值。ABU等[40]研究发现黑曲霉发酵甘薯后,蛋白质含量增高最多。赵华等[41]通过复合菌种固态发酵甘薯渣使粗蛋白含量达到9.75%。分别用不同的复合菌种对甘薯渣发酵生产蛋白的工艺条件进行优化[42-44],优化后真蛋白含量最高达22.95%,较优化前提高了47.68%[44]。王淑军等[45]发现在进行复合菌发酵时,向甘薯渣中加入麸皮、尿素作为氮源,可使粗蛋白含量提高到42.4%。氮源有助于稳定发酵过程中的pH,对微生物合成蛋白质有一定的促进作用。
综上,大部分菌种具备利用甘薯渣为碳源发酵生产高价值产品的能力。但目前利用甘薯渣进行发酵生产存在以下问题:(1)甘薯作为季节性作物在秋季成熟,而加工产生的鲜薯渣含水量较大难以储存,这易导致生产原料的短缺。(2)甘薯渣发酵生产并未能完全利用薯渣中的有效成分,且仍会产生废渣污染环境。(3)目前利用甘薯渣生产的产品质量差异较大,缺乏相应质量标准。这些问题都导致了甘薯渣尚未能实现规模化的实际生产应用。
3 甘薯渣的其它应用
3.1 甘薯渣提取膳食纤维及果胶
甘薯渣中的膳食纤维提取后可用作食品添加剂等,它可以增加人的饱腹感、促进肠胃蠕动、吸附肠道内有害物质、改善肠道菌群,在保持人体消化系统健康中不可或缺。阎光宇等[46]用甘薯渣代替小麦粉制作面包,发现当甘薯渣膳食纤维添加量在6%时,面包的色泽、风味及面包芯的质地纹理等处于最佳状态。贾玉华等[47]的研究也证实了这一结论。利用甘薯渣制成的酸奶通过对甘薯渣量、蔗糖量、发酵剂接种量等因素的探究后发现,甘薯渣量会影响酸奶的色泽、黏稠度、口味。最优结果为甘薯渣浓度18 g/L、蔗糖浓度69 g/L、发酵剂接种体积分数3.2%,最终获得的感官平均分为88.9[48]。甘薯渣中的膳食纤维作为天然有益成分,既能改善食品营养结构、促进人体健康,还能一定程度上提高食品的风味。饼干、方便面等食品加工中都可尝试添加薯渣膳食纤维以增加薯渣纤维的利用范围。
果胶具有抑制癌细胞生长和转移、加快癌细胞凋亡的作用,甘薯渣中果胶含量十分丰富。张燕燕[49]对pH改性和热改性后的甘薯果胶进行了活性研究,发现改性后的甘薯果胶对结肠癌细胞HT-29、乳腺癌细胞Bcap-37及肝癌细胞SMMC-7721增殖的抑制作用显著提高;癌细胞的黏附程度、迁移率和uPA(尿激酶型纤溶酶原激活剂)含量也显著降低。刘倩倩[50]对超声波辅助盐法提取甘薯渣果胶进行了工艺优化。最终在提取液质量浓度3.95 g/L、提取温度66 ℃、提取时间1.7 h、超声波功率375 W、提取料液比1∶20(g∶mL)的条件下,提取率达到15.48%。以上,甘薯果胶在作为抗癌药物添加剂方面具有一定的潜力。
但甘薯渣中膳食纤维与果胶在提取纯化中存在着经济效益较低的问题。如甘薯果胶的提取目前主要有酸碱法、微波法、超声波处理法等。酸碱法提取虽然成本低、见效快,但提取的果胶品质低,生产器材难以长期使用且产生的废渣会对环境造成更大的污染。微波法和超声波处理法虽然提取效率高、质量好,但需要特殊设备导致生产成本过高难以实现大规模应用。此外,甘薯渣果胶对癌细胞的作用机理尚未完全明确。这些问题都使得甘薯渣果胶的工业化生产受到阻碍。
3.2 甘薯渣制备新型材料
甘薯渣还可用于制备具有可降解性、吸附性等性能的材料。李昭[51]利用乙酸乙烯酯和甘薯渣进行接枝,获得的接枝共聚物不仅干燥快、稳定性好且与聚乳酸的界面相容性优于甘薯渣。杨栋磊等[52]将丙烯酸与甘薯渣接枝后,以二甲基亚砜为溶剂与聚乳酸共混制备出一种新型可降解材料。利用这些可降解材料来替代传统以石油为原料的塑料制品,是解决“白色污染”问题的方法之一。甘薯渣制备的吸附材料对碱基品红和碱基块绿的吸附率最高分别为97.38%和95.84%,最大吸附量分别为37.17和16.62 mg/g。这种吸附材料对水中的Cr6+和Zn2+等金属离子也有吸附作用,且效果显著优于活性炭[53-54]。甘薯渣被用作丙烯腈表面的高分子引发剂时,在以镧粉为催化剂、溴乙酰溴化的甘薯淀粉为大分子引发剂的条件下,吸附剂对Hg2+的最大吸附量达4.03 mmol/g[55]。利用甘薯渣制备的生物吸附剂表面疏松多孔,在处理碱基块绿等污染物时具有吸附效率快、吸附容量大等优点,可以很好地用于印染废水的处理。
甘薯渣中含碳量较多,对其进行水热碳化处理后也可作为吸附材料或燃料。碳化后的甘薯渣比表面积大、内部孔隙多、表面有丰富的官能团,同样可以用于吸附印染废水中的污染物[56]。在燃料应用方面,CHEN等[57]对水热碳化甘薯渣的温度及停留时间进行了研究发现水热碳的燃点、燃烧温度、活化能随着反应温度和时间增加而增加,燃烧特性也变得更好,但水热碳的产率会变少。在水热碳化甘薯渣的过程中,水相循环可以使产量、热解开始及终止温度、热稳定性、燃烧温度以及含碳量提高,使水热碳的燃点、生产过程中排放的氮氧化物和二氧化硫的量降低。
甘薯渣制备的新型材料都尚处于实验室研究阶段。用甘薯渣生产的可降解材料及吸附材料工序复杂、成本也相对较高。且新型可降解材料仍存在稳定性不如传统塑料的问题。由于薯渣中的纤维素具有较强的水解抗力,水热碳化又较难实现。同时,薯渣碳化过程中一些参与反应的物质并不确定且会产生大量副产物,这也使得水热碳化难以得到推广。
4 结论与展望
综上所述,通过微生物发酵这一方式来提高甘薯种植的经济价值,实现甘薯产业的多样化,解决长久以来甘薯加工副产物污染环境的问题是今后研究的方向之一。在未来更加深入的研究过程中,可以考虑从以下几个方面对甘薯渣发酵生产高值化产品进行探讨:
首先,形成完整的产业链条,完善专业协作机制,形成主导产业和次生产业的联合发展。甘薯从种植到淀粉加工、薯渣发酵、产品销售。其次,可通过形成专业产业园区实现集群发展,通过扩大发酵规模减少甘薯渣的腐败,这样既可以减少运输、贮存等方面的成本,也可以提高甘薯渣的利用率。最后,还可以与其它农业废弃物结合如玉米渣、甘蔗渣等,最大化利用生产设备。
优化发酵工艺采用现代化技术控制发酵条件,并实现发酵过程的全方位监测,对发酵液中的有效成分进行更加充分的利用,并进一步减少薯渣资源的浪费。通过自动化技术降低人力资源成本的同时,避免杂菌污染的风险。
通过筛选及诱变等技术选育出甘薯渣专用菌株,使其具有高产、高适应性并可以稳定地生产与传代,缩小不同批次发酵产物在品质方面的差异,使产品可以形成统一的标准。同时,相关产品也需制定相应的国家标准、行业标准等,更加有效地规范发酵产品的品质。
希望以上几点举措能帮助解决甘薯渣发酵研究及规模化生产所面临的问题,完善我国的甘薯产业结构,推动我国甘薯产业的绿色可持续发展。
[1] Food and Agriculture Organization of the United Nations.FAOSTAT statistics database[EB/OL].[2019-03-04].http://www.fao.org/faostat/ en/#data/QC[2021-03-04].
[2] MILIND P,MONIKA.Sweet potato as a super-food[J].International Journal of Research in Ayurveda and Pharmacy,2015,6(4):557-562.
[3] 张静.甘薯淀粉生产工艺研究[D].重庆:西南大学,2018.
ZHANG J.Study on cleaner production technology of sweet potato starch[D].Chongqing:Southwest University,2018.
[4] 张彩云,何立宁,高庆辉,等.青贮饲料及其在奶牛养殖中的应用[J].今日畜牧兽医,2022,38(6):9-10.
ZHANG C Y,HE L N,GAO Q H,et al.Silage and its application in dairy farming[J].Today Animal Husbandry and Veterinary Medicine,2022,38(6):9-10.
[5] JU D,MU T H,SUN H N.Sweet potato and potato residual flours as potential nutritional and healthy food material[J].Journal of Integrative Agriculture,2017,16(11):2632-2645.
[6] SHARMA P,GAUR V K,KIM S H,et al.Microbial strategies for bio-transforming food waste into resources[J].Bioresource Technology,2020,299:122580.
[7] 冯泽宇,冯辉霞,赵丹,等.木质素的分离方法及应用研究进展[J].应用化工,2020,49(5):1245-1250.
FENG Z Y,FENG H X,ZHAO D,et al.Progress in separation methods and application of lignin[J].Applied Chemical Industry,2020,49(5):1245-1250.
[8] PAGANA I,MORAWICKI R,HAGER T J.Lactic acid production using waste generated from sweet potato processing[J].International Journal of Food Science &Technology,2014,49(2):641-649.
[9] 王树宁,冯龙斐,黄滢洁,等.甘薯残渣纤维素酶解工艺研究[J].食品研究与开发,2020,41(8):179-182.
WANG S N,FENG L F,HUANG Y J,et al.Optimization of cellulose hydrolysis from sweet potato residue by cellulase[J].Food Research and Development,2020,41(8):179-182.
[10] 韩业君,彭小伟,贾晓静,等.一种红薯渣快速酶解成单糖的方法:CN105087716B[P].2019-07-12.
HAN Y J,PENG X W,JIA X J,et al.A rapid enzymatic hydrolysis method of sweet potato residue to monosaccharide:CN105087716B[P].2019-07-12
[11] 韩业君,邱卫华.一种红薯渣高固相循环酶解制备高浓度葡萄糖的方法:CN106222212A[P].2016-12-14.
HAN Y J,QIU W H.Preparation of high concentration of glucose by high solid phase cycle enzymatic hydrolysis of sweet potato residue:CN106222212A[P].2016-12-14.
[12] SUN R C,TOMKINSON J,WANG S Q,et al.Characterization of lignins from wheat straw by alkaline peroxide treatment[J].Polymer Degradation and Stability,2000,67(1):101-109.
[13] YANG M K,ZHANG X,CHENG G.A two-stage pretreatment using dilute sodium hydroxide solution followed by an ionic liquid at low temperatures:Toward construction of lignin-first biomass pretreatment[J].Bioresource Technology Reports,2019,7:100286.
[14] 李平,余双强,曾舟华.超声波结合稀碱预处理甘薯渣的乙醇发酵制备[J].湖北农业科学,2012,51(24):5748-5751.
LI P,YU S Q,ZENG Z H.Preparation of ethanol by fermentation of ultrasonic dilute alkali pretreated sweet potato residue[J].Hubei Agricultural Sciences,2012,51(24):5748-5751.
[15] XIA J,SHU J Y,YAO K W,et al.Synergism of cellulase,pectinase and xylanase on hydrolyzing differently pretreated sweet potato residues[J].Preparative Biochemistry &Biotechnology,2020,50(2):181-190.
[16] LI X,KIM T H,NGHIEM N P.Bioethanol production from corn stover using aqueous ammonia pretreatment and two-phase simultaneous saccharification and fermentation (TPSSF)[J].Bioresource Technology,2010,101(15):5910-5916.
[17] SONG L,YANG D H,LIU R,et al.Microbial production of lactic acid from food waste:Latest advances,limits,and perspectives[J].Bioresource Technology,2022,345:126052.
[18] 朱莉莉,木泰华,马梦梅,等.甘薯渣高值化发酵转化利用研究进展[J].食品安全质量检测学报,2022,13(10):3343-3351.
ZHU L L,MU T H,MA M M,et al.Research progress on high value fermentation transformation and utilization of Ipomoea batatas Lam.residue[J].Journal of Food Safety &Quality,2022,13(10):3343-3351.
[19] ABOYEJI O O,OLOKE J K,ARINKOOLA A O,et al.Optimization of media components and fermentation conditions for citric acid production from sweet potato peel starch hydrolysate by Aspergillus niger[J].Scientific African,2020,10:e00554.
[20] BINDUMOLE V R,KIRAN K,BALAGOPALAN C.Production of citric acid by the fermentation of sweet potato using Aspergillus niger[J].Journal of Root Crops,2000,26:38-42.
[21] 刘玉婷,吴明阳,靳艳玲,等.鼠李糖乳杆菌利用甘薯废渣发酵产乳酸的研究[J].中国农业科学,2016,49(9):1767-1777.
LIU Y T,WU M Y,JIN Y L,et al.Lactic acid fermentation by Lactobacillus rhamnosus from sweet potato residue[J].Scientia Agricultura Sinica,2016,49(9):1767-1777.
[22] 沈寿国,刘献文,张洁,等.米根霉薯渣固态发酵产L(+)-乳酸的研究[J].合肥学院学报(综合版),2018,35(5):60-64;96.
SHEN S G,LIU X W,ZHANG J,et al.L(+)-lactic acid production by Rhizopus oryzae PW352 in the solid-state fermentation of sweet potato pulp[J].Journal of Hefei University (Comprehensive Ed),2018,35(5):60-64;96.
[23] 顾振新,张书玉,尹永祺,等.一种紫甘薯醋及其酿造工艺:CN102690750A[P].2012-09-26.
GU Z X,ZHANG S Y,YIN Y Q,et al.Purple sweet potato vinegar and its brewing process:CN102690750A[P].2012-09-26.
[24] LI H N,XIAO W J,LIU J S,et al.Combination strategy of laccase pretreatment and rhamnolipid addition enhance ethanol production in simultaneous saccharification and fermentation of corn stover[J].Bioresource Technology,2022,345:126414.
[25] 李永恒,苏云,崔春生,等.木薯小麦混合发酵生产燃料乙醇研究[J].企业科技与发展,2021(10):37-39.
LI Y H,SU Y,CUI C S,et al.Study on fuel ethanol production by mixed fermentation of cassava and wheat[J].Sci-Tech &Development of Enterprise,2021(10):37-39.
[26] 朱许慧.甘薯渣生料发酵生产乙醇的研究[D].天津:天津大学,2008.
ZHU X H.Study on ethanol production by raw material fermentation of sweet potato residue[D].Tianjin:Tianjin University,2008.
[27] 徐雨濛,李庆文,盛燕,等.超声波辅助Lewis酸预处理甘薯渣发酵制乙醇的工艺研究[J].湖北农业科学,2014,53(23):5820-5822;5827.
XU Y M,LI Q W,SHENG Y,et al.Preparing ethanol by fermenting sweet potato residue pretreated ultrasonic assisted Lewis acid pretreatment[J].Hubei Agricultural Sciences,2014,53(23):5820-5822;5827.
[28] 王贤,张苗,木泰华.甘薯渣同步糖化发酵生产酒精的工艺优化[J].农业工程学报,2012,28(14):256-261.
WANG X,ZHANG M,MU T H.Process optimization on alcohol production using sweet potato residue by simultaneous saccharification and fermentation method[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(14):256-261.
[29] 王楠,岳婉婷,王博,等.甘薯渣同步糖化发酵生产酒精的工艺优化[J].黑龙江科技信息,2013(25):89.
WANG N,YUE W T,WANG B,et al.Optimization of alcohol production by simultaneous saccharification and fermentation of sweet potato residue[J].Scientific and Technological Innovation,2013(25):89.
[30] 李立平,陈文秀,吴冬志,等.优化甘薯渣同步糖化发酵生产酒精工艺[J].现代食品,2016(18):96-97.
LI L P,CHEN W X,WU D Z,et al.Optimization of sweet potato residue synchronous saccharification fermentation alcohol production technology[J].Modern Food,2016(18):96-97.
[31] CATENZA K F,DONKOR K K.Recent approaches for the quantitative analysis of functional oligosaccharides used in the food industry:A review[J].Food Chemistry,2021,355:129416.
[32] 李燕.甘薯渣生物发酵制备低聚糖的研究[D].杭州:浙江农林大学,2014.
LI Y.Study on preparation of oligosaccharides from sweet potato residue by biological fermentation[D].Hangzhou:Zhejiang A &F University,2014.
[33] 王允祥,李燕,周龙,等.甘薯渣制备低聚糖发酵条件的优化[J].核农学报,2014,28(8):1392-1399.
WANG Y X,LI Y,ZHOU L,et al.Optimization of fermentation conditions for the preparation of oligosaccharides from sweet potato pomace[J].Journal of Nuclear Agricultural Sciences,2014,28(8):1392-1399.
[34] YANG S S,CHIU W F.Protease production with sweet potato residue by solid state fermentation[J].Chinese Journal of Microbiology and Immunology,1986,19(4):276-288.
[35] YOKOI H,SAITSU A,UCHIDA H,et al.Microbial hydrogen production from sweet potato starch residue[J].Journal of Bioscience and Bioengineering,2001,91(1):58-63.
[36] 刘平.固态发酵甘薯渣获取膳食纤维工艺及设备研究[D].武汉:华中科技大学,2008.
LIU P.Study on technique of producing dietary fiber by Schizophyllum commune solide state fermentation on sweet potato residue and design of bioreactor[D].Wuhan:Huazhong University of Science and Technology,2008.
[37] 邬建国,周帅,张晓昱,等.采用药用真菌液态发酵甘薯渣获得膳食纤维的发酵工艺研究[J].食品与发酵工业,2005,31(7):42-44.
WU J G,ZHOU S,ZHANG X Y,et al.Study on fermentation technic for officinal fungi to obtain dietary fiber[J].Food and Fermentation Industries,2005,31(7):42-44.
[38] 刘蔚,王征,丰来.灵芝菌发酵紫甘薯渣获得可溶性膳食纤维的工艺优化[J].食品与发酵工业,2012,38(2):131-134.
LIU W,WANG Z,FENG L.Optimization of fermentation conditions with purple sweet potato slag for soluble dietary fiber by Ganoderma lucidum[J].Food and Fermentation Industries,2012,38(2):131-134.
[39] 田亚红,刘辉.乳酸菌发酵提取甘薯渣中水不溶性膳食纤维的研究[J].食品工业,2014,35(4):20-22.
TIAN Y H,LIU H.Study on extraction of insoluble dietary fiber from sweet potato pomace by Lactobacillus[J].The Food Industry,2014,35(4):20-22.
[40] ABU O A,TEWE O O,LOSEL D M,et al.Changes in lipid,fatty acids and protein composition of sweet potato (Ipomoea batatas) after solid-state fungal fermentation[J].Bioresource Technology,2000,72(2):189-192.
[41] 赵华,王雪涛,汤加勇,等.复合益生菌固态发酵改善甘薯渣营养价值的研究[J].动物营养学报,2015,27(4):1191-1198.
ZHAO H,WANG X T,TANG J Y,et al.Nutritional improvement of sweet potato residue by solid-state fermentation with mixed microbe strains[J].Chinese Journal of Animal Nutrition,2015,27(4):1191-1198.
[42] 沈维亮,靳艳玲,丁凡,等.甘薯淀粉加工废渣生产蛋白饲料的工艺[J].粮食与饲料工业,2017(12):41-45.
SHEN W L,JIN Y L,DING F,et al.Protein feed preparation technology from sweet potato residue[J].Cereal &Feed Industry,2017(12):41-45.
[43] 夏军,章茜,袁丽亚,等.甘薯渣固态发酵生产富含赖氨酸的菌体蛋白[J].淮阴师范学院学报(自然科学版),2017,16(4):329-334.
XIA J,ZHANG Q,YUAN L Y,et al.Production of lysine enriched cell protein from sweet potato residue via solid state fermentation[J].Journal of Huaiyin Teachers College (Natural Science Edition),2017,16(4):329-334.
[44] 邢文会,付瑞敏,王丁,等.微生物发酵甘薯渣产蛋白饲料的工艺优化及对育肥猪生产性能的影响[J].江苏农业科学,2016,44(4):279-284.
XING W H,FU R M,WANG D,et al.Optimization of technology for producing protein feed from sweet potato residue by microbial fermentation and its effect on production performance of finishing pigs[J].Jiangsu Agricultural Sciences,2016,44(4):279-284.
[45] 王淑军,吕明生,王永坤.混菌发酵提高甘薯渣饲用价值的研究[J].食品与发酵工业,2002,28(6):40-45.
WANG S J,LYU M S,WANG Y K.Studies on feeding value of sweet potato waste by mixed culture[J].Food and Fermentation Industries,2002,28(6):40-45.
[46] 阎光宇,邱松林,余蕾.红薯渣膳食纤维对面包烘焙特性的影响[J].中国食品添加剂,2019,30(8):97-102.
YAN G Y,QIU S L,YU L.Effect of sweet potato waste residue fiber on baking characteristics of bread[J].China Food Additives,2019,30(8):97-102.
[47] 贾玉华,钟耀广.甘薯渣粉对小麦粉面团物化特性及面包品质的影响[J].食品工业科技,2018,39(21):81-85.
JIA Y H,ZHONG Y G.Effect of sweet potato residue flour on the physico-chemical properties of dough and the quality of bread[J].Science and Technology of Food Industry,2018,39(21):81-85.
[48] 岳瑞雪,钮福祥,孙健,等.富含甘薯膳食纤维酸奶的发酵工艺研究[J].江苏师范大学学报(自然科学版),2017,35(4):27-30.
YUE R X,NIU F X,SUN J,et al.Fermentation technology of yogurt rich in sweet potato dietary fiber[J].Journal of Jiangsu Normal University (Natural Science Edition),2017,35(4):27-30.
[49] 张燕燕.改性甘薯果胶抑制癌细胞增殖与转移活性研究[D].北京:中国农业科学院,2012.
ZHANG Y Y.Study on the effects of anti-proliferation and anti-metastasis of modified sweet potato pectins on cancer cells[D].Beijing:Chinese Academy of Agricultural Sciences,2012.
[50] 刘倩倩.甘薯渣果胶超声波辅助盐法提取工艺的优化[J].河南农业科学,2015,44(9):135-138.
LIU Q Q.Optimization of ultrasonics-assisted salt extraction technology for pectin from sweet potato residues[J].Journal of Henan Agricultural Sciences,2015,44(9):135-138.
[51] 李昭.红薯渣改性聚乳酸共混材料的性能及反应动力学研究[D].齐齐哈尔:齐齐哈尔大学,2016.
LI Z.Study on the properties and reaction kinetics of polylactic acid/modified by sweet potato residue[D].Qiqihar:Qiqihar University,2016.
[52] 杨栋磊,李昭,杨长龙.丙烯酸接枝红薯渣/PLA可降解材料的制备及性能研究[J].化工新型材料,2016,44(4):164-166.
YANG D L,LI Z,YANG C L.Preparation and property of the modified acrylic sweet potato residue/polylactic acid biodegradable material[J].New Chemical Materials,2016,44(4):164-166.
[53] 陈莉,熊晓明,李新.化学修饰甘薯渣对碱性品红的吸附特性[J].现代食品科技,2019,35(2):209-215.
CHEN L,XIONG X M,LI X.Adsorption characteristics of alkali fuchsia by sweet potato dregs by chemical modification[J].Modern Food Science and Technology,2019,35(2):209-215.
[54] 陈莉,韩甲勋,姜贞兰,等.甘薯渣生物吸附剂对碱基块绿的吸附性能[J].食品工业,2019,40(8):127-131.
CHEN L,HAN K H,JEONG R K,et al.Adsorption performance of sweet potato as a bio-adsorbent for removal of malachite green[J].The Food Industry,2019,40(8):127-131.
[55] HAO Z H,WANG D J,CHEN H,et al.Sweet potato starch residue as starting material to prepare polyacrylonitrile adsorbent via SI-SET-LRP[J].Journal of Agricultural and Food Chemistry,2014,62(8):1765-1770.
[56] 李曼菲,简子兴,何钥媚,等.活性炭吸附法在印染废水净化中的应用[J].广东化工,2019,46(16):121-122.
LI M F,JIAN Z X,HE Y M,et al.Application of activated carbon adsorption method in purification of printing and dyeing wastewater[J].Guangdong Chemical Industry,2019,46(16):121-122.
[57] CHEN X F,MA X Q,PENG X W,et al.Conversion of sweet potato waste to solid fuel via hydrothermal carbonization[J].Bioresource Technology,2018,249:900-907.