萝卜硫素,又被称为莱菔硫烷,广泛存在于十字花科蔬菜中,如西兰花、萝卜、胭脂萝卜和白菜等[1]。在十字花科植物中,硫代葡萄糖苷位于液泡中,而内源芥子酶则位于细胞内特定的蛋白体中,两者存在天然的物理隔离。当植物组织遭到破坏时,硫代葡萄糖苷与内源芥子酶接触后发生水解反应,失去一个葡萄糖基团,生成不稳定的中间体,在中性条件下,发生分子重排生成萝卜硫素[2-4]。萝卜硫素属于一种异硫代氰酸盐,常温条件下呈液态,一般为黄色或无色,极易溶于有机溶剂,在高温和碱性条件下易被分解,其分子式为C6H11S2NO,相对分子质量为177.3。萝卜硫素具有抗氧化、抑菌、抗炎症和抗衰老等作用,也是目前蔬菜中发现的抗癌效果最强的成分之一[5]。萝卜硫素可以使癌细胞发生细胞凋亡和细胞阻滞,诱导人体内的Ⅱ相解毒酶,同时抑制Ⅰ型酶的产生,最终通过多种酶体系排出致癌物和自由基等有害成分[6]。本文就萝卜硫素的抑菌、抗氧化、抗炎症和抗癌等功能进行了系统论述,并阐述其抑制机制,为萝卜硫素的研究提供理论依据。
1 抑菌功能
萝卜硫素对大肠杆菌、金黄色葡萄球菌、幽门螺杆菌等具有重要抑制作用[7]。
大肠杆菌是条件性致病菌,能够引起尿道等局部组织器官、手术部位感染,肺炎和革兰氏阴性败血症[8]。吴华彰等[9]发现萝卜硫素能影响大肠杆菌细胞膜的通透性、物质和能量代谢,并且不会直接破坏膜的完整性;萝卜硫素处理大肠杆菌16 h后,其细胞内和细胞外蛋白质总量分别下降了42.5%和17.6%,DNA和RNA数量分别下降了34.8%和48.5%,萝卜硫素显著抑制了大肠杆菌核酸和蛋白质的合成。由此可见,萝卜硫素通过影响细胞膜通透性、细胞物质和能量代谢以及抑制核酸和蛋白合成速率等方面抑制大肠杆菌,其中影响菌体核酸和蛋白合成是其主要抑菌机制。
金黄色葡萄球菌是常见的食源性致病菌,在适当的条件下,能够产生肠毒素,引起食物中毒。DERAMAUDT等[10]发现萝卜硫素预处理巨噬细胞后,可以抑制金黄色葡萄球菌诱导的编码促炎细胞因子:白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的基因转录表达。蛋白质印迹分析表明:金黄色葡萄球菌激活了p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和c-JunN-末端激酶(c-jun N-terminal kinase,JNK)信号通路,IL-1β、IL-6和TNF-α基因的转录水平依赖于p38和JNK,而萝卜硫素预处理阻止了p38和JNK磷酸化,有效地抑制了因金黄色葡萄球菌导致的食物中毒。
幽门螺杆菌会导致胃十二指肠炎,国际癌症研究机构将幽门螺旋杆菌列为第一类致癌因子[11],其能够穿透胃上皮并占据胃腔,许多临床分离株对一种或多种常规抗生素有抗性[12]。胃幽门螺旋杆菌感染表现为高脲酶活性,产生氨,中和胃酸,从而引发炎症。FAHEY等[13]将纯化的幽门螺杆菌脲酶经过萝卜硫素处理后,其在280~340 nm处的紫外吸收会发生变化,且随处理时间的延长,萝卜硫素的ITC基团和脲酶的半胱氨酸硫醇之间形成二硫代氨基甲酸酯,使脲酶活性丧失,进而减轻胃幽门螺杆菌感染的程度。
此外,萝卜硫素还对绿脓杆菌[14],空肠弯曲杆菌[15]等细菌也有明显的抑制作用。
2 抗氧化功能
生物衰老的一个显著特征是抗氧化防御机制的逐渐衰退,抗氧化防御机制对于保护细胞和组织免受氧化、化学和病理应激至关重要。萝卜硫素被证实可以在动物多个器官和组织部位产生抗氧化效果。萝卜硫素具有较高的抗氧化活性和抑制超氧阴离子能力,但对超氧阴离子的直接清除率并不高[16],说明萝卜硫素并不是一种直接的抗氧化剂,而是通过激活核转录相关因子2/抗氧化反应元件(nuclear factor erythroid 2-related factor 2/antioxidant response element,Nrf2/ARE)信号通路,刺激机体提高谷胱甘肽的生成,间接起到抗氧化作用[17]。
KUBO等[18]发现在晶状体上皮细胞老化过程中,过氧化还原酶6重组蛋白(peroxiredoxin,Prdx6)的启动子与Nrf2/ARE调控区(357/349)的结合逐渐减少,从而导致氧化作用的产生。而萝卜硫素通过增强 Prdx6表达和促进核内Nrf2易位,提高了Nrf2与DNA的结合并增加了启动子活性,恢复Prdx6的表达水平,从而实现抗氧化能力。萝卜硫素对肝脏损伤也具有一定的保护作用。例如四氯化碳引发的肝脏氧化应激反应[19],萝卜硫素可以降低肝脏中四氯化碳诱导的血清丙氨酸氨基转移酶活性,减少肝脏细胞坏死区;并且抑制脂质的过氧化,诱导Ⅱ相酶并增加谷胱甘肽含量,提高解毒水平[20]。
另外,萝卜硫素也可以通过调节机体内相应的酶活性,并且减少活性氧(reactive oxygen species,ROS)的产生,从而达到抗氧化的效果。INNAMORATO等[21]以BV2小胶质细胞作为研究对象,发现萝卜硫素对脂多糖(lipopolysaccharide,LPS)的抗氧化作用与血红素加氧酶-1(heme oxygenase 1,HO-1)诱导有关,LPS诱导BV2小胶质细胞产生ROS,造成机体细胞结构造成严重损害,而萝卜硫素能够有效铲除ROS,减轻氧化应激反应;细胞培养中,多巴胺(dopamine,DA)能细胞受到6-羟基多巴胺和四氢生物蝶呤(tetrahydrobiopterin,BH4)的毒性作用,产生DA醌类产物和氧化应激并导致DA能细胞的选择性死亡。萝卜硫素对DA能细胞死亡具有保护作用,萝卜硫素以剂量依赖的方式引起醌还原酶mRNA水平和酶活性增加,致使醌产物去除,并且萝卜硫素也减弱了BH4诱导的ROS产生、DNA片段化和膜破裂,有效保护DA能细胞免受氧化应激的影响[22]。在肾脏损伤模型中,萝卜硫素可以减轻顺铂(又名顺式-二氯二氨合铂)诱导的肾功能障碍、结构损伤、氧化/亚硝化应激等作用[23]。GUERRERO-BELTR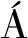 N等[24]发现萝卜硫素减少顺铂诱导的线粒体突变,以及减轻细胞保护酶——醌氧化还原酶1和γ谷氨酰半胱氨酸连接酶活性损伤,有效地阻止了顺铂诱导的活性氧增加,从而减轻肾毒性作用。
N等[24]发现萝卜硫素减少顺铂诱导的线粒体突变,以及减轻细胞保护酶——醌氧化还原酶1和γ谷氨酰半胱氨酸连接酶活性损伤,有效地阻止了顺铂诱导的活性氧增加,从而减轻肾毒性作用。
萝卜硫素还在心肌细胞[25]、大脑[26]、β细胞系[27]等器官和组织方面有着突出的抗氧化效果。
3 抗炎症作用
炎症是人体对外来损伤所产生的一种防御性反应,这种防御同样会给人带来很大的危害。炎症的局部表现为红、肿、热、痛和功能障碍,有多种因素可以引起炎症。越来越多的研究证明,萝卜硫素有很好的抗炎症特性。
萝卜硫素可激活细胞内的抗衰信号因子Nrf2,Nrf2和核因子κB(nuclear factor kappa-B,NF-κB)之间相互作用,调节多种细胞信号通路,抑制炎症或减轻炎症。NF-κB对细胞的炎症反应、免疫应答等过程起到关键性作用,NF-κB的错误调节会引发自身免疫疾病、慢性炎症,萝卜硫素通过抑制NF-κB与DNA的结合,延缓局部炎症。
萝卜硫素通过激活靶向T淋巴细胞中的GSK3β/Nrf-2和NF-κB通路发挥抗炎作用。CHECKER等[28]给小鼠腹膜内注射萝卜硫素(5 mg/kg),并在给药24 h后分离淋巴细胞。与对照小鼠相比,淋巴细胞增殖显著减少。萝卜硫素抑制淋巴细胞中有丝分裂原,诱导NF-κB核转位。当萝卜硫素加入到活化淋巴细胞的核提取物中时,萝卜硫素能够抑制NF-κB与DNA结合,达到减轻炎症的效果。这表明,萝卜硫素通过抑制GSK3β途径,导致Nrf-2活化和NF-κB抑制(图1),从而抑制T淋巴细胞介导的体内外免疫反应。

图1 萝卜硫素在 T 细胞中抗炎作用的分子机制[28]
Fig.1 Molecular mechanism of anti-inflammatory effect of sulforaphane in T cells[28]
在暴露于体外循环心脏手术(extracorporeal circulation,CPB)中,萝卜硫素预处理降低了循环单核细胞中p38和NF-κB的活化,并抑制循环白细胞中炎症细胞因子的表达[29]。萝卜硫素减轻了CPB引起的急性肾小管坏死,但它不影响肾组织中炎症信号或细胞因子的表达。表明萝卜硫素通过使白细胞中的炎症信号通路失活来保护肾脏免受CPB损伤。
萝卜硫素同样可以通过诱导Nrf2活化来缓解由于营养不良导致肌肉的炎症。SUN等[30]用萝卜硫素[2 mg/(kg·d)]治疗4周大的雄性小鼠4周。结果表明,萝卜硫素处理以Nrf2依赖的方式增加了血红素加氧酶HO-1的表达。萝卜硫素减少了小鼠的炎症,表现为肌营养不良症小鼠骨骼中,免疫细胞浸润和炎症细胞因子CD45和促炎细胞因子(肿瘤坏死因子-α、白细胞介素-1β和白细胞介素-6)的表达减少。此外,萝卜硫素治疗还以Nrf2依赖的方式降低了小鼠中NF-κB抗体p65和磷酸化IκB激酶-α的表达,并增加了κB-α表达的抑制物。表明萝卜硫素诱导的Nrf2可以通过抑制NF-κB信号通路来减轻肌营养不良症小鼠的肌肉炎症。
萝卜硫素也可以通过控制免疫细胞的表型,减少促炎功能(M1)表型细胞,增加抗炎功能(M2)表型细胞,从而减轻神经炎症。高氨血症诱导中枢神经系统中免疫细胞—小胶质细胞的活化,小胶质细胞被激活是大脑产生神经炎症的主要途径[31]。萝卜硫素通过增加了M2标记物(IL-4、IL-10、Arg 1和YM-1),减少M1表型小胶质细胞标记物,促进了小胶质细胞向M2小胶质细胞表型的转化。萝卜硫素促进了M2表型,减少了小胶质细胞的活化并使IL-1β水平正常化,从而使星形胶质细胞失活,γ-氨基丁酸转运蛋白GAT-3的膜表达及细胞外γ-氨基丁酸水平恢复正常,使γ-氨基丁酸能够进行正常的神经传递,从而恢复运动协调和学习能力。
萝卜硫素也能够有效地减轻由葡聚糖硫酸钠诱导的肠道炎症,其具体表现为减轻粪便形成和粪便出血的症状。在肠道炎症期间,通过病原体相关分子模式激活,单核细胞分化成特异性未成熟巨噬细胞,然后巨噬细胞分泌促炎细胞因子,加重炎症反应和屏障损伤[32]。萝卜硫素通过IL-10/信号转导和转录激活因子3(signal transducers trallscription 3,STAT3)信号介导的巨噬细胞表型从M1转变为M2,炎症性白细胞的释放改变,有助于炎症状态的缓解。
4 抗癌功能
癌症是一种身体细胞不受控制生长并扩散到身体其他部位的疾病,目前已经发现并公布的多达100余种癌症,其对人类的健康有着巨大威胁,其致癌作用与表观遗传失调密切相关,因此学者对防癌、抗癌方面也在不断地深入研究。研究表明,食用十字花科蔬菜可有效降低患癌的风险[33]。萝卜硫素通过调节诱导凋亡、细胞周期停滞和抑制血管生成的关键信号通路和基因表达发挥其抗癌作用。
萝卜硫素是一种天然的组蛋白去乙酰化酶抑制剂[34],萝卜硫素通过下调上游转录因子1(upstream transcription factor 1,USF1)来抑制组蛋白去乙酰化酶5(histone deacetylase 5,HDAC5),从而抑制乳腺癌的发展(图2);研究揭示了HDAC5转录的调控机制,并确定了天然生物活性HDAC抑制剂——萝卜硫素通过下调USF1抑制HDAC5转录,从而使乳腺癌细胞中的去甲基化酶1(lysine specific demethylase 1,LSD1)蛋白失稳[35]。这表明在乳腺癌治疗中,萝卜硫素联合LSD1靶向HDAC5-LSD1轴抑制剂可以增强抗肿瘤疗效和克服表观遗传失调,是一种高效可靠抗癌方式。
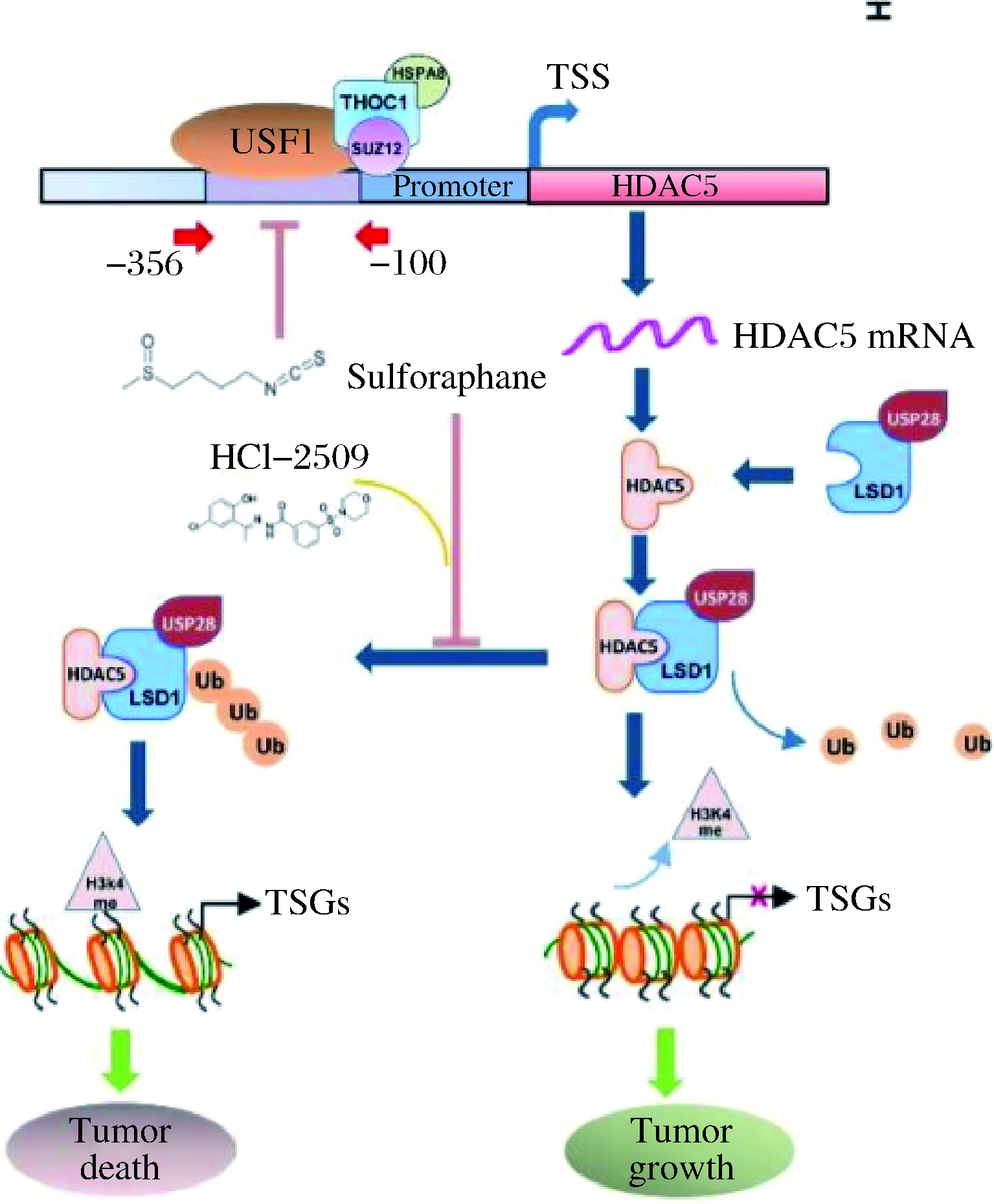
图2 HDAC5-LSD1 轴介导萝卜硫素对人类乳腺癌细胞的抗肿瘤作用模型[35]
Fig.2 Antitumor model of sulforaphane on human breast cancer cells mediated by HDAC5-LSD1 axis[35]
在肝癌细胞的相关探究中,SATO等[36]使用异种移植模型评估了萝卜硫素在“体内”的抑制作用,萝卜硫素通过下调癌基因CCND1、CCNB1、CDK1、CDK2和CCNB1的表达,显著抑制肝癌细胞增殖。同时还发现,萝卜硫素抑制人肝癌细胞系的增殖和血管生成,萝卜硫素通过刺激肝癌细胞系中的Nrf2信号级联,从而刺激肝癌细胞以阻止其增殖。
萝卜硫素能够减弱非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表皮生长因子受体(epithelial growth factor receptor,EGFR)信号通路,具有潜在的抗转移作用。WANG等[37]研究发现,萝卜硫素抑制人的非小细胞肺癌细胞株H1299、95C和95D的细胞增殖。在低浓度(1~5 μmol/L)下,能够抑制具有相对高转移潜能的95D和H1299细胞的迁移和侵袭,这是因为沉默miR-616-5p(一种基因表达的负调控因子)显著抑制体外95D细胞的迁移和侵袭以及体内NSCLC转移,而萝卜硫素通过组蛋白修饰降低miR-616-5p水平,使GSK3β/β连环蛋白信号通路失活,从而抑制上皮质间转化(epithelial-mesenchymal transition,EMT)和肺癌细胞的转移。
CHENG等[38]发现宫颈癌细胞毒性与细胞周期G2(DNA合成后期)/M(分裂后期)期的细胞积累有关,而萝卜硫素可以通过下调细胞周期蛋白B1基因表达,解离细胞周期蛋白B1/CDC2复合物,上调GADD45β蛋白,阻止细胞生长,从而延缓癌症的发展。
此外,萝卜硫素还对结直肠癌[39]、胰腺癌[40]、膀胱癌[41]等癌细胞均有抑制作用。
5 总结与展望
萝卜硫素具有抗癌、抗菌、抗炎症、抗氧化等作用,在近20年间引起了国内外学者的广泛关注。国内主要侧重萝卜硫素提取纯化的研究,而国外则更侧重于对萝卜硫素功能性的研究。本文重点叙述了萝卜硫素的抑菌、抗氧化、抗炎症、抗癌等功能性及其作用机制,为萝卜硫素的应用与科学研究提供借鉴和参考。
萝卜硫素的稳定性较低,包埋技术可以提高萝卜硫素的稳定性,可以用乳清蛋白、麦芽糊精等作为壁材进行包埋;也可以对萝卜硫素进行分子修饰提高萝卜硫素的稳定性。萝卜硫素的前体物质萝卜硫苷有着很好的热稳定性,但无抗癌活性,已有报道指出人体肠道中含有的某些微生物具有酶解萝卜硫苷的能力,因此可以通过小鼠模型对萝卜硫苷进行体内实验研究。
食用萝卜硫素对抗癌症是有效果的。然而,当使用萝卜硫素与其他药物联合使用时应谨慎考虑,某些情况下萝卜硫素会降低疗效,例如萝卜硫素上调Nrf2信号导致第Ⅱ相解毒酶的激活,从而产生抗凋亡作用,这种机制可能会潜在地降低其他药物的有效性[42]。萝卜硫素的抗菌性及抗菌活性的机制还需要深入探讨,例如探究某些代谢相关酶类的表达或活性,使得某些代谢途径被迫中断,从而影响细菌的代谢;萝卜硫素的抗氧化研究多为体外实验,而生物体内的氧化代谢极其复杂,因此萝卜硫素的体内抗氧化作用和抑菌机制仍需进一步研究。
[1] 毛舒香,王军伟,徐浩然,等.十字花科蔬菜萝卜硫素合成代谢相关基因及外源调控[J].中国细胞生物学学报,2018,40(8):1415-1423.
MAO S X,WANG J W,XU H R,et al.Anabolism relative genes and allogenic material regulation of sulforaphane in cruciferous vegetables[J].Chinese Journal of Cell Biology,2018,40(8):1415-1423.
[2] 张静,马永强,冯进,等.响应面法优化纤维素酶辅助提取西蓝花萝卜硫素工艺研究[J].食品科技,2020,45(12):188-195.
ZHANG J,MA Y Q,FENG J,et al.Optimization of the cellulose-assisted extraction technique of sulforaphane from broccoli by response surface method[J].Food Science and Technology,2020,45(12):188-195.
[3] 潘宇,吴伦清.萝卜硫素在临床营养干预中的应用研究进展[J].肠外与肠内营养,2020,27(6):372-375.
PAN Y,WU L Q.Research progress of sulforaphane in clinical nutrition intervention[J].Parenteral &Enteral Nutrition,2020,27(6):372-375.
[4] 黄忆真.西兰花种子中萝卜硫素的提取分离与微胶囊化工艺研究[D].杭州:浙江大学,2019:1-3.
HUANG Y Z.Study on extraction separation and microencapsulation of sulforaphane from broccoli seed[D].Hangzhou:Zhejiang University,2019:1-3.
[5] 邱正明,黄燕,矫振彪,等.萝卜硫代葡萄糖苷的研究进展[J].中国瓜菜,2021,34(2):1-7.
QIU Z M,HUANG Y,JIAO Z B,et al.Research progress of glucosinolates in radish[J].China Cucurbits and Vegetables,2021,34(2):1-7.
[6] 张维,李苏宜.萝卜硫素在乳腺癌、卵巢癌及宫颈癌中的潜在作用[J].肿瘤代谢与营养电子杂志,2020,7(4):391-395;376.
ZHANG W,LI S Y.The potential role of sulforaphane in breast cancer,ovarian cancer and cervical cancer[J].Electronic Journal of Metabolism and Nutrition of Cancer,2020,7(4):391-395;376.
[7] 王浩,谢庆芝.萝卜硫素治疗幽门螺杆菌感染的研究进展[J].国际医药卫生导报,2022,28(7):1021-1024.
WANG H,XIE Q Z.Research progress of sulforaphane in treatment of Helicobacter pylori infection[J].International Medicine and Health Guidance News,2022,28(7):1021-1024.
[8] LIU B,FUREVI A,PEREPELOV A V,et al.Structure and genetics of Escherichia coli O antigens[J].FEMS Microbiology Reviews,2020,44(6):655-683.
[9] 吴华彰,费鸿君,赵云利,等.萝卜硫素对大肠杆菌抑菌机制的研究[J].四川大学学报(医学版),2012,43(3):386-390.
WU H Z,FEI H J,ZHAO Y L,et al.Antibacterial mechanism of sulforaphane on Escherichia coli[J].Journal of Sichuan University (Medical Science Edition),2012,43(3):386-390.
[10] DERAMAUDT T,ALI M,VINIT S,et al.Sulforaphane reduces intracellular survival of Staphylococcus aureus in macrophages through inhibition of JNK and p38 MAPK-cinduced inflammation[J].International Journal of Molecular Medicine,2020,45(6):1927-1941.
[11] VAZIRI F,TARASHI S,FATEH A,et al.New insights of Helicobacter pylori host-pathogen interactions:The triangle of virulence factors,epigenetic modifications and non-coding RNAs[J].World Journal of Clinical Cases,2018,6(5):64-73.
[12] KIM I J,LEE J,OH S J,et al.Helicobacter pylori infection modulates host cell metabolism through VacA-dependent inhibition of mTORC1[J].Cell Host &Microbe,2018,23(5):583-593.e8.
[13] FAHEY J W,STEPHENSON K K,WADE K L,et al.Urease from Helicobacter pylori is inactivated by sulforaphane and other isothiocyanates[J].Biochemical and Biophysical Research Communications,2013,435(1):1-7.
[14] KAISER S J,MUTTERS N T,BLESSING B,et al.Natural isothiocyanates express antimicrobial activity against developing and mature biofilms of Pseudomonas aeruginosa[J].Fitoterapia,2017,119:57-63.
[15] DUFOUR V,ALAZZAM B,ERMEL G,et al.Antimicrobial activities of isothiocyanates against Campylobacter jejuni isolates[J].Frontiers in Cellular and Infection Microbiology,2012,2:53.
[16] 吴华彰,费鸿君,黄银久,等.萝卜硫素的体外抗氧化和抑菌活性[J].中国老年学杂志,2012,32(4):750-753.
WU H Z,FEI H J,HUANG Y J,et al.In vitro studies on antioxidant and antimicrobial activities of sulforaphane[J].Chinese Journal of Gerontology,2012,32(4):750-753.
[17] ZHANG Z H,QU J,ZHENG C,et al.Nrf2 antioxidant pathway suppresses Numb-mediated epithelial-mesenchymal transition during pulmonary fibrosis[J].Cell Death &Disease,2018,9(2):1-11.
[18] KUBO E R,CHHUNCHHA B,SINGH P,et al.Sulforaphane reactivates cellular antioxidant defense by inducing Nrf2/ARE/Prdx6 activity during aging and oxidative stress[J].Scientific Reports,2017,7(1):1-17.
[19] BOLL M,WEBER L W,BECKER E,et al.Mechanism of carbon tetrachloride-induced hepatotoxicity.Hepatocellular damage by reactive carbon tetrachloride metabolites[J].Zeitschrift Fur Naturforschung.C,Journal of Biosciences,2001,56(7-8):649-659.
[20] BAEK S H,PARK M,SUH J H,et al.Protective effects of an extract of young radish (Raphanus sativus L) cultivated with sulfur (sulfur-radish extract) and of sulforaphane on carbon tetrachloride-induced hepatotoxicity[J].Bioscience,Biotechnology,and Biochemistry,2008,72(5):1176-1182.
[21] INNAMORATO N G,ROJO A I,GARC A-YAGÜE A J,et al.The transcription factor Nrf2 is a therapeutic target against brain inflammation[J].The Journal of Immunology (Baltimore,Md.:1950),2008,181(1):680-689.
A-YAGÜE A J,et al.The transcription factor Nrf2 is a therapeutic target against brain inflammation[J].The Journal of Immunology (Baltimore,Md.:1950),2008,181(1):680-689.
[22] HAN J M,LEE Y J,LEE S Y,et al.Protective effect of sulforaphane against dopaminergic cell death[J].The Journal of Pharmacology and Experimental Therapeutics,2007,321(1):249-256.
[23] MAPUSKAR K A,WEN H,HOLANDA D G,et al.Persistent increase in mitochondrial superoxide mediates cisplatin-induced chronic kidney disease[J].Redox Biology,2019,20:98-106.
[24] GUERRERO-BELTR N C E,CALDER
N C E,CALDER N-OLIVER M,MART
N-OLIVER M,MART NEZ-ABUNDIS E,et al.Protective effect of sulforaphane against cisplatin-induced mitochondrial alterations and impairment in the activity of NAD(P)H:Quinone oxidoreductase 1 and γ glutamyl cysteine ligase:Studies in mitochondria isolated from rat kidney and in LLC-PK1 cells[J].Toxicology Letters,2010,199(1):80-92.
NEZ-ABUNDIS E,et al.Protective effect of sulforaphane against cisplatin-induced mitochondrial alterations and impairment in the activity of NAD(P)H:Quinone oxidoreductase 1 and γ glutamyl cysteine ligase:Studies in mitochondria isolated from rat kidney and in LLC-PK1 cells[J].Toxicology Letters,2010,199(1):80-92.
[25] CORSSAC G B,CAMPOS-CARRARO C,HICKMANN A,et al.Sulforaphane effects on oxidative stress parameters in culture of adult cardiomyocytes[J].Biomedicine &Pharmacotherapy,2018,104:165-171.
[26] LIU J X,CHANDAKA G K,ZHANG R,et al.Acute antioxidant and cytoprotective effects of sulforaphane in brain endothelial cells and astrocytes during inflammation and excitotoxicity[J].Pharmacology Research &Perspectives,2020,8(4):e00630.
[27] EGUCHI N,VAZIRI N D,DAFOE D C,et al.The role of oxidative stress in pancreatic β cell dysfunction in diabetes[J].International Journal of Molecular Sciences,2021,22(4):1509.
[28] CHECKER R,GAMBHIR L,THOH M,et al.Sulforaphane,a naturally occurring isothiocyanate,exhibits anti-inflammatory effects by targeting GSK3β/Nrf-2 and NF-κB pathways in T cells[J].Journal of Functional Foods,2015,19:426-438.
[29] NGUYEN B,LUONG L,NAASE H,et al.Sulforaphane pretreatment prevents systemic inflammation and renal injury in response to cardiopulmonary bypass[J].The Journal of Thoracic and Cardiovascular Surgery,2014,148(2):690-697.e3.
[30] SUN C C,LI S J,YANG C L,et al.Sulforaphane attenuates muscle inflammation in dystrophin-deficient mdx mice via NF-E2-related factor 2 (Nrf2)-mediated inhibition of NF-κB signaling pathway[J].The Journal of Biological Chemistry,2015,290(29):17784-17795.
[31] HERNANDEZ-RABAZA V,CABRERA-PASTOR A,TAORO-GONZALEZ L,et al.Neuroinflammation increases GABAergic tone and impairs cognitive and motor function in hyperammonemia by increasing GAT-3 membrane expression.Reversal by sulforaphane by promoting M2 polarization of microglia[J].Journal of Neuroinflammation,2016,13(1):1-13.
[32] SUN Y Y,TANG J Q,LI C,et al.Sulforaphane attenuates dextran sodium sulphate induced intestinal inflammation via IL-10/STAT3 signaling mediated macrophage phenotype switching[J].Food Science and Human Wellness,2022,11(1):129-142.
[33] MOKHTARI R B,BALUCH N,HOMAYOUNI T S,et al.The role of Sulforaphane in cancer chemoprevention and health benefits:A mini-review[J].Journal of Cell Communication and Signaling,2018,12(1):91-101.
[34] GU H F,MAO X Y,DU M.Metabolism,absorption,and anti-cancer effects of sulforaphane:An update[J].Critical Reviews in Food Science and Nutrition,2022,62(13):3437-3452.
[35] CAO C Y,WU H,VASILATOS S N,et al.HDAC5-LSD1 axis regulates antineoplastic effect of natural HDAC inhibitor sulforaphane in human breast cancer cells[J].International Journal of Cancer,2018,143(6):1388-1401.
[36] SATO S,MORIYA K,FURUKAWA M,et al.Sulforaphane inhibits liver cancer cell growth and angiogenesis[J].Annals of Behavioural Science,2018,4(2):23.
[37] WANG D X,ZOU Y J,ZHUANG X B,et al.Sulforaphane suppresses EMT and metastasis in human lung cancer through miR-616-5p-mediated GSK3β/β-catenin signaling pathways[J].Acta Pharmacologica Sinica,2017,38(2):241-251.
[38] CHENG Y M,TSAI C C,HSU Y C.Sulforaphane,a dietary isothiocyanate,induces G2/M arrest in cervical cancer cells through CyclinB1 downregulation and GADD45β/CDC2 association[J].International Journal of Molecular Sciences,2016,17(9):1530.
[39] MARTIN S L,KALA R,TOLLEFSBOL T.Mechanisms for the inhibition of colon cancer cells by sulforaphane through epigenetic modulation of microRNA-21 and human telomerase reverse transcriptase (hTERT) down-regulation[J].Current Cancer Drug Targets,2018,18(1):97-106.
[40] NAUMANN P,LIERMANN J,FORTUNATO F,et al.Sulforaphane enhances irradiation effects in terms of perturbed cell cycle progression and increased DNA damage in pancreatic cancer cells[J].PLoS One,2017,12(7):e0180940.
[41] XIE H,CHUN F K H,RUTZ J,et al.Sulforaphane impact on reactive oxygen species (ROS) in bladder carcinoma[J].International Journal of Molecular Sciences,2021,22(11):5938.
[42] 张云龙.不同形态硒、维生素E和紫萝卜提取物抗氧化协同作用研究[D].南昌:南昌大学,2015.
ZHANG Y L.The antioxidant effects of individual and combined selenium,VE,anthocyanin extracts of purple carrots[D].Nanchang:Nanchang University,2015.