细胞凋亡是一种基本的生物学现象,并广泛存在于生理、病理或生态条件下,是细胞为维持内环境稳定,由其自身基因控制的细胞主动有序结束生命的过程[1]。细胞凋亡是细胞为了更好的适应环境而死亡的一种主动过程,这种过程在生物界中普遍存在。酵母作为单细胞微生物,具有典型的真核细胞结构,其生长周期短、易于培养且遗传背景简单,被广泛用于生物技术等领域的研究[2]。高浓度乙醇和SO2、药物刺激、氧化损伤以及紫外线辐射[3]等胁迫条件均可诱导酵母细胞的凋亡。
酵母广泛应用于生物技术、食品工业过程中。在酿酒工业中,不同的阶段酵母可能会产生不同的胁迫应激,而SO2是常应用于酿酒工艺中的食品添加剂。毛江川等[4]发现啤酒酵母中SO2和乙醛的产生存在着一定的正相关。刘树文等[5]发现启动发酵的主要是非酿酒酵母,而维持发酵并最终将发酵进行到最后的主要是较耐SO2和酒精的酿酒酵母。SO2进入细胞后,溶解产生的![]() 会在细胞内发生氧化,从而产生大量的活性氧(reactive oxygen species,ROS)。随着ROS的积累,高浓度的ROS改变了细胞膜的通透性,Ca2+内流使细胞内Ca2+浓度升高,从而再次引发ROS水平的升高,高浓度的ROS以及Ca2+导致线粒体损伤及线粒体膜电位的下降,并引发细胞色素C的释放,最终诱发细胞凋亡[6]。
会在细胞内发生氧化,从而产生大量的活性氧(reactive oxygen species,ROS)。随着ROS的积累,高浓度的ROS改变了细胞膜的通透性,Ca2+内流使细胞内Ca2+浓度升高,从而再次引发ROS水平的升高,高浓度的ROS以及Ca2+导致线粒体损伤及线粒体膜电位的下降,并引发细胞色素C的释放,最终诱发细胞凋亡[6]。
为避免SO2对细胞的影响,工业上常使用实验室筛选耐SO2的酿酒酵母和商业酿酒酵母按比例混合的方式进行发酵,在酿酒酵母对数生长期添加SO2[7],或是发酵过程中降低SO2添加量的同时严格控温[8-9]。然而,耐SO2的酿酒酵母对比商业酵母稳定性较低,且有概率影响酿酒终产物的生理指标[10],酿酒酵母的对数生长期会随着原料、环境等因素随时变化,这种不稳定性对大规模生产有极其不利的影响,降低SO2的添加意味着需要更多的成本用来控制氧化和微生物问题,增加了工业经营的成本。
想投入工业生产必然对性价比有着极高的要求,褪黑素广泛存在于植物体内,可通过生物萃取、临界CO2法[11]或高产褪黑素酿酒酵母[12]大量生产,且保存条件较为宽松,保存时间长、稳定性好[13],极低的浓度便可对酿酒酵母产生保护作用。研究发现,外源褪黑素可以显著降低酵母中海藻糖和甘油的代谢生成量,且低浓度的褪黑素可以提高酵母超氧化物歧化酶、过氧化氢酶活性,减少丙二醛的积累[14]。褪黑素及其代谢物是广谱抗氧化剂和自由基清除剂,它们在不同病理生理情况下调节多种分子途径,例如细胞炎症、增殖、凋亡和转移[15]。有研究发现,中低浓度的褪黑素会诱导酵母提高超氧化物歧化酶、过氧化氢酶等抗氧化相关酶活性增加,并减少丙二醛的产生[14]。说明外源褪黑素可以使细胞适应逆境胁迫的能力更强,提升细胞在逆境环境的生存活性。
目前尚无关于褪黑素对SO2胁迫下酵母细胞产生影响的研究,因此本文在SO2胁迫下考察了褪黑素对酵母细胞凋亡产生的影响。该研究在酿酒工业生产中具有重要的实际生产意义,为酿酒过程的优化提供了思路。
1 材料与方法
1.1 材料
1.1.1 菌种
酿酒酵母(Saccharomyces cerevisiae)AWRIR2,澳大利亚Marivin公司。
1.1.2 试剂
褪黑素标品,纯度99.9%,Solarbio(北京);葡萄糖、果糖、KH2PO4、MgSO4·7H2O、CaCl2、(NH4)2SO4、DNS 试剂、二乙酸荧光素(fluorescein diacetate,FDA)溶液、碘化丙锭(propidium iodide,PI)等试剂均为国产分析纯。高效液相的标样购自Sigma,色谱纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):蛋白胨20,葡萄糖20,酵母膏10,用HCl溶液调pH至3.5,121 ℃灭菌20 min,冷却备用。
1.2 实验方法
1.2.1 SO2浓度的确定
在GB 5009.34—2022《食品安全国家标准 食品中二氧化硫的测定》文件中规定,SO2可用于葡萄酒、果酒等的最大使用量不应超过0.25 g/kg,工业生产从干白到甜酒常使用的范围为40~180 mg/L[16-17],故本实验的SO2研究范围在0~300 mg/L。为了确定SO2的处理浓度,设置不同质量浓度梯度的偏重亚硫酸钾(0、100、150、175、200、225、250、275、300 mg/L),其中SO2的有效浓度为50%。将活化后的酵母接种到100 mL含有不同浓度SO2的YPD培养基中。每隔2 h用紫外分光光度计在OD600下测吸光值,绘制生长曲线。
1.2.2 酵母菌的培养及药物处理
酵母菌接种于YPD培养基中,28 ℃、120 r/min摇床培养至对数中后期,进行酵母的活化富集。
根据王成等[18]的前期研究,选取0.01、1、100 mg/L的褪黑素质量浓度,进行了1~5 mg/L的预实验,预实验发现在质量浓度>2 mg/L时,再加大褪黑素浓度对细胞活性发酵几乎不产生影响,故本研究选取的质量浓度为2 mg/L。
按照表1设置不同的发酵体系,将活化后的酵母转接到不同体系中,28 ℃、120 r/min摇床培养至细胞对数中后期。之后加入确定浓度的偏重亚硫酸钾溶液应激反应1 h。
表1 发酵体系
Table 1 Fermentation system
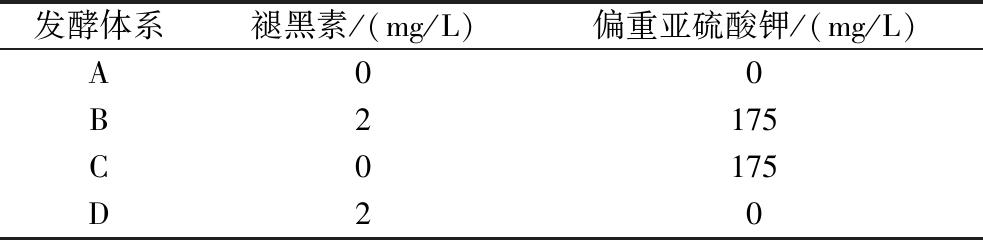
发酵体系褪黑素/(mg/L)偏重亚硫酸钾/(mg/L)A00B2175C0175D20
1.2.3 细胞存活率的测定
采用美蓝染色法对细胞存活率进行测定[19]。酵母细胞处理后取样,在血球计数板上统计染色细胞和总细胞数目。按公式(1)计算细胞存活率:
细胞存活率/%=活细胞数/细胞总数×100
(1)
1.2.4 细胞内线粒体膜电位的测定
采用罗丹明123染色细胞检测细胞内线粒体的膜电位水平,用于检测的细胞浓度保持在106~107 CFU/mL[20]。取菌液1 mL,4 ℃、8 000 r/min离心10 min,弃掉上清液。加入1 mL PBS洗涤并悬浮细胞,再次在同样条件下离心10 min,弃掉上清液后加入1 mL PBS悬浮细胞。加入罗丹明123,使之工作质量浓度为10 μg/mL,30 ℃避光孵育30 min,流式细胞仪检测细胞内线粒体的膜电位水平。
1.2.5 细胞色素C的测定
取酵母菌悬液1.5 mL于2 mL离心管中,4 ℃、8 000 r/min离心10 min,弃掉上清液;加入0.5 mL PBS悬浮细胞,再加入0.5 mL 0.145 mol/L的三氯乙酸溶液,振荡提取10 min后用浓度1 mol/L的NaOH溶液调至pH为6.0,10 000 r/min离心10 min,所得上清液即为细胞色素C的待测液。取1 mL待测液,在避光条件下用PBS稀释至5 mL,每管加入微量连二亚硫酸钠,摇匀后于波长520 nm下测定吸光值,将数据代入标准曲线公式计算浓度。
细胞色素C标准曲线的制作:取1 mL细胞色素C标准品,用0.2 mol/L的PBS(pH 7.3)稀释至10 mL,分别取0.5、1、1.5、2、2.5 mL于试管中,用PBS分别定容至5 mL,每支试管中加入微量连二亚硫酸钠,以保证所有细胞色素C都转变为还原型,振荡摇匀,以加入微量连二亚硫酸钠的PBS为空白对照,在波长520 nm下测定吸光值[21]。以细胞色素C标准品的浓度为横坐标,吸光值为纵坐标绘制标准曲线。
1.2.6 酵母细胞内ROS水平的测定
参考赵仁亮等[22]的方法,荧光指示剂,即ROS荧光探针,2′,7′-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)染色后利用流式细胞仪检测细胞内ROS水平。用于检测的细胞浓度应保持在106~107 CFU。SO2处理后收集各发酵体系酵母细胞,用PBS洗涤并悬浮,加入DCFH-DA(5 μmol/L),30 ℃避光孵育30 min,用流式细胞仪检测细胞内ROS水平[23]。
1.2.7 酵母生长活力的测定
参考曹国珍等[24]的方法,测定应激(添加SO2)和无应激(未添加SO2)条件下酵母细胞的生长活力。采用96孔板,每个孔中加入250 μL未接种的YPD培养基,取不同发酵体系中酵母悬液20 mL,按顺序分别加入到孔中,以未接种的YPD培养基作为对照。在28 ℃、120 r/min的条件下培养,每小时使用酶标仪在OD600 nm下测量吸光值,绘制不同应激处理后酵母的生长曲线并判断酵母活力。
1.3 数据处理
采用Origin 2018数据软件进行统计与分析,Adobe Photoshop CS辅助作图。所有实验数据均为3次重复实验。
2 结果与分析
2.1 SO2对酵母细胞生长的影响
通过绘制酵母细胞生长曲线比较不同浓度SO2对酵母细胞的胁迫作用,选择作用明显但未完全抑制酵母细胞生长的浓度作为处理浓度。由图1可以看出,当添加的偏重亚硫酸钾为100和150 mg/L时,与对照组菌液相比,前8 h生长情况没有区别,8 h后酵母细胞生长量略低于对照,无明显差异。当处理质量浓度>200 mg/L时,酵母的生长一直处于延滞期,说明酵母细胞受到高浓度SO2的抑制造成无法生长繁殖。而当处理质量浓度为175 mg/L,酵母生长受到明显抑制,但仍能缓慢生长,因此选取偏重亚硫酸钾的工作质量浓度为175 mg/L作为应激条件。
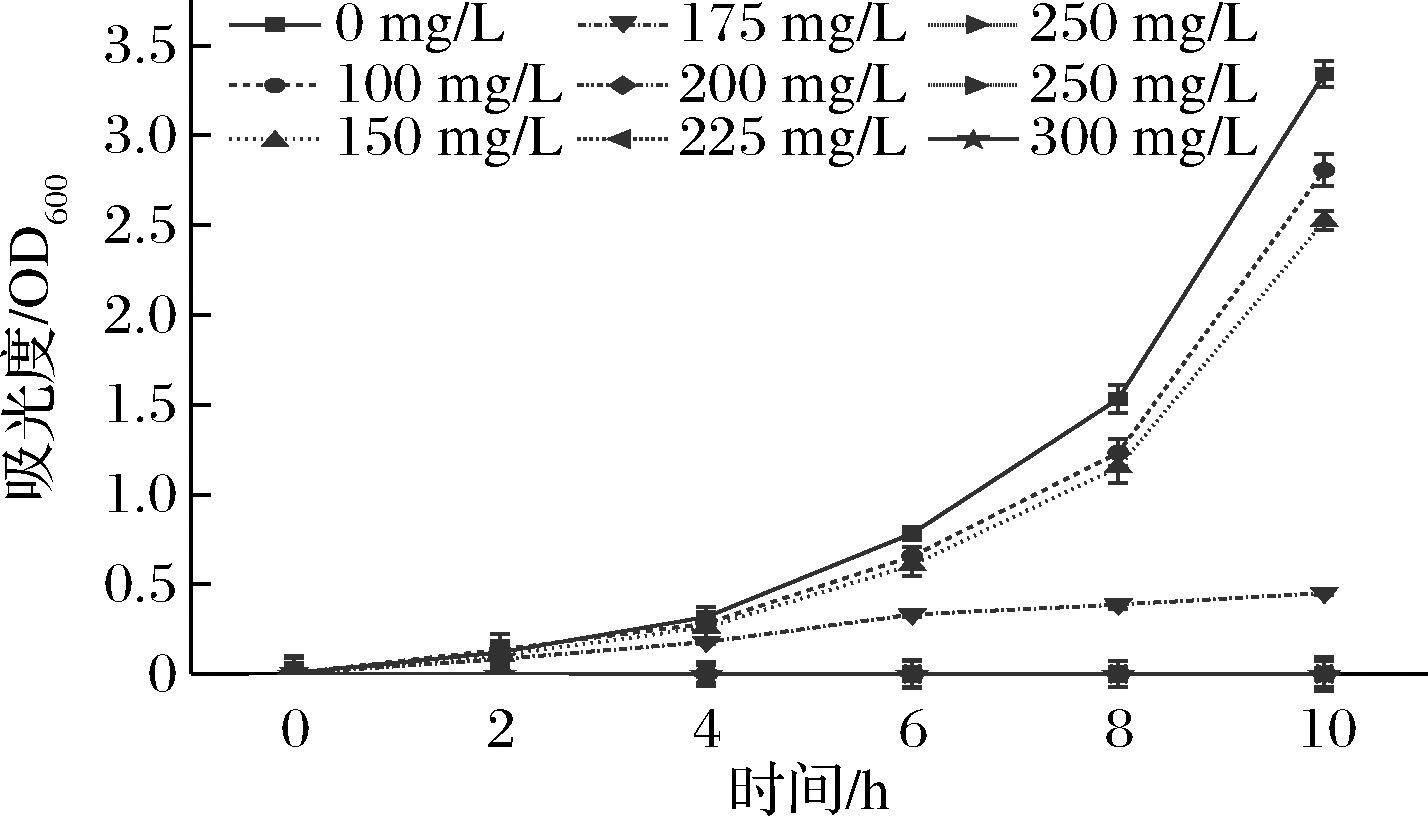
图1 不同SO2浓度对酵母生长的影响
Fig.1 Effect of SO2 concentration on growth of yeast
2.2 酵母细胞存活率分析
如表2所示,A、B、C和D组酵母菌存活率分别为93.33%、95.03%、87.30%和95.68%。与对照组(A组)相比,C组细胞存活率明显下降,说明SO2作用于酵母细胞后引起酵母细胞一定程度的凋亡;只添加褪黑素的发酵体系中(D组)酵母菌液细胞活菌数和存活率均提高,说明褪黑素对细胞有保护作用。比较B组和C组,添加褪黑素的体系中活菌数明显增多,且存活率明显提高;但活菌数和存活率仍低于A组和D组。由数据可以判断,SO2会引起酵母细胞的凋亡,而褪黑素可以在SO2胁迫条件下对酵母细胞的凋亡起到缓解作用,具有一定的保护效应。
表2 不同发酵体系中酵母活菌数及存活率
Table 2 Yeast viable count and survival rate in various fermentation systems

组别活菌数/(107CFU/mL)存活率/%A13.9993.33B12.6495.03C9.6087.30D14.1295.68
2.3 酵母细胞内ROS水平分析
研究发现ROS可使细胞质膜钙通道被激活,引起胞内Ca2+增加,随后出现细胞死亡现象[25]。研究发现SO2可引起细胞内ROS水平升高,一旦细胞内氧化还原系统被破坏,便可激活下游的蛋白酶,进而诱导细胞凋亡[26]。
DCFH-DA是一种通用的氧化应激指示剂,其具细胞膜渗透性,本身无荧光。一旦进入细胞后,被细胞酯酶水解生成2′,7′-二氯二氢荧光素(2′,7′-dichlorofluorescein,DCF),之后被快速氧化生成强荧光产物DCF,普遍用来监测细胞氧化还原过程[27]。用流式细胞仪对DCFH-DA染色后酵母细胞的荧光强度进行检测,分析不同处理组酵母细胞内ROS水平,结果如图2所示。仅用SO2和褪黑素处理后的酵母菌液荧光强度分别为182和140,与对照组(荧光强度145)相比,分别升高了25.52%和降低了3.45%。说明SO2可以明显提高酵母中ROS水平,进而诱导细胞凋亡,这与王智波[26]的研究结果一致。添加褪黑素后再用SO2处理组(B)的酵母菌液荧光强度为143,比仅用SO2处理的酵母菌液荧光强度降低了21.43%,与对照组无明显差异,说明褪黑素对SO2引起的酵母细胞凋亡有抑制作用。
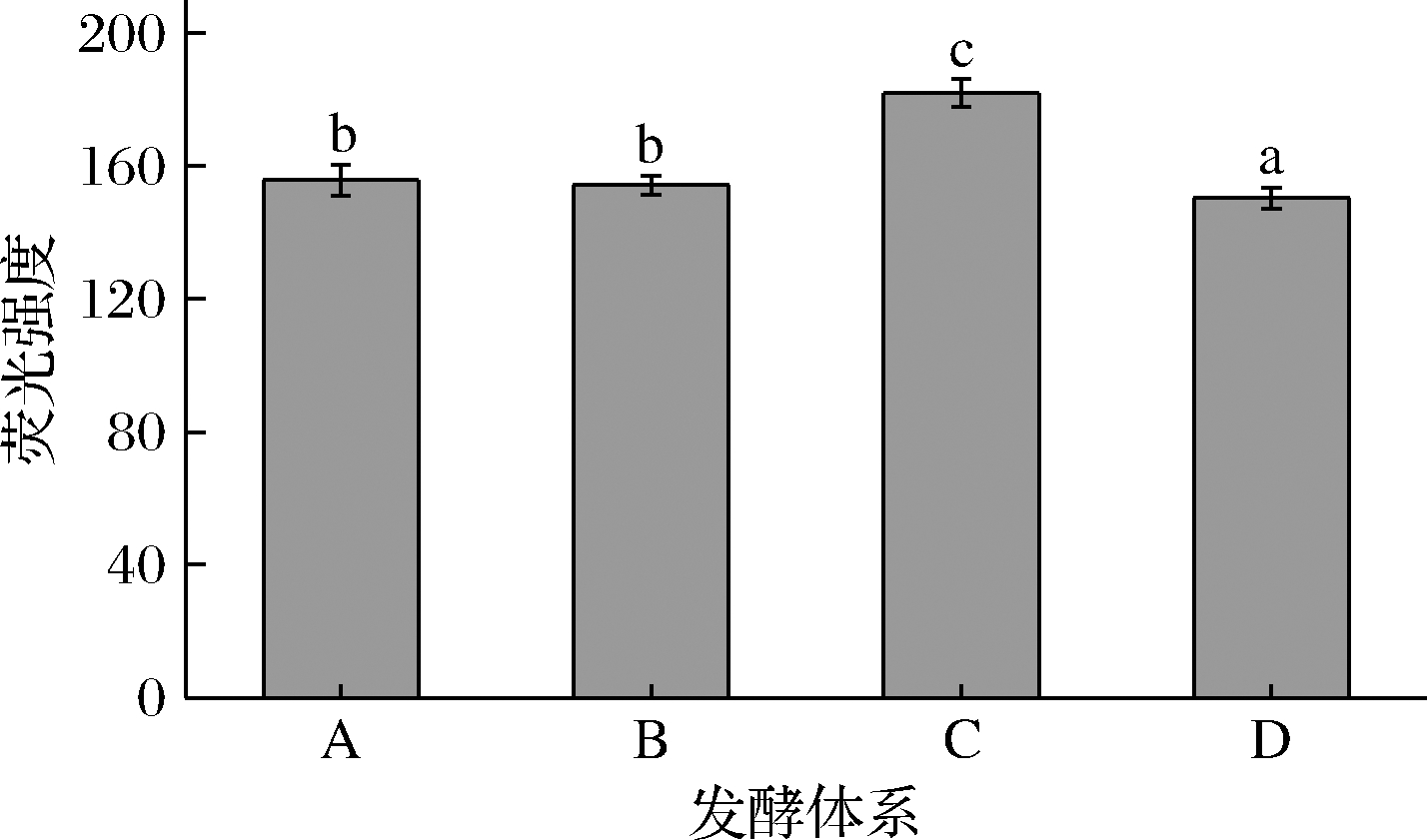
图2 实验各组酵母的ROS荧光强度
Fig.2 ROS fluorescence intensity in various fermentation systems
注:组间不同小写字母表示差异显著(P<0.05)(下同)。
2.4 酵母细胞内线粒体膜电位水平的变化
细胞凋亡是由其自身基因控制的细胞主动有序结束生命的过程,而线粒体在细胞凋亡的过程中起着重要的作用。线粒体由两层膜包被,线粒体呼吸链在传递电子的过程中可将H+从线粒体内膜基质泵至膜外,从而使内膜两侧产生电势差,即线粒体膜电位[28],以维持线粒体的正常功能。而当细胞受到外界刺激时,离子和呼吸链底物在线粒体内膜两侧达到动态平衡,质子梯度消失,导致线粒体功能障碍,进而导致细胞调亡。
罗丹明123是一种常用的荧光染料,可以快速通过细胞膜对胞内线粒体的阳离子进行染色,呈现为黄绿色荧光,常在细胞凋亡中用作检测线粒体膜电位的荧光探针[29]。新陈代谢作用旺盛的活细胞所呈现的荧光信号较强,而死细胞或新陈代谢作用弱的细胞荧光强度较弱或不呈现荧光。本实验用流式细胞仪检测染色后不同体系中酵母细胞的荧光强度。图3中对照组(A)的荧光强度为185,处理组B、C、D的荧光强度为178、145、190。与对照组相比,仅用SO2处理后的酵母菌液(C组)荧光强度降低21.62%,仅用褪黑素处理后的菌液荧光强度提高2.7%。而与B组比较,C组液荧光强度降低了22.76%。膜电位的结果与细胞存活率的结果一致,说明SO2引起酵母细胞凋亡,荧光强度减弱,而褪黑素对SO2诱导的酵母细胞有一定的保护作用,使酵母死亡率降低。
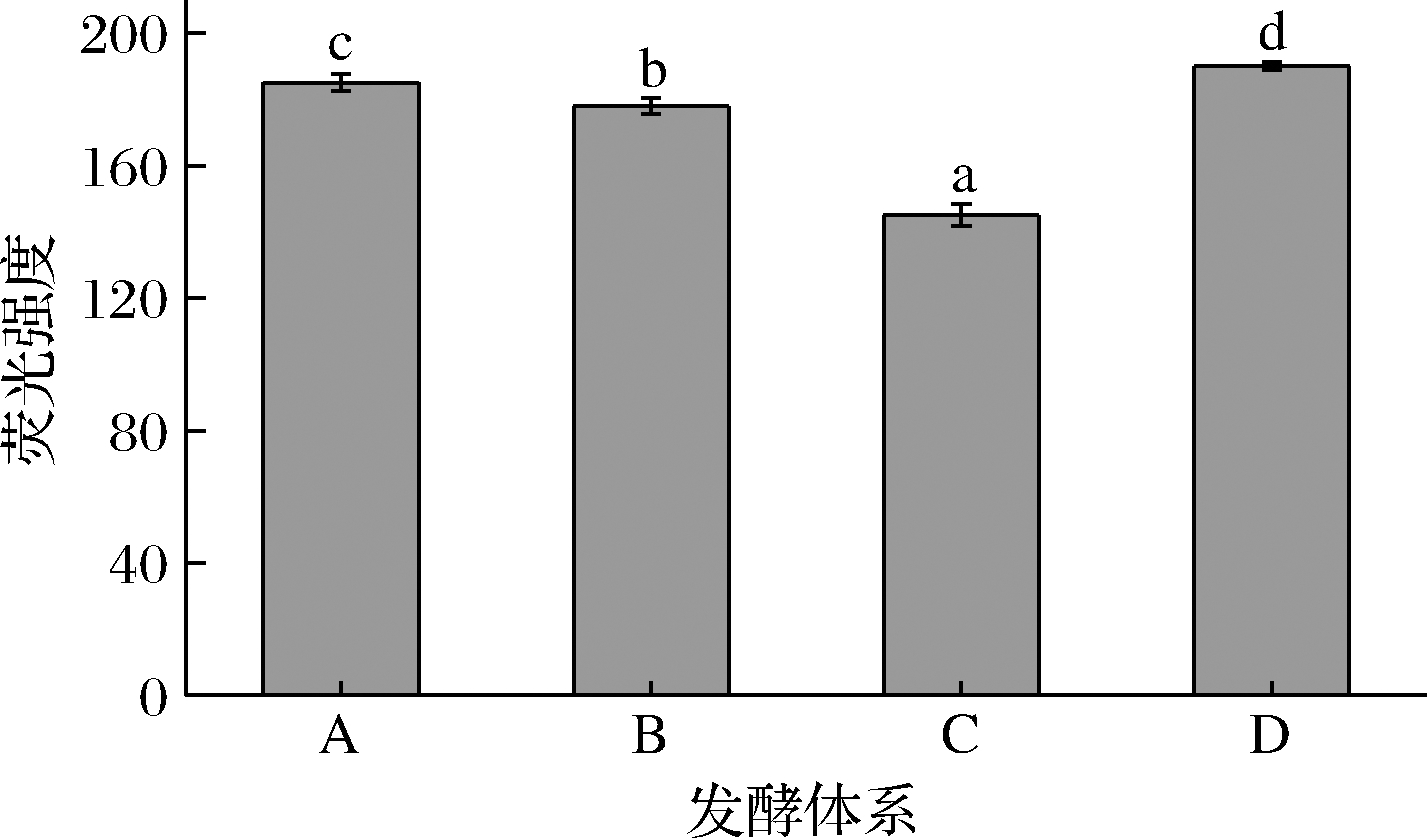
图3 实验各组酵母细胞内线粒体膜电位水平的ROS荧光强度
Fig.3 ROS fluorescence intensity of mitochondrial membrane voltage in various fermentation systems
2.5 酵母细胞内细胞色素C水平的变化
细胞色素C是一种以血红素为辅基的蛋白,是线粒体呼吸链的重要组成部分,可以在呼吸链中传递电子[30]。当细胞受到刺激时,细胞色素C从线粒体膜间隙中释放到胞质中,与凋亡蛋白酶活化因子形成多聚体,使之活化。进而激活下游的凋亡效应组,核酸酶进入细胞核水解核酸及细胞骨架蛋白,导致细胞凋亡。因此不同凋亡程度的细胞中细胞色素C的含量不同。
如图4所示,对照组(A组)测得细胞色素C质量浓度为0.013 9 g/L,仅用SO2处理过的菌液(C组)测得细胞色素C质量浓度为0.023 1 g/L,含量提高了66.2%,说明SO2明显造成酵母的凋亡。仅用褪黑素处理的菌液(D组)测得细胞色素C质量浓度为0.012 g/L,含量比对照组降低,说明褪黑素对酵母有保护作用。添加褪黑素后再用SO2处理的菌液(B组)测得细胞色素C质量浓度为0.012 8 g/L,与D组的含量无显著差异,但比C组的浓度有明显降低,降低了44.59%说明褪黑素对SO2引起的酵母细胞凋亡有明显的抑制作用。
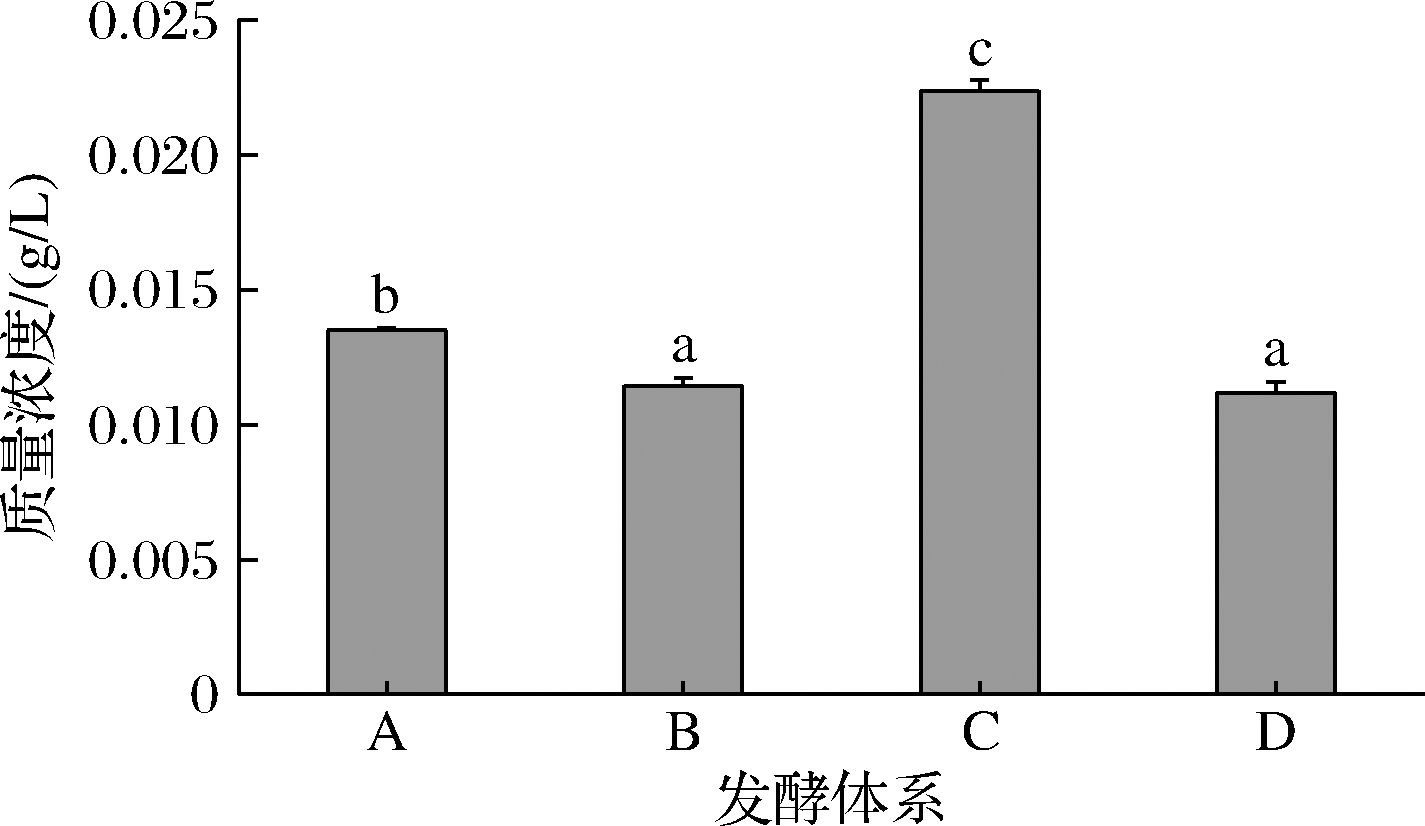
图4 实验各组菌液细胞色素C浓度
Fig.4 Cytochrome C concentration in various fermentation systems
2.6 酵母细胞生长活力的测定
处理后的各组菌的生长曲线如图5所示。与对照组(A组)相比,仅用SO2处理的菌体(C组)的生长曲线有了较为明显的降低,说明处理后的细胞活力减弱。褪黑素培养后再用SO2处理的菌体(B组)再生长的曲线与对照的生长曲线无明显差异,可以推断利用褪黑素培养的酵母活力有较明显的提高,可以缓解SO2引起的活力下降。
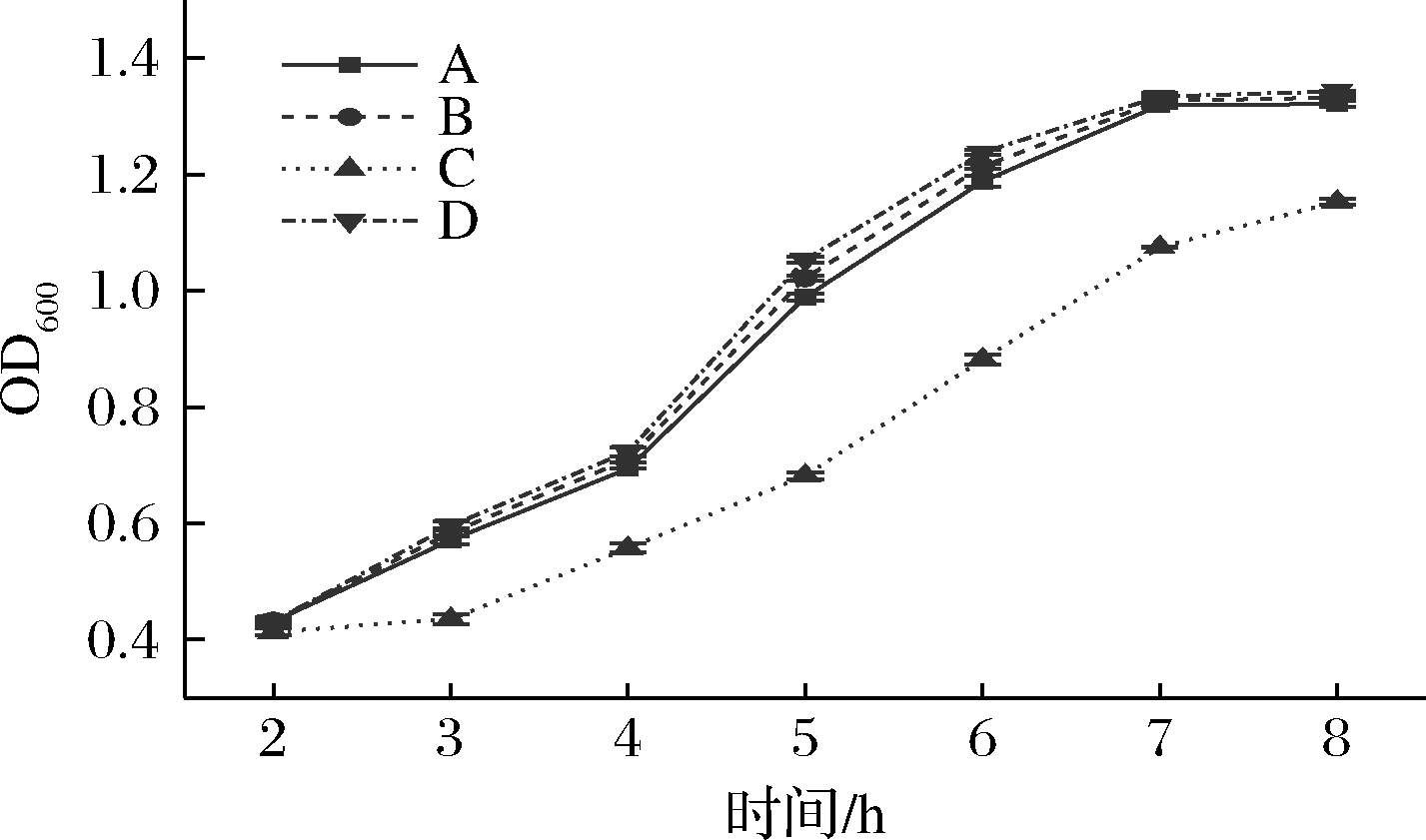
图5 实验各组酵母生长曲线
Fig.5 The growth curve of yeast in various fermentation systems
3 结论与讨论
先前研究表明,酵母细胞的凋亡可受到化学因素和物理因素如环境、渗透压等的外源因素诱导[31]。本实验以SO2作为应激条件去诱导酵母细胞凋亡,通过添加褪黑素后测定酵母细胞存活率、线粒体膜电位水平、细胞色素C的浓度以及细胞活力,研究褪黑素对SO2诱导的酵母细胞凋亡的影响。结果表明,在SO2的作用下,利用褪黑素处理的菌液与未处理的菌液相比,细胞存活率提高了7.73%;胞内ROS的荧光强度降低了21.43%;线粒体内膜电位的荧光强度提高了22.76%;细胞色素C浓度降低了44.59%;可以推断在胁迫条件下,添加褪黑素后酵母细胞生长活力有所提高,说明SO2引起的酵母细胞凋亡受到了褪黑素的抑制。
天然植物及其提取物例如白藜芦醇和甘草多糖等因多样性功能、无毒性、可持续等诸多优点而成为研究热点。武晓英等[32]研究表明玫瑰花提取物可以有效地缓解砷对酵母细胞的损伤,极显著地提高了砷胁迫下酵母细胞的生长率和存活率,玫瑰花提取物的添加对正常酵母细胞无害,但对砷胁迫下的酵母细胞起到了积极的损伤修复作用。本研究中褪黑素同时对正常细胞和SO2胁迫下的酵母起到了积极的作用,说明褪黑素与玫瑰花提取物具在损伤修复活动上有相似的作用。
细胞凋亡有2种途径,分别是外在的死亡受体途径和内在的线粒体途径。在细胞凋亡中起决定性作用的是线粒体,线粒体是多种促进细胞调亡信号转导分子的靶点[33]。在外界环境对细胞有胁迫作用时,线粒体膜脂质发生过氧化且细胞内自由基水平升高;或当胞内Ca2+超载时,线粒体受损且线粒体膜通透性转换孔开放,最终导致膜电位下降,细胞释放细胞色素C从而激活下游的蛋白酶,引发细胞凋亡。
本研究结果表明,当SO2胁迫酵母细胞时,细胞中ROS水平上升,线粒体膜电位下降,细胞质中的细胞色素C含量显著升高。而添加褪黑素后,相应的检测指标变化水平都有所减弱。因此推测褪黑素和SO2均是通过线粒体途径来影响酵母细胞凋亡。研究结果显示,酵母细胞经SO2处理后胞内ROS水平升高,其原因可能是细胞内氧化还原平衡被破坏,使得胞内自由基水平升高,这可能是引起酵母细胞死亡的一个原因。褪黑素及其代谢产物都有强大的清除自由基的能力,可诱导相关的抗氧化酶活性增强。刘玉清等[34]研究表明,500 μmol/L浓度的褪黑素能防止脂质过氧化引起的线粒体膜流动性降低,能防止生物膜的脂质过氧化损伤。本实验中当加入褪黑素后,SO2的致死效应显著降低,说明褪黑素可以降低SO2引起的自由基增高,进而缓解酵母细胞死亡。
胞外Ca2+向细胞内流在诱导细胞死亡过程中起重要作用,本研究发现发酵体系中加入SO2后,线粒体膜电位下降,细胞色素C含量上升,这可能是SO2进入细胞后激活质膜上的Ca2+通道,从而使Ca2+内流引起的。当加入褪黑素后,膜电位及细胞色素C变化幅度减少。有研究表明褪黑素可以减少细胞色素C从线粒体内向胞浆转移[35],减少细胞凋亡而保护线粒体功能,从而延缓小鼠的心肌衰老。因此推测褪黑素在酵母细胞中也可以起到相同的作用,延缓了细胞的凋亡。
RODRIGUEZ-NARANJO等[36]认为,褪黑素是酿酒酵母在发酵过程中产生,并可在细胞外界环境改变时起到保护细胞正常生理活动的作用。本研究发现褪黑素可以减缓酿酒过程中SO2对酵母细胞造成的损伤,SO2又是实际生产中酿酒常用的化学添加剂,以此为基础在酿酒生产过程中分析并建立发酵过程中褪黑素对不同胁迫损伤的保护效应提供了实验思路,具有重要的生产意义。
[1] 杨晓菁,姚红军,王玉凤.哺乳动物卵母细胞凋亡的研究进展[J].动物学杂志,2004,39(6):101-106.
YANG X J,YAO H J,WANG Y F.Advances in the research of oocyte apoptosis in mammals[J].Chinese Journal of Zoology,2004,39(6):101-106.
[2] 杨国华,马光喜.国内生物分子学技术应用于酿酒酵母的研究进展[J].酿酒科技,2014(11):77-80+83.
YANG G H,MA G X.Domestic research progress in the application of molecular biology technology to Saccharomyces cerevisiae[J].Liquor-Making Science &Technology,2014(11):77-80;83.
[3] 杨东升,朱丽元,谢晓红,等.UV处理筛选耐高浓度乙醇酿酒酵母菌株[J].中国酿造,2010,29(10):35-38.
YANG D S,ZHU L Y,XIE X H,et al.Screen of ethanol tolerance strains Saccharomyces cerevisiae mutated by ultraviolet radiation[J].China Brewing,2010,29(10):35-38.
[4] 毛江川,王金晶,郑飞云,等.蛋氨酸、半胱氨酸及苏氨酸对啤酒酵母产二氧化硫和乙醛的影响[J].食品与发酵工业,2019,45(9):67-73.
MAO J C,WANG J J,ZHENG F Y,et al.Effects of methionine,cysteine,and threonine on sulfur dioxide and acetaldehyde production from beer yeast[J].Food and Fermentation Industries,2019,45(9):67-73.
[5] 刘树文,王玉霞,陶怀泉,等.SO2和酒精处理对葡萄酒自然发酵酵母菌群的影响[J].西北农林科技大学学报(自然科学版),2008,36(5):196-200;205.
LIU S W,WANG Y X,TAO H Q,et al.Influence of SO2 and alcohol treatments on wine yeast floras during grape must spontaneous fermentation[J].Journal of Northwest A&F University (Natural Science Edition),2008,36(5):196-200;205.
[6] 侯颖,马文瑞,程雅文,等.聚赖氨酸偶联活性氧诱导酿酒酵母细胞凋亡[J].食品科学,2020,41(10):81-87.
HOU Y,MA W R,CHENG Y W,et al.Apoptosis of Saccharomyces cerevisiae induced by ε-poly-L-lysine combined with reactive oxygen species[J].Food Science,2020,41(10):81-87.
[7] ONETTO C,KUTYNA D,KOLOUCHOVA R,et al.SO2 and copper tolerance exhibit an evolutionary trade-off in Saccharomyces cerevisiae[J].PLoS Genet.2023,19(3):e1010692
[8] 张鑫.大曲清香白酒地上控温发酵工艺探索[J].酿酒,2015,42(4):48-53.
ZHANG X.Exploration of aboveground temperature-controlled fermentation process of Daqu of Fen flavor liquor[J].Liquor Making,2015,42(4):48-53.
[9] 俞然,张彦聪,周晓芳,等.白起泡葡萄酒发酵工艺的优化[J].食品研究与开发,2022,43(10):166-171.
YU R,ZHANG Y C,ZHOU X F,et al.Optimization of fermentation technology for white sparkling wine[J].Food Research and Development,2022,43(10):166-171.
[10] 刘灿珍,董书甲,姜凯凯,等.5株非酿酒酵母的耐受性及发酵特性研究[J].中国酿造,2017,36(10):42-46.
LIU C Z,DONG S J,JIANG K K,et al.Tolerance and fermentation characteristics of 5 non-Saccharomyces[J].China Brewing,2017,36(10):42-46.
[11] 赵少杰,叶盛英,欧春凤,等.超临界CO2法制备褪黑素脂质体的工艺优化[J].农业工程学报,2014,30(3):251-258.
ZHAO S J,YE S Y,OU C F,et al.Technology optimization of melatonin liposome using supercritical CO2[J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(3):251-258.
[12] 秦伟帅,姚玉新,张娜,等.一株高产褪黑素的葡萄酿酒酵母及其应用:CN112899176B[P].2022-04-29.
QIN W S,YAO Y X,ZHANG N,et al.A Saccharomyces cerevisiae with high yield of melatonin and its application,CN112899176B[P].2022-04-29.
[13] 达里奥·阿库纳·卡斯特罗维霍,杰曼·埃斯卡梅斯·罗莎,帕布洛·布埃诺·拉朗诺,等.呈现长期稳定性的褪黑素注射剂的持久制剂:CN114392228A[P].2022-04-26.
DARIO A C,JAMAN E R,PABLO B L,et al.Persistent preparations of melatonin injection with long-term stability,CN114392228A[P].2022-04-26.
[14] AVCIL S,UYSAL P,YENISEY Ç,et al.Elevated melatonin levels in children with attention deficit hyperactivity disorder:Relationship to oxidative and nitrosative stress[J].Journal of Attention Disorders,2021,25(5):693-703.
[15] TORDJMAN S,CHOKRON S,DELORME R,et al.Melatonin:Pharmacology,functions and therapeutic benefits[J].Current Neuropharmacology,2017,15(3):434-443.
[16] 祝霞,刘琦,赵丹丹,等.干白葡萄酒增香酿造工艺参数优化[J].农业工程学报,2019,35(18):282-291.
ZHU X,LIU Q,ZHAO D D,et al.Parameter optimization aroma enhancement fermentation technology of dry white wine[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(18):282-291.
[17] 张军,张彦聪,韩焱,等.一种柠檬椰香型甜酒的酿造方法:CN110872548A[P].2020-03-10.
HANG J,ZHANG Y C,HAN Y,et al.A brewing method of lemon coconut sweet wine,CN110872548A[P].2020-03-10.
[18] 王成,战吉宬,刘兴艳,等.外源褪黑素对酿酒酵母发酵及抗氧化体系的影响[J].现代食品科技,2015,31(4):102-108;227.
WANG C,ZHAN J C,LIU X Y,et al.Effect of exogenous melatonin on ethanol fermentation and antioxidant activity of Saccharomyces cerevisiae[J].Modern Food Science and Technology,2015,31(4):102-108;227.
[19] 金佳美,张宇辉,陈明,等.原子力声显微镜评价超声靶向微泡破坏法对大鼠心肌母细胞的影响[J].中国超声医学杂志,2013,29(10):929-933.
JIN J M,ZHANG Y H,CHEN M,et al.Assessment of effect of ultrasound targeted microbubble destruction on rat myocardial cells by atomic force acoustic Microcope[J].Chinese Journal of Ultrasound in Medicine,2013,29(10):929-933.
[20] SHEN M,CAO Y,JIANG Y,et al.Melatonin protects mouse granulosa cells against oxidative damage by inhibiting FOXO1-mediated autophagy:Implication of an antioxidation-independent mechanism[J].Redox Biology,2018,18:138-157.
[21] 韩晓霞,张海静,李俊博,等.一种基于过渡金属纳米材料特异性还原细胞色素c的方法:CN108659118A[P].2018-10-16.
HAN X X,ZHANG H J,LI J B,et al.A method for specific reduction of cytochrome C based on transition metal nanomaterials.CN201810288598.7[P].2018-10-16.
[22] 赵仁亮,王春霞.细胞凋亡的检测方法[J].医学综述,2002,8(3):130-131.
ZHAO R L,WANG C X.Detection method of apoptosis[J].Medical Recapitulate,2002,8(3):130-131.
[23] 李少平.流式细胞仪在医学真菌研究中的应用[J].国外医学(微生物学分册),1999,22(5):20-21;27.
LI S P.Application of flow cytometry in the study of medical fungi[J].Foreign Medicine(Microbiology Section),1999,22(5):20-21;27.
[24] 曹国珍,陆栋,张苗苗,等.X-射线辐照对酿酒酵母细胞线粒体膜电位的影响[J].辐射研究与辐射工艺学报,2015,33(1):15-21.
CAO G Z,LU D,ZHANG M M,et al.Effects on mitochondrial transmembrane potential of Saccharomyces cerevisiae by X-ray irradiation[J].Journal of Radiation Research and Radiation Processing,2015,33(1):15-21.
[25] FEISSNER R F,SKALSKA J,GAUM W E,et al.Crosstalk signaling between mitochondrial Ca2+ and ROS[J].Frontiers in Bioscience (Landmark Edition),2009,14(4):1197-1218.
[26] 王智波.线粒体呼吸链活性氧产生的动力学及细胞色素c过氧化氢歧化酶活性[D].北京:中国科学院生物物理研究所,2003.
WANG Z B.Kinetics of reactive oxygen species production in mitochondrial respiratory chain and cytochrome c hydrogen peroxide dismutase activity[D].Beijing:Institute of Biophysics,Chinese Academy of Sciences,2003.
[27] 周全,黄国阳,徐伟刚.细胞活性氧荧光探针研究现状[J].军事医学,2018,42(1):72-76.
ZHOU Q,HUANG G Y,XU W G.Current development of fluorescent probes for cellular reactive oxygen species[J].Military Medical Sciences,2018,42(1):72-76
[28] 陈鄑先,许彩民,潘华珍.线粒体与细胞凋亡[J].解剖学报,2000,31(3):285-287.
CHEN J X,XU C M,PAN H Z.Mitochondria and apoptosis[J].Acta Anatomica Sinica,2000,31(3):285-287.
[29] 邹汉法.毛细管电泳-激光诱导荧光联用在单细胞水平上测定K562/S细胞体积[C].郑州:第十五次全国色谱学术报告会文集,2005.
ZOU H F.Determination of K562/S cell volume by capillary electrophoresis combined with laser-induced fluorescence at single cell level[C]//Proceedings of the 15th National Symposium on Chromatography(Book below).Zhengzhou,Henan,China:Publishers unknown,2005.
[30] 邓育琼,张穗盈,黄杏兰,等.线粒体细胞色素C氧化酶I的研究进展[J].国际免疫学杂志,2020,43(6):677-682.
DENG Y Q,ZHANG S Y,HUANG X L,et al.Research progress of mitochondrial cytochrome C oxidase I[J].International Journal of Immunology,2020,43(6):677-682.
[31] 姜俏,林琳,汪天虹.研究细胞凋亡的新模式生物:酵母[J].生物化学与生物物理进展,2008,35(4):361-367.
JIANG Q,LIN L,WANG T H.A new model for apoptosis research:Yeast[J].Progress in Biochemistry and Biophysics,2008,35(4):361-367.
[32] 武晓英,李博,吴丽华,等.玫瑰花提取物对砷胁迫下酵母细胞凋亡抑制的研究[J].激光生物学报,2020,29(4):325-332.
WU X Y,LI B,WU L H,et al.The effect of rose extract on inhibition yeast cell apoptosis under arsenic stress[J].Acta Laser Biology Sinica,2020,29(4):325-332.
[33] RODRIGUEZ-NARANJO M I,GIL-IZQUIERDO A,TRONCOSO A M,et al.Melatonin is synthesised by yeast during alcoholic fermentation in wines[J].Food Chemistry,2011,126(4):1608-1613.
[34] 刘玉清,刘静,郭剑英,等.褪黑素对内毒素血症山羊肝线粒体自由基代谢的影响[J].中国兽医科学,2007,37(9):6-8.
LIU Y Q,LIU J,GUO J Y,et al.Effect of melatonin on liver mitochondrial free radical metabolism in goats with endotoxemia[J].Veterinary Science in China,2007,37(9):6-8.
[35] 张波,付春芳,张明远.雌激素对大鼠主动脉组织细胞色素C、线粒体Ca2+、胞浆游离Ca2+水平的影响[J].黑龙江医药科学,2006,29(4):67-68.
ZHANG B,FU C F,ZHANG M Y.Effects of estrogen on cytochrome C,mitochondrial Ca2+ and cytoplasmic Ca2+ levels in rat aorta[J].Heilongjiang Medicine and Pharmacy,2006,29(4):67-68.
[36] RODRIGUEZ-NARANJO M I,GIL-IZQUIERDO A,TRONCOSO A M,et al.Melatonin is synthesised by yeast during alcoholic fermentation in wines[J].Food Chemistry,2011,126(4):1608-1613.