乳清酸,又称维生素B13,是嘧啶核糖核苷酸从头生物合成途径的中间产物,因此常作为5-氟尿嘧啶、胸腺嘧啶等核苷酸和嘧啶衍生化合物的前体物质[1-2]。不仅如此,乳清酸还广泛应用于医药、食品保健、饲料和化妆品等领域。例如:乳清酸在治疗黄疸性肝病及防治冠心病具有较好疗效[3],被添加至儿童营养食品中有益于身体发育。作为许多化妆品的有效成分,乳清酸还具有延缓细胞衰老,促进新陈代谢等功效。随着人们对乳清酸功能研究的逐渐深入,其市场需求还在不断扩大。当前工业化生产乳清酸的方式主要还是化学法和微生物发酵法,但化学法制备乳清酸的工艺存在使用危险试剂、操作繁琐和原料成本高等缺点,而微生物发酵法可有效克服这些问题,成为代替化学法的首选[4]。
早在20世纪60年代初,日本通过筛选尿嘧啶营养缺陷型突变株进行微生物发酵从而实现发酵法制备乳清酸的工业化[5],但目前国内大多数企业还未能利用微生物发酵法工业生产乳清酸,造成这种局面的主要原因就是乳清酸产量及转化率还处于一个较低水平,无法达到工业化要求。探究合适的发酵培养基且对菌株进行发酵条件优化是提升乳清酸发酵水平的有效方法之一[6]。B族维生素是生物体内多种关键酶的辅酶因子,适量的外源添加可有效增强酶的活力,促进菌体生长[7]。苏跃稳[8]通过对培养基中部分B族维生素添加量的优化,进而提高了L-苏氨酸的产量;孙鹏杰等[7]通过探究培养基中5种B族维生素最佳添加量,有效提高了枯草芽孢杆菌产腺苷能力。
本研究以前期实验室构建的乳清酸高产菌株大肠杆菌Ora-6为实验菌株,在原培养基配方的基础上,添加不同浓度梯度的维生素B1、维生素B3、维生素B5、维生素B6、维生素B7、维生素B12作为变量进行单因素实验,探究以上6种B族维生素对乳清酸发酵生产的影响。随后通过正交试验对6种B族维生素最佳添加量进行优化分析。在以上优化培养基条件下进行5 L发酵罐验证试验,以达到提升大肠杆菌乳清酸发酵能力的目标。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌(Escherichia coli)Ora-6[4],天津科技大学代谢工程实验室保藏菌种。
1.1.2 培养基
斜面培养基(g/L):葡萄糖2,蛋白胨10,酵母浸出粉5,NaCl 2.5,KH2PO4 1,MgSO4 0.2,琼脂粉25,高压蒸汽锅灭菌121 ℃,20 min。
种子培养基(g/L):葡萄糖30,酵母粉8,蛋白胨2,MgSO4·7H2O 0.5,KH2PO4 3,蛋氨酸2,(NH4)2SO4 2,尿苷0.5,微量元素混合液1 mL/L,高压蒸汽锅灭菌115 ℃,15 min。
发酵培养基(g/L):葡萄糖10,谷氨酸2,酵母粉6,KH2PO4 6.0,MgSO4·7H2O 1.5,FeSO4·7H2O 40 mg/L,(NH4)2SO4 2,尿苷0.2,微量元素混合液1 ml/L,高压蒸汽锅灭菌115 ℃,15 min。
上述微量元素混合液(mg/L):钼酸铵0.28,硼酸5,CoC12·6H2O 1.4,MnSO4·H2O 0.5,CuSO4·7H2O 0.5,ZnSO4·7H2O 0.6。将上述成分称量固体后溶解于1 L水中,在4 ℃保存[4]。
1.1.3 试剂
蛋白胨、酵母粉,均为生化试剂,英国Oxoid公司;MgSO4·7H2O、FeSO4·7H2O、(NH4)2SO4、KH2PO4,均为分析纯,天津市光复科技发展有限公司;NaCl(分析纯),天津市登峰化学制剂厂;一水合葡萄糖(食品级),天津金汇太亚化学试剂有限公司;蛋氨酸(食品级)、NaH2PO4、Na2HPO4,均为色谱纯,上海阿拉丁生化科技股份有限公司;谷氨酸(分析纯),天津希恩思生化科技有限公司;乳清酸(分析纯),上海麦克林生化科技有限公司;维生素B1、维生素B3、维生素B5、维生素B6、维生素B7、维生素B12(≥98%),国药集团化学试剂有限公司;乙腈(色谱纯),国药集团化学制剂有限公司。
1.2 仪器与设备
SBA-40E生物传感分析仪,山东省科学院生物研究所;LDZH-100KBS立式压力蒸汽灭菌器,驰通仪器(上海)有限公司;UV1800系列紫外分光光度计,上海菁华科学仪器有限公司;5 L不锈钢机械搅拌发酵罐,上海保兴生物设备工程有限公司;Agilent 1200高效液相色谱仪,美国Agilent Technologies;JADE-PAK® ODS-AQ C18高效液相色谱柱(5 μm,250 mm×4.6 mm),广州太玮生物科技有限公司。
1.3 实验方法
1.3.1 菌种培养与发酵
摇瓶发酵:取-80 ℃保藏试验菌株大肠杆菌Ora-6划线接种于活化斜面,37 ℃培养12 h。刮取2环活化后种子接种于种子培养基中,36 ℃,200 r/min培养10 h。之后,按15%接种量将种子液转接到发酵培养基中,36 ℃,220 r/min振荡培养,发酵过程中手动补加氨水维持pH在7.0~7.2;添加600 g/L葡萄糖溶液维持发酵进行[4]。
5 L发酵罐发酵:取-80 ℃保藏试验菌株大肠杆菌Ora-6划线接种于活化斜面,37 ℃培养12 h后转接至茄形瓶中继续培养12 h;取适量无菌水于茄形瓶中,将菌悬液接入种子培养基中继续培养,pH维持在7.0~7.2,温度恒定在36 ℃,溶氧在30%~60%;待种子菌体量(OD600)达到25左右,按照20%接种量将种子液接入新鲜的发酵培养基,定容至3 L。发酵过程中pH稳定控制在7.0~7.2,温度维持在36 ℃,溶氧在30%~60%;发酵过程中流加800 g/L的葡萄糖溶液维持发酵[4]。过程中每2 h取样3~5 mL发酵液进行测样,pH通过蠕动泵流加氨水维持。
1.3.2 试验方法
1.3.2.1 B族维生素添加量优化单因素试验
在培养基其他成分不变的情况下(维生素B1、维生素B3、维生素B5、维生素B12的原始添加量为3 mg/L、维生素B6和维生素B7的原始添加量分别为2 mg/L和2.5 mg/L),分别控制维生素B1、维生素B3、维生素B5、维生素B12的添加量为0、2、4、6、8 mg/L进行培养基单因素发酵试验;维生素B6的添加量控制为0、1.5、3、4.5、6 mg/L进行培养基的单因素试验,维生素B7的添加量控制为0、1、2、3、4 mg/L进行培养基的单因素试验,以探究不同种类及不同浓度的B族维生素对菌体量(以OD600表示)、乳清酸发酵产量及糖酸转化率的影响。
1.3.2.2 B族维生素添加量优化正交分析试验
单因素试验基础上,设置L25(56)正交试验设计,以探究以上6种B族维生素的最佳添加量及试验组合,正交试验因素与水平见表1。
表1 B族维生素添加量优化正交试验因素与水平 单位:mg/L
Table 1 Factors and levels of orthogonal experiment for optimizing the addition of B vitamins
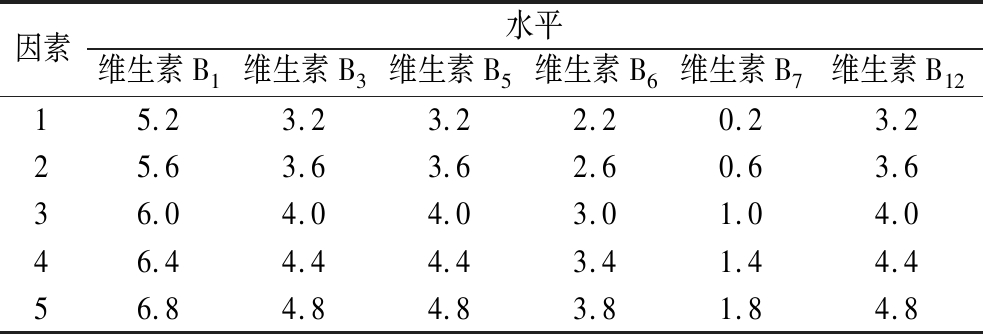
因素水平维生素B1维生素B3维生素B5维生素B6维生素B7维生素B1215.23.23.22.20.23.225.63.63.62.60.63.636.04.04.03.01.04.046.44.44.43.41.44.456.84.84.83.81.84.8
1.3.2.3 5 L发酵罐中B族维生素添加方式优化试验
添加方式和方案见表2。
表2 B族维生素组合添加量的添加方式
Table 2 The way of adding the combination of B vitamins

添加方式添加方案A在底物中一次性添加全部量的B族维生素B初始在底物添加总量的30%,发酵10、20h时分别添加总量的35%C初始在底物添加总量的30%,发酵10h开始以0.15g/(L·h)的速度持续流加含总量70%的水溶液
1.3.3 检测方法
发酵过程中pH、温度、溶氧、罐压、通风量、菌体量、残糖测定方法参考文献[7]的方法。
乳清酸产量检测:振荡混匀待测发酵液,吸取适量发酵液加入100 mL容量瓶中,去离子水稀释定容,13 000 r/min离心2 min,吸取上清液过0.22 μm滤膜,进样。
高效液相色谱检测:流动相,V[磷酸盐缓冲液(1.884 g/L Na2HPO4、0.726 g/L NaH2PO4)]∶V(乙腈)=97∶3。操作条件,使用ODS-AQ C18高效液相色谱柱(5 μm,250 mm×4.6 mm),柱温30 ℃,紫外检测波长282 nm,流动相流速1.0 mL/min。
1.3.4 糖酸转化率计算
糖酸转化率按公式(1)计算:
糖酸转化率![]()
(1)
式中:ρ,乳清酸质量浓度,g/L;V,发酵液总体积,L;m,总耗糖质量,g。
每个试验数据取3次平行试验的均值。参照文献[7]的方法进行数据处理。
2 结果与分析
2.1 单因素试验
2.1.1 维生素B1添加量优化单因素试验
由图1可知,维生素B1对乳清酸产量和糖酸转化率影响显著,空白组[ρ(维生素B1)=0]的乳清酸产量和转化率仅有19.56 g/L、16.5%,原始对照组[ρ(维生素B1)=3 mg/L]的产量和转化率为23.25 g/L、20.01%。随着维生素B1添加量的逐渐增加,乳清酸产量和糖酸转化率有明显的提升,且在6 mg/L添加量时达到最高,为26.10 g/L、22.09%,较空白组分别提高了33.43%和33.62%,较对照组分别提高了12.25%和10.39%。但当添加量增长至8 mg/L时,乳清酸产量和转化率趋于平稳。维生素B1是重要的生长因子,参与糖代谢和氨基酸代谢等过程,是α-酮戊二酸脱氢酶等关键酶的辅酶[9-10]。对于乳清酸的生物合成途径,前体物谷氨酰胺与天冬氨酸的代谢流均来自于三羧酸(tricarboxylic acid,TCA)循环,而丙酮酸脱氢酶在TCA循环中是关键的限速酶。分析可知,随着辅酶维生素B1含量增加,可能导致丙酮酸脱氢酶活性被极大加强,更多的代谢流会流入TCA循环,从而加大乳清酸合成途径前体物的积累,进而促进乳清酸合成,提高转化率。当辅酶维生素B1添加量>6 mg/L时,推测其已达到催化上限,所以对乳清酸产量及转化率影响较小。出于经济性考虑,故选择维生素B1最佳添加量为6 mg/L。
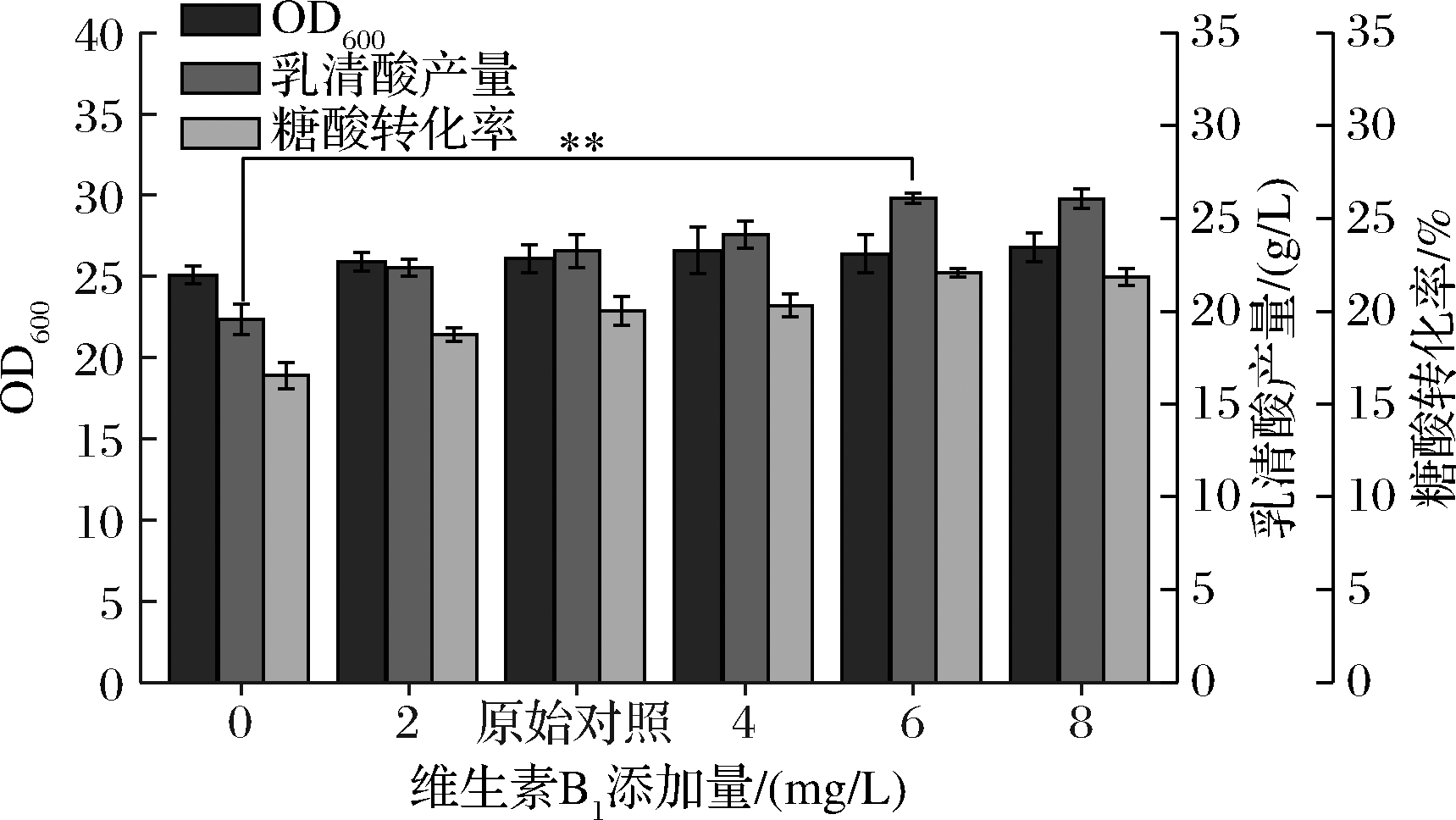
图1 不同维生素B1添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.1 Effects of different VB1 additions on biomass,orotic acid production and sugar-acid conversion rate
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)(下同)。
2.1.2 维生素B3添加量优化单因素试验
由图2可知,维生素B3对菌体生长、乳清酸产量和糖酸转化率都有一定程度影响,空白组[ρ(维生素B3)=0]的OD600值、产量和转化率分别为25.2、20.59 g/L、17.22%,随着维生素B3添加量的增加,菌体量也随之提升,且在8 mg/L时达到最高,此时OD600为30.5,较空白组提高了21.03%;乳清酸产量和糖酸转化率也随添加量增加有明显的提升,且在4 mg/L添加量时,乳清酸产量和转化率达到最高,为25.30 g/L、21.41%,较空白组分别提升了22.89%和24.31%,较原始对照组[ρ(维生素B3)=3 mg/L]分别提高了8.8%和7.0%,但随着维生素B3添加量≥6 mg/L时,乳清酸产量出现轻微下降趋势,而转化率下降更加显著。维生素B3是辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD,辅酶Ⅰ)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP,辅酶Ⅱ)的重要前体[11],在细胞生命活动中参与其中的氧化过程,起到氢传递的作用,同时还促进细胞氧化呼吸[12],所以推测其对菌体的生长具有促进作用。同时,NADH是TCA循环中3种限速酶的共同辅因子,且起到电子传递的作用[13-14]。随着维生素B3添加量提升,TCA循环会大大加强,乳清酸合成途径前体物也会随之积累,进而促进乳清酸合成,转化率也会随之提高;但当维生素B3添加量≥6 mg/L时,乳清酸产量和转化率开始下降,且转化率下降趋势较大,推测维生素B3过多添加会加强菌体呼吸代谢,促进菌体生长,但伴随着其他副产物增多,导致合成乳清酸途径变弱,转化率也随之大幅下降。所以选择维生素B3的最佳添加量为4 mg/L。
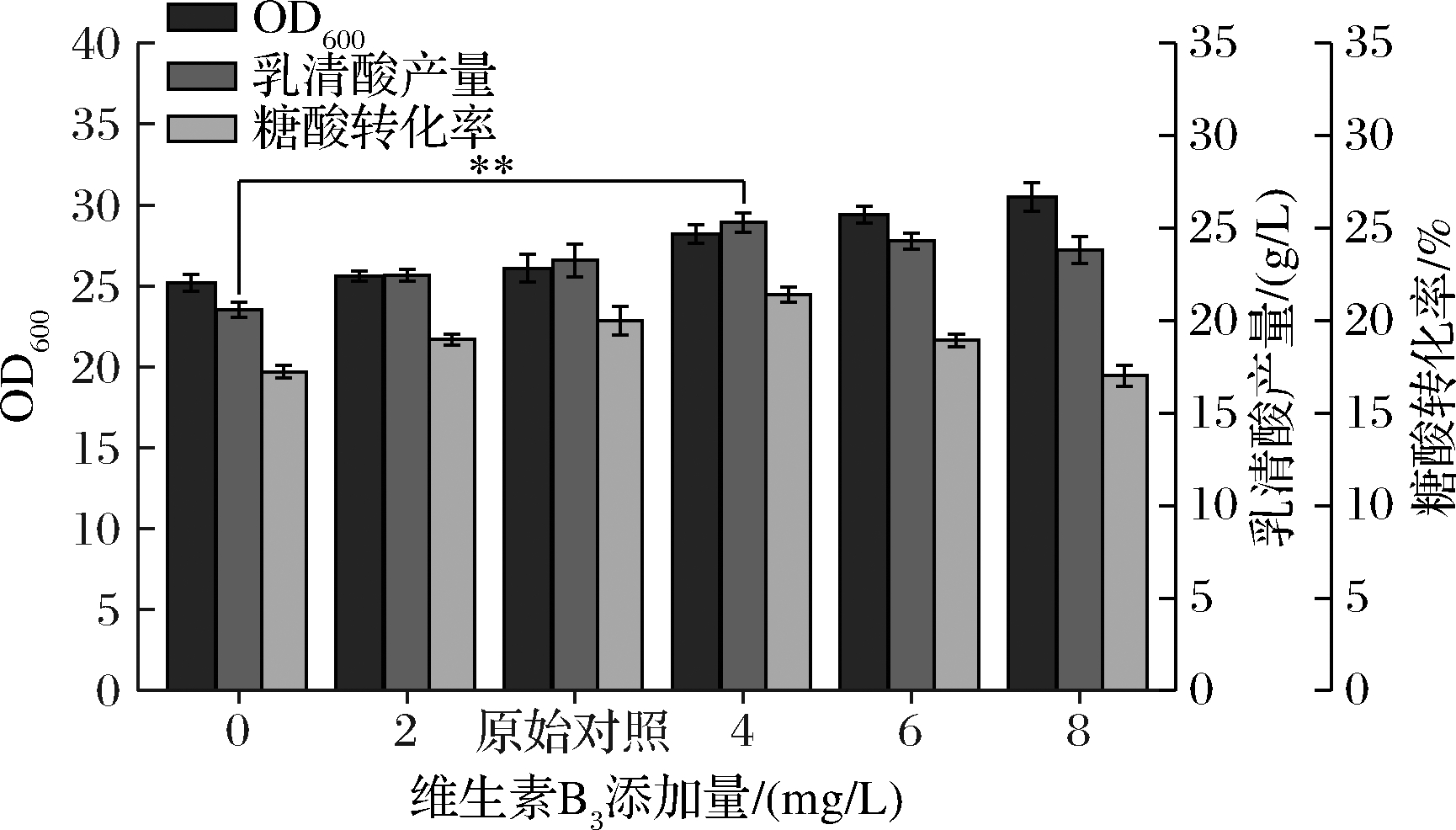
图2 不同维生素B3添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.2 Effects of different VB3 additions on biomass,orotic acid production and sugar-acid conversion rate
2.1.3 维生素B5添加量优化单因素试验
由图3可知,随着维生素B5添加量的增加,菌体量呈上升趋势,在8 mg/L添加量时,OD600达最高值,为29.3,较空白组提高了21.07%;乳清酸产量和糖酸转化率也随添加量增加有明显的提升,且在添加量为4 mg/L时,乳清酸产量和转化率达到最高,为25.50 g/L、21.58%,较空白组分别提高了28.05%和29.11%,较原始对照组[ρ(维生素B5)=3 mg/L]分别提高了9.67%和7.85%,但当ρ(维生素B5)≥6 mg/L时,乳清酸产量和转化率呈大幅下降趋势。维生素B5是NAD、NADH2和NADP、NADPH2的重要组成成分[15],除此之外,维生素B5的活性形式辅酶A是各类酰化反应中的辅助因子,参与糖代谢和氨基酸代谢,不仅如此,辅酶A还参与细菌构建细胞壁过程[16-17],因此推测VB5对菌体生长有促进作用;当ρ(维生素B5)≥6 mg/L时,可能会导致菌体活力过高,造成摇瓶内供氧不足而导致产量和转化率下降。综上,选择维生素B5的最佳添加量为4 mg/L。
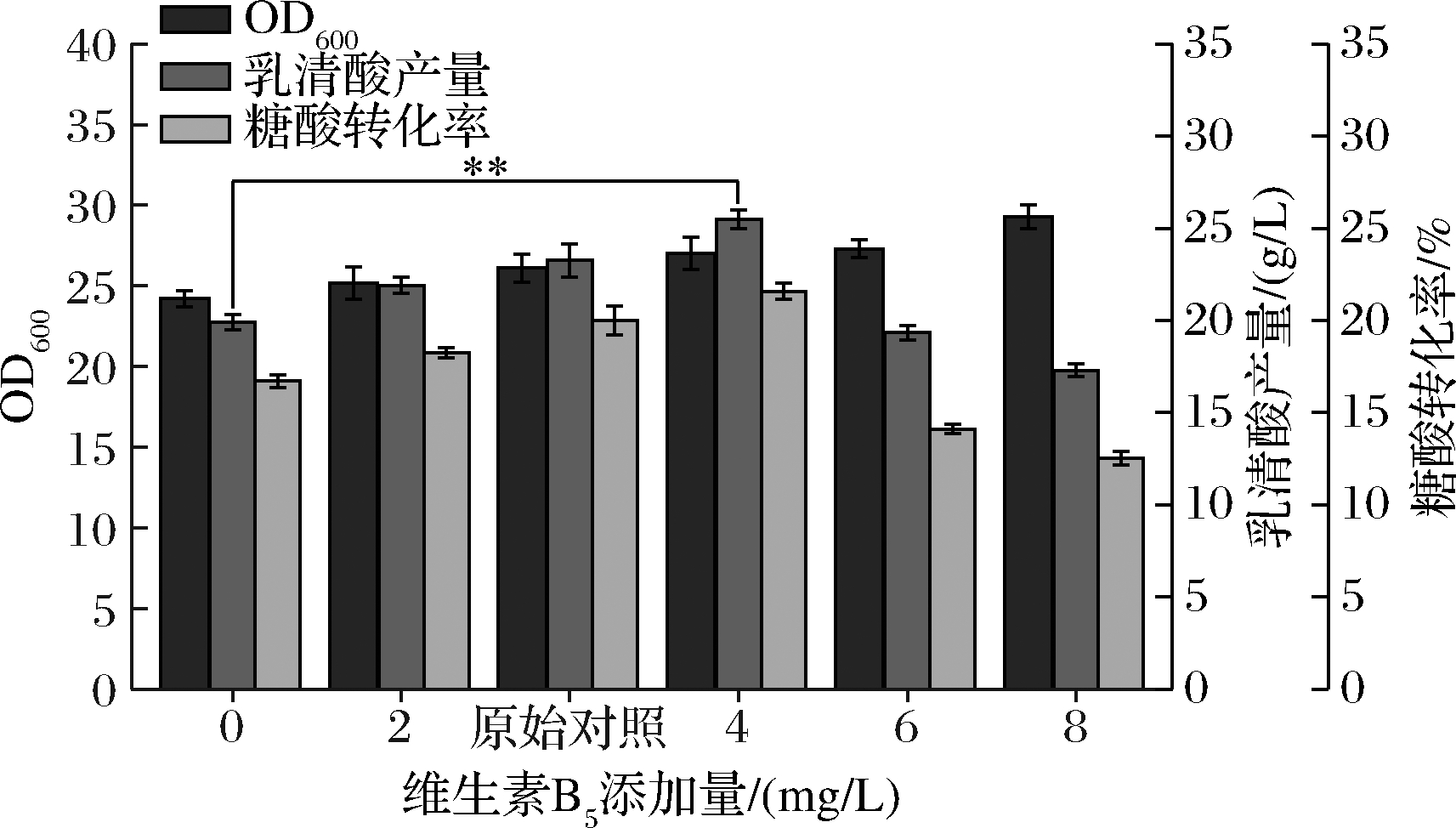
图3 不同维生素B5添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.3 Effects of different VB5 additions on biomass,orotic acid production and sugar-acid conversion rate
2.1.4 维生素B6添加量优化单因素试验
由图4可知,维生素B6对菌体量、乳清酸产量和糖酸转化率有着不同程度的促进作用。
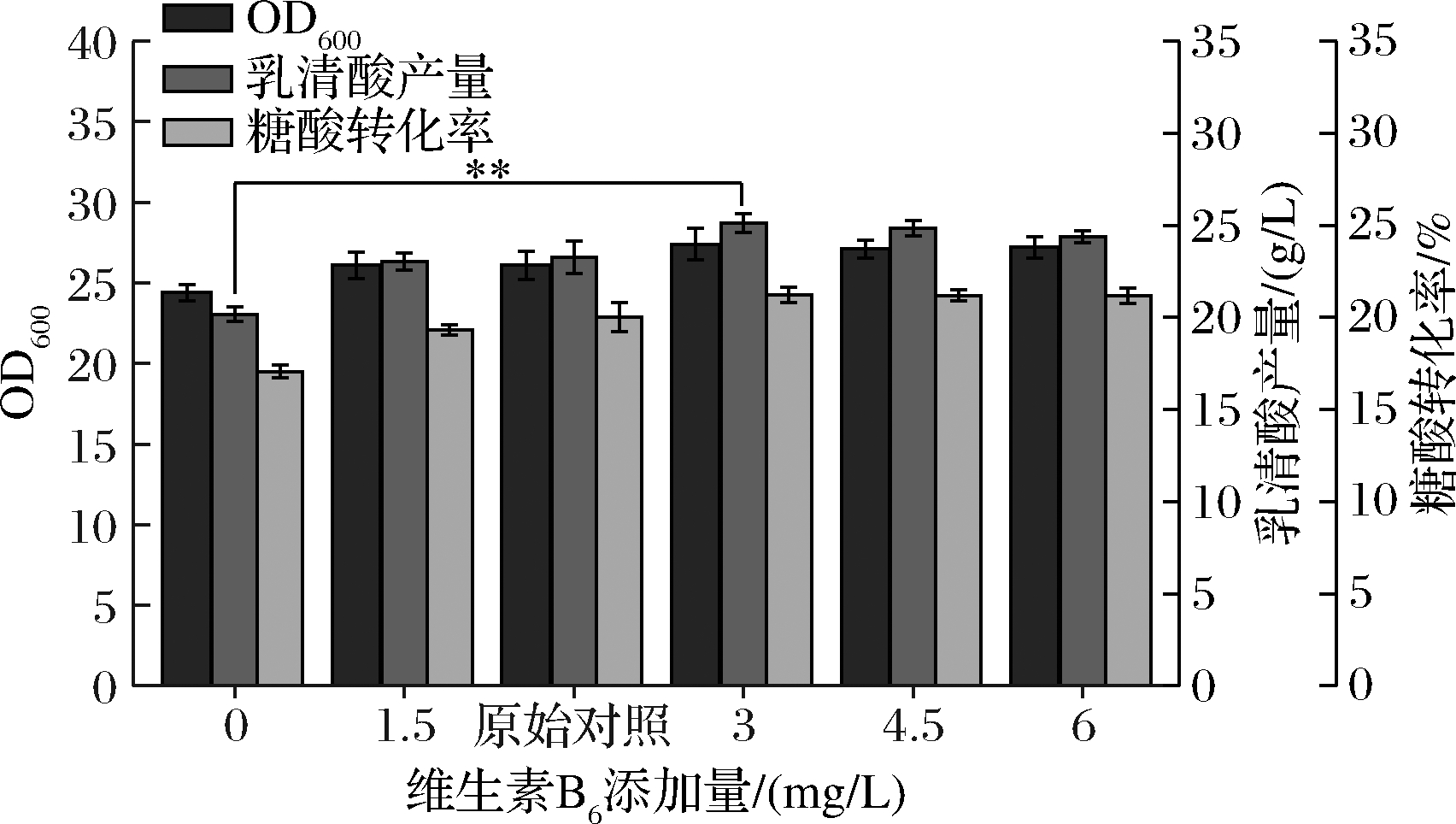
图4 不同维生素B6添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.4 Effects of different VB6 additions on biomass,orotic acid production and sugar-acid conversion rate
随着维生素B6添加量的逐渐增加,菌体量、乳清酸产量和糖酸转化率都呈增长趋势,且产量与转化率变化更加显著,直到添加量为3 mg/L时,3者都达到最高水平,分别为27.4、25.10 g/L、21.23%,较维生素B6空白组分别提高了12.3%、24.46%、24.45%,较原始对照组[ρ(维生素B6)=2 mg/L]分别提高了4.98%、7.95%、6.10%。维生素B6的活性形式——磷酸吡哆醛(pyridoxal-5-phosphate,PLP)是氨基酸代谢中的多种酶的辅酶[18],其参与胞内一些转氨、脱氨及氨基酸的脱羧基反应[19]。故外源添加一定量的维生素B6对菌体生长、乳清酸产量及糖酸转化率都有促进作用,但随着ρ(维生素B6)≥4.5 mg/L时,菌体量、乳清酸产量和转化率都趋于稳定。推测维生素B6作为多种酶的辅酶,此时已达到催化上限浓度,所以对菌体生长、乳清酸产量及转化率影响较小。为了节约成本,故选择维生素B6最佳添加量为3 mg/L。
2.1.5 维生素B7添加量优化单因素试验
由图5可知,当空白组无外源添加维生素B7时,乳清酸产量和转化率仅有20.23 g/L、17.90%,在添加1 mg/L时,乳清酸的产量和转化率具有显著提升,分别达到了25.66 g/L、21.33%,较空白组提升了26.82%、19.20%,当添加量再次提高时,产量和转化率出现下降的趋势;OD600值会随着维生素B7添加量的增长而显著增长,在添加4 mg/L时,OD600值达到最高,为29.2,较空白组增长了19.18%。维生素B7是氨基酸代谢和糖异生中羧化反应中重要酶促辅因子,尤其是乙酰CoA羧化酶等关键酶的辅酶,参与到菌体细胞膜的生成、CO2的固定等过程[20-21],细胞膜的合成又是影响菌体生长的限制性因素,因此,菌体量会随着维生素B7添加量增加而提升;但当添加量超过2 mg/L时,乳清酸产量和转化率都开始呈下降趋势,推测外源添加过多维生素B7会导致菌体呼吸代谢加强,葡萄糖代谢速率加快,造成其他副产物增加,进而导致转化率大幅下降,因此选择维生素B7的最佳添加量为1 mg/L。
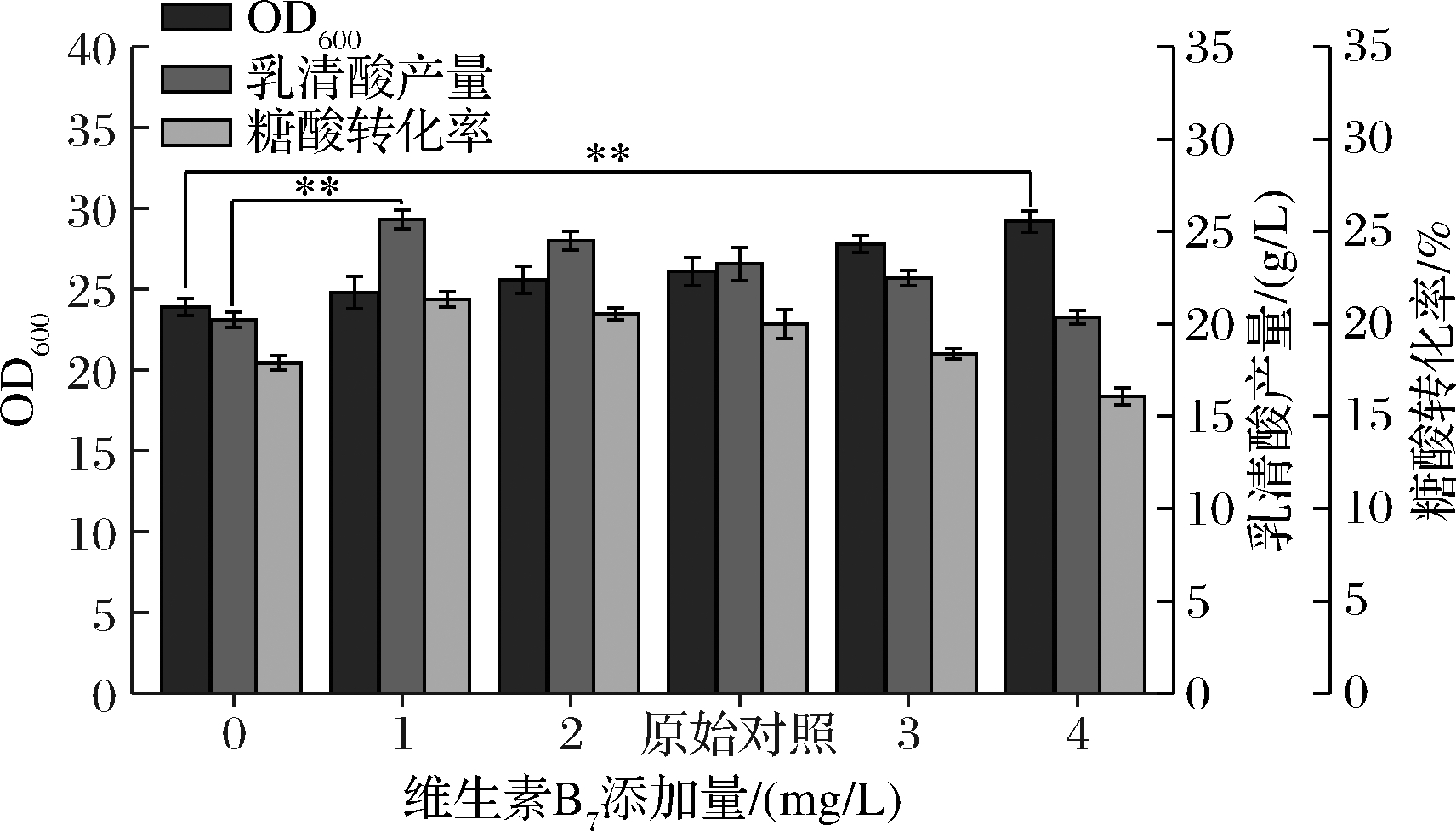
图5 不同维生素B7添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.5 Effects of different VB7 additions on biomass,orotic acid production and sugar-acid conversion rate
2.1.6 维生素B12添加量优化单因素试验
由图6可知,空白组[ρ(维生素B12)=0]的OD600为24.4,随着维生素B12添加量的增加而呈上升趋势,当添加量为8 mg/L时,达到本组试验最高值29.0,较空白组提升了18.9%。而维生素B12对乳清酸产量具有一定程度影响,随着添加量提升,乳清酸产量呈先上升后下降趋势,当添加量为4 mg/L时,达到本组试验最高产量25.50 g/L,较空白组提升了9.9%。维生素B12是多种代谢过程中的辅酶因子,具有促进甲基形成和转移,加快DNA和蛋白质合成,促进细胞成熟等功能[22-23],推测对菌体生长有一定的促进作用。实验结果显示维生素B12对乳清酸产量也有一定程度提升作用,可当ρ(维生素B12)≥4 mg/L时,乳清酸产量和转化率都开始下降,推测维生素B12的过量添加会导致代谢流过多流向菌体生长方向,造成合成乳清酸的前体物不足,引起产量下降并伴随转化率降低。综上,选择维生素B12最佳添加量为4 mg/L。
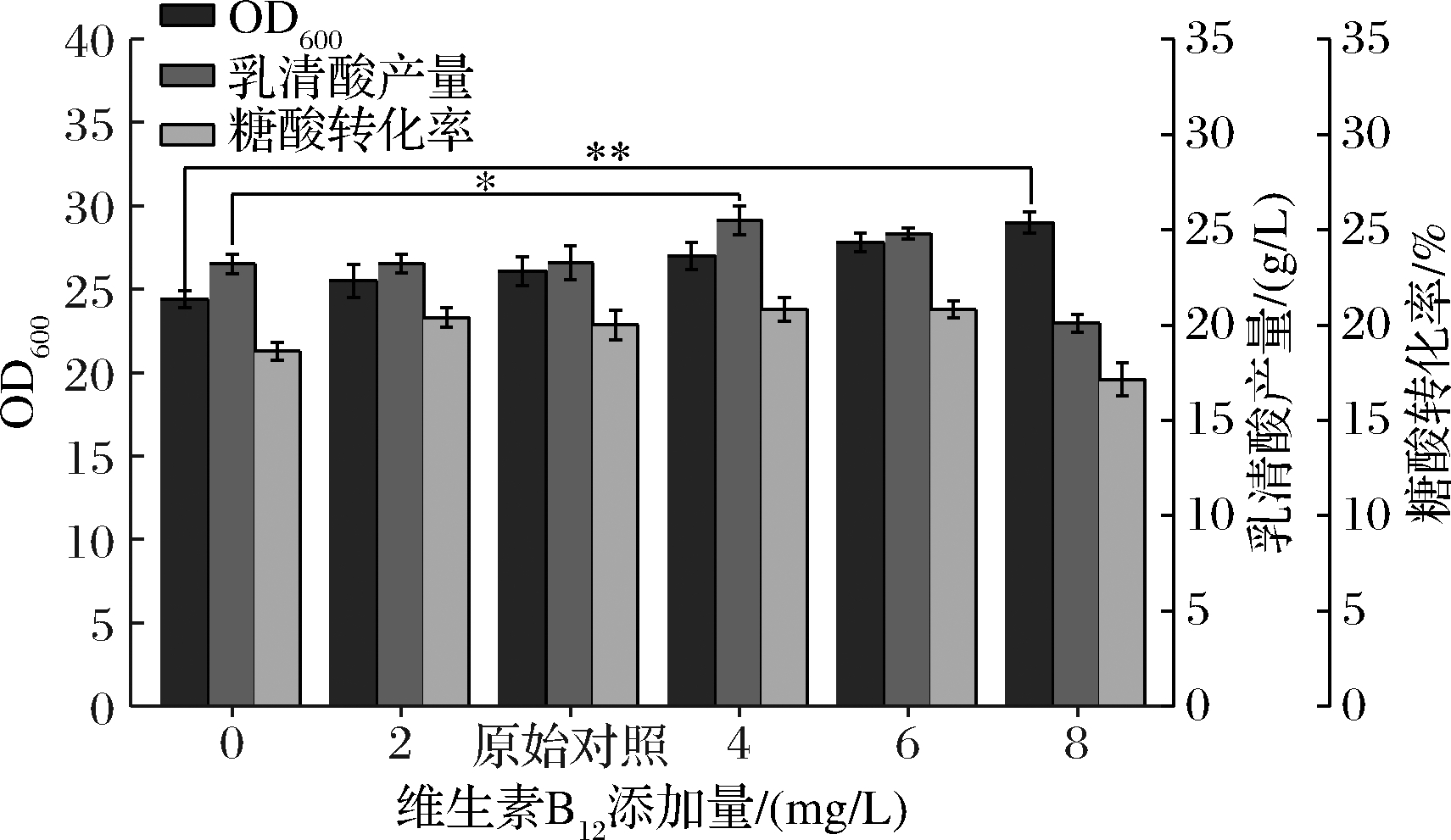
图6 不同维生素B12添加量对菌体量、乳清酸产量和糖酸转化率的影响
Fig.6 Effects of different VB12 additions on biomass,orotic acid production and sugar-acid conversion rate
2.2 B族维生素添加量优化正交试验
在单因素试验的基础上,以OD600、乳清酸产量和糖酸转化率作为指标,根据表1的试验方案设置L25(56)的正交试验,试验结果及分析见表3,极差分析结果见表4。
表3 B族维生素添加量优化正交试验结果
Table 3 Results of orthogonal tests for optimisation of B vitamins addition
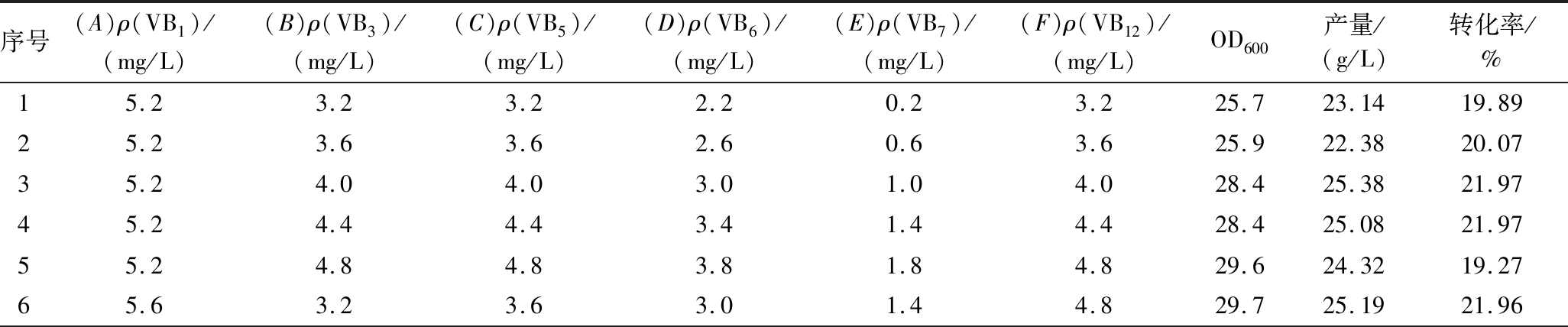
序号(A)ρ(VB1)/(mg/L)(B)ρ(VB3)/(mg/L)(C)ρ(VB5)/(mg/L)(D)ρ(VB6)/(mg/L)(E)ρ(VB7)/(mg/L)(F)ρ(VB12)/(mg/L)OD600产量/(g/L)转化率/%15.23.23.22.20.23.225.723.1419.8925.23.63.62.60.63.625.922.3820.0735.24.04.03.01.04.028.425.3821.9745.24.44.43.41.44.428.425.0821.9755.24.84.83.81.84.829.624.3219.2765.63.23.63.01.44.829.725.1921.96
续表3
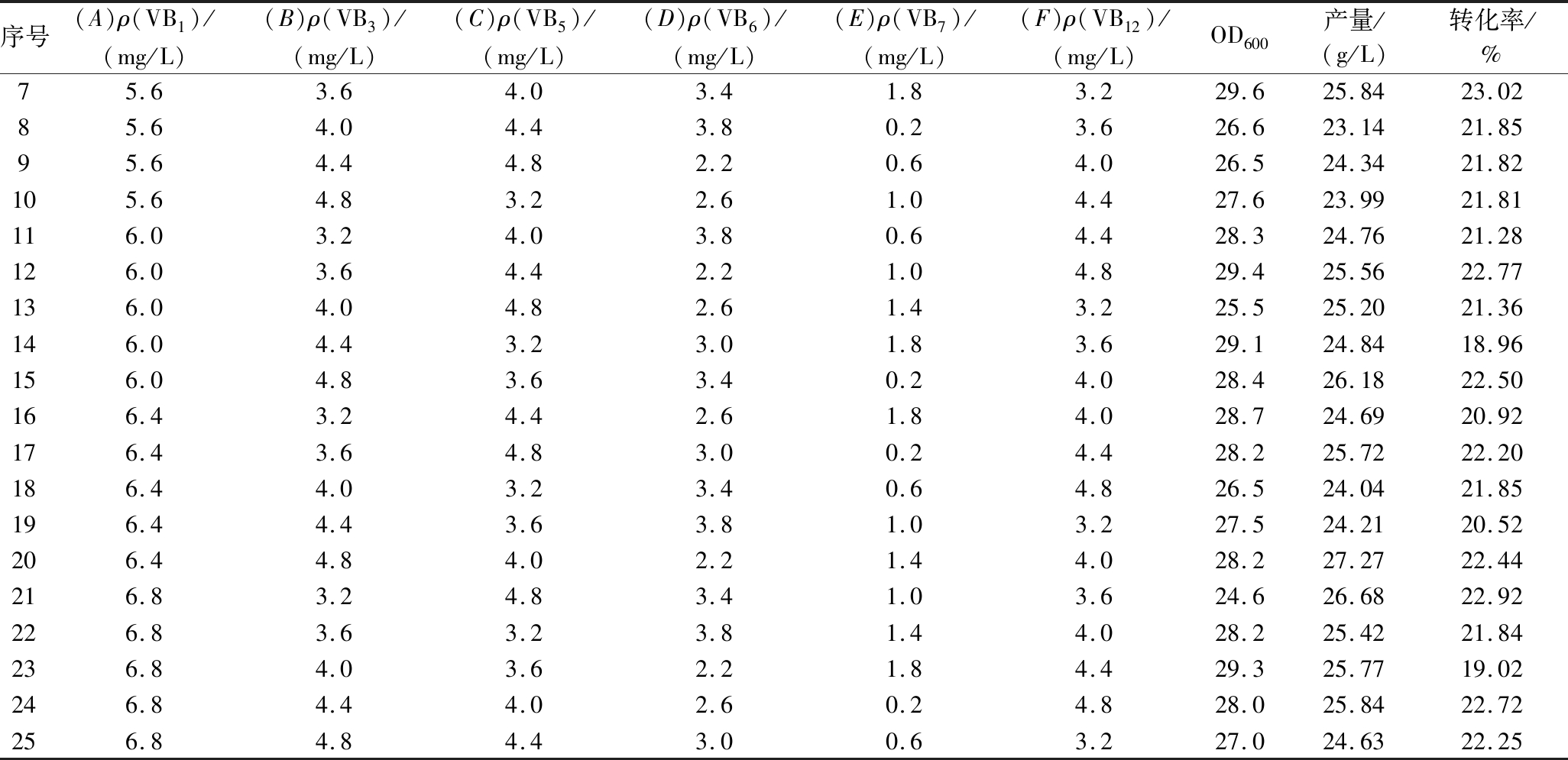
序号(A)ρ(VB1)/(mg/L)(B)ρ(VB3)/(mg/L)(C)ρ(VB5)/(mg/L)(D)ρ(VB6)/(mg/L)(E)ρ(VB7)/(mg/L)(F)ρ(VB12)/(mg/L)OD600产量/(g/L)转化率/%75.63.64.03.41.83.229.625.8423.0285.64.04.43.80.23.626.623.1421.8595.64.44.82.20.64.026.524.3421.82105.64.83.22.61.04.427.623.9921.81116.03.24.03.80.64.428.324.7621.28126.03.64.42.21.04.829.425.5622.77136.04.04.82.61.43.225.525.2021.36146.04.43.23.01.83.629.124.8418.96156.04.83.63.40.24.028.426.1822.50166.43.24.42.61.84.028.724.6920.92176.43.64.83.00.24.428.225.7222.20186.44.03.23.40.64.826.524.0421.85196.44.43.63.81.03.227.524.2120.52206.44.84.02.21.44.028.227.2722.44216.83.24.83.41.03.624.626.6822.92226.83.63.23.81.44.028.225.4221.84236.84.03.62.21.84.429.325.7719.02246.84.44.02.60.24.828.025.8422.72256.84.84.43.00.63.227.024.6322.25
表4 正交试验极差分析结果
Table 4 Range analysis results of orthogonal test
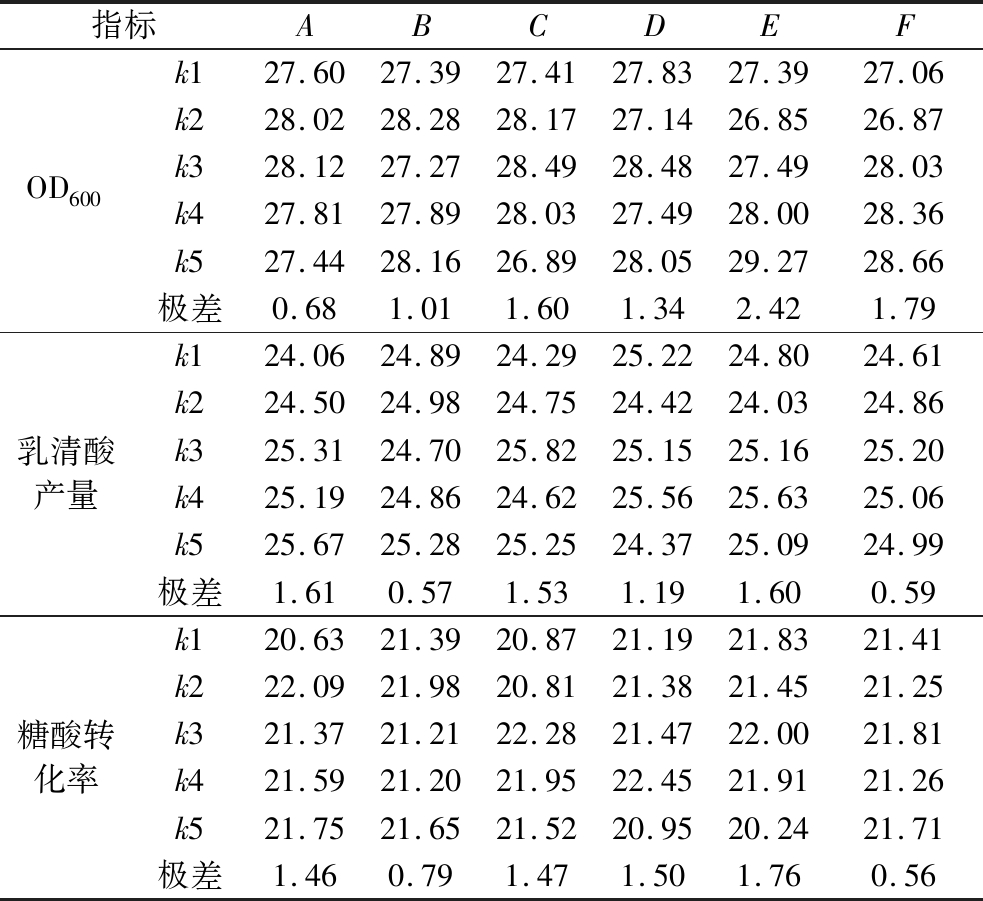
指标ABCDEFOD600k127.6027.3927.4127.8327.3927.06k228.0228.2828.1727.1426.8526.87k328.1227.2728.4928.4827.4928.03k427.8127.8928.0327.4928.0028.36k527.4428.1626.8928.0529.2728.66极差0.681.011.601.342.421.79乳清酸产量k124.0624.8924.2925.2224.8024.61k224.5024.9824.7524.4224.0324.86k325.3124.7025.8225.1525.1625.20k425.1924.8624.6225.5625.6325.06k525.6725.2825.2524.3725.0924.99极差1.610.571.531.191.600.59糖酸转化率k120.6321.3920.8721.1921.8321.41k222.0921.9820.8121.3821.4521.25k321.3721.2122.2821.4722.0021.81k421.5921.2021.9522.4521.9121.26k521.7521.6521.5220.9520.2421.71极差1.460.791.471.501.760.56
由表3~表4可知,影响发酵过程菌体量(OD600值)的因素依次为E>F>C>D>B>A;影响乳清酸产量的因素依次为A>E>C>D>F>B;影响转化率的因素依次为E>D>C>A>B>F。综上,以乳清酸发酵产量为最终选择指标,确定最佳添加量组合为A5B5C3D4E4F3,即维生素B1 6.8 mg/L,维生素B3 4.8 mg/L,维生素B5 4 mg/L,维生素B6 3.4 mg/L,维生素B7 1.4 mg/L,维生素B12 4 mg/L。
2.3 5 L发酵罐分批补料发酵试验
2.3.1 5 L发酵罐验证B族维生素最佳添加量
以菌体量(OD600)、乳清酸产量和糖酸转化率为指标,单因素试验分析了6种B族维生素的最佳添加量,并通过正交试验进一步筛选出对发酵结果影响最优的试验条件。在保证培养基其他成分及发酵条件不变的情况下,对优化后的添加量进行5 L发酵罐试验(乳清酸产量从2 h起开始测量),进一步探究试验的可行性和优越性。
如图7、表5所示,整个发酵过程中,优化培养基后的试验组菌体生长速率显著高于原始培养基的对照组,在4~20 h尤为明显,且在36 h达到最大菌体量,此时OD600值为134.32,较对照组提升了13.16%;乳清酸产量也有一定程度的提升,16 h后开始出现明显差异,在发酵42 h时产量达到了121.41 g/L,较对照组增长了15.47%,同时转化率也得到了显著提升,达到25.73%,较对照组提高了12.96%。
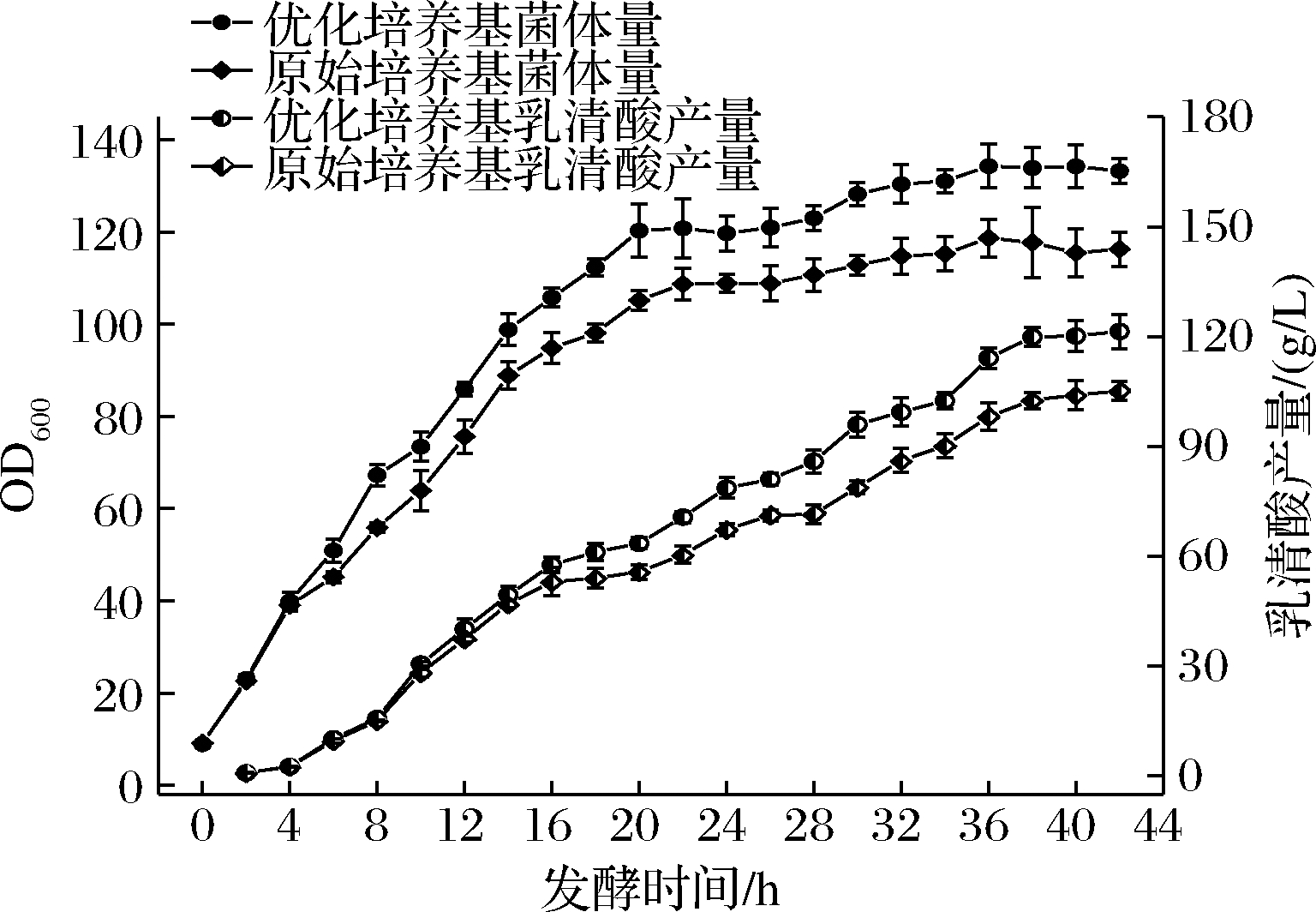
图7 优化培养基与原培养基在5 L发酵罐中的对比
Fig.7 Comparison between optimized medium and original medium in 5 L fermenter
表5 优化培养基在5 L发酵罐中对菌体量、乳清酸产量和糖酸转化率的影响
Table 5 Effects of optimized medium on biomass,orotic acid production and sugar-acid conversion rate in 5 L fermenter

培养基菌体量(OD600)乳清酸产量/(g/L)糖酸转化率/%原始培养基118.70105.1422.78优化培养基134.32121.4125.73
2.3.2 B族维生素不同添加方式对5 L发酵罐发酵乳清酸的影响
为进一步探究优化后培养基在发酵生产中的效益潜能,我们需要分析B族维生素不同添加方式对5 L发酵罐发酵乳清酸的影响,从而确定最佳的添加方式。
如图8所示,添加方式A由于在培养基中一次性加入了全部量B族维生素,使得原体系中的营养充足,菌体在前14 h生物量的增长速度最快,但是随着发酵的进行,添加方式A的弊端逐渐显露,后期由于B族维生素的缺乏,菌体无法保持前期的生长态势。于发酵38和42 h时,分别达到OD600值和乳清酸产量最高,为134.59、120.7 g/L,随之菌体量和产量都呈轻微下降趋势。添加方式B的结果显示在补料添加后的4 h内菌体量增长速度有一定程度的提升,随后涨幅逐渐下降,最高的OD600值和乳清酸产量为139.92、129.3 g/L,较方式A分别提高了4.0%和7.1%。添加方式C使得整个发酵周期内菌体所需的B族维生素都处于一个相对稳定的水平,直到发酵截止,最终OD600和乳清酸产量较前2 h仍无下降趋势,保持着一定的菌体活力。从最终的结果来看,添加方式C展现出了持续流加的优势,最终的菌体生物量(OD600)为148.23,较方式A和方式B分别提高了10.1%和5.9%,最终的乳清酸产量为138.2 g/L,较方式A和方式B分别提高了14.5%和6.9%。
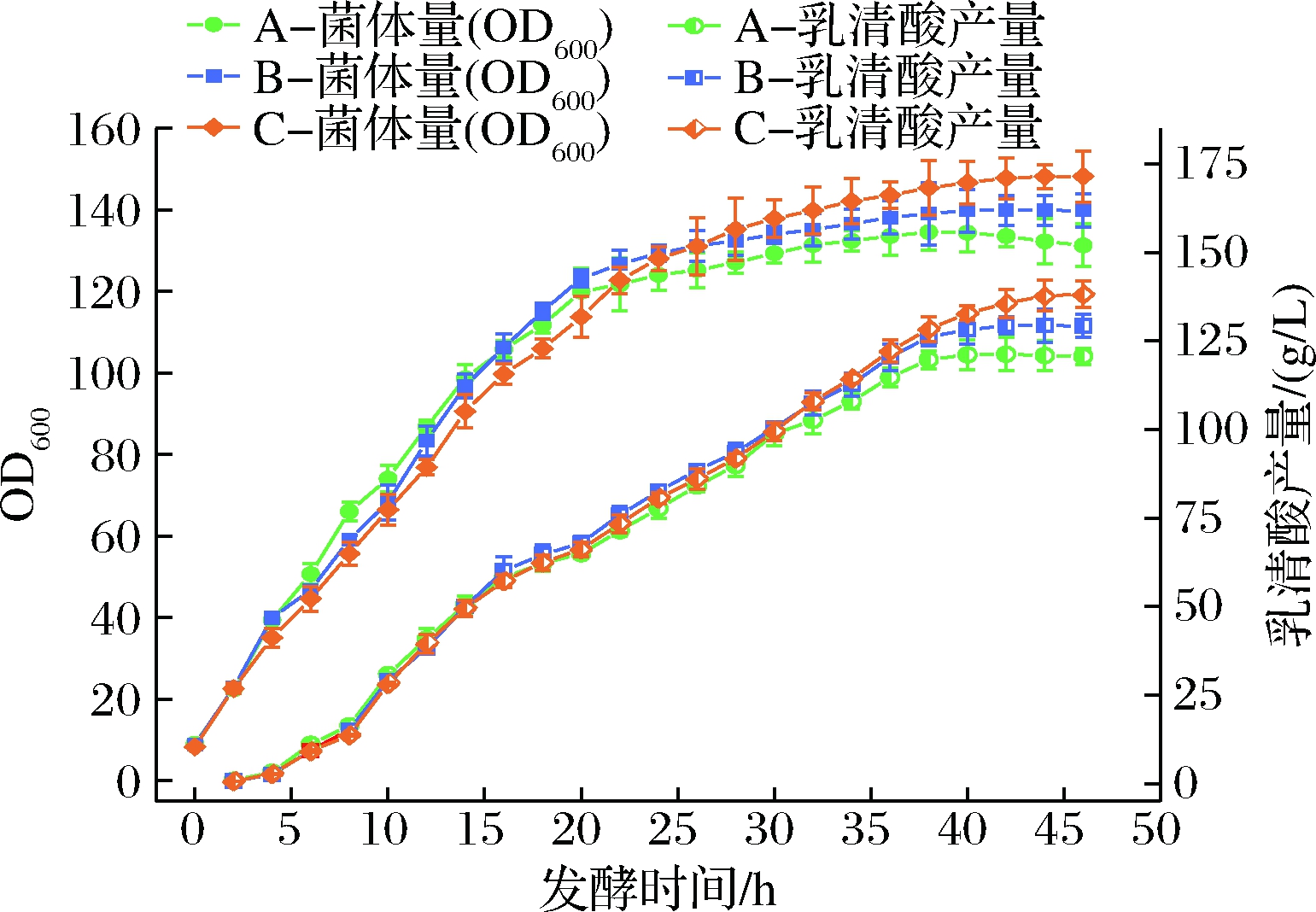
方式A-底物中全部添加;方式B-在10、20 h补料添加;方式C-从10 h持续流加
图8 不同添加方式对菌体生物量及乳清酸产量的影响
Fig.8 Effects of different addition methods on biomass and orotic acid production
3 结论
本文通过单因素试验对B族维生素在乳清酸发酵中的作用做了较为深入的探究,研究发现维生素B1对乳清酸产量有显著影响,适量添加可以增强大肠杆菌Ora-6的产酸能力;适量的维生素B7对大肠杆菌Ora-6的菌体生长具有较大的促进作用,能有效提升菌体活力。随后在单因素试验的基础上,设置正交试验,通过正交试验分析得出大肠杆菌Ora-6发酵乳清酸培养基中B族维生素最佳组合添加量,即维生素B1 6.8 mg/L,维生素B3 4.8 mg/L,维生素B5 4 mg/L,维生素B6 3.4 mg/L,维生素B7 1.4 mg/L,维生素B12 4 mg/L。随后通过5 L发酵罐进行验证优化培养基试验,对比发现优化后的培养基菌体量(OD600)、乳清酸产量和糖酸转化率较优化前分别提高了13.16%、15.47%、12.96%。同时研究确定了B族维生素采取从10 h持续流加的发酵优化策略,使得5 L发酵乳清酸最终菌体量和产量分别达到148.23、138.2 g/L。本研究所确定的乳清酸发酵培养基及添加方式与原发酵策略相比,菌体量、乳清酸产量和转化率都有了不同程度的提升,为今后工业化发酵生产乳清酸提供了参考。
[1] LÖFFLER M,CARREY E A,ZAMEITAT E.Orotate (orotic acid):An essential and versatile molecule[J].Nucleosides,Nucleotides &Nucleic Acids,2016,35(10-12):566-577.
[2] CARVALHO N,COELHO E,GALES L,et al.Production of orotic acid by a Klura3Δ mutant of Kluyveromyces lactis[J].Journal of Bioscience and Bioengineering,2016,121(6):625-630.
[3] 佟臻,韦阳,高彦祥.关于CoQ10传递体系的研究进展[J].中国食品添加剂,2018(10):201-210.
TONG Z,WEI Y,GAO Y X.Research progress on coenzyme Q10 delivery system[J].China Food Additives,2018(10):201-210.
[4] 徐庆阳,李长庚,孙鹏杰.一种生产乳清酸的基因工程菌及其构建方法与应用:CN114774341A[P].2022-07-22.
[5] 郝柿田.乳清酸合成工艺研究[D].天津:河北工业大学,2019.
HAO S T.Study on synthesis technology of orotic acid[D].Tianjin:Hebei University of Technology,2019.
[6] 张震,熊海波,徐庆阳.大肠杆菌高密度培养发酵L-色氨酸[J].食品与发酵工业,2019,45(23):15-20.
ZHANG Z,XIONG H B,XU Q Y.L-tryptophan fermentation by high cell density culture of Escherichia coli[J].Food and Fermentation Industries,2019,45(23):15-20.
[7] 孙鹏杰,余子辰,徐庆阳.B族维生素对枯草芽孢杆菌发酵生产腺苷的影响[J].中国酿造,2022,41(4):93-98.
SUN P J,YU Z C,XU Q Y.Effect of vitamin B on adenosine production by Bacillus subtilis fermentation[J].China Brewing,2022,41(4):93-98.
[8] 苏跃稳.L-苏氨酸基因工程菌的改造及发酵过程的优化[D].长春:吉林大学,2017.
SU Y W.Modification of L-threonine genetically engineered bacteria and optimization of fermentation process[D].Changchun:Jilin University,2017.
[9] CHEN Y Y,WANG L L,SHANG F,et al.Structural insight of the 5-(Hydroxyethyl)-methylthiazole kinase ThiM involving vitamin B1 biosynthetic pathway from the Klebsiella pneumoniae[J].Biochemical and Biophysical Research Communications,2019,518(3):513-518.
[10] LIAO Z P,SUO Y K,XUE C,et al.Improving the fermentation performance of Clostridium acetobutylicum ATCC 824 by strengthening the VB1 biosynthesis pathway[J].Applied Microbiology and Biotechnology,2018,102(18):8107-8119.
[11] GILLE A,BODOR E T,AHMED K,et al.Nicotinic acid:Pharmacological effects and mechanisms of action[J].Annual Review of Pharmacology and Toxicology,2008,48:79-106.
[12] AGLEDAL L,NIERE M,ZIEGLER M.The phosphate makes a difference:Cellular functions of NADP[J].Redox Report,2010,15(1):2-10.
[13] RIGOULET M,BOUCHEZ C L,PAUMARD P,et al.Cell energy metabolism:An update[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,2020,1861(11):148276.
[14] NAVAS L E,CARNERO A.NAD+ metabolism,stemness,the immune response,and cancer[J].Signal Transduction and Targeted Therapy,2021,6(1):1-20.
[15] 程坤源,陈岳明,陈全英,等.脯氨酸发酵培养基添加VB5的试验[J].发酵科技通讯,2012,41(1):8-9.
CHENG K Y,CHEN Y M,CHEN Q Y,et al.Experiment of adding VB5 to proline fermentation medium[J].Bulletin of Fermentation Science and Technology,2012,41(1):8-9.
[16] 娄秀平,沈健增,蔡宇杰,等.维生素对大肠杆菌Escherichia coli.JN8产L-色氨酸的影响[J].食品与生物技术学报,2013,32(9):921-926.
LOU X P,SHEN J Z,CAI Y J,et al.Effect of vitamins on production of L-tryptophan in Escherichia coli JN8[J].Journal of Food Science and Biotechnology,2013,32(9):921-926.
[17] 杨延辉,肖春玲.泛酸的功能和生物合成[J].生命的化学,2008,28(4):448-452.
YANG Y H,XIAO C L.The functions and biosynthesis of pantothenate[J].Chemistry of Life,2008,28(4):448-452.
[18] 朱圣庚,徐长法.生物化学[M].第四版.北京:高等教育出版社,2020:497-498.
ZHU S G,XU C F.Biochemistry[M].Fourth edition.Beijing:Higher Education Press,2020:497-498.
[19] 何俊锋.L-组氨酸产生菌的选育及其发酵条件优化[D].无锡:江南大学,2006.
HE J F.Breeding of L-histidine producing strain and optimization of its fermentation conditions[D].Wuxi:Jiangnan University,2006.
[20] 陈志超,王金多,徐庆阳.微量元素与生长因子对L-苯丙氨酸发酵的影响[J].食品与发酵工业,2022,48(8):82-89.
CHEN Z C,WANG J D,XU Q Y.Effects of trace elements and growth factors on L-phenylalanine fermentation[J].Food and Fermentation Industries,2022,48(8):82-89.
[21] 熊海波,梅漫莉,徐庆阳.当量生物素控制对谷氨酸棒杆菌发酵产L-异亮氨酸的影响[J].中国调味品,2020,45(5):27-32.
XIONG H B,MEI M L,XU Q Y.Effects of equivalent biotin control on L-isoleucine production by Corynebacterium glutamate fermentation[J].China Condiment,2020,45(5):27-32.
[22] LIU J,LIU Y F,WU J,et al.Metabolic profiling analysis of the vitamin B12 producer Propionibacterium freudenreichii[J].MicrobiologyOpen,2021,10(3):e1199.
[23] LI D,FANG H,GAI Y M,et al.Metabolic engineering and optimization of the fermentation medium for vitamin B12 production in Escherichia coli[J].Bioprocess and Biosystems Engineering,2020,43(10):1735-1745.