灰葡萄孢菌(Botrytis cinerea)是造成瓜果蔬菜灰霉病的主要病原菌[1]。因其具有寄主范围广、传播快等特点,导致瓜果蔬菜因腐烂变质在采后运输和储藏过程中的储存期变短、品质下降,带来严重的经济损失,是一种世界性的病害[2-3]。
目前,已有研究报道把化学杀菌剂或微生物及其代谢产物应用于果蔬采后灰霉病害的控制,但长期使用化学杀菌剂会导致病原菌产生一定的抗药性,且化学防治手段不仅成本高,残存在环境中的化学药剂还可能会危害人畜健康[4-5]。微生物及其代谢产物经过大量研究证明可以很好地替代化学杀菌剂,是一种重要的绿色防控手段[6]。在微生物天然抑菌剂中,挥发性抑菌物质与非挥发性抑菌物质相比,具有分子小、易于在环境中渗透和扩散等特点,能更全方位地杀灭环境中的病原菌[7]。这些挥发性化学物质更不容易受到环境温度、紫外照射、pH等各种形式失活的影响,具有广阔的发展前景[8]。
本文就以从实验室筛选鉴定的膜醭毕赤酵母(Pichia membranaefaciens)为材料,首次探究膜醭毕赤酵母产生的挥发性物质对灰葡萄孢菌抑菌活性及初步抑菌机理,并利用GC-MS对其产生的挥发性物质组成成分进行分析,为开发利用新型熏蒸生物剂提供一定依据和参考。
1 材料与方法
1.1 供试菌株和培养基
膜醭毕赤酵母菌(Pichia membranaefaciens)、灰葡萄孢菌(Botrytis cinerea),保藏于天津科技大学农产品物流保鲜与加工研究室。
PDA培养基:马铃薯200 g,葡萄糖20 g,固体培养基加入琼脂15~20 g(液体培养基不加),蒸馏水1 L,121 ℃灭菌20 min。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;ZHJH-C1109B垂直流超净工作台,上海智城分析仪器制造有限公司;SY-100 Nikon光学显微镜,上海拓精工业检测仪器有限公司;GCMS-QP20100气质联用仪,日本岛津公司;SU1510扫描电子显微镜,日本HITACHI公司;N50 TOUCH超微量紫外分光光度计,德国Implen公司。
1.3 膜醭毕赤酵母菌菌悬液的制备
将酵母菌接种于PDB液体培养基中,培养3 d,离心富集菌体沉淀,无菌水清洗3遍后,加入一定量无菌水即得到酵母菌菌悬液[9],调整浓度为106~107 CFU/mL。
1.4 灰葡萄孢菌的活化及孢子悬浮液的制备
将实验室保藏的灰葡萄孢菌接种至PDA培养基,28 ℃培养7 d,用无菌铲刮取灰葡萄孢菌的分生孢子到无菌水中,调整孢子悬浮液浓度为106 spore/mL[10]。
1.5 膜醭毕赤酵母菌的挥发性物质对灰葡萄孢菌抑菌活性的测定
参考PARAFATI等[11]的方法和平皿对扣法,在PDA培养基皿底均匀涂布酵母菌悬液,另一个PDA培养基皿底放直径为9 mm的灰葡萄孢菌菌饼,两皿底对扣,用Parafilm封口膜密封,28 ℃培养7 d,涂布无菌水的平板为空白对照,采用十字交叉法测定灰葡萄孢菌直径。观察、计算抑菌率,抑菌率的计算如公式(1)所示:
抑菌率![]()
(1)
式中:dc、d、d0分别为对照组、处理组、初始菌落直径,mm。
1.6 挥发性物质对灰葡萄孢菌产孢量的影响
参考ARREBOLA等[12]的方法,并稍加修改。一个皿底涂布适量酵母菌悬液,另外一个PDA培养基皿底放置灰葡萄孢菌菌饼,无菌水为空白对照,培养2、3、4、5、6 d后用血球计数板法计数灰葡萄孢霉病菌的产孢量。
1.7 挥发性物质对灰葡萄孢菌细胞膜通透性的影响
参考LI等[13]、VIRTO等[14]的方法,并稍加修改。一个皿底涂布适量酵母菌悬液,另一个皿底涂布孢子悬浮液。无菌水为空白对照。28 ℃下培养24、48、60、72、96、120 h时取出,无菌水洗下菌体,离心后,用超微量紫外分光光度计测定上清液在260、280 nm下吸光度,表征核酸和蛋白质外泄含量。
1.8 菌丝扫描电镜观察
采用平板对峙隔离法[15]和插片培养法相结合。将PDA平板中央位置宽度约0.5 cm的PDA培养基移除,一侧涂布酵母菌细胞悬浮液,另一侧放置灰霉菌菌饼。将无菌盖玻片以距离灰霉菌菌饼1.0~1.5 cm斜插入固体培养基中,无菌水为空白对照。28 ℃,培养2~3 d后取出盖玻片,在生物显微镜下观察灰霉菌菌丝的生长形态变化。盖玻片经过预处理后在扫描电子显微镜下观察灰葡萄孢菌的菌丝形态变化。
1.9 挥发性物质对活体防治效果
樱桃番茄经过预处理[16]后分为2组,用无菌打孔器在番茄腰部打孔。在伤口处注入孢子悬浮液后,放置于闭光的泡沫箱中,其中1组泡沫箱中的4个角落放置已培养48 h酵母菌的皿底作为实验组,无菌水为空白组,喷水保持湿度。7 d后观察记录番茄果实的病斑直径。
1.10 挥发性气体的收集及GC-MS分析
参考ZHANG等[17]的方法,进行稍加修改。对挥发性气体进行手动萃取并配置二乙烯苯/碳分子筛/聚二甲基硅氧烷微萃取头(DVB/CAR/PDMS,灰色)。以顶空固相微萃取(headspace solid-phase microextraction gas chromatography,HS-SPME)法对由膜醭毕赤酵母产生的挥发性气体的成分进行采样,并通过GC-MS进行鉴定。将顶空进样瓶在50 ℃水浴平衡15 min后,用萃取头吸附40 min,250 ℃下解吸10 min。条件如下:
GC条件:进样器温度250 ℃;载气He,柱流速1.00 mL/min;柱温在40 ℃下保持13 min,并以4 ℃/min的温度升至150 ℃,保持2 min,然后以8 ℃/min的速度升至250 ℃,并保持6 min。
MS条件:离子源温度200 ℃;电子能量70 eV;全扫描质量(m/z)35~500 amu。
1.11 数据统计分析
采用Origin 2017软件进行绘图,SPSS 19.0进行数据统计分析,实验重复3次,取测定结果的平均值,数据用平均值±标准误差表示。
2 结果与分析
2.1 挥发性物质对灰葡萄孢菌抑菌活性的测定
如图1所示,平板对扣培养7 d后,与空白组对比,菌丝生长明显被抑制,随着时间的推移,空白组菌丝产生的毒素沉淀可布满平皿,实验组菌丝所产毒素被抑制。如图2所示,从第2天开始,菌落直径差异一直显著(P<0.05),抑菌率在第2天高达74%,后续操作中把实验组含有膜醭毕赤酵母的平皿换成正常的平皿,发现灰葡萄孢菌不能很快恢复正常生长。推测其挥发性物质对菌丝造成了破坏作用。周海莲等[18]研究也表明,葡萄有孢汉逊酵母(Hanseniaspora uvarum)产生的挥发性代谢物通过熏蒸作用对番茄灰霉病菌菌丝生长有明显的抑制,对其菌丝色素沉淀、形态大小也有一定的影响,与本文得出的结果相似。由此表明,离体实验中膜醭毕赤酵母生长过程中产生的挥发性物质,对灰葡萄孢菌菌丝生长和色素的产生都具有显著的抑制作用。
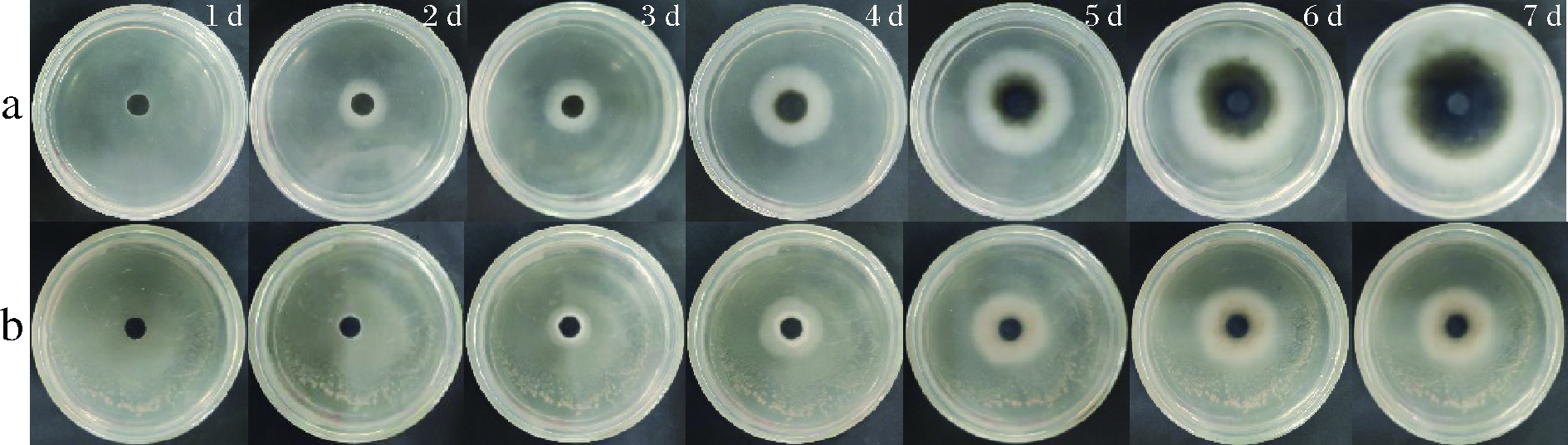
a-空白组;b-挥发性物质
图1 挥发性物质对灰葡萄孢菌菌落的生长情况
Fig.1 Growth of B.cinerea colonies by VOCs
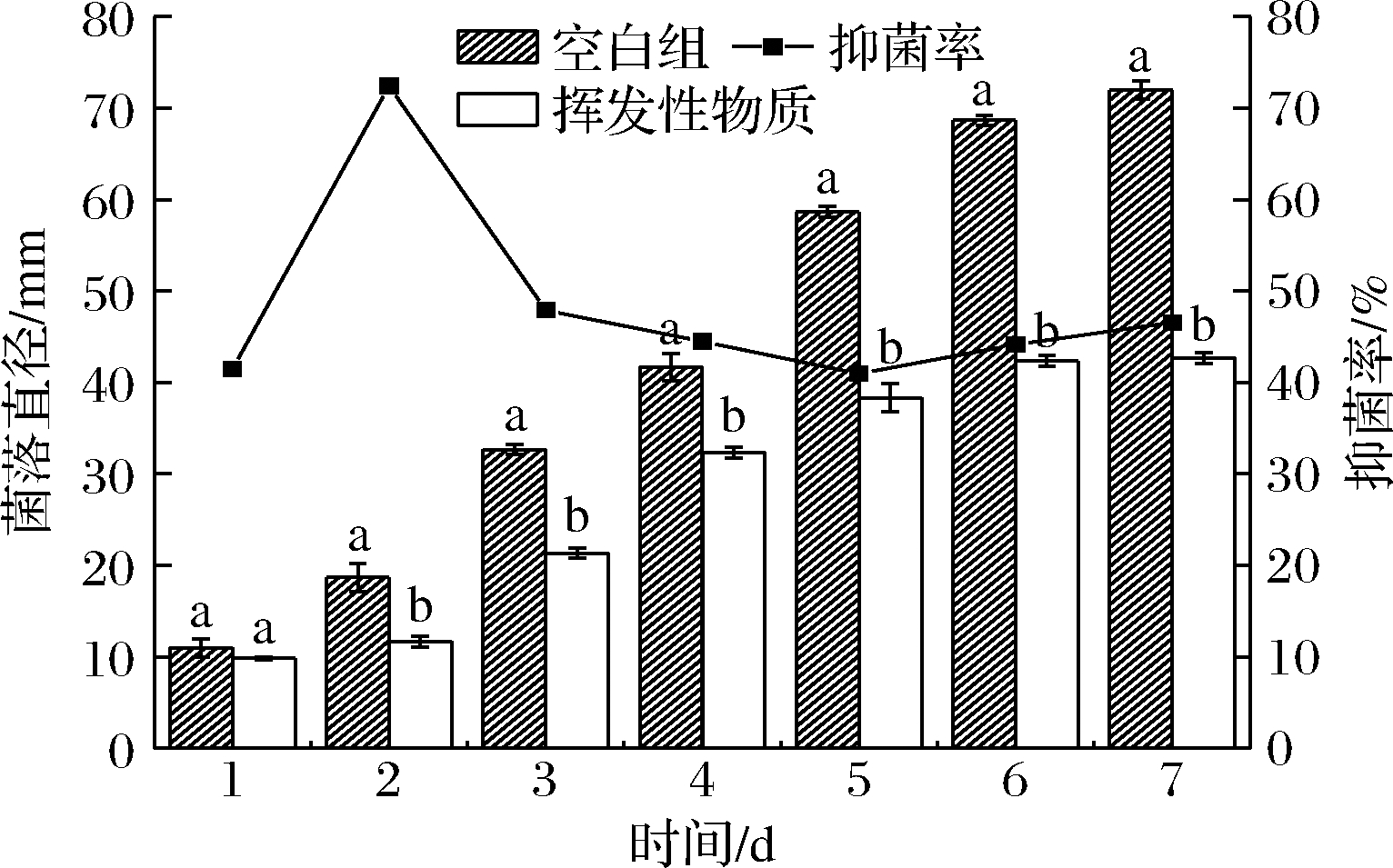
图2 膜醭毕赤酵母的挥发性代谢产物对灰葡萄孢菌抑菌性的影响和菌落直径的测定
Fig.2 Effect of volatile organic compounds of P. membranaefaciens on mycelial diameter and inhibition rate of B.cinerea
注:不同小写字母表示空白组与挥发性物质组差异显著(P<0.05)(下同)。
2.2 挥发性物质对产孢量的影响
真菌的繁殖主要依赖于孢子的萌发和生长[19]。在离体和活体实验中,致病菌孢子的产生都会受到挥发性物质熏蒸的影响,从而延缓采后果实的发病时间[20]。由图3可知,挥发性物质对灰霉病菌产孢量有显著抑制作用(P<0.05),空白组和实验组灰葡萄孢菌的产孢量在2~4 d时,都呈现上升趋势,4 d后,空白组产孢量趋于平稳,推测其产孢量不再增加的原因是平皿空间不足造成。而实验组4 d后,产孢量则缓慢下降。结果分析表明,在挥发性物质的持续作用下,实验组的产孢量始终低于空白组。
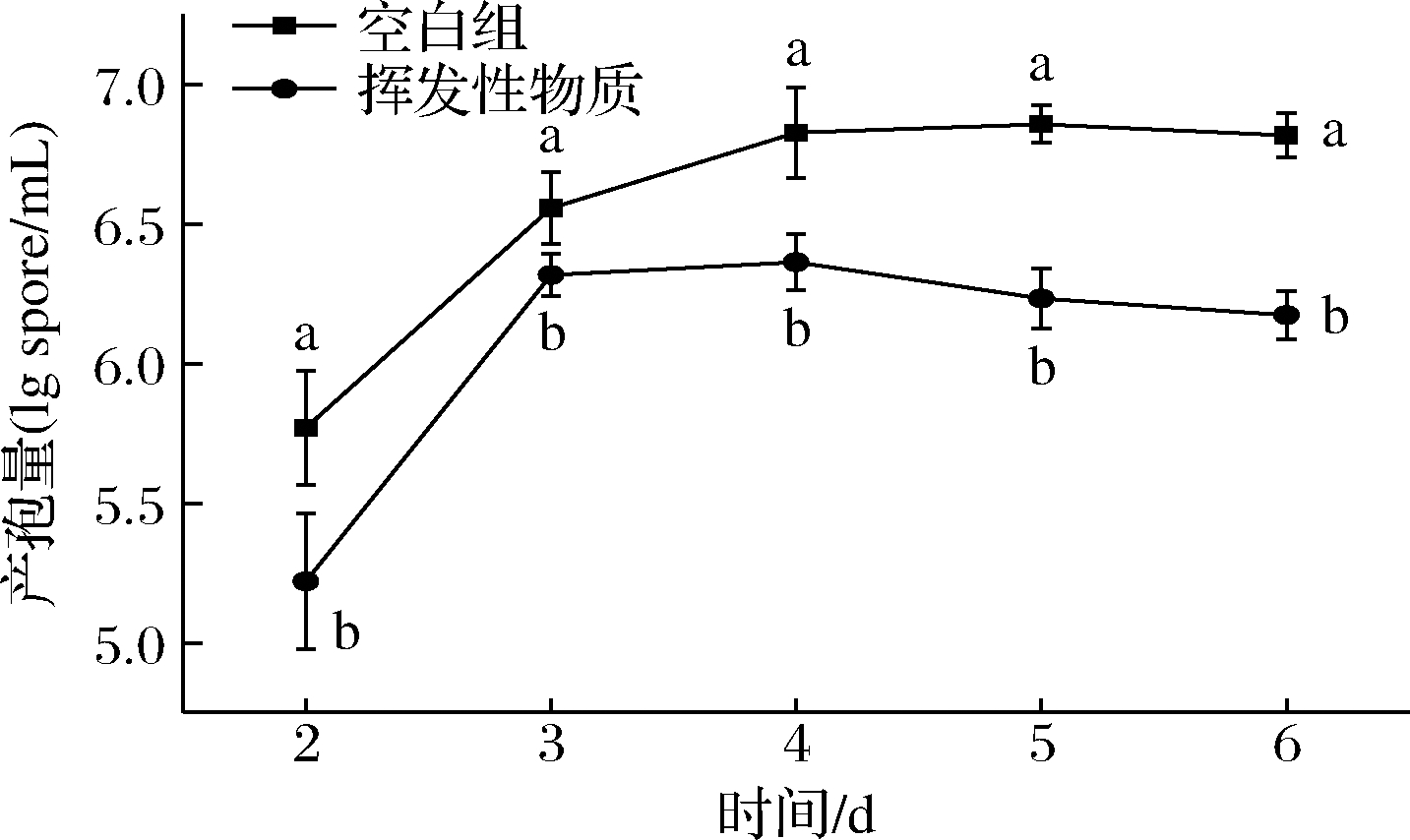
图3 膜醭毕赤酵母的挥发性代谢产物对灰葡萄孢菌产孢量的影响
Fig.3 Effect of volatile organic compounds of P. membranaefaciens on spore production of B.cinerea
2.3 挥发性物质对灰葡萄孢菌核酸及蛋白质泄露情况的测定
细胞膜是维持细胞完整性及保持正常物质和能量代谢的基础,而细胞内成分的释放是膜完整性的一个很好的指标[21-22]。经过挥发性物质熏蒸后,实验组灰霉病菌菌丝体的核酸渗出量始终高于空白组(图4-a)。蛋白质渗出量也具有相同趋势(图4-b)。24~72 h,核酸和蛋白渗出量呈缓慢上升趋势。推测这是实验组灰霉病菌在逆境下发生的应激反应,通过自我保护状态增强其抵抗力[23]。随着熏蒸时间的延长,实验组蛋白质和核酸渗漏量远高于空白组(P<0.05)。推测在这个期间,实验组在逆境下的这种自我保护机制已逐渐崩溃。由此说明在膜醭毕赤酵母挥发性气体作用下,菌体细胞膜的完整性已被破坏。
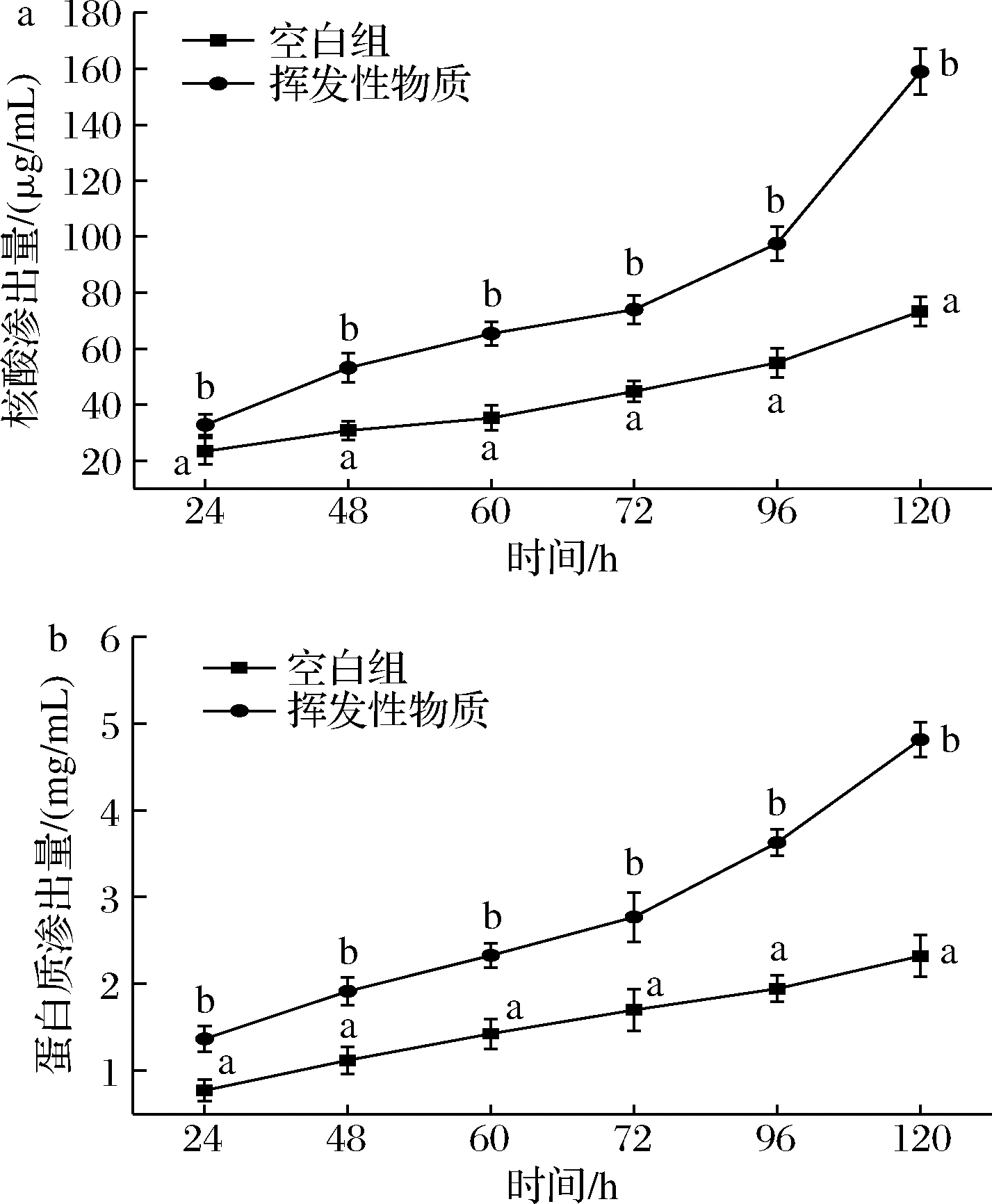
a-核酸渗出量;b-蛋白质渗出量
图4 膜醭毕赤酵母挥发性代谢产物对灰葡萄孢菌细胞膜通透性的影响
Fig.4 Effect of volatile organic compounds of P. membranaefaciens on membrane permeability of B.cinerea
2.4 挥发性物质作用于灰葡萄孢菌菌丝后扫描电镜观察
膜醭毕赤酵母产生的挥发性物质对灰霉孢菌菌丝形态影响的扫描电镜图如图5所示,对照组菌丝形态饱满,表面光滑,粗细均匀,生长状态良好。经过膜醭毕赤酵母产生的挥发性物质处理后,菌丝表面出现干瘪、缢缩、凹凸不平等现象,甚至导致部分菌丝内容物渗漏和菌丝的消解。
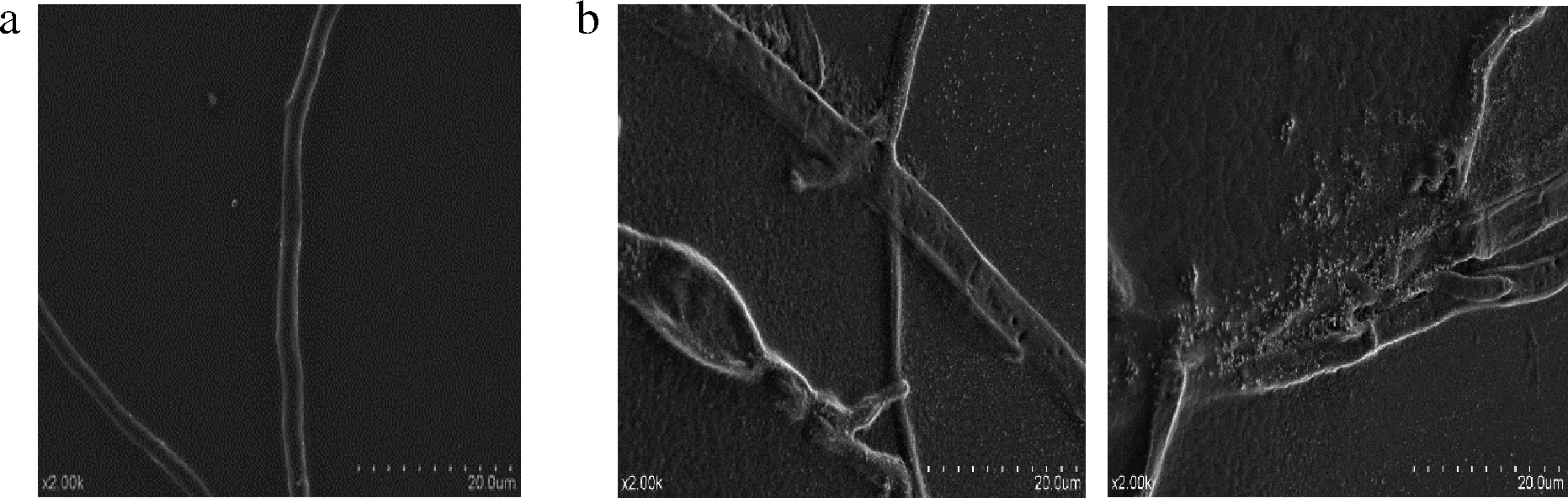
a-空白组;b-挥发性物质
图5 膜醭毕赤酵母挥发性代谢产物对灰葡萄孢菌菌丝的作用
Fig.5 Effect of volatile organic compounds of P. membranaefaciens on mycelia of B.cinerea
已有研究发现,由白黄链霉菌TD-1菌株产生的挥发性物质有抑制灰霉孢菌产孢的能力,增大菌丝细胞膜通透性,扫描电镜结果显示细胞形态异常、菌丝表面粗糙、分节增多等[14]。
在本研究中,膜醭毕赤酵母菌所产的挥发性物质将灰葡萄孢菌的细胞膜作为靶点,经过处理的灰葡萄孢菌的菌丝细胞膜通透性增大,表现为核酸、蛋白质溶出量增多。扫描电镜观察结果也能很好地验证这一点,处理过的菌丝表面经电镜放大后出现干瘪、皱缩和内容物流出等现象。进一步可推测经过熏蒸的灰葡萄孢菌丝不能很快恢复正常生长的原因是细胞膜遭到了严重的破环,细胞破裂死亡,影响其正常的生理功能。
2.5 活体试验
在(25±2) ℃、相对湿度85%~95%下储存7 d并经过挥发性物质熏蒸后观察发现,实验组樱桃番茄病斑直径为(1.47±0.16) cm,空白组为(2.57±0.32) cm,实验组病斑直径明显小于空白组病斑直径(P<0.05)(表1)。这可能是因为实验组的泡沫箱空气中充满了挥发性气体,推测该气体不仅抑制了空气中的病原体,还进一步阻止了空气中的病原体侵染番茄果实。再次通过活体试验验证膜醭毕赤酵母产生的挥发性物质对番茄果实病害的腐烂发生率具有显著抑制作用,可在一定程度上延缓樱桃番茄的腐败变质。
表1 膜醭毕赤酵母挥发性代谢产物对樱桃番茄病斑直径的影响
Table 1 Effect of volatile organic compounds of P. membranaefaciens on spot diameter of cherry tomatoes

处理病斑直径/cm空白组2.57±0.32b挥发性物质1.47±0.16a
注:不同小写字母表示同列不同组显著性差异(P<0.05)
2.6 膜醭毕赤酵母菌挥发性物质的分析
微生物在代谢过程中产生的挥发性物质种类较多。通过GC-MS对挥发性物质进行测定。依据NIST标准谱库,共检测出20种不同的挥发物单体,匹配度都>85%(图6),包括醇类、酮类、酸类等。通过分析结果可以看出,醇类和酮类构成了膜醭毕赤酵母菌挥发有机化合物的主要化合物类别,其中(2R,3R)-(-)-2,3-丁二醇(C4H10O2)占比最多,为39.26%,其次是3-羟基-2-丁酮(C4H8O2),24.72%,和2-甲基丁酸(C5H10O2),8.51%。
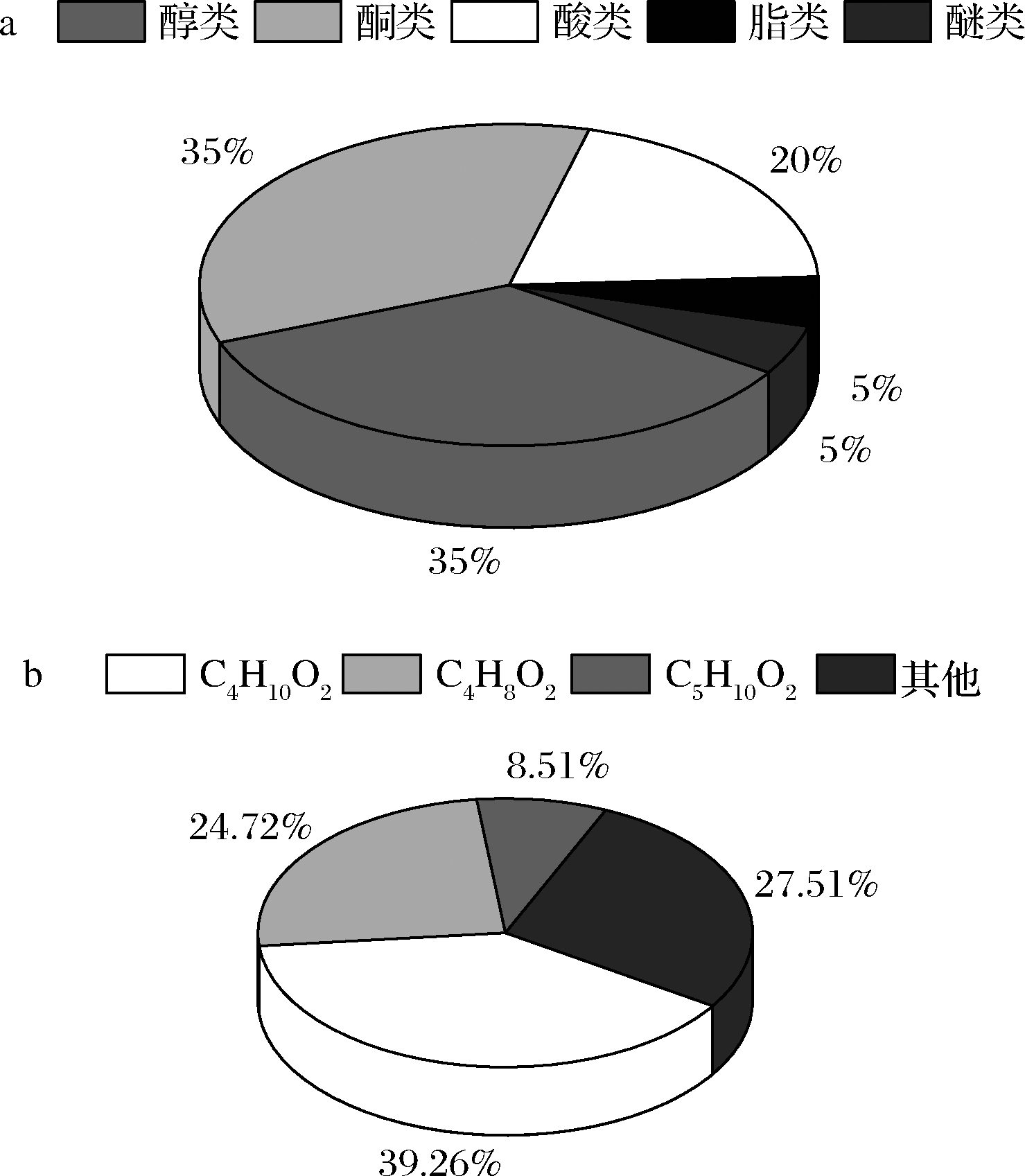
a-挥发性代谢物种类;b-主要挥发性代谢物
图6 膜醭毕赤酵母挥发性代谢产物的种类、主要成分及相对含量
Fig.6 Species,main components,and relative contents of volatile organic component from P. membranaefaciens
膜醭毕赤酵母菌所产的挥发性物质作为一种重要的信号分子,其对番茄果实的主要致病菌的抑制活性尚未见报道。我们首次将挥发性物质作用于番茄果实并得到了较好效果。在占比含量较多的几种化合物中,3-羟基-2-丁酮、2-甲基丁酸已被证实对一些致病菌有较强抑菌性,3-羟基-2-丁酮主要通过抑制病原菌孢子萌发来降低果实的腐烂发生率和腐烂严重程度,抑菌效果随着时间的增加而增强[12]。2-甲基丁酸属于有机酸类,对黄萎菌均有较强抑菌活性[24],其抑菌作用可能是由于pH调节黄萎菌的正常生长繁殖。RYU等[25]报道了细菌产生的挥发性物质(2R,3R)-(-)-2,3-丁二醇能促进拟南芥的生长,并能诱导拟南芥乙烯介导的抗病途径,使植物产生抗病作用。从而降低由胡萝卜软腐欧氏杆菌(Erwiuia carotovora subsp.Carotovora)引起的腐烂病。
这3种主要的化合物单体对灰葡萄孢菌的抑菌活性报道还尚少,其抑菌机理是通过单一成分或协同作用抑制病原菌生长繁殖,还是通过增强采后果蔬的抗病性,还需进一步深入研究。
3 结论
将微生物的挥发性物质作为生物防治制剂来控制采后果蔬致病菌已成为近年来的研究热点。这一举措不仅可以减少化学杀菌剂使用,还是无害环境的病害管理策略[26]。
本文以果蔬采后灰葡萄孢菌作为指示菌,首次对一株膜醭毕赤酵母菌所产挥发性物质的抑菌活性进行探究。离体实验表明在熏蒸处理的第2天抑菌率高达72.41%,也初步明确了挥发性物质对灰葡萄孢菌菌丝的抑菌机理是通过破坏菌丝细胞膜使核酸和蛋白质大量外泄、减少产孢量来实现的。活体实验再次验证挥发性物质可延缓樱桃番茄的腐败变质。同时,还对挥发性物质进行了组分分析,其中C4H10O2、C4H8O2、C5H10O2等含量占比较高,具体可通过后续实验验证化合物纯品的灰葡萄孢菌抑菌活性。以上分析可为膜醭毕赤酵母菌在实际采后农产品保鲜应用中提供坚实的理论依据和数据支撑。
[1] 李贞景,张春慧,路来风,等.白黄链霉菌TD-1菌株挥发性有机物对灰霉孢菌的抑制作用[J].食品科学技术学报,2016,34(3):46-52.
LI Z J,ZHANG C H,LU L F,et al.Inhibitory effect of volatile organic components from Streptomyces alboflavus TD-1 against Botrytis cinerea[J].Journal of Food Science and Technology,2016,34(3):46-52.
[2] 张莉,张博源,黄继红,等.植物灰霉病生物防治研究进展[J].现代牧业,2021,5(2):55-60.
ZHANG L,ZHANG B Y,HUANG J H,et al.Research progress on biological control of Botrytis cinerea[J].Modern Animal Husbandry,2021,5(2):55-60.
[3] 陈宇春,陈敏,王其刚,等.植物灰霉病及抗性研究进展[J].江苏农业科学,2020,48(15):42-51;63.
CHEN Y C,CHEN M,WANG Q G,et al.Research progress of plant gray mold and resistance[J].Jiangsu Agricultural Science,2020,48(15):42-51;63.
[4] 柯杨,马瑜,朱海云,等.葡萄灰霉病无公害防治研究进展[J].生物学杂志,2017,34(3):87-91.
KE Y,MA Y,ZHU H Y,et al.Research progress in nuisanceless control techniques of grape gray mold[J].Journal of Biology,2017,34(3):87-91.
[5] 杨昭辉,王笑笑,赵祺,等.膜醭毕赤酵母菌外泌蛋白抑菌复合膜的制备及性能研究[J].食品与发酵工业,2022,48(12):215-219.
YANG Z H,WANG X X,ZHAO Q,et al.Preparation and properties of antibacterial composite membrane of secreted protein from Pichia membranaefaciens[J].Food and Fermentation Industries,2022,48(12):215-219.
[6] 王静,曹建敏,陈德鑫,等.短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析[J].中国农业科学,2018,51(10):1908-1919.
WANG J,CAO J M,CHEN D X,et al.Antimicrobial effect and components analysis of volatile organic compounds from Bacillus pumilus AR03[J].Scientia Agricultura Sinica,2018,51(10):1908-1919.
[7] ZHANG X Y,GAO Z F,ZHANG X X,et al.Control effects of Bacillus siamensis G-3 volatile compounds on raspberry postharvest diseases caused by Botrytis cinerea and Rhizopus stolonifer[J].Biological Control,2020,141:104135.
[8] 陈奕鹏,杨扬,桑建伟,等.拮抗内生芽孢杆菌BEB17分离鉴定及其挥发性物质抑菌活性分析[J].植物病理学报,2018,48(4):537-546.
CHEN Y P,YANG Y,SANG J W,et al.Isolation and identification of antagonistic endophytic bacillus BEB17 and analysis of antibacterial activity of volatile organic compounds[J].Acta Phytopathologica Sinica,2018,48(4):537-546.
[9] 季小诗,郭红莲,王笑笑,等.拮抗菌发酵液对冬枣贮藏品质的影响[J].食品与发酵工业,2021,47(14):82-87.
JI X S,GUO H L,WANG X X,et al.Effects of an antagonistic yeast fermentation broth on the storage quality of winter jujube[J].Food and Fermentation Industries,2021,47(14):82-87.
[10] GUO H L,XING Z J,YU Q Y,et al.Effectiveness of preharvest application of submicron chitosan dispersions for controlling Alternaria rot in postharvest jujube fruit[J].Journal of Phytopathology,2017,165(7-8):425-431.
[11] PARAFATI L,VITALE A,RESTUCCIA C,et al.Biocontrol ability and action mechanism of food-isolated yeast strains against Botrytis cinerea causing post-harvest bunch rot of table grape[J].Food Microbiology,2015,47:85-92.
[12] ARREBOLA E,SIVAKUMAR D,KORSTEN L.Effect of volatile compounds produced by Bacillus strains on postharvest decay in citrus[J].Biological Control,2010,53(1):122-128.
[13] LI H,HE C,LI G J,et al.The modes of action of epsilon-polylysine (ε-PL) against Botrytis cinerea in jujube fruit[J].Postharvest Biology and Technology,2019,147:1-9.
[14] VIRTO R,MA AS P,ALVAREZ I,et al.Membrane damage and microbial inactivation by chlorine in the absence and presence of a chlorine-demanding substrate[J].Applied and Environmental Microbiology,2005,71(9):5022-5028.
AS P,ALVAREZ I,et al.Membrane damage and microbial inactivation by chlorine in the absence and presence of a chlorine-demanding substrate[J].Applied and Environmental Microbiology,2005,71(9):5022-5028.
[15] 张迪.葡萄灰霉病拮抗酵母菌的筛选及产挥发性抑菌物质特性研究[D].石河子:石河子大学,2018.
ZHANG D.Screening and antibiotic characterization of volatile organic compounds produced by antagonistic yeasts against grape grey mold[D].Shihezi:Shihezi University,2018.
[16] ZHENG M,SHI J Y,SHI J,et al.Antimicrobial effects of volatiles produced by two antagonistic Bacillus strains on the anthracnose pathogen in postharvest mangos[J].Biological Control,2013,65(2):200-206.
[17] ZHANG Y,LI T J,LIU Y F,et al.Volatile organic compounds produced by Pseudomonas chlororaphis subsp.aureofaciens SPS-41 as biological fumigants to control Ceratocystis fimbriata in postharvest sweet potatoes[J].Journal of Agricultural and Food Chemistry,2019,67(13):3702-3710.
[18] 周海莲.葡萄有孢汉逊酵母(Hanseniaspora uvarum)对灰霉病抑制机理的探讨[D].南京:南京农业大学,2012.
ZHOU H L.The inhibition mechanism study of Hanseniaspora uvarum control of gray mold[D].Nanjing:Nanjing Agricultural University,2012
[19] RIQUELME M,AGUIRRE J,BARTNICKI-GARC A S,et al.Fungal morphogenesis,from the polarized growth of hyphae to complex reproduction and infection structures[J].Microbiology and Molecular Biology Reviews:MMBR,2018,82(2):e00068-e00017.
A S,et al.Fungal morphogenesis,from the polarized growth of hyphae to complex reproduction and infection structures[J].Microbiology and Molecular Biology Reviews:MMBR,2018,82(2):e00068-e00017.
[20] HUANG R,LI G Q,ZHANG J,et al.Control of postharvest Botrytis fruit rot of strawberry by volatile organic compounds of Candida intermedia[J].Phytopathology,2011,101(7):859-869.
[21] 李文娟.瑞香狼毒抑菌活性及其作用机制的初步研究[D].成都:四川大学,2006.
LI W J.The antibiotic activity of the extracts of the root of the Stellera chamaejasme L.and the preliminary studies on the mechanism[D].Chengdu:Sichuan University,2006.
[22] LIU S,WANG W J,DENG L L,et al.Control of sour rot in citrus fruit by three insect antimicrobial peptides[J].Postharvest Biology and Technology,2019,149:200-208.
[23] 陈丹.拮抗菌对灰葡萄孢霉菌的抑制作用[D].大连:大连工业大学,2019.
CHEN D.Research on the inhibitory effect of antagonistic bacteria against Botrytis cinerea[D].Dalian:Dalian University of Technology,2019.
[24] 刘元元,庞学兵,李国,等.棉花黄萎病生防菌的筛选及挥发性抑菌物质检测[J].西北农业学报,2019,28(5):820-829.
LIU Y Y,PANG X B,LI G,et al.Screening for bio-control bacteria against cotton Verticillium wilt and detection of volatile antimicrobial substances[J].Acta Agriculturae Boreali-Occidentalis Sinica,2019,28(5):820-829.
[25] RYU C M,FARAG M A,HU C H,et al.Bacterial volatiles promote growth in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(8):4927-4932.
[26] GOMES A A M,QUEIROZ M V,PEREIRA O L.Mycofumigation for the biological control of post-harvest diseases in fruits and vegetables:A review[J].Austin Journal of Biotechnology and Bioengineering,2015,2(4):1-8.