作为中国传统白酒生产领域中一类应用广泛的糖化发酵剂,大曲是酿造过程的重要动力来源,可直接影响白酒产品的质量和出酒率,素来有“酒之骨”的美誉[1]。大曲由小麦(或配有大麦、豌豆)经固态发酵制成,是集微生物菌系、酶系及物系于一体的复合生物制品,其中微生物类群是影响大曲品质的关键因素之一[2]。由于多采用生料制曲、自然接种、人工安曲,大曲发酵涉及了来源丰富的微生物种类[3]。此外,微生物的生长代谢会受到温度、湿度、酸度、含氧量等环境因素的影响,这导致通风、堆积、翻曲、转库等人为手段均会扰动大曲发酵效果。在诸多环境因素之中,温度极大程度上决定了成品大曲的类型,根据发酵顶温的不同,大曲可分成高温大曲(60~65 ℃)、中温大曲(50~60 ℃)和低温大曲(45~50 ℃)[4]。在传统酿造过程中,不同顶温类型的大曲常被用于不同香型白酒的生产投料[5]。
不同发酵顶温控制策略使得成品曲的理化指标、风味物质、微生物群落各不相同。随着分子生物技术的发展,高通量扩增子测序手段越来越多地被运用于大曲微生物群落结构研究。刘慧等[6]发现中温大曲中的优势细菌属为Weissella和Lactobacillus,并通过相关性分析发现温度是影响大曲微生物结构的主要环境因子。杜向军等[7]以成品机制大曲和人工大曲为研究对象,发现机制大曲不同部位的细菌构成具有较大差异,而人工大曲不同部位的细菌构成具有较高的相似性。CAI等[8]对具有不同发酵顶温的3种低温大曲(红心、后火、清茬)的微生物群落结构及风味剖面进行了探究,发现Thermoactinomyces和Lactobacillus在低温大曲中占据主导地位,且红心曲具有最高的细菌丰富度和多样性,而真菌则在清茬曲中占据类似优势。SHI等[9]从同一车间采集得到发酵顶温不同的3种高温大曲(黑曲、黄曲、白曲),并对它们的微生物群落结构及酶活特性进行了探究,发现白曲中的主要细菌及真菌类群分别为Oceanobacillus和Thermomyces,黄曲、黑曲中的优势菌分别为Kroppenstedtia和Thermoascus。冯佳婷等[10]以同一批制曲原料分别进行中温和高温发酵,发现高温大曲中Bacillus和Aspergillus的相对丰度显著高于中温大曲,而Lactobacillus和Weissella则反之。张清玫等[11]基于宏基因组学技术对3种香型白酒大曲微生物群落及其功能特征进行解析,通过LEfSe分析揭示浓香型大曲特征细菌属为Bacillus,高丰度的Bacillus有利于四甲基吡嗪和2,3-丁二醇的生成,清香型大曲特征菌群以Lactobacillus、Weissella等产酸细菌为主,酱香型大曲中的特征细菌为Desmospora。
截止至目前,关于不同顶温类型大曲的研究仍多存在平行样取样个数偏少等缺陷,且很少涉及同一顶温类型不同来源的大曲取样,这造成相应的论证设计在全面性、准确性、客观性上仍稍显薄弱。据此,本研究以高通量测序技术为手段,以同一地区不同厂家来源的中温大曲和高温大曲为研究对象,更加系统地对两类大曲在细菌群落组成及多样性上的差异进行探究,旨在为大曲生产和研究提供参考。
1 材料与方法
1.1 材料与试剂
样品:本研究所采集的中温及高温大曲均由产自河南的软质普通小麦(Triticum aestivum)发酵制成,从制曲起始至最终进行样品采集的时间均为3个月。
主要试剂:Soil DNA Kit,美国Omega公司;葡萄糖、琼脂糖、可溶性淀粉,生工生物工程(上海)股份有限公司;NaOH、盐酸、次甲基蓝、碘、KI、CuSO4·5H2O、酒石酸钾钠、乙酸、乙酸钠,泸州聚合化工有限公司。
1.2 仪器与设备
ME20A电子分析天平、SevenExcellence多参数测试仪,瑞士Mettler-Toledo公司;MLS-3751L-PC高压蒸汽灭菌锅,日本Sanyo公司;NanoDrop2000微量紫外可见分光光度计,美国Thermo Scientific公司;5804R冷冻离心机,德国Eppendorf公司;TL2010S中通量组织研磨破碎仪,鼎浩源科技发展(天津)有限公司;DHG-9245A电热鼓风干燥箱,上海一恒科技有限公司。
1.3 实验方法
1.3.1 样品采集
大曲样品于2020年12月至2021年1月采集自西南部赤水流域(优质白酒生产核心区域)4家企业(分别编号为A、B、C、D)。A、B两家企业从事中温大曲生产,C、D两家企业从事高温大曲生产。于每家企业库房内随机采集6块符合正常发酵感官特点的同批次大曲,共计24块。根据顶温类型及来源企业的不同,4组大曲样品分别编号为MT-A、MT-B(中温大曲)和HT-C、HT-D(高温大曲),另按照“组别-数字”组合为所有样品一一编号。将每块大曲粉碎混合均匀后的适量样品置入无菌袋中,于-80 ℃保藏备用。
1.3.2 理化指标的检测
样品水分、粗淀粉、总酸、还原糖、糖化力等理化指标参照轻工业行业标准QB/T 4257—2011《酿酒大曲通用分析方法》进行测定。
1.3.3 大曲基因组提取及扩增子测序
称取2 g左右大曲样品,使用组织研磨破碎仪结合液氮冷冻对样品进行均质化、微粒化处理。使用试剂盒进行总DNA提取,采用1%琼脂糖凝胶电泳检测DNA提取效果,采用微量分光光度计检测其纯度和浓度。检测合格后,将24份DNA样品用干冰寄送至上海派森诺生物科技有限公司,执行后续的特定片段扩增及测序操作,所使用的细菌通用引物包括正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)[12]。
1.3.4 数据处理
采用派森诺云平台(https://www.genescloud.cn/)基于QIIME2软件对测序得到的原始序列进行质量控制,并通过去重(相当于以100%相似度进行聚类)操作得到扩增子序列变异(Amplicon sequence variants,ASVs)序列及表格,使用Silva 132数据库对ASVs进行分类学注释。利用云平台上的在线工具进行群落多样性及组成分析。利用联川云平台(https://www.omicstudio.cn/tool/)完成线性判别分析-效果量(linear discriminant analysis-effect size,LEfSe)分析,所涉及到的Kruskal-Wallis检验及进一步的Wilcoxon检验过滤阈值均设为0.05,LDA过滤阈值设为3。利用R软件计算微生物属水平单元之间的Spearman相关性系数并进行可视化分析。原始数据已上传国家基因组科学数据中心GSA数据库(https://ngdc.cncb.ac.cn/gsa/),数据检索号为CRA007466。
2 结果与分析
2.1 不同发酵顶温大曲的理化指标分析
大曲理化指标一方面代表了微生物的生长环境,另一方面也反映出菌群生理代谢对大曲功能的潜在影响,4组样品主要理化指标测定结果如表1所示。大曲的还原糖含量并未因顶温类型的不同产生显著差异,且水分、粗淀粉、总酸的含量值也未在两类大曲之间呈现出明显的分化趋势。其中,HT-C组样品的粗淀粉含量显著低于其他组,总酸含量却显著高于其他组,提示此组样品中的微生物可能将更多的多糖类物质通过糖酵解等途径进一步转化成了酸类物质,从而表现为酸的累积。MT-A组样品的水分含量最低,不过此组样品其他理化指标测定值与同为中温大曲的MT-B组样品均相近,这表明这一自然发酵过程对水分控制的要求可能并不是十分严苛。
表1 不同顶温大曲样品理化指标
Table 1 Physicochemical indices of Daqus of different peak temperatures
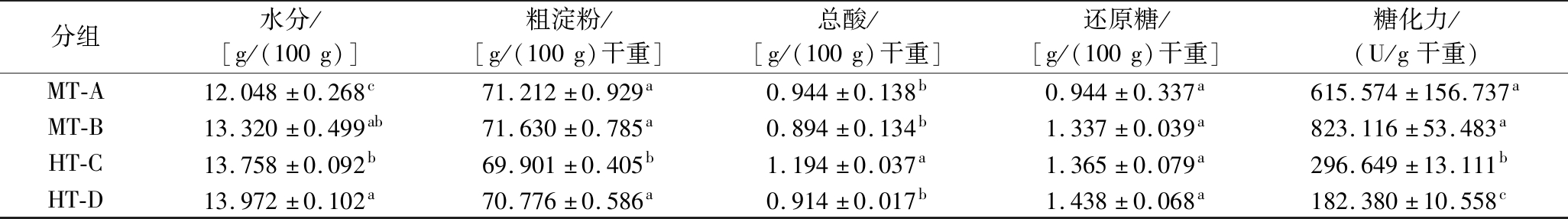
分组水分/[g/(100g)]粗淀粉/[g/(100g)干重]总酸/[g/(100g)干重]还原糖/[g/(100g)干重]糖化力/(U/g干重)MT-A12.048±0.268c71.212±0.929a0.944±0.138b0.944±0.337a615.574±156.737aMT-B13.320±0.499ab71.630±0.785a0.894±0.134b1.337±0.039a823.116±53.483aHT-C13.758±0.092b69.901±0.405b1.194±0.037a1.365±0.079a296.649±13.111bHT-D13.972±0.102a70.776±0.586a0.914±0.017b1.438±0.068a182.380±10.558c
注:数值表示为“平均值±标准偏差”;同列标注的不同字母代表数值间存在差异性显著(P<0.05)。
与前人研究结果相吻合[10,13],高温大曲在37 ℃条件下表现出的糖化酶活力显著低于中温大曲,这反映出分泌胞外糖化酶的微生物可能在中温大曲中实现了更高程度的富集,以及这些微生物分泌的糖化酶作用温度范围可能更加贴近常温。但根据两类大曲的淀粉含量,发现中温大曲在自身发酵过程中并未比高温大曲涉及更大程度的淀粉转化,不过前者在促进多糖类物质分解上所展现的更优潜力,有利于小分子物质的生成并推动后续酒醅发酵。
2.2 不同发酵顶温大曲的细菌群落多样性及物种组成分析
2.2.1 测序数据有效序列统计及合理性分析
利用DADA2方法去除Illumina Novaseq平台测序数据中的标签及引物信息,并对双端数据进行了过滤低质量序列、降噪、拼接及去除嵌合体序列等操作[14]。质控之后,24份样品测序数据中有效序列数最小值为54 808条,最大值为89 025条,平均数为63 509条,中位数为61 516条。各大曲样品细菌测序数据Chao1指数稀释曲线如图1所示,随着测序深度的加大,所有曲线均趋向平坦,这说明每份样品测序数据量均较合理,能有效反映样品中的细菌群落信息。

图1 不同顶温大曲样品细菌群落Chao1指数稀释性曲线
Fig.1 Rarefaction curves of Chao1 index of bacterial community in Daqus of different peak temperatures
2.2.2 细菌群落α-多样性分析
按样本最小序列数进行抽平后,计算Observed_species、Chao1、Pielou_e、Goods_coverage、Shannon、Simpson等6种常见多样性指数,旨在反映各样品生境内细菌群落的丰富度(Richness)和均匀度(Evenness),如图2所示。

图2 中温大曲及高温大曲细菌群落常见α-多样性指数比较
Fig.2 Comparison of common α-diversity indices of bacterial community in MT-Daqu and HT-Daqu
中温大曲细菌群落的Goods_coverage指数(即覆盖率)显著高于高温大曲(P<0.05)。而通过对比其他5种指数,可发现高温大曲细菌群落所对应的多样性指数数值虽然平均高于中温大曲,但并不存在显著性差异(P>0.05)。因此,从整体上看,两种类型大曲在细菌物种数量、群落稳定性方面均无显著差异,且所有样品覆盖率均大于98.5%,进一步表明本研究测序结果能较真实地反映实际状况。
2.2.3 细菌群落β-多样性分析
与表征局部生境内多样性的α-多样性分析不同,β-多样性分析侧重于展示不同生境群落之间物种组成的相异性,基于Bray-Curtis距离的细菌群落非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析及主坐标分析(principal coordinate analysis,PCoA)结果如图3所示。
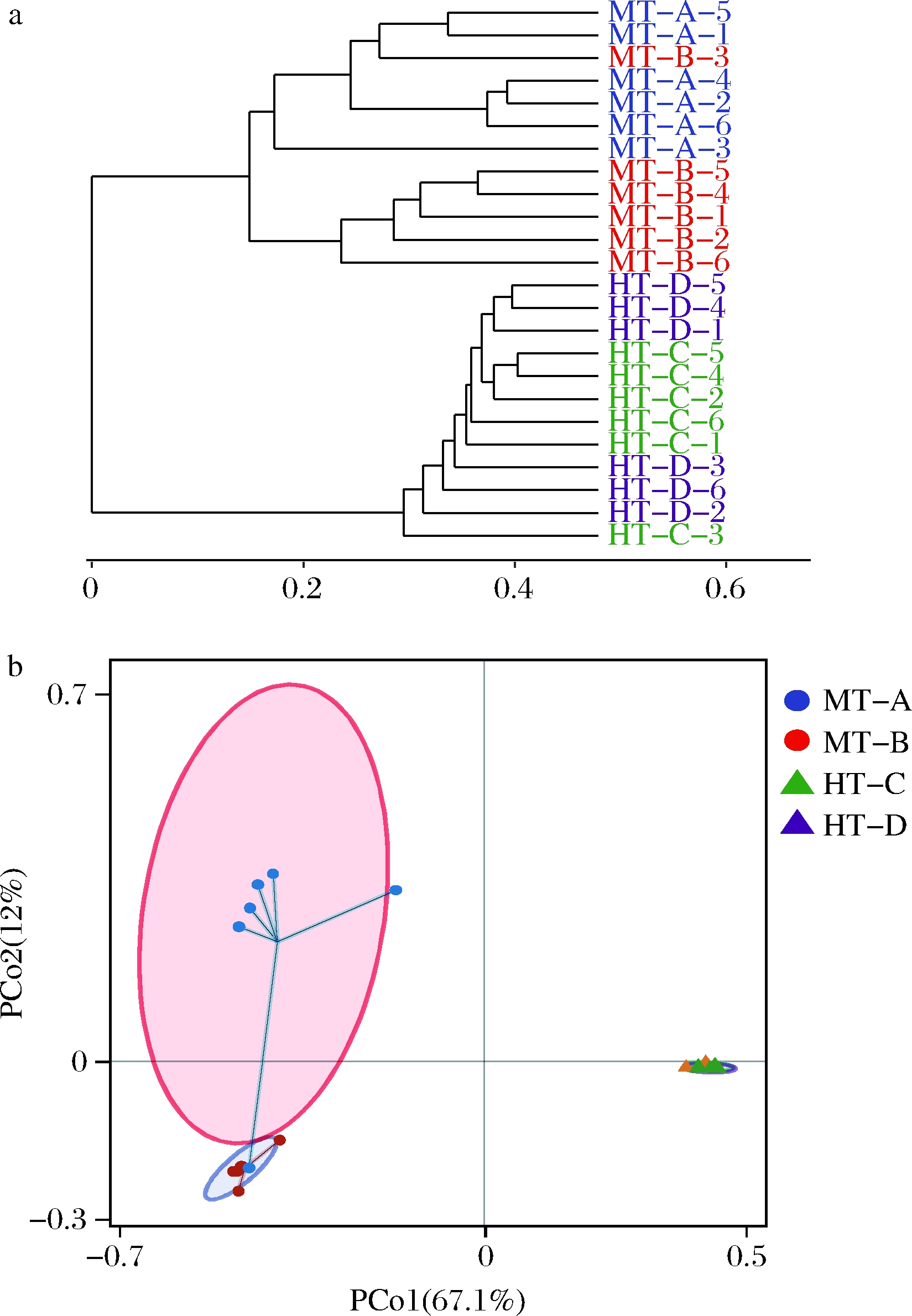
a-UPGMA聚类树;b-PCoA分析
图3 中温大曲及高温大曲细菌群落β-多样性分析
Fig.3 Analysis of β-diversity of bacterial community in MT-Daqu and HT-Daqu
据图3-a,24份大曲可明显根据顶温类型的不同聚为两大类,这说明中温大曲与高温大曲细菌区系之间存在显著差异。各中温大曲样品之间的距离相较高温大曲组的内部距离更远,这说明高温大曲样品群落间的差异相对较小,原因可能是高温作为一种主要的环境压力,对群落演替有着较强的驱动力,能够使得发酵顶温相似的样品拥有较为趋同的群落演替方向。此外,同种顶温类型不同厂家来源的2组样品虽在层级聚类树中各自表现出一定的聚集性,但也有一部分样品与非同来源的样品展示出更高的相似度,这一现象在高温大曲内部表现得尤其明显,这表明顶温类型比工艺细节、生产条件、原料质量等其他因素,可能对细菌群落具有更加强力的贡献。在图3-b展示的PCoA分析结果中,PCo1和PCo2对样品差异的解释度分别为67.1%和12%,两轴解释度之和接近80%,能较好反映不同样品间的相似及相异程度。总的来说,PCoA与UPGMA的分析结果基本一致。
2.2.4 细菌群落组成分析
参考Silva数据库对ASV序列进行物种注释,可得到各分类水平上的物种组成及丰度信息,属水平上的细菌群落物种组成结果如图4所示。

a-不同样品的细菌群落组成;b-不同顶温类型的细菌群落组成(按组内均值计算)
图4 中温大曲及高温大曲细菌群落组成分析(属水平)
Fig.4 Composition of bacterial community in MT-Daqu and HT-Daqu (at genus level)
据图4-a,中温大曲中的优势细菌主要包括魏斯氏菌属(Weissella)、乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)等,此外MT-B组样品中相对丰度较高的种群还包括泛菌属(Pantoea)。总的来说,虽然2组不同厂家来源的中温大曲在优势细菌种类上较为类似,但在组成比例上存在明显差异,而2组高温大曲的优势细菌在种类及比例上均较为相似。克罗彭施泰特氏菌属(Kroppenstedtia)、枝芽孢杆菌属(Virgibacillus)作为高温大曲中的绝对优势菌,在所有样品中的相对丰度总和均超55%,最高达到74.53%(HT-C-3)。此外,Bacillus、糖多孢菌属(Saccharopolyspora)、大洋芽孢杆菌属(Oceanobacillus)在本研究所有高温大曲样品中有着较为稳定的分布。由图4-b可知,两类大曲的细菌群落呈现明显差异,包括Weissella、Lactobacillus在内的乳酸菌(lactic acid bacteria,LABs)以及包括Kroppenstedtia、Virgibacillus、Oceanobacillus在内的芽孢杆菌目(Bacillales)细菌分别组成了中温及高温大曲的细菌优势种群。
2.3 不同发酵顶温大曲的细菌群落物种差异分析
2.3.1 不同发酵顶温大曲的细菌群落Venn图分析
基于样品ASV表进行Venn图绘制,可帮助了解不同分组样品之间共现和特有ASV的数量,结果如图5所示。据图5-a,两类大曲中共检出15 433个ASV,而两类大曲中的共现ASV仅709个,约占两类大曲特有ASV数量的10%,这说明温度及发酵过程相关环境因子对生境内细菌种类影响巨大,进而随之影响成品曲的整体功能表现。据图5-b,同一类型不同厂家来源的样品之间共现ASV数量较高,且4组样品均包含较高数量的特有ASV。
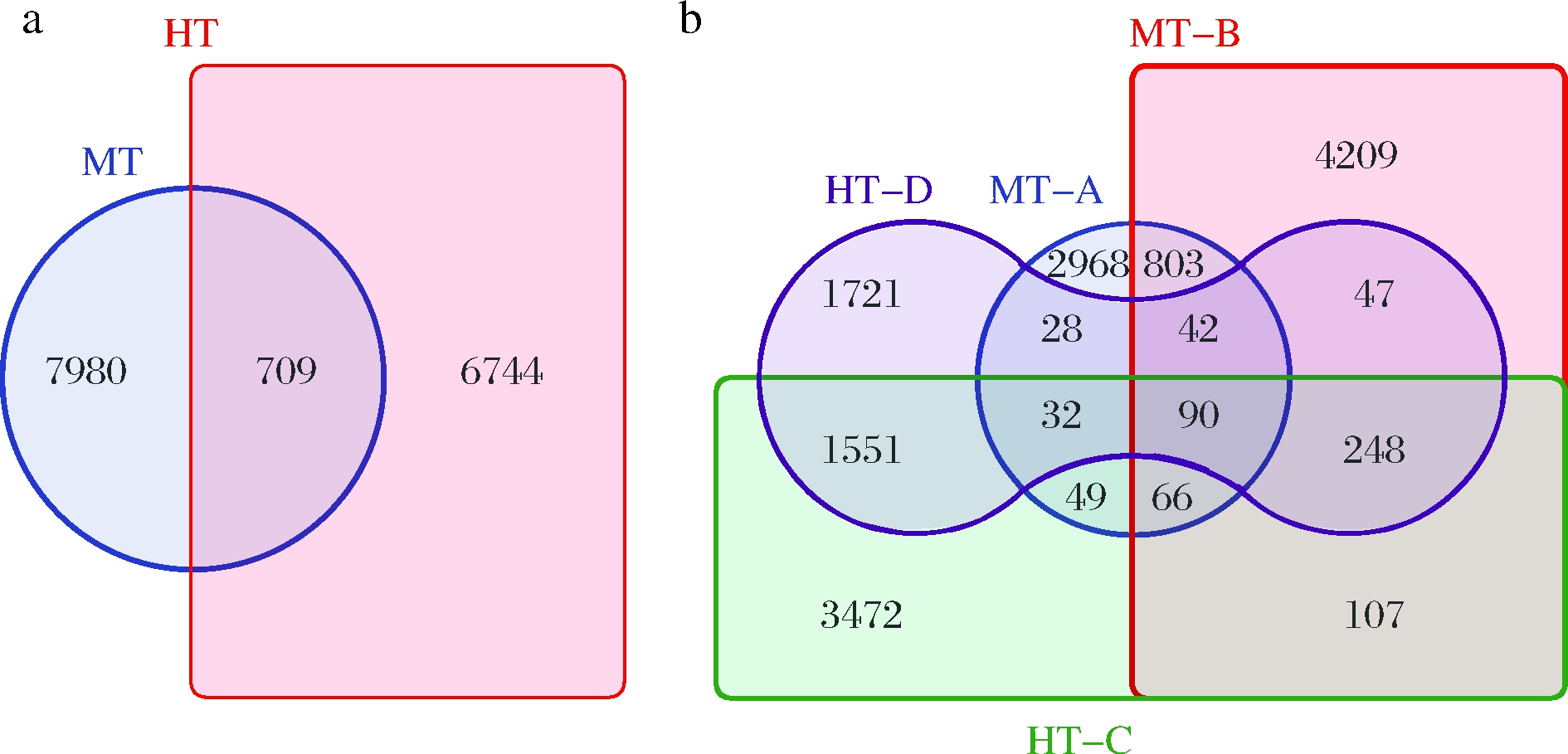
a-两类大曲细菌群落Venn图;b-4组大曲细菌群落Venn图
图5 中温大曲及高温大曲细菌群落Venn图
Fig.5 Venn diagrams of bacterial community in MT-Daqu and HT-Daqu
2.3.2 不同发酵顶温大曲的细菌群落LEfSe分析
过滤掉低丰度ASV(占比<0.1%)后,通过进一步的LEfSe分析辨别各组间在丰度上存在显著差异的标志物种(Biomarker),结果如图6所示。

图6 中温大曲及高温大曲细菌群落的LEfSe分析图
Fig.6 LEfSe results of bacterial community in MT-Daqu and HT-Daqu
中温大曲细菌群落中的标志物种主要集中在进化树上的3处分支,其中一大支主要集中在a1[乳酸杆菌目(Lactobacillales)],以t(Lactobacillus)下的种群数目最多,另在w[明串珠菌属(Leuconostoc)]及x(Weissella)下也各有2个种群。另一大支主要集中在a9[变形菌门(Proteobacteria)]下的a6[肠杆菌科(Enterobacteriaceae)]分支,分别归属于a2[肠杆菌属(Enterobacteria)]、a3[科萨克氏菌属(Kosakonia)]、a4(Pantoea)、d5[分类地位未知的肠杆菌(unclassified_Enterobacteriaceae)]分支下。剩下一小支则位于s(Bacillales)的o(Staphylococcus)单元内。高温大曲的标志物种则在进化分支的科水平上表现出4处聚集,分别为c[假诺卡氏菌科(Pseudonocardiaceae)]、l[芽孢杆菌科(Bacillaceae)]、n[芽孢乳酸杆菌科(Sporolactobacillaceae)]、r[高温放线菌科(Thermoactinomycetaceae)],其中以Bacillaceae所囊括的种群数目最多。
2.3.3 不同发酵顶温大曲的细菌群落物种丰度分布趋势分析
为了进一步探究样本主要物种之间的组成差异,对细菌群落丰度前20的物种在不同大曲样品中的丰度分布趋势以热图形式可视化,数据按行进行了标准化处理,并按行及列分别基于Euclidean距离聚类,结果如图7所示。

图7 中温大曲及高温大曲种水平优势细菌组成热图
Fig.7 Heatmap of dominant bacteria in MT-Daqu and HT-Daqu at species level
大曲样品基于主要物种的分布趋势聚为两大簇,恰好符合基于顶温类型的分组规律,这表明这些主要物种的动态变化是大曲细菌群落从发酵伊始向最终状态演替的标志性事件之一。20个优势物种可基于一定相似度聚为三大簇,簇I中类群在高温大曲中有较高丰度的分布,主要包括某些归属于Bacillales分类单元下的微生物及一种放线菌——直杆糖多孢菌(Saccharopolyspora rectivirgula),前者涵盖3种Bacillus菌[热酸芽孢杆菌(Bacillus thermolactis)、混料芽孢杆菌(Bacillus farraginis)、解半乳糖苷芽孢杆菌(Bacillus galactosidilyticus)]、2种Oceanobacillus菌[淤泥大洋芽孢杆菌(Oceanobacillu caeni)、Oceanobacillu indicireducens]、大曲岩石芽孢杆菌(Scopulibacillus daqui)以及Kroppenstedtia eburnea。簇II下类群则在中温大曲中分布频率较高,它们均属于乳酸菌的范畴。类肠膜魏斯氏菌(Weissella paramesenteroides)被发现于酱醪等多种自然发酵产品中,具有较优的短链脂肪酸合成能力[15]。短乳酸杆菌(Lactobacillus brevis)、类食品乳杆菌(Lactobacillus paralimentarius)、发酵乳酸杆菌(Lactobacillus fermentum)、桥状乳酸杆菌(Lactobacillus pontis)等4种Lactobacillus菌均在多篇前人文献中有过报道,是不同地域中温大曲中的常见菌种[16-18]。簇III内的5种细菌则主要在MT-B组中温大曲中占比较高,由于这些菌的分布趋势并未因大曲顶温类型的不同呈现明显分化,在此不予讨论。
2.4 大曲细菌群落主要菌属相关性分析
大曲细菌群落的动态演替变化是所有细菌共同参与的结果,为更加深入地了解大曲发酵规律,本节对各优势种群内部相关性进行了探究,显著性相关的判定标准设置为P<0.05且|ρ|>0.6,结果如图8所示。

图8 中温大曲及高温大曲属水平优势细菌相关性系数图
Fig.8 Diagram of correlation coefficients among dominant bacteria in MT-Daqu and HT-Daqu at genus level
值得注意的是,Virgibacillus、Oceanobacillus、Scopulibacillus、假纤细芽孢杆菌属(Pseudogracilibacillus)等多种芽孢杆菌与Weissella、Lactobacillus、Leuconostoc、Lactococcus、片球菌属(Pediococcus)等多种乳酸菌之间多呈显著负相关,而这两大类群内部成员之间则多呈显著正相关。Bacillus被公认为高温大曲中的优势细菌,具有丰富的酶系和产风味能力[19]。而随着近年来生物分类学的不断发展,进化分支上的各分类单元被更精细地界定,Virgibacillus、Oceanobacillus、Scopulibacillus等多种Bacillus近源属渐渐走入研究者视野,它们同样能够耐受高温发酵环节并在干燥成熟大曲中留存下来,并可能与高温大曲特征风味间有着密切的关系[9]。乳酸菌可代谢产生细菌素和有机酸等多种抑菌化合物,有效抑制腐败菌及致病菌的生长,在食品防腐保鲜领域有着重要地位[20]。上述两大类菌群之间及内部的拮抗或共生关系反映出大曲菌群相关性网络中存在着多个高相关性节点,也称作Hub节点(与一定数量的其他微生物均呈相关性的一类微生物)[21]。这些正负关联性的存在能够对菌群结构的稳定性产生正面影响,同时也构成了菌群演替的内在调控动力及机制,有助于维持整个发酵体系的正常、稳态发展,可能在一定程度上决定了大曲群落的最终发展方向,保障了不同批次间大曲质量的较高重复性、稳定性。
本研究另发现Bacillus、Thermoactinomyces、Streptomyces与其他优势类群之间的关联性不大,不属于群落相关性网络中的Hub节点,它们对整体群落结构的塑造力以及对维持菌群网络平衡的贡献可能较弱。不过值得注意的是,类似Bacillus这样的大型分类单元,其下辖的种群及ASV数目非常多,因此基于其属水平丰度的相关性分析容易以偏概全,导致它的实际贡献性被低估。
3 结论
本研究通过高通量测序技术对发酵过程顶温温度不同的两类大曲细菌群落结构及多样性进行了系统探究。结果表明:(1)同一类型及来源曲块之间的细菌群落相似程度较高,而相较于顶温类型,厂家来源对大曲细菌群落结构影响较小;(2)中温大曲与高温大曲细菌群落结构差异主要体现在物种组成上,物种数量、群落稳定性整体相差不大,除覆盖率外的其他α-多样性指数均无显著性差异;(3)两类大曲样品之间共检测到709个共现ASV,仅约占两类大曲特有ASV数量的10%,包括Weissella、Lactobacillus等在内的乳酸菌以及包括Kroppenstedtia、Virgibacillus、Oceanobacillus等在内的芽孢杆菌目细菌分别构成了中温大曲与高温大曲的细菌优势类群;(4)大曲细菌群落中的多种芽孢杆菌与多种乳酸菌之间多呈显著负相关,而这两大类细菌内部种群之间则多呈显著正相关,这些拮抗和共生关系能够对菌群网络的稳定产生正面影响,有利于大曲群落的演变更替趋势在不同来源、不同批次、不同曲块样品之间保持较高相似度。本研究通过对不同顶温类型的大曲细菌群落结构进行系统分析,进一步证实并解析了温度这一环境因素对成品大曲菌群的重要驱动与影响,并通过相关性分析有效解析菌群互作规律,对全面了解大曲发酵、科学指导大曲生产有重要意义。
[1] 胡承,邬捷锋,沈才洪,等.浓香型(泸型)大曲的研究及其应用[J].酿酒科技,2004(1):33-36.
HU C,WU J F,SHEN C H,et al.Research on Luzhou-flavor Daqu starter &its application[J].Liquor-Making Science &Technology,2004(1):33-36.
[2] YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Research International,2021,140:110037.
[3] 刘延波,赵志军,陈黄曌,等.高通量测序技术分析浓香型白酒中温曲和高温曲的细菌群落结构[J].现代食品科技,2018,34(5):229-235.
LIU Y B,ZHAO Z J,CHEN H Z,et al.Analysis of bacterial community structure in medium temperature Daqu and high temperature daqu of Luzhou-flavor liqu by high-throughput sequencing[J].Modern Food Science and Technology,2018,34(5):229-235.
[4] XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology,2017,83(23):e01550-e01517.
[5] ZHENG X W,TABRIZI M R,ROBERT NOUT M J,et al.Daqu:a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing,2011,117(1):82-90.
[6] 刘慧,涂璇,吕育财,等.中高温大曲在制曲过程中微生物区系演替特征及功能研究[J].食品与发酵工业,2022,48(22):180-186.
LIU H,TU X,LYU Y C,et al.Succession of microbial communities and function of medium-high-temperature Daqu during the starter-making process[J].Food and Fermentation Industries,2022,48(22):180-186.
[7] 杜向军,明红梅,马浩,等.机制与人工大曲曲块部位间微生物群落结构差异及关键影响因素分析[J].食品与发酵工业,2023,49(3):83-91.
DU X J,MING H M,MA H,et al.Microbial community structure differences and key influencing factors among different parts of mechanical and artificial Daqu[J].Food and Fermentation Industries,2023,49(3):83-91.
[8] CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Research International,2021,150:110734.
[9] SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International,2022,156:111298.
[10] 冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
FENG J T,LU Z M,SHI W,et al.Effects of different culture temperatures on microbial community structure,enzyme activity,and volatile compounds in Daqu[J].Chinese Journal of Applied and Environmental Biology,2021,27(3):760-767.
[11] 张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
ZHANG Q M,ZHAO X R,LI J H,et al.The relationship between microbial community and flavors of three types of Daqu[J].Food and Fermentation Industries,2022,48(10):1-8.
[12] FIERER N,JACKSON J A,VILGALYS R,et al.Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J].Applied and Environmental Microbiology,2005,71(7):4117-4120.
[13] LIU J J,CHEN J Y,FAN Y,et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu:A Chinese industrial fermentation starter[J].Journal of the Science of Food and Agriculture,2018,98(1):113-121.
[14] CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:High-resolution sample inference from Illumina amplicon data[J].Nature Methods,2016,13(7):581-583.
[15] 李巧玉,陈坚,曾伟主,等.酱醪中魏斯氏菌的分离及特性分析[J].微生物学通报,2018,45(11):2449-2462.
LI Q Y,CHEN J,ZENG W Z,et al.Isolation and characterization of Weissella strains from soy sauce moromi mash[J].Microbiology China,2018,45(11):2449-2462.
[16] ZHANG J,LIU S P,SUN H L,et al.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of Baijiu Daqu and Huangjiu wheat Qu[J].Food Research International,2022,152:110707.
[17] 肖辰.泸型酒中温大曲微生物群落的演替及其对酒醅发酵的贡献[D].无锡:江南大学,2018.
XIAO C.Succession of mid-temperature Daqu microbiota and its contribution to the fermentation of Luzhou-flavor Baijiu[D].Wuxi:Jiangnan University,2018.
[18] 张会敏.古井贡酒微生物群落结构及其与主要风味物质的关联研究[D].哈尔滨:哈尔滨工业大学,2017.
ZHANG H M.Study on GujingTribute microbial community structure and its association with liquor flavor molecules[D].Harbin:Harbin Institute of Technology,2017.
[19] WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology,2017,250:59-67.
[20] PAUL ROSS R,MORGAN S,HILL C.Preservation and fermentation:Past,present and future[J].International Journal of Food Microbiology,2002,79(1-2):3-16.
[21] 黎瑶依,胡小霞,黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学,2021,42(18):164-170.
LI Y Y,HU X X,HUANG Y G.Analysis of the diversity of fungal flora in Maotai-flavor liquor brewing environment in Maotai town[J].Food Science,2021,42(18):164-170.