众所周知,乳制品、大豆加工等食品生产过程中会产生大量含有高浓度蛋白质的废水。2018年,全球乳制品产量达到7 500万t,比2017年增长2.9%[1]。乳制品废水的特征是富含大量碳水化合物和乳清/酪蛋白。同时,2019/2020年全球大豆平均产量达到3.37亿t,到2029年全球大豆产量可能达到4.06亿t[2]。大豆加工过程也会产生大量含蛋白质的废水。对于该类废水的处理,厌氧消化处理不仅效率高、成本低,而且可实现资源回收,因此被认为是一种非常有前景的技术。但高浓度蛋白质在厌氧分解时会产生高浓度的氨氮。一般认为氨氮浓度低于200 mg/L时有利于厌氧过程,因为氮是厌氧微生物的必要营养物;但高浓度的氨氮会对厌氧消化产生抑制。游离氨 (NH3)被认为是氨抑制的主要原因,游离氨分子可以通过被动扩散进入细胞,导致质子不平衡或钾缺乏[3]。因此,厌氧过程中需要控制氨浓度范围,进而缓解氨的抑制效应。相应措施包括稀释、共消化、汽提、磷酸铵镁沉淀、添加剂的使用(如沸石、微量元素)等[4]。其中,氨汽提和稀释方法已经成功地应用于大规模沼气生产[5]。原位厌氧氨汽提指在反应器内使用气体混合系统,氨不断从消化液中除去。但需要添加大量药剂来提高溶液的pH值[6]。稀释法在降低氨氮浓度的同时不利于产生CH4[7],而且会形成大量的沼液。
近年来,膜分离技术迅速发展,特别是脱氨膜的应用可以有效地从废水及消化液中去除和回收氨氮[8-9]。废水中的游离氨通过疏水脱氨膜转移,并被酸性溶液吸收。一些研究表明,针对高浓度蛋白底物,通过利用消化系统自身的碱度,在不需调节pH的条件下实现氨氮的去除和回收氨资源。这为降低高浓度蛋白废水厌氧消化反应器中氨氮的浓度,进而降低氨氮对厌氧消化系统的抑制作用提供了一种可行的方法。基于此,本研究将高浓度蛋白废水厌氧消化与膜法氨回收相结合,分析该废水厌氧消化过程中氨氮的变化过程及脱氨过程对厌氧消化性能的影响,评估氨同步回收对高浓度蛋白废水厌氧消化性能的促进作用,并阐明其作用机理,为该技术的推广应用奠定基础。
1 材料与方法
1.1 试剂与材料
本研究中所采用高浓度蛋白废水为人工配水,采用蛋白胨配制,主要成分为:30 g/L胰蛋白胨,0.1 g/L NaCl,0.09 g/L KH2PO4,0.296 g/L CaCl2·2H2O,0.041 g/L MgSO4·7H2O,2.0 mg/L FeSO4·7H2O,0.3 mg/L CoSO4·7H2O和0.2 mg/L NiCl2·6H2O,国药集团试剂有限公司。该废水主要水质特征为化学需氧量(chemical oxygen demand, COD)31 520 mg/L;pH值5.62;氨氮115 mg/L,可溶性蛋白15 810 mg/L。接种厌氧颗粒污泥取自无锡某公司柠檬酸生产废水厌氧消化反应器。实验前,采用蒸馏水对接种污泥进行淘洗以去除其中溶解性有机物,然后过筛去除其中的杂物和大颗粒物。预处理后颗粒污泥的总固体(total solid, TS)和挥发性固体(volatile solid, VS)分别为10.21%和8.5%。污泥接种比例(VS与COD质量比)为1∶1.5。脱氢酶、乙酸激酶和蛋白酶试剂盒,苏州科铭生物技术有限公司;Mag-Bind土壤DNA试剂盒,美国Omega公司。
1.2 仪器与设备
ETO-2.5X8型气渗透膜,苏州艾吉克膜科技有限公司;GC-2014型气相色谱仪、GC-2010PLUS型气相色谱仪,日本岛津公司;F-7000型荧光分光光度计,日本日立公司。
1.3 实验装置及实验方法
采用1.0 L的血清瓶作为厌氧脱氨反应器(有效容积0.8 L),并构建厌氧消化与膜脱氨组合系统,如图1所示。反应器配有气体采样袋和取样口,放置于水浴锅中,使反应温度控制在37.0 ℃。在高浓度蛋白废水进行厌氧消化处理过程中,实验组采用气渗透膜对厌氧过程中所产生的氨氮进行回收,对照组在厌氧消化过程中不进行脱氨处理。实验组反应器的脱氨处理分别在厌氧消化反应第1、2、3.5、5、12天后进行,具体脱氨过程和时间点如表1所示。

图1 实验装置图
Fig.1 Experimental set-up
表1 脱氨膜运行过程
Table 1 Operation process of membrane contactor

运行工况第1次(1 d)第2次(2 d)第3次(3.5 d)第4次(5 d)第5次(12 d)脱氨膜系统运行时间/h1.51.51.51.52累积脱氨量/mg3789511 5291 9292 614
注:实验条件:温度37 ℃,废水流速250 mL/min,体积0.5 L;硫酸流速200 mL/min,浓度0.2 mol/L,体积0.5 L
1.4 分析方法
废水pH、COD、氨氮和可溶性蛋白指标按照标准方法测定[10]。分析测试前,水样以8 000 r/min离心10 min,上清液经0.45 μm膜过滤。每天收集沼气并测量其成分,使用配有热导检测器和填充柱的气相色谱仪分析沼气成分。挥发性脂肪酸(volatile fatty acids, VFAs)的浓度通过使用配备有火焰离子化检测器和毛细管柱的气相色谱仪测定。厌氧消化后采集污泥样品,并对污泥的胞外聚合物(extracellular polymeric substance, EPS) 进行分步提取,分别获得松散型EPS(LB-EPS)和紧密型EPS(TB-EPS)[11],并使用荧光分光光度计对EPS特征进行三维激发-发射矩阵(excitation emission matrix, EEM)荧光光谱分析。激发波长(excitation wavelength,Ex)和发射波长(emission wavelength,Em)扫描范围分别为200~450 nm和200~550 nm,步长为5 nm,狭缝宽度为5 nm,样品的扫描速度为2 400 nm/min。脱氢酶、乙酸激酶和蛋白酶活性采用试剂盒测定,并参考ZHAO等[12]报道的方法对辅酶F420活性进行测定。
1.5 DNA提取和PCR扩增
厌氧消化反应初始和反应结束时采集污泥样品,分别标记为A1(初始)、A2(对照组)和A3(实验组),并对微生物群落结构变化进行分析。使用Mag-Bind土壤DNA试剂盒对DNA进行提取。通过16S rRNA基因高通量测序对微生物群落进行分析。用341F(5′-CTACGGGNGGCWGCAG-3′)和805R(5′-GATCACHVGGGTATCTAATCC-3′)引物扩增细菌16S rRNA基因V3-V4区。采用第一轮引物340F(5′-CCCCTAYGGGGYGCASCAG-3′)和1000R(5′-GGCCCATGCA-CYWCYTCTC-3′)以及第二轮引物349F(5′-GGYGCASCAGKCGMGAAW-3′)和806R(5-GGACTACVSGGGTATCTAAT-3′)扩增古菌16S rRNA基因的V3-V4区。PCR扩增采用WANG等[13]报道的方法,并使用高通量Illumina Miseq平台对扩增产物进行纯化和测序。16S rRNA基因高通量测序由上海生工生物工程股份有限公司完成。
2 结果与分析
2.1 可溶性蛋白、氨氮的变化
蛋白质的构象和结构比较复杂,需要水解酶的参与下被降解为多肽和氨基酸,才能被产甲烷菌进行利用[14]。厌氧消化过程中的可溶性蛋白的变化如图2-a所示。从反应初始到第7天,由于蛋白质分子的水解,对照和实验组的可溶性蛋白浓度快速降低,而且经膜脱氨处理的实验组中可溶性蛋白浓度始终低于对照组。反应第1天,对照和实验组的可溶性蛋白浓度降低最为迅速,反应第2~7天呈缓慢下降;从第7天到反应结束,可溶性蛋白浓度保持在一个相对稳定的水平,最终对照组残留可溶性蛋白1 308 mg/L,实验组残留可溶性蛋白84 mg/L,实验组可溶性蛋白基本降解完全。

a-可溶性蛋白浓度;b-氨氮浓度
图2 高浓度蛋白废水厌氧消化过程中可溶性蛋白和氨氮浓度的变化
Fig.2 Variation of soluble protein and ammonia nitrogen concentration during anaerobic digestion of wastewater with high content of protein
氨氮来源于蛋白质的降解,适宜的氨氮浓度在微生物生长代谢中发挥着重要作用。蛋白质首先转化为氨基酸,然后经脱氨和脱羧过程产生氨、有机酸、二氧化碳和胺等主要产物[14]。厌氧消化过程中氨氮浓度的变化如图2-b所示。在前4 d,对照组反应器中氨氮浓度快速上升,第4天时氨氮浓度高达3 000 mg/L。然后,氨氮含量逐渐增加,直至反应结束。氨氮从初始的115 mg/L增至4 192 mg/L。发酵液中氨氮的含量由细菌的同化和蛋白质降解所决定[15]。从氨氮的变化来看,释放速率远远超过了同化的量。从COD的变化来看,对照组第5天后的有机物不能被继续降解,可能是高氨氮在较高pH条件下,形成大量的游离氨,疏水性氨分子可以被动扩散的方式进入细胞中,导致质子不平衡以及K+的流失等[16],从而对微生物菌群表现出强烈的抑制作用,降低废水厌氧消化性能。
由于实验组在反应第1、2、3.5、5、12天进行膜脱氨处理,分别从反应器中去除氨氮378、573、578、400、685 mg,最终累积去除氨氮量为2 614 mg;从而使得整个厌氧消化过程中实验组反应器氨氮浓度维持在2 000 mg/L以下(1 075~1 949 mg/L)。从可溶性蛋白浓度及COD(图3-c)变化来看,实验组一定程度上缓解了氨抑制,第5天后有机物和可溶性蛋白继续被微生物利用,最终底物基本被完全降解。

a-累积气体产量;b-累积甲烷产量;c-出水COD浓度
图3 高浓度蛋白废水厌氧消化过程中累积气体产量,累积甲烷产量和出水COD浓度变化
Fig.3 Variation of cumulative biogas production, cumulative methane production, and effluent COD concentration during anaerobic digestion of wastewater with high content of protein
2.2 甲烷产量和COD的变化
沼气和甲烷的产量变化如图3-a和图3-b所示。总体上对照和实验组的沼气和甲烷累积产量经历了快速上升、缓慢上升和趋于平稳的过程。厌氧消化结束时,实验组反应器沼气及甲烷产量明显高于对照组,其中,实验组累产甲烷产量较对照组提高了54%。图3-c为厌氧消化过程中COD的变化趋势。实验组是在反应第1、2、3.5、5、12天进行了膜脱氨处理。随着反应进行,对照和实验组COD都在逐渐下降,但对照组在第5天时,因为高浓度氨氮的抑制作用导致出水COD不再降低,维持在16 000 mg/L左右;经膜脱氨处理后,实验组出水COD持续下降至1 144 mg/L。实验组COD去除率较对照组提高了88%。
2.3 VFAs、pH和碱度的变化
厌氧消化过程中所产生的高浓度游离氨往往会对产甲烷菌有较强的抑制作用,从而导致VFAs积累[17-18]。这个过程中,氨氮及pH变化让厌氧消化系统处于“抑制型假稳态”,运行虽稳定,但甲烷产量非常低[3]。在厌氧消化过程中,VFAs浓度和组分变化如图4-a和4-b所示。由图4-a可以看出,对照组中VFAs浓度不断提高,表明反应器中VFAs不断积累,反应结束时VFAs浓度达到7 676 mg/L;实验组中VFAs浓度出现先增加后降低的趋势,在第1天时VFAs浓度达到最高点为1 851 mg/L,之后在2~5 d维持在1 350 mg/L左右,然后持续下降,到12 d时VFAs被完全消耗。图4-b观察到的VFAs主要成分为乙酸、丙酸和丁酸。第5天时,对照组和实验组乙酸比例分别为55%和50%,但是两者乙酸含量相差很大,分别为3 302 mg/L (对照组)和709 mg/L(实验组),反应至第12天时,对照组乙酸占比77%,乙酸含量为5 933 mg/L;而实验组的乙酸被完全消耗。厌氧反应过程中对照组受高氨氮的影响,使乙酸向甲烷转化出现抑制,造成酸累积;而实验组经脱膜后,有效缓解氨抑制的影响浓度,促进了VFAs的消耗。

a-VFAs;b-VFAs组分;c-pH值;d-碱度
图4 高浓度蛋白废水厌氧消化过程中VFAs、对照和实验组第5天以及对照组反应结束时的VFAs组分、pH值和碱度变化
Fig.4 Variation of VFAs, VFAs components of control and experimental groups on the 5th day and at the end of control reactor, pH, and alkalinity during anaerobic digestion of wastewater with high content of protein
厌氧消化过程中生成了大量氨,导致碱度不断上升(图4-d),对照组最终碱度维持在10 740 mg/L,而且对照组碱度高于实验组。实验组经膜脱氨过程处理,会消耗一部分碱度,从第1天至反应结束,实验组碱度维持在4 893~6 194 mg/L。碱度较高,可以允许更多的酸性物质存在,缓冲性能较好。VFAs/碱度比值是反应厌氧消化系统稳定性的重要参数[19]。此值小于0.4时反应稳定,处于0.4~0.8出现系统不稳定,而大于0.8严重不稳定甚至反应停止。对照组VFAs/碱度为0.3~0.72,实验组为0~0.31,实验组较对照组更加稳定,经膜处理后的厌氧消化可以更加稳定的进行。
图4-c为对照和实验组厌氧过程的pH变化,2组反应器中pH值从初始的5.62上升到7.27,然后维持在7.5左右,第5~9天对照组的pH值略低于实验组。在对照组中,较高pH和氨氮浓度导致游离氨浓度较高,从而对厌氧消化产生不利影响。而经过脱氨后,实验组反应器中氨氮浓度得到有效降低,游离氨总量下降,从而减轻氨氮的抑制。
2.4 三维EEM荧光光谱分析
三维EEM荧光光谱可以表征污泥EPS中溶解有机物质的特征。在第12天时,对照和实验组污泥EPS的荧光光谱如图5-a~图5-f所示。EEM峰分为5个区域,包括酪氨酸、色氨酸类物质(区域Ⅰ和区域Ⅱ,Ex=200~250 nm,Em=200~380 nm)、黄腐酸类有机物(区域Ⅲ,Ex=200~250 nm,Em=380~500 nm)、可溶性微生物副产物(区域Ⅳ,Ex=250~280 nm,Em=200~380 nm)和腐植酸类有机物(区域Ⅴ、Ex=250~400 nm,Em=380~500 nm)。图5-a~图5-c松散型EPS的三维荧光光谱,其中有2个明显的荧光峰,主要为可溶性微生物副产物、酪氨酸和色氨酸类物质。反应前后2个峰区域荧光强度变化表现为对照组>实验组>初始。图5-d~图5-f为紧密型EPS的三维荧光光谱图,同样观察到可溶性微生物副产物、酪氨酸和色氨酸类物质,并无观察到腐殖质和黄腐酸类有机物。实验组TB-EPS中酪氨酸、色氨酸类物质荧光强度高于对照组和初始。其中色氨酸类物质有利于厌氧颗粒污泥的稳定性[13]。可见,经脱氨处理后有利于厌氧颗粒污泥和底物结合,使其更加稳定、充分地进行厌氧反应。

a-初始LB-EPS;b-对照组LB-EPS;c-实验组LB-EPS;d-初始TB-EPS;e-对照组TB-EPS;f-实验组TB-EPS
图5 高浓度蛋白废水厌氧消化过程后初始、对照组和实验组的LB-EPS三维荧光光谱以及初始、对照组和实验组的TB-EPS三维荧光光谱图
Fig.5 3D-EEM fluorescence spectra of LB-EPS of initial sludge, sludge in control reactor, and experimental reactor, 3D-EEM fluorescence spectra of TB-EPS of initial sludge, sludge in control reactor, and experimental reactor after anaerobic digestion of wastewater with high content of protein
2.5 酶活性变化
在高浓度蛋白废水厌氧消化过程中,几种关键酶(蛋白酶、脱氢酶、乙酸激酶和辅酶F420)的活性变化如图6所示,其中以初始污泥的酶活性为100%。碱性蛋白酶是指在碱性条件下催化蛋白质肽键水解的酶类,该酶还能水解酯键、酰胺键,具有转酯及转肽的功能。由图6-a可以看出,对照组蛋白酶水平低于实验组,对照组的蛋白酶受到中间代谢产物氨基酸的抑制[20],而实验组经过膜脱氨后水解反应可以更快速地进行,实验组中微生物分泌更多的蛋白酶。脱氢酶为催化物质氧化还原反应的酶,底物通过细胞色素系统被氧化,释放的能量以供微生物生长代谢。乙酸激酶是催化乙酸和ATP生成乙酰磷酸和ADP,参与细菌碳代谢和能量代谢,为古细菌合成甲烷提供关键原料。图6-b和图6-c表明,对照组中脱氢酶和乙酸激酶活性较初始污泥分别降低了44%和33%,这主要是因为高浓度的氨氮抑制了酶活性。实验组脱氢酶和乙酸激酶活性增大,分别是对照组的1.57倍和2.96倍。可见,经膜脱氨处理后,可以提高微生物对底物氧化还原以及乙酸激酶的活性,实现有机物向VFAs的高效转化。F420为产甲烷菌中的富含电子载体的辅酶[21]。辅酶F420活性可以间接表示产甲烷菌落的数目或者微生物产甲烷的效能[22]。由图6-d可以看出,实验组辅酶F420活性高于对照组,这与实验组甲烷产量高于对照组的结果一致。

a-蛋白酶;b-脱氢酶;c-乙酸激酶;d-辅酶F420
图6 高浓度蛋白废水厌氧消化过程后蛋白酶、脱氢酶、乙酸激酶和辅酶F420相对活性的变化
Fig.6 Variation of relative activity of protease, dehydrogenase, acetate kinase, and F420 after anaerobic digestion of wastewater with high content of protein
2.6 微生物群落分析
对初始污泥、对照组及实验组污泥中微生物群落结构的变化情况进行分析,探究氨同步回收处理对微生物群落结构的影响。图7-a为细菌门水平上的分布,可以观察到Bacteroidetes,Chloroflexi 和Firmicutes为优势菌属。Bacteroidetes是厌氧消化过程中水解和酸化时的优势细菌,包含大量可以降解蛋白质和氨基酸的发酵细菌,其参与乙酸和丙酸的产生[23-24],在发酵过程中起到了重要作用[25]。对照组和实验组中Bacteroidetes相对丰度分别为40.68%和30.76%。产酸细菌Chloroflexi通常需要共生繁殖,并能将有机物转化为VFAs[26]。Chloroflexi的相对丰度由对照组的12.98%增加到实验组的15.35%。Firmicutes有降解大分子(蛋白质、脂类和碳水化合物)和产生VFAs的能力[27]。对照组和实验组相对于初始污泥,Firmicutes丰度都有一定程度的提升,而且实验组(13.12%)略高于对照组(11.56%)。因此,膜处理后提高了微生物群落对蛋白质的降解能力。
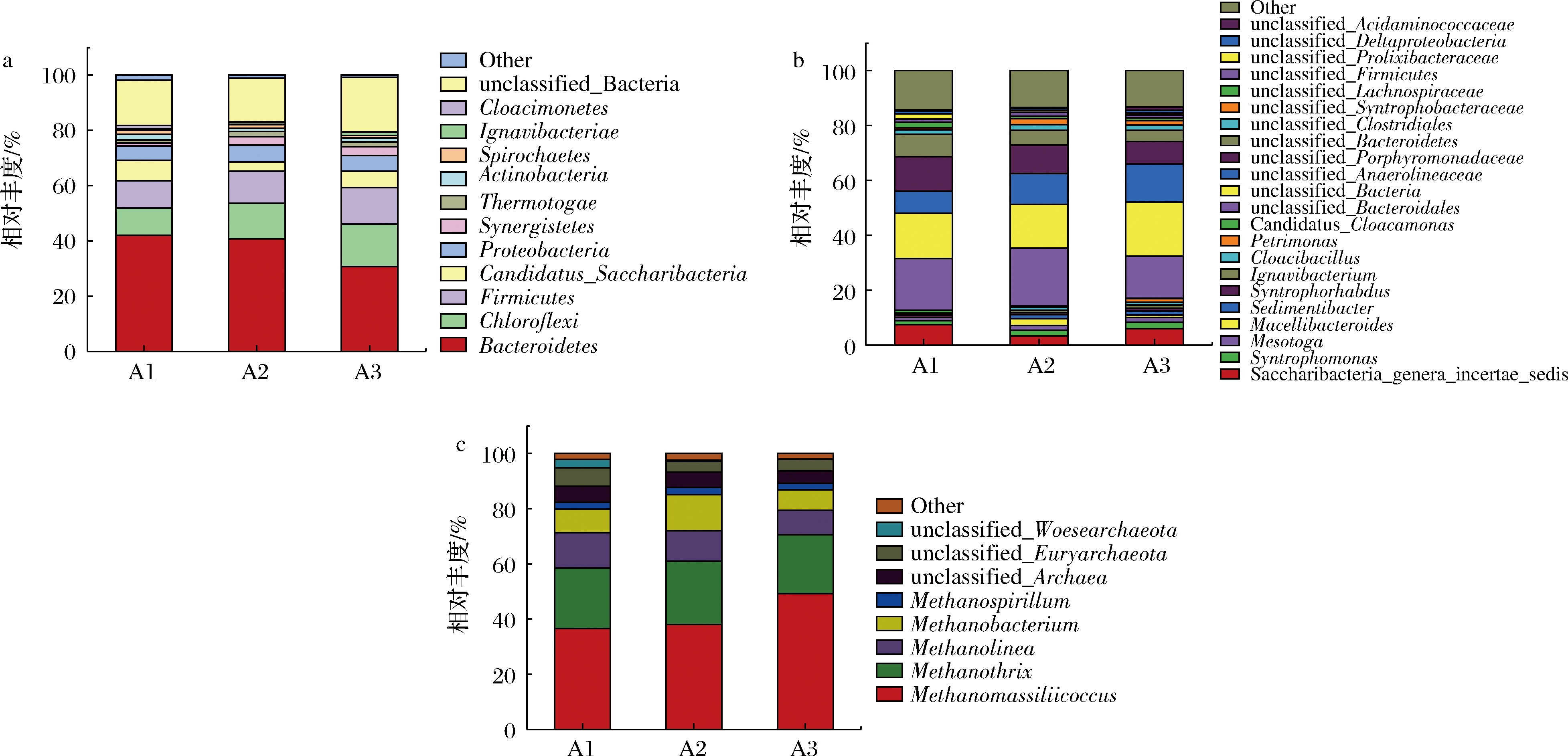
a-细菌门;b-细菌属;c-古菌属
图7 初始(A1)、对照(A2)和实验(A3)细菌门和属以及古菌属群落结构变化
Fig.7 Variation in relative abundance of bacterial communities at the phylum level and genus level in each group and methanogenic archaea at the genus level in initial sludge (A1), control (A2), and experimental (A3) reactor
图7-b是细菌属水平的微生物群落分布。unclassified_Bacteroidales主要以碳水化合物(淀粉、葡萄糖等)和蛋白质化合物(蛋白胨、胰蛋白胨等)为主要代谢来源,可以在极端环境条件下生长。在高氨氮抑制下,unclassified_Bacteroidales在对照组中(21.03%,接种污泥为18.74%)富集,相比之下,经脱氨后的实验组unclassified_Bacteroidales相对丰度明显降低(15.30%)。此外膜处理后的反应器unclassified_Anaerolineaceae相对丰度较未进行膜处理的相比增加了3.12%,Anaerolineaceae被认为与嗜乙酸型产甲烷菌一起通过直接种间电子传递参与产甲烷,促进系统中有机物的快速消耗。Macellibacteroides在对照组中得到富集,可能是导致产生大量丁酸的重要原因。Saccharibacteria是大多数活性污泥中的优势种,Saccharibacteria与蛋白质水解和有机物降解有关[28]。此菌相对丰度在对照组为3.41%,低于初始污泥中该菌相对丰度(7.49%);而实验组(5.97%)该菌相对丰度高于对照组(3.41%)。对照组中受氨抑制的影响,该菌属相对丰度大幅降低,而经膜脱氨后在一定程度上缓解了氨抑制,提高此菌落的相对丰度。Syntrophomonas不仅参与长链脂肪酸的降解,还能与产甲烷菌建立合成代谢[29]。对照组Syntrophomonas的相对丰度为1.98%,而实验组相对丰度2.37%,Syntrophomonas可将丙酸和丁酸降解为乙酸,其丰度的增加促进了VFAs的降解。实验组Syntrophorhabdus (1.06%)和Petrimonas (1.34%)相对丰度高于对照组(分别为0.75%和0.22%),这两种菌群都能将复杂化合物转化为乙酸、H2和CO2,并与嗜氢产甲烷菌合作生产CH4[30-31]。实验组Ignavibacterium相对丰度(1.16%)高于对照组(0.8%),据报道, Ignavibacterium与Methanobacterium存在共生作用[32],可以通过直接种间电子传递过程促进甲烷的产率。综上,实验组经膜脱氨处理,可以大量的富集蛋白质和酸降解细菌,同时将有机物转化为乙酸、H2和CO2,促进嗜氢产甲烷和直接种间电子传递过程。
图7-c是古菌属水平微生物群落分布,主要古菌属为Methanomassiliicoccus,Methanolinea,Methanobacterium 和Methanothrix。古菌Methanomassiliicoccus属消耗H2和CH3OH生成CH4[33]。该甲烷菌在实验组(49.25%)的相对丰度是初始(36.61%)及对照组(37.99%)的1.32和1.29倍。Methanolinea为氢营养型产甲烷菌,其相对丰度在对照组和实验组分别为11.03%和8.83%。Methanobacterium是一种嗜氢型产甲烷菌[34],一般出现于消化早期[35]。Methanobacterium在对照组和实验组的相对丰度分别为13%和7%。Methanothrix为乙酸裂解型产甲烷菌,是厌氧消化的优势产甲烷菌[36]。对照组和实验组Methanothrix的相对丰度分别为23%和21%,两者之间没有显著的差异。古菌群落结构变化主要表现为氢营养型产甲烷菌,特别是Methanomassiliicoccus和Methanobacterium相对丰度的变化,而且氢营养型产甲烷菌为优势菌群。据研究报道,在氨氮抑制的厌氧消化系统中,氢营养型产甲烷菌更为活跃[37]。
因此,在本研究中,氨氮的抑制作用与该抑制作用的缓解并没有改变高浓度蛋白废水厌氧消化产甲烷途径,而脱氨过程可以缓解氨氮抑制,并促进了厌氧消化过程中各种关键酶的活性,从而提高了高浓度蛋白废水厌氧消化性能。
3 结论
本研究采用脱氨膜对发酵液中的氨氮进行回收,以缓解高浓度蛋白废水厌氧消化过程中的氨氮抑制作用。未经脱氨处理的厌氧消化反应器(对照组)中氨氮浓度快速上升,最后达到4 192 mg/L;经脱氨处理的反应器(实验组)中氨氮浓度一直维持在2 000 mg/L以下。相对于对照组,实验组累积甲烷产量提升了54%,COD去除率提高了88%;对照组反应器中出现了VFAs的积累,反应结束时,VFAs浓度达到7 676 mg/L;与此同时,实验组反应器中VFAs一直维持在较低浓度,而且最终被完全消耗。因此,脱氨处理缓解了高氨氮对高浓度蛋白废水厌氧消化的抑制作用。
微生物群落结构分析表明,在产甲烷过程中,氢营养型产甲烷菌相对丰度较高,为优势菌群。经脱氨处理的实验组反应器中,细菌主要以Bacteroidetes,Chloroflexi和Firmicutes为主,有利于提高微生物对蛋白质的降解以及有机物分解为VFAs的能力;从属水平上来看,实验组反应器中富集Saccharibacteria蛋白质水解菌以及Syntrophomonas酸降解菌,有利于加快有机物向乙酸、H2和CO2转化,促进嗜氢产甲烷和直接种间电子传递过程。此外,脱氨处理增强了厌氧消化过程中各种关键酶的活性,从而提高了高浓度蛋白废水厌氧消化性能。
[1] AWASTHI M K, PAUL A, KUMAR V, et al.Recent trends and developments on integrated biochemical conversion process for valorization of dairy waste to value added bioproducts:A review[J].Bioresource Technology, 2022, 344:126193.
[2] CANAAN J M M, BRASIL G S P, DE BARROS N R, et al.Soybean processing wastes and their potential in the generation of high value added products[J].Food Chemistry, 2022, 373:131476.
[3] CHEN Y, CHENG J J, CREAMER K S.Inhibition of anaerobic digestion process:A review[J].Bioresource Technology, 2008, 99(10):4 044-4 064.
[4] RAJAGOPAL R, MASSÉ D I, SINGH G.A critical review on inhibition of anaerobic digestion process by excess ammonia[J].Bioresource Technology, 2013, 143:632-641.
[5] FUCHS W, WANG X M, GABAUER W, et al.Tackling ammonia inhibition for efficient biogas production from chicken manure:Status and technical trends in Europe and China[J].Renewable &Sustainable Energy Reviews, 2018, 97:186-199.
[6] WALKER M, IYER K, HEAVEN S, et al.Ammonia removal in anaerobic digestion by biogas stripping:An evaluation of process alternatives using a first order rate model based on experimental findings[J].Chemical Engineering Journal, 2011, 178:138-145.
[7] JIANG X, HAYASHI J, SUN Z Y, et al.Improving biogas production from protein-rich distillery wastewater by decreasing ammonia inhibition[J].Process Biochemistry, 2013, 48(11):1 778-1 784.
[8] DUBE P J, VANOTTI M B, SZOGI A A, et al.Enhancing recovery of ammonia from swine manure anaerobic digester effluent using gas-permeable membrane technology[J].Waste Management, 2016, 49:372-377.
[9] LICON BERNAL E E, MAYA C, VALDERRAMA C C, et al.Valorization of ammonia concentrates from treated urban wastewater using liquid-liquid membrane contactors[J].Chemical Engineering Journal, 2016, 302:641-649.
[10] HINMAN J J JR. Standard methods for the examination of water, sewage, and industrial wastes. American Journal of Public Health and the Nations Health, 1955, 45(6):821.
[11] WANG Z W, WU Z C, TANG S J.Characterization of dissolved organic matter in a submerged membrane bioreactor by using three-dimensional excitation and emission matrix fluorescence spectroscopy[J].Water Research, 2009, 43(6):1 533-1 540.
[12] ZHAO J W, ZHANG J, ZHANG D L, et al.Effect of emerging pollutant fluoxetine on the excess sludge anaerobic digestion[J].Science of the Total Environment, 2021, 752:141932.
[13] WANG C Q, WANG C, JIN L N, et al.Response of syntrophic aggregates to the magnetite loss in continuous anaerobic bioreactor[J].Water Research, 2019, 164:114925.
[14] YU P Q.Protein secondary structures (alpha-helix and beta-sheet) at a cellular level and protein fractions in relation to rumen degradation behaviours of protein:A new approach[J].The British Journal of Nutrition, 2005, 94(5):655-665.
[15] HUANG J H, PAN Y, LIU L, et al.High salinity slowed organic acid production from acidogenic fermentation of kitchen wastewater by shaping functional bacterial community[J].Journal of Environmental Management, 2022, 310:114765.
[16] KAYHANIAN M.Ammonia inhibition in high-solids biogasification:An overview and practical solutions[J].Environmental Technology, 1999, 20(4):355-365.
[17] NAKAKUBO R, MØLLER H B, NIELSEN A M, et al.Ammonia Inhibition of Methanogenesis and Identification of Process Indicators during anaerobic digestion[J].Environmental Engineering Science, 2008, 25(10):1 487-1 496.
[18] SHI X C, LIN J, ZUO J E, et al.Effects of free ammonia on volatile fatty acid accumulation and process performance in the anaerobic digestion of two typical bio-wastes[J].Journal of Environmental Sciences, 2017, 55:49-57.
[19] RAPOSO F, BORJA R, MART N M A, et al.Influence of inoculum-substrate ratio on the anaerobic digestion of sunflower oil cake in batch mode:Process stability and kinetic evaluation[J].Chemical Engineering Journal, 2009, 149(1-3):70-77.
N M A, et al.Influence of inoculum-substrate ratio on the anaerobic digestion of sunflower oil cake in batch mode:Process stability and kinetic evaluation[J].Chemical Engineering Journal, 2009, 149(1-3):70-77.
[20] 高树梅. 餐厨垃圾厌氧消化过程中氨氮耐受响应机制研究[D].无锡:江南大学, 2015.
GAO S M.Study on response mechanism of ammonia nitrogen tolerance during anaerobic digestion of kitchen wastes[D].Wuxi:Jiangnan University, 2015.
[21] 尹小波, 连莉文, 徐洁泉, 等.产甲烷过程的独特酶类及生化监测方法[J].中国沼气, 1998, 16(3):8-12.
YIN X B, LIAN L W, XU J Q, et al.Unique enzymes and biochemical monitoring methods in methanogenesis[J].China Biogas, 1998, 16(3):8-12.
[22] 吴唯民, 蒋青.辅酶F420及其在厌氧处理中的作用[J].中国沼气, 1984, 2(2):3-11.
WU W M, JIANG Q.Coenzyme F420 and its role in anaerobic treatment[J].China Biogas, 1984, 2(2):3-11.
[23] CAPSON-TOJO G, MOSCOVIZ R, RUIZ D, et al.Addition of granular activated carbon and trace elements to favor volatile fatty acid consumption during anaerobic digestion of food waste[J].Bioresource Technology, 2018, 260:157-168.
[24] LEE J, HONG J, JEONG S, et al.Interactions between substrate characteristics and microbial communities on biogas production yield and rate[J].Bioresource Technology, 2020, 303:122934.
[25] DYKSTRA C M, PAVLOSTATHIS S G.Methanogenic biocathode microbial community development and the role of bacteria[J].Environmental Science &Technology, 2017, 51(9):5 306-5 316.
[26] YAMADA C, KATO S, UENO Y, et al.Conductive iron oxides accelerate thermophilic methanogenesis from acetate and propionate[J].Journal of Bioscience and Bioengineering, 2015, 119 (6):678-682.
[27] ANTWI P, LI J Z, BOADI P O, et al.Dosing effect of zero valent iron (ZVI) on biomethanation and microbial community distribution as revealed by 16S rRNA high-throughput sequencing[J].International Biodeterioration &Biodegradation, 2017, 123:191-199.
[28] IBARBALZ F M, FIGUEROLA E L M, ERIJMAN L.Industrial activated sludge exhibit unique bacterial community composition at high taxonomic ranks[J].Water Research, 2013, 47(11):3 854-3 864.
[29] SIEBER J R, SIMS D R, HAN C, et al.The genome of Syntrophomonas wolfei:New insights into syntrophic metabolism and biohydrogen production[J].Environmental Microbiology, 2010, 12(8):2 289-2 301.
[30] NA J G, LEE M K, YUN Y M, et al.Microbial community analysis of anaerobic granules in phenol-degrading UASB by next generation sequencing[J].Biochemical Engineering Journal, 2016, 112:241-248.
[31] LI Y, TANG Y P, XIONG P, et al.High-efficiency methanogenesis via kitchen wastes served as ethanol source to establish direct interspecies electron transfer during anaerobic co-digestion with waste activated sludge[J].Water Research, 2020, 176:115763.
[32] YU H, KASHIMA H, REGAN J M, et al.Kinetic study on anaerobic oxidation of methane coupled to denitrification[J].Enzyme and Microbial Technology, 2017, 104:47-55.
[33] DANG Y, SUN D Z, WOODARD T L, et al.Stimulation of the anaerobic digestion of the dry organic fraction of municipal solid waste (OFMSW) with carbon-based conductive materials[J].Bioresource Technology, 2017, 238:30-38.
[34] YIN Q D, YANG S, WANG Z Z, et al.Clarifying electron transfer and metagenomic analysis of microbial community in the methane production process with the addition of ferroferric oxide[J].Chemical Engineering Journal, 2018, 333:216-225.
[35] LYU F, LUO C H, SHAO L M, et al.Biochar alleviates combined stress of ammonium and acids by firstly enriching Methanosaeta and then Methanosarcina[J].Water Research, 2016, 90:34-43.
[36] LEE Y Y, KIM T G, CHO K S.Characterization of the COD removal, electricity generation, and bacterial communities in microbial fuel cells treating molasses wastewater[J].Journal of Environmental Science and Health,Part A, 2016, 51(13):1 131-1 138.
[37] MOESTEDT J, MÜLLER B, WESTERHOLM M, et al.Ammonia threshold for inhibition of anaerobic digestion of thin stillage and the importance of organic loading rate[J].Microbial Biotechnology, 2016, 9(2):180-194.