桑(Morus alba L.)为桑科桑属的落叶乔木或灌木,在世界各地分布广泛。桑叶作为药食同源植物,含有多种活性物质,如蛋白质、多糖、生物碱、多酚、维生素、矿物质等[1],具有降低胆固醇[2]、防治糖尿病[3]、预防肥胖[4]、抗氧化[5]等功能。已有研究表明,桑叶中蛋白质含量占其干基重的15%~30%,且不含胆固醇。由于桑叶蛋白质含量和体内消化率高,其被认为是工业消费的潜在植物蛋白质来源[6]。但目前,桑叶主要用于桑蚕业的饲料以及提取生物碱等,仅少量加工为桑叶茶等饮料及功能产品,在食品等领域还未得到充分开发与应用。
酚类化合物具有至少一个芳香环和一个或多个羟基,是一种天然抗氧化剂,此外酚类化合物还具有抑菌、抗过敏、抗衰老、抗肿瘤和抗糖尿病等功能,受到广泛的关注[7]。酚类物质作为桑叶的主要活性成分之一,主要包括绿原酸、芦丁、白藜芦醇等11种单体[8]。研究表明,酚类与蛋白、多糖和油脂等生物大分子之间可以通过氢键、疏水相互作用、范德华力和静电相互作用发生可逆的非共价相互作用或通过蛋白质中的亲和残基与醌形成共价键发生不可逆的共价相互作用[9],从而改变蛋白质的消化功能,并对食品体系产生明显的影响。ZHAO等[10]研究发现单宁酸和没食子酸会降低鱼皮胶原蛋白和酪蛋白的水解程度并影响其抗氧化性能。雷选[11]的研究表明,桑葚多酚可以抑制酪蛋白在小肠阶段的水解。ZHOU等[12]研究发现大豆分离蛋白与表没食子儿茶素没食子酸酯相互作用形成的共价复合物抗消化能力较强,在肠道中更加稳定。
蛋白质和酚类化合物在包括桑叶等多种食物或食物混合物中天然存在,这些化合物之间的相互作用在食品加工、运输、贮藏及食用后对机体的影响至关重要[13]。然而目前大部分研究主要集中于外源酚类物质对蛋白性质的影响,而对植物内源酚类与蛋白的相互作用研究较少。绿原酸(chlorogenic acid, Cla)和白藜芦醇(resveratrol, Res)作为桑叶内源酚类物质,在加工和食用等过程中可能与桑叶蛋白(mulberry leaf protein, MLP)发生相互作用,从而影响桑叶蛋白的结构与功能特性,但此方面的研究报道较少。因此,本文选取桑叶内源酚类物质绿原酸和白藜芦醇,利用紫外-可见光光谱、荧光光谱和傅里叶变换红外光谱分别研究其与桑叶蛋白的相互作用及对蛋白体外消化和抗氧化等功能性质的影响,以期揭示食物内源性酚类化合物与蛋白之间的影响规律,为桑叶功能性产品的开发与利用提供理论参考。
1 材料与方法
1.1 材料与试剂
桑叶蛋白,西安国豪生物科技有限公司;98%白藜芦醇、98%绿原酸、胃蛋白酶、胰蛋白酶,上海源叶生物科技有限公司;DPPH(纯度>97.0%),梯希爱(上海)化成工业发展有限公司;ABTS(纯度>98.0%),上海蓝季科技发展有限公司;其他试剂均为分析纯。
1.2 仪器与设备
SHA-B水浴恒温振荡器,上海汗诺仪器有限公司;Alpha傅里叶红外变换光谱仪,美国布鲁克公司;TU-1801紫外可见分光光度计,北京普析通用仪器有限责任公司;F-7000型荧光分光光度计,日本日立公司;电子分析天平,苏州岛津公司。
1.3 实验方法
1.3.1 桑叶酚类/蛋白溶液的制备
称取一定质量的桑叶蛋白粉,溶解至0.1 mol/L磷酸盐缓冲液(pH 7.2~7.4)中,取上清液,4 ℃贮藏备用。另称取一定质量的Res和Cla,分别溶解至10 mol/L 和0.1 mol/L的磷酸盐缓冲液(pH 7.2~7.4)中,配制成0.1 mmol/L的Res储备液和2 mmol/L的Cla储备液。
桑叶酚类/蛋白复合溶液:取4 mL MLP溶液于10 mL容量瓶中,分别加入不同体积的酚类化合物溶液,使终浓度分别为0、4、8、12、16、20 μmol/L,混匀,于37 ℃振荡12 h。
1.3.2 紫外-可见光光谱分析
采用紫外-可见分光光度法测定MLP、酚类/蛋白复合溶液的紫外-可见吸收光谱。将样品置于光程为1 cm 的比色皿中进行扫描,扫描范围为190~500 nm。
1.3.3 荧光光谱分析
利用F-7000荧光分光光度计测定不同温度下(300、305、310 K)MLP和酚类/蛋白复合溶液的荧光光谱,以不含酚类物质的MLP做空白对照。激发波长280 nm,激发和发射狭缝宽度5 nm,发射波长扫描范围300~400 nm。
采用Stern-Volmer方程对不同温度下的荧光猝灭数据进行分析,分别探讨Res、Cla对MLP的荧光猝灭机制。荧光猝灭的计算如公式(1)所示:
(1)
式中:F为加入酚类物质时MLP的荧光强度;F0为未加酚类物质时MLP的荧光强度;Kq为速率常数,动态猝灭时,各种猝灭剂对生物分子的最大碰撞猝灭常数Kq为2.0×1010 L/(mol·s);τ0为无淬灭剂(Res、Cla)时生物大分子的平均荧光寿命,约为10-8 s;Q为酚类物质浓度;Ksv为Stern-Volmer淬灭速率常数。
对于静态猝灭,利用双对数方程分析结合常数与结合位点数。静态猝灭的计算如公式(2)所示:
(2)
式中:Ka为结合常数;n为结合位点数。
利用Van’t Hoff方差对热力学参数进行拟合,进一步判断酚类物质与桑叶蛋白间的相互作用力的类型。热力学参数的计算如公式(3)、公式(4)所示:
(3)
ΔG=ΔH-TΔS=-RTlnKa
(4)
式中:ΔH表示焓变,kJ/mol;ΔG表示吉布斯自由能变化,kJ/mol;ΔS表示熵变,J/K;T为绝对温度;Ka为结合常数;R为气体常数,8.314 J/(mol·K)。
1.3.4 傅里叶变换红外光谱分析
将MLP溶液和桑叶酚类/蛋白复合溶液在-60 ℃中预冷冻6 h后进行冷冻干燥,得到固形复合物。按样品与溴化钾粉末质量比1∶40混合,压片,分别在4 000~400 cm-1波数内进行红外光谱扫描,分辨率为2 cm-1,扫描32次。
1.3.5 差示扫描量热(differential scanning calorimetry, DSC)分析
取4 mg样品于坩埚中密封,以密封的空坩埚作为空白对照,测试温度为25~150 ℃,升温速率为10 ℃/min,氮气流速为30 mL/min。
1.3.6 桑叶酚类/蛋白复合物体外消化吸收特性
参考肖雅丽[14]报道的方法进行模拟体外消化实验。称取一定量MLP及酚类/蛋白复合物,配制为质量浓度10.0 mg/mL的溶液,用1.0 mol/L HCl调节溶液pH至1.5,溶液37 ℃水浴加热5 min后,将胃蛋白酶与样品溶液以1∶50的质量比混合,在37 ℃下消化2 h,分别在0、10、20、30、60、120 min时取消化样品,并将样品加热10 min灭活。取胃蛋白酶酶解120 min 的样品,用1.0 mol/L NaOH调节pH至7.0,将胰蛋白酶与样品以1∶50的质量比混合,在37 ℃下消化2 h,分别在0、10、20、30、60、120 min时取样,并将样品加热10 min灭酶。
茚三酮法测定水解度(degree of hydrolysis, DH):称取一定量酪氨酸溶于水中,分别配制成梯度浓度为10、20、30、40、50 μg/mL的溶液,并分别加入1.0 mL的0.1 mol/L磷酸盐缓冲液(pH 7.2~7.4)和1.5%(质量分数)的茚三酮溶液,沸水中反应20 min ,冷却至室温,570 nm处测定其吸光度,绘制标准曲线。MLP的氨基含量测试同上,根据标准曲线计算MLP中氨基含量。取4.0 mL模拟消化样品,加入1.0 mL 10%(质量分数)三氯乙酸溶液,于3 000 r/min 下离心10 min,以除去大分子物质与杂质;取4.0 mL上清液,分别加入1.0 mL的0.1 mol/L磷酸盐缓冲液(pH 7.2~7.4)和1.5%(质量分数)的茚三酮溶液,于沸水中反应20 min,冷却至室温,570 nm处测定其吸光度,水解度的计算如公式(5)所示:
(5)
1.3.7 抗氧化能力分析
采用DPPH自由基和ABTS阳离子自由基清除能力实验测定样品的抗氧化能力。称取3.94 mg DPPH溶于50 mL容量瓶内,加无水乙醇定容,避光充分溶解,配制成0.2 mmol/L的DPPH乙醇溶液,4 ℃贮藏备用。分别取5 mL MLP溶液、20 μmol/L酚类溶液和含20 μmol/L酚类/蛋白复合物溶液与5 mL DPPH 乙醇溶液混合,避光反应0.5 h,利用紫外-可见分光光度计测定其在517 nm处的吸光值,DPPH自由基清除率的计算如公式(6)所示:
DPPH自由基清除率![]()
(6)
式中:A1为样品吸光度;A0为空白对照组的吸光度。
称取一定量ABTS溶于10 mL容量瓶内,配制成7.0 mmol/L的ABTS溶液。称取一定量的过硫酸钾溶于10 mL容量瓶内,配制成5.0 mmol/L的过硫酸钾溶液。将两者等体积混合后,避光室温放置12 h。加蒸馏水稀释,使其在734 nm处吸光度为(0.70±0.02)。将4 mL ABTS溶液与0.5 mL样品混合,避光反应6 min,在734 nm处测其吸光度,以相应蒸馏水为对照。ABTS阳离子自由基清除率的计算如公式(7)所示:
ABTS阳离子自由基清除率![]()
(7)
式中:Ai为样品与ABTS反应后的吸光度;A0为蒸馏水代替样品与ABTS反应后的吸光度;Aj为蒸馏水代替ABTS与样品反应后的吸光度。
1.4 数据处理与分析
所有数据均采用Origin 8.0软件进行数据分析与作图,每组实验设置3次平行实验,结果以![]() 表示,采用SPSS 22.0统计软件进行单因素ANOVA判断(Duncan检验),P<0.05表示具有显著性差异。
表示,采用SPSS 22.0统计软件进行单因素ANOVA判断(Duncan检验),P<0.05表示具有显著性差异。
2 结果与分析
2.1 桑叶中两种酚类化合物与蛋白相互作用的紫外-可见光光谱分析
紫外-可见光光谱法通过测定从基态到激发态的电子跃迁效应来研究酚类与蛋白分子间的相互作用[15]。桑叶中不同浓度的Res、Cla分别与蛋白作用的紫外-可见光光谱分析结果见图1。

a-Res;b-Cla
图1 不同浓度的Res、Cla对MLP溶液紫外-可见光光谱吸收的影响
Fig.1 Effect of different concentrations of Res and Cla on the UV-Vis absorption spectrum of MLP
由图1可知,MLP在205、255 nm处具有明显的吸收峰。分别加入Res与Cla反应后,酚类/蛋白产物在205、255 nm处的吸收峰增大,且随着酚类浓度的增加,峰值呈上升趋势,同时吸收峰发生红移,最大吸收峰均红移约1 nm。吸收峰强度和位移的变化表明Res与Cla与MLP发生了相互作用而形成了新的复合物。这可能是由于Res及Cla与MLP中的疏水基团结合形成络合物,改变了MLP的空间构造,掩盖了MLP色氨酸和酪氨酸的芳香环疏水基团,降低了复合物的疏水性能[16]。Cla与MLP作用后在320 nm处出现吸收峰,并随着Cla浓度的增加而吸收峰的强度增强,表明MLP与Cla之间存在相互作用[17]。
2.2 桑叶中两种酚类化合物与蛋白相互作用的荧光光谱分析
MLP的氨基酸组成中存在酪氨酸和苯丙氨酸,因含有苯环结构,在一定的激发波长下能够产生荧光[18]。在不同温度下,不同浓度的Res与Cla分别与MLP相互作用的荧光光谱见图2。
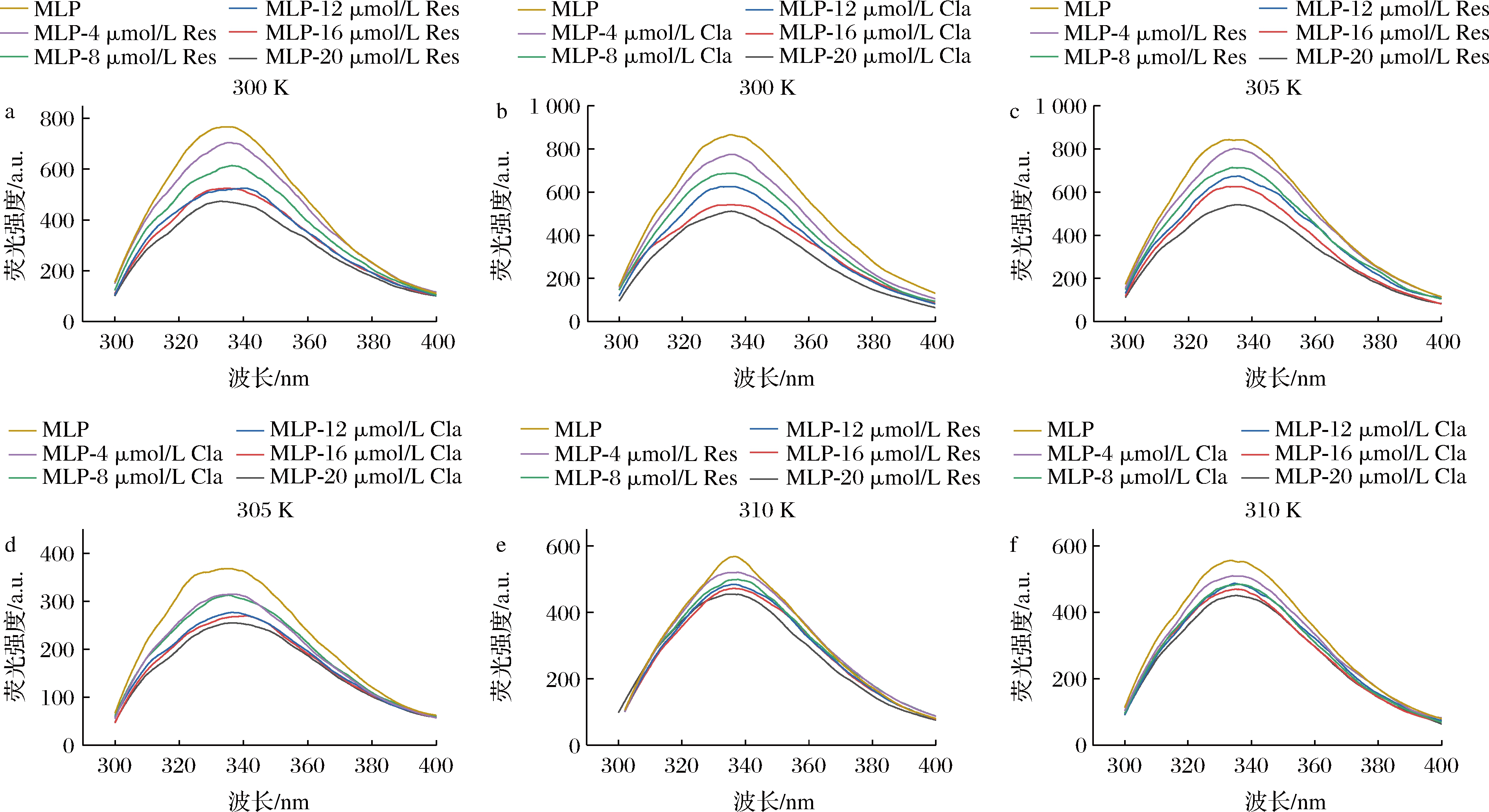
a-Res,300 K;b-Cla,300 K;c-Res,305 K;d-Cla,305 K;e-Res,310 K;f-Cla,310 K
图2 Res、Cla分别与MLP在不同温度下相互作用的荧光光谱分析
Fig.2 Fluorescence spectra of interaction between Res and Cla and MLP at different temperatures
由图2可知,酚类/蛋白体系溶液的最大发射波长约为340 nm,在300、305、310 K 3种作用温度下,Res和Cla的加入均可降低MLP的荧光强度,且随着Res和Cla浓度的增加,MLP发射峰的荧光强度呈现降低的趋势,发射峰出现不同程度的蓝移或红移。此外,随着温度的升高,酚类对MLP荧光猝灭效果呈现降低的趋势。例如,在Res和Cla浓度为20 μmol/L时,溶液的荧光猝灭强度与MLP相比,在3种温度下分别下降了293.119 6、300.772 9、113.014 3 a.u.和354.085 4、112.983 9、105.225 0 a.u.。这可能是由于MLP中酪氨酸和苯丙氨酸残基与Res和Cla的芳香环发生相互作用[19],导致氨基酸残基所处的微环境发生变化,使蛋白内源荧光发生猝灭,并形成弱荧光的酚类/蛋白复合物。
利用Stern-Volmer方程分别分析了Res、Cla与MLP相互作用的猝灭机理、结合位点和结合常数,结果见表1和表2。
表1 酚类与MLP相互作用的荧光猝灭常数与线性相关系数
Table 1 Quenching rate constants and correlation coefficients of phenolics and MLP
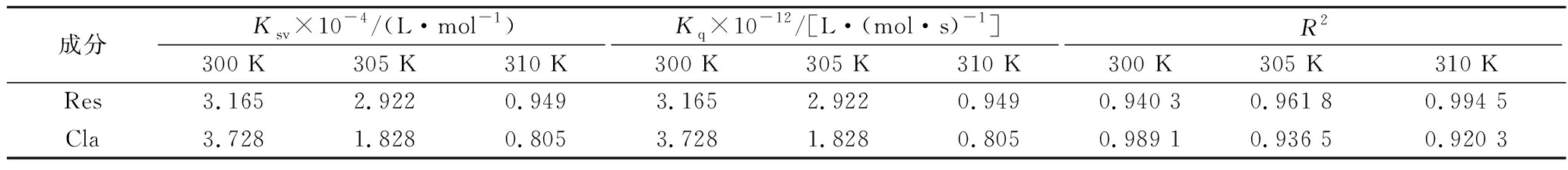
成分Ksv×10-4/(L·mol-1)Kq×10-12/[L·(mol·s)-1]R2300 K305 K310 K300 K305 K310 K300 K305 K310 KRes3.1652.9220.9493.1652.9220.9490.940 30.961 80.994 5Cla3.7281.8280.8053.7281.8280.8050.989 10.936 50.920 3
表2 酚类与MLP相互作用的结合位点、表观结合常数及线性相关系数
Table 2 Apparent binding constants, binding sites numbers and correlation coefficients of phenolics and MLP

成分Ka×10-4/(L·mol-1)nR2300 K305 K310 K300 K305 K310K300 K305 K310 KRes29.032172.345 50.016 681.1991.3860.6050.961 50.980 10.995 4Cla14.070 20.0411 10.006 551.1270.6370.6370.995 70.865 00.914 6
由表1可知,在酚类化合物作用浓度范围内的曲线拟合具有较好的线性关系。在300、305、310 K的处理温度下,Res和Cla的淬灭速率常数Ksv均随着温度的升高而逐渐减小。Res、Cla与MLP在上述3种温度下的Kq分别为3.165×1012、2.922×1012、0.949×1012 L/(mol·s)和3.728×1012、1.828×1012、0.805×1012 L/(mol·s),均大于动态猝灭的最大碰撞速率常数2.0×1010 L/(mol·s),与动态猝灭的特性相反[20]。因此可以推断,Res、Cla对MLP的荧光猝灭可能均是由酚类化合物和蛋白相互作用引起的静态猝灭,而不是由分子扩散和碰撞引起的动态猝灭[21],即荧光团与猝灭剂形成了非荧光的复合物[22]。
由表2可知,酚类与MLP的结合常数均在104 L/mol 左右,表明二者之间能形成稳定的复合物[23]。随着温度的升高,2种酚类化合物与MLP结合常数均呈现降低的趋势,表明Res、Cla与蛋白质均是通过氢键结合的放热反应[24]。在相同的温度下,Res与MLP的结合常数Ka值大于Cla与MLP的结合常数,说明Res与MLP的结合能力更强。在300 K的温度下,2种酚类与MLP的结合位点数n值为1左右,表明MLP上存在单个结合位点,并且酚类与蛋白约以1∶1的摩尔比结合。从300 K升至310 K,2种酚类与MLP的结合位点下降,表明温度对酚类与MLP结合形成的复合物的稳定性有影响,复合物随着温度的升高而变得不稳定[25],可能是升温破坏了酚类与MLP之间的非共价相互作用。
进一步对酚类化合物与MLP之间相互作用的热力学参数和作用力进行分析,ΔH、ΔS、ΔG的拟合结果见表3。
表3 酚类与MLP相互作用的热力学参数
Table 3 Thermodynamic constants of interaction between phenolics and MLP

成分ΔG/(kJ·mol-1)300 K305 K310 KΔH/(kJ·mol-1)ΔS/[kJ·(mol·K)-1]Res-31.389-35.834-12.769-561.413-1.751Cla-29.582-15.020-10.435-568.791-1.802
非共价相互作用的作用力有氢键、范德华力、疏水相互作用力、静电相互作用力等。研究表明,当ΔH>0且ΔS>0时主要作用力为疏水作用力;当ΔH<0且ΔS>0时主要作用力为静电力;当ΔH<0且ΔS<0时主要作用力为氢键和范德华力[26]。由表3可知,不同温度下Res、Cla与MLP反应的ΔG均小于0,表明两者之间的反应均是自发进行的,Res、Cla与MLP的结合过程均为放热反应,升高温度不利于两者之间的结合。Res、Cla与MLP相互作用的ΔH和ΔS均小于0,表明氢键和范德华力在两者结合中起主要作用。
2.3 桑叶中2种酚类化合物与蛋白的傅里叶变换红外光谱分析
红外光谱在测定蛋白质二级结构方面具有重要作用,其可以进一步分析酚类对蛋白质多个酰胺带的构象变化,如蛋白质的酰胺Ⅰ带(1 600~1 700 cm-1)主要由C![]() O伸缩振动引起,酰胺Ⅱ带(1 500~1 600 cm-1)则是由C—N伸缩振动和N—H弯曲振动引起[15]。由于酰胺I带比酰胺Ⅱ带对蛋白质的二级结构更敏感,因此目前的研究主要集中在酰胺I带上[27]。Res、Cla与MLP相互作用的红外光谱分析结果见图3。由图3可知,在蛋白中加入不同浓度的酚类后的红外光谱图与蛋白质对照组的谱图相似,表明酚类与蛋白作用后没有生成新的共价键[21]。酚类与MLP作用后主要的红外光谱吸收峰出现在1 660 cm-1左右,对应蛋白质的酰胺Ⅰ带,波长和吸光度随着Res和Cla浓度的增加而改变,特征吸收峰发生平移,表明Res和Cla的加入改变了MLP分子的构象。
O伸缩振动引起,酰胺Ⅱ带(1 500~1 600 cm-1)则是由C—N伸缩振动和N—H弯曲振动引起[15]。由于酰胺I带比酰胺Ⅱ带对蛋白质的二级结构更敏感,因此目前的研究主要集中在酰胺I带上[27]。Res、Cla与MLP相互作用的红外光谱分析结果见图3。由图3可知,在蛋白中加入不同浓度的酚类后的红外光谱图与蛋白质对照组的谱图相似,表明酚类与蛋白作用后没有生成新的共价键[21]。酚类与MLP作用后主要的红外光谱吸收峰出现在1 660 cm-1左右,对应蛋白质的酰胺Ⅰ带,波长和吸光度随着Res和Cla浓度的增加而改变,特征吸收峰发生平移,表明Res和Cla的加入改变了MLP分子的构象。
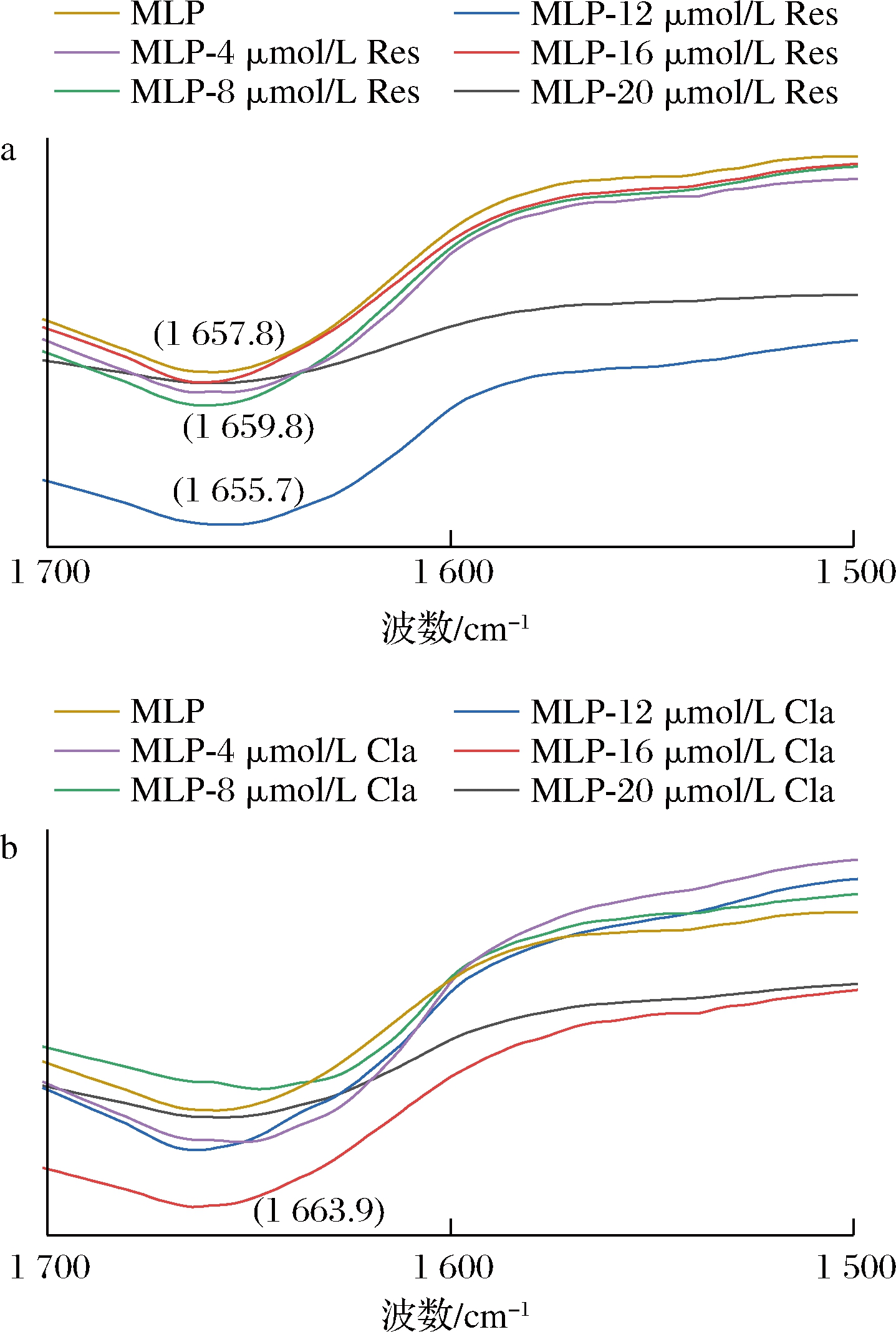
a-Res与MLP相互作用;b-Cla与MLP相互作用
图3 Res、Cla与MLP作用的红外光谱分析
Fig.3 FT-IR spectrum analysis of the interaction between Res, Cla and MLP
2.4 DSC分析
通过差示扫描量热法可以分析酚类与MLP结合后对蛋白质热稳定性的影响,结果见图4。
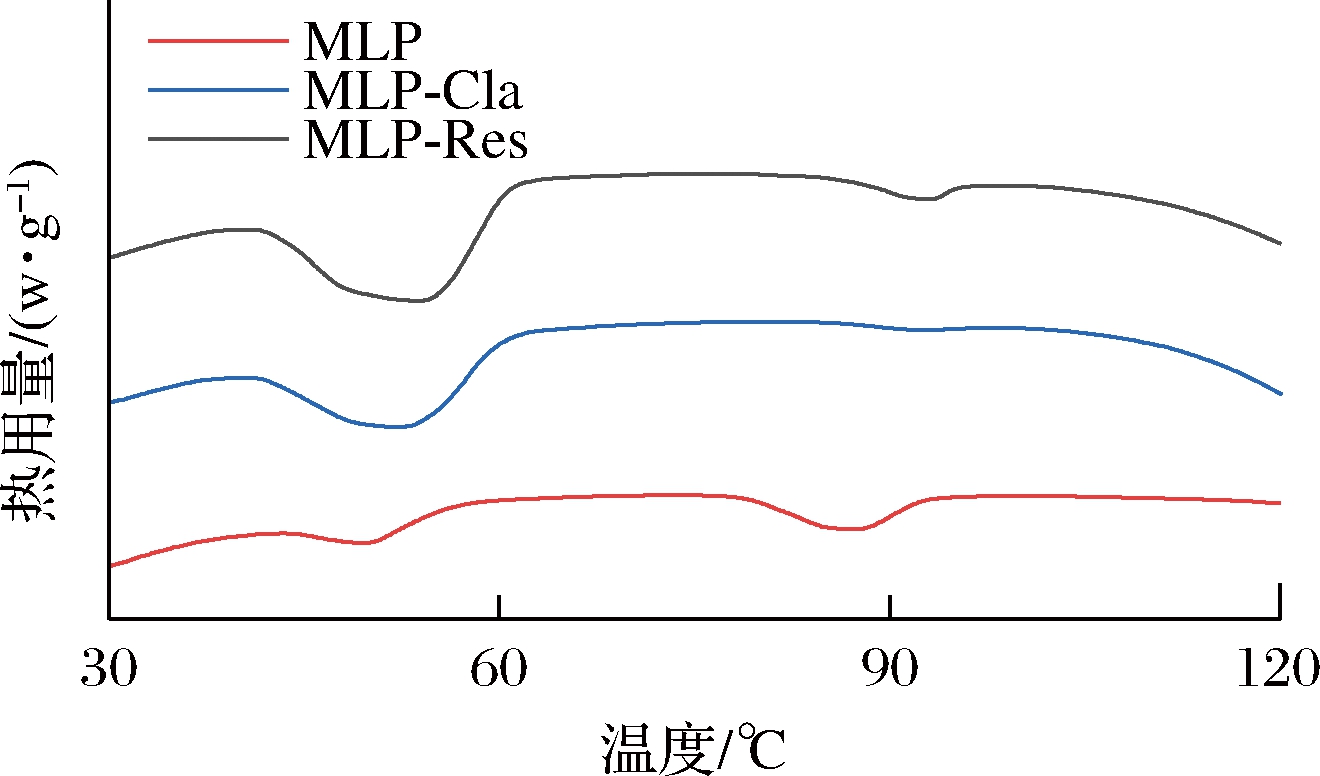
图4 酚类与MLP形成的复合物的热稳定性分析
Fig.4 Thermal stability analysis of phenolics and MLP complexes
由图4可知,MLP在50.14 ℃时出现吸热峰,对应其热变性温度,其变性焓为3.40 J/g。当Res、Cla与MLP相互作用后形成的复合物的热变性温度均大于MLP的热变性温度,表明Res、Cla的加入会提高MLP的热稳定性。其中Res与MLP作用后形成的复合物的热变性温度提高了4.32 ℃,变性焓提高了10.91 J/g,而Cla与MLP结合后热变性温度提高了2.81 ℃,变性焓提高了9.97 J/g。这可能是Res、Cla与MLP发生了较强的相互作用致使蛋白质的结构发生改变,从而提高了蛋白质的热变性温度[28]。
2.5 体外消化吸收特性分析
MLP及酚类/MLP复合物的体外消化过程中水解度变化结果见图5。MLP及复合物在胃、肠2个消化阶段总体呈上升趋势。在胃消化阶段,MLP及酚类/MLP复合物在消化开始时迅速水解,10 min后水解速度减缓,并随着消化时间的延长,水解度趋于平缓。水解度的大小依次为:MLP>MLP-Cla>MLP-Res。在胃消化阶段,MLP水解度最高为25.43%。在肠消化阶段,MLP及酚类/MLP复合物的水解度均明显增加,在肠消化阶段的水解度变化显著高于胃消化阶段,表明蛋白质的消化主要发生在小肠消化阶段。总体来看,水解度大小依次为:MLP>MLP-Cla>MLP-Res。MLP的水解度在胃、肠2个消化阶段都是最高的,水解度可达55.06%,而MLP-Res的消化率最低,水解度仅为44.38%。MLP与酚类相互作用形成复合物后水解度降低,推测可能由于MLP受酚类化合物的影响,空间结构发生改变[29],复合物的形成抑制了消化酶对蛋白质的水解。Res、Cla和MLP之间的相互作用会影响蛋白质的消化特性。
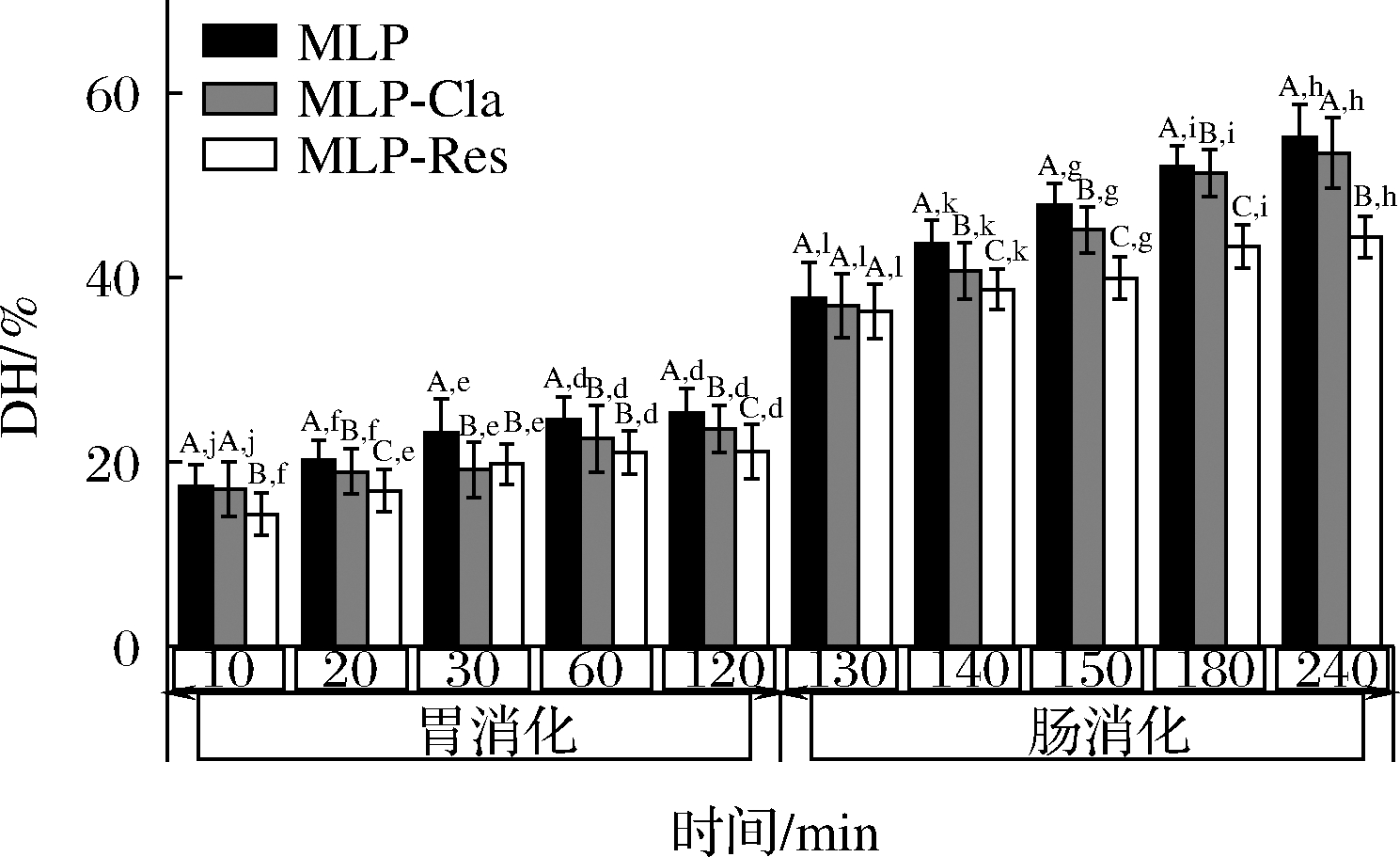
图5 桑叶酚类/蛋白复合物在体外模拟胃肠道消化阶段DH的变化
Fig.5 Changes of DH of mulberry leaf polyphenol/protein complexes during simulated gastrointestinal digestion in vitro
注:A~C代表同一时间下,MLP、MLP-Cla、MLP-Res消化率的差异显著(P<0.05);d~j代表在胃消化阶段,不同时间同一样品消化率的差异显著(P<0.05);h、i代表在肠消化阶段,不同时间同一样品消化率的差异显著(P<0.05)
2.6 抗氧化能力分析
采用DPPH和ABTS方法比较了MLP、Res、Cla及其复合物的抗氧化能力,结果见图6。
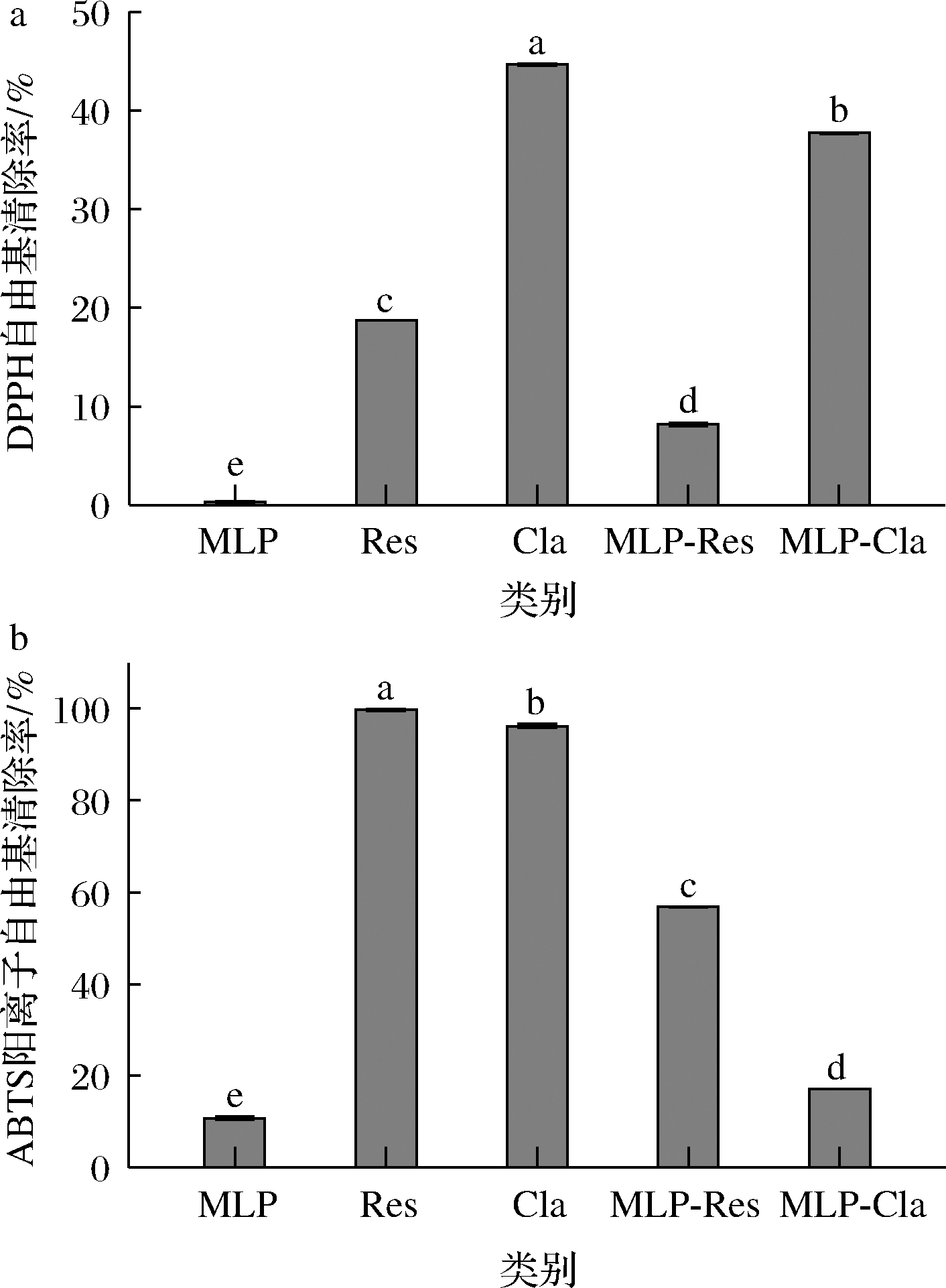
a-DPPH自由基;b-ABTS阳离子自由基
图6 桑叶酚类/蛋白复合物对DPPH自由基和ABTS阳离子自由基的清除能力
Fig.6 DPPHand ABTS, scavenging capacity of mulberry leaf polyphenol/protein complexes
注:不同字母代表不同样品差异显著(P<0.05)
由图6可知,MLP本身对于DPPH自由基和ABTS阳离子自由基的清除能力较弱,而Res和Cla对DPPH自由基和ABTS阳离子自由基的清除能力较强。当酚类与蛋白形成复合物后表现出较强的DPPH自由基和ABTS阳离子自由基清除能力,其对DPPH自由基和ABTS阳离子自由基的清除能力明显强于MLP(P<0.05),但较酚类化合物本身均明显降低(P<0.05)。这些结果表明酚类与桑叶蛋白形成复合物后使酚类化合物对DPPH自由基和ABTS阳离子自由基的清除能力受到一定的抑制,导致抗氧化能力降低。这可能是由于部分酚羟基与蛋白发生相互作用,可以向自由基提供氢和电子的位置被掩盖,降低了其与自由基碰撞的几率,导致酚类/桑叶蛋白复合物的抗氧化能力低于游离酚类化合物[30]。
3 结论
通过对桑叶中内源酚类物质Res、Cla分别与蛋白之间的相互作用及功能性质进行研究,表明2种桑叶内源酚类化合物与蛋白均表现出较强的相互作用力,且可以形成较稳定的复合物。Res、Cla对蛋白的荧光猝灭类型均是静态猝灭,氢键和范德华力是主要作用力;Res、Cla与MLP之间相互作用导致蛋白质的二级结构发生变化,提高了MLP的热稳定性,抑制了消化酶对MLP的水解,提高了MLP本身对DPPH自由基和ABTS阳离子自由基的清除能力。研究结果将为桑叶作为食物基质中可能存在的酚类与蛋白之间的相互作用及对其功能特性的影响提供依据。
[1] 王芳, 励建荣.桑叶的化学成分、生理功能及应用研究进展[J].食品科学, 2005, 26(S1):111-117.
WANG F, LI J R.Research progress on chemical constituents, physiological function and application of mulberry leaves[J].Food Science, 2005, 26(S1):111-117.
[2] LEE E, LEE M S, CHANG E, et al.High hydrostatic pressure extract of mulberry leaves ameliorates hypercholesterolemia via modulating hepatic microRNA-33 expression and AMPK activity in high cholesterol diet fed rats[J].Food &Nutrition Research, 2021, 65:1-10.
[3] CHENG L, WANG J K, AN Y C, et al.Mulberry leaf activates brown adipose tissue and induces browning of inguinal white adipose tissue in type 2 diabetic rats through regulating AMP-activated protein kinase signalling pathway[J].The British Journal of Nutrition, 2022, 127(6):810-822.
[4] LIAO S T, LONG X S, ZOU Y X, et al.Mulberry leaf phenolics and fiber exert anti-obesity through the gut microbiota-host metabolism pathway[J].Journal of Food Science, 2021, 86(4):1 432-1 447.
[5] NEAMAT-ALLAH A N F, MAHMOUD E A, MAHSOUB Y.Effects of dietary white mulberry leaves on hemato-biochemical alterations, immunosuppression and oxidative stress induced by Aeromonas hydrophila in Oreochromis niloticus[J].Fish &Shellfish Immunology, 2021, 108:147-156.
[6] SUN C Z, WU W J, MA Y R, et al.Physicochemical, functional properties, and antioxidant activities of protein fractions obtained from mulberry (Morus atropurpurea roxb.) leaf[J].International Journal of Food Properties, 2017, 20(sup3):S3 311-S3 325.
[7] CHEN G, WANG S T, FENG B, et al.Interaction between soybean protein and tea polyphenols under high pressure[J].Food Chemistry, 2019, 277:632-638.
[8] 王晨, 邹宇晓, 李倩, 等.桑叶酚类物质组成及富集工艺研究[J].蚕业科学, 2018, 44(5):729-737.
WANG C, ZOU Y X, LI Q, et al.An investigation on composition and enrichment process of phenolic compounds in mulberry leaf[J].Science of Sericulture, 2018, 44(5):729-737.
[9] QIE X J, CHENG Y, CHEN Y, et al.In vitro phenolic bioaccessibility of coffee beverages with milk and soy subjected to thermal treatment and protein-phenolic interactions[J].Food Chemistry, 2022, 375:131644.
[10] ZHAO Q, YU X J, ZHOU C S, et al.Effects of collagen and casein with phenolic compounds interactions on protein in vitro digestion and antioxidation[J].LWT, 2020, 124:109192.
[11] 雷选. 桑椹汁对酸奶品质的影响及桑椹多酚-酪蛋白相互作用研究[D].南昌:江西农业大学, 2020.
LEI X.Effects of mulberry juice on yogurt quality and interaction between mulberry polyphenols and casein[D].Nanchang:Jiangxi Agricultural University, 2020.
[12] ZHOU S D, LIN Y F, XU X, et al.Effect of non-covalent and covalent complexation of (-)-epigallocatechin gallate with soybean protein isolate on protein structure and in vitro digestion characteristics[J].Food Chemistry, 2020, 309:125718.
[13] GÜNAL-KÖRO?値LU D, TURAN S, CAPANOGLU E.Interaction of lentil protein and onion skin phenolics:Effects on functional properties of proteins and in vitro gastrointestinal digestibility[J].Food Chemistry, 2022, 372:130892.
[14] 肖雅丽. 茶叶籽粕蛋白制备、功能性质和消化吸收特性研究[D].扬州:扬州大学, 2021.
XIAO Y L.Study on the preparation of tea seed cake protein and its functional and digestion and absorption properties[D].Yangzhou:Yangzhou University, 2021.
[15] ABDOLLAHI K, CONDICT L, HUNG A, et al.Binding parameters and molecular dynamics of β-lactoglobulin-vanillic acid complexation as a function of pH-part B:Neutral pH[J].Food Chemistry, 2022, 367:130655.
[16] 岳鑫, 包怡红.基于荧光及紫外光谱法对红松种鳞多酚与乳清蛋白相互作用的研究[J].现代食品科技, 2019, 35(7):114-120.
YUE X, BAO Y H.Interaction between the polyphenols from Pinus koraiensis seeds scales and whey protein studied by fluorescence and ultraviolet spectroscopy[J].Modern Food Science & Technology, 2019, 35(7):114-120.
[17] ZHANG Y Y, LU Y C, YANG Y, et al.Comparison of non-covalent binding interactions between three whey proteins and chlorogenic acid:Spectroscopic analysis and molecular docking[J].Food Bioscience, 2021, 41:101035.
[18] 李庆舒, 程琳, 邓红, 等.三种多酚与牛血清蛋白相互作用的初步研究[J].食品与发酵工业, 2020, 46(3):180-187.
LI Q S, CHENG L, DENG H, et al.Study of interactions between three polyphenols and bovine serum albumin[J].Food and Fermentation Industries, 2020, 46(3):180-187.
[19] QUAN T H, BENJAKUL S, SAE-LEAW T, et al.Protein-polyphenol conjugates:Antioxidant property, functionalities and their applications[J].Trends in Food Science &Technology, 2019, 91:507-517.
[20] AGRAWAL R, THAKUR Y, TRIPATHI M, et al.Elucidating the binding propensity of naphthyl hydroxamic acid to human serum albumin (HSA):Multi-spectroscopic and molecular modeling approach[J].Journal of Molecular Structure, 2019, 1 184:1-11.
[21] JIANG J, ZHANG Z P, ZHAO J, et al.The effect of non-covalent interaction of chlorogenic acid with whey protein and casein on physicochemical and radical-scavenging activity of in vitro protein digests[J].Food Chemistry, 2018, 268:334-341.
[22] YOU Y H, YANG L, CHEN H, et al.Effects of (-)-epigallocatechin-3-gallate on the functional and structural properties of soybean protein isolate[J].Journal of Agricultural and Food Chemistry, 2021, 69(7):2 306-2 315.
[23] 高瑾, 梁宏闪, 赵靖昀, 等.玉米醇溶蛋白-多酚相互作用及复合物制备与表征[J].食品科学, 2022, 43(2):8-17.
GAO J, LIANG H S, ZHAO J Y, et al.Interactions between zein and polyphenols and characterization of their complexes[J].Food Science, 2022, 43(2):8-17.
[24] LUO W, HUANG H, ZHANG Y H, et al.Complex coacervation behavior and the mechanism between rice glutelin and gum Arabic at pH 3.0 studied by turbidity, light scattering, fluorescence spectra and molecular docking[J].LWT, 2021, 150:112084.
[25] TANG L, LI S, BI H N, et al.Interaction of cyanidin-3-O-glucoside with three proteins[J].Food Chemistry, 2016, 196:550-559.
[26] LI H L, ZHANG L Y, ZHUANG S L, et al.Fluorescence investigation on the interaction of a prevalent competitive fluorescent probe with entomic odorant binding protein[J].Spectroscopy Letters, 2013, 46(7):527-534.
[27] GU J L, HUANG X Y, LIU H R, et al.A mutispectroscopic study on the structure-affinity relationship of the interactions of bisphenol analogues with bovine serum albumin[J].Chemosphere, 2022, 291:132769.
[28] LIU F G, MA C C, MCCLEMENTS D J, et al.A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J].Food Hydrocolloids, 2017, 63:625-634.
[29] CIRKOVIC VELICKOVIC T D, STANIC-VUCINIC D J.The role of dietary phenolic compounds in protein digestion and processing technologies to improve their antinutritive properties[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(1):82-103.
[30] ZHANG S, SHENG Y N, FENG Y C, et al.Changes in structural and functional properties of globulin-polyphenol complexes in mung beans:Exploration under different interaction ratios and heat treatment conditions[J].International Journal of Food Science &Technology, 2022, 57(4):1 920-1 935.