金黄色葡萄球菌(简称金葡菌)是一种革兰氏阳性、兼性厌氧、凝固酶阳性的葡萄球菌,常见于人类的生活环境。金葡菌能适应较宽的温度和pH范围,以及具有耐盐的特性,使其能耐受食品加工过程中的选择性压力,在各种食品中生长和存活[1]。金葡菌污染食品后可产生多种毒素,特别是耐热性肠毒素,在食品热加工的温度下依然能保持毒性,残留于食品中引起人食物中毒。当食品中金葡菌浓度超过105 CFU/g时,产生的肠毒可导致人食物中毒[2]。金葡菌及其产生的肠毒素污染已成为影响相关食品安全的关键因素之一,控制和预防食品原料和加工过程中金葡菌的残留,对降低微生物安全风险,确保食品中微生物安全有重要的意义。
生物被膜是细菌附着于表面或界面的一种生存模式。生物被膜是细菌附着后形成的一种复杂的细胞外聚合物(extracellular polymeric substance,EPS)结构,为包裹于其中的菌体形成微菌落,免受不利环境条件影响,以及后期膜内菌体扩散的重新定居提供了一个安全和保护性的环境[3]。金葡菌具有很强的生物被膜形成能力,在食品加工环境中,金葡菌生物被膜保护菌体定殖于与食品物料接触的设备表面或管道中,形成生物被膜群落。从目前不同食品中金葡菌分离株被膜形成的研究来看,蛋白质含量高的动物原料食品中报道的较多,如乳品[4]、水产品[5]、肉品[6]等。金葡菌在食品接触面上形成的生物被膜会污染产品,导致产品货架期降低和食源性疾病,对食品安全构成了巨大的风险。
速冻水饺是速冻面米制品中主要的产品类型,其产量和消费量在相关食品中位居前列[7]。速冻水饺营养成分丰富,且水分活度较高,容易受到微生物污染而带来食品安全问题。金葡菌是速冻水饺产品中常检出的污染菌,由于其较强的耐低温存活的特性,在-18 ℃的冷链温度下,仍能存活很长时间[8]。此外,速冻产品在实际运输、贮藏、销售和消费者购买过程中,很容易出现温度波动,如反复冻融,从而导致金葡菌数量增加[9]。因此,在食品加工过程中尽量减少金葡菌的污染,控制出厂产品中菌体浓度在较低的水平,即远低于其产肠毒素的条件浓度,最大限度地降低中毒风险,是保障速冻水饺食品安全的关键。
生物被膜的形成和发展与菌株携带的被膜相关基因和材料的表面性质有关,同时也受加工过程环境条件的影响。此外,被膜形成后增加膜内细菌的抗性,如何有效消杀设备等表面的金葡菌,对降低产品中金葡菌食品安全风险有重要的意义。目前关于速冻食品中金葡菌生物被膜的研究较少,较缺乏上述相关方面的信息。本研究以从速冻水饺产品中分离的金葡菌菌株为研究对象,评估其在聚苯乙烯和不锈钢表面形成生物被膜的能力,研究编码被膜形成的相关基因在分离株中的分布特性,并考察温度、pH和NaCl浓度等环境因素对菌株形成被膜的影响,最后研究成熟生物被膜对常用消毒剂的抗性作用,以期为了解速冻水饺中金葡菌形成生物被膜的特性、明确环境条件对被膜形成的影响、在实际生产中防治生物被膜、降低食品安全风险提供基础数据和参考。
1 材料与方法
1.1 材料与试剂
24孔和96孔细胞培养板(聚苯乙烯材质),美国康宁Corning公司;不锈钢片(304不锈钢2B板,尺寸10 mm×10 mm,厚度1 mm);HiPure Bacterial DNA抽提试剂盒,广州美基生物科技有限公司;ExTaq酶,日本Takara公司;其余试剂为均为分析纯。
1.2 菌种和培养基
1.2.1 菌种
金黄色葡萄球菌ATCC43300和ATCC25923,作为标准菌株用于生物被膜形成能力实验。金葡菌待测分离株,采用GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》的方法分离自市售速冻水饺样品,实验鉴定为凝固酶阳性的葡萄球菌菌株,并经16S rDNA基因扩增测序[10]鉴定为金黄色葡萄球菌。
1.2.2 培养基
胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基(g/L):胰蛋白胨17,大豆蛋白胨3,葡萄糖2.5,NaCl 5,K2HPO4 2.5,pH值7.3±0.2,121 ℃灭菌15 min。TSB用于菌株的活化、培养及被膜形成实验。TSB中加入无菌甘油至体积分数为20%,用于菌株的甘油管保藏。D/E中和肉汤作为消毒剂实验中的中和剂。
1.3 实验方法
1.3.1 结晶紫染色法测定生物被膜形成能力
生物被膜形成能力测定参考DI CICCIO等[11]描述的结晶紫染色法,并做适当修改。24孔聚苯乙烯培养板(底面积为2 cm2)和304不锈钢片(面积为1 cm2)分别用作在聚苯乙烯和不锈钢表面被膜形成能力试验。菌液稀释液的准备:甘油管保藏菌株按1%接种量接种至5 mL TSB培养基,37 ℃、150 r/min培养16~24 h,用TSB稀释,得浓度约为106 CFU/mL的菌液稀释液。将500 μL菌液稀释液分别加入到24孔板和预先放入灭菌不锈钢片的24孔板中,于37 ℃培养24 h以形成生物被膜。每个菌株做4个重复,以不加菌的500 μL TSB培养基作为空白对照。培养后参考文献[11]中的方法进行被膜固定、结晶紫染色和冰乙酸脱色,最后取200 μL的冰乙酸脱色液转移到新的96孔板中,于570 nm下测定吸光度值。以生物被膜形成指数(biofilm production indices,BPI)表示菌株形成生物被膜的能力,BPI定义为单位面积(1 cm2)上去除空白对照后的吸光度值,如公式(1)所示:
(1)
式中:AS表示菌株测定吸光度的平均值;A0表示空白测定吸光度的平均值;S表示被膜形成表面的面积,cm2。
1.3.2 生物被膜形成相关基因的检测
DNA的提取:甘油管保藏的各待测菌株按1%的接种量接种于TSB培养基,于37 ℃、150 r/min摇床条件下培养16 h,取1 mL培养后的菌液,采用HiPure Bacterial DNA抽提试剂盒提取DNA。
参照TANG等[12]描述的方法,采用特异性引物扩增各生物被膜相关基因,引物序列及退火温度如表1所示。PCR反应体系50 μL,其中:10×buffer 5 μL,dNTPs (2.5 mmol/L) 4 μL,正向和反向引物(10 μmol/L)各1 μL,模版DNA(>50 ng/μL) 1 μL,ExTaq (5 U/μL) 0.25 μL。PCR反应条件包括,95 ℃预变性5 min,然后进行35个循环的如下扩增:95 ℃变性30 s、各引物的退火温度下退火50 s、72 ℃延伸60 s,最后72 ℃终延伸6 min。扩增产物用1.5%的琼脂糖凝胶电泳分离,GelRed染色后,在紫外下拍照,对照DNA分子质量标准判定扩增产物的大小。随机选择各待测基因阳性结果的PCR产物,测序后进行确认。
表1 生物被膜相关基因PCR检测所用的引物与反应条件
Table 1 Primers and reaction conditions for PCR detection of biofilm-related genes

基因引物序列产物大小/bp退火温度/℃icaAD5'- TGGCTACTGGGATACTGATA-3'5'-TGGAAATGCGACAAGAACTA-3'52055icaBC5'-GCCTATCCTTATGGCTTGA-3'5'-TGGAATCCGTCCCATCTC-3'18256fib5'-CTACAACTACAATTGCCGTCAA-CAG-3'5'-GCTCTTGTAAGACCATTTTCTTCAC-3'34756fnbA5'-GTGAAGTTTTAGAAGGTGGAAAGATT-AG-3'5'-GCTCTTGTAAGACCATTTTTCT-TCAC-3'95254fnbB5'-GTAACAGCTAATGGTCGAATT-GATACT-3'5'-CAAGTTCGATAGGAGTACTATGT-TC-3'45254clfA5'-ATTGGCGTGGCTTCAGTGCT-3'5'-CGTTTCTTCCGTAGTTGCATTTG-3'79656clfB5'-ACATCAGTAATAG-TAGGGGGCAAC-3'5'-TTCGCACTGTTTGTGTTTGCAC-3'96857ebpS5'-CATCCAGAACCAATCGAAGAC-3'5'-CTTAACAGTTACATCATCATGTT-TATCTTTG-3'66156eno5'-ACGTGCAGCAGCTGACT-3'5'-CAACAGCATYCTTCAGTACCTTC-3'81258cna5'-GTCAAGCAGTTATTAACACCAGAC-3'5'-AATCAGTAATTGCACTTTGTC-CACTG-3'71654sasG5'-TATCAACACTTCCGTAACCTTC-3'5'-CGTCAGTCACTCATAACGCAGA-3'15959bbp5'-AACTACATCTAGTACTCAACAA-CAG-3'5'-ATGTGCTTGAATAACACCAT-CATCT-3'1 66256bap5'-GAGCCAAGACAAAGGTGAAG-3'5'-GTAGCCATAGCACGGAACAT-3'87358
1.3.3 环境因素对生物被膜形成的影响
采用结晶紫染色法测定不同环境条件(温度、pH、NaCl浓度)对不锈钢表面生物被膜形成的影响。温度的影响分别在15、25、37 ℃培养24 h后测定。分别配制不同pH和NaCl浓度的TSB培养基,用于不锈钢表面生物被膜形成试验,考查pH和NaCl浓度的影响。
1.3.4 消毒剂对生物被膜的清除作用
参考CAMPANA等[13]方法测定最小杀菌浓度(minimal bactericidal concentration,MBC)和最小生物被膜清除浓度(minimal biofilm eradication concentration,MBEC)。MBEC测定以不锈钢片上形成的48 h成熟生物被膜作为被处理样品,测定消毒剂对生物被膜中菌体的清除效果。
1.3.5 数据处理与统计分析
数据结果以平均值±标准差表示。采用SPSS 22软件(IBM公司)对实验结果进行统计分析,统计显著性采用单因素方差分析(ANOVA),通过事后最小显著性差异(least significant difference,LSD)检验方差的同质性。采用皮尔逊相关性分析(Pearson’s correlation)评价黏附基因与被膜形成能力的相关性。
2 结果与分析
2.1 不同材料表面生物被膜形成能力
本研究选择了不锈钢和聚苯乙烯两种表面材料。不锈钢是加工设备表面最常用的材料,属于亲水性。聚苯乙烯(PS塑料)是食品加工中常用的代表性聚合物材料之一,常用于食品包装或物料盛装容器的制造材料,属于疏水性。通过对两种材料的结果进行归一化处理,以BPI值代表被膜的形成能力,使得在不同材料上的实验结果可比较,以便于考察菌株在两种材料上形成被膜能力的差异。如图1所示,所有测试的分离株都可以形成生物被膜,但各菌株形成生物被膜的能力呈现差异。在聚苯乙烯表面上,除HQ3、SG23、HR33、XP8外,其余分离株形成被膜能力较弱,它们在24 h和48 h的BPI值均小于0.2,低于参考菌株ATCC43300形成被膜的量;其中分离株SN12和JZM7形成被膜的量最少,BPI值在0.05以下。在形成被膜能力较强的4个分离株中,HQ3和HR33形成能力最强,在24 h 和48 h都显著高于参考菌株ATCC25923(P<0.05),SG23和XP8的被膜形成能力显著高于参考菌株ATCC43300(P<0.05)。在不锈钢表面上,所有菌株都形成了较强的生物被膜,BPI值均大于0.2;各菌株之间形成被膜能力有较大的差异,其中HQ3、SG23和HR33的形成能力最强,并且显著高于参考菌株ATCC25923(P<0.05);分离株SN31和SN12能力最弱,在24 h和48 h时间形成被膜量与参考菌株ATCC43300相比无显著性差异(P>0.05)。

a-聚苯乙烯;b-不锈钢
图1 金黄色葡萄球菌分离株在聚苯乙烯和不锈钢表面形成生物被膜的能力
Fig.1 Biofilm formation ability of Staphylococcus aureus isolates on the surface of polystyrene and stainless steel
注:图中小写字母和大写字母分别表示24 h和48 h时菌株形成生物被膜的显著性差异,菌株的不同字母表示显著性差异(P<0.05)(下同)
从不同材料表面的结果来看,金葡菌分离株在两种表面材料上的生物被膜形成特性不同,所有测试的分离株在聚苯乙烯表面形成被膜的BPI值均显著低于其在不锈钢表面的值(P<0.05),表明它们在不锈钢表面更容易形成生物量高的被膜。而参考菌株ATCC43300和ATCC25923在两种材料表面形成被膜量的差异较小,特别是菌株ATCC43300在两种材料表面形成被膜无显著性差异(P>0.05)。速冻水饺中金葡菌分离株在不锈钢表面上的强生物被膜形成能力,有助于菌体在加工设备表面持久性存活,表明设备不锈钢表面上形成的被膜很可能是金葡菌在加工过程中重要的贮存宿主。从不同菌株间比较来看,在聚苯乙烯表面形成较强生物被膜的菌株,如HQ3、HR33、SG23和XP8,相较于其他菌株,在不锈钢上也能形成较高生物量的被膜。从不同时间的影响来看,在聚苯乙烯表面,除SG23外,其余分离株在24 h和48 h形成的生物被膜无显著性差异(P>0.05),而在不锈钢上,所有分离株在24 h和48 h形成的生物被膜无显著性差异(P>0.05),表明24 h内各分离株已完成了被膜形成的主要过程,形成了较成熟的生物被膜。
2.2 生物被膜形成相关基因的检测
生物被膜形成相关基因检测结果见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.033356)。各分离株中至少能检出4种以上的被膜形成相关基因,其中eno和clfB基因是分离株中最普遍存在的基因,检出率100%,而bap基因在所有菌株都未被检测到。其他被膜形成相关基因的检出率:fnbA为50%,fnbB为70%,sasG为65%,fib为35%,clfA为25%,ebps为15%,can为15%,bbp为25%,icaAD和icaBC均为15%。从各基因的检出率与生物被膜形成能力的相关性来看,在不锈钢表面,sasG与生物被膜形成呈极显著的正相关(P<0.01),clfA和fnbA呈显著正相关(P<0.05),而icaAD、icaBC和fib呈极显著的负相关(P<0.01);在聚苯乙烯表面,sasG呈显著正相关(P<0.05),fib呈显著负相关(P<0.05)。根据分离株被膜相关基因的检测结果,可将分离株分为6种类型(附表1),选取SN12、JM3、QH6、HQ3、HR33和XP8作为各类型的代表菌株,进行实验考察环境条件对生物被膜形成的影响。
2.3 温度对生物被膜形成的影响
6种生物被膜黏附基因类型的代表菌株SN12、JM3、QH6、HQ3、HR33和XP8,在不同温度下形成生物被膜的结果如图2所示。从总体上看,在金葡菌生长的最佳温度为37 ℃时,各分离株都呈现出最高的BPI均值,表明生长最佳温度有利于形成更多的生物被膜。在室温25 ℃条件下,菌株HR33和XP8形成的被膜生物量与它们在37 ℃下相比无显著性差异(P>0.05),而其余的4个菌株25 ℃形成的被膜比37 ℃时有所降低,但依然能保持65%~88%的生物量。在15 ℃时,所有6个菌株均能检测到生物被膜的形成,除SN12形成被膜量较小外,其余5个菌株形成被膜的生物量可达到37 ℃时的29%~36%。
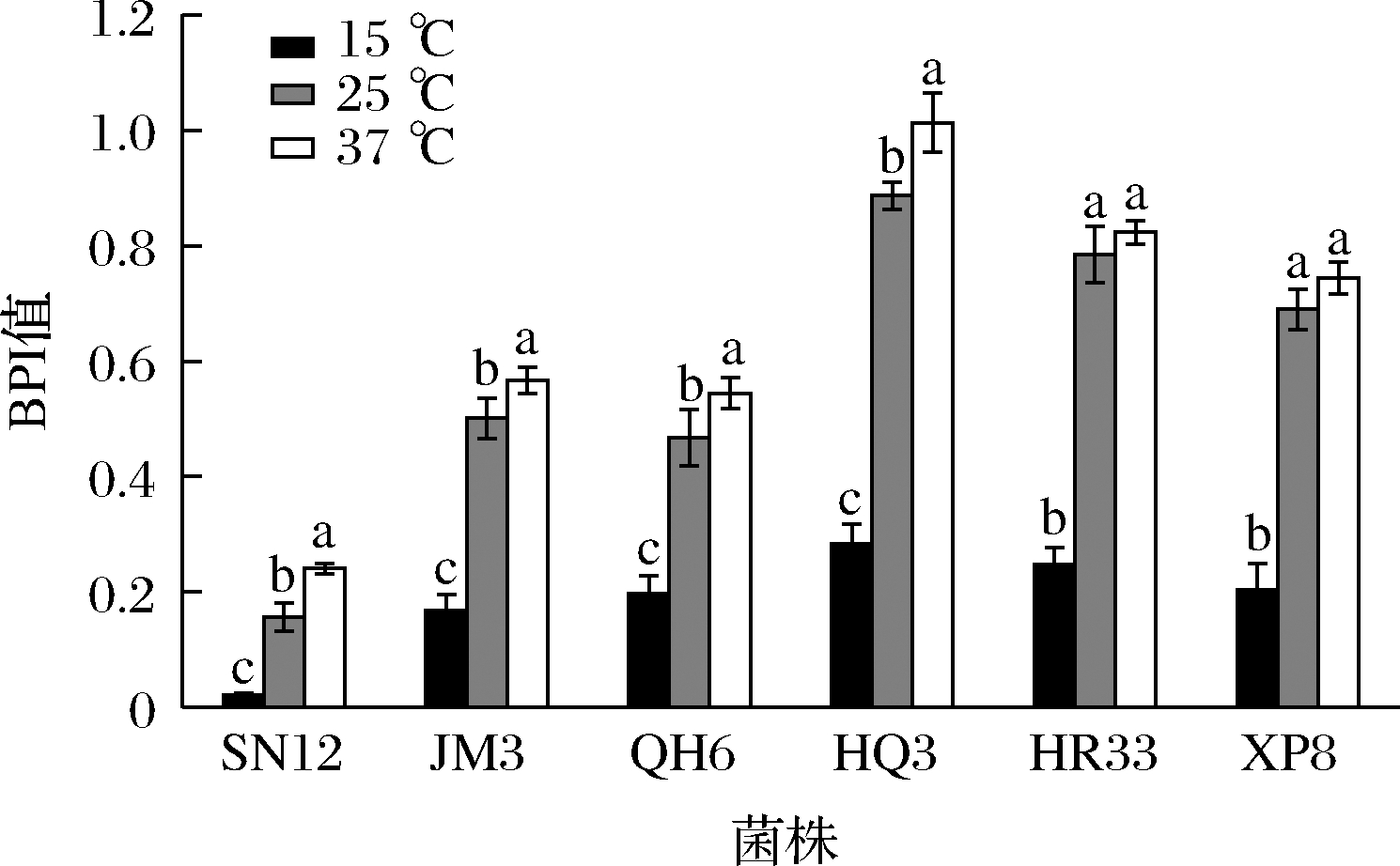
图2 温度对生物被膜形成的影响
Fig.2 Effect of temperature on biofilm formation
2.4 pH对生物被膜形成的影响
如图3所示,环境pH值对生物被膜的形成有明显影响。所有测试的6个菌株在pH 7时达到了最高的BPI值,从而表明中性pH环境最有利于附着在不锈钢上形成生物被膜。当pH值为6和8时,生物被膜形成较pH 7时有所降低,菌株JM3、HQ3、HR33在pH 6和pH 8时所形成的被膜生物量与在pH 7时无显著性差异(P>0.05),但仍然保持了较高的生物量,表明弱酸性和弱碱性条件下,菌株受到的影响较小,仍能形成较多的生物被膜。当pH值为5时,各菌株被膜生物量呈现出大幅度的降低,pH 5时的被膜量均为pH 7时的50%左右或更低。当pH值为4,所有菌株都未观察到被膜形成,表明酸度的增加能显著抑制被膜的形成。在pH 9时,可观察到和pH 5时类似的趋势,但各菌株依然能形成一定的被膜,pH 9时形成的被膜量为pH 7时的46.9%~65.1%。

图3 pH对生物被膜形成的影响
Fig.3 Effect of pH on biofilm formation
2.5 NaCl浓度对生物被膜形成的影响
图4显示了不同NaCl浓度对生物被膜形成的影响。当NaCl质量分数从0增加到1%时,可观察到菌株SN12、HQ3、HR33和XP8的生物被膜增加,而对菌株JM3和QH6没有显著影响(P>0.05)。当NaCl质量分数从1%进一步增加时,除菌株HQ3外,其余5个菌株的被膜生物量都增加。当质量分数达到4%时,菌株SN12、HR33、XP8、QH6被膜生物量达到最大。当质量分数为5%时,所有菌株被膜生物量出现降低的趋势,但依然高于不加NaCl的对照。当质量分数>6%时,所有菌株被膜的量与不加NaCl的对照相比,未观察到显著增加;有些菌株的被膜生物量在质量分数为8%时还出现了降低,表明过高的质量分数有抑制作用。以上的结果表明,在低浓度(质量分数<5%)的NaCl条件下,可以增强分离株在不锈钢表面形成生物被膜,对被膜的形成有一定的刺激作用。

图4 NaCl对生物被膜形成的影响
Fig.4 Effect of the concentration of NaCl on biofilm formation
2.6 消毒剂对生物被膜的清除作用
图5比较了常用工业消毒剂次氯酸钠、过氧乙酸和苯扎溴铵对6种被膜基因型代表株的浮游菌体和生物被膜细胞的杀灭作用。虽然不同菌株对消毒剂的耐受程度有所不同,但从总体来看,生物被膜的形成在很大程度上提高了膜内菌体对消毒剂的耐受性,3种消毒剂处理被膜菌体的MBEC相比处理浮游细胞的MBC,分别提高了15~20倍(次氯酸钠)、6~10倍(过氧乙酸)和5~12倍(苯扎溴铵)。从3种消毒剂对被膜细胞杀灭效果来看,过氧乙酸的效果最好,能在较低的质量浓度下(2 000~4 000 mg/L)有效杀灭膜内细胞。6个测试菌株与标准菌株ATCC25923相比,MBC值较接近,而MBEC值呈现出不同程度的增加,表明分离株形成的生物被膜更能保护其中的菌体耐受消毒剂的杀灭作用。
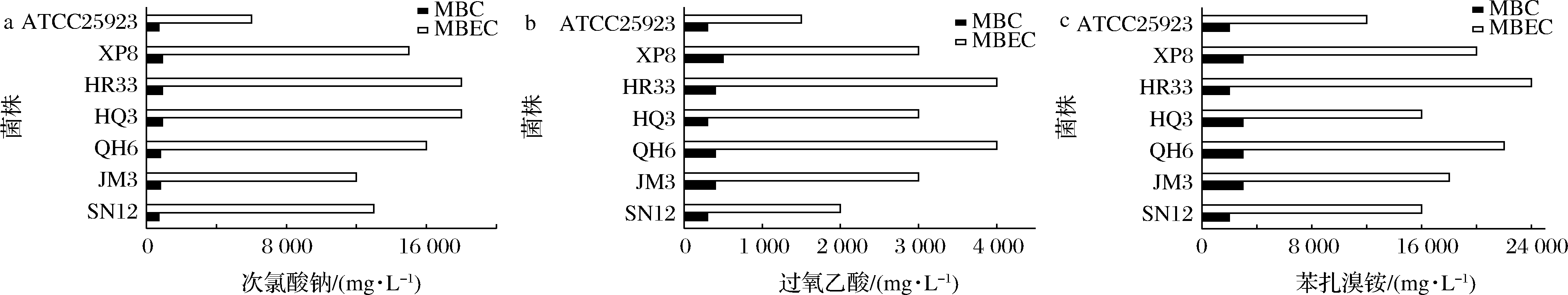
a-次氯酸钠;b-过氧乙酸;c-苯扎溴铵
图5 消毒剂对浮游菌体和生物被膜菌体的杀灭作用
Fig.5 Bactericidal effect of disinfectants against plankton cells and cells in biofilm
3 讨论
3.1 生物被膜相关基因
本研究中对13个被膜相关基因进行了检测,结果表明eno和clfB基因在全部分离株中均被检出,该结果与下列文献报道的较为一致。SHARMA等[14]研究了来源于生牛奶的金葡菌分离株被膜基因,发现eno在所有菌株中均为阳性,clfB的检出率为93%。TANG等[12]检测了不同食品来源的金葡菌分离株被膜基因,clfB和sasG的检出率为100%,eno为93.75%。金黄色葡萄球菌表面结合蛋白(Staphylococcus aureus surface binding protein,sasG)是一种促进细胞间相互作用的表面蛋白,与非生物表面附着有关[15-16]。本研究中sasG的检出率为65%,并且与不锈钢表面被膜形成呈极显著的正相关(P<0.01),与聚苯乙烯表面被膜形成呈显著正相关(P<0.05),表明其在非生物表面的强生物被膜形成中有重要的作用。根据EPS的组成,金葡菌生物被膜可分为两大类:由多糖基质组成的生物被膜和含有蛋白质基质的生物被膜[17-18]。多糖基质组成的生物被膜中,多糖的主体成分由多糖细胞间黏附素(polysaccharide intercellular adhesins,PIA)组成,PIA的合成依赖于细胞内黏附(ica)操纵子调控[19]。本研究中icaAD和icaBC的检出率为15%,并且ica携带菌株只能形成较弱的被膜,表明分离株被膜主要由蛋白质基质构成,即不依赖PIA的生物被膜。除了在初始黏附中起到作用外,纤维连接蛋白结合蛋白A(fnbA)和B(fnbB)被认为能在蛋白基质生物被膜中起到促进细胞间相互作用、增加被膜形成的作用[20]。本研究结果从侧面证实了这种观点,在基因检测结果中,fnbA和fnbB基因检出率分别为50%和70%,而且在ica阳性的菌株中均未检出这两个基因,表明fnbA和fnbB基因在能形成蛋白基质被膜的菌株中较普遍存在。
3.2 环境因素对被膜形成的影响
本研究温度影响的结果表明,37 ℃时BPI均值最高,25 ℃时仍能保持较高的被膜生物量,特别是高产被膜菌株HR33和XP8,在两个温度下被膜生物量无显著性差异。而15 ℃时所有测试菌株的被膜生物量显著减少。类似的结果出现在PAGEDAR等[21]对乳品来源的金葡菌分离株的研究中,该研究报道在25 ℃时不锈钢上形成被膜的细胞数高于37 ℃时,而在12.5 ℃时,被膜形成显著减少。25 ℃常温是食品加工环境常见的温度条件,金葡菌分离株在该温度下具有良好的在不锈钢表面形成被膜的能力,可能是由于加工过程环境温度长期的选择压力,有助于菌体持久存活于加工设备表面等环境中,从而增加了最终产品中的污染。本研究中pH的影响结果表明,金葡菌分离株在弱酸性和弱碱性条件下,菌株受到的影响较小,仍能形成较多的生物被膜。ARCE MIRANDA等[22]研究临床金葡菌分离株在96孔板上形成被膜中pH的影响,报道弱酸性条件比碱性条件更能促进生物被膜的形成。与本研究中结果不同原因可能是由于实验所使用的黏附材料不同,pH的变化导致细胞表面带电荷的变化,从而在不同的材料表面反映出不同的结果。本研究观察到在低质量分数(<5%)的NaCl条件下,可显著增强金葡菌分离株形成生物被膜。KIM等[23]研究了不同来源的金葡菌株形成被膜时NaCl的影响,报道了当在5%(质量分数)NaCl的条件下,生物被膜形成活性大于任何其他NaCl浓度和不加NaCl的对照组,与本研究中观察到结果相类似。食盐是水饺馅料中主要的调味成分,使得加工过程中与物料接触面处于低浓度NaCl的环境中,为金葡菌在表面形成生物被膜提供了条件。
3.3 消毒剂的抗性
食品加工过程中对设备表面进行消毒清洗是常用的保持加工过程卫生和降低微生物残留的方法。本研究试验了3种常用消毒剂对分离株成熟生物被膜中菌体的杀灭效果,结果表明分离株一旦形成成熟的生物被膜后,对消毒剂的抗性有很大程度的增加,与浮游细胞相比,成熟被膜内细胞对3种消毒剂最小杀灭浓度分别提高了15~20倍(次氯酸钠)、6~10倍(过氧乙酸)和5~12倍(苯扎溴铵)。这就意味着要保持良好的消毒效果,需使用更高浓度的消毒剂,然而高浓度消毒剂的使用可能会带来设备表面腐蚀、终端产品中消毒剂残留等问题。从3种消毒剂对被膜中细胞的杀灭效果来看,过氧乙酸在较低的浓度下能起到较好的杀灭作用。过氧乙酸作为强氧化性消毒剂,除对铝和铜表面外,对食品工业中常用的材料表面如不锈钢、玻璃、聚氯乙烯等兼容性较好,腐蚀性小[24]。此外,其分解产物为乙酸、氧气和水,残留物安全无毒,是处理有生物被膜材料表面较理想的消毒剂。本研究的结果还观察到,与参考菌株ATCC25923相比,分离株形成的生物被膜对消毒剂的耐受性更高。这种现象可能的原因是,在实际生产中使用低于MBEC的消毒剂对菌株产生的选择作用,增加了菌株形成生物被膜对消毒剂的耐药性。因此在实际应用中,每次应采用足量的剂量,或者轮换使用和组合使用不同消毒剂,可减少菌株产生耐药性的风险。
4 结论
本文研究了速冻水饺金葡菌分离株生物被膜形成能力,发现分离株能在不锈钢表面形成更强的生物被膜,表明设备不锈钢表面上形成的被膜很可能是金葡菌在加工过程中重要的贮存宿主,导致了金葡菌的污染。黏附基因检测研究中发现ica检出率较低,且与不锈钢表面被膜形成呈显著负相关,表明分离株在不锈钢上主要形成不依赖PIA的生物被膜。环境条件影响方面,常温25 ℃时仍形成较多生物量的被膜,低质量分数(<5%)的NaCl对被膜形成有一定的刺激作用。被膜的形成能在很大程度上提高膜内细胞对消毒剂的抗性,过氧乙酸对生物被膜内菌体杀灭效果最好。本文在速冻水饺中金葡菌生物被膜研究上作了有意义的尝试,为更好地了解生物被膜的形成特性、环境的影响、对消毒剂的抗性作用提供了基础数据,后续研究有待于进一步解析金葡菌在模拟食品加工厂的条件下如何完成初始附着和形成生物被膜,有针对性地筛选消毒和清除被膜的方法,为控制和降低金葡菌生物被膜危害提供基础。
[1] GUTIÉRREZ D, DELGADO S, V ZQUEZ-S
ZQUEZ-S NCHEZ D, et al.Incidence of Staphylococcus aureus and analysis of associated bacterial communities on food industry surfaces[J].Applied and Environmental Microbiology, 2012, 78(24):8 547-8 554.
NCHEZ D, et al.Incidence of Staphylococcus aureus and analysis of associated bacterial communities on food industry surfaces[J].Applied and Environmental Microbiology, 2012, 78(24):8 547-8 554.
[2] BHUNIA A.Foodborne Microbial Pathogens:Mechanisms and Pathogenesis-Staphylococcus aureus[M].New York, NY:Springer New York, 2018.
[3] BAI X J, NAKATSU C H, BHUNIA A K.Bacterial biofilms and their implications in pathogenesis and food safety[J].Foods, 2021, 10(9):2117.
[4] FLINT S, BREMER P, BROOKS J, et al.Bacterial fouling in dairy processing[J].International Dairy Journal, 2020, 101:104593.
[5] ÖZDEMIR F, ARSLAN S, EKEN C B.Biofilm formation, icaABCD genes and agr genotyping of Staphylococcus aureus from fish and ground beef[J].Acta Alimentaria, 2021, 50(2):170-179.
[6] OU C J, SHANG D Q, YANG J X, et al.Prevalence of multidrug-resistant Staphylococcus aureus isolates with strong biofilm formation ability among animal-based food in Shanghai[J].Food Control, 2020, 112:107106.
[7] 刘萌, 余小领.速冻水饺加工中存在的问题及对策[J].江苏调味副食品, 2013,30(2):25-28;44.
LIU M, YU X L.Problems existing in processing and its research development of quick-frozen dumplings[J].Jiangsu Condiment and Subsidiary Food, 2013,30(2):25-28;44.
[8] 宋金丽, 索标, 王娜, 等.速冻水饺中背景菌对冷冻亚致死金黄色葡萄球菌修复及检测的影响[J].中国食品学报, 2013, 13(12):156-162.
SONG J L, SUO B, WANG N, et al.Effects of native microflora of quick-frozen dumplings on recovery of frozen-sublethal Staphylococcus aureus[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(12):156-162.
[9] 韩齐, 孙钦秀, 孙方达, 等.反复冻融对速冻水饺菌相变化的影响[J].现代食品科技, 2015, 31(5):206-211;302.
HAN Q, SUN Q X, SUN F D, et al.Effect of multiple freeze-thaw cycles on the microflora of quick-frozen dumplings[J].Modern Food Science and Technology, 2015, 31(5):206-211;302.
[10] 孟令缘, 牛沁雅, 廉鲁昕, 等.基于16S rDNA序列、MALDI-TOF-MS和VITEK的沙门氏菌和金黄色葡萄球菌的鉴定[J].中国食品学报, 2021, 21(10):197-205.
MENG L Y, NIU Q Y, LIAN L X, et al.Identification of Salmonella and Staphylococcus aureus using 16S rDNA sequencing, MALDI-TOF-MS and VITEK system[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):197-205.
[11] DI CICCIO P, VERGARA A, FESTINO A R, et al.Biofilm formation by Staphylococcus aureus on food contact surfaces:Relationship with temperature and cell surface hydrophobicity[J].Food Control, 2015, 50:930-936.
[12] TANG J N, CHEN J A, LI H H, et al.Characterization of adhesin genes, staphylococcal nuclease, hemolysis, and biofilm formation among Staphylococcus aureus strains isolated from different sources[J].Foodborne Pathogens and Disease, 2013, 10(9):757-763.
[13] CAMPANA R, CASETTARI L, FAGIOLI L, et al.Activity of essential oil-based microemulsions against Staphylococcus aureus biofilms developed on stainless steel surface in different culture media and growth conditions[J].International Journal of Food Microbiology, 2017, 241:132-140.
[14] SHARMA V, SHARMA S, DAHIYA D K, et al.Coagulase gene polymorphism, enterotoxigenecity, biofilm production, and antibiotic resistance in Staphylococcus aureus isolated from bovine raw milk in North West India[J].Annals of Clinical Microbiology and Antimicrobials, 2017, 16(1):1-14.
[15] CONLON B P, GEOGHEGAN J A, WATERS E M, et al.Role for the A domain of unprocessed accumulation-associated protein (Aap) in the attachment phase of the Staphylococcus epidermidis biofilm phenotype[J].Journal of Bacteriology, 2014, 196(24):4 268-4 275.
[16] GEOGHEGAN J A, CORRIGAN R M, GRUSZKA D T, et al.Role of surface protein SasG in biofilm formation by Staphylococcus aureus[J].Journal of Bacteriology, 2010, 192(21):5 663-5 673.
[17] SPEZIALE P, PIETROCOLA G, FOSTER T J, et al.Protein-based biofilm matrices in staphylococci[J].Frontiers in Cellular and Infection Microbiology, 2014,4:171.
[18] O′GARA J P.Ica and beyond:Biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus[J].FEMS Microbiology Letters, 2007, 270(2):179-188.
[19] NGUYEN H T T, NGUYEN T H, OTTO M.The staphylococcal exopolysaccharide PIA-Biosynthesis and role in biofilm formation, colonization, and infection[J].Computational and Structural Biotechnology Journal, 2020, 18:3 324-3 334.
[20] O′NEILL E, POZZI C, HOUSTON P, et al.A novel Staphylococcus aureus biofilm phenotype mediated by the fibronectin-binding proteins, FnBPA and FnBPB[J].Journal of Bacteriology, 2008, 190(11):3 835-3 850.
[21] PAGEDAR A, SINGH J, BATISH V K.Surface hydrophobicity, nutritional contents affect Staphylococcus aureus biofilms and temperature influences its survival in preformed biofilms[J].Journal of Basic Microbiology, 2010, 50(S1):S98-S106.
[22] ARCE MIRANDA J E, SOTOMAYOR C E, ALBESA I, et al.Oxidative and nitrosative stress in Staphylococcus aureus biofilm[J].FEMS Microbiology Letters, 2011, 315(1):23-29.
[23] KIM B R, BAE Y M, LEE S Y.Effect of environmental conditions on biofilm formation and related characteristics of Staphylococcus aureus[J].Journal of Food Safety, 2016, 36(3):412-422.
[24] 李志云, 宋金武, 邓金花, 等.过氧乙酸消毒液在食品工业中的应用[J].食品安全导刊, 2017(3):149-150.
LI Z Y, SONG J W, DENG J H, et al.Application of peracetic acid disinfectant in food industry[J].China Food Safety Magazine, 2017(3):149-150.