辣木别名鼓槌树,是一种原产于印度的喜光照、喜温热的热带作物,在我国云南、四川、福建等地已大规模种植。辣木的叶、茎、皮、花、籽和根等均可食用,其中辣木籽内含有35.0%~40.0%的油脂[1],该油脂在室温下呈现金黄色,能散发出类似于花生的宜人坚果味,具有良好的感官品质[2]。同时该油脂中含50.2%~56.5%的油酸[3],还含有生育酚、多酚等活性成分,具有良好的氧化稳定性[4]。目前,辣木籽油的研究主要集中在油脂提取工艺的优化[5-8]、功能性成分的分析[9]和氧化稳定[10]方面,关于辣木籽油在食品加工应用方面的报道还较少。因此,不断探索和积累加工处理对辣木籽油理化性质的影响,对充分认识和开发该新资源油脂具有重要意义。
在热处理过程中,食用油会发生氧化、水解和聚合等反应,其营养成分会发生改变甚至产生对人体危害的物质。因此,在典型的食品热加工过程中选择稳定性强的油脂,对维持该食品的良好品质尤其重要。ANWAR等[11]分别将辣木籽油与葵花籽油和大豆油混合后置于180 ℃下加热6 h,持续7 d,混合油的总极性组分含量降低,这说明辣木籽油在加热过程中的稳定性高于对照组(葵花籽油、大豆油)。OGUNSINA等[12]比较了冷榨辣木籽油与精制花生油在煎炸中的稳定性,发现煎炸后辣木籽油的游离脂肪酸(28%)和过氧化值(10 meq O2/kg)的增加值均低于精制花生油(48%,22 meq O2/kg),表明辣木籽油具有良好的热稳定性。然而,上述研究中热处理对辣木籽油稳定性的评价指标较单一,缺乏对其热加工中主要抗氧化成分变化的探索。目前,棕榈油因其热稳定性好和价格合适等特点,已作为食品煎炸油得到较好的推广应用,开展辣木籽油与棕榈油热稳定性的比较研究,有利于综合评价辣木籽油的热稳定性。
因此,本文以棕榈油作为参照,以水酶法提取的辣木籽油为原料,研究不同加热温度(150、180、200 ℃)和加热时间(30、60、90、120 min)下这2种油脂氧化产物、酸价和生育酚含量的变化情况,以及利用红外光谱、差示扫描量热(differential scanning calorimetry, DSC)分析和热重分析探究2种油脂的官能团、结晶和熔融以及质量损失变化情况。此外,通过色泽测定观察其外观特性的变化情况,以此为拓展辣木籽油在食品领域的应用范围提供一定借鉴。
1 材料与方法
1.1 材料与试剂
辣木籽,云滇养生堂;棕榈油,重庆市北碚区天生路永辉超市;37种脂肪酸甲酯混合标准品(47885-U),中国Sigma-Aldrich公司;中性蛋白酶Neutrase 0.8 L,丹麦诺维信公司;乙醚、正己烷、甲醇、氢氧化钾、氢氧化钠、盐酸等试剂(均属于分析纯),成都市科龙化工试剂厂。
1.2 设备与仪器
LC-20A型高效液相色谱仪,日本岛津科技有限公司;Spectrun 100型傅里叶红外光谱仪,美国PerkinElmer公司;DSC 4000型差示扫描量热仪,上海铂金埃尔默仪器有限公司;TGA 550型热重分析仪,美国TA公司;UltraScan PRO型测色仪,美国Hunter Lab公司。
1.3 实验方法
1.3.1 辣木籽油的提取方法
辣木籽油提取方法参照孙燕等[13]超声预处理提取辣木籽油的方法。取辣木籽脱壳,粉碎后过60~80目筛,按液料质量比6∶1加入超纯水。96 ℃水浴加热10 min,冷却至室温。经超声预处理(40 W,20 min)后用1.00 mol/L盐酸溶液调节pH值至6.0。样品中加入中性蛋白酶(1.5×105 μg/100 g辣木籽粉),在45 ℃下进行酶解反应。酶解后于95 ℃水浴灭酶30 min,高速离心(6 211×g,20 min)后分离并收集上层清油,即得到辣木籽油。
1.3.2 油脂热处理实验
以室温下的辣木籽油和棕榈油为对照,分别将等量的辣木籽油和棕榈油在不同的温度(150、180、200 ℃)下加热30 min,研究加热温度对油脂稳定性的影响;此外,将等量的辣木籽油和棕榈油在180 ℃下加热不同的时间(30、60、90、120 min),考察加热时间对油脂稳定性的影响。所有样品均充入氮气贮存于-80 ℃冰箱,待检测分析。
1.3.3 过氧化值测定
采用过氧化值评价油脂的初级氧化产物(主要为氢过氧化物),具体方法参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》进行。
1.3.4 茴香胺值测定
采用茴香胺值评价油脂的次级氧化产物,具体操作参照GB/T 24304—2009《动植物油脂 茴香胺值的测定》,根据公式(1)计算辣木籽油和棕榈油的茴香胺(anisidine value,AV)值:
(1)
式中:V,溶解试样的体积,mL;m,样品的质量,g;Q,测定溶液中样品质量浓度,g/mL;A0,空白溶液吸光度;A1,反应溶液吸光度;A2,未反应溶液吸光度。
1.3.5 总氧化值测定
总氧化值(total oxidation, TOTOX)的测定按照公式(2)计算[14]:
TOTOX=2×PV+AV
(2)
式中:PV,油脂的过氧化值,meq/kg;AV,油脂的茴香胺值。
1.3.6 酸价测定
酸价的测定参考GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》的方法进行操作。
1.3.7 生育酚含量测定
样品前处理:称取0.3 g油样(精度0.001 g)于10 mL棕色容量瓶中,加入流动相漩涡振荡溶解后,用流动相定容至刻度,摇匀。过孔径为0.45 μm的有机系滤头于棕色进样瓶中,待进样。
标准溶液配制:参照GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》配制不同浓度的生育酚标准溶液。置于-18 ℃下避光保存,待进样。
色谱条件:色谱柱为Si 60硅胶柱(250 mm×4.6 mm×5 μm);流动相为正己烷+1,4-二氧六环(95∶5,体积比);柱温30 ℃;流速1.0 mL/min;进样量10 μL;荧光检测波长为激发波长294 nm,发射波长328 nm。
1.3.8 红外光吸收频率测定
使用Spectrun 100型傅里叶红外光谱仪对辣木籽油和棕榈油进行分析。取适量干燥KBr于玛瑙研钵中研磨后置于固体压片磨具,以此制备均匀透明锭片。在其表面滴一滴油样并涂抹均匀,装进测试架后放入红外检测仪中测定。仪器设定波数范围在4 000~400 cm-1内,分辨率4 cm-1下扫描16次获得。
1.3.9 DCS熔化结晶曲线测定
使用DSC 4000型DSC对热处理前的辣木籽油和棕榈油进行热性能分析。放置10 mg样品于封闭铝坩埚中,空铝坩埚为空白对照,设置程序为:将样品加热到60 ℃并保持5 min,以5 ℃/min速率依次测定60~-50 ℃的结晶曲线和-50~60 ℃的熔化曲线,期间平衡5 min。环境氛围为N2。
1.3.10 热重分析曲线测定
使用TGA 550型热重分析仪对热处理前的辣木籽油和棕榈油进行测定。分别称取10 mg样品于坩埚中,设定加热速率为10 ℃/min,N2气流为20 mL/min,600 ℃内测定[15]。
1.3.11 色泽测定
使用UltraScan PRO型测色仪对装入1 cm石英比色皿中的样品进行颜色测定,以白板为色差测定参比,依次读取a*值和b*值,平行测量8次,取平均值。a*值表示从负到正(绿色到红色)的变化,b*值表示从负到正(从蓝色到黄色)的变化。
1.4 数据处理
各试验重复2次,各样品的指标至少进行3次平行测定,以平均值±标准偏差表示结果。使用SPSS 18.0软件对数据进行单因素方差分析(P<0.05时判断组间存在差异),之后采用S-N-K检验(假设方差相等)或DunnettT3检验(变量论证后不假设方差相等)。
2 结果与分析
2.1 辣木籽油和棕榈油DSC分析结晶和熔融曲线
如图1-A所示,辣木籽油和棕榈油的DSC分析结晶曲线均主要表现为2个峰,但峰的位置和强度存在差异。辣木籽油和棕榈油的第一个峰分别出现在1.6 ℃和-11.3 ℃,该处峰代表饱和甘油三酯结晶。两种油脂分别在-43.5 ℃和-27.9 ℃时出现第二个峰,该峰的出现是因为油脂中大量不饱和甘油三酯结晶[8]。肖新生等[16]报道,DSC分析结晶曲线的峰高度正比于结晶速率。因此,由图1-A可知,辣木籽油中不饱和甘油三酯的结晶速率快于棕榈油。图1-B是辣木籽油和棕榈油的DSC分析熔融曲线。由图1-B 可知,与棕榈油(-1.0 ℃)相比,辣木籽油(-1.8 ℃)在较低温度下呈现一个较深的峰,在该峰辣木籽油中大多数甘油三酯呈液态。此外,辣木籽油还有3个吸热变化不明显的肩峰,温度从低到高依次为-14.5、9.5、18.5 ℃,肩峰的出现可能是由于辣木籽油中不稳定的甘油三酯熔融-重结晶所导致的[17]。
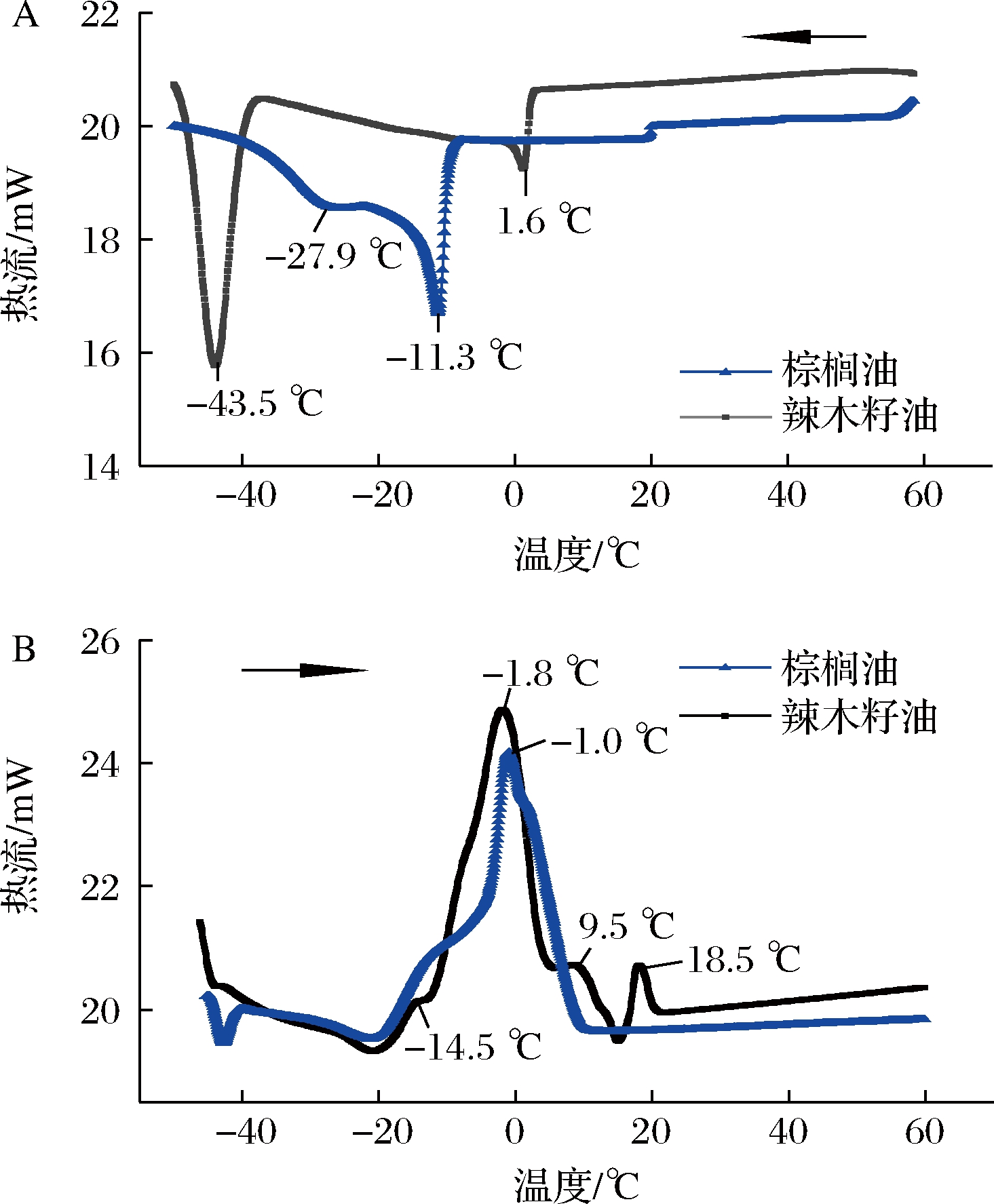
A-DSC分析结晶曲线;B-熔融曲线
图1 辣木籽油和棕榈油的DSC分析结晶和熔融曲线
Fig.1 DSC crystallization and melting curves of Moringa oleifera seed oil and palm oil
2.2 热处理对辣木籽油和棕榈油过氧化值、茴香胺值和总氧化值的影响
过氧化值、茴香胺值和总氧化值都是衡量油脂氧化稳定性的重要指标。辣木籽油和棕榈油的过氧化值、茴香胺值和总氧化值随加热温度和加热时间的变化如图2所示。随着加热温度的升高,辣木籽油的过氧化值和茴香胺值均呈现逐步上升趋势(图2-A和图2-C)。当加热温度从150 ℃升高到200 ℃时,辣木籽油的过氧化值和茴香胺值分别增加了73.3%和82.9%;棕榈油的过氧化值降低了61.4%,而茴香胺值增加了1.8倍。这是由于高温使棕榈油生成的氢过氧化物进一步氧化而生成了醛类和酮类等羰基化合物[18]。此外,200 ℃时,辣木籽油的总氧化值较未加热时升高了2.1 meq/kg,显著低于棕榈油的(12.0 meq/kg),这可能是因为辣木籽油中油酸和饱和脂肪酸占总脂肪酸的比例更高[8]以及生育酚含量更高且在热处理过程中损失较少。

A-加热温度-过氧化值;B-加热时间-过氧化值;C-加热温度-茴香胺值、总氧化值;D-加热时间-茴香胺值、总氧化值
图2 加热温度和加热时间对辣木籽油和棕榈油氧化稳定性的影响
Fig.2 Effect of heating temperature and heating time on peroxide value of Moringa oleifera seed oil and palm oil
注:小写字母不同表示差异显著(P< 0.05)(下同)
辣木籽油和棕榈油的茴香胺值和总氧化值随加热时间延长的总体变化趋势(图2-D)与升温处理(图2-C)相似。当加热时间从30 min延长至120 min时,辣木籽油的过氧化值由0.4 meq/kg下降至0.1 meq/kg(图2-B),说明加热时间对辣木籽油中氢过氧化物生成次级氧化产物的作用效果强于加热温度[19]。由上述分析可知,与棕榈油比较,辣木籽油在热处理过程中具有更高的稳定性。
2.3 热处理对辣木籽油和棕榈油酸价的影响
酸价反映油脂中游离脂肪酸含量,也是评价油脂变质情况的一个重要指标。如图3-A和3-B所示,辣木籽油的初始酸价明显高于棕榈酸,这可能是因为实验用的棕榈油是经过精炼处理的商品化油,而辣木籽油是经水酶法提取后未作精炼处理的油,从而残留了更多的游离脂肪酸。但辣木籽油的酸价仍低于5 mg/g,符合国家食用植物油卫生标准GB 2716—2018《食品安全国家标准 植物油》的限定范围。辣木籽油和棕榈油的酸价随加热温度的升高和加热时间的延长均呈逐步上升趋势。200 ℃时,辣木籽油和棕榈油的酸价分别为各自初始酸价的1.1倍和1.3倍(图3-A)。由图3-B可知,当加热时间从0 min延长至120 min时,辣木籽油的酸价增加了23.8%,显著低于棕榈油的(52.6%),表明辣木籽油在热处理过程中更不易发生水解反应,具有更高的稳定性。

A-加热温度;B-加热时间
图3 加热温度和加热时间对辣木籽油和棕榈油酸价的影响
Fig.3 Effect of heating temperature and heating time on acid value of Moringa oleifera seed oil and palm oil
2.4 热处理对辣木籽油和棕榈油红外光谱图的影响
图4是不同热处理下辣木籽油和棕榈油的傅里叶变换红外光谱。未经热处理的辣木籽油和棕榈油在3 468、2 924、2 858、1 744、1 162 cm-1处的特征峰分别与O—H伸缩振动,—CH2不对称伸缩振动,—CH2对称伸缩振动,C![]() O伸缩振动和C—O伸缩振动有关。由图4-A和图4-C可知,当温度升高至200 ℃时,辣木籽油和棕榈油在1 744 cm-1处的C
O伸缩振动和C—O伸缩振动有关。由图4-A和图4-C可知,当温度升高至200 ℃时,辣木籽油和棕榈油在1 744 cm-1处的C![]() O基团分别蓝移至1 749 cm-1和1 752 cm-1处,这可能是因为油脂发生氧化并生成了醛基和羰基类物质[20]。另外,由图4-B和图4-D可知,辣木籽油在1 744 cm-1处的峰变宽而棕榈油无明显变化,这可能是因为辣木籽油甘油三酯C
O基团分别蓝移至1 749 cm-1和1 752 cm-1处,这可能是因为油脂发生氧化并生成了醛基和羰基类物质[20]。另外,由图4-B和图4-D可知,辣木籽油在1 744 cm-1处的峰变宽而棕榈油无明显变化,这可能是因为辣木籽油甘油三酯C![]() O吸收峰与新产生的醛基类物质处于同一吸光度区域从而导致其伸缩振动重叠[21]。
O吸收峰与新产生的醛基类物质处于同一吸光度区域从而导致其伸缩振动重叠[21]。

A-棕榈油在不同温度下加热30 min;B-棕榈油在180 ℃下加热不同时间;C-辣木籽油在不同温度下加热30 min;D-辣木籽油在180 ℃下加热不同时间
图4 不同加热温度和加热时间辣木籽油和棕榈油的红外光谱图
Fig.4 Fourier infrared spectrum of Moringa oleifera seed oil and palm oil with heating temperature and heating time
2.5 热处理对辣木籽油和棕榈油成分热降解损失率的影响
加热过程中辣木籽油和棕榈油的热重分析曲线如图5所示。辣木籽油和棕榈油的质量损失分为3个阶段,第一阶段分别是30.0~195.5 ℃和30.0~221.9 ℃,该阶段辣木籽油和棕榈油的失重均低于1.0%,这可能与油脂中游离水分的蒸发有关[15];第二阶段的质量损失分别发生在195.5~342.5 ℃和221.9~326.6 ℃,辣木籽油和棕榈油的失重分别为7.7%和4.9%,这可能是由于高温导致了部分稳定性较差的脂肪酸缓慢分解[22];辣木籽油和棕榈油第三阶段的质量损失可能与油脂中甘油三酯的氧化分解有关[23]。由图5可知,第三阶段辣木籽油质量损失的起始温度为342.5 ℃,比棕榈油(326.6 ℃)高15.9 ℃,且该阶段内的质量损失(91.5%)比棕榈油(94.6%)低3.1%,这可能是因为辣木籽油中生育酚含量更高(辣木籽油生育酚含量263.6 μg/g,棕榈油生育酚含量254.1 μg/g),从而延缓了甘油三酯的氧化分解[24]。综上所述,辣木籽油较棕榈油在高温下的稳定性更加良好,但在热加工应用中应控制温度在195.5 ℃内。
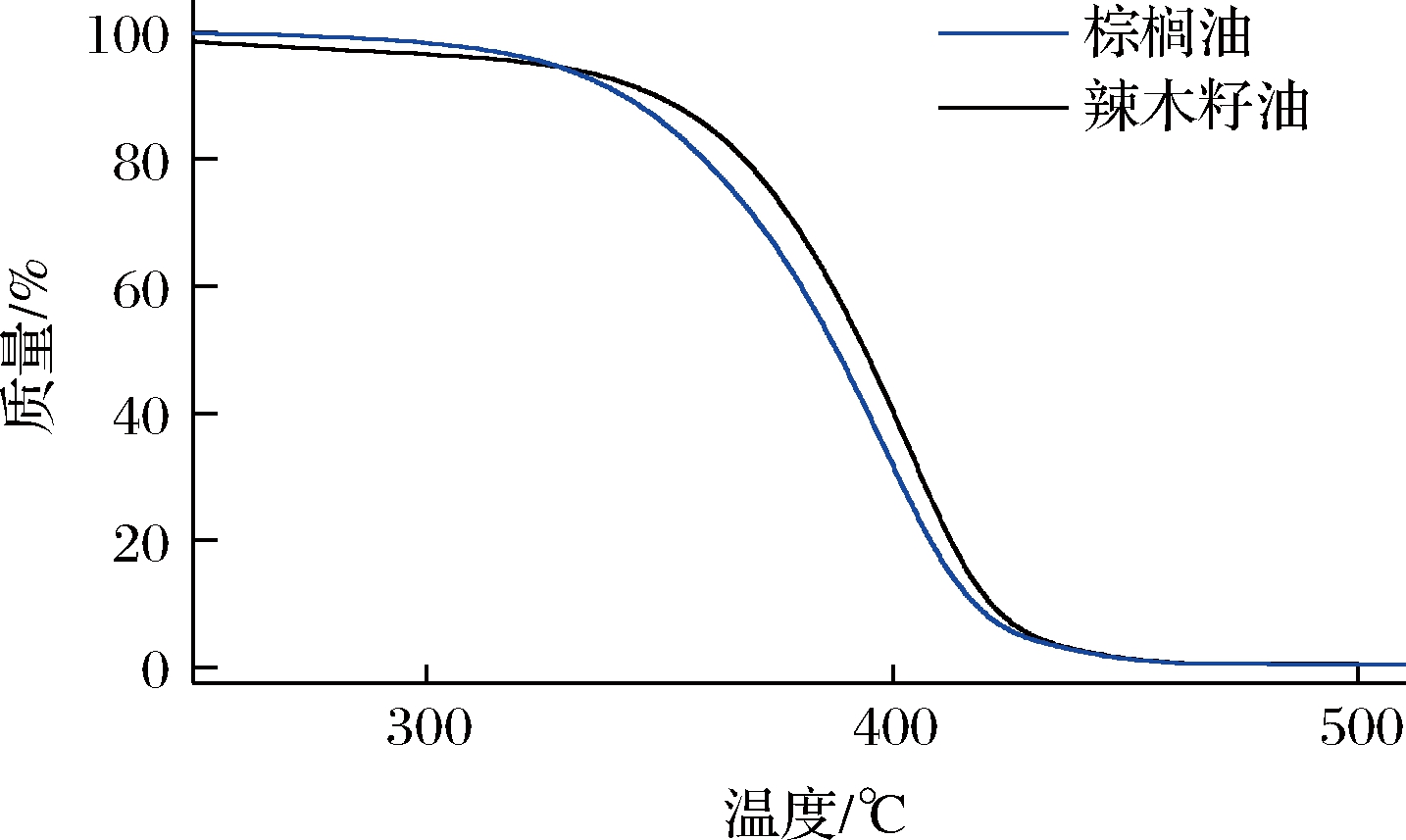
图5 辣木籽油和棕榈油的热重分析曲线
Fig.5 Thermo gravimetric analysis curves of Moringa oleifera seed oil and palm oil
2.6 热处理对辣木籽油和棕榈油生育酚含量的影响
生育酚作为自由基清除剂,其含量对于植物油的氧化稳定性至关重要。因此,本环节研究辣木籽油和棕榈油中α-生育酚和γ-生育酚的含量在热处理下的变化规律。由图6-A和图6-C可知,加热前,辣木籽油和棕榈油中α-生育酚含量没有显著差异,但辣木籽油中γ-生育酚的含量为14.5 μg/g,约为棕榈油(7.2 μg/g)的2.0倍。随着加热温度的升高和加热时间的延长,辣木籽油和棕榈油中α-生育酚和γ-生育酚的含量均呈现降低趋势。200 ℃时,辣木籽油α-生育酚和γ-生育酚的保留率分别为棕榈油相对应生育酚保留率的1.2倍和1.1倍(图6-A和图6-C)。图6-B显示,120 min时,辣木籽油中α-生育酚的保留率(70.0%)比棕榈油(57.6%)高12.4%。由此可见,热处理过程中辣木籽油生育酚的保留率高于棕榈油,这可能更有利于延缓高温下辣木籽油的氧化变质(图2)和降解(图5)。
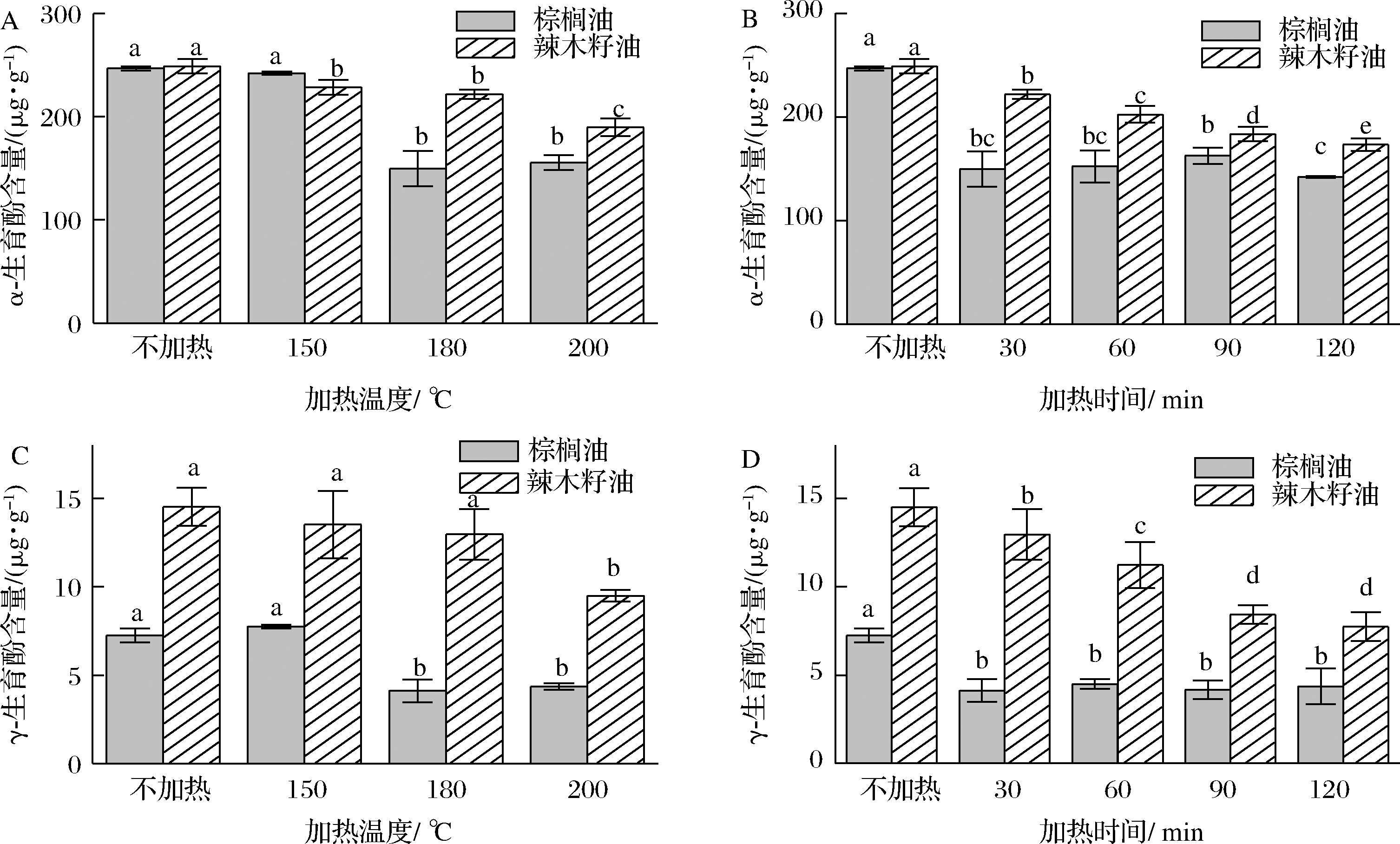
A-加热温度-α-生育酚含量;B-加热时间-α-生育酚含量;C-加热温度-γ-生育酚含量;D-加热时间-γ-生育酚含量
图6 加热温度和加热时间对辣木籽油和棕榈油α-生育酚含量和γ-生育酚含量的影响
Fig.6 Effect of heating temperature and heating time on the content of α-tocopherol and γ-tocopherol of Moringa oleifera seed oil and palm oil
2.7 热处理对辣木籽油和棕榈油色泽的影响
不同加热温度和加热时间下的辣木籽油和棕榈油色泽变化如图7所示。由图7-A和图7-B可知,随着加热温度的升高和加热时间的延长,辣木籽油和棕榈油的a*值均呈现先下降后上升的趋势。180 ℃时,辣木籽油和棕榈油的a*值分别降低了21.8%和2.0%;200 ℃时,辣木籽油和棕榈油的a*值分别升高了8.4%和7.3%(图7-A),说明辣木籽油和棕榈油的绿色先变深后变浅,且前者的变化程度大于后者。当加热时间由0 min增加至120 min时,辣木籽油a*值的变化量是棕榈油的1.1倍(图7-B)。图7-C和图7-D显示,热处理过程中辣木籽油的b*值逐渐降低,而棕榈油的b*值始终维持在21.1左右,说明辣木籽油的黄色逐渐变浅,而棕榈油的黄色无显著变化。综上所述,辣木籽油色泽受热处理的影响大于棕榈油。

A-a*-加热温度;B-a*-加热时间;C-b*-加热温度;D-b*-加热时间
图7 不同加热温度和加热时间辣木籽油和棕榈油色泽a*和b*的变化
Fig.7 Effect of heating temperature and heating time on a* and b* of Moringa oleifera seed oil and palm oil
3 结论
本文对比考察了辣木籽油和棕榈油的热稳定性及其变化规律。发现在考察温度(150~200 ℃)和考察时间(30~120 min)范围内,辣木籽油和棕榈油的过氧化值、茴香胺值和总氧化值总体均呈增长趋势。辣木籽油中γ-生育酚的含量(14.5 μg/g)为棕榈油(7.2 μg/g)的2.1倍,200 ℃时,该生育酚的保留率为棕榈油的1.1倍。辣木籽油a*值和b*值受热处理的影响大于棕榈油。本结果可为辣木籽油高温下稳定性变化的进一步研究提供理论依据,并为辣木籽油在食品加工中的应用提供理论参考。
[1] NADEEM M, IMRAN M.Promising features of Moringa oleifera oil:Recent updates and perspectives[J].Lipids in Health and Disease, 2016, 15(1):212.
[2] 邵婷, 覃小丽, 钟金锋, 等.辣木籽油的提取方法及其应用[J].食品与发酵工业, 2019, 45(17):286-293.
SHAO T, QIN X L, ZHONG J F, et al.Extraction methods and applications of oil from Moringa oleifera seed[J].Food and Fermentation Industries, 2019, 45(17):286-293.
[3] 王铁旦, 杨敏, 杨芳, 等.辣木籽油功能性成分检测及多元统计分析[J].食品科学, 2020, 41(16):145-150.
WANG T D, YANG M, YANG F, et al.Determination and multivariate statistical analysis of functional components of Moringa oleifera seed oil[J].Food Science, 2020, 41(16):145-150.
[4] 虎虓真, 陶宁萍, 许长华.基于食药价值的辣木籽研究进展[J].食品科学, 2018, 39(15):302-309.
HU X Z, TAO N P, XU C H.Recent advances in research on the medicinal and culinary value of Moringa seeds[J].Food Science, 2018, 39(15):302-309.
[5] 邓韦丝, 王敏, 吕秋冰.复合酶法提取辣木籽油及其体外抗氧化活性[J].粮食与油脂, 2019, 32(12):67-72.
DENG W S, WANG M, LYU Q B.Study on composite enzymatic extraction and in vitro anti-oxidative of Moringa oleifera seed oil[J].Cereals and Oils, 2019, 32(12):67-72.
[6] ZHAO S W, ZHANG D K.A parametric study of supercritical carbon dioxide extraction of oil from Moringa oleifera seeds using a response surface methodology[J].Separation and Purification Technology, 2013, 113:9-17.
[7] MOHAMMADPOUR H, SADRAMELI S M, ESLAMI F, et al.Optimization of ultrasound-assisted extraction of Moringa peregrina oil with response surface methodology and comparison with Soxhlet method[J].Industrial Crops and Products, 2019, 131:106-116.
[8] ZHONG J F, WANG Y H, YANG R, et al.The application of ultrasound and microwave to increase oil extraction from Moringa oleifera seeds[J].Industrial Crops and Products, 2018, 120:1-10.
[9] 王丽虹, 许悦, 刘阳.辣木籽中活性物质及其生理功能研究进展[J].食品研究与开发, 2019, 40(4):190-195.
WANG L H, XU Y, LIU Y.The research progress of active components and its physiological functions of Moringa oleifera seeds[J].Food Research and Development, 2019, 40(4):190-195.
[10] DUARTE A M, AQUINO J S, QUEIROZ N, et al.A comparative study of the thermal and oxidative stability of Moringa oil with olive and canola oils[J].Journal of Thermal Analysis and Calorimetry, 2018, 134(3):1 943-1 952.
[11] ANWAR F, HUSSAIN A I, IQBAL S, et al.Enhancement of the oxidative stability of some vegetable oils by blending with Moringa oleifera oil[J].Food Chemistry, 2007, 103(4):1 181-1 191.
[12] OGUNSINA B S, INDIRA T N, BHATNAGAR A S, et al.Quality characteristics and stability of Moringa oleifera seed oil of Indian origin[J].Journal of Food Science and Technology, 2014, 51(3):503-510.
[13] 孙燕, 覃小丽, 钟金锋, 等.不同预处理对辣木籽油提取率的影响及其机理初步分析[J].食品与发酵工业, 2019, 45(11):179-184;190.
SUN Y, QIN X L, ZHONG J F, et al.Effects of different pretreatments on extracting Moringa oleifera seed oil and relevant mechanisms[J].Food and Fermentation Industries, 2019, 45(11):179-184;190.
[14] SHAHIDI F, WANASUNDARA U. Methods for measuring oxidative rancidity in fats and oils. Florida: CRC Press, 2002.
[15] BHUTADA P R, JADHAV A J, PINJARI D V, et al.Solvent assisted extraction of oil from Moringa oleifera Lam.seeds[J].Industrial Crops and Products, 2016, 82:74-80.
[16] 肖新生, 杨天奎.脂类结晶习性的研究[J].粮油加工, 2008(4):75-77.
XIAO X S, YANG T K.Study on the crystallization habit of lipids[J].Cereals and Oils Processing, 2008(4):75-77.
[17] FU X N, SU J L, HOU L, et al.Physicochemical and thermal characteristics of Moringa oleifera seed oil[J].Advanced Composites and Hybrid Materials, 2021, 4(3):685-695.
[18] ABDULKARIM S M, LONG K, LAI O M, et al.Frying quality and stability of high-oleic Moringa oleifera seed oil in comparison with other vegetable oils[J].Food Chemistry, 2007, 105(4):1 382-1 389.
[19] SANDHYA RANI A K S, REDDY S Y, CHETANA R.Quality changes in trans and trans free fats/oils and products during frying[J].European Food Research and Technology, 2010, 230(6):803-811.
[20] ROHMAN A, CHE MAN Y B.Application of FTIR spectroscopy for monitoring the stabilities of selected vegetable oils during thermal oxidation[J].International Journal of Food Properties, 2013, 16(7):1 594-1 603.
[21] REXHEPI F, SURLEVA A, HYSENI A, et al.Comprehensive investigation of thermal degradation characteristics and properties changes of plant edible oils by FTIR spectroscopy[J].Acta Chemica Iasi, 2019, 27:263-286.
[22] DOSSANTOS COSTA M N F, MUNIZ M A P, NEGR O C A B, et al.Characterization of Pentaclethra macroloba oil:Thermal stability, gas chromatography and Rancimat[J].Journal of Thermal Analysis and Calorimetry, 2014, 115(3):2 269-2 275.
O C A B, et al.Characterization of Pentaclethra macroloba oil:Thermal stability, gas chromatography and Rancimat[J].Journal of Thermal Analysis and Calorimetry, 2014, 115(3):2 269-2 275.
[23] SHEN Q, ZHANG Z C, EMAMI S, et al.Publisher Correction: Triacylglycerols are preferentially oxidized over free fatty acids in heated soybean oil[J].NPJ Science of Food, 2021, 5:7.
[24] DE ALBUQUERQUE MEIRELES B R L, ALC NTARA M A, DE LIMA BRITO POLARI I, et al.Catole coconut (Syagrus cearensis) oil:Physicochemical characterization and thermo coxidative stability by TG/DTG/DTA and Rancimat[J].Journal of Thermal Analysis and Calorimetry, 2022, 147(5):3 591-3 598.
NTARA M A, DE LIMA BRITO POLARI I, et al.Catole coconut (Syagrus cearensis) oil:Physicochemical characterization and thermo coxidative stability by TG/DTG/DTA and Rancimat[J].Journal of Thermal Analysis and Calorimetry, 2022, 147(5):3 591-3 598.