大曲是中国白酒酿造中的糖化发酵剂,富含微生物、水解酶和风味物质,对白酒的生产起着至关重要的作用。根据最高培养温度和风味特征的不同,大曲可以划分为低温、中温和高温大曲,其中低温大曲的曲胚温度在40~50 ℃,用其酿造的白酒具有入口绵、落口甜和清香纯正等风味特征[1]。俗话说“曲乃酒之骨”,大曲品质的好坏对于白酒的生产具有重要影响,大量研究表明曲中微生物的组成与大曲的品质之间存在一定的关联性[2]。WU等[3]的研究表明库德毕赤酵母菌(Pichia kudriavzevii)是白酒发酵中的关键菌种,可产生醇类、酸类和酯类等芳香化合物,该物种在谷类基质的发酵过程中可产生2-苯乙醇等香气物质。作为白酒酿造中的功能微生物,JIN等[4]的研究表明以曲霉属(Aspergillus)为代表的丝状真菌具有糖化淀粉的能力,该属也被认为是形成白酒中吡嗪、酯类和某些芳香化合物的关键微生物。因此,解析大曲中微生物的菌群结构是调控和提升大曲品质的关键。
Illumina Miseq高通量测序技术在解析微生物多样性上具有通量高和速度快的优点,因而在大曲微生物类群解析中应用较为广泛[5]。基于该技术,ZHOU等[6]对低温、中温和高温大曲的真菌菌群进行了解析,发现大曲加工温度对真菌群落结构有着重要影响。电子鼻仿生技术具有易操作和准确性高等优点,通常用于食品领域中的风味品质检测[7],雷炎等[8]使用该技术选择出了适用于红枣酒发酵的扣囊复膜酵母菌株。山西是清香型白酒的发源地,其中吕梁地区出产的汾酒更是成为了清香型白酒的代表,吸引国内众多学者对其微生物类群和风味品质开展了研究[9]。山西省长治、临汾和太原等地区亦有制作低温大曲和酿造清香型白酒的传统,然而目前有关长治地区低温大曲中真菌菌群结构及其风味品质特征的研究较少。
本研究首先采用Illumina Miseq测序技术解析长治地区低温大曲中真菌的菌群结构,继而使用电子鼻识别大曲中的挥发性物质,并在此基础上对大曲中蕴含的真菌类群与风味品质的关联性进行了分析评价,以期为后续低温大曲的工业化生产提供部分参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
低温大曲:11个大曲样品均采自山西省长治市长治县(北纬35°49′~37°07′,东经111°59′~113°44′),所有样品均属于青茬曲,且以大麦和豌豆为主要原料,由当地酒厂车间工人制作而成,制曲温度在40~50 ℃,样品编号记为LXS1~LXS11。大曲样品采集时间为2022年4月,制作完成后的大曲在曲库存放时间均大于3个月,样品采集时将曲块放于20 cm×20 cm的自封袋中密封,送回实验室后打磨成粉末状放于-20 ℃冰箱备用。
1.1.2 试剂
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,青岛海博生物技术有限公司;QIAGEN DNeasy maricon Food Kit DNA基因组提取试剂盒,德国QIAGEN公司;FastPfu Fly DNA Polymerase、5×Trans StartTM、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)Mix和FastPfu Buffer,北京全式金生物技术有限公司;引物ITS4R/ITS3F,武汉天一辉远生物科技有限公司。
1.2 仪器与设备
JFSD-100Ⅱ粉碎机,上海隆拓仪器设备有限公司;Veriti FAST梯度PCR扩增仪,美国ABI公司;UVPCDS8000凝胶成像分析系统,美国Protein Simple公司;MiSeq PE300高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司;LTF-8D水浴锅,上海龙跃仪器有限公司;PEN3电子鼻,德国Airsense公司。
1.3 实验方法
1.3.1 霉菌和酵母菌平板菌落计数
参照汪腊云等[10]的方法对大曲样品中的霉菌和酵母菌进行计数,其中样品10倍稀释至10-6梯度,取1 mL稀释液与约20 mL培养基混匀后待平板凝固,正置于28 ℃培养箱中培养5 d,随后对平板中生长的菌落进行计数。
1.3.2 宏基因组提取、PCR扩增和Illumina MiSeq测序
使用试剂盒提取低温大曲中微生物的宏基因组DNA[11],参照KANG等[12]的方法对ITS2区域进行PCR扩增,将具有明亮且清晰条带的扩增产物寄往上海美吉生物医药科技有限公司用Illumina MiSeq PE300高通量测序平台进行测序。
1.3.3 生物信息学分析
参照WANG等[13]的方法对下机序列进行拼接和质控,基于QIIME(V1.9.1)分析平台[14]并使用PyNAST软件对原始序列进行校准和对齐[15],在100%和97%相似性下使用UCLUST软件划分分类操作单元(operational taxonomic unit,OTU)[16],使用ChimeraSlayer软件剔除含有嵌合体的OTU[17],通过与UNITE数据库比对明确各分类学地位[18]。
1.3.4 基于电子鼻技术低温大曲的风味品质评价
准确称取20 g低温大曲样品于电子鼻专用样品瓶中,在50 ℃水浴锅中水浴30 min后放于室温平衡30 min,使用PEN3电子鼻进行检测,测试参数参照张鑫等[19]的方法。每个样品设置3个平行,在60 s的测试时间中取已达到平稳的第49 s、第50 s和第51 s时传感器响应值的平均值作为测试值。
1.3.5 数据处理
使用Cytoscape软件(v3.7.2)绘制真菌属的相关性网络图;使用R软件(v4.1.2)的“BiodiversityR”包绘制物种累积箱形图,“waterfall”包绘制瀑布图,“pacman”、“reshape”、“psych”、“ggtree”、“aplot”、“ggplot2”和“pheatmap”包绘制真菌属与风味品质的相关性热图;使用Graph Pad Prism9软件绘制样品风味品质评价的小提琴图;其余图均为使用Origin 2018软件绘制。
2 结果与分析
2.1 长治地区低温大曲的测序结果及α多样性分析
本研究首先对长治地区低温大曲样品中霉菌和酵母菌进行了计数,发现其含量在7.00~7.37 lg CFU/g,进一步采用高通量测序技术解析11个大曲样品的真菌菌群结构,对各样品测序结果进行了分析整合,如表1所示。
表1 低温大曲样品测序结果及各分类地位数量
Table 1 Sequencing results of low-temperature Daqu samples and the number of taxonomic status
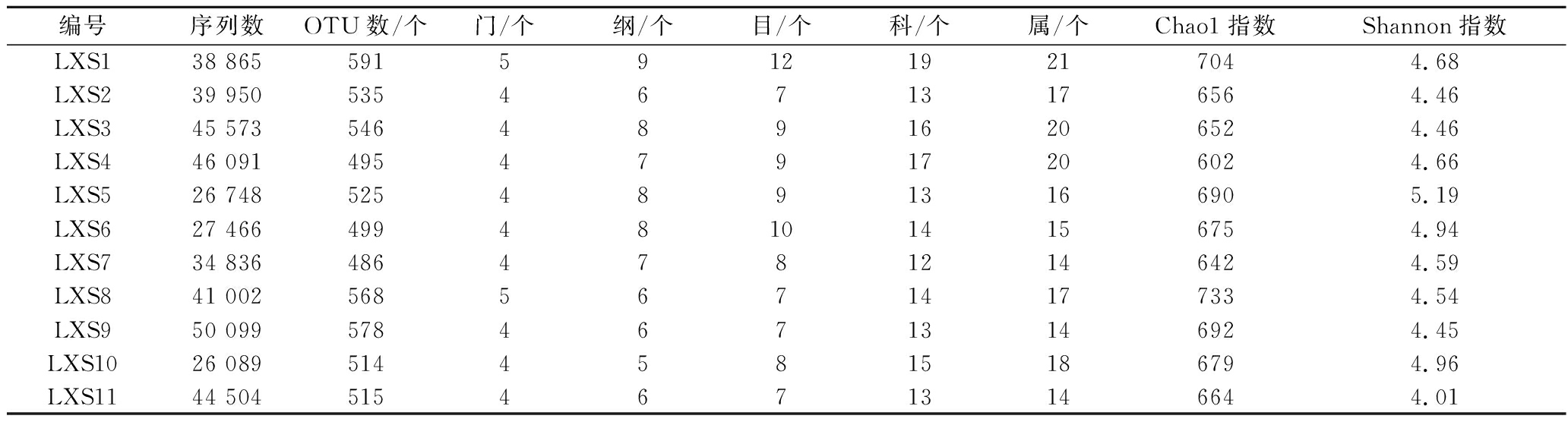
编号序列数OTU数/个门/个纲/个目/个科/个属/个Chao1指数Shannon指数LXS138 865591591219217044.68LXS239 95053546713176564.46LXS345 57354648916206524.46LXS446 09149547917206024.66LXS526 74852548913166905.19LXS627 466499481014156754.94LXS734 83648647812146424.59LXS841 00256856714177334.54LXS950 09957846713146924.45LXS1026 08951445815186794.96LXS1144 50451546713146644.01
注:Chao 1指数和Shannon指数均在测序量为25 010条序列时计算所得
由表1可知,本研究共产生421 223条优质序列,平均每个样品38 293条,经97%相似度聚类分析共得到5 852个OTU,所有样品中的真菌隶属于6个门、15个纲、27个目、39个科和51个属。当测序量在25 010条序列时,样品LXS8具有最高的Chao1指数为733,样品LXS5具有最高的Shannon指数为5.19,由此可见,样品LXS8的真菌菌群丰度最高,而样品LXS5的真菌菌群多样性最高。
为评估本研究的测序深度是否满足后续生物信息学分析的需要,绘制了物种累积箱型图,如图1所示。

图1 低温大曲中物种累积箱型图
Fig.1 Box diagram of species accumulation in low-temperature Daqu
由图1可知,随着纳入本研究样本数的增加,可观察到物种的多样性也随之递增,而曲线上升的趋势逐渐接近平稳,可见本研究中涵盖的样品数已满足实验的要求,若再增加大曲的样品数,物种数也不会再发生大幅度变化,这表明测序数据量足以反映纳入本研究所有样品的大多数微生物信息并满足后续生物信息学分析的要求。
2.2 长治地区低温大曲的真菌菌群结构解析
本研究将在11个低温大曲样品中均存在,且平均相对含量>1.0%的真菌门、属和OTU,定义为核心优势真菌门、属和OTU,同时比较分析了各样品中核心优势真菌门和属的组成与含量,如图2所示。

a-真菌门;b-属
图2 低温大曲中核心优势真菌门和属的相对含量分析
Fig.2 Analysis of relative content of core dominant fungal phyla and genera in low-temperature Daqu
由图2可知,在长治地区低温大曲样品中3个核心优势真菌门分别为毛霉门(Mucoromycota,64.00%)、子囊菌门(Ascomycota,32.81%)和担子菌门(Basidiomycota,1.36%),7个核心优势真菌属分别为根霉属(Rhizopus,59.48%)、曲霉属(Aspergillus,14.31%)、双足囊菌属(Dipodascus,4.15%)、丝毕赤酵母属(Hyphopichia,3.95%)、梗霉属(Lichtheimia,2.70%)、根毛霉属(Rhizomucor,2.36%)和复膜孢酵母属(Saccharomycopsis,1.70%)。CAI等[20]亦采用高通量测序的方法,发现湖北襄阳地区的30个低温大曲中优势真菌属为Saccharomycopsis(81.05%)、嗜热子囊菌属(Thermoascus,7.47%)和红曲霉属(Monascus,3.39%)。由此可见,不同地区、工艺、原料和环境等因素可能对于大曲中微生物的组成有一定的影响。值得一提的是,Saccharomycopsis是两个地区低温大曲的共有优势真菌属,LI等[21]的研究表明隶属于Saccharomycopsis的扣囊复膜孢酵母菌(S.fibuligera)能产生大量淀粉酶,将淀粉水解成葡萄糖,但它不能将葡萄糖发酵成乙醇,在白酒酿造中通常与酿酒酵母(Saccharomyces cerevisiae)混合培养用以提高乙醇的产量。由此可见,积极开发具有优良发酵特性S.fibuligera的筛选和应用,对于提高大曲的品质可能具有积极意义。
核心优势真菌属的相关性网络图,如图3所示。
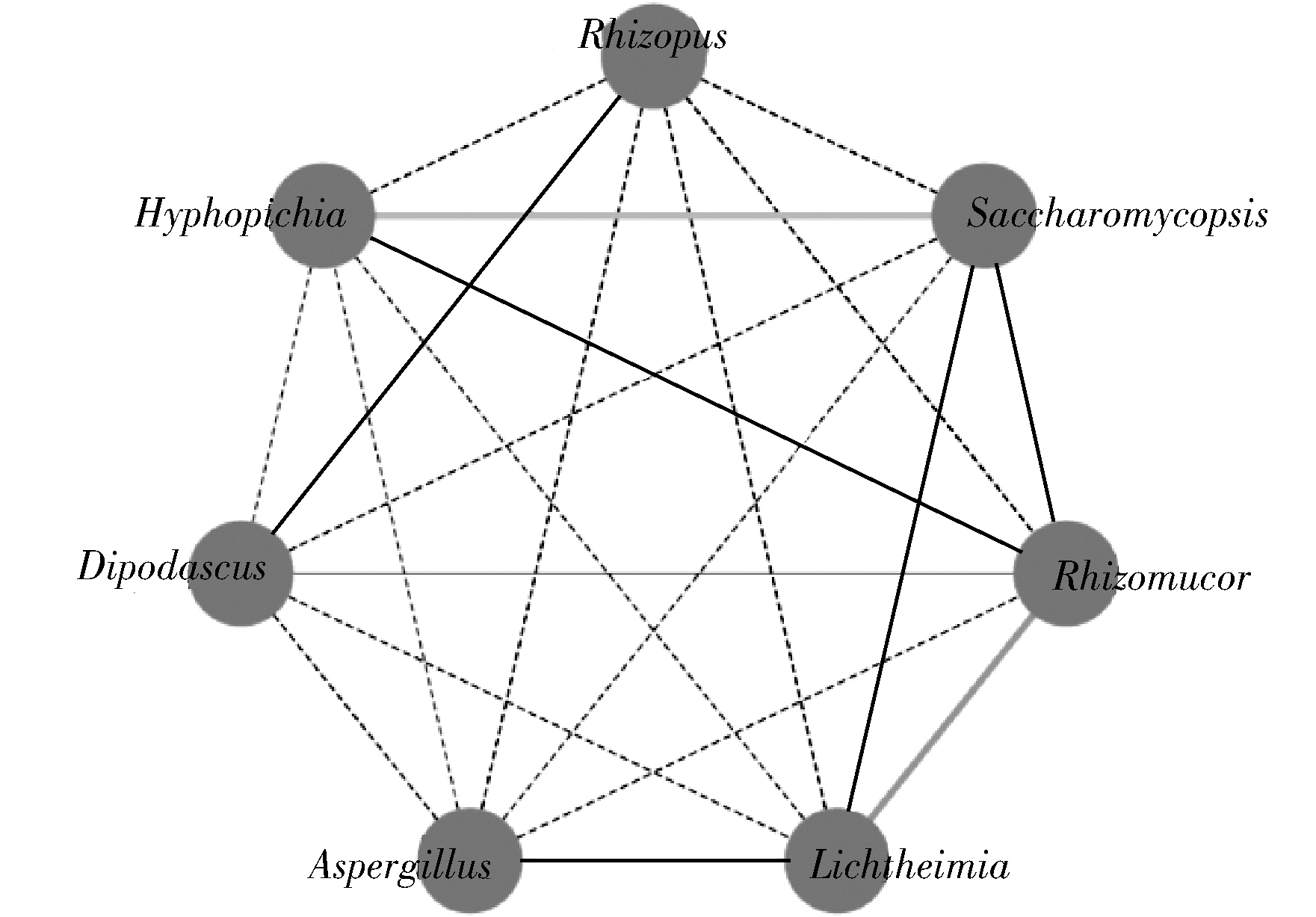
图3 低温大曲中核心优势真菌属的相关性网络图
Fig.3 Correlation network of core dominant fungal genera in low-temperature Daqu
注:实线代表正相关,虚线代表负相关;加粗线段代表P<0.05
由图3可知,7个核心优势真菌属之间共存在8个正相关和13个负相关,其中Lichtheimia和Rhizomucor呈显著正相关(P<0.05),Hyphopichia和Saccharomycopsis亦呈显著正相关(P<0.05)。DU等[22]的研究表明,Hyphopichia具有一定的耐热性,并且能产生乙酸乙酯等多种重要的风味物质,是引起大曲表层形成的关键真菌。MA等[23]的研究表明,Saccharomycopsis可以产生α-淀粉酶和葡萄糖淀粉酶等各种酶,在将淀粉转化为可溶性糖方面表现出良好的性能,并对乙酸乙酯、乳酸乙酯和β-苯乙醇等挥发性化合物的生产过程产生具有积极影响。由此可见,低温大曲样品中真菌菌群之间存在一定的关联性,其中核心优势真菌属之间存在明显的正相关性,这可能是低温大曲中风味形成的基础。
本研究进一步在OTU水平上解析了低温大曲样品中真菌的菌群结构,绘制了核心优势OTU的瀑布图,如图4所示。

图4 低温大曲中核心优势OTU的瀑布图
Fig.4 Waterfall diagram of core dominant OTU in low-temperature Daqu
由图4可知,虽然在所有低温大曲样品中均存在的OTU高达207个,但其中核心优势OTU仅有13个,分别为隶属于Rhizopus的OTU 1978、OTU 1783、OTU 1647、OTU 2047、OTU 783、OTU 2785和OTU 693,其累计平均含量为43.29%;隶属于Aspergillus的OTU 790和OTU 2266,其累计平均含量为13.27%;隶属于Dipodascus的OTU 756,其平均含量为4.13%;隶属于Rhizomucor的OTU 2144,其平均含量为2.34%以及隶属于Lichtheimia的OTU 141,其平均含量为1.10%。作为纳入本研究低温大曲中含量最丰富的真菌属,WANG等[24]的研究表明Rhizopus的菌株具有糖化和合成脂肪酶的能力,对酒体风味具有独特的贡献。由此可见,长治地区低温大曲样品中蕴含丰富的真菌菌群,解析不同样品中真菌的菌群组成对于研究大曲的品质具有重要意义。
2.3 长治地区低温大曲的风味品质评价
PEN3电子鼻在食品风味和大气质量的评价中均有广泛应用[25],其中传感器W5S、W6S和W1S主要是用于评价大气中的氮氧化物、氢气和甲烷含量,故而本研究中对上述3个传感器进行了屏蔽,使用剩余7个传感器对低温大曲的风味品质进行了评价,其响应值箱型图如图5所示。
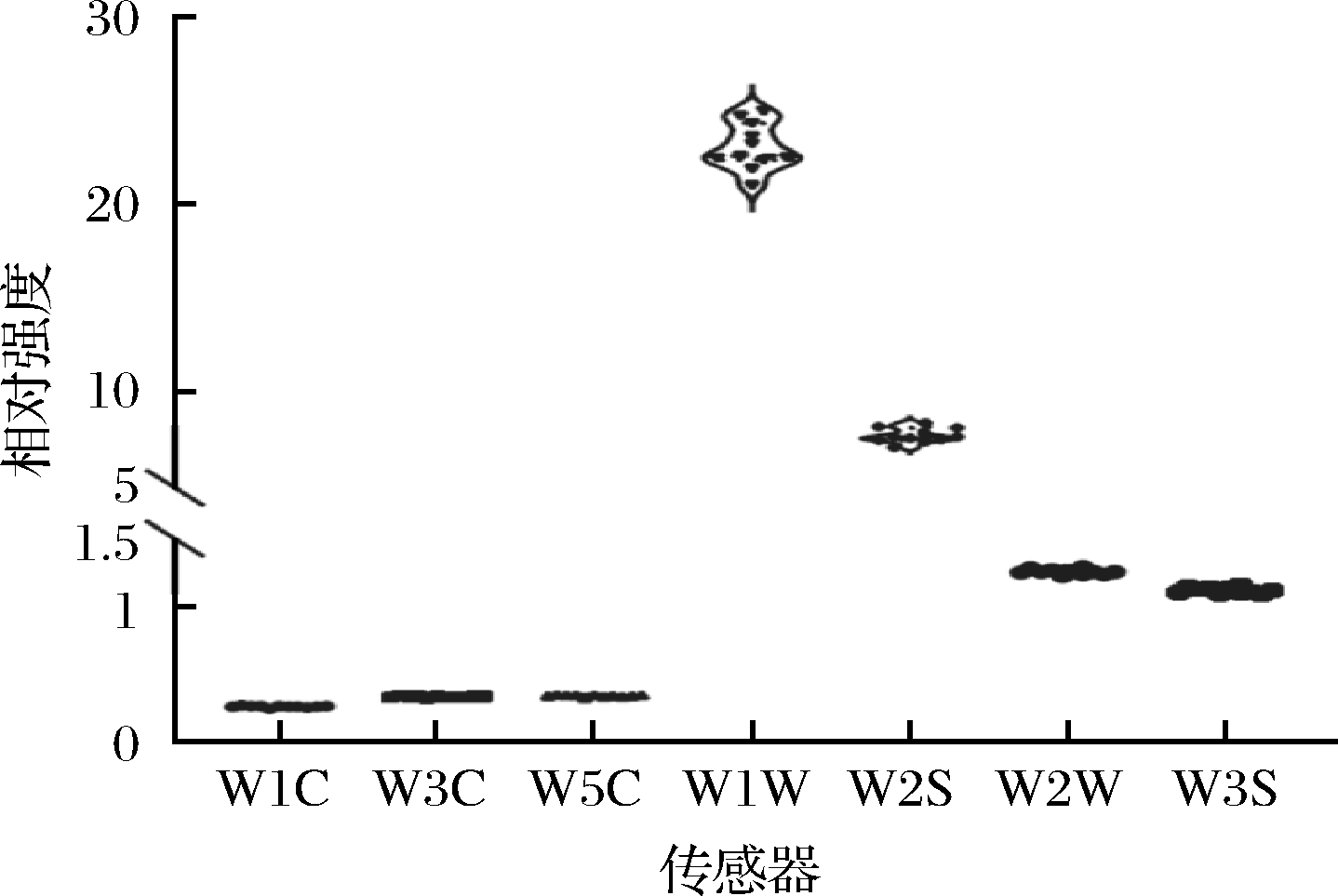
W1C-对芳香味物质灵敏;W3C-对芳香类物质灵敏;W5C-对烷烃、 芳香类物质灵敏;W1W-对有机硫化物、萜类物质灵敏; W2S-对乙醇灵敏;W2W-对有机硫化物灵敏;W3S-对烷烃灵敏
图5 低温大曲样品的风味品质评价
Fig.5 Flavor quality evaluation of of low-temperature Daqu samples
由图5可知,纳入本研究大曲的风味物质含量相对较少,仅有W1W(对有机硫化物、萜类物质灵敏)和W2S(对乙醇灵敏)2个传感器在所有样品中响应值的平均值大于5,可见长治地区低温大曲的挥发性物质含量较少,且主要的挥发性物质体现在有机硫化物、萜类物质和乙醇上。由图5亦可知,所有样品在风味指标上的差异主要表现在W1W上,变异系数为5.37%,这说明不同样品中挥发性风味物质的差异主要在有机硫化物和萜类物质上。有机硫化物作为长治地区低温大曲中一个较为突出的风味物质,SONG等[26]的研究表明,2-甲基-3-呋喃硫醇和2-糠基硫醇两个有机硫化物对清香型和浓香型白酒的总体香气特征有显著贡献,并且这些化合物可用于区分清香型、浓香型和酱香型白酒。
2.4 长治地区低温大曲真菌菌群和风味品质的相关性分析
本研究在解析低温大曲中的真菌菌群并使用电子鼻识别样品中挥发性物质的基础上,对核心优势真菌属与风味品质的关联性进行了分析,结果如图6所示。

图6 低温大曲中核心优势真菌属与风味指标的相关性热图
Fig.6 Heatmap of the correlation between core dominant fungal genera and odor indexes in low-temperature Daqu
注:*代表P<0.05
由图6可知,Rhizomucor与W2W传感器(对有机硫化物灵敏)的响应值呈显著正相关(P<0.05),Lichtheimia与W3C传感器(对芳香类物质灵敏)的响应值呈显著负相关(P<0.05),由于有机硫化物和芳香类物质是大曲的特征指标,故而Rhizomucor和Lichtheimia对大曲风味的形成具有重要作用。DENG等[27]的研究表明,Rhizomucor可以分解大曲原料中的淀粉,促进丙酮酸和氨基酸的转化,为其他微生物的生长提供营养,并为后期酒精发酵积累还原糖,此外Rhizomucor还能分泌脂肪酶和蛋白酶,它们在酯、醛、脂肪酸等挥发性物质的合成过程中起着关键作用。FAN等[28]的研究表明Lichtheimia是淀粉酶的主要生产者,表现出水解淀粉的强产糖活性,有研究亦表明乙酸、乙醇、苯乙醇和乙酸乙酯等挥发性代谢物与Lichtheimia有关。由此可见,积极选育具有提升大曲风味品质特性的Rhizomucor和Lichtheimia菌株,对于提高大曲的品质亦可能具有积极意义。
3 结论
长治地区低温大曲中存在丰富的真菌菌群,在门水平上主要由Mucoromycota、Ascomycota和Basidiomycota构成,在属水平上主要由Rhizopus、Aspergillus、Dipodascus、Hyphopichia、Lichtheimia、Rhizomucor和Saccharomycopsis构成。大曲样品中主要的挥发性物质体现在有机硫化物、萜类物质和乙醇上,并且Rhizomucor与有机硫化物呈显著正相关,Lichtheimia与芳香类物质呈显正相关。
[1] ZHENG X W, TABRIZI M R, ROBERT NOUT M J, et al.Daqu-A traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2011, 117(1):82-90.
[2] HOU Q C, WANG Y R, CAI W C, et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Research International, 2022, 156:111167.
[3] WU Q, ZHU Y, FANG C, et al.Can we control microbiota in spontaneous food fermentation?-Chinese liquor as a case example[J].Trends in Food Science &Technology, 2021, 110:321-331.
[4] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[5] YANG J G, DOU X A, MA Y Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].Journal of the Institute of Brewing, 2018, 124(4):498-507.
[6] ZHOU Q F, MA K, SONG Y, et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu daqu starters made at low-, medium-and high-temperatures[J].LWT, 2022, 162:113408.
[7] 王俊, 崔绍庆, 陈新伟, 等.电子鼻传感技术与应用研究进展[J].农业机械学报, 2013, 44(11):160-167;179.
WANG J, CUI S Q, CHEN X W, et al.Advanced technology and new application in electronic nose[J].Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(11):160-167;179.
[8] 雷炎, 刘梦琦, 易秦振, 等.扣囊复膜酵母在红枣酒中的应用[J].食品研究与开发, 2021, 42(5):131-136.
LEI Y, LIU M Q, YI Q Z, et al.Application of Saccharomycopsis fibuligera in jujube wine[J].Food Research and Development, 2021, 42(5):131-136.
[9] 马茹菲, 马玉帛, 佟世生, 等.不同清香型大曲理化生化指标和挥发性成分分析[J].酿酒科技, 2019, 40(3):70-75.
MA R F, MA Y B, TONG S S, et al.Physiochemical and biochemical indexes and volatile compounds of different Qingxiang Daqu[J].Liquor-Making Science &Technology, 2019, 40(3):70-75.
[10] 汪腊云, 裴华, 朱晓薇, 等.食品中霉菌和酵母菌计数的检测能力验证结果分析[J].食品安全质量检测学报, 2021, 12(3):1 021-1 025.
WANG L Y, PEI H, ZHU X W, et al.Analysis of verification results of detection ability of molds and yeasts in food[J].Journal of Food Safety Quality, 2021, 12(3):1 021-1 025.
[11] 赵恒, 陈富安, 赵慧君, 等.茨河腐乳细菌与真菌多样性及其功能关联分析[J].食品与发酵工业, 2022, 48(10):212-218.
ZHAO H, CHEN F A, ZHAO H J, et al.Diversity and functional correlation analysis of bacteria and fungi in Huase sufu[J].Food and Fermentation Industries, 2022, 48(10):212-218.
[12] KANG J M, JIA L L, ZHANG Z X, et al.Comparison of physicochemical characteristics and microbiome profiles of low-temperature Daqu with and without adding tartary buckwheat[J].Food Bioscience, 2022, 49(10):101931.
[13] WANG Y R, SHE M N, GUO Z A, et al.Determination of fungal diversity of acidic gruel by using culture-dependent and independent methods[J].Food Science &Nutrition, 2020, 8(11):5 832-5 840.
[14] L PEZ-GARC
PEZ-GARC A A, PINEDA-QUIROGA C, ATXAERANDIO R, et al.Comparison of mothur and QIIME for the analysis of rumen microbiota composition based on 16S rRNA amplicon sequences[J].Frontiers in Microbiology, 2018, 9:3010.
A A, PINEDA-QUIROGA C, ATXAERANDIO R, et al.Comparison of mothur and QIIME for the analysis of rumen microbiota composition based on 16S rRNA amplicon sequences[J].Frontiers in Microbiology, 2018, 9:3010.
[15] CAPORASO J G, BITTINGER K, BUSHMAN F D, et al.PyNAST:A flexible tool for aligning sequences to a template alignment[J].Bioinformatics, 2010, 26(2):266-267.
[16] SODHI K K, KUMAR M, SINGH D K.Assessing the bacterial diversity and functional profiles of the River Yamuna using Illumina MiSeq sequencing[J].Archives of Microbiology, 2021, 203(1):367-375.
[17] SESSOU P, KEISAM S, TUIKHAR N, et al.High-throughput Illumina MiSeq amplicon sequencing of yeast communities associated with indigenous dairy products from republics of Benin and Niger[J].Frontiers in Microbiology, 2019, 10(4):594.
[18] NILSSON R H, LARSSON K H, TAYLOR A F S, et al.The UNITE database for molecular identification of fungi:Handling dark taxa and parallel taxonomic classifications[J].Nucleic Acids Research, 2019, 47(D1):D259-D264.
[19] 张鑫, 刘帅, 吕丙, 等.电子鼻测定大曲气味的方法探讨[J].食品工程, 2018, 25(3):46-50.
ZHANG X, LIU S, LV B, et al.Study on the determination method of Daqu by electronic nose[J].Food Engineering, 2018, 25(3):46-50.
[20] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150:110734.
[21] LI R Y, ZHENG X W, ZHANG X, et al.Characterization of bacteria and yeasts isolated from traditional fermentation starter (Fen-Daqu) through a 1H NMR-based metabolomics approach[J].Food Microbiology, 2018, 76:11-20.
[22] DU H, SUN J A, ZHOU T C, et al.A high-throughput absolute abundance quantification method for the characterisation of Daqu core fungal communities[J].Fermentation, 2022, 8(8):345.
[23] MA R F, SUI L, ZHANG J S, et al.Polyphasic characterization of yeasts and lactic acid bacteria metabolic contribution in semi-solid fermentation of Chinese Baijiu (traditional fermented alcoholic drink):Towards the design of a tailored starter culture[J].Microorganisms, 2019, 7(5):147.
[24] WANG X D, BAN S D, QIU S Y.Analysis of the mould microbiome and exogenous enzyme production in Moutai-flavor Daqu[J].Journal of the Institute of Brewing, 2018, 124(1):91-99.
[25] DI GILIO A, PALMISANI J, PETRACCONE S, et al.An integrated high temporal resolution approach to monitor VOCs concentrations and odour annoyance near a petroleum plant[J].Environmental Engineering &Management Journal, 2018, 17(10):2 373-2 378.
[26] SONG X B, ZHU L, JING S, et al.Insights into the role of 2-methyl-3-furanthiol and 2-furfurylthiol as markers for the differentiation of Chinese light, strong, and soy sauce aroma types of Baijiu[J].Journal of Agricultural and Food Chemistry, 2020, 68(30):7 946-7 954.
[27] DENG Y K, HUANG D, HAN B L, et al.Correlation:Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Frontiers in Microbiology, 2021, 12(9):688981.
[28] FAN G S, DU Y H, FU Z L, et al.Characterisation of physicochemical properties, flavour components and microbial community in Chinese Guojing roasted sesame-like flavour Daqu[J].Journal of the Institute of Brewing, 2019, 126(1):105-115.