肥胖现已成为继吸烟、艾滋病之后的第三位影响人类健康的流行病学因素,且位居全球第五大死亡原因[1]。肥胖不仅与糖尿病、高血压、冠状动脉心脏病、高血脂、脑卒中、关节炎等多种慢性疾病密切相关,同时又是许多慢性非传染性疾病的危险因素[2]。肥胖的发生与脂质代谢密切相关,当机体能量摄入与支出失衡时,脂肪组织将过剩营养以甘油三酯的形式贮存在脂肪组织中,导致脂肪细胞数量的过度增加、细胞体积的过度增大,甚至导致脂肪细胞凋亡或坏死,进而导致脂肪过度堆积和(或)分布异常的病理状态[3-4]。另一方面,由于能量摄入与消耗的不平衡使机体能量系统出现应激反应,导致肠道代谢生态系统的变化[5]。近年来大量研究证实,肠道菌群失调能够改变肠道通透性[6],使大量游离脂肪酸进入肝脏导致肝内大量脂质沉积[7],诱导肝细胞氧化损伤,促进慢性疾病的发生发展[5]。
肠道微生物群能够影响肠道内物质的吸收、能量代谢,免疫器官发育和抵抗病原体等生理过程,在生命活动中发挥着至关重要的作用[8]。肠道内脂肪营养源微生物分解摄入的外源食物时,当脂质含量超过机体所需量,会被进一步贮存进而直接或间接导致肥胖[2]。这一生理过程会改变血清、脂肪组织和肝脏中的脂质代谢产物来影响甘油三酯、磷脂酰胆碱和短链脂肪酸(short-chain fatty acids, SCFA)的代谢,从而间接影响能量和脂质代谢[9]。越来越多的证据还表明,肥胖相关微生物可以改变宿主能量获取、胰岛素抵抗、体内平衡和脂肪沉积。SCFA、γ-氨基丁酸、胆汁酸和5-羟色胺,是一类典型的肠道菌代谢产物,这些物质可通过免疫系统、肠-脑神经系统和全身循环传播到中枢神经系统。然后,这些信号涉及各种传入和传出通路,如迷走神经和下丘脑-肝/脂肪组织轴,以调节稳态的各个方面。因此,调节肠道微生物群可能会改善肥胖相关疾病,例如调节脂肪积累和脂质代谢。除了通过体育锻炼以及控制饮食量调节肠道菌群的热量外,还可以服用几种药物,最常用的是双歧杆菌[10]、乳酸菌和复合嗜酸乳杆菌[11],但大多数需要控制饮食。近几年越来越多的研究发现富含多酚的食物具有抗氧化、抗肿瘤以及改善肠道微生物组成的功效[12-16]。因此,从天然植物中开发安全性、功能性的食品来调节肠道菌群结构和脂质代谢具有重要意义。
甜叶菊是多年生草本植物,于慧等[17]发现甜叶菊提取物(stevia extract, STE)具有良好的抗氧化活性,可有效抑制鱼油、鲐鱼松的氧化。李丹等[18]、任晓静等[19]发现STE对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌有抑菌作用。本课题组前期经过高场核磁共振以及液相串联三重四级杆质谱仪检测确定,STE中主要物质为香草醛酸4-O-β-D-吡喃葡萄糖苷、原儿茶酸、咖啡酸、绿原酸和隐绿原酸。基于此,本研究通过构建脂代谢紊乱模型,研究STE对高脂血症鼠糖脂代谢、氧化应激和肠道微生态的影响。本研究对于甜叶菊类保健食品的开发具有重要意义,为甜叶菊高值高质化利用提供思路。
1 材料与方法
1.1 试剂与仪器
甜叶菊提取物STE(维科制剂),上海维丘康敬生物有限公司;体重20~25 g,36只SPF级昆明小鼠,上海杰斯捷生物有限公司;基础饲料,南京盛民生物有限公司;Qubit3.0 DNA检测试剂盒,Life生物有限公司;除特殊说明外,本实验中所使用的试剂盒均购自南京建成生物有限公司;乙醚,源叶生物工程有限公司。
Pico-21台式离心机,Thermo Fisher公司;DYY-6C电泳仪,北京市六一仪器厂;PCR仪,北京东胜创新生物科技有限公司;酶标仪,美国 Molecular Devices公司;GA-3型血糖仪,三诺生物传感有限公司。
1.2 实验动物与饲料
将昆明鼠分别单独饲养于塑料笼具中,饲养环境为温度(23±2) ℃、相对湿度(50±10)%、明暗周期12 h。饲料及水均为自由摄取,笼具及垫料定期清洗更换,适应性喂养7 d后,分为3组(对照组,模型组,制剂组),各组体重无显著性差异(图1)。对照组:继续饲喂标准饮食20 d后,每天灌胃0.4 mL无菌水,标准饲料及水均为自由摄取30 d;模型组:高脂高糖饮食20 d后,每天灌胃0.4 mL无菌水,高脂高糖饲料及水均为自由摄取30 d;制剂组:模型组高脂高糖饮食20 d后,每天灌胃0.4 mL STE制剂(按制剂干基0.05 g/kg比例将相应量制剂稀释在0.4 mL无菌水内),高脂高糖饲料及水均为自由摄取30 d。其中每天灌胃的时间为18:00~19:00,每3 d称量1次鼠体重并调整灌胃制剂量。试验结束后,禁食不禁水12 h,采用乙醚麻醉。眼眶取血浆,后在室温下静置20 min,在4 000 r/min,4 ℃条件下离心15 min,取上层血清,置于-80 ℃冰箱。快速解剖出肝脏、肾脏、腹部脂肪、结肠,称量,其中肝脏和结肠部位剪切一部分放入固定液,用于后续病理分析,其余全部分装放入-80 ℃冰箱用于后续分析。

图1 实验示意图
Fig.1 Experimental scheme
1.3 生理生化指标的测定
参考试剂盒说明书,分别检测血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein cholesterol, HDL)、低密度脂蛋白(low-density lipoprotein cholesterol, LDL)和游离脂肪酸(free fatty acid,FFA)。参考试剂盒说明书,检测肝脏中TC、TG的含量。使用血糖仪测定鼠血糖情况,待仪器数值稳定后,读取数值并记录动脉硬化指数(atherogenic index, AI),计算如公式(1)所示:
(1)
1.4 氧化应激及转氨酶水平测定
参考试剂盒说明书,分别检测血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽氧化物酶(glutathione peroxidase, GSH-Px)和丙二醛(malondialdehyde,MDA)含量。
1.5 组织切片
将肝脏和结肠组织浸泡在固定液中24 h后,使用蒸馏水反复清洗。按照浓度由低到高原则依次用60%,70%,80%,90%,100%(体积分数)乙醇进行梯度脱水。之后按照试剂盒对所得切片进行苏木精-伊红(hematoxylin-eosin staining,H&E)染色,使用生物显微镜观察并拍照。
1.6 肠道内容物水分的测定
使用快速水分测定仪测定结肠内容物水分含量。
1.7 小鼠粪便中肠道菌群的16S rRNA V3~V4区测序
试验结束前,采用刺激外周肛门将采集到的粪便立即放在无菌离心管内,立即使用天根试剂盒提取总DNA。引物341F(5′-ACTCCTACGGGAGGCAGCA-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)用于扩增活性 16S rDNA的V3~V4区域。从2%琼脂糖凝胶中提取扩增子,使用Qubit3.0 DNA检测试剂盒进行纯化和定量,然后在生工生物工程有限公司使用FLASH (v.1.2.7)对原始读数进行分析和质量过滤。使用UCLUST (v.5.2.236)对序列进行聚类,并根据97%成对同一性的阈值分配给相同的操作分类单元(operational taxonomic unit,OTU)。使用QIIME (v.1.8.0)计算Shannon和Simpson多样性指数,以及Chao1和ACE丰度指数来分析alpha多样性。QIIME软件用于分析肠道菌群的组成和丰度,识别肠道菌群的结构变化。随后得到样本物种丰富度以及菌群多样性等信息,并进一步比较分析不同分组其粪便微生物结构和功能的差异。
1.8 数据统计分析
采用SPSS 26.0软件进行统计分析,方差分析采用ANOVA分析,数据进行正态分布检验,符合正态分布的多重比较采用Duncan法,不符合正态分布的采用Kruskal-Wallis检验,P<0.05,差异显著。作图采用软件Prism 9.0软件(Graph Pad)绘制,数据以Mean±SD表示。
2 结果与分析
2.1 体重及脏器指数的影响
脂肪过度摄入会促使体脂在各个部位堆积,因此本文考察体重及几个主要脏器的质量。从图2可以看出,模型组体重,肝脏、附睾脂肪质量显著高于对照组(P<0.05),但是对肾脏几乎无影响(P>0.05)。STE制剂组的腹部脂肪显著低于模型组(P<0.05),这也意味着STE制剂能够促进昆明鼠脂质的代谢,抑制其脂肪过度贮存。肝脏是脂质的主要代谢器官,当机体摄入过多的脂肪,脂质分解代谢速率低于脂肪合成速率致使脂质在肝脏的堆积[4],肝叶肥大[7],STE可以抑制脂质在肝脏的堆积。血糖来源主要有两种:一是食物中的糖类、蛋白质、脂肪[12];二是自身存储的肝糖原和肌糖原[14],当血糖含量过高时会引起胰岛素抵抗[20]。模型组由于摄入高脂高糖饮食,其血糖浓度极显著高于对照组(P<0.001)。STE的干预显著降低血糖浓度(P<0.05)。通过这些结果,我们可以证明甜叶菊提取物可以有效的抑制高脂高糖饮食带来的体重增加和血糖升高。
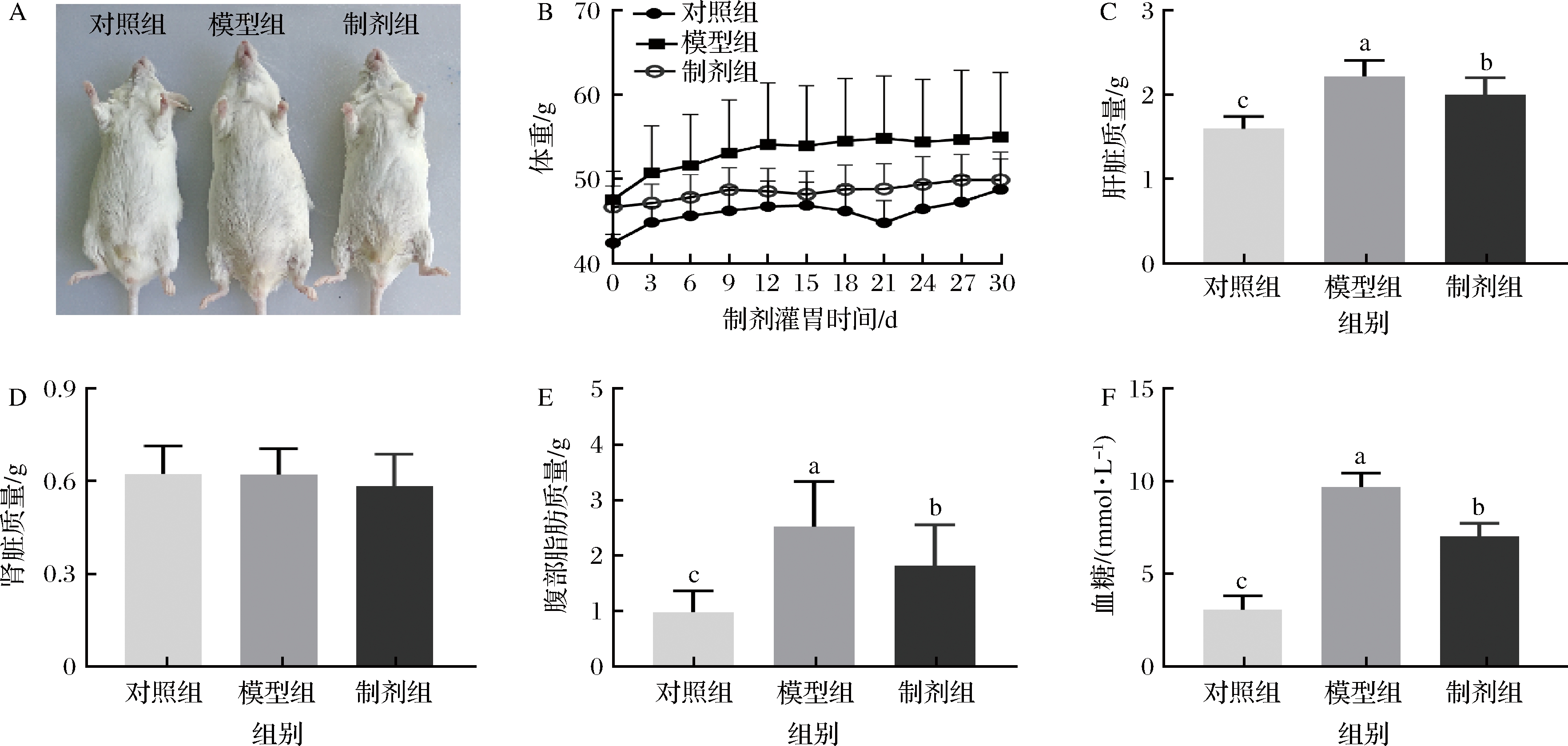
A-小鼠体照片;B-体重;C-肝脏质量;D-肾脏质量;E-腹部脂肪质量;F-血糖
图2 昆明鼠体重,脏器质量及血糖变化
Fig.2 Changes in body weight, organ mass and blood sugar of Kunming rat
注:不同小写字母表示样品组之间存在显著差异(P< 0.05)(下同)
2.2 脂质代谢的影响
血脂四项(TG、TC、HDL和LDL)水平反应了机体脂代谢水平正常与否[8]。由图3可知,高脂高糖饮食导致血清和肝脏中TG和TC的含量极显著增加(P<0.001)。STE可以显著降低血清和肝脏重TG和TC含量(P<0.05)。STE可以显著抑制由高脂高糖饮食带来的HDL升高和LDL降低(P<0.05)。血清中游离脂肪酸含量和AI指数也可以侧面反映血脂代谢情况[21],高脂高糖饮食极其显著的提高血清FFA含量和AI指数(P<0.001),STE能够极显著的降低FFA含量(P<0.001),这一结果与上文表型结果相一致。STE能影响高脂高糖膳食饲喂小鼠的脂代谢水平。
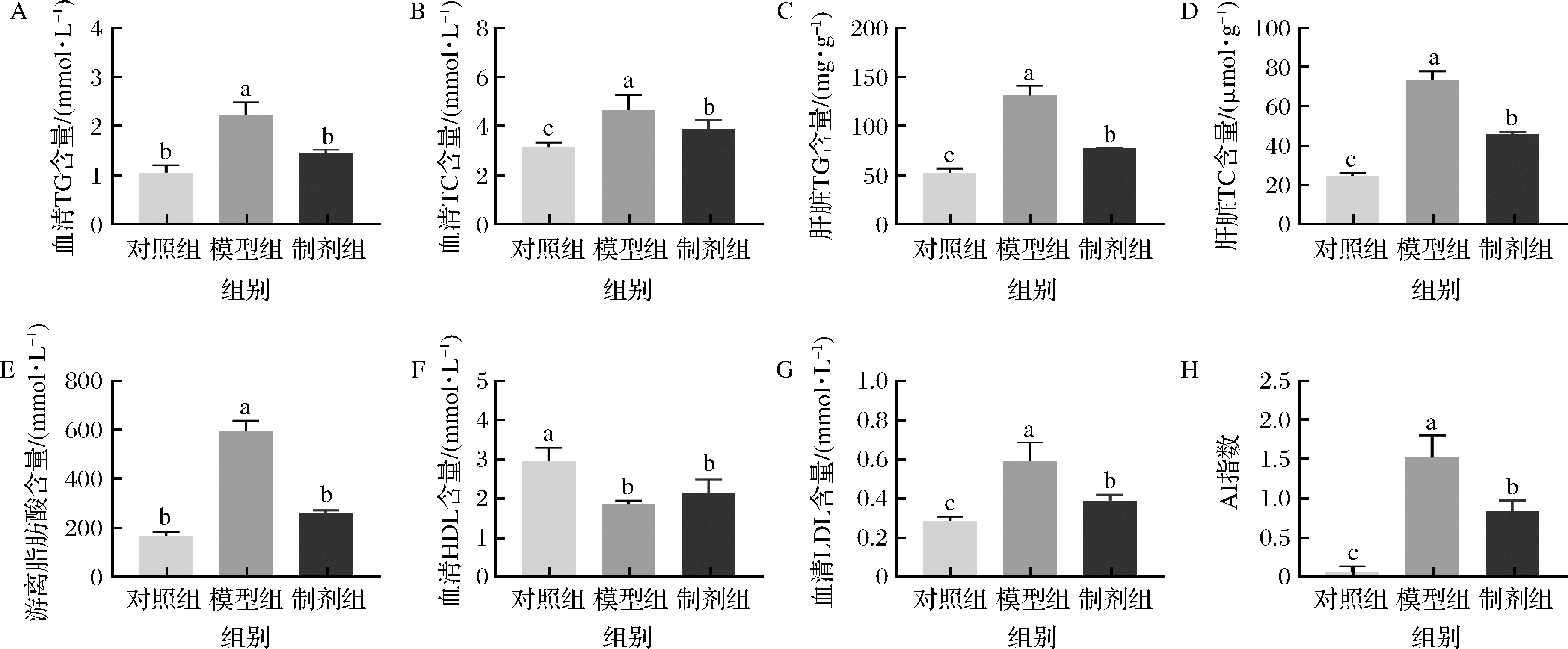
A-血清TG含量;B-血清TC含量;C-肝脏TG含量;D-肝脏TC含量;E-游离脂肪酸含量;F-血清HDL含量;G-血清LDL含量;H-AI指数
图3 昆明鼠血清及肝脏中脂质代谢产物的含量
Fig.3 Contents of lipid metabolites in serum and liver of Kunming mice
2.3 氧化应激状态
氧化应激是指生物体内氧化与抗氧化系统紊乱引起活性氧自由基积累,而活性氧自由基可以与细胞膜上的不饱和脂肪酸发生脂质过氧化作用(产生中间产物MDA),导致组织及器官氧化损伤[2,13,22]。大量研究表明高脂高糖饮食可以诱导机体氧化应激[23]。SOD是生物体内最重要且最佳的自由基清除剂,维持机体代谢平衡。谷胱甘肽过氧化物酶可以催化谷胱甘肽产生氧化型谷胱甘肽,是机体内广泛存在的一种重要的过氧化物分解酶[15]。本研究发现高脂高糖饮食降低了血清中GSH-Px和SOD水平,提高了MDA的含量,这可能是由于血清中脂质的过氧化产生MDA,诱导GSH-Px和SOD的消耗。相对于模型组,STE能够显著的提高GSH-Px和SOD水平(P<0.05),同时降低MDA的含量促使其恢复正常水平(P<0.05)(图4)。有研究表明在应激状态下机体血糖会大量分解提供热量和功能,因此氧化应激的改变也促进了血糖的改变,这一结果与上文一致。这里可以得出STE干预显著改善了高脂高糖饮食引起的氧化应激状态。
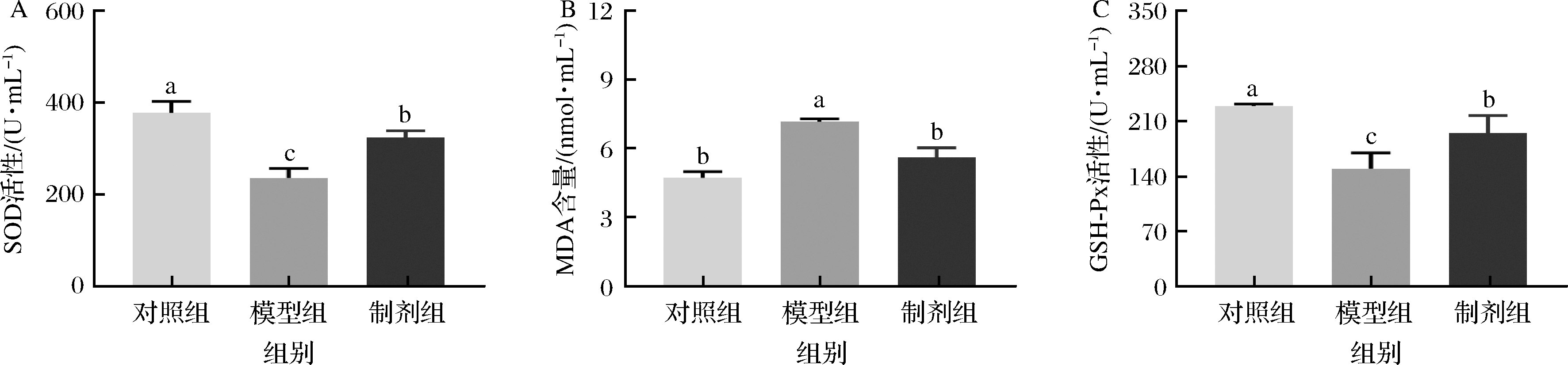
A-SOD;B-MDA;C-GSH-Px
图4 昆明鼠血清中氧化应激的变化
Fig.4 Changes of oxidative stress in serum of Kunming mice
2.4 肝脏损伤情况
高脂高糖饮食诱导脂质代谢紊乱,肝脏代谢功能是否正常需要被确认,如图5所示,测定血清中ALT和AST水平。结果显示高脂高糖饮食组血清ALT和AST水平极其显著高于标准饮食鼠(P<0.001),STE能够显著抑制转氨酶的升高(P<0.01),表明STE能够保护肝脏,维持正常的肝脏脂代谢功能。对肝脏组织进行H&E染色发现,模型组和制剂组与对照组相比肝脏脂滴明显增多,脂质积累明显增加。相对于模型组,制剂组肝脏脂质小而少,这一结果与血脂情况以及转氨酶结果相一致。证明STE能够调节脂代谢,保护肝脏组织。

A-ALT;B-AST;C-肝脏H&E染色切片
图5 昆明鼠转氨酶水平及肝脏组织形态学观察
Fig.5 The level of transaminase and histomorphology observation of liver in Kunming mice
2.5 结肠损伤情况
结肠是肠道消化食物中的重要部位。从图6可以看出模型组结肠长度比对照组短(P<0.05),制剂组能够抑制高脂高糖饮食引起的结肠变短。绒毛长度和隐窝深度是评价肠道消化性能的直观指标,肠道绒毛越长,隐窝越浅,绒毛长度和隐窝深度的比值越大,代表消化吸收能力越好,反之消化吸收能力较差[24]。结肠H&E染色切片显示,长时间的高脂高糖饮食饲喂显著改善了小鼠肠道的形态结构,模型组小鼠肠道绒毛明显变短、隐窝显著加深,说明高脂膳食对小鼠肠道的消化吸收能力存在影响。制剂组和模型组相比,肠绒毛长度增加,隐窝深度减小,并且可以看出制剂组肠道形态几乎和对照组相似。肠道内容物水分含量能侧面反映肠道的消化能力,水分含量较高促进食物在肠道内的蠕动促进消化,通过检测发现,制剂组的水分含量都较高,与对照组无显著差异(P>0.05),显著高于模型组(P<0.05)。上述结果表明STE的添加对高脂高糖饮食引起的小鼠肠道消化吸收能力、形态结构的改变有一定的改善作用。

A-结肠图片;B-结肠长度;C-肠道内容物水分含量;D-结肠H&E染色照片
图6 昆明鼠结肠组织学评估
Fig.6 Histological evaluation of the intestines of Kunming mice
2.6 肠道菌群结构
越来越多的研究表明肠道微生物与宿主对营养物质和能量的摄取[7]、糖代谢和胆固醇代谢[12]、胰岛素敏感性[22]、非酒精性脂肪肝[20]和慢性炎症[25]等有关。在本研究中,利用Illumina Miseq高通量测序平台测定小鼠肠道微生物16S rDNA的V3~V4区的序列来研究高糖高脂饮食和STE对小鼠肠道微生物的影响。肠道内微生物的多样性决定着肠道微生态,可以用Chao1指数以及Simpson指数衡量肠道微生物多样性[26]。从图7-A~图7-C可以看出,高糖高脂饮食以及STE对肠道微生物多样性产生影响。主成分分析显示,制剂组与对照组接近,与模型组较远,这也说明制剂组肠道菌群结构与对照组相似。从肠道菌门水平上看,小鼠的肠道菌群主要由厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)组成。厚壁菌门微生物对食物中的热量敏感,促进热量的吸收,丰度过高,会引起肥胖。高脂膳食饲喂显著增加了厚壁菌门的丰度(P<0.05),STE的干预显著改善了高脂高糖饮食引起的这一变化。和模型组相比,制剂组拟杆菌门丰度显著增加,从而导致厚壁菌门/拟杆菌门(Firmicutes/Bacteroidetes,F/B)的比值降低。以上结果可以说明STE干预可以将高糖高脂导致的紊乱肠道微生物组成逐渐向正常状态移动。研究还发现STE的添加还可以提高乳酸杆菌属的丰度。通过功能注释分析发现,高脂高糖饮食影响着肠道脂代谢与糖代谢、信号传递通路、氨基酸转运与代谢通路。

A-Chao 1指数;B-Simpson指数;C-肠道菌门水平;D-主成分分析;E-厚壁菌门/拟杆菌门比值;F-差异菌群丰度分析;G-热图分析
图7 甜叶菊提取物对昆明鼠肠道微生物的影响
Fig.7 Effects of stevia extract on intestinal microbes of Kunming rats
为了探讨肠道微生物与糖脂代谢以及氧化应激之间的关系,本文就肠道菌群的丰度与相关指标进行相关性分析[27],AI指数与Stenotrophomonas、Ruminococaceae、Odoribacter和Acetatifactor这些菌水平呈现显著正相关。值得关注的是HDL含量、SOD、GSH-Px活性与影响SCFA合成的Prevotellaceae、抑制脂多糖产生的Akkermansia丰度显著正相关。SCFA是肠道能量物质,较多的SCFA促进肠道微生物活动,SCFA的缺乏减弱了其对于肠道黏膜屏障的保护作用[28];脂多糖是一种肠源性内毒素,含量过高会破坏肠道黏膜屏障[29]。TG,TC,LDL,AST以及ALT与Rothia菌呈现显著正相关。根据这些结果,推测STE的干预通过提高Prevotellaceae与Akkermansia的丰度,促使SCFA的产生增强肠道黏膜屏障的保护作用,降低肠源性内毒素脂多糖产生,维持肠道稳态,进而通过肝-肠轴作用调节血脂代谢,维持各部位脂质的平稳,保护肝脏。
3 结论
本研究使用高糖高脂饮食构建脂代谢紊乱模型,通过甜叶菊提取物干预高脂饮食鼠发现STE可以有效的抑制高脂高糖饮食带来的体重增加和血糖升高,同时调节脂质代谢,维持氧化应激平衡,抑制肝脏脂质堆积;另一方面STE可以改善肠道结肠形态促进食物的消化吸收,调节肠道厚壁菌和拟杆菌的丰度。相关性分析表明HDL、SOD、GSH-Px与Prevotellaceae、Akkermansia相对丰度显著正相关。本研究的发现为利用甜叶菊及其副产物改善脂代谢紊乱提供了新理论依据,同时为甜叶菊高值化利用提供了新思路。
[1] GARC A-FERN
A-FERN NDEZ G, KROTTER A, GARC
NDEZ G, KROTTER A, GARC A-PÉREZ
A-PÉREZ  , et al.Pilot randomized trial of cognitive-behavioral treatment plus contingency management for quitting smoking and weight gain prevention among smokers with overweight or obesity[J].Drug and Alcohol Dependence,2022,236:109477.
, et al.Pilot randomized trial of cognitive-behavioral treatment plus contingency management for quitting smoking and weight gain prevention among smokers with overweight or obesity[J].Drug and Alcohol Dependence,2022,236:109477.
[2] MAHMOUD H M, SALLAM R M, AYAD HENIN C M, et al.Synbiotics intake improves disturbed metabolism in a rat model of high fat diet-induced obesity:A potential role of adipose tissue browning[J].Obesity Medicine,2022,32:100414.
[3] 王佳. “肠—肝—脑”轴介导的番茄红素改善糖脂代谢紊乱及认知障碍的作用机制研究[D].杨凌:西北农林科技大学,2019.
WANG J.Lycopene attenuates the impairment of cognitive function via improving glycolipid metabolism dysfunction in gut-liver-brain axis[D].Yangling:Northwest A&F University, 2019.
[4] 尚延侠.运动对肥胖儿童少年血管内皮功能与血清淀粉样蛋白A等炎症因子的影响[D].上海:上海体育学院, 2011.
SHANG Y X.The effect of exercise on endothelial function and inflammatory factors such as acute-phase serum amyloid a in obese children and adolescents[D].Shanghai:Shanghai University of Sport, 2011.
[5] 尹畅. 外源性胆汁酸缓解肉鸡热应激作用的研究[D].北京:中国农业科学院,2021.
YIN C.The effects of exogenous bile acid on alleviating heat stress in broiler chickens[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[6] 魏萌,蒋红利,史珂慧,等.益生菌改善尿毒症大鼠肠道氧化应激反应保护肠道屏障功能的研究[J].临床肾脏病杂志,2020,20(7):573-578.
WEI M, JIANG H L, SHI K H, et al.Probiotics improve intestinal oxidative stress to protect intestinal barrier function in uremic rats[J].Journal of Clinical Nephrology, 2020, 20(7):573-578.
[7] RAMIREZ L A, SNYDER E E, MATTSON D, et al.T cells contribute to lipid deposition in male and female dahl rats fed a high saturated fat diet[J].The FASEB Journal,2022.https://doi.org/10.1096/fasebj.2022.36.S1.0R832.
[8] WEI B, ZHANG B, DU A Q, et al.Saccharina japonica Fucan suppresses high fat diet-induced obesity and enriches fucoidan-degrading gut bacteria[J].Carbohydrate Polymers, 2022, 290:119411.
[9] KHOSRAVI A D, SEYED-MOHAMMADI S, TEIMOORI A, et al. The role of microbiota in colorectal cancer. Folia Microbiologica, 2022, 67(5):683-691.
[10] ZHA H, SI G N, WANG C Y, et al.Characteristics of the gut microbiota in Bifidobacterium catenulatum LI10 pretreated rats with lower levels of D-galactosamine-induced liver damage[J].Journal of Applied Microbiology,2022, 133(2):375-384.
[11] YANG S Q, XIONG Z H, XU T F, et al.Compound probiotics alleviate cadmium-induced intestinal dysfunction and microbiota disorders in broilers[J].Ecotoxicology and Environmental Safety, 2022, 234:113374.
[12] LI P, GAO M K, FU J H, et al.Dietary soya saponin improves the lipid metabolism and intestinal health of laying hens[J].Poultry Science,2022,101(4):101663.
[13] HE D, WU Q F, LU C Y, et al.Pyropia yezoensis porphyran alleviates metabolic disorders via modulating gut microbiota in high-sucrose-fed Drosophila melanogaster[J].Journal of the Science of Food and Agriculture,2022, 102(11):4 802-4 812.
[14] HE Y S, LUO R L, XIA M Y, et al.Orally administered diosgenin alleviates colitis in mice induced by dextran sulfate sodium through gut microbiota modulation and short-chain fatty acid generation[J].Journal of Medicinal Food,2022,25(3):261-271.
[15] 和贵文,和云凤,陈粉粉,等.麻风树叶提取物多酚与黄酮分析及对肉鸡盲肠微生物多样性的影响[J].江苏农业科学,2022,50(7):165-171.
HE G W, HE Y F, CHEN F F, et al.Analysis of polyphenols and flavonoids from Jatropha curcas leaf extract and their effects on cecal microbial diversity of broilers[J].Jiangsu Agricultural Science,2022,50(7):165-171.
[16] YU H, YANG G Q, SATO M, et al.Antioxidant activities of aqueous extract from Stevia rebaudiana stem waste to inhibit fish oil oxidation and identification of its phenolic compounds[J].Food Chemistry, 2017, 232, 379-386.
[17] 于慧,王锡昌,奚印慈.甜叶菊废弃物制得生物制剂的抗氧化活性研究[J].食品科学,2008, 29(8):65-69.
YU H, WANG X C, XI Y C.Study on antioxidant activity of biological preparation from Stevia rebaudiana waste[J].Food Science,2008, 29(8):65-69.
[18] 李丹,任晓静, 陈婷,等.维科天然生物制剂对干酪乳杆菌生长影响的初探[J].食品工业科技,2016,37(7):148-152;158.
LI D, REN X J, CHEN T, et al.Effect of WIC natural biologics on the growth of Lactobacillus casei[J].Science and Technology of Food Industry,2016,37(7):148-152;158.
[19] 任晓静,奚印慈,洪怡蓝,等.甜叶菊提取物抑菌作用的研究[J].食品工业科技,2014,35(14):174-177.
REN X J, XI Y C, HONG Y L, et al.Study on antibacterial effect of extraction from Stevia rebaudiana[J].Science and Technology of Food Industry, 2014,35(14):174-177.
[20] 张金山,刘艳,张立会,等.人参提取物及皂苷类成分对2型糖尿病作用机制的研究进展[J/OL].中药药理与临床, 2022.DOI:10.13412/j.cnki.zyyl.20220506.002.
ZHANG J S, LIU Y, ZHANG L H, et al.Research progress on the mechanism of action of ginseng extracts and saponins on type 2 diabetes mellitus[J/OL].Chinese Medicine Pharmacology and Clinical, 2022.DOI:10.13412/j.cnki.zyyl.20220506.002.
[21] 赵士博,吴忠港,郑淮远,等.松黄和野菊花及其联合应用对小鼠血糖及血脂的影响[J].中国老年学杂志,2022,42(8):1 950-1 952.
ZHAO S B, WU Z G, ZHENG H Y, et al.Effects of pine huang and wild chrysanthemum and their combined application on blood sugar and blood lipids in mice[J].Chinese Journal of Gerontology,2022,42(8):1 950-1 952.
[22] FAJRANI A M, SULCHAN M, MUIS S F, et al.Effect of black garlic on visceral fat, oxidative stress and insulin resistance in nonalcoholic fatty liver disease rats[J].Nutrition &Amp;Food Science,2021.DOI:10.1108/NFS-11-2020-0439.
[23] ASCHBACHER K, KORNFELD S, PICARD M, et al.Chronic stress increases vulnerability to diet-related abdominal fat, oxidative stress, and metabolic risk[J].Psychoneuroendocrinology,2014,46:14-22.
[24] 胡元利,谭晓梅,张文新.黄连总生物碱与盐酸小檗碱对小鼠溃疡性结肠炎治疗作用的比较[J].中药药理与临床,2011, 27(5):45-48.
HU Y L, TAN X M, ZHANG W X.Comparison of total alkaloids from Coptis Root and berberine for ulcerative colitis treatment[J].Pharmacology and Clinics of Chinese Materia Medica, 2011,27(5):45-48.
[25] LUISI M L E, LUCARINI L, BIFFI B, et al.Effect of Mediterranean diet enriched in high quality extra virgin olive oil on oxidative stress, inflammation and gut microbiota in obese and normal weight adult subjects[J].Frontiers in Pharmacology,2019,10:1366.
[26] ZONG L, LI H Y, LI S H.Effects of neoadjuvant chemotherapy combined with enteral nutrition on perioperative immunity, inflammation and intestinal flora in gastric cancer patients[J].Journal of the Balkan Union of Oncology,2019,24(3):1 113-1 119.
[27] COLLINS K H, PAUL H A, HART D A, et al.A high-fat high-sucrose diet rapidly alters muscle integrity, inflammation and gut microbiota in male rats[J].Scientific Reports,2016,6:37278.
[28] MELHEM, H, HANSMANNEL, F, BRESSENOT, A et al.Methyl-deficient diet promotes colitis and SIRT1-mediated endoplasmic reticulum stress[J].Gut, 2016, 65(4):595-606.
[29] VANDEPUTTE, D, FALONY, G, VIEIRA-SILVA, S, et al.Stool consistency is strongly associated with gut microbiota richness and composition, enterotypes and bacterial growth rates[J].Gut, 2016, 65(1):57-62.