乳酸菌胞外多糖(exopolysaccharide,EPS)是乳酸菌在生长代谢过程中分泌到细胞壁外环境中或结合在菌体表面的一类糖类化合物[1]。乳酸菌产生的EPS能够改变发酵产品的外观、流变特性、质地和口感,因此它们可作为增黏剂、稳定剂、乳化剂或胶凝剂运用到食品工业中,其还可作为生物絮凝剂、生物吸收剂、离子交换树脂和重金属去除剂用于化妆品、制药行业和环境保护[2-3]。由于乳酸菌生产的生物聚合物不会对健康造成危害,通常被认为是安全的[4]。越来越多的研究表明乳酸菌EPS在改善人类健康中具有多种功能作用,包括免疫调节、抗癌、抗氧化、抗溃疡、预防病原菌的生物被膜黏附、降血糖、降胆固醇和抗高血压等[5-8]。
航天诱变技术是利用搭载卫星、火箭等返回式航天器将菌株搭载到宇宙空间中,使其在太空因子的作用下,如强辐射、微重力、高真空、交变磁场、超净环境等来改变菌株自身的基因,使得菌株的遗传性状发生改变,从而获得有益突变,再对其进行深入研究,进行新产品的开发利用[9]。近年来,我国利用航天诱变技术对微生物进行诱变,得到了许多性状优良的菌株。因此,利用航天诱变技术获得菌株新特性具备较高的可行性[10-11]。
前期实验中通过航天诱变筛选出一株具有较好活性的肠膜明串珠菌L21-49,基于此,本研究首先采用离子交换层析和分子筛层析对其产生的EPS进行分离纯化,然后采用凝胶渗透色谱、红外光谱、液相色谱对纯化后EPS组分进行结构解析,并分析多糖对2种常见病原菌的抗生物被膜活性、体外抗氧化活性、对α-葡萄糖苷酶和α-淀粉酶的抑制活性。研究结果为扩大乳酸菌的综合利用,以及使其EPS成为一种多功能活性物质提供参考。
1 材料与方法
1.1 材料与仪器
肠膜明串珠菌L21-49由本实验从经航天诱变的肠膜明串珠菌L16的诱变菌株中分离、纯化并经16S rRNA鉴定,保藏于-80 ℃冰箱。
胰蛋白胨、大豆蛋白胨、牛肉浸膏、酵母粉,广东环凯微生物科技有限公司;DEAE-Sepharose Fast Flow、Sepharose CL-6B、透析袋、Tris,北京索莱宝科技有限公司;三氯乙酸,天津市福晨化学试剂有限公司;DPPH试剂、ABTS试剂,美国sigma公司;黄嘌呤氧化酶,上海阿拉丁生化科技股份有限公司;4-硝基苯基-β-D-吡喃葡萄糖醛酸(p-Nitrophenyl β-D-Glucuronide,pNPG),深圳文乐生物科技公司;α-淀粉酶、α-葡萄糖苷酶,上海吉至生化科技有限公司;其他试剂均为分析纯。
YXQ-LS-50A 全自动高压灭菌锅,上海博迅实业有限公司医疗设备厂;Scientz-12 N 冷冻干燥机,宁波新芝生物科技股份有限公司;PL602-S电子分析天平,瑞士梅特勒-托利多公司;PHS-25 pH计,上海仪电科学仪器股份有限公司;1285生物安全柜,美国Thermo Electron公司;VersaMax 光栅型酶标仪,美国Melecular Devices公司;Evolution 300 紫外可见分光光度计、Nicolet IS 50/6700傅里叶变换红外光谱仪,美国ThermoFIsher Scientific公司;LC-20AD 高效液相色谱仪,日本岛津公司;R1001-VN 旋转蒸发仪,郑州长城科工贸有限公司;150A恒温培养箱,江苏省金坛市荣华仪器制造有限公司;Agilent1260 凝胶渗透色谱,美国Agilent公司。
1.2 实验方法
1.2.1 主要培养基和溶液的配制
MRS培养基(g/L):胰蛋白胨10.0,牛肉膏5.0,酵母粉4.0,葡萄糖20.0,吐温80 1.0 mL,磷酸氢二钾1.52,乙酸钠3.53,柠檬酸三铵2.0,硫酸镁0.2,硫酸锰0.03,pH 6.0。121 ℃ 灭菌20 min。
LB 培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,pH 7.0。121 ℃灭菌20 min。
0.1 mol/L PBS溶液(pH=6.86):A液(0.2 mol/L Na2HPO4):称取71.6 g Na2HPO4·12H2O溶于1 L水中;B液(0.2 mol/L NaH2PO4):称取31.2 g NaH2PO4·2H2O溶于1 L水中。取49 mL A液和51 mL B液混合配成pH=7.4的缓冲液,取500 mL加超纯水稀释至1 000 mL。
ABTS阳离子工作液:7.4 mmol/L ABTS与等体积2.6 mmo/L K2S2O8混合后于黑暗条件下静置12 h,使用前用pH 7.4的PBS稀释,使其OD734nm值为0.7±0.2。
α-淀粉酶溶液、α-葡萄糖苷酶溶液:使用PBS缓冲盐溶液将α-淀粉酶溶液、α-葡萄糖苷酶溶液分别配制成1 U/mL后避光保存于-20 ℃,使用前放置于40 ℃水浴锅中预热30 min。
1.2.2 肠膜明串珠菌EPS的分离纯化
1.2.2.1 EPS的提取
参考卢承蓉等[12]的方法并略作修改。将肠膜明串珠菌L21-49按3%接种量接种于MRS培养基中,在37 ℃恒温静置培养24 h,连续活化3次后,4 ℃、10 000 r/min离心10 min,弃菌体沉淀,取上清液加入80%(质量分数)三氯乙酸溶液,使溶液中三氯乙酸终质量浓度为4 g/L,在4 ℃冰箱中静置6~8 h后,4 ℃、10 000 r/min离心15 min,弃去蛋白质沉淀,取上清液加入自身3倍体积的95%(体积分数)乙醇,在4 ℃冰箱中静置12~15 h后4 ℃、10 000 r/min离心15 min即得多糖沉淀。多糖加入去离子水溶解后移至透析袋(截留分子质量8 000~14 000 Da)中,用去离子水透析3 h后换水,之后每隔8 h换一次水,持续2 d,收集透析液,真空冷冻干燥,即得到粗多糖。
1.2.2.2 DEAE-Sepharose Fast Flow离子交换层析
参考李尧等[13]的方法并略作修改。用55 mmol/L Tris-HCl溶液(pH 7.5~7.8)以1 mL/min平衡DEAE-Sepharose Fast Flow阴离子交换层析柱(2.6 cm×58 cm),平衡3个柱体积,200 mg粗多糖溶于4 mL Tris-HCl溶液中,0.22 μm滤头过滤后上样。以Tris-HCl和含有0.1、0.3、0.5、0.7 mol/L NaCl的Tris-HCl溶液进行梯度洗脱,流速为1 mL/min,每8 min收集一管洗脱液,每管采用苯酚-硫酸法[14]检测多糖含量,测定其OD490nm值。以管数为横坐标,OD490nm值为纵坐标,作洗脱曲线。根据洗脱曲线收集主峰,减压旋转蒸发浓缩,超纯水透析2 d,真空冷冻干燥。
1.2.2.3 Sepharose CL-6B 分子筛层析
Tris-HCl溶液以1 mL/min平衡Sepharose CL-6B层析柱(2.6 cm×60 cm),平衡3个柱体积,取经阴离子交换柱层析后的多糖样品100 mg溶于2 mL Tris-HCl中,0.22 μm滤头过滤后上样。以Tris-HCl溶液进行洗脱,流速为1 mL/min,每8 min收集一管洗脱液,每管采用苯酚-硫酸法检测多糖含量,测定其OD490nm值。以管数为横坐标,OD490nm值为纵坐标,作洗脱曲线。根据洗脱曲线收集主峰,减压旋转蒸发浓缩,超纯水透析2 d,真空冷冻干燥,即得到纯化EPS。
1.2.3 肠膜明串珠菌EPS纯化组分的基本组成分析
1.2.3.1 紫外光谱分析
通过紫外分光光度计将1.00 mg/mL纯化EPS溶液进行200~800 nm全波段扫描,检测纯化EPS在260、280 nm和400~700 nm处是否含有核酸、蛋白质和色素的特征吸收峰。
1.2.3.2 总糖、蛋白质、硫酸根、糖醛酸含量测定
采用硫酸-苯酚法,通过绘制葡萄糖标准曲线测定纯化EPS的总糖含量;使用索莱宝蛋白质含量试剂盒,通过绘制蛋白质含量标准曲线测定纯化EPS的蛋白质含量;采用氯化钡-明胶比浊法,通过绘制硫酸根含量标准曲线测定纯化EPS的硫酸根含量[15];采用硫酸-咔唑法,通过绘制糖醛酸含量标准曲线测定纯化EPS的糖醛酸含量[16]。
1.2.4 肠膜明串珠菌EPS纯化组分的结构分析
1.2.4.1 相对分子质量测定
采用水相凝胶渗透色谱(gel permeation chromatography,GPC)测定纯化后EPS的分子质量。用超纯水配制质量浓度为1.00 mg/mL的样品溶液,0.22 μm 滤膜过滤后进行GPC检测。采用不同相对分子质量的标准葡聚糖制作标准曲线,通过Breeze软件进行数据分析,确定其平均分子质量。
GPC色谱条件:采用Waters 2414示差折光检测器;PL aquqgel-OH MIXED 8 μm(250 mm×4.6 mm)色谱柱,0.2 mol/L NaNO3和0.01 mol/L NaH2PO4(pH 7.0)为流动相,柱温30 ℃,进样量40 μL,流速1 mL/min进行洗脱。
1.2.4.2 红外光谱测定
取干燥至恒重的纯化EPS与干燥的KBr以质量比1∶50研磨、压片,利用傅里叶红外光谱仪在4 000~400 cm-1进行扫描。
1.2.4.3 单糖组成分析
精密称取甘露糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,N-乙酰-氨基葡萄糖,葡萄糖,N-乙酰-氨基半乳糖,半乳糖,木糖,阿拉伯糖,岩藻糖对照品适量,加水溶解稀释至每1 mL中各含50 μg的混合对照溶液。另取约3.0 mg纯化多糖、3.0 mL 2 mol/L三氟乙酸于10 mL安瓿瓶中,封管,120 ℃酸解4 h,取出加入甲醇,氮吹挥干三氟乙酸,加3.0 mL水复溶。精确吸取250 μL混合对照溶液和水解后的纯化EPS溶液至5 mL EP管中,加入250 μL 0.6 mol/L NaOH,500 μL 0.4 mol/L 1-苯基-3-甲基-5-吡唑啉酮(溶于甲醇),70 ℃反应1 h。冷水中冷却10 min;加入500 μL 0.3 mol/L HCl中和,再加入1 mL氯仿涡旋1 min,3 000 r/min离心10 min,小心取上清液,萃取3次后采用高效液相色谱仪分析。
分析条件:采用Xtimate C18 (4.6 mm×200 mm)5 μm色谱柱,以V(0.05 mol/L K2HPO4)∶V(乙腈)=83∶17为流动相,柱温30 ℃,进样量20 μL,检测波长250 nm,流速1.0 mL/min进行洗脱。
1.2.5 肠膜明串珠菌EPS纯化组分的功能活性测定
1.2.5.1 抗致病菌生物被膜活性的测定
参考WANG等[17]的方法稍作修改。将金黄色葡萄球菌、单增李斯特菌以2%的接种量接种至LB培养基中,37 ℃、150 r/min活化两代后,用新鲜LB培养基稀释至106 CFU/mL,取100 μL稀释后的菌液加入到96 孔板中,另取 0.5、1、2、4、8 mg/mL 100 μL纯化EPS加入96孔板中,37 ℃恒温静置培养24 h,用无菌水作为对照。采用结晶紫染色法测定纯化EPS对致病菌生物被膜形成的抑制率[18]。
1.2.5.2 抗氧化活性的测定
参考李尧等[13]的方法测定纯化EPS对DPPH自由基、羟自由基(·OH)、ABTS阳离子自由基和超氧阴离子自由基(·O2-)清除能力;参考WANG等[19]的方法测定纯化EPS的总还原能力。
1.2.5.3 对α-葡萄糖苷酶和α-淀粉酶抑制活性的测定
参考WANG等[20]的方法测定纯化EPS对α-葡萄糖苷酶和α-淀粉酶的抑制活性。
1.3 数据分析
试验涉及的数据均重复3次或3次以上,采用IBM SPSS Statistics 25对数据进行统计分析,以P<0.05表示数据具有统计学差异,采用GraphPad Prism 8作图。
2 结果与分析
2.1 EPS的分离纯化
乳酸菌EPS粗提物中通常含有带不同电荷、不同分子质量的EPS,以及一些小分子杂质,为混合物,需要对其进一步分离纯化。DEAE-Sepharose Fast Flow属于阴离子交换剂,分辨率高,适用于大剂量样品分离出中性、酸性多糖[21]。如图1所示,L21-49的EPS粗提物经不同浓度的Tris-NaCl(0~0.7 mol/L)洗脱后共得到EPS-A、EPS-B、EPS-C和EPS-D 4个多糖组分,将其对应管数收集,透析、冷冻干燥之后称重,得率分别为21.15%、14.00%、10.28%和3.68%。其中用Tris-HCl洗脱可以得到EPS-A,为中性多糖;用不同浓度的Tris-NaCl洗脱可以得到EPS-B、EPS-C和EPS-D,这3种多糖组分都带有电荷,为酸性多糖。由于EPS-D得率太低,后续主要研究EPS-A、EPS-B和EPS-C。
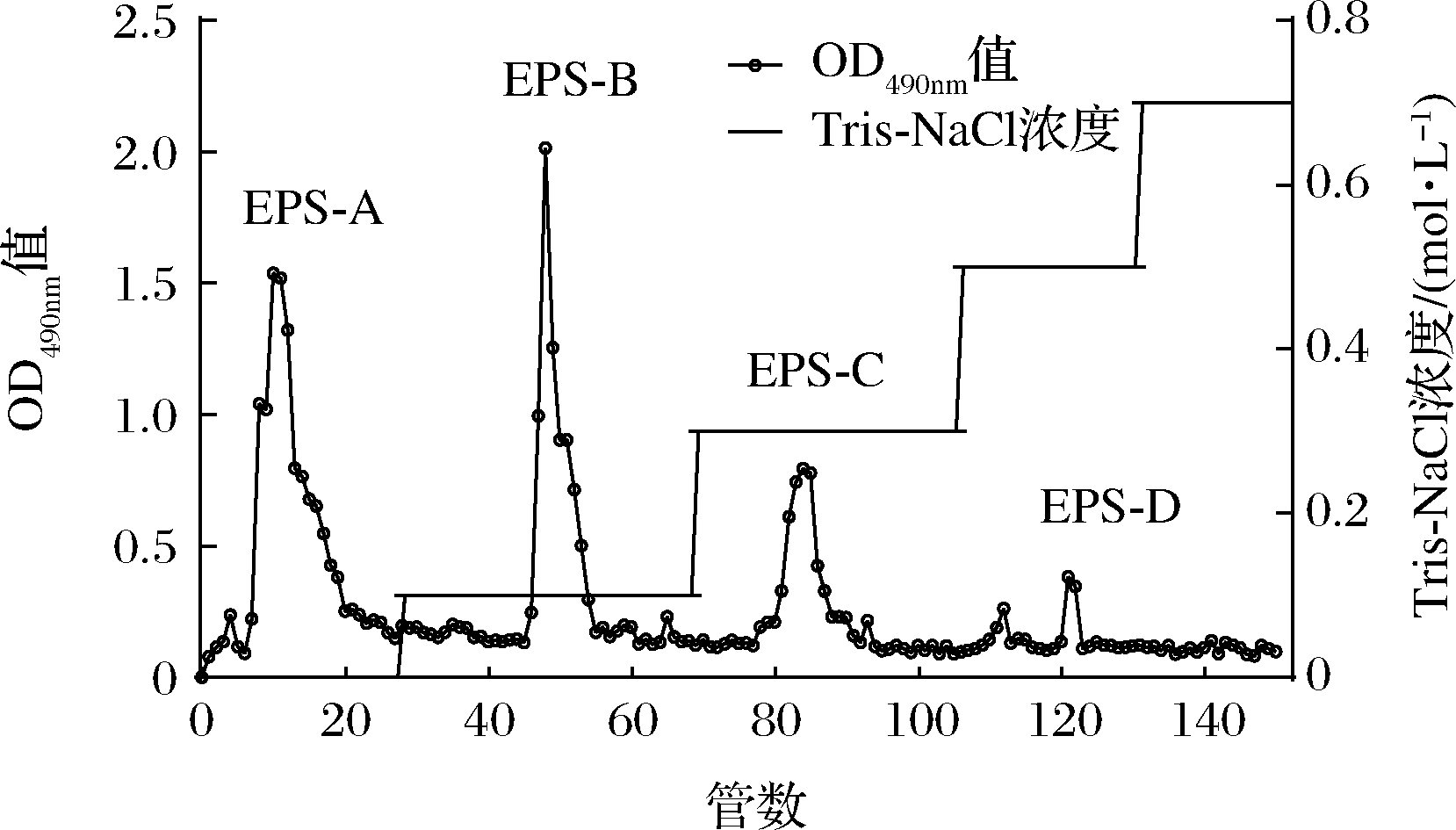
图1 L21-49的EPS粗提物的DEAE-Sepharose Fast Flow离子交换层析
Fig.1 The DEAE-Sepharose Fast Flow ion exchange chromatogram of the crude EPS of L21-49
经离子交换层析纯化后获得不带电荷和带电荷性质相近的EPS组分,由于其分子质量大小可能不同,因此还需通过Sepharose CL-6B分子筛进一步分离纯化。Sepharose CL-6B具有化学稳定性高、重复性好、流速快等优势。如图2所示,用Tris-HCl对L21-49的3种纯化组分进行洗脱,3种组分的洗脱曲线都能得到比较对称的单一峰,表明这3种纯化EPS组分为分子质量大小均一的单一组分。将EPS-A、EPS-B和EPS-C对应管数收集,透析、冷冻干燥之后称重,得率分别为57.20%、54.79%和59.20%。

a-EPS-A;b-EPS-B;c-EPS-C
图2 EPS-A、EPS-B、EPS-C的Sepharose CL-6B分子筛层析
Fig.2 The Sepharose CL-6B exclusion chromatography for EPS-A, EPS-B, and EPS-C
2.2 EPS纯化组分的基本组成分析
2.2.1 紫外光谱分析
使用紫外可见分光光度计对不同的EPS样品进行紫外-可见(200~800 nm)全波长扫描,吸收光谱如图3所示。各纯化组分在260 nm处没有吸收峰;EPS-A和EPS-B在280 nm处无吸收峰,而EPS-C在280 nm处出现了微弱吸收峰,可能其含有少量的蛋白质,为糖-蛋白体系。各组分在可见光波长都没有出现吸收峰,表明都不含有色素。综上所述EPS-A、EPS-B和EPS-C基本不含有核酸、蛋白质和色素,分离效果好,较为纯净。

a-EPS粗提物;b-EPS-A;c-EPS-B;d-EPS-C
图3 EPS粗提物和各纯化EPS的紫外-可见吸收光谱
Fig.3 The UV-Vis spectra of the crude EPS and the purified EPSs
2.2.2 总糖、蛋白质、硫酸根、糖醛酸含量
通过实验获得葡萄糖含量标准曲线方程为Y=0.006 9X+0.084 5(R2=0.999),蛋白质含量标准曲线方程为Y=1.669 0X+0.593 2(R2=0.990),硫酸根含量标准曲线方程为Y=0.187 4X+0.084 9(R2=0.993),糖醛酸含量标准曲线方程为Y=5.667 0X+0.158 8(R2=0.990)。纯化EPS的总糖、蛋白质、硫酸根、糖醛酸含量如表1所示。本研究中L21-49的纯化EPS的总糖含量高于粗多糖,但硫酸根和糖醛酸含量却比粗多糖低。EPS-A和EPS-B的硫酸根及糖醛酸含量都低于EPS-C,与周佳敏[22]分离纯化的一株鼠李糖乳杆菌结果类似,由此可见酸性多糖不同带电量应该与硫酸根、糖醛酸含量以及其所处环境等有关。
表1 L21-49 的EPS的基本组成 单位:%
Table 1 The contents of the basic components of L21-49 EPS
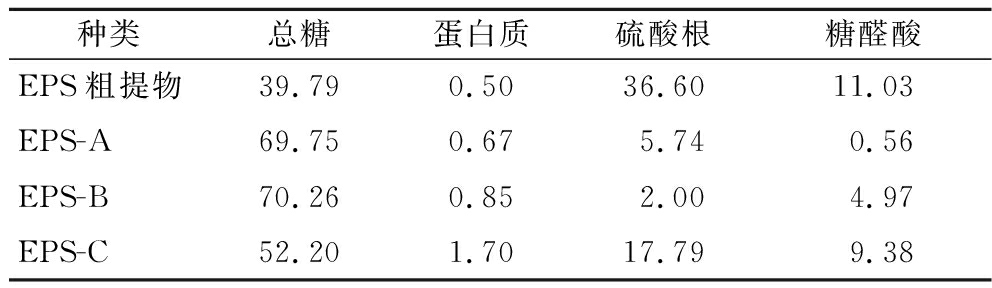
种类总糖蛋白质硫酸根糖醛酸EPS粗提物39.790.5036.6011.03EPS-A69.750.675.740.56EPS-B70.260.852.004.97EPS-C52.201.7017.799.38
2.3 EPS纯化组分的结构分析
2.3.1 相对分子质量测定
纯化EPS相对分子质量的GPC色谱图如图4所示,3种纯化EPS经 GPC 洗脱后第1个峰峰形尖锐对称,表明得到的EPS较为纯净,分子质量均一。利用Brezze软件分析3种纯化EPS的分子特征,如表2所示。
表2 纯化EPS的分子特征
Table 2 The molecular characteristics of the purified EPSs
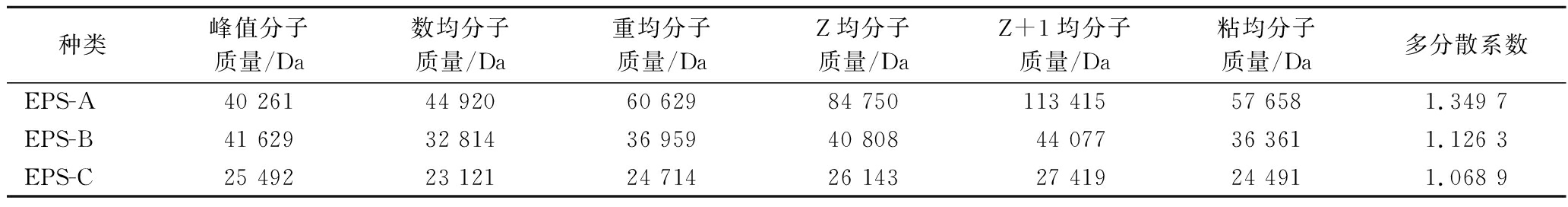
种类峰值分子质量/Da数均分子质量/Da重均分子质量/DaZ均分子质量/DaZ+1均分子质量/Da粘均分子质量/Da多分散系数EPS-A40 26144 92060 62984 750113 41557 6581.349 7EPS-B41 62932 81436 95940 80844 07736 3611.126 3EPS-C25 49223 12124 71426 14327 41924 4911.068 9

a-EPS-A;b-EPS-B;c-EPS-C
图4 EPS-A、EPS-B、EPS-C的GPC图谱
Fig.4 The gel permeation chromatograms of EPS-A, EPS-B, and EPS-C
当多分散性系数(polymer dispersity index,PDI,Mz/Mw)小于3时,表明分子质量分布范围较为均一[23],也有研究表明,PDI作为衡量EPS 分子质量分布宽度的指标,对EPS功能性质具有显著影响[24]。EPS的分子质量在很大程度上影响其理化、生理甚至生物学性质。EPS一些生物活性如抗菌和降低胆固醇与分子质量呈正相关,有研究表明高分子质量EPS对革兰氏阳性菌的抗菌作用比低分子质量EPS更强[25]。但EPS分子质量与免疫调节和抗肿瘤活性之间是否存在关系尚没有确定的结论[19]。
2.3.2 红外光谱测定
红外光谱是一种有价值的技术,可用于提供有关结构和官能团的信息,3种纯化EPS的红外光谱扫描图如图5所示,均具有多糖的特征吸收峰。红外光谱在3 326 cm-1(EPS-A)、3 320 cm-1(EPS-B)、3 300 cm-1(EPS-C)附近具有强宽带吸收峰,在2 930 cm-1(EPS-A)、2 931 cm-1(EPS-B)、2 931 cm-1(EPS-C)处具有弱吸收峰,这两处分别归因于O—H和C—H的伸缩振动;1 647 cm-1(EPS-A)和1 644 cm-1(EPS-B)处为C![]() O键不对称伸缩振动引起的吸收峰;1 368 cm-1(EPS-A)、1 370 cm-1(EPS-B)、1 367 cm-1(EPS-C)处的峰可能是因为C
O键不对称伸缩振动引起的吸收峰;1 368 cm-1(EPS-A)、1 370 cm-1(EPS-B)、1 367 cm-1(EPS-C)处的峰可能是因为C![]() O的拉伸;3种纯化EPS在1 240~1 020 cm-1都存在两个吸收峰,即为吡喃糖环的特征吸收峰,其对应于吡喃糖骨架C—H—O和C—O—C之间的伸缩振动;同时3种纯化EPS在815 cm-1附近都有吸收峰,表示含有甘露糖残基;EPS-C在1 207 cm-1附近的小吸收峰可能是由于S
O的拉伸;3种纯化EPS在1 240~1 020 cm-1都存在两个吸收峰,即为吡喃糖环的特征吸收峰,其对应于吡喃糖骨架C—H—O和C—O—C之间的伸缩振动;同时3种纯化EPS在815 cm-1附近都有吸收峰,表示含有甘露糖残基;EPS-C在1 207 cm-1附近的小吸收峰可能是由于S![]() O 不对称伸缩振动,这表明EPS-C中存在硫酸盐基团[13, 26-28]。
O 不对称伸缩振动,这表明EPS-C中存在硫酸盐基团[13, 26-28]。
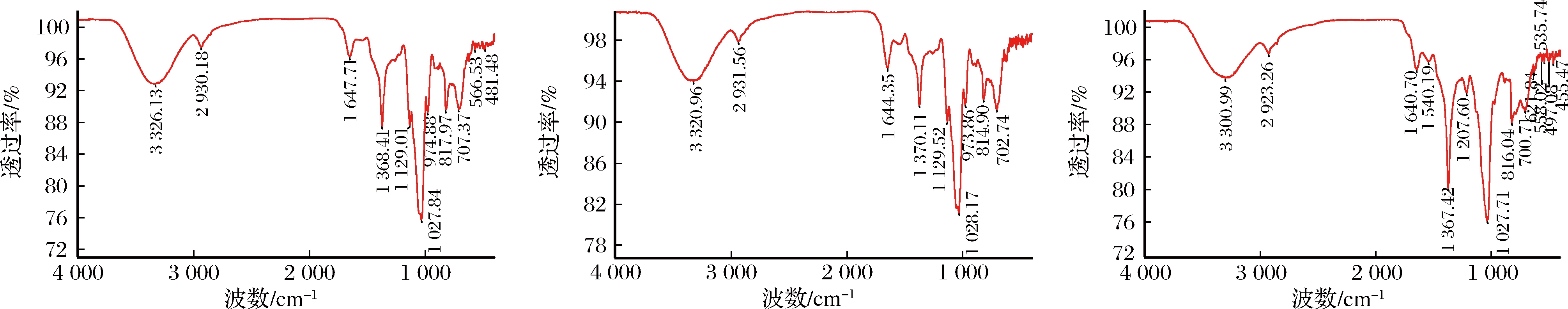
a-EPS-A;b-EPS-B;c-EPS-C
图5 EPS-A、EPS-B、EPS-C的红外光谱图
Fig.5 The infrared spectra of EPS-A, EPS-B, and EPS-C
EPS的分子骨架,从连接方式(α/β和1→3、4、6)到成分组成(异构体和官能团)都可以显著影响它们的物理化学和生物学特性[29]。(1→4)主链连接方式赋予比(1→2)和(1→3)更大的刚度,因此在EPS抗氧化活性中可以通过这种刚性结构将大量半缩醛羟基暴露于环境自由基分子中[30]。羧基这种官能团可以发挥协同作用,一方面它们可以提供更多的孤对电子以加强分子间氢键相互作用,从而显示出高黏度、抗菌和降胆固醇活性,另一方面,这些负基团可以为EPS创造酸性环境,以促进其水解以暴露更多的半缩醛羟基,从而显示出优异的抗氧化活性[31]。
2.3.3 单糖组成分析
如表3所示,3种多糖均含有甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖,但组成的比例不同。EPS-A主要含有甘露糖和葡萄糖,EPS-B主要含有甘露糖、半乳糖、葡萄糖和葡萄糖醛酸,EPS-C单糖组成较多,主要由葡萄糖、半乳糖、甘露糖、核糖、葡萄糖醛酸和岩藻糖组成。
表3 纯化EPS的单糖组成 单位:%
Table 3 The monosaccharide composition of the purified EPSs
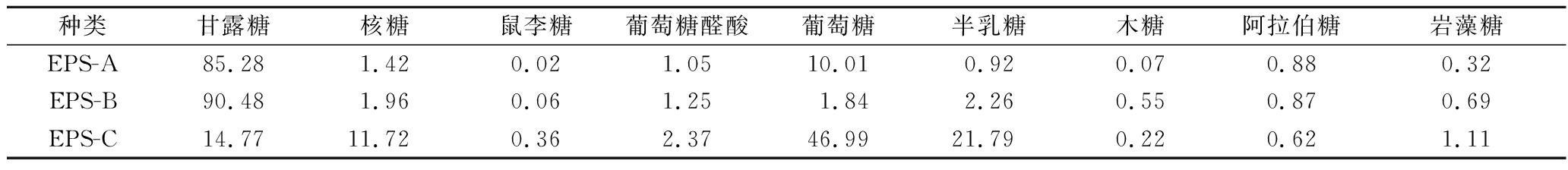
种类甘露糖核糖鼠李糖葡萄糖醛酸葡萄糖半乳糖木糖阿拉伯糖岩藻糖EPS-A85.281.420.021.0510.010.920.070.880.32EPS-B90.481.960.061.251.842.260.550.870.69EPS-C14.7711.720.362.3746.9921.790.220.621.11
2.4 EPS纯化组分的功能活性测定
2.4.1 抗致病菌生物被膜活性的测定
结果如图6所示,质量浓度为8.0 mg/mL时,EPS-A、EPS-B、EPS-C对金黄色葡萄球菌生物被膜的抑制率分别为51.58%、62.24%、47.33%;但是EPS-A、EPS-B、EPS-C对单增李斯特菌生物被膜的抑制率分别为34.57%、55.96%、30.58%。总体来看,3种纯化EPS都表现出一定的抑制活性,EPS-B对两种菌生物被膜的抑制效果始终优于EPS-A和EPS-C。KANMANI等[32]研究表明乳酸链球菌EPS可以抑制革兰氏阳性和革兰氏阴性细菌的生物被膜形成,其在1 mg/mL 时对单增李斯特菌和金黄色葡萄球菌生物被膜的抑制率超过67%。
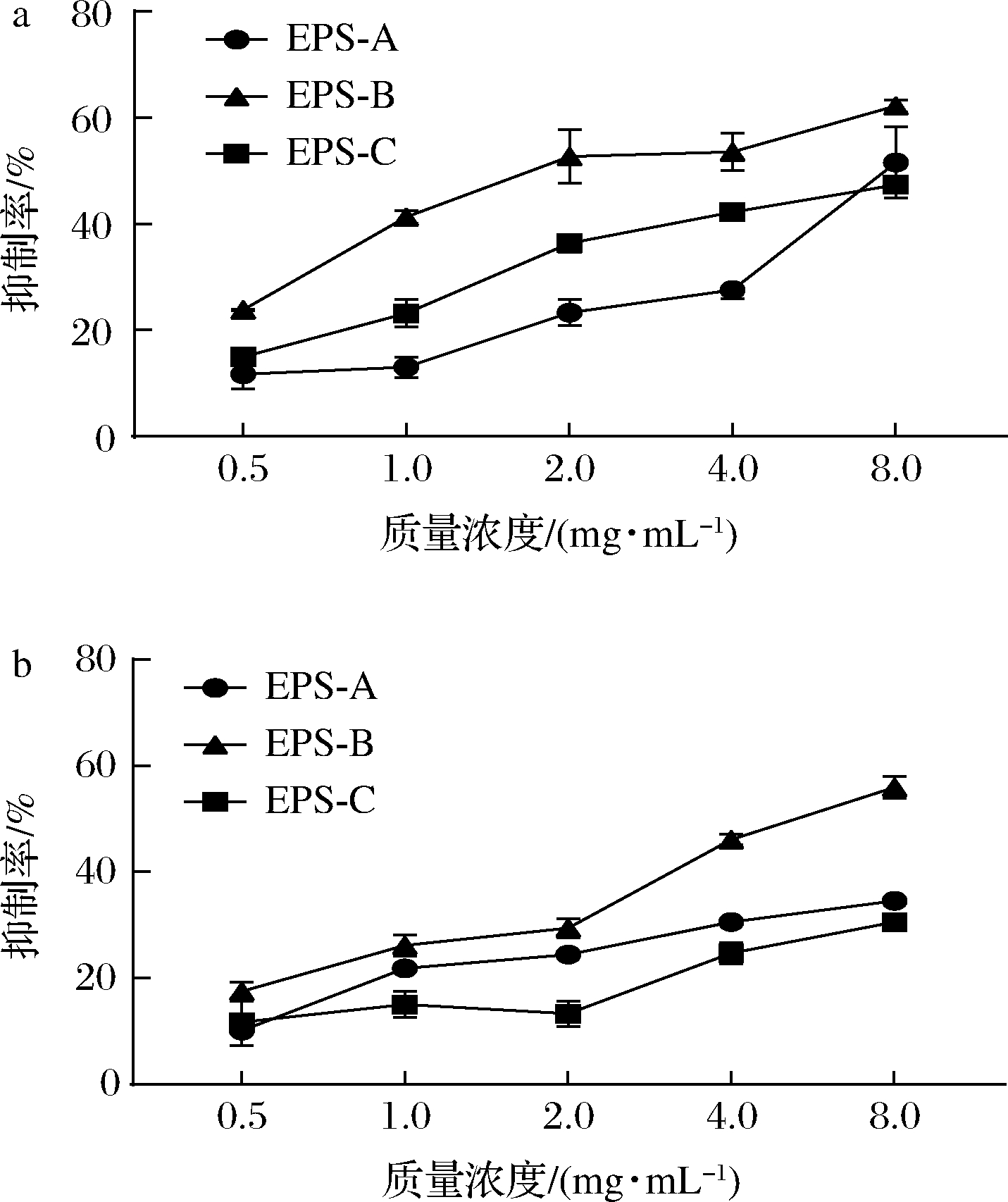
a-金黄色葡萄球菌;b-单增李斯特菌
图6 纯化EPS的抗致病菌生物被膜活性
Fig.6 The anti-biofilm activities of the purified EPSs
对于乳酸菌EPS抗致病菌生物被膜的研究相对较少,有研究显示添加EPS可以降低致病菌细胞表面疏水性、zeta电位和细胞间相互作用,从而抑制生物被膜的形成,然而具体的抑制机制尚未阐明[33]。在本研究中,L21-49的3种纯化EPS对于两种致病菌生物被膜抑制率均呈现EPS-B>EPS-A>EPS-C,生物被膜抑制活性的差异可能是由于不同EPS的电荷、分子质量和结构不同引起的,推测中等分子质量并带有少量电荷的EPS对生物被膜具有较好的抑制活性。BAI等[34]研究也表明乳酸菌EPS在质量浓度为4.00 mg/mL时对单增李斯特菌生物被膜也具有较好的抑制活性,且EPS可能对细菌细胞表面的修饰、初始细胞附着的抑制或下调参与生物被膜形成的基因表达具有潜在的影响。乳酸菌EPS抑制生物被膜的机制还需要更加深入的研究。
2.4.2 抗氧化活性的测定
分别考察不同纯化EPS组分对DPPH自由基、·OH、ABTS阳离子自由基和![]() 清除能力以及总还原能力,结果如图7所示。EPS-C对DPPH的清除率在8.0 mg/mL时可达(81.70±2.82)%,略低于发酵乳杆菌S1的EPS的清除率(83.05±1.65)%[35]。EPS-C对·OH的清除率随EPS浓度的增大而增大,在8.0 mg/mL时达到最大值(61.95±0.33)%,其清除率显著高于EPS-A和EPS-B;叶广彬等[36]研究表明假肠膜明串珠菌EPS质量浓度为5.0 mg/mL时,对·OH的清除率可达(78.24±3.52)%。EPS-A、EPS-B和EPS-C质量浓度在0.5~2.0 mg/mL时,各组分对ABTS阳离子自由基的清除能力较小且各组分差距不大,当质量浓度高于4.0 mg/mL时,EPS-B和EPS-C的清除率高于EPS-A,当质量浓度为8.0 mg/mL时EPS-C的效果显著高于EPS-B。3种组分对
清除能力以及总还原能力,结果如图7所示。EPS-C对DPPH的清除率在8.0 mg/mL时可达(81.70±2.82)%,略低于发酵乳杆菌S1的EPS的清除率(83.05±1.65)%[35]。EPS-C对·OH的清除率随EPS浓度的增大而增大,在8.0 mg/mL时达到最大值(61.95±0.33)%,其清除率显著高于EPS-A和EPS-B;叶广彬等[36]研究表明假肠膜明串珠菌EPS质量浓度为5.0 mg/mL时,对·OH的清除率可达(78.24±3.52)%。EPS-A、EPS-B和EPS-C质量浓度在0.5~2.0 mg/mL时,各组分对ABTS阳离子自由基的清除能力较小且各组分差距不大,当质量浓度高于4.0 mg/mL时,EPS-B和EPS-C的清除率高于EPS-A,当质量浓度为8.0 mg/mL时EPS-C的效果显著高于EPS-B。3种组分对![]() 的清除率在EPS质量浓度为0.5~8.0 mg/mL时未表现出浓度依赖性,在EPS质量浓度为8.00 mg/mL时,EPS-C的清除率达到49.48%。另外,3种纯化EPS总还原力EPS-C>EPS-B>EPS-A。
的清除率在EPS质量浓度为0.5~8.0 mg/mL时未表现出浓度依赖性,在EPS质量浓度为8.00 mg/mL时,EPS-C的清除率达到49.48%。另外,3种纯化EPS总还原力EPS-C>EPS-B>EPS-A。
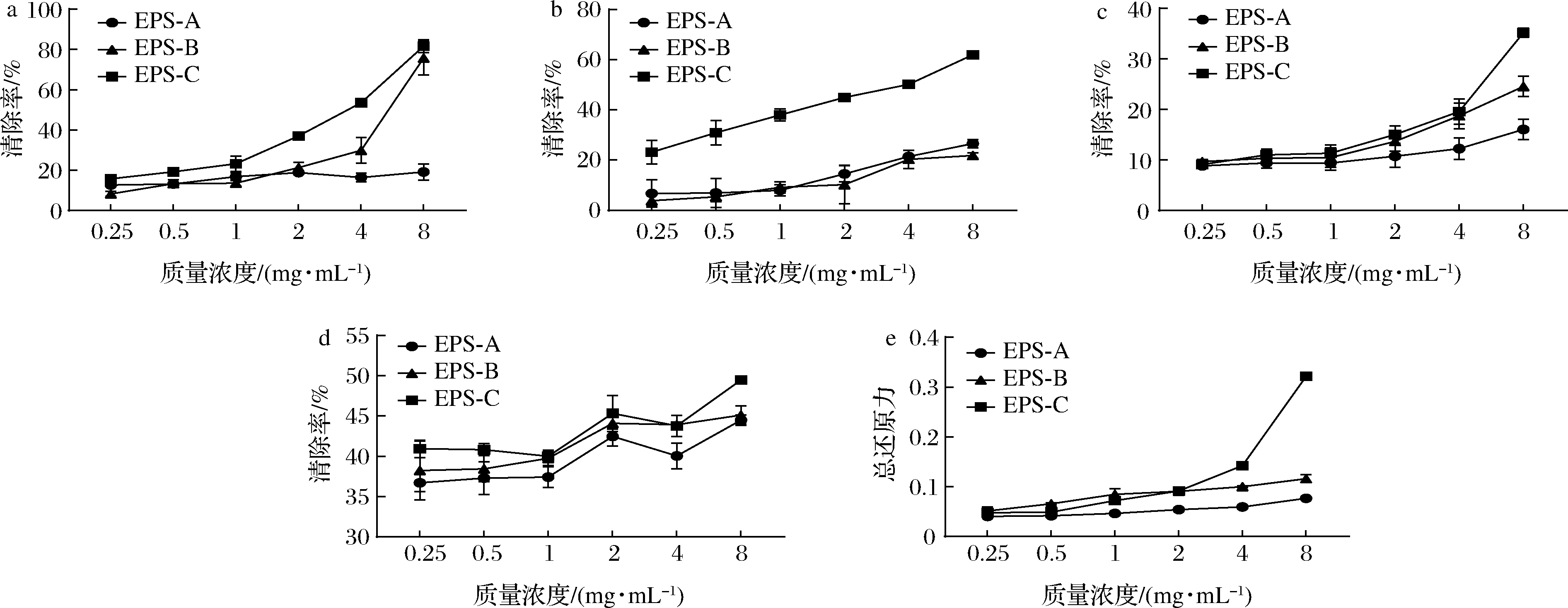
a-DPPH自由基;b-·OH;c-ABTS阳离子自由基;![]() 总还原力
总还原力
图7 纯化EPS的抗氧化活性
Fig.7 The antioxidant activities of the purified EPSs
EPS体外抗氧化的分子机制在于这些生物大分子在酸性环境中发生水解,产生大量活泼的半缩醛羟基,同时将电子传递给反应体系中的自由基,促进自由基向稳定物质的转化,最终降低自由基的浓度[31]。抗氧化性能与分子质量有很大关系,如前所述,这些聚合物的抗氧化活性取决于半缩醛羟基的数量,同时分子质量越低,在同等质量浓度下暴露的半缩醛羟基越多,因此,抗氧化活性随着分子质量的降低而提高。本研究中3种纯化EPS分子质量从高到低依次为EPS-A、EPS-B和EPS-C,根据糖醛酸含量和单糖组成分析结果,EPS-A基本不含葡萄糖醛酸,EPS-C的葡萄糖醛酸含量高于EPS-B,预测抗氧化活性EPS-C>EPS-B>EPS-A,从后续实验中也验证了这个结果,EPS-C的高抗氧化活性也有可能与其含有硫酸盐有关。
2.4.3 对α-淀粉酶和α-葡萄糖苷酶抑制活性的测定
抑制α-淀粉酶和α-葡萄糖苷酶的活性,可以降低食物在肠道内水解成葡萄糖的速度,从而降低血液中的葡萄糖含量[37]。如图8所示,L21-49的3种纯化EPS在0.5~1.0 mg/mL时对α-淀粉酶发挥浓度依赖性抑制作用,其对α-淀粉酶的最大抑制率分别为25.60%、27.55%、17.78%。WANG等[20]研究表明桦褐孔菌胞外多糖UIOPS-1I在0.2 mg/mL质量浓度下对α-淀粉酶的抑制率为37.96%。3种纯化EPS在0.5~8.0 mg/mL对α-葡萄糖苷酶发挥浓度依赖性抑制作用,最大抑制率分别为32.19%、20.41%、22.80%。
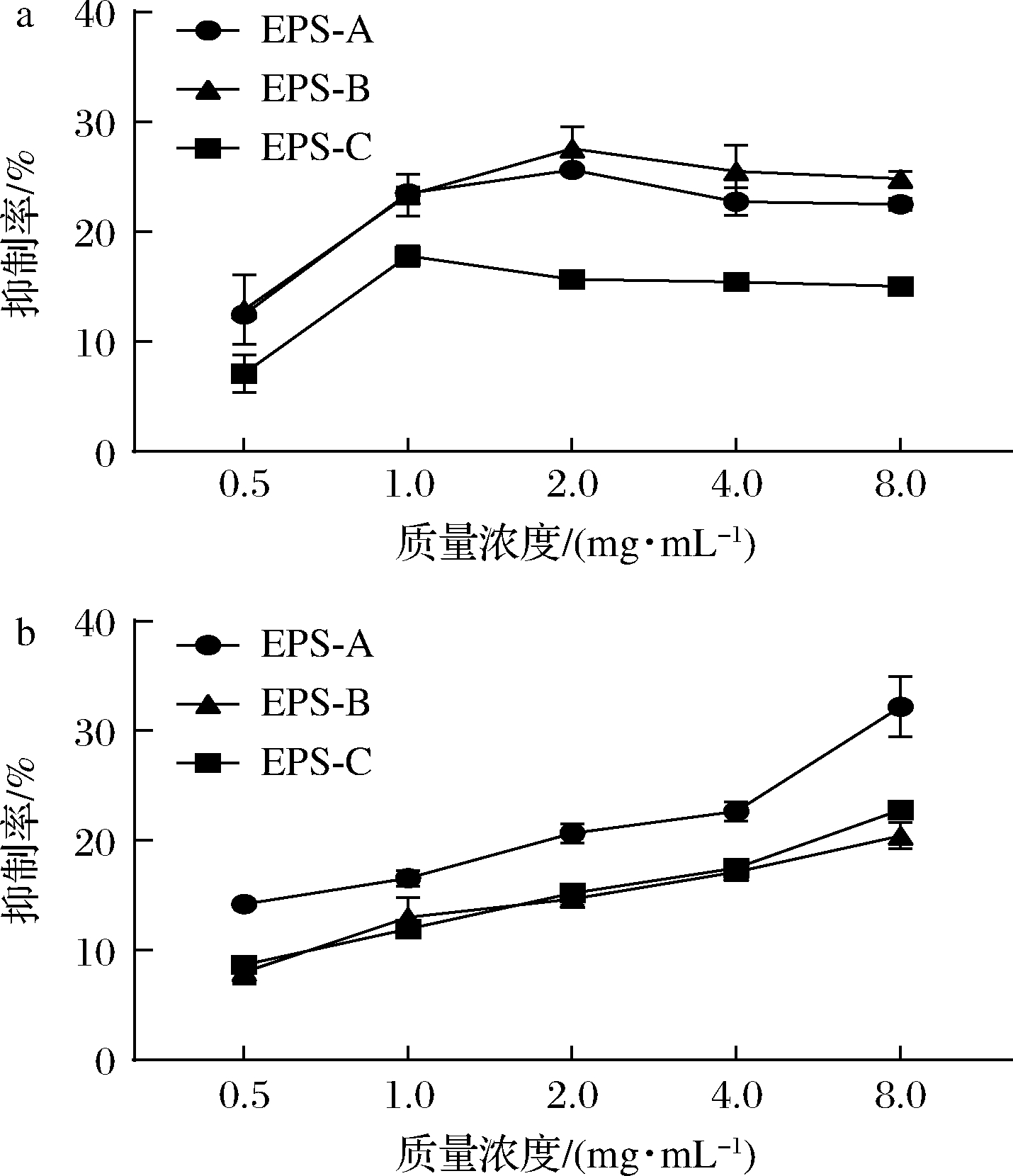
a-α-淀粉酶;b-α-葡萄糖苷酶
图8 纯化EPS对α-淀粉酶和α-葡萄糖苷酶的抑制活性
Fig.8 The inhibitory activities of the purified EPSs on α-amylase and α-glucosidase
EPS-A相较于EPS-B和EPS-C来说具有较高的抑制α-淀粉酶和α-葡萄糖苷酶的活性,且随着EPS浓度的增加,对α-淀粉酶的抑制率不再上升,说明EPS对α-淀粉酶的活性抑制作用有饱和效应,而对于α-葡萄糖苷酶也具有一定的浓度依赖性。JIANG等[37]通过α-淀粉酶和α-葡萄糖苷酶的抑制动力学研究发现,乳酸菌EPS对两种酶的抑制作用均为可逆的竞争性抑制。
3 结论
目前对EPS结构及其功能特性之间的机制的理解仍不清晰。因此,详细描述各种良好的乳酸菌EPS的化学结构对于探索其功能特性至关重要。本研究对航天诱变肠膜明串珠菌L21-49的EPS进行分离纯化,得到3个纯化组分EPS-A、EPS-B和EPS-C。研究表明EPS-A、EPS-B和EPS-C相对分子质量分别为60 629、36 959、24 714 Da。3种纯化多糖均含有甘露糖、核糖、葡萄糖醛酸、葡萄糖和半乳糖等单糖。此3种纯化EPS对金黄色葡萄球菌、单增李斯特菌生物被膜表现出较好的抑制活性,生物被膜抑制活性的差异可能是由于不同EPS的电荷、分子质量和结构不同引起的,推测中等分子质量并带有少量电荷的EPS对生物被膜具有较好的抑制活性。其次3种纯化EPS能有效清除DPPH自由基、·OH、ABTS阳离子自由基和![]() 具有良好的还原能力,抗氧化活性取决于半缩醛羟基的数量,推测糖醛酸和硫酸根含量高同时分子质量小的EPS具有较高的抗氧化活性。此外3种纯化EPS对α-淀粉酶和α-葡萄糖苷酶具有一定抑制作用,但对α-淀粉酶活性的抑制作用有饱和效应,对于α-葡萄糖苷酶作用具有一定的浓度依赖性,其中EPS-A抑制活性最高。本研究为肠膜明串珠菌EPS的研究和应用,以及深入探究EPS结构与其功能活性之间的关系提供了参考资料,但后续还需进一步探究EPS结构与其体内功能活性的关系。
具有良好的还原能力,抗氧化活性取决于半缩醛羟基的数量,推测糖醛酸和硫酸根含量高同时分子质量小的EPS具有较高的抗氧化活性。此外3种纯化EPS对α-淀粉酶和α-葡萄糖苷酶具有一定抑制作用,但对α-淀粉酶活性的抑制作用有饱和效应,对于α-葡萄糖苷酶作用具有一定的浓度依赖性,其中EPS-A抑制活性最高。本研究为肠膜明串珠菌EPS的研究和应用,以及深入探究EPS结构与其功能活性之间的关系提供了参考资料,但后续还需进一步探究EPS结构与其体内功能活性的关系。
[1] 张钊瑞, 张晨, 李大鹏.微生物多糖的结构与应用研究进展[J].食品研究与开发, 2021, 42(1):182-192.
ZHANG Z R, ZHANG C, LI D P.Advances in structure and application of microbial polysaccharides[J].Food Research and Development, 2021, 42(1):182-192.
[2] 彭家伟, 黄桂东, 黄伟志, 等.乳酸菌胞外多糖在食品工业中的应用[J].农产品加工, 2017(18):47-52.
PENG J W, HUANG G D, HUANG W Z, et al.Applications in food industry of exopolysaccharies produced by lactic acid bacteria[J].Farm Products Processing, 2017(18):47-52.
[3] 李洋. 肠膜明串珠菌SN-8胞外多糖分离纯化,结构鉴定及功能特性研究[D].沈阳:沈阳农业大学, 2020.
LI Y.Isolation, purification, structural identification and functional properties of extracellular polysaccharide from Leuconostoc mesenteroides SN-8[D].Shenyang:Shenyang Agricultural University, 2020.
[4] FENG J C, CAI Z L, CHEN Y Y, et al.Effects of an exopolysaccharide from Lactococcus lactis Z-2 on innate immune response, antioxidant activity, and disease resistance against Aeromonas hydrophila in Cyprinus carpio L[J].Fish and Shellfish Immunology, 2020, 98:324-333.
[5] CAGGIANIELLO G, KLEEREBEZEM M, SPANO G.Exopolysaccharides produced by lactic acid bacteria:From health-promoting benefits to stress tolerance mechanisms[J].Applied microbiology and biotechnology, 2016, 100(9):3 877-3 886.
[6] ABID Y, CASILLO A, GHARSALLAH H, et al.Production and structural characterization of exopolysaccharides from newly isolated probiotic lactic acid bacteria[J].International Journal of Biological Macromolecules, 2018, 108:719-728.
[7] ANGELIN J, KAVITHA M.Exopolysaccharides from probiotic bacteria and their health potential[J].International Journal of Biological Macromolecules, 2020, 162:853-865.
[8] OERLEMANS M M P, AKKERMAN R, FERRARI M, et al.Benefits of bacteria-derived exopolysaccharides on gastrointestinal microbiota, immunity and health[J].Journal of Functional Foods, 2021, 76:104289.
[9] 游勇飞, 岑建宁, 张积仁, 等.太空诱变对链球菌菌体多糖分子表达的影响[J].中国生物制品学杂志, 2009, 22(7):676-678.
YOU Y F, CEN J N, ZHANG J R, et al.Effect of outer space mutagenesis on expression of polysaccharide in Streptococcus[J].Chinese Journal of Biologicals, 2009, 22(7):676-678.
[10] 杨素晶, 蹇华丽, 魏锋, 等.航天诱变菌株JH-R23产虾青素培养条件优化[J].食品科技, 2021, 46(11):1-8.
YANG S J, JIAN H L, WEI F, et al.Optimization of culture conditions for astaxanthin production by space mutation strain JH-R23[J].Food Science and Technology, 2021, 46(11):1-8.
[11] 马丽, 魏海霞, 汪倩倩, 等.航天诱变毛霉ZY-3在腐乳生产中的应用研究[J].中国酿造, 2015, 34(4):62-65.
MA L, WEI H X, WANG Q Q, et al.Application of space mutation strain Mucor ZY-3 in sufu production[J].China Brewing, 2015, 34(4):62-65.
[12] 卢承蓉, 叶美芝, 上官文丹, 等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业, 2020, 46(12):14-20.
LU C R, YE M Z,SHANGGUAN W D, et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries, 2020, 46(12):14-20.
[13] 李尧, 卢承蓉, 刘丹, 等.乳酸片球菌胞外多糖的分离纯化、结构分析及抗氧化活性研究[J].食品与发酵工业, 2021, 47(19):35-42.
LI Y, LU C R, LIU D, et al.Structure and antioxidant activity of Pediococcus lactis extracellular polysaccharide[J].Food and Fermentation Industries, 2021, 47(19):35-42.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[15] 彭安安. 嗜酸硫氧化细菌元素硫活化氧化机制研究[D].长沙:中南大学, 2012.
PENG A A.Study on the sulfur activation and oxidation mechanism of acidophilic sulfur-oxidizing bacteria[D].Changsha:Central South University, 2012.
[16] BITTER T, MUIR H M.A modified uronic acid carbazole reaction[J].Analytical Biochemistry, 1962, 4(4):330-334.
[17] WANG D, ZHANG T H, YE H Q, et al.In vitro probiotic screening and evaluation of space-induced mutant Lactobacillus plantarum[J].Food Science &Nutrition, 2020, 8(11):6 031-6 036.
[18] 上官文丹, 陈可, 陈清莹, 等.戊糖乳杆菌DF9对副溶血弧菌群体感应的淬灭作用[J].食品工业科技, 2022, 43(6):126-132.
SHANGGUAN W D, CHEN K, CHEN Q Y, et al.Quenching effects of Lactobacillus pentosus DF9 on quorum sensing of Vibrio parahaemolyticus[J].Science and Technology of Food Industry, 2022, 43(6):126-132.
[19] WANG X, SHAO C G, LIU L, et al.Optimization, partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J].International Journal of Biological Macromolecules, 2017, 103:1 173-1 184.
[20] WANG C, LI W W, CHEN Z Q, et al.Effects of simulated gastrointestinal digestion in vitro on the chemical properties, antioxidant activity, α-amylase and α-glucosidase inhibitory activity of polysaccharides from Inonotus obliquus[J].Food Research International, 2018, 103:280-288.
[21] SUN N X, LIU H P, LIU S J, et al.Purification, preliminary structure and antitumor activity of exopolysaccharide produced by Streptococcus thermophilus CH9[J].Molecules, 2018, 23(11):2898.
[22] 周佳敏. 鼠李糖乳杆菌胞外多糖的纯化及降脂和调节肠道菌群活性研究[D].杭州:浙江工商大学, 2020.
ZHOU J M.Purification of exopolysaccharides of Lactobacillus rhamnosus and their hypolipidemic and intestinal flora-regulating activities[D].Hangzhou:Zhejiang Gongshang University, 2020.
[23] 陈海燕. 高产胞外多糖嗜热链球菌的筛选、培养条件的优化及多糖的结构分析[D].呼和浩特:内蒙古农业大学, 2020.
CHEN H Y.Screening of high exopolysacchrides-producing Streptococcus thermophilus, optimization of culture conditions and structural analysis of polysaccharides[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[24] ZHENG J Q, WANG J Z, SHI C W, et al.Characterization and antioxidant activity for exopolysaccharide from submerged culture of Boletus aereus[J].Process Biochemistry, 2014, 49(6):1 047-1 053.
[25] MAALEJ H, BOISSET C, HMIDET N, et al.Depolymerization of Pseudomonas stutzeri exopolysaccharide upon fermentation as a promising production process of antibacterial compounds[J].Food Chemistry, 2017, 227(15):22-32.
[26] LIN Y Y, ZENG H Y, WANG K, et al.Microwave-assisted aqueous two-phase extraction of diverse polysaccharides from Lentinus edodes:Process optimization, structure characterization and antioxidant activity[J].International Journal of Biological Macromolecules, 2019, 136:305-315.
[27] WANG K, LI W, RUI X, et al.Chemical modification, characterization and bioactivity of a released exopolysaccharide (r-EPS1) from Lactobacillus plantarum 70810[J].Glycoconjugate Journal, 2015, 32(1):17-27.
[28] ZHOU K, ZENG Y T, YANG M L, et al.Production, purification and structural study of an exopolysaccharide from Lactobacillus plantarum BC-25[J].Carbohydrate Polymers, 2016, 144:205-214.
[29] LAWS A, GU Y C, MARSHALL V.Biosynthesis, characterisation, and design of bacterial exopolysaccharides from lactic acid bacteria[J].Biotechnology Advances, 2001, 19(8):597-625.
[30] ZHOU Y, CUI Y H, QU X J.Exopolysaccharides of lactic acid bacteria:Structure, bioactivity and associations:A review[J].Carbohydrate Polymers, 2019, 207:317-332.
[31] TANG W Z, DONG M S, WANG W L, et al.Structural characterization and antioxidant property of released exopolysaccharides from Lactobacillus delbrueckii ssp.bulgaricus SRFM-1[J].Carbohydrate Polymers, 2017, 173:654-664.
[32] KANMANI P, SATISH KUMAR R, YUVARAJ N, et al.Production and purification of a novel exopolysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J].Bioresource Technology, 2011, 102(7):4 827-4 833.
[33] SHETTY A D, MATTHEWS K, HEGDE A R, et al.Multidrug resistant pathogenic bacterial biofilm inhibition by Lactobacillus plantarum exopolysaccharide[J].Bioactive Carbohydrates and Dietary Fibre, 2016, 8(1):7-14.
[34] BAI Y Y, LUO B L, ZHANG Y, et al.Exopolysaccharides produced by Pediococcus acidilactici MT41-11 isolated from camel milk:Structural characteristics and bioactive properties[J].International Journal of Biological Macromolecules, 2021, 185:1 036-1 049.
[35] WANG K, NIU M M, YAO D, et al.Physicochemical characteristics and in vitro and in vivo antioxidant activity of a cell-bound exopolysaccharide produced by Lactobacillus fermentum S1[J].International Journal of Biological Macromolecules, 2019, 139(15):252-261.
[36] 叶广彬, 陈源红, 王长丽, 等.假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究[J].食品研究与开发, 2019, 40(3):31-37.
YE G B, CHEN Y H, WANG C L, et al.Separation, purification and antioxidant activity of exopolysaccharide from Leuconostoc pseudomesenteroides[J].Food Research and Development, 2019, 40(3):31-37.
[37] JIANG B, WANG L L, ZHU M, et al.Separation, structural characteristics and biological activity of lactic acid bacteria exopolysaccharides separated by aqueous two-phase system[J].LWT, 2021, 147:111617.