面条是我国的传统主食,每年大约有40%的小麦粉用于制作面条[1],面条种类繁多,根据不同的生产工艺可以分为生面条和熟面条两大类,熟面条中的即食湿面,也称为LL面(long life noodles)、方便湿面、保鲜湿面、湿法方便面等,是一种经真空和面、熟化、压延、切条、蒸煮、水洗、酸浸、包装、巴氏杀菌等工艺制备而成开袋即食的熟湿面。即食湿面因水分含量高于60%,会造成微生物快速繁殖,导致产品腐败,因此工业化生产中主要采用乳酸或其他有机酸浸泡提高面条的酸度,从而达到抑制微生物的生长和延长货架期的目的[2]。即食湿面因其含水量高、非油炸、口感爽滑筋道、携带和食用方便、保质期长等特点逐渐受到消费者的青睐,但生产加工中高浓度有机酸保鲜处理后的面条往往有明显的酸味,部分消费者难以接受,影响乳酸保鲜即食湿面的市场推广。降低面条酸度、提升口感,是酸性乳酸保鲜即食湿面的产业化需求。
目前,乳酸等有机酸保鲜即食湿面的相关研究主要集中在其对即食湿面品质和保质期的影响上,对于乳酸保鲜即食湿面致腐微生物的研究较少,乳酸处理后即食湿面的保质期明显延长,但对其感官属性存在一定的负面影响[3-4]。有研究发现导致熟面腐败的细菌菌群主要为芽孢杆菌属(Bacillus)、梭状芽孢杆菌属(Clostridium)和类芽孢杆菌属(Paenibacillus)[5],通过对分离菌株的形态学和生化鉴定获得了多株自制即食湿面中的主要致腐微生物(枯草芽孢杆菌、地衣芽孢杆菌和巨大芽孢杆菌)[6],但目前研究未对传统工业化生产乳酸保鲜即食湿面中腐败菌鉴定到种水平,其生长特性尚不清楚。
本研究对工业化生产乳酸保鲜即食湿面中的致腐微生物进行多样性分析,结合传统分离培养方法,通过形态学和分子生物学鉴定获得乳酸保鲜即食湿面中的降酸致腐优势菌种,同时研究其生长特性。旨在明确降低酸性乳酸保鲜即食湿面中的优势致腐微生物及其生长特性,为后续工业化生产中针对目标菌株对酸性乳酸保鲜即食湿面采取降酸处理,避免酸度较大影响面条口感,同时也为开发新的防腐保鲜技术提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 乳酸保鲜即食湿面样品
从企业生产线采取在常温条件下贮藏7 d后的低酸性(pH 5.0~5.5)和酸性(pH 3.6~4.0)乳酸保鲜即食湿面各5袋。降酸后腐败的低酸性乳酸保鲜即食湿面分为未液化区域(jgs-1,菌落总数2.1×104 CFU/g)和液化区域(jgs-2,菌落总数1.1×107 CFU/g),酸性乳酸保鲜即食湿面未腐败,不作区分(jgs-3,菌落总数<10 CFU/g)。

a-低酸性;b-酸性
图1 乳酸保鲜即食湿面
Fig.1 Lactic acid preservative instant wet noodles
1.1.2 试剂
琼脂粉,北京奥博星生物技术有限责任公司;NaCl、盐酸,国药集团化学试剂有限公司;革兰氏染色液,常德比克曼生物科技有限公司;脱纤维绵羊血,上海源叶生物科技有限公司;PCR扩增试剂与合成扩增引物,上海生工生物工程股份有限公司。
葡萄糖胰蛋白胨琼脂培养基(dextrose tryptophan agar, DTA)(g/L):胰酪蛋白胨10.0,葡萄糖5.0,琼脂15.0,溴甲酚紫0.04,pH 6.7±0.1;平板计数培养基(plate count agar, PCA)(g/L):胰蛋白胨5.0,酵母浸粉2.5,葡萄糖1.0,琼脂15.0,pH 7.0±0.2;胰蛋白胨大豆肉汤培养基(trypticase soy broth, TSB)(g/L):胰蛋白胨17.0,大豆蛋白胨3.0,NaCl 5.0,磷酸氢二钾2.5,葡萄糖2.5,pH 7.3±0.2;胰蛋白胨大豆琼脂培养基(tryptic soy agar, TSA)(g/L):TSB培养基中加入琼脂15.0,pH 7.3±0.2。
1.2 仪器与设备
DL-CJ-1N医用型洁净工作台,北京东联哈尔仪器制造有限公司;SHP-300生化培养箱,常州普天仪器制造有限公司;LS-50HD立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;Leica DM500显微镜,徕卡显微系统上海贸易有限公司;SHZ-28A水浴恒温振荡器,太仓市豪诚实验仪器制造有限公司;ME104E/02电子天平,梅特勒-托利多仪器上海有限公司;PB-10型pH计,赛多利斯科学仪器北京有限公司;3-30 K台式高速冷冻离心机,德国SIGMA离心机有限公司。
1.3 实验方法
1.3.1 乳酸保鲜即食湿面工业化生产工艺流程
乳酸保鲜即食湿面工业化生产工艺流程如下:
原辅料(小麦粉、醋酸酯淀粉、谷朊粉、食用盐等)→真空和面→熟化→复合逐级压延→切条→蒸面→切面→煮面→水洗→乳酸浸泡→沥水→包装→巴氏杀菌→冷却→成品
1.3.2 微生物多样性分析
DNA的提取:采用OMEGA土壤DNA试剂盒(M5635-02)提取样品中生物的总基因组DNA,采用琼脂糖凝胶电泳测定提取DNA的浓度和纯度。
PCR扩增及测序:细菌采用16S rDNA基因V3~V4区引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-TCGGACTACHVGGGTWTCTAAT-3′),真菌采用ITS序列V1区引物ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)分别进行PCR扩增,PCR产物使用Illumina MiSeq平台进行高通量测序。采用QIIME2(2019.4)软件的DADA2方法对序列进行去引物、降噪等,并采用NCBI数据库比对结果对序列进行物种分类学注释。通过对物种的序列数量(绝对丰度值)进行百分比统计获得各分类学水平上不同物种基因的相对丰度。
1.3.3 优势菌的分离纯化
取样品25 g充分碾磨,加入225 mL无菌水,取0.1 mL逐级稀释不同浓度梯度的稀释液,涂布于DTA培养基上,37 ℃倒置培养24 h。挑取不同菌落形态的单一菌落,以平板划线法分离纯化获得分离菌株[7]。
1.3.4 分离菌的形态学观察
将分离菌株划线接种到PCA培养基上于37 ℃培养观察单菌落的形态特征,并进行革兰氏染色,通过光学显微镜观察菌体及芽孢形态[8]。
1.3.5 分离菌的分子生物学鉴定
采用改良CTAB法提取DNA,采用细菌通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-TACGGTTACCTTGTTACGACTT-3′)对16S rRNA基因序列进行PCR扩增,PCR反应条件和体系见参考文献[7]。PCR产物经试剂盒回收纯化,使用测序仪ABI3730-XL进行DNA测序。测序结果提交NCBI GenBank用BLAST进行相似性检索和同源性比对。利用MEGA-X软件,采用基于Kimura 2-parameter模型的邻接法构建系统发育树,进化树分支稳定性用Bootstrap分析,重复1 000次。
1.3.6 分离菌的生长特性研究
1.3.6.1 溶血特性
将分离菌株划线接种于TSA血琼脂平板上,在37 ℃培养48~60 h,观察细菌的溶血能力[9]。
1.3.6.2 需氧特性
将分离菌株划线接种于TSA培养基上,分别采用厌氧袋厌氧培养和普通需氧培养,37 ℃培养48 h观察平板上微生物的生长状况。
1.3.6.3 耐酸特性
用盐酸调节TSB培养基使pH值分别为2.40、3.03、3.50、4.03、4.54、5.04、5.71、6.82、7.33,加入1%不同分离菌的菌悬液(约为107 CFU/mL)于10 mL TSB的玻璃试管中,在37 ℃培养48~60 h,记录微生物的生长状况[10]。
1.3.6.4 耐盐特性
将分离菌株划线接种于含有0.5%、2%、5%、10%、12%、14%、20%(质量分数)NaCl的TSA培养基上,在37 ℃培养48~60 h,记录微生物的生长状况[11]。
1.3.6.5 耐热特性
将分离菌株接种于TSB培养基中,37 ℃下培养48~60 h,经8 000×g、4 ℃离心10 min,收获菌体。产芽孢菌在80 ℃水浴25 min,杀灭营养体细胞,其他菌不经水浴。将菌体(芽孢)重新悬浮在无菌水中,浓度约为107 CFU/mL,将收集的菌在100 ℃下加热5 min,测定热处理后的菌落总数,以水浴后菌落存活率作为衡量各菌株耐热力的指标[12]。
1.3.7 数据统计分析
利用IBM SPSS Statistics 23、MEGA-X软件对实验数据进行分析处理,利用Origin 2018软件绘制图表。
2 结果与分析
2.1 微生物多样性组成谱分析
基于高通量测序技术分别分析样品中真菌和细菌群落的组成,结果显示,乳酸保鲜即食湿面3种样品的真菌群落均以子囊菌门(Ascomycota)为主(>70%),属间物种多样性丰富,但占比较小,样品间真菌群落组成差异不大,不是主要腐败微生物(图2)。图3显示,3种样品中细菌群落组成存在较大差异,jgs-1与jgs-3中的细菌群落均以变形菌门(Proteobacteria)为主(>90%),而在腐败液化即食湿面jgs-2中占绝对优势的为厚壁菌门(Firmicutes)的芽孢杆菌(Bacillus),相对丰度达90.93%。说明芽孢杆菌为低酸性乳酸保鲜即食湿面腐败的主要致腐微生物。真菌和细菌微生物主要来源于小麦粉等生产原料和加工过程[13],即食湿面生产采用的蒸煮、巴氏杀菌等热处理工艺容易使不耐热的真菌及变形菌门细菌失活,耐热性较强的厚壁菌门细菌可能逃脱系列热处理存活下来,需要进一步乳酸处理抑制其生长。这与张婉[5]的研究结果类似,芽孢杆菌属(Bacillus)、梭状芽孢杆菌属(Clostridium)和类芽孢杆菌属(Paenibacillus)等厚壁菌门细菌被认为是经热处理熟面条的主要腐败菌。

a-门水平;b-属水平
图2 乳酸保鲜即食湿面中真菌群落结构分布
Fig.2 Distribution of fungal community structure of lactic acid preservative instant wet noodles

a-门水平;b-属水平
图3 乳酸保鲜即食湿面中细菌群落结构分布
Fig.3 Distribution of bacterial community structure of lactic acid preservative instant wet noodles
2.2 分离菌的形态学观察和分子生物学鉴定
2.2.1 分离菌的形态学观察
采用传统分离纯化法从3个样品中共分离获得6株菌。其菌落形态特征如图4和表1所示。从低酸性腐败即食湿面jgs-1和jgs-2中分离出的5株菌中有4株均为菌落形态相近的产芽孢菌,1株为无芽孢革兰氏阳性菌。从酸性即食湿面jgs-3中分离出1株不产芽孢的革兰氏阴性菌。
表1 六株细菌菌落形态特征描述
Table 1 The morphological characterizations of 6 strains of bacteria

菌株来源菌株编号菌落形态革兰氏染色产芽孢情况芽孢形态jgs-2A1表面粗糙,中心圆形水泡状凸起,后皱缩,边缘呈不规则裙摆形扩展G+是中间,较大,不膨出A2表面粗糙,中心皱缩凸起,水泡较少,边缘呈不规则裙摆形扩展G+是中间,较大,不膨出A3表面粗糙,中心圆形水泡状大凸起,水泡较大,边缘呈近圆形扩展G+是中间,较大,不膨出jgs-1B1表面粗糙,中心圆形水泡状大凸起,水泡较大,边缘呈不规则裙摆形扩展G+是中间,较大,不膨出B2扁平,不透明,表面较湿润的圆形菌落G+否—jgs-3C1表面稍湿润呈年轮状扩展,边缘不整齐,不透明黄色菌落G-否—
注:“—”表示无芽孢产生

图4 六株细菌在PCA培养基上菌落形态特征
Fig.4 Colony morphology of 6 strains of bacteria on PCA culture medium
注:A1~A3分离自jgs-2,B1、B2分离自jgs-1,C1分离自jgs-3(下同)
2.2.2 分离菌的分子生物学鉴定
序列比对结果(表2)显示,A1、A2、A3和B1与Bacillus amyloliquefaciens strain BCRC 11601的同源性为99.79%~100.00%,结合菌落特征鉴定为解淀粉芽孢杆菌;B2与Peribacillus frigoritolerans strain DSM 8801的同源性达99.93%,被鉴定为耐寒短杆菌。基于基因组学,因与芽孢杆菌属菌株具有较高的同源性,2020年耐寒短杆菌被划分为芽孢杆菌属,之前曾隶属于短杆菌属(Brevibacterium)[14-15],为不生孢的革兰氏阳性菌;C1与Pantoea sp. strain Glg 21具有99.93%的同源性,结合菌落特征初步鉴定为泛菌属细菌。
表2 NCBI Blast结果
Table 2 Result of NCBI Blast

菌株编号GenBank中同源性最高的菌种登录号同源性/%A1Bacillus amyloliquefaciens strain BCRC 11601NR116022.1100.00A2Bacillus amyloliquefaciens strain BCRC 11601NR116022.199.79A3Bacillus amyloliquefaciens strain BCRC 11601NR116022.1100.00B1Bacillus amyloliquefaciens strain BCRC 11601NR116022.1100.00B2Peribacillus frigoritolerans strain DSM 8801NR117474.199.93C1Pantoea sp.strain Glg 21MK312599.199.93
本研究采用高通量测序分析微生物多样性结合传统分离培养的方法[16]鉴定出导致降酸处理的低酸性乳酸保鲜即食湿面腐败液化的优势致腐微生物为芽孢杆菌属中的解淀粉芽孢杆菌(图5),作为枯草芽孢杆菌近缘种群,可产生多种淀粉酶和蛋白酶[17-18],分解面条中的淀粉和蛋白质,从而导致面条的液化现象。酸性乳酸保鲜即食湿面中的活菌数量极少,经多次分离培养只分离出1株与变形菌门中泛菌属同源性相近的菌株C1,这表明高酸度能够很好地抑制腐败菌的生长繁殖并具有一定的杀灭作用,严格控制生产原料和环境条件中芽孢杆菌、变形菌群等微生物的混入和污染有利于保障产品质量安全。
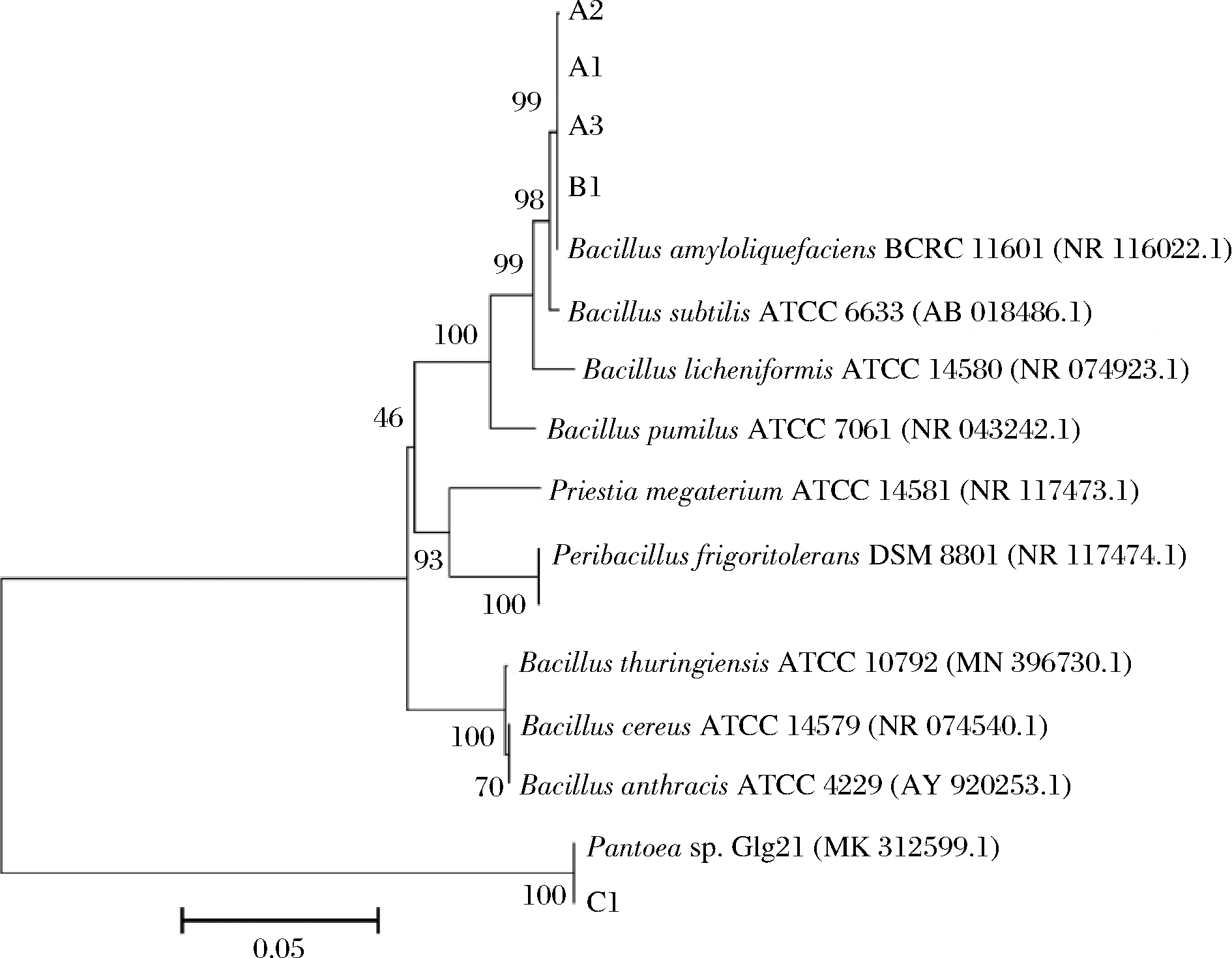
图5 基于16S rDNA序列基因构建的系统发育树
Fig.5 Phylogenetic tree constructed based on 16S rDNA sequence genes
2.3 分离菌的生长特性
2.3.1 溶血特性
具有溶血特性的细菌具有致病性的可能性较高。溶血试验结果显示,6株分离菌菌落周围均未见溶血环(图6),说明它们均不具有溶血能力。该产品在加工过程中受溶血性致病菌污染的可能性较小,具有溶血能力的细菌在生产过程中可能易被酸和(或)热处理杀灭。

图6 六株细菌的溶血性测定
Fig.6 Hemolytic assay of 6 strains of bacteria
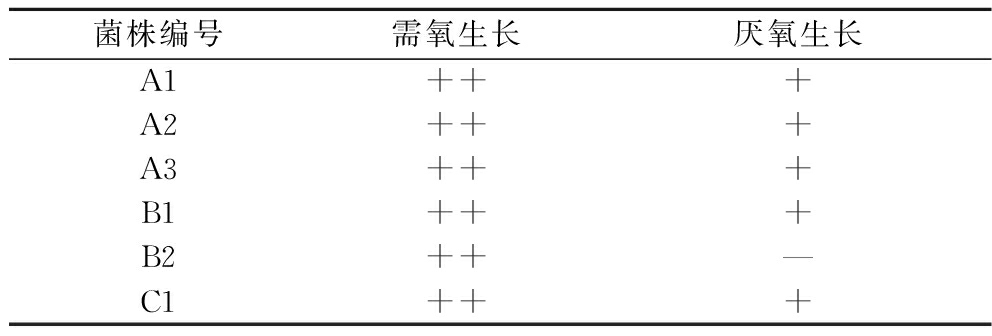
2.3.2 需氧特性
表3结果显示,耐寒短杆菌B2在厌氧条件下生长受到明显抑制,为需氧菌;其他菌株在厌氧条件下可生长但生长速度较慢,均为兼性好氧菌。4株解淀粉芽孢杆菌A1、A2、A3、B1在厌氧环境中仍可产生芽孢和黏液。乳酸保鲜即食湿面工业化生产中主要采用有氧包装,为微生物的生长繁殖提供了有利条件,若采取无氧或充氮包装将有利于减缓多数微生物的生长繁殖,但无法阻止解淀粉芽孢杆菌腐败产生的面条液化现象。
表3 六株细菌的需氧特性
Table 3 Aerobic characteristics of 6 strains of bacteria
菌株编号需氧生长厌氧生长A1+++A2+++A3+++B1+++B2++—C1+++
注:“++”表示有菌体生长,生长速度较快;“+”表示有菌体生长,生长速度较慢;“—”表示未见明显菌体生长(下同)
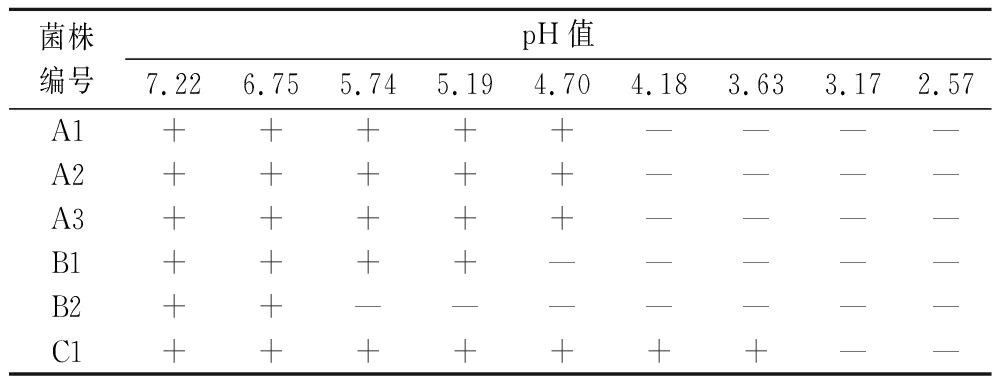
2.3.3 耐酸特性
表4结果显示,A1、A2、A3和B1解淀粉芽孢杆菌在pH<4.70时生长均受到明显抑制,与YING等[19]分离出的解淀粉芽孢杆菌最小耐受pH 4.0接近;耐寒短杆菌B2在pH<6.75时生长受到抑制,耐酸性较弱;泛菌属菌株C1是从未腐败酸性乳酸保鲜即食湿面中分离出的菌株,耐酸性较强。未腐败酸性乳酸保鲜即食湿面pH值为3.6~4.0,此时乳酸对芽孢杆菌、耐寒短杆菌等腐败菌具有较好的抑制作用;当降酸乳酸保鲜即食湿面获得较适宜的口感酸度时,pH值为5.0~5.5,酸抑制对部分腐败菌有效,但由于解淀粉芽孢杆菌的适宜生长pH值为5.0~9.0[18],无法完全抑制这些优势致腐菌的生长繁殖,需增加其他针对性保鲜手段加以控制。
表4 六株细菌的耐酸特性
Table 4 Acid tolerance of 6 strains of bacteria
菌株编号pH值7.226.755.745.194.704.183.633.172.57A1+++++————A2+++++————A3+++++————B1++++—————B2++———————C1+++++++——
2.3.4 耐盐特性
表5结果显示,从乳酸保鲜即食湿面中分离出的4株解淀粉芽孢杆菌抗盐能力较强,可耐受盐质量分数为12%,比其他样品中分离出的解淀粉芽孢杆菌[19-20]具有更高的耐盐能力。耐寒短杆菌和泛菌属细菌的耐盐能力较弱,仅耐受5%(质量分数)。乳酸保鲜即食湿面生产加工中添加食盐质量分数不超过5%,对分离菌的生长并无抑制作用。
表5 六株细菌的耐盐特性
Table 5 Salt tolerance of 6 strains of bacteria

菌株编号NaCl质量分数/%0.52510121420A1+++++++——A2+++++++——A3+++++++——B1+++++++——B2+++++————C1+++++————
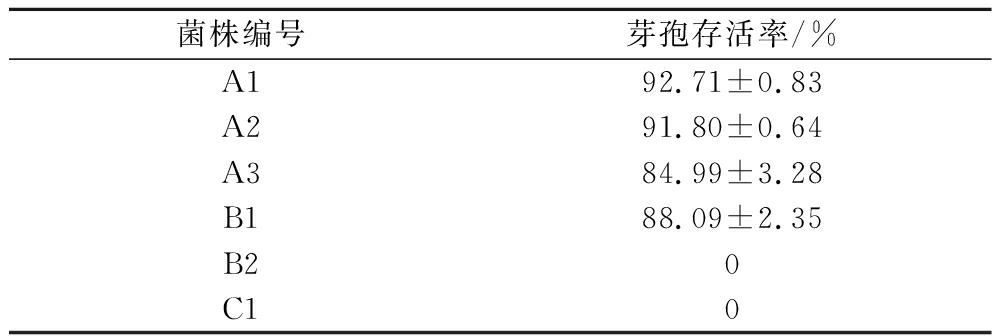
2.3.5 耐热特性
表6结果显示,本研究中分离菌解淀粉芽孢杆菌芽孢的抗逆性较强,在100 ℃下加热处理5 min时存活率为84.99%~92.71%,乳酸保鲜即食湿面加工生产中的蒸煮工艺不能使其彻底失活。LARSEN等[12]在对解淀粉芽孢杆菌和枯草芽孢杆菌等10个分离物种的芽孢耐热性研究中发现,100 ℃处理5~10 min解淀粉芽孢杆菌芽孢的耐热性最强,与本研究的结果一致。耐寒短杆菌呈杆状不易产芽孢[21],因此在培养基中培养48~60 h,100 ℃加热处理5 min已完全失活。泛菌属菌株为非芽孢杆菌,耐热性较差。优势分离菌解淀粉芽孢杆菌芽孢的耐热性较强,工业化生产中蒸煮工艺和巴氏杀菌不能使其彻底失活。若要降低生产加工中酸味剂的使用以及在不升高杀菌温度的前提下,减少对产品品质的影响,针对抗逆性较强的优势致腐菌解淀粉芽孢杆菌开发新的防腐保鲜技术十分必要。
表6 六株细菌的耐热特性
Table 6 Heat tolerance of 6 strains of bacteria
菌株编号芽孢存活率/%A192.71±0.83A291.80±0.64A384.99±3.28B188.09±2.35B20C10
3 结论
本研究对工业化生产乳酸保鲜即食湿面中的致腐微生物进行了多样性分析,结合传统分离培养方法,通过形态学和分子生物学鉴定获得了乳酸保鲜即食湿面中的降酸致腐优势菌种,同时研究了其生长特性。结果表明降酸处理导致乳酸保鲜即食湿面腐败液化的优势微生物是芽孢杆菌属的解淀粉芽孢杆菌。4株分离菌株解淀粉芽孢杆菌均为非溶血性的兼性好氧菌,抗逆性较强,最大耐受pH值为4.70,最大耐盐质量分数为12%,100 ℃热处理5 min芽孢存活率为84.99%~92.71%。本研究为乳酸保鲜即食湿面关键致腐微生物的控制及低酸性乳酸保鲜即食湿面新产品的开发提供了理论基础。
[1] WANG X L, MA Z, LI X P, et al.Food additives and technologies used in Chinese traditional staple foods[J].Chemical and Biological Technologies in Agriculture, 2018, 5(1):1-15.
[2] HAN T Y, YANG Z, YU C, et al.Effect of acidity regulators on the shelf life, quality, and physicochemical characteristics of fresh wet noodles[J].Journal of Cereal Science, 2022, 103:103409.
[3] HSUEH-LIANG L, DER-SHENG C, CHIN-HUNG T, et al.Effects of acidification on the extension of shelf life of Japanese wet-type noodles (woo-long noodle)[J].African Journal of Microbiology Research, 2016, 10(45):1 918-1 925.
[4] FU X W, HUANG B, DAN W, et al.Effect of organic-acid-soaking on the extension of the shelf life of fresh noodles[J].American Journal of Food Technology, 2015, 10(5):215-222.
[5] 张婉. 鲜熟面贮藏品质及货架期预测模型研究[D].北京:中国农业科学院, 2016.
ZHANG W.Study on storage quality and shelf-life prediction model of fresh cooked noodles[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[6] 许玉慧, 许喜林, 辛淑敏.即食湿面条中腐败微生物的分离和鉴定的初步研究[J].中国酿造, 2014, 33(7):68-71.
XU Y H, XU X L, XIN S M.Separation and identification of spoilage microorganisms in instant wet noodles[J].China Brewing, 2014, 33(7):68-71.
[7] 王欢, 李刚凤, 夏欣欣, 等.市售生鲜湿面中腐败菌的分离与鉴定[J].中国酿造, 2020, 39(9):148-151.
WANG H, LI G F, XIA X X, et al.Isolation and identification of spoilage bacteria in commercial fresh wet noodles[J].China Brewing, 2020, 39(9):148-151.
[8] 刘晓燕, 王玲玲, 栾会妮, 等.一株枯草芽孢杆菌的分离鉴定、生物学特性及其对水质净化的作用[J].微生物学通报, 2021, 48(2):449-461.
LIU X Y, WANG L L, LUAN H N, et al.Isolation and identification of a Bacillus subtilis strain for water purification[J].Microbiology China, 2021, 48(2):449-461.
[9] JEON H L, YANG S J, SON S H, et al.Evaluation of probiotic Bacillus subtilis P229 isolated from cheonggukjang and its application in soybean fermentation[J].LWT, 2018, 97:94-99.
[10] LU L H, LIU T T, LIU X L, et al.Screening and identification of purine degrading Lactobacillus fermentum 9-4 from Chinese fermented rice-flour noodles[J].Food Science and Human Wellness, 2022, 11(5):1 402-1 408.
[11] 何银, 唐杰, 张惟广.赤水晒醋中腐败微生物的生长特性研究[J].中国调味品, 2018, 43(2):17-22.
HE Y, TANG J, ZHANG W G.Study on the growth characteristics of spoilage microorganisms in Chishui sun vinegar[J].China Condiment, 2018, 43(2):17-22.
[12] LARSEN N, THORSEN L, KPIKPI E N, et al.Characterization of Bacillus spp.strains for use as probiotic additives in pig feed[J].Applied Microbiology and Biotechnology, 2014, 98(3):1 105-1 118.
[13] 李彪, 李国长, 柳琴.微生物对小麦及其加工品污染的调查分析[J].粮食储藏, 2003,32(5):36-38.
LI B, LI G C, LIU Q.Investigation of microorganism contamination on wheat and its by-products[J].Grain Storage, 2003,32(5):36-38.
[14] LIU G H, LIU B, WANG J P, et al.Reclassification of Brevibacterium frigoritolerans DSM 8801 T as Bacillus frigoritolerans comb.nov.based on genome analysis[J].Current Microbiology, 2020, 77(8):1 916-1 923.
[15] MONTECILLO J A V, BAE H H.Reclassification of Brevibacterium frigoritolerans as Peribacillus frigoritolerans comb.nov.based on phylogenomics and multiple molecular synapomorphies[J].International Journal of Systematic and Evolutionary Microbiology, 2022, 72(5). DOI: 10.1099/ijsem.0.005389.
[16] XU Y H, YU Y, TIAN Y M, et al.Analysis of Beijing douzhir microbiota by high-throughput sequencing and isolation of acidogenic, starch-flocculating strains[J].Frontiers in Microbiology, 2018, 9:1142.
[17] MUSHTAQ H, JEHANGIR A, AHMAD GANAI S, et al.Biochemical characterization and functional analysis of heat stable high potential protease of Bacillus amyloliquefaciens strain HM48 from soils of Dachigam National Park in Kashmir Himalaya[J].Biomolecules, 2021, 11(1):117.
[18] KAHRAMAN S, AYDENIZ Y, GUZEL I, et al.Partial purification of α-amylase from Bacillus amyloliquefaciens, a strain isolated from a novel source[J].Journal of Biotechnology, 2017, 256:S24.
[19] YING T T, WU P J, GAO L L, et al.Isolation and characterization of a new strain of Bacillus amyloliquefaciens and its effect on strawberry preservation[J].LWT, 2022, 165:113712.
[20] 蒋凯丽, 周新丽, 高海燕.一株具有拮抗作用的解淀粉芽孢杆菌的筛选、鉴定及生物学特性研究[J].工业微生物, 2020, 50(1):8-13.
JIANG K L, ZHOU X L, GAO H Y.Screening, identification and biological characteristics of an antagonistic Bacillus amyloliquefaciens[J].Industrial Microbiology, 2020, 50(1):8-13.
[21] 王明. 内蒙古草原纤维素分解菌的筛选及秸秆乙醇发酵[D].扬州:扬州大学, 2021.
WANG M.Screening of cellulose degradation bacteria in Inner Mongolia grasslands and it′s ethanol fermentation from corn stalk[D].Yangzhou:Yangzhou University, 2021.