粮食是人类赖以生存的宝藏资源,更是关系到国计民生的重要战略性物资。中国作为世界第一人口大国,有近三分之二的人口以稻米为主食[1],因此,稻米的食品安全问题非常关键。镉作为稻米中常见的重金属污染元素,其污染事件在我国仍有发生,2020年4月21日,云南昭通市镇雄县在发电厂销毁99.4 t的“镉大米”,引发了社会的广泛关注。GB 2762—2017《食品安全国家标准 食品中污染物限量》指出食品中镉元素限量值≤0.2 mg/kg。镉的摄入量超标将会导致多种疾病,可引起“痛痛病”,导致骨软化、骨质疏松、肾损伤等[2]。而镉超标大米流入社会的主要原因是个别地区土壤中重金属镉污染严重,导致土壤中的Cd迁移到水稻当中。为了避免这些镉超标大米进入人体,寻找一个简单、快速、准确的测定方法去测定镉含量显得尤为重要。
常见的镉元素检测方法有石墨炉原子吸收法(graphite furnace atomic absorption spectrometry,GFAAS)[3-8]、火焰原子吸收法(flame atomic absorption spectroscopy,FAAS)[9-10]、电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)[11-16]、原子发射光谱法(atomic emission spectrometry,AES)[17-18]、氢化物发生原子荧光法(hydride generation-atomic fluorescence spectrometry,HG-AFS)[19-23]等,但上述的前4种检测方法的核心技术均由国外掌控,且仪器体积较大、价格昂贵、对操作人员要求较高。而本研究使用的仪器是CAF18-YG202双道氢化物发生原子荧光仪,该仪器不仅体积小[61 cm(长)×42 cm(宽)×50 cm(高)]、重量轻(仅35 kg),而且检出限好、灵敏度高,非常适用于痕量镉测定。
测定镉元素的前处理方法有湿法消解法[16,20]、微波消解法[7-9]、干灰化法[3-4]、压力罐消解法、稀酸浸提法[5,10,17]等,而湿法消解法、干灰化法、压力消解法等传统方法虽然比较成熟,但其实验步骤繁琐且耗时较长。为此,本研究建立了一种只需稀酸溶样超声辅助浸提的前处理方法,再通过使用微型氢化物发生原子荧光仪进行检测,以实现简单、快速、准确的测定稻米中的痕量镉。
1 材料与方法
1.1 材料与试剂
镉标准溶液(国家标准样品,GSB 04-1721—2004),1 000 μg/mL,国家有色金属及电子材料分析测试中心;大米标准物质GBW10025(GSB-1)、四川大米标准物质GBW10043(GSB-22),地球物理地球化学勘查研究所;镉增敏剂,多彩实验室;氢氧化钠、硼氢化钠、盐酸、硫脲,分析纯,西陇科学股份有限公司;稻米样品(大米、糯米、红米、黑米),市售。
1.2 仪器与设备
CAF18-YG202双道微型氢化物发生原子荧光仪,东华理工大学与重庆民泰新农业科技发展集团有限公司联合研发;高强度镉空心阴极灯,国标(北京)检验认证有限公司;KQ5200DB超声波清洗器,江苏省昆山市超声仪器有限公司;TG16-WS台式高速离心机,上海卢湘仪有限公司;WGL-125B电热鼓风干燥器,南京伊若达仪器设备有限公司;FA2004电子天平,上海舜宇恒平科学仪器有限公司;ZWY-240恒温培养振荡器,上海智城分析仪器制造有限公司。
优化后的CAF18-YG202工作条件:灯电流30 mA、负高压240 V、进样泵转速100 r/min、屏蔽气流量1 200 mL/min、载带气流量500 mL/min、取样时间4 s、换插时间3 s、读数时间8 s、读数方式:峰面积。
1.3 实验方法
1.3.1 溶液配制
硫脲溶液(50 g/L):称取5.0 g硫脲溶于100 mL水中,混匀后备用。镉增敏剂(25 g/L):称取2.5 g镉增敏剂溶于100 mL水中,混匀后备用。盐酸(50%,体积分数):量取100 mL水于250 mL烧杯中,再量取100 mL 浓盐酸与水混合,搅拌均匀。还原剂溶液(硼氢化钠-氢氧化钠混合溶液):称取0.8 g氢氧化钠溶于100 mL水中,混匀后,再称取3.0 g硼氢化钠溶于其中,混匀后备用(使用前现配)。镉标准溶液配制:将1 mg/mL镉标准溶液(含5% HNO3)稀释至100 ng/mL(含5% HNO3),临用时将此溶液稀释成1 ng/mL的镉标准溶液(含2% HCl),移取0、0.5、1.0、1.5、2.0、2.5 mL的1 μg/L镉标准溶液于1~6号25 mL容量瓶中,每个容量瓶中加入50%(体积分数)盐酸2 mL,50 g/L硫脲2.5 mL,25 g/L镉增敏剂2.5 mL,加水定容至刻度,混匀备用,配制成系列质量浓度为0.00、0.05、0.10、0.15、0.20、0.25 ng/mL的镉溶液。
1.3.2 样品制备
(1)将购买的稻米样品置于干燥箱中于45 ℃下烘干,将烘干后的样品用研磨机进行研磨后过60目,室温[(25±2) ℃]下于离心管中密封保存。
(2)将大米置于不同浓度镉溶液中进行浸泡污染,浸泡48 h后,将污染后的大米放于干燥箱中烘干,研磨,室温下于离心管中密封保存,并编号为125大米、126大米、165大米、190大米、214大米。
1.3.3 提取方法
称取制备好的稻米样品0.100 0 g(精确至0.000 1 g),置于50 mL容量瓶中,加入50%(体积分数)盐酸4 mL,50 g/L硫脲5 mL,25 g/L镉增敏剂5 mL,定容至50 mL并混匀。辅助浸提10 min后用0.45 μm滤膜过滤后上机检测,同时做试剂空白实验。
2 结果与分析
2.1 条件优化
本研究采用辅助稀酸浸提法提取稻米中的痕量镉。由于不同的辅助浸提方式、超声时间、超声功率、盐酸体积分数和硫脲的用量对提取镉会产生不同的影响,同时,仪器的参数设置对元素的测定也会有不同程度的影响。因此,实验通过单因素变量法对不同因素进行对比分析,从而选择出最佳配比组分。
2.1.1 不同辅助浸提方式选择
实验过程中发现,在进行稀酸浸提取时,使用不同的辅助浸提法会对测定得到的数值产生影响,所以需要探究确定最佳的辅助浸提法。按照1.3.3对红米样品进行试验,结果见表1。由表1可以明显观察到超声辅助浸提法处理的实验结果相对离心、振荡和静置这3种辅助浸提方式更加充分、稳定、可靠,主要是因为超声辅助提取法利用超声传播时所产生的机械效应、空化效应和热效应,可实现短时间提取且提取率较高[24],故选择超声为测量的最佳辅助浸提方式。
表1 不同辅助浸提方式测定红米中镉(n=3)
Table 1 Determination of cadmium in red rice by different auxiliary extraction methods (n=3)

辅助浸提方式含量/(mg·kg-1)RSD/%离心0.0622.59超声0.0650.86振荡0.0601.64静置0.0628.97
注:RSD为相对标准偏差(relative standard deviation)
2.1.2 超声时间的选择
按照1.3.3试验方法,分别对红米样品超声辅助浸提3、5、10、15、30 min。结果如图1所示,结果表明,随着超声时间的延长,镉的浸提效率逐步提高,并在10 min后趋于稳定,其原因可能超声引起的空化效应和机械效应能够促使料液分散均匀,空化泡的产生及崩溃能有效破坏植物细胞壁[24],使镉组分分散到溶剂中,因此能在短时间内最大限度地将红米中的镉提取出来,在10 min后浸提完全并保持稳定。因此,选择最佳超声时间为10 min。
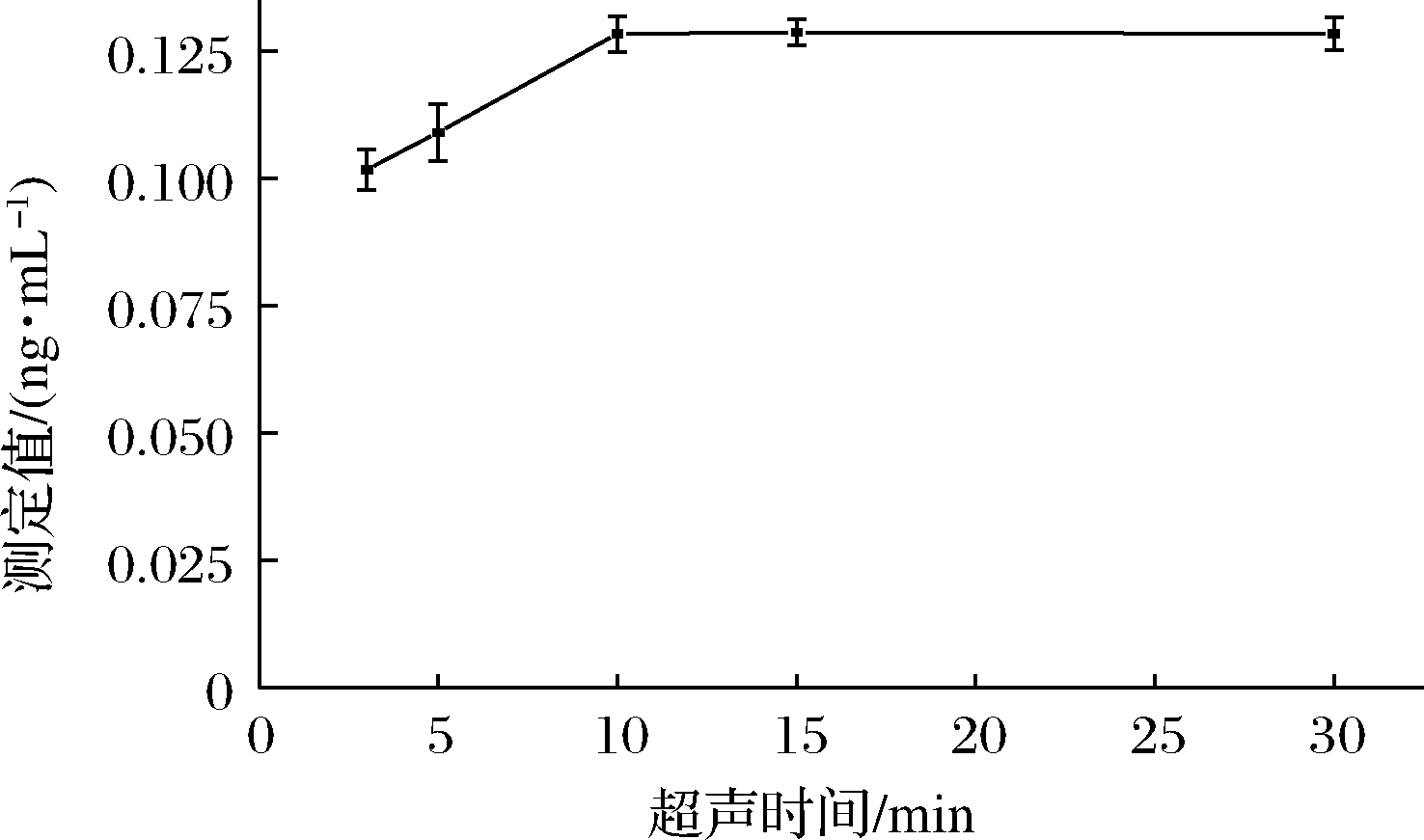
图1 超声时间对测定值的影响
Fig.1 Effect of ultrasonic time on the measured value
2.1.3 超声功率的选择
按照1.3.3试验方法,对红米样品进行超声辅助浸提,但超声功率分别设置为50%、60%、70%、80%、90%、100%。结果如图2所示,结果表明,超声功率的大小对镉的浸提效果有一定的影响,其呈现出先增大后趋于稳定趋势,其原因可能是超声功率增大有助于强化空化效应,提高传质速率,于80%达到最佳,而随着超声功率继续增大,导致空气气泡过多,产生空化作用,无法继续增大,因此镉提取效率趋于稳定。因此,选择超声功率为80%。
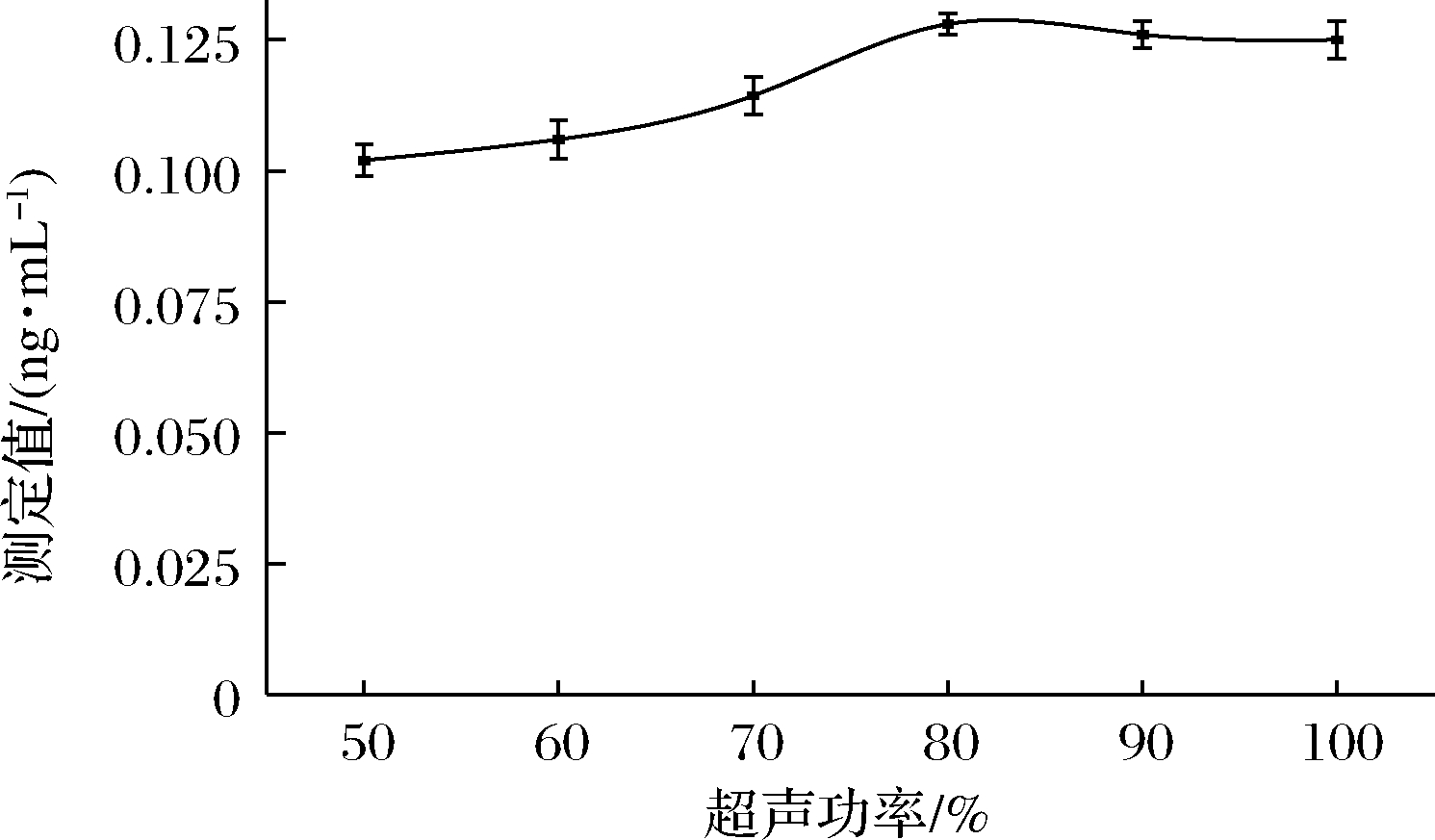
图2 超声功率对测定值的影响
Fig.2 Effect of ultrasonic power on the measured value
2.1.4 镉增敏剂用量的选择
在测定镉的过程中,需要使用到含钴离子(Co2+)的镉增敏剂,以提高测定镉的灵敏度和稳定性[23]。按照1.3.1标准溶液的配制过程,选定0.2 ng/mL镉标准溶液作为研究对象,将镉增敏剂用量分别改变为1.5、2.0、2.5、3.0、3.5 mL,使得镉增敏剂质量浓度为1.5、2.0、2.5、3.0、3.5 g/L。结果如图3所示,结果表明,随着镉增敏剂用量的加大,镉的荧光强度呈现出先增大后减小的趋势,因此选择最佳镉增敏剂质量浓度为2.5 g/L。
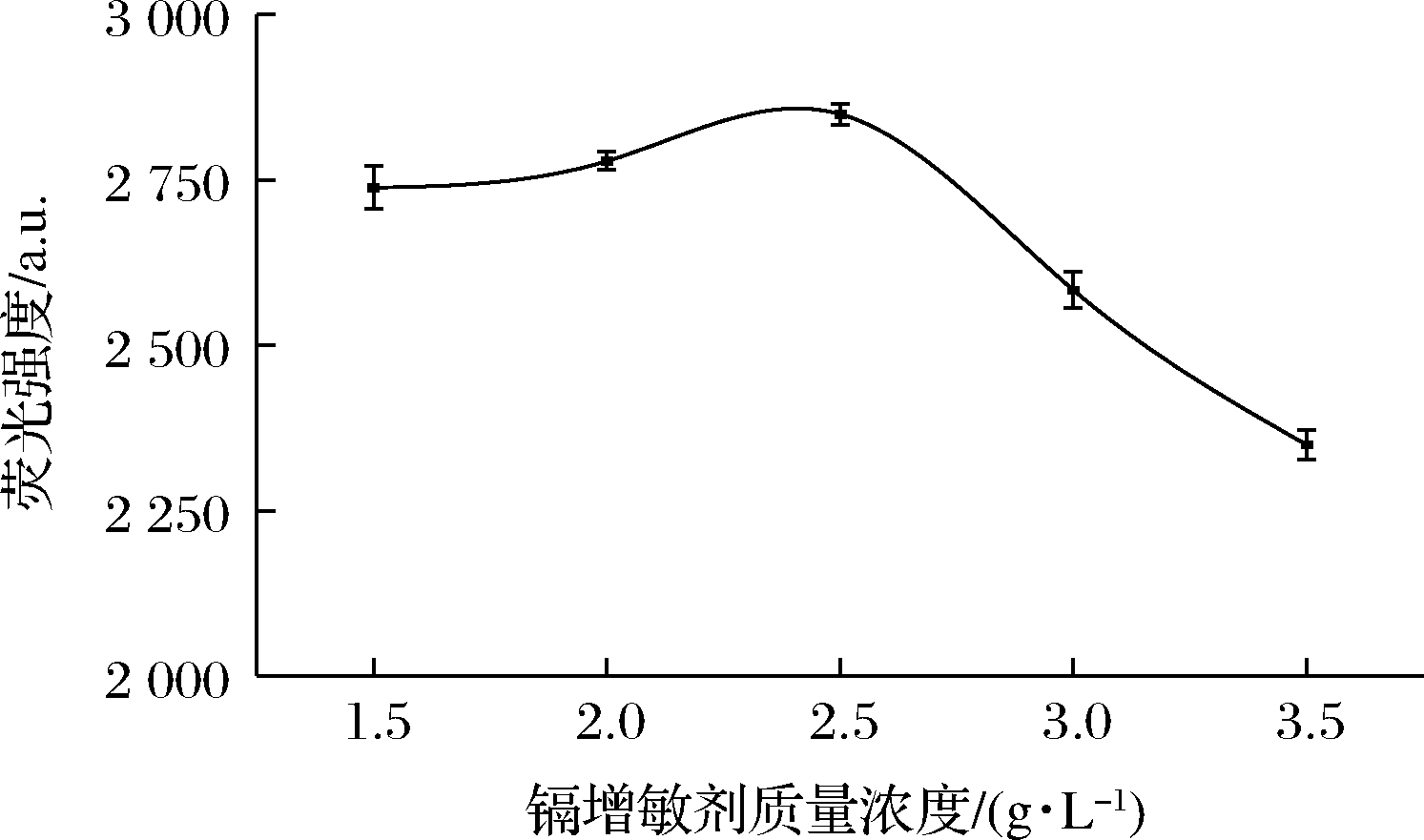
图3 镉增敏剂质量浓度对荧光强度的影响
Fig.3 Effect of cadmium sensitizer concentration on fluorescence intensity
2.1.5 硫脲用量的选择
硫脲与Co2+混合使用,荧光增敏效果有明显增强[25]。按照1.3.1标准溶液的配制过程,选定0.2 ng/mL镉标准溶液作为研究对象,将硫脲用量分别改变为1.5、2.0、2.5、3.0、3.5 mL,使得硫脲浓度为3.0、4.0、5.0、6.0、7.0 g/L。结果如图4所示,结果表明,随着硫脲用量的加大,镉的荧光强度呈现出先增大后几乎保持不变的趋势,因此选择最佳硫脲质量浓度为5.0 g/L。

图4 硫脲质量浓度对荧光强度的影响
Fig.4 Effect of thiourea concentration on fluorescence intensity
2.1.6 盐酸体积分数的选择
不同的酸度对氢化物与蒸汽发生有显著影响[26],因而选择合适的酸度很关键。实验按照1.3.3,固定其他变量,选择控制盐酸的体积分数为2%、3%、4%、5%、6%进行分析测定,结果见图5。由图5可以看出,随着盐酸体积分数的增大,镉的荧光强度呈现出先增大后减小的趋势,盐酸体积分数为4%时荧光强度最佳,本研究选定4%(体积分数)的盐酸进行实验。
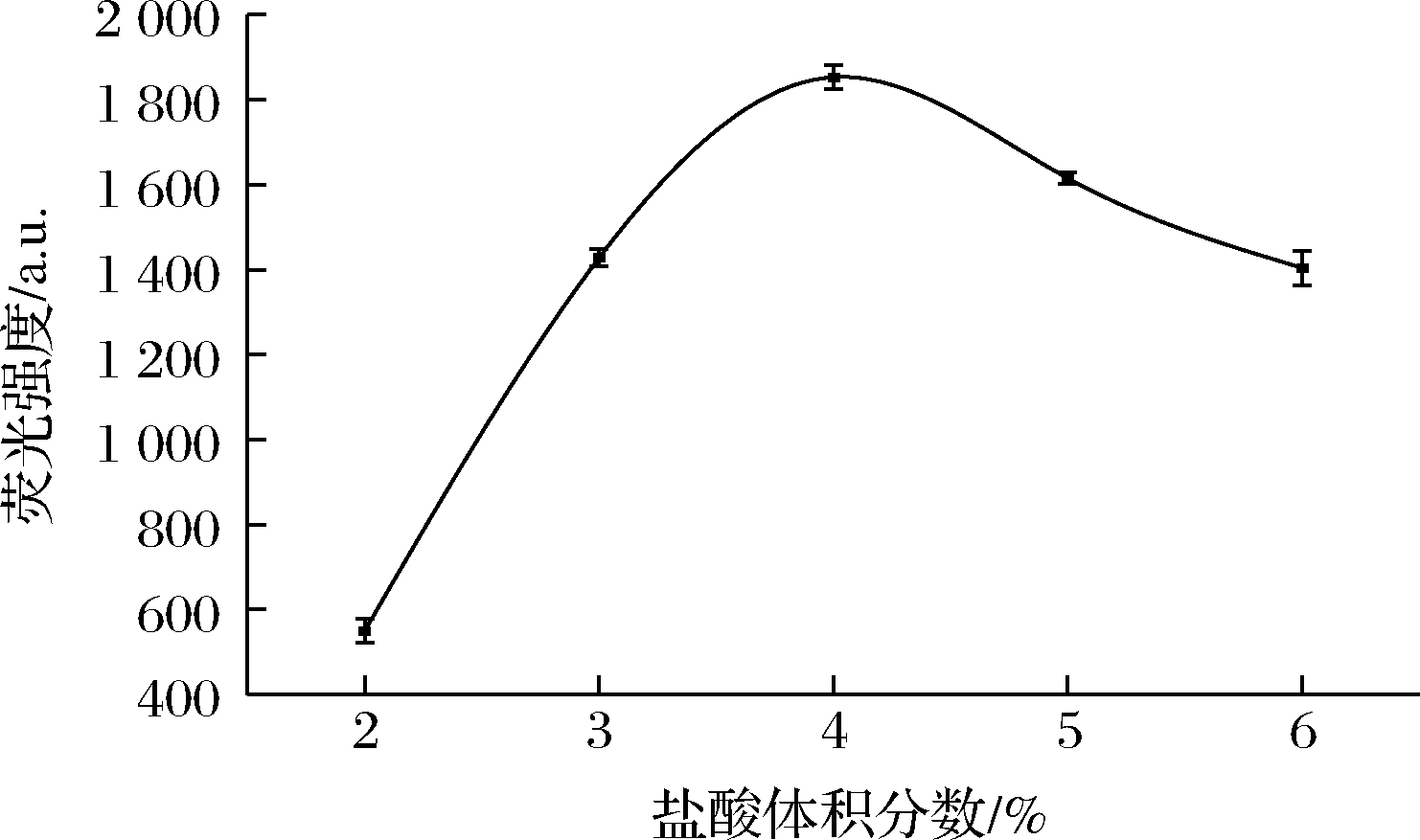
图5 盐酸体积分数对荧光强度的影响
Fig.5 Effect of hydrochloric acid concentration on fluorescence intensity
2.1.7 还原剂溶液浓度的选择
硼氢化钠作为实验的还原剂,其质量浓度的大小直接影响氢化物的产生效率[26]。质量浓度过小会使生成的氢化物偏少,导致测得的荧光强度偏低;质量浓度过大则会使得反应产生大量的氢气稀释了氢化物浓度,也会导致测得的荧光强度偏低且稳定性变差。通过固定其他变量,分别选择质量浓度为15、20、25、30、35 g/L的硼氢化钠溶液 进行测定,结果见图6。
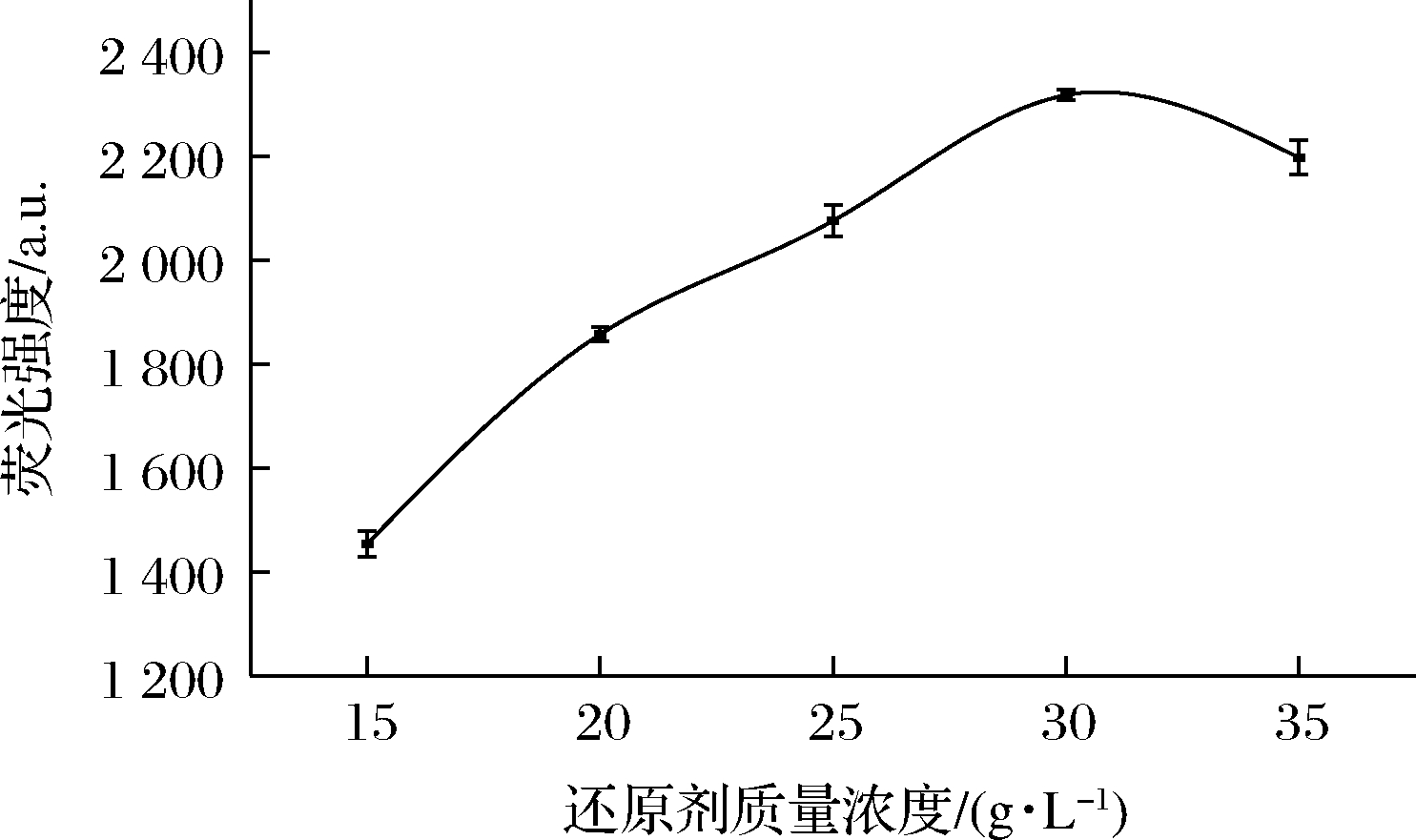
图6 还原剂质量浓度对荧光强度的影响
Fig.6 Effect of reducing agent concentration on fluorescence intensity
图6实验结果表明,镉元素荧光强度随硼氢化钠质量浓度的增大呈现出抛物线趋势,其中硼氢化钠质量浓度为30 g/L时荧光强度最大,因此,本研究选取30 g/L的硼氢化钠进行实验。
2.1.8 灯电流的选择
根据原子荧光原理,尽管光源辐射强度与荧光强度成正比,但并不意味着灯电流越大越好,灯电流太大不仅噪声较大,而且会产生自吸,减少灯的使用寿命;电流太小会导致荧光强度偏低,不利于实验的测定[26]。因此,本研究对仪器的信噪比进行研究,以纯水做研究对象,固定其他变量,通过改变灯电流,计算体系的灵敏度(信号存在)和体系噪音(信号不存在)的数据的商,即信噪比,结果见图7。

图7 灯电流大小对信噪比的影响
Fig.7 Effect of lamp current on signal-to-noise ratio
由图7可以得出,随着灯电流的增大,信噪比也在增大,但其增大的趋势呈现出先快速增大后缓慢增大的趋势,考虑到灯管寿命的因素,选择拐点处30 mA作为本研究的最佳灯电流。
2.1.9 负高压的选择
负高压对原子荧光空白值的影响十分明显,它能够起到很好的调节作用,使得所测的数据准确、可靠[27]。增大负高压,所测的信号强度也会随之增大,同时背景噪声也会增大,负高压太高会使信号不稳定,太低会使灵敏度不够。因此,本研究对仪器的信噪比进行研究,以纯水做研究对象,通过改变负高压大小,探究仪器的信噪比的变化,结果见图8。
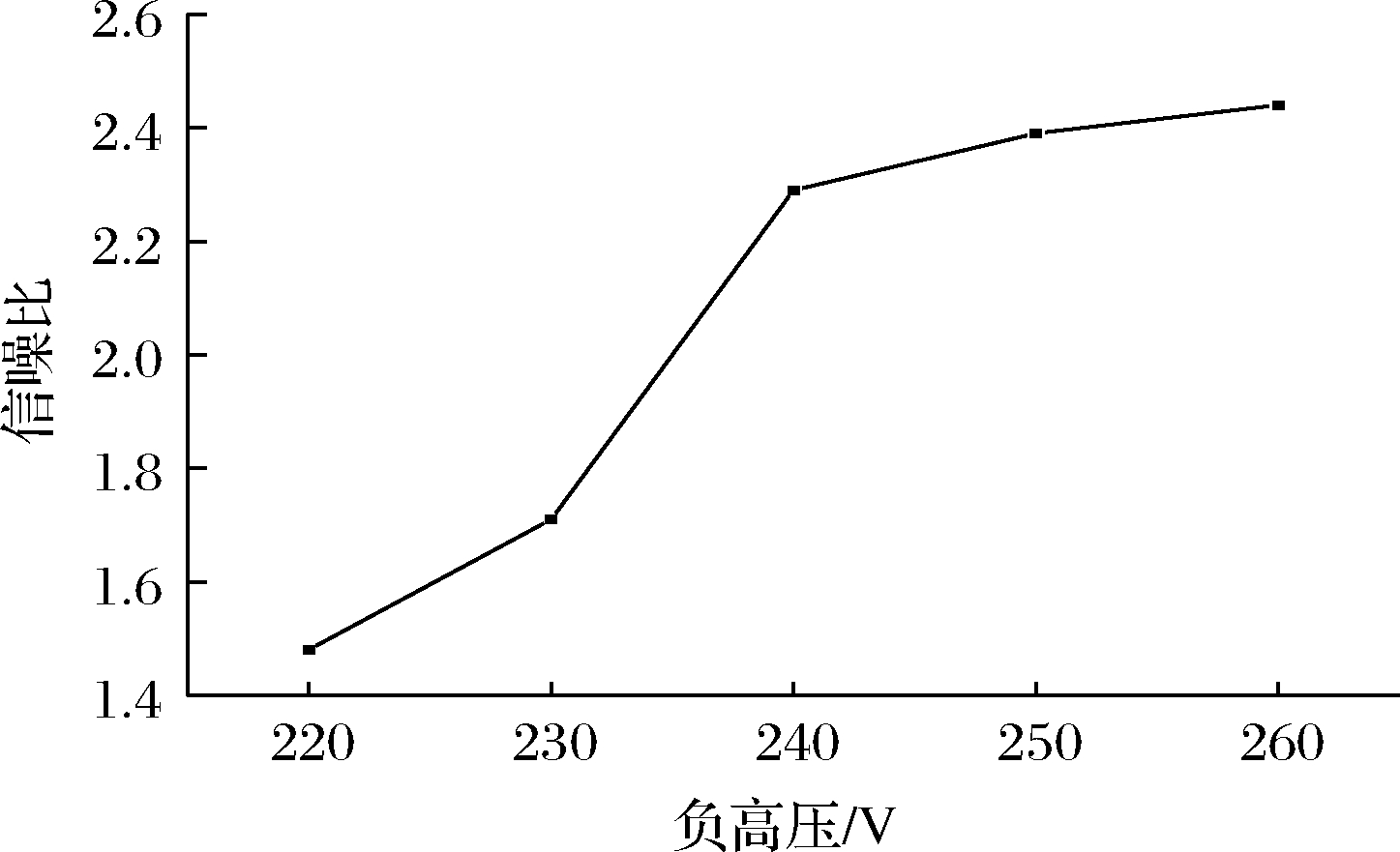
图8 负高压大小对信噪比的影响
Fig.8 Effect of negative high pressure on signal-to-noise ratio
由图8可知,随着负高压的增大,仪器的信噪比也在增大,但是在240 V以后增加的幅度较为平缓,并有趋于稳定的趋势,考虑到负高压太大时也会缩短光电倍增管的使用寿命,最终选定240 V为最佳负高压。
2.2 标准曲线与检出限
配制质量浓度为0、0.05、0.10、0.15、0.20、0.25 ng/mL 的镉标准溶液,按照试验方法在仪器最佳条件下考查其线性范围,在0~0.25 ng/mL范围内,镉标液回归方程为y=9 365.9x+6.9,相关系数r=0.999 8。对样品空白溶液按照试验方法测定11次,计算镉元素的检出限,得本法的仪器检出限为0.001 22 ng/mL,根据称样量可换算方法检出限为0.000 61 mg/kg。
2.3 重复性实验与加标回收试验
按照优化好的试验条件,对红米样品进行7次平行实验,通过计算得其RSD为3.82%,表明该方法的重现性良好。
取红米样品0.1 g于容量瓶中,分别加入3个水平的镉标准溶液,在优化好的实验条件下进行测定,并计算红米的加标回收率,测定结果见表2。结果表明,加标回收率为93.3%~106.7%,RSD为1.62%~4.06%,加标回收率较好,说明该方法测定镉含量准确可靠。
表2 超声辅助浸提法测定红米中镉的含量(n=3)
Table 2 Determination of cadmium content in red rice by ultrasonic-assisted extraction method (n=3)
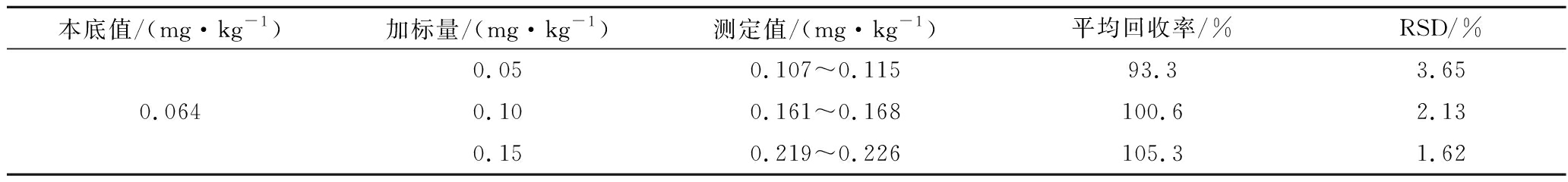
本底值/(mg·kg-1)加标量/(mg·kg-1)测定值/(mg·kg-1)平均回收率/%RSD/%0.050.107~0.11593.33.650.0640.100.161~0.168100.62.130.150.219~0.226105.31.62
2.4 质控样品校验
为进一步验证方法的准确性,按照优化的前处理方法对用国家标准物质GSB-1大米和GSB-22四川大米进行测定,测得结果见表3。由表3可知,测定结果均在标准值范围内,符合证书要求。
表3两种大米标准物质中镉的含量测定(n=3)
Table 3 Determination of cadmium in two rice reference materials (n=3)

样品编号标准值/(ng·g-1)测定浓度/(ng·g-1)RSD/%GSB-1(大米)87±587.52.01GSB-22(四川大米)18±217.33.86
2.5 与文献方法比较
该方法与文献方法在样品前处理时间、前处理试剂消耗、检测仪器、方法检出限、操作简洁性方面进行了综合比较,结果见表4。由表4可以看出,本研究方法相较于文献中的方法更加简单、快速、准确,更加适用于稻米中痕量镉的测定。
表4 方法比较
Table 4 Methods comparison

前处理技术检测对象前处理时间前处理试剂消耗检测仪器方法检出限/(mg·kg-1)操作简洁性参考文献超声辅助稀酸浸提红米等10 min4 mL 50% (体积分数)HClHG-AFS0.000 61简单本文湿法消解(国标法)稻谷放置过夜9 mL HNO3+1 mL HClO4GFAAS0.001复杂[5]干灰化法稻谷≥6 h≥0.5 mL 混合酸(HNO3∶HClO4,体积比9∶1)GFAAS-复杂[5]微波消解稻谷45 min5 mL HNO3+2 mL H2O2GFAAS-一般[5]干灰化法大米>3 h1 mL 混合酸(HNO3∶HClO4,体积比9∶1),3 mL 0.5 mol/L硝酸GFAAS-复杂[6]稀酸振荡浸提大米15 min5 mL 0.5% HNO3+2 mL H2O2GFAAS0.08简单[7]微波消解大米、面粉11 min5 mL HNO3+1 mL H2O2FAAS0.34简单[11]微波消解粮食50 min5 mL HNO3+2 mL H2O2GFAASICP-MS0.4900.474一般复杂[15][15]湿法消解粮食181 min10 mL HNO3+2 mL H2O2ICP-MS0.001复杂[17]稀酸浸提大米11 min1 mL 2%(体积分数)HNO3DBD-AES0.011 9简单[19]湿法消解大米放置过夜4 mL HNO3+1 mL HClO4HG-AFS-复杂[22]
注:表中-为文献中未注明
2.6 稻米样品分析
采用优化好的前处理及检测方法,对市售稻米样品和不同污染程度大米中的镉进行测定,同时与国标方法GB 5009.15—2014《食品安全国家标准 食品中镉的测定》中的湿法消解法进行对比,结果见表5。结果显示,稻米样品中红米、大米中含有痕量镉,但均未超过GB 2762—2017《食品安全国家标准 食品中污染物限量》指出的镉元素限量值0.2 mg/kg,其他的均为未检出。对比本方法与国标方法测定值,发现两者的值基本相符,相比较之下,超声辅助稀酸浸提法具有耗时短、试剂消耗小、反应条件温和等优点,而且测定结果准确可靠,用于稻米中痕量镉的测定具有一定的普适性。
表5 各稻米样品的镉含量(n=3)
Table 5 Cadmium content in rice samples (n=3)

样品名称元素含量/(mg·kg-1)国标方法测定值/(mg·kg-1)样品名称元素含量/(mg·kg-1)国标方法测定值/(mg·kg-1)大米0.002±0.0010.000 2125大米0.163±0.0060.165糯米ND-126大米0.005±0.0010.006红米0.064±0.0030.066165大米0.036±0.0020.037黑米ND-190大米0.124±0.0040.126214大米0.119±0.0040.120
注:表中ND表示未检出
3 结论
本研究基于微型氢化物发生原子荧光仪,建立了一种简单、快速、准确的测定稻米中痕量镉的分析方法——超声辅助稀酸浸提法。通过对比4种辅助浸提方式及其他条件,优选出最佳试验条件。该方法的精密度和准确度较好,对国家标准物质GSB-1大米和GSB-22四川大米进行分析,测定结果均在标准值范围内。与国标中湿法消解法对比,稻米中镉的测定值保持一致;与传统方法对比,该方法更加快速高效,不仅操作简单,试剂用量少,而且不需要赶酸,前处理时间仅需10 min。相比之下,该方法更加适用于稻米样品的快速筛选,可用于稻米等谷物粮食中镉元素的现场测定。
[1] HU A Y, CHENG H F.Control of mercury emissions from stationary coal combustion sources in China:Current status and recommendations[J].Environmental Pollution, 2016, 218:1 209-1 221.
[2] 王瑛, 林钰清, 李爱军, 等.重金属危害机制及益生菌清除重金属机制研究进展[J].食品与发酵工业, 2020, 46(3):281-292.
WANG Y, LIN Y Q, LI A J, et al.Research progress on the mechanism of heavy metal contamination and probiotics sequestration[J].Food and Fermentation Industries, 2020, 46(3):281-292.
[3] 张瑞莉, 郭家柱, 肖开德, 等.石墨炉原子吸收法测定稻谷中镉含量前处理方法比较[J].农产品加工, 2020, 19(19):66-68.
ZHANG R L, GUO J Z, XIAO K D, et al.Comparison of pretreatment methods for determination of cadmium content in rice by graphite furnace atomic absorption spectrometry[J].Farm Products Processing, 2020, 19(19):66-68.
[4] 蒋昭琼, 程方平, 罗芳, 等.干法消解测定大米中的铅镉铬[J].食品研究与开发, 2016, 37(14):136-139.
JIANG Z Q, CHENG F P, LUO F, et al.Determination of plumbum, cadmium and chromium in rice by dry digestion process[J].Food Research and Development, 2016, 37(14):136-139.
[5] 周明慧, 王松雪, 伍燕湘.稀酸温和提取直接进样快速测定大米中镉含量[J].中国粮油学报, 2015, 30(2):97-102.
ZHOU M H, WANG S X, WU Y X.Rapid direct sampling detection of Cd in rice using diluted acid extraction[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(2):97-102.
[6] G MEZ-NIETO B, MOTYZHOV V, GISMERA M J, et al.Fast-sequential determination of cadmium and copper in milk powder and infant formula by direct solid sampling high-resolution continuum source graphite furnace atomic absorption spectrometry[J].Microchemical Journal, 2020, 159:105335.
MEZ-NIETO B, MOTYZHOV V, GISMERA M J, et al.Fast-sequential determination of cadmium and copper in milk powder and infant formula by direct solid sampling high-resolution continuum source graphite furnace atomic absorption spectrometry[J].Microchemical Journal, 2020, 159:105335.
[7] 王松, 毕容, 褚添, 等.微波消解-石墨炉原子吸收法对多种进口婴幼儿米粉中铅、镉的测定分析[J].中国卫生检验杂志, 2022, 32(4):415-417.
WANG S, BI R, CHU T, et al.Determination and analysis of lead and cadmium in a variety of imported rice noodles for infants and young children by microwave digestion-atomic absorption graphite furnace method[J].Chinese Journal of Health Laboratory Technology, 2022, 32(4):415-417.
[8] 刘全德, 刘恩岐, 陈尚龙, 等.微波消解-石墨炉原子吸收光谱法测定蛋白质粉中镉[J].食品与发酵工业, 2011, 37(10):168-173.
LIU Q D, LIU E Q, CHEN S L, et al.Determination of cadmium in protein powder by microwave digestion-GFAAS[J].Food and Fermentation Industries, 2011, 37(10):168-173.
[9] 刘建波, 张君才, 王晓玲, 等.微波消解-火焰原子吸收光谱法测定粮食中的镉[J].光谱实验室, 2013, 30(1):364-366.
LIU J B, ZHANG J C, WANG X L, et al.Determination of cadmium in grain by FAAS with microwave digestion[J].Chinese Journal of Spectroscopy Laboratory, 2013, 30(1):364-366.
[10] 周明慧, 张洁琼, 高树林, 等.稀酸温和提取-火焰原子荧光光谱法快速测定谷物中镉的含量[J].分析试验室, 2018, 37(12):1 389-1 392.
ZHOU M H, ZHANG J Q, GAO S L, et al.Rapid detection of Cd incereals using diluted acid extraction coupled with flame atomic fluorescence spectrometer[J].Chinese Journal of Analysis Laboratory, 2018, 37(12):1 389-1 392.
[11] 周美丽, 杨子秋, 杨伟, 等.3种前处理方法在电感耦合等离子体质谱测定螺旋藻中铅、镉含量的比较[J].食品与发酵工业, 2018, 44(12):256-260.
ZHOU M L, YANG Z Q, YANG W, et al.Comparison of the different preparation methods for determination of lead and cadmium in Spirulina by inductively coupled plasma mass spectrometry[J].Food and Fermentation Industries, 2018, 44(12):256-260.
[12] 范晓旭, 周美丽, 杨春花, 等.超声酶提取-电感耦合等离子体质谱法测定藻类中的锰、锌、锶、镉含量[J].食品与发酵工业, 2020, 46(12):271-276.
FAN X X, ZHOU M L, YANG C H, et al.Determination of Mn, Zn, Sr and Cd in algae by ICP-MS with ultrasonic enzyme extraction[J].Food and Fermentation Industries, 2020, 46(12):271-276.
[13] 戴冠苹, 高敬铭, 张红云, 等.ICP-MS和GFAAS测定粮食中镉的对比研究[J].粮油食品科技, 2018, 26(4):36-39.
DAI G P, GAO J M, ZHANG H Y, et al.Comparative study on the determination of cadmium in grain by ICP-MS and GFAAS[J].Science and Technology of Cereals, Oils and Foods, 2018, 26(4):36-39.
[14] ZHANG Y, MAO X F, LIU J X, et al.Direct determination of cadmium in foods by solid sampling electrothermal vaporization inductively coupled plasma mass spectrometry using a tungsten coil trap[J].Spectrochimica Acta Part B:Atomic Spectroscopy, 2016, 118:119-126.
[15] 李丽娜, 郝晓莉, 詹德江, 等.ICP-MS法同时测定粮食中6种重金属元素含量的研究[J].辽宁农业科学, 2021, 62(1):22-25.
LI L N, HAO X L, ZHAN D J, et al.Determination of 6 kinds of heavy metal elements in grain by ICP-MS at the same time[J].Liaoning Agricultural Sciences, 2021, 62(1):22-25.
[16] SHAO Z Y, XUE M, LIU Q, et al.Determination of cadmium in rice bran oils by ICP-MS with rapid ultrasound-assisted acid leaching extraction[J].Journal of Consumer Protection and Food Safety, 2020, 15(2):193-198.
[17] JIANG J, LI Z L, WANG Y Y, et al.Rapid determination of cadmium in rice by portable dielectric barrier discharge-atomic emission spectrometer[J].Food Chemistry, 2020, 310:125824.
[18] ZHANG B, QU C L, PANG L Y, et al.Rapid determination of cadmium in rice and wheat by solid sampling plasma jet atomic emission spectrometry (PJ-AES)[J].Analytical Letters, 2022, 55(8):1 207-1 216.
[19] ZHANG J Y, FANG J L, DUAN X C.Determination of cadmium in water samples by fast pyrolysis-chemical vapor generation atomic fluorescence spectrometry[J].Spectrochimica Acta Part B:Atomic Spectroscopy, 2016, 122:52-55.
[20] 李小燕, 张硕, 罗文明, 等.氢化物发生-原子荧光光谱法测定大米中镉方法探讨[J].应用预防医学, 2015, 21(2):135-138.
LI X Y, ZHANG S, LUO W M, et al.Determination of cadmium in rice by hydride generation-atomic fluorescence spectrometry[J].Journal of Applied Preventive Medicine, 2015, 21(2):135-138.
[21] FENG L, LIU J X.Solid sampling graphite fibre felt electrothermal atomic fluorescence spectrometry with tungsten coil atomic trap for the determination of cadmium in food samples[J].Journal of Analytical Atomic Spectrometry, 2010, 25(7):1 072-1 078.
[22] LEI Z R, CHEN L Q, HU K, et al.Non-aqueous phase cold vapor generation and determination of trace cadmium by atomic fluorescence spectrometry[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 203:522-527.
[23] 杨有泽, 杨珍, 贺攀红, 等.盐酸振荡浸取-原子荧光光谱法测定大米中的痕量镉[J].食品安全质量检测学报, 2021, 12(3):1 107-1 112.
YANG Y Z, YANG Z, HE P H, et al.Determination of trace cadmium in rice by atomic fluorescence spectrometry with hydrochloric acid oscillating extraction[J].Journal of Food Safety and Quality, 2021, 12(3):1 107-1 112.
[24] TIWARI B K.Ultrasound:A clean, green extraction technology[J].TrAC Trends in Analytical Chemistry, 2015, 71:100-109.
[25] 李金桥. 原子荧光法测定镉元素的技术研究[J].生物化工, 2020, 6(1):91-93.
LI J Q.Atomic Fluorescence determination of cadmium[J].Biological Chemical Engineering, 2020, 6(1):91-93.
[26] 邓勃.应用原子吸收与原子荧光光谱分析[M].北京:化学工业出版社, 2003.
DENG B.Application of Atomic Absorption and Atomic Fluorescence Spectrometry[M].Beijing:Chemical Industry Press, 2003.
[27] 胡刚, 童诚, 马文, 等.原子荧光使用中影响空白值的因素分析[J].计测技术, 2015, 35(S1):250-251.
HU G, TONG C, MA W, et al.Analysis of factors affecting the blank value in the use of atomic fluorescence[J].Metrology &Measurement Technology, 2015, 35(S1):250-251.