地参(Lycopus lucidus)是唇形科地笋属植物泽兰的根部,性平或微温,能活血化瘀、解毒消痈、利水消肿[1],是一种药食同源的植物。在我国重庆、四川、云南、贵州等多地均有分布。经研究表明,地参含有多酚类、三萜类、黄酮类等活性成分[2-4]。总黄酮是地参中重要的活性成分之一,抗氧化、抗心脑血管缺血性疾病、抗炎能力出众[5-8]。因此,总黄酮也是衡量地参品质的重要成分之一。但是对其含量测定的研究较少。总黄酮的测定方法多种多样,有NaNO2-Al(NO3)3-NaOH比色法、AlCl3-KAc比色法、三乙胺比色法、HCl-Mg法、KOH比色法[9]。响应面Box-Behnken设计是一种基于三水平的二阶试验设计方法,采用多元二次方程拟合因素和响应值之间的关系,找出最优的工艺参数,此方法在食品、中药等领域中高频使用。测量不确定度直接影响检测结果的判定,通过不确定度的评定,可以得到被测量值的合理分布区间,使最终实验结果由单一数值变为可能分布的数值范围,可以减小实验结果被判定为不合理实验结果的概率,大大提高检验结果的准确性。它也是定量说明检测结果质量的参数,检测结果的可靠性很大程度上取决于测量不确定度大小,测量不确定度越小,说明检测水平越高。在有关地参黄酮的研究报告中,不同产地地参中黄酮含量差异巨大,甚至在同一产地中,不同植株地参总黄酮含量的差距也不小,因此本文优化了在NaNO2-Al(NO3)3-NaOH显色体系下分光光度法对地参总黄酮含量检测方法并参考 CNAS-GL006—2019《化学分析中不确定度的评估指南》,JJF1059.1—2012《测量不确定度评定与表示》,GB/T 27025—2019《检测和校准实验室能力的通用要求》对其不确定度进行评定。
1 材料与方法
1.1 材料与试剂
地参,重庆市万州区恒合乡石桶寨村种植地;标准品芦丁(批号:DST1812221-156)、异槲皮苷(批号:DST180108-006)、芹菜素(批号:DST171118-026)、木犀草苷(批号:DST160928-016)、槲皮素(批号:DST173637-045)、木犀草素(批号:DST180328-032),成都德思特生物技术有限公司;亚硝酸钠、硝酸铝、氢氧化钠等均为分析纯。
1.2 仪器与设备
FA1004型电子天平,上海舜宇恒平科学仪器有限公司;YRE-2000A型旋转蒸发仪,巩义市予华仪器有限公司;V-1200型紫外可见分光光度计,上海美谱达仪器有限公司;UV-2450全波长紫外分光光度计,岛津仪器(苏州)有限公司;HSY-26型水浴锅,上海跃进医疗器械有限公司。
1.3 实验方法
1.3.1 供试品溶液的制备
精密称定地参粉末0.5 g(过60目筛)至茄形瓶中,加入体积分数为60%的乙醇30 mL[料液比(g∶mL)1∶60],回流2 h,温度设置为70 ℃,回流结束后离心收集滤液,蒸干,用60%乙醇定容至20 mL容量瓶中,备用[6]。
1.3.2 对照品溶液的制备
精密称取7.8 mg芦丁和适量槲皮素、异槲皮苷、芹菜素、木犀草素、木犀草苷于25 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
1.3.3 标准曲线的制备
使用5 mL移液管,精密吸取芦丁对照品溶液0.3、0.6、0.9、1.2、1.5、1.8、2.1、2.4、2.7 mL,分别置于10 mL量瓶中,分别加入50 g/L亚硝酸钠0.3 mL,混匀,放置3 min,然后加入100 g/L硝酸铝0.3 mL,混匀,再放置4 min;加入1 mol/L氢氧化钠溶液4 mL,用60%乙醇稀释至刻度,混匀,放置11 min,以相应的试剂为空白,照紫外可见分光光度计于510 nm处测定吸光度,以芦丁对照品溶液质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程Y=10.071X-0.007 4(R2=0.999 9),证明芦丁在0.009 36~0.084 24 mg/mL的质量浓度下拥有良好的线性关系。
1.3.4 总黄酮的显色体系
NaNO2-Al(NO3)3-NaOH法:取10 mL 容量瓶,加入 0.2 mL 供试品溶液,先加 0.3 mL 50 g/L NaNO2溶液,摇匀,静置 3 min;然后加入 0.3 mL 100 g/L Al(NO3)3溶液,摇匀,静置 4 min;最后加入 1 mol/L NaOH 溶液 4.0 mL, 用 60%乙醇定容, 摇匀,放置11 min后测定吸光度并记录[10]。
AlCl3-KAc法:取10 mL容量瓶,加供试品溶液0.2 mL,加0.1 mol/L A1Cl3溶液1 mL,1 mol/L KAc溶液1.5 mL,用60%乙醇定容,摇匀即得。测定吸光度并记录[11]。
三乙胺法:取10 mL容量瓶。加供试品溶液0.2 mL,加60%乙醇溶液5 mL,再用1%(体积分数)三乙胺溶液定容,摇匀即得,测定吸光度并记录[12]。
2 结果与分析
2.1 显色体系和吸收波长的选择
精密量取适量芦丁、槲皮素、异槲皮苷、芹菜素、木犀草素、木犀草苷6种对照品溶液和供试品溶液,分别置于10 mL容量瓶中,按照“1.3.4”节下的3种显色体系进行显色试验,在波长200~600 nm内测量吸光度,部分吸收波长结果见图1。在NaNO2-Al(NO3)3-NaOH显色体系中,供试品与芦丁对照品吸收波长最为相似,且两者的最大吸收波长最为接近,故本文采用NaNO2-Al(NO3)3-NaOH体系进行显色试验,并选择芦丁为对照品,吸收波长为510 nm。

A-NaNO2-Al(NO3)3-NaOH法显色;B-AlCl3-KAc法显色;C-三乙胺法显色
图1 供试品和对照品溶液显色后的吸收光谱图
Fig.1 Absorption spectra of test and reference solutions after color reaction
2.2 NaNO2-Al(NO3)3-NaOH显色体系单因素考察
2.2.1 亚硝酸钠、硝酸铝、氢氧化钠加入量和显色温度的考察
各取10 mL容量瓶,照“2.1”节选择的显色体系进行显色试验,加入供试品溶液0.2 mL,加入亚硝酸钠溶液0.5、0.7、0.9、1.1、1.3 mL;加入硝酸铝溶液0.1、0.3、0.5、0.7、0.9 mL;氢氧化钠溶液加入量2、3、4、5、6 mL;显色温度分别是20、30、40、50、60 ℃。单因素考察图如图2所示。

A-亚硝酸钠溶液;B-硝酸铝溶液;C-氢氧化钠溶液;D-温度
图2 亚硝酸钠、硝酸铝及氢氧化钠加入量和温度对地参黄酮提取液含量的影响
Fig.2 Effects of sodium nitrite, aluminum nitrate and sodium hydroxide additional content and temperature on the content influence of Lycopus lucidus flavonoids extract solution
2.3 Box-Behnken设计与数据分析
根据单因素试验的结果,选择亚硝酸钠(X1)、硝酸铝(X2)、氢氧化钠(X3)、温度(X4)为自变量,所测得的含量(Y)为因变量运用Design-Expert 12进行Box-Behnken设计(以下简称BBD设计)和数据分析,具体试验因素和水平见表1。
表1 Box-Behnken设计因素和水平
Table 1 The factors and levels of Box-Behnken design
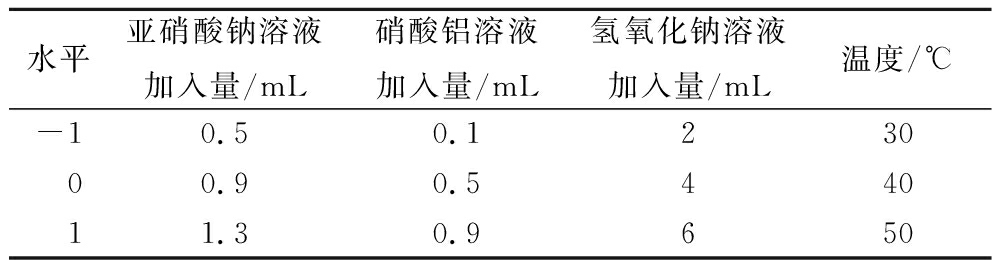
水平亚硝酸钠溶液加入量/mL硝酸铝溶液加入量/mL氢氧化钠溶液加入量/mL温度/℃-10.50.123000.90.544011.30.9650
根据BBD方法原理,采用Design-Expert 12软件设计4因素3水平的试验,测定时,每次试验平行测定4次,试验方案及结果见表2。利用Design-Expert 12建立含量(Y)与亚硝酸钠(X1)、硝酸铝(X2)、氢氧化钠(X3)、温度(X4)的二次多项回归方程模型:
表2 Box-Behnken设计试验与结果
Table 2 The experiment and results of Box-Behnken design
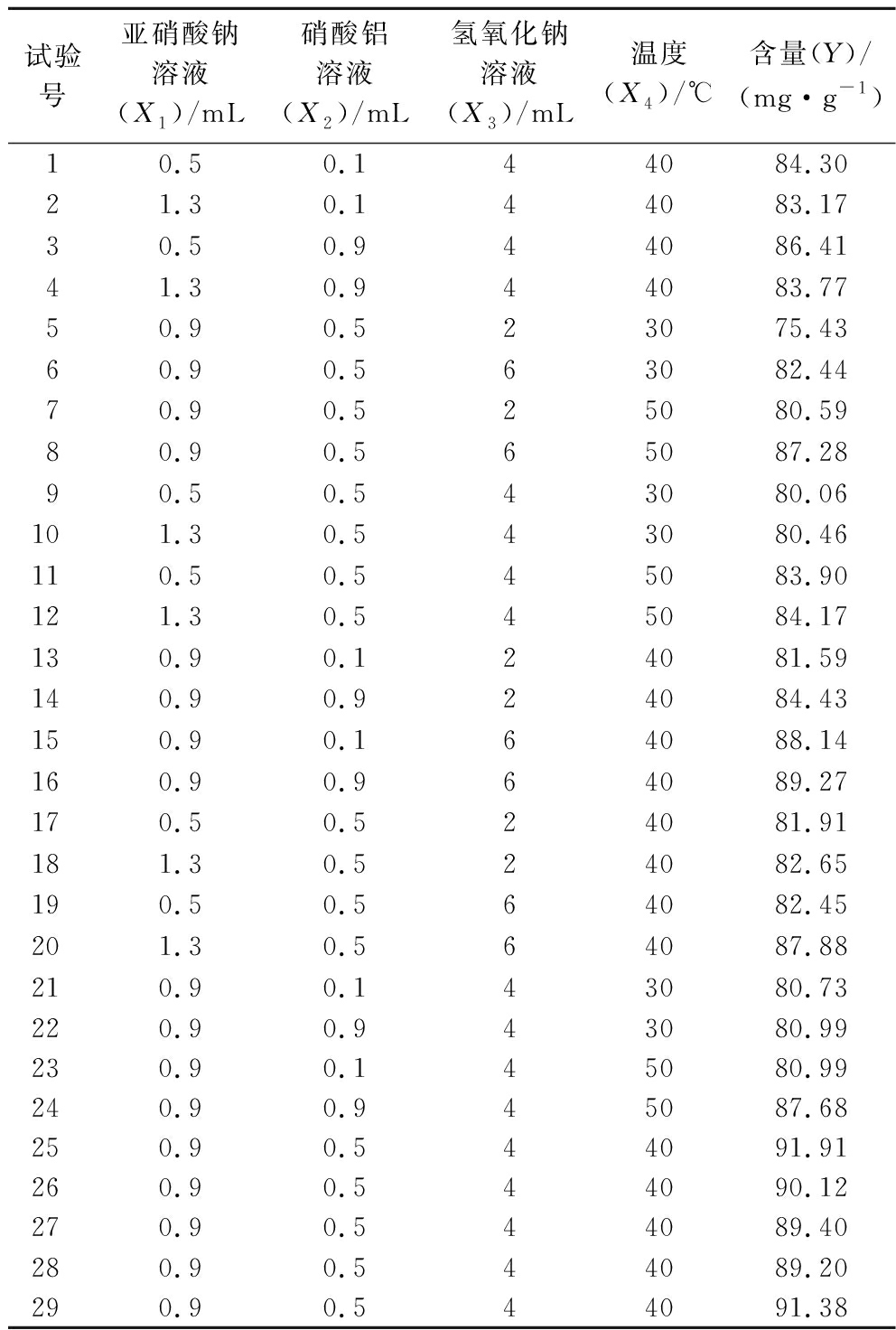
试验号亚硝酸钠溶液(X1)/mL硝酸铝溶液(X2)/mL氢氧化钠溶液(X3)/mL温度(X4)/℃含量(Y)/(mg·g-1)10.50.144084.3021.30.144083.1730.50.944086.4141.30.944083.7750.90.523075.4360.90.563082.4470.90.525080.5980.90.565087.2890.50.543080.06101.30.543080.46110.50.545083.90121.30.545084.17130.90.124081.59140.90.924084.43150.90.164088.14160.90.964089.27170.50.524081.91181.30.524082.65190.50.564082.45201.30.564087.88210.90.143080.73220.90.943080.99230.90.145080.99240.90.945087.68250.90.544091.91260.90.544090.12270.90.544089.40280.90.544089.20290.90.544091.38
Y=90.4+0.253 8X1+1.14X2+2.57X3+2.04X4-0.380 6X1X2+1.17X1X3-0.033 1X1X4-0.430 3X2X3+1.61X2X4-0.082 ![]()
由表3可知,含量的回归模型显著(P<0.05),表明模型具有统计学意义;失拟项P=0.256 2>0.05;校正系数Adj R2=0.843 5;Predict R2=0.603,表明模型能很好的反应实验结果,模型拟合度良好。
表3 含量的回归方程系数及方差分析表
Table 3 Regression equation coefficient and variance analysis table of content
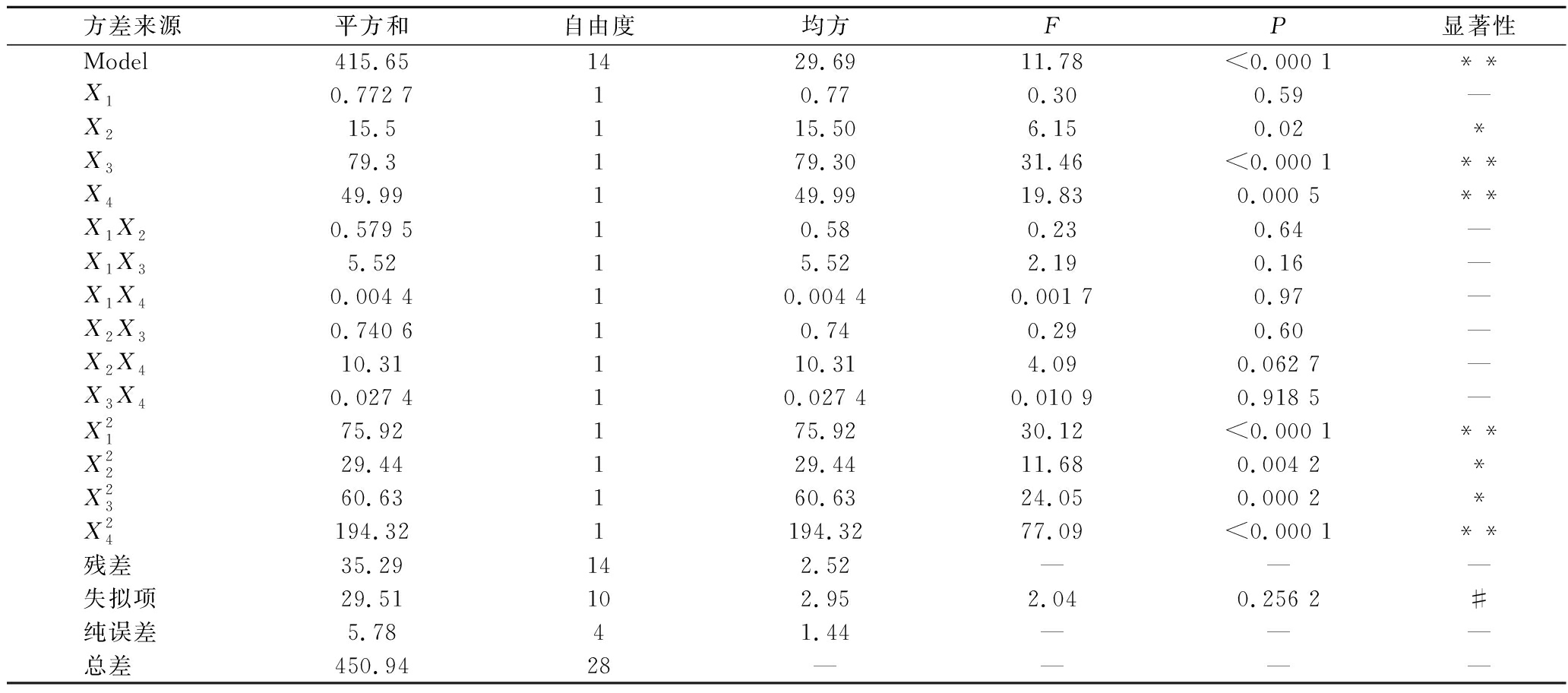
方差来源平方和自由度均方FP显著性Model415.651429.6911.78<0.000 1**X10.772 710.770.300.59—X215.5115.506.150.02*X379.3179.3031.46<0.000 1**X449.99149.9919.830.000 5**X1X20.579 510.580.230.64—X1X35.5215.522.190.16—X1X40.004 410.004 40.001 70.97—X2X30.740 610.740.290.60—X2X410.31110.314.090.062 7—X3X40.027 410.027 40.010 90.918 5—X2175.92175.9230.12<0.000 1**X2229.44129.4411.680.004 2*X2360.63160.6324.050.000 2*X24194.321194.3277.09<0.000 1**残差35.29142.52———失拟项29.51102.952.040.256 2#纯误差5.7841.44———总差450.9428————
注:*差异显著(P<0.05);**差异极显著(P<0.01);#差异P>0.05表示不显著;—表示无数据
2.4 工艺优化与预测
图3表明了X1(亚硝酸钠溶液加入量)、X2(硝酸铝溶液加入量)、X3(氢氧化钠溶液加入量)和X4(温度)4个因素之间的交互作用。响应面的陡峭程度与该交互的因素对提取率的影响成正比。通过对以上结果的分析发现,实验优化后的最佳显色条件为50 g/L亚硝酸钠0.9 mL,100 g/L硝酸铝0.6 mL,1 mol/L氢氧化钠4.8 mL和显色温度在42 ℃时为最佳显色条件,此条件下检测出黄酮含量为91.352 mg/g,提取率为9.1%。

图3 各因素对响应值影响的三维效应曲面图
Fig.3 3D Effect surface plot of the effects of various factors on the response value
2.5 验证实验
为检验分析结果的可靠性,按照“1.3.4”节下NaNO2-Al(NO3)3-NaOH法的条件对同一批供试品显色,平行测定3次,测得总黄酮平均含量为(91.052±2.75) mg/g。预测值与实际值之间偏差极小,说明响应面所得到的优化条件符合设计目标。
2.6 方法学验证
2.6.1 精密度实验
精密量取芦丁对照品溶液2 mL,置10 mL容量瓶中,平行配制6份,按“1.3.4”节NaNO2-Al(NO3)3-NaOH法方法进行显色,在510 nm测定吸光度。结果RSD为0.23%,表明方法精密度良好。
2.6.2 重复性试验
按“1.3.1”节制备供试品溶液6份,按“1.3.4”节NaNO2-Al(NO3)3-NaOH法方法进行显色,在510 nm 测定吸光度,计算含量。结果供试品总黄酮平均含量为89.994 mg/g,RSD为0.01%, 表明方法重复性良好。
2.6.3 稳定性试验
按“1.3.1”节制备供试品溶液,于制备供试品溶液后的0、1、2、4、8 h精密量取供试品溶液0.2 mL于10 mL容量瓶中,按“1.3.4”节NaNO2-Al(NO3)3-NaOH法方法进行显色,在510 nm测定吸光度,结果在预定的时间内,供试品溶液吸光度平均值为0.443,RSD为2.6%,表明在8 h内,供试溶液稳定性良好。
2.6.4 加样回收率试验
取总黄酮质量分数已知的样品1 g,精密称定6份,分别加入对照品50.3 mg, 按“1.3.1”节方法制备供试品溶液,按“1.3.4”节NaNO2-Al(NO3)3-NaOH法方法进行显色,在510 nm测定吸光度,计算加样回收率,结果显示平均加样回收率为(99.93±1.49)%,其RSD为1.49%,见表4,表明方法的加样回收率符合要求。
表4 总黄酮加样回收率试验结果
Table 4 The recovery results of total flavonoids
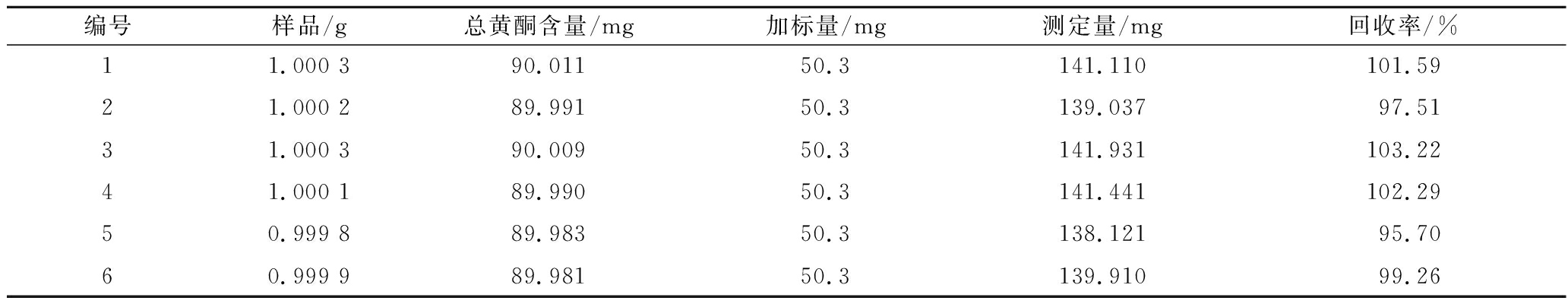
编号样品/g总黄酮含量/mg加标量/mg测定量/mg回收率/%11.000 390.01150.3141.110101.5921.000 289.99150.3139.03797.5131.000 390.00950.3141.931103.2241.000 189.99050.3141.441102.2950.999 889.98350.3138.12195.7060.999 989.98150.3139.91099.26
2.7 总黄酮含量检测的不确定度评定
2.7.1 本实验不确定度的主要来源
(1)供试品溶液制备引入的不确定度;(2)对照品溶液制备引入的不确定度;(3)显色体系引入的不确定度;(4)标准曲线拟合引入的不确定度。
2.7.2 供试品溶液的制备引入的不确定度
供试品溶液制备主要使用的仪器有:万分之一分析天平[13]、50 mL量筒[14]和20 mL容量瓶[15],制备的溶液在标定和实验时的温差在±3 ℃,其不确定度来源,分布情况,不确定度和标准不确定见表5。
表5 供试品溶液的制备引入的不确定度
Table 5 The uncertainties introduced by preparation of test solutions

仪器来源分布标准偏差各分量的不确定度不确定度相对不确定度万分之一分析天平校准 重复性均匀分布三角分布0.1 mg0.05 mgU(1w.1)=0.1/3=0.057 8 mgU(1w.2)=0.05 mgU(1w)=0.076 425 mgU(rel.1w)=0.000 15350 mL量筒校准 重复性温差 三角分布正态分布均匀分布0.05 mL0.097 mL0.031 5 mLU(l1)=0.5/6=0.2 mL0.097 mLU(l3)=0.018 9/3=0.0109 mLU(l)=0.222 5 mLU(rel.l)=0.007 41820 mL容量瓶校准 重复性温差 三角分布正态分布均匀分布0.03 mL0.039 mL0.012 6 mLU(v20.1)=0.03/6=0.122 mL0.039 mLU(v20.3)=0.012 6/3=0.007 3 mLU(v20)=0.128 3 mLU(rel.v20)=0.006 415
2.7.3 对照品溶液的制备引入的不确定度
对照品溶液制备[16]主要使用的仪器有:十万分之一分析天平和25 mL容量瓶。其不确定度来源,分布情况,不确定度和标准不确定见表6。
表6 对照品溶液的制备引入的不确定度
Table 6 The uncertainties introduced by preparation of standards solutions

仪器来源分布标准偏差各分量的不确定度不确定度相对不确定度十万分之一分析天平校准 重复性均匀分布三角分布0.01 mg0.02 mgU(10w.1)=0.01/3=0.005 78 mgU(10w.2)=0.02 mgU(10w)=0.020 8 mgU(rel.10w)=0.002 66925 mL容量瓶校准 重复性温差 三角分布正态分布均匀分布0.03 mL0.004 3 mL0.015 7 mLU(v25.1)=0.03/6=0.012 2 mL0.004 3 mLU(v25.3)=0.015 7/6=0.009 1 mLU(v25)=0.015 8 mLU(rel.v25)=0.005 2
2.7.4 显色体系引入的不确定度
供试品溶液制备主要使用的仪器有[17]:1 mL移液管、5 mL移液管和10 mL容量瓶,其不确定度来源、分布情况、不确定度和标准不确定见表7。
表7 显色体系引入的不确定度
Table 7 Uncertainty introduced by the color reaction
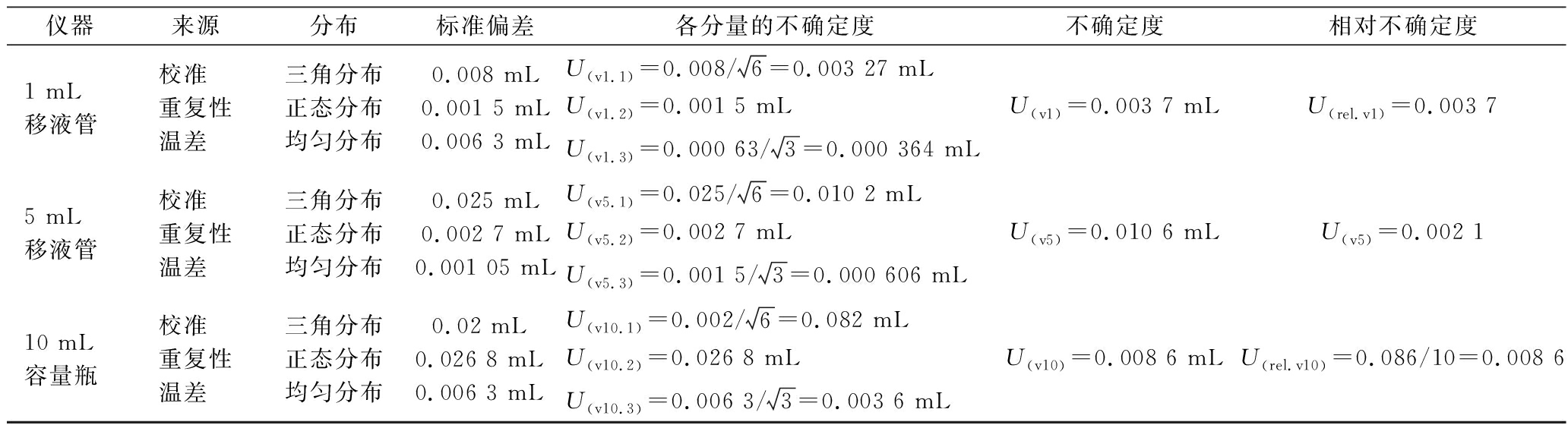
仪器来源分布标准偏差各分量的不确定度不确定度相对不确定度1 mL移液管校准 重复性温差 三角分布正态分布均匀分布0.008 mL0.001 5 mL0.006 3 mLU(v1.1)=0.008/6=0.003 27 mLU(v1.2)=0.001 5 mLU(v1.3)=0.000 63/3=0.000 364 mLU(v1)=0.003 7 mLU(rel.v1)=0.003 75 mL移液管校准 重复性温差 三角分布正态分布均匀分布0.025 mL0.002 7 mL0.001 05 mLU(v5.1)=0.025/6=0.010 2 mLU(v5.2)=0.002 7 mLU(v5.3)=0.001 5/3=0.000 606 mLU(v5)=0.010 6 mL U(v5)=0.002 110 mL容量瓶校准 重复性温差 三角分布正态分布均匀分布0.02 mL0.026 8 mL0.006 3 mLU(v10.1)=0.002/6=0.082 mLU(v10.2)=0.026 8 mLU(v10.3)=0.006 3/3=0.003 6 mLU(v10)=0.008 6 mL U(rel.v10)=0.086/10=0.008 6
2.7.5 标准曲线拟合引入的不确定度
精密吸取芦丁对照品溶液0.3、0.6、0.9、1.2、1.5、1.8、2.1、2.4、2.7 mL,分别置于10 mL量瓶中,分别加入50 g/L亚硝酸钠0.3 mL,混匀,放置3 min,然后加入100 g/L硝酸铝0.3 mL,混匀,再放置4 min;加入1 mol/L氢氧化钠溶液4 mL,用60%乙醇稀释至刻度,混匀,放置11 min,以相应的试剂为空白,照紫外可见分光光度法于510 nm处测定吸光度,以芦丁对照品溶液质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,并求得标准曲线的回归方程[18]:Y=10.071X-0.007 4由此可得:斜率a=10.071,截距b=-0.007 4,R2=0.999 9,证明芦丁在0.009 36~0.084 24 mg/mL的质量浓度下拥有良好的线性关系。
取响应面优化验证时供试品溶液一份,平行测定2次,由方程求得c0=0.045 7 mg/mL,评估方法如公式(1)所示:
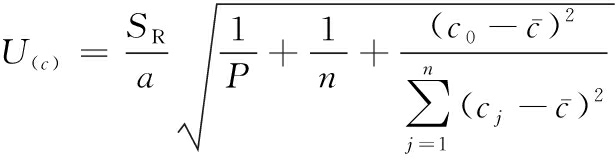
(1)
式中:U(c),标准曲线拟合时引入的不确定度;SR,工作曲线的标准偏差;P,每份供试品溶液平行测定2次;n,标准曲线测量次数,制备过程中测定了9个浓度,每个浓度测定2次,共18次测量;c0,常数,值为:0.045 7;cj,芦丁标准溶液的浓度值,![]() 标准曲线浓度的平均值;a,标准曲线的斜率,值为10.071;
标准曲线浓度的平均值;a,标准曲线的斜率,值为10.071;
测定溶液的标准偏差如公式(2)所示:
(2)
式中:cj,芦丁标准溶液的浓度值,![]() 标准曲线浓度的平均值。
标准曲线浓度的平均值。
标准曲线的标准偏差计算过程及结果如公式(3)所示:
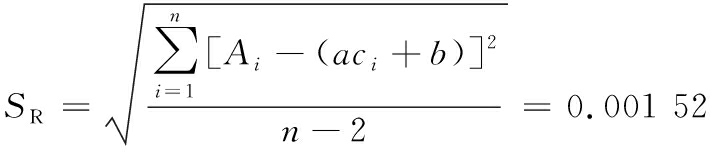
(3)
式中:Ai,标准溶液吸光度测定值;a,标准曲线的斜率,10.071;ci,标准溶液芦丁的浓度值,mg/mL;b,标准曲线截距,-0.007 4;n,标准曲线测量次数,制备过程中测定了9个浓度,每个浓度测定2次,共18次测量。
将公式(2)、公式(3)带入公式(1)中,得到:
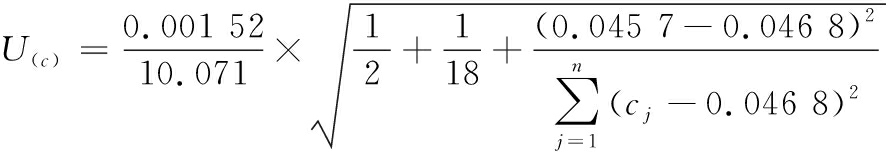
=0.000 112
标准曲线引入的不确定度为![]()
2.7.6 计算合成不确定度
由上述各不确定度分量合成地参中总黄酮的标准不确定度为[19]:
=0.015 11
各不确定度分量对相对标准不确定度的贡献率如图4所示。
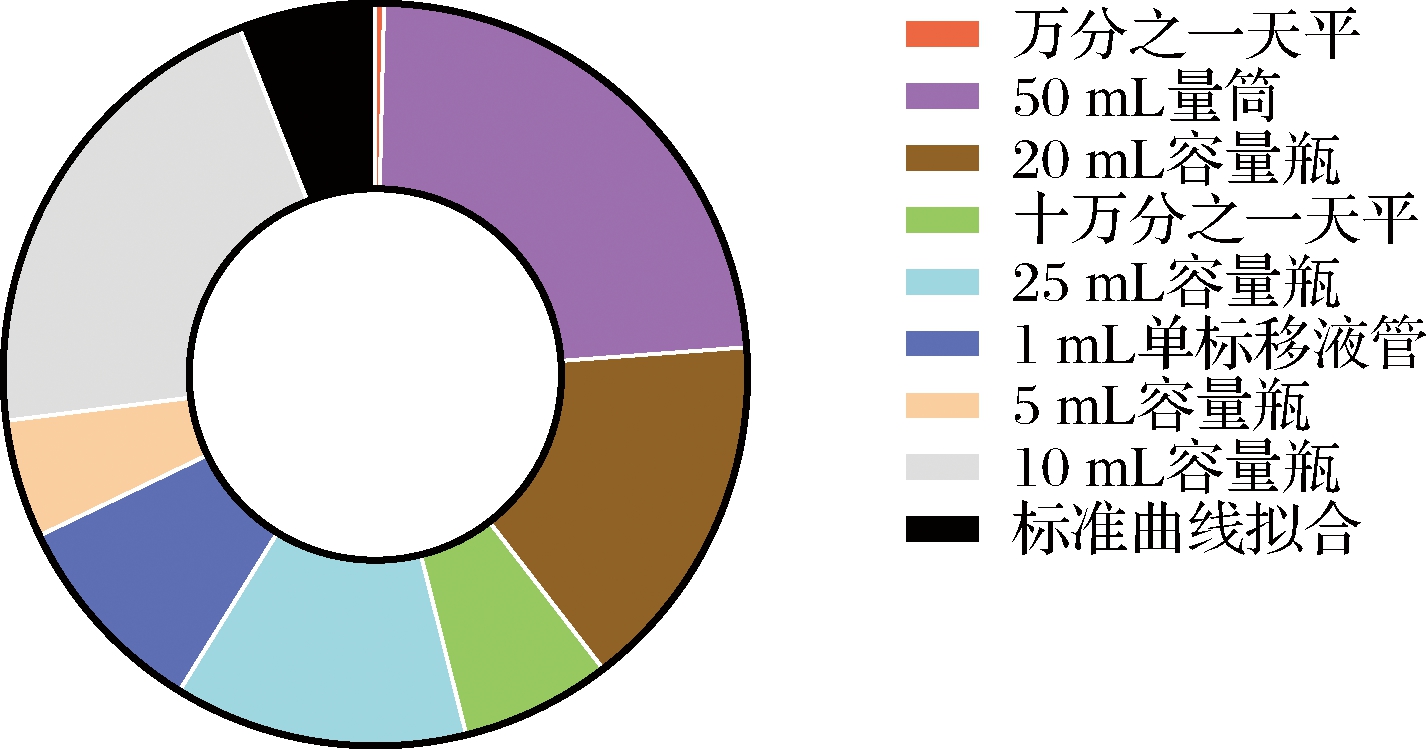
图4 合成相对不确定度分量比较
Fig.4 Comparison of relative uncertainty component
2.7.7 扩展不确定度及报告不确定度
在95%的置信概率下其包含因子k=2,将合成标准不确定度乘以包含因子计算得到测量结果的扩展不确定度U95为:
U95=k×Uadd(w)=2×0.015 11=0.030 2
U95=91.052×0.030 2=2.75
由实验所测得到地参中总黄酮的含量为(91.052±2.75) mg。
3 结论
本文比较了NaNO2-Al(NO3)3-NaOH、AlCl3-Kac和三乙胺3种显色体系条件下地参总黄酮的提取液及不同对照品的光谱吸收效果,得出在NaNO2-Al(NO3)3-NaOH体系中,芦丁标准品与地参黄酮提取液在400~600 nm范围吸收光谱图最相似,且两者的最大吸收波长最接近。选择NaNO2-Al(NO3)3-NaOH比色法,以NaNO2、Al(NO3)3、NaOH添加量及显色温度为单因素实验,以芦丁为标准品对地参总黄酮最佳含量测定条件进行了考察,并采用了Box-Behnken设计预测出了显色剂的最优配比为0.9 mL 50 g/L亚硝酸钠,0.6 mL 100 g/L硝酸铝,4.8 mL 1 mol/L的氢氧化钠和显色温度42 ℃。然后,对供试品溶液的制备,对照品溶液的制备,显色体系和标准曲线拟合进行了不确定度评估,评定出了测量结果的合成标准不确定度和扩展不确定度,最终测得总黄酮量为(91.052±2.75) mg。且响应面的预测值与验证实际值之间偏差极小,加之含有不确定度评估,结果准确可靠,为总黄酮的测定提供了新的参考方法。
[1] 赵国平,戴慎,陈仁寿主编. 南京中医药大学编著. 中药大辞典. 2版. 上海: 上海科学技术出版社, 2006.
[2] 黄菊华. 地参多酚的组成及其抗氧化活性研究[D].大理:大理学院, 2015.
HUANG J H.Study on the composition and antioxidant activity of polyphenols from Radix rehmanniae[D].Dali:Dali Unniversity, 2015.
[3] LU Y H, HUANG J H, LI Y C, et al.Variation in nutritional compositions, antioxidant activity and microstructure of Lycopus lucidus Turcz.root at different harvest times[J].Food Chemistry, 2015, 183:91-100.
[4] 杨保成, 彭涛, 康文艺.地笋属植物化学成分研究进展[J].中国实验方剂学杂志, 2013, 19(4):346-350.
YANG B C, PENG T, KANG W Y.Advance on chemical constituents of Lycopus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(4):346-350.
[5] 马莹慧, 熊馨, 李月, 等.长白山红景天黄酮组分的提取工艺及抗炎作用[J].中国兽医杂志, 2021, 57(11):56-61.
MA Y H, XIONG X, LI Y, et al.Extraction process of flavonoids from Rhodiola sachalinensis and its anti-inflammatory effect[J].Chinese Journal of Veterinary Medicine, 2021, 57(11):56-61.
[6] 李月, 王桂花, 范媛媛, 等.地参总黄酮的提取及抗氧化活性研究[J].分子科学学报, 2019, 35(1):55-62.
LI Y, WANG G H, FAN Y Y, et al.Study on extraction and antioxidant activity of total flavones from Lycopus lucidus Turcz[J].Journal of Molecular Science, 2019, 35(1):55-62.
[7] 付依依, 王永霞, 李月, 等.大果沙棘中黄酮的体外抗炎及抗氧化活性研究[J].中国食品添加剂, 2021(10):67-74.
FU Y Y, WANG Y X, LI Y, et al.Study on in vitro anti-inflammatory and antioxidant activities of flavonoids from sea buckthorn[J].China Food Additives, 2021(10):67-74.
[8] 严啸东, 郭美丽.黄酮类化合物抗心脑血管缺血性疾病作用的研究进展[J].药学实践杂志, 2022, 40(2):97-102.
YAN X D, GUO M L.Research progress of the effect of flavonoids on cardiovascular and cerebrovascular ischemic diseases[J].Journal of Pharmaceutical Practice, 2022, 40(2):97-102.
[9] 包强, 刘丽梅, 王延玲, 等.中药材有效部位总黄酮含量测定方法研究概述[J].中国中医药信息杂志, 2018, 25(4):136-140.
BAO Q, LIU L M, WANG Y L, et al.Research overview on content determination methods of total flavonoids in effective parts of Chinese materia medica[J].Chinese Journal of Information on Traditional Chinese Medicine, 2018, 25(4):136-140.
[10] 常飞, 吴文能, 曹晖.白补药总黄酮含量测定方法的建立[J].天然产物研究与开发, 2016, 28(1):71-75;82.
CHANG F, WU W N, CAO H.Determination of total flavonoids in Salvia scapiformis hance[J].Natural Product Research and Development, 2016, 28(1):71-75;82.
[11] 李夏冰, 江琴, 崔长伟, 等.鱼腥草中总黄酮含量测定方法比较研究[J].楚雄师范学院学报, 2020, 35(3):96-100.
LI X B, JIANG Q, CUI C W, et al.Comparative study on assays for determination of flavonoids in Houttuynia cordata[J].Journal of Chuxiong Normal Univesity, 2020, 35(3):96-100.
[12] 范世明, 谢心月, 曾繁天, 等.三叶青叶化学成分鉴定及其总黄酮含量测定研究[J].药物分析杂志, 2017, 37(8):1 481-1 488.
FAN S M, XIE X Y, ZENG F T, et al.Identification of chemical components and determination of flavonoids in Tetrastigma hemsleyanum leaves[J].Chinese Journal of Pharmaceutical Analysis, 2017, 37(8):1 481-1 488.
[13] 陈舒茵, 梁国成, 黄小鸥, 等.柴胡利胆颗粒中总黄酮含量测定及不确定度评定[J].陕西中医, 2019, 40(10):1 467-1 470;1 476.
CHEN S Y, LIANG G C, HUANG X O, et al.Determination and uncertainty evaluation of total flavonoids in Chaihu Lidan granules[J].Shaanxi Journal of Traditional Chinese Medicine, 2019, 40(10):1 467-1 470;1 476.
[14] 陶松, 刘旭海, 刘玲, 等.紫外分光光度法测定补肾口服液中总黄酮含量的不确定度评定[J].江西中医学院学报, 2011, 23(6):39-42.
TAO S, LIU X H, LIU L, et al.Evaluation of uncertainty in the determination of total flavonoids in busen oral liquid by UV Spectrometery[J].Journal of Jiangxi University of Traditional Chinese Medicine, 2011, 23(6):39-42.
[15] 王秀文, 刘永梅.降脂代用茶中总黄酮的含量测定及不确定度分析[J].广东化工, 2022, 49(5):156-158;172.
WANG X W, LIU Y M.Determination of total flavonoids in alternative tea and analysis of uncertainty[J].Guangdong Chemical Industry, 2022, 49(5):156-158;72.
[16] 曹宏燕. 分析测试中测量不确定度及评定第四部分实例(3)测定钢中碳量的不确定度评定. 冶金分析, 2005, 25(6):73-76.
CAO H Y. Uncertainty in measurement and its evaluation in analysis and testing Part 4 Example(3) Evaluation of the uncertainty for measurement of carbon content in steel. Metallurgical Analysis, 2005, 25(6):73-76.
[17] 华晶忠, 王莹, 王嵩, 等.分光光度法测定桑黄中总黄酮的不确定度评定[J].食品安全质量检测学报, 2020, 11(8):2 498-2 502.
HUA J Z, WANG Y, WANG S, et al.Evaluation of uncertainty in determination of total flavone in Phellinus spp.by spectrophotometer[J].Journal of Food Safety and Quality, 2020, 11(8):2 498-2 502.
[18] 才志阳, 郭伟英.紫外分光光度法测定葎草总黄酮含量的不确定度评定[J].锦州医科大学学报, 2019, 40(1):17-21.
CAI Z Y, GUO W Y.Evaluation of uncertainty on the determination of total flavones in humulus scandens by UV spectrophotometry[J].Journal of Jinzhou Medical University, 2019, 40(1):17-21.
[19] 严华, 张萍, 程显龙, 等.紫外分光光度法测定沙棘中总黄酮含量的不确定度评定[J].中国药事, 2009, 23(4):339-344.
YAN H, ZHANG P, CHENG X L, et al.Evaluation of the uncertainty on the determination of total flavones in fructus Hippophae by UV spectropho tometry[J].Chinese Pharmaceutical Affairs, 2009, 23(4):339-344.