花椒(Zanthoxylum bungeanum Maxim)为成熟干燥的果皮,药食两用,具有镇痛、抗肿瘤、抗凝血和抗氧化等药理作用[1-3]。在甘肃、陕西、四川、贵州等省份有较大规模种植。研究表明花椒主要含有挥发性成分、酰胺类物质、生物碱、黄酮和脂肪酸等成分,其中花椒的挥发性成分主要包括醇类、萜烯类、酯类、烷类等化合物[4-6],与花椒的抑菌杀菌[7]、杀虫[8]、抗氧化[9]、抗癌[10]等作用有关。
陇南武都花椒种植面积高达100万亩,年产量3 500万斤,花椒总产值达39亿,被誉为“中国花椒之都”。武都花椒种植历史悠久,但由于自然杂交、自身变异及人为因素的影响导致了花椒品种混淆、不易分辨,同时市场上也存在同物异名、同名异物及以次充好的现象,给消费者带来很多困扰和损害。目前鉴定和评价武都花椒品质的主要方法主要有理化指标、感官评审等,缺乏客观的评价依据。因此,亟需建立一种综合评价武都花椒的整体质量,又能区别于其他产区花椒产品的有效途径,为陇南优质花椒品牌创建提供依据。
气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)常用来分析挥发性物质,如樊丹青等[11]采用GC-MS对甘肃、四川等6个产地红花椒的挥发性成分含量及组成进行分析对比,陈光静等[12]采用GC-MS对陕西、甘肃、四川3个省8个产地的红花椒挥发物的化学组分和含量进行分析比较;而指纹图谱是运用光谱、色谱等仪器检测出能反映食品内部特征的图谱,强调对研究对象“共有特征性”的研究,并在共有特性中寻找个性差异,具有整体性、系统性、特征性和稳定性的特点,在食品的产地识别、品质检测、品种分类等方面发挥着重要作用[13-15]。本文采用GC-MS对陇南武都16个品种的花椒挥发性物质进行检测、分析,聚类分析和主成分分析进行分类评价,建立指纹图谱,并用相似度分析验证,从而建立一套完整、全面综合的武都花椒果皮香味物质评估体系,为武都花椒产地识别、品质检测、品种分类、进化关系及其有效应用提供参考。
1 材料与方法
1.1 材料与试剂
陇南武都属于北亚热带干热河谷区,干燥度为0.5~2,平均气温为14.6 ℃,≥10 ℃的积温4 568.7 ℃,年日照时间1 911.7 h,土壤pH 6.5~7.5,年降水量为450~500 mm,符合花椒树耐旱喜光的生长特点。
16个花椒样品均采自陇南市经济林研究院花椒研究所花椒种质资源基因库,且培育条件相同,花椒果实均为正常生长发育的成熟果实,采摘时间如表1所示。石油醚、无水硫酸钠,分析纯;实验用水为超纯水。
表1 实验材料
Table 1 Experimental materials

1.2 仪器与设备
Baygene BG-Qspin微型离心机,无锡杰瑞安仪器设备有限公司;AL/AS1310与TRACE1300 ISQ自动进样-气相色谱-质谱联用仪、TR-5MS(30 m×0.25 mm×0.25 μm)弱极性弹性石英毛细管色谱柱、0.45 μm有机系微孔滤膜,美国Thermo Scientific。
1.3 实验方法
1.3.1 花椒挥发性物质的制备
在罗凯等[16]提取方法的基础上进行修改,精密称取各样品3.000 g于安瓿瓶中,加入10 mL石油醚浸泡,120 W超声条件下提取15 min,倾出浸提液,无水硫酸钠脱水干燥,5 000 r/min离心5 min,取上清液进样分析。
1.3.2 GC-MS分析方法
GC条件:TR-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);采用程序升温法:起始温度50 ℃保持1 min,以3 ℃/min升温到至100 ℃,保持2 min,再以8 ℃/min升温到250 ℃,保持2 min。进样量1 μL,分流比200∶1,进样口温度280 ℃,载气流速1 mL/min。
MS条件:溶剂延迟3 min,离子源温度250 ℃,扫描范围50~650 m/z。
样品经GC-MS分析后,利用NIST11版标准质谱检索库进行定性分析,并进一步利用保留指数法对花椒提取物的主要成分进行定性验证。
1.3.3 参照峰的选择
建立指纹图谱的第一步是找到参照峰和特征峰,一般选择峰面积较大且相对稳定的峰作为参照峰,特征峰则是根据色谱峰的保留时间来确定[17]。本研究中发现保留时间为12.39 min的峰面积最大且相对稳定作为参照峰,结合GC-MS分析发现此峰对应的化合物为柠檬烯。将参照峰的保留时间和峰面积皆定为1,其他峰的相对峰面积为该峰峰面积与参照峰峰面积之比。
1.4 数据处理
采用“中药指纹图谱相似度评价系统(2012版)”构建指纹图谱,IBM SPSS Statistic 23.0软件进行相似度分析、主成分分析和聚类分析。
2 结果与分析
2.1 方法学考查结果
2.1.1 精密度试验
称取组培梅花椒(ZPMHJ)样品,在“1.3.1”节条件下制备供试品,依“1.3.2”节条件测定,连续进样5次,进样量2 μm,以柠檬烯为参照峰(S),计算得到其他色谱峰的相对保留时间的相对标准偏差(relative standard deviation,RSD)值小于1%,相对峰面积的RSD值小于2%,说明该仪器精密度良好。
2.1.2 重复性试验
精密称取组培梅花椒(ZPMHJ)样品3份,在“1.3.1”节下制备供试品溶液,依“1.3.2”节条件下检测,每份重复检测3次,以柠檬烯为参照峰(S),记算共有峰的相对保留时间和相对峰面积,测得相对保留时间及相对峰面积的RSD均小于0.1%,结果表明该方法的重复性较好。
2.1.3 稳定性试验
精密吸取“1.3.1”节下制备的组培梅花椒(ZPMHJ)供试品溶液,分别于0、2、4、8、12、24 h按“1.3.2”节色谱条件检测,并以柠檬烯为参照峰(S),计算得出各共有峰的相对保留时间和相对峰面积的RSD均小于2%,表明供试品溶液在24 h内稳定。
2.2 16个花椒品种的挥发性物质成分的分析与鉴定
本研究在相同栽培环境下,对陇南武都的16个品种花椒样品进行GC-MS测定分析,发现各花椒样品的总离子流图色谱峰分离较好且整体较相似,说明武都花椒样品中的挥发性成分相近,挥发性物质种类差别较小。花椒挥发性成分包括醇类、烯烃类、酯类、酮类、醛类、烷烃类和苯类(图1),共同构成了花椒的香味物质。16个花椒品种所测挥发性物质种类数量如图2所示,结果表明醇类和烯烃类物质不仅种类最多,其相对含量也最高,这些醇类和烯烃类化合物成分,具有明显的香气呈香特性,构成了武都花椒香气成分的重要特色。16个品种的花椒主要挥发性物质D-柠檬烯、α-水芹烯、α-蒎烯、罗勒烯、芳樟醇、桉叶醇及乙酸芳樟酯的相对含量较高(表2),与霍归国等[18]所测甘肃武都‘大红袍’花椒的D-柠檬烯、芳樟醇和罗勒烯等主要特征成分的相对含量较高的结果一致。但花椒挥发性成分的相对百分含量之间存在着差异,说明各挥发性成分对武都花椒的香味贡献大小存在着差异,如云华七叶青(YHQYQ)相对含量最高的挥发性化合物是芳樟醇,而D-柠檬烯在其他花椒品种相对含量最高。云华七叶青(YHQYQ)和汉源青椒(HYQJ)均为青花椒,相对含量也存在差异,可能是地域接壤、地域相近的地区的花椒生长环境差别小,而较远地区的花椒由于长期地域环境差异而产生较大的自然变异[19],也可能是因为花粉的传播造成种源遗传信息的混合,促进了种源间的基因交流有关[20]。

图1 不同品种花椒所含挥发性成分堆积图
Fig.1 The accumulation diagram of volatile components in different kinds of Zanthoxylum bungeanum
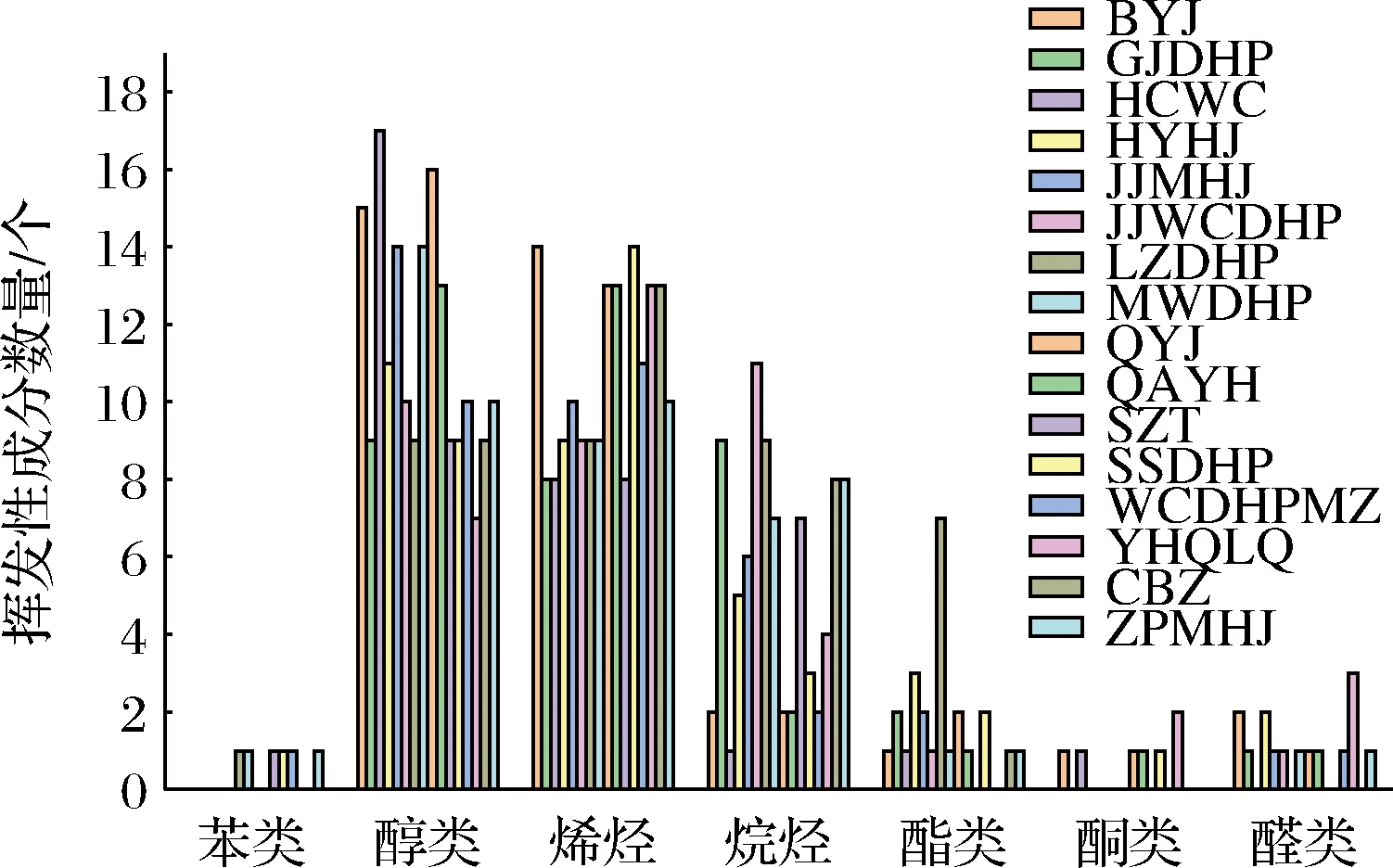
图2 不同品种花椒所含挥发性成分数量
Fig.2 Number of volatile components in different varieties of Zanthoxylum bungeanum
表2 不同品种花椒主要挥发性物质相对含量
Table 2 Relative contents of main volatile components in different cultivars of Zanthoxylum bungeanum

品种相对含量/%α-水芹烯α-蒎烯D-柠檬烯桉叶醇反式-α-罗勒烯α-罗勒烯芳樟醇 α-松油醇乙酸芳樟酯八月椒(BYJ)8.57±0.509.47±0.2619.82±0.5322.90±0.735.77±0.114.03±0.112.64±0.082.99±0.091.04±0.03郭嘉大红袍(GJDHP)6.51±0.193.91±0.1218.16±0.628.73±0.020.81±0.020.71±0.0213.04±0.42-19.62±0.49韩城无刺(HCWC)5.57±0.126.66±0.1716.39±0.325.81±0.131.93±0.102.26±0.0413.37±0.244.49±0.0812.50±0.28汉源青椒(HYQJ)0.91±0.036.49±0.3930.39±2.147.38±0.401.74±0.062.71±0.1122.27±1.470.56±0.0110.75±0.61嫁接梅花椒(JJMHJ)8.90±0.344.39±0.1217.91±0.508.05±0.160.98±0.010.86±0.0210.71±0.300.26±0.0121.53±0.50嫁接无刺大红袍(JJWCDHP)11.35±0.493.65±0.1914.86±0.896.70±0.330.77±0.030.68±0.037.44±0.430.26±0.0114.8±0.86林州大红袍(LZDHP)7.77±0.1311.49±0.7834.54±0.9910.32±0.101.95±0.04-5.20±0.090.12±0.0113.96±0.33茂汶大红袍(MWDHP)4.18±0.14-17.89±0.518.70±0.170.83±0.010.78±0.0210.89±0.270.33±0.0118.68±0.68七月椒(QYJ)0.10±0.017.85±0.1920.27±0.837.08±0.061.81±0.102.08±0.0111.06±0.203.51±0.0610.79±0.02秦安一号(QAYH)14.38.±0.0712.57±0.3214.42±0.27-7.93±0.045.17±0.442.24±0.06-0.91±0.02狮子头(SZT)7.85±0.067.06±0.3634.54±0.9910.32±0.101.95±0.04-5.20±0.09-13.96±0.33实生大红袍(SSDHP)0.14±0.010.73±0.0213.07±0.875.62±0.290.57±0.01-13.05±0.780.22±0.0237.87±2.27无刺大红袍母株(WCDHPMZ)6.78±0.320.13±0.0122.07±1.0010.84±0.421.53±0.01-10.74±0.440.38±0.0322.49±1.15云华七叶青(YHQYQ)5.00±0.125.53±0.1415.30±0.357.31±0.34-0.76±0.0239.91±0.820.89±0.100.42±0.01长把子(CBZ)3.56±0.036.76±0.4532.16±2.17.31±0.342.08±0.042.61±0.162.92±0.181.78±0.098.72±0.57组培梅花椒(ZPMHJ)2.26±0.265.27±0.3818.77±1.228.94±0.461.09±0.030.96±0.046.26±0.27-16.24±0.29
注:“-”表示未检测到该种物质
2.3 16种花椒挥发性物质的聚类分析
为了建立稳定的花椒指纹图谱,需要排除挥发性成分和含量差异较大的花椒样品,实验中采用GC-MS对花椒挥发性成分进行分析,将16种花椒挥发性物质的共有峰面积为原始数据导入SPSS 22.0软件,以系统聚类法结合欧氏距离(d)为测度获得花椒挥发性成分聚类谱系图,如图3所示。d=10时,16个花椒样品可聚为两类,云华七叶青(YHQYQ)为单独一类,可能与云华七叶青的芳樟醇的含量最高有关;d=5时,后一类又可聚为两类,林州大红袍(LZDHP)、长把子(CBZ)、实生大红袍(SSDHP)、秦安一号(QAYH)、汉源青椒(HYQJ)、无刺大红袍母株(WCDHPMZ)聚为一类,嫁接无刺大红袍(JJWCDHP)、组培梅花椒(ZPMHJ)、嫁接梅花椒(JJMHJ)、茂汶大红袍(MWDHP)、郭嘉大红袍(GJDHP)、韩城无刺(HCWC)、七月椒(QYJ)、狮子头(SZT)、八月椒(BYJ)为一类。聚类分析将16个品种的花椒进行分类,得到不同品种的花椒在挥发性物质上存在差异,但从整体上看,不存在差异性较大的品种,这与花椒所处于相同的地理位置和栽培环境具有一定的相关性,也可能与长期以来人为地从不同种源地进行引种有关,从而造成种源遗传信息的混合,促进了种源间的基因交流有关[21]。聚类分析结果表明,花椒亲缘关系与化学成分相似性存在一定的关系,16个花椒中不存在差异性较大的品种,满足构建指纹图谱的要求。
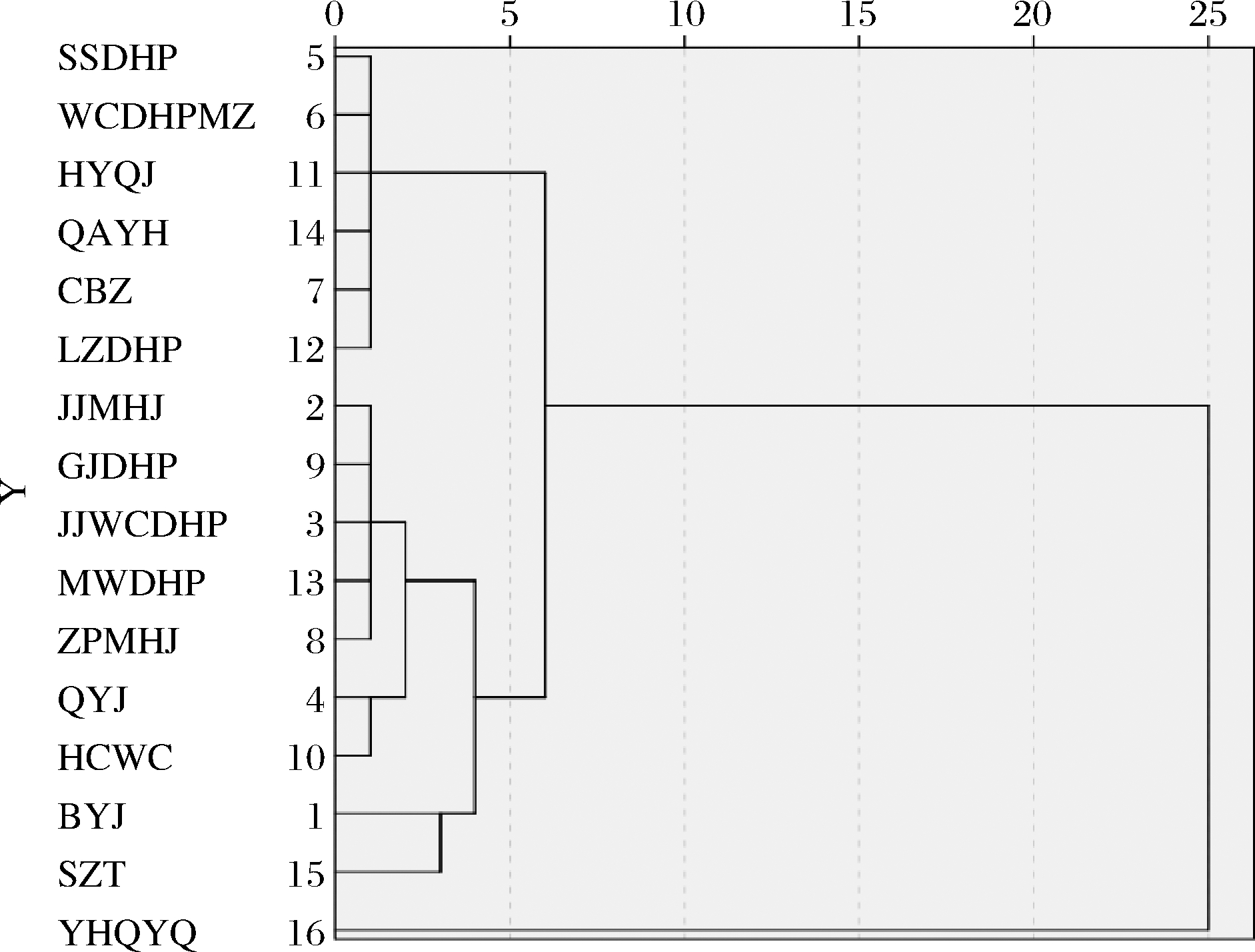
图3 不同品种花椒聚类分析
Fig.3 Cluster analysis in different kinds of Zanthoxylum bungeanum
2.4 16种花椒挥发性物质主成分分析
主成分分析利用降维的思想,将原来多个变量通过线性转变为几个较少变量的一种多元统计方法。将16种花椒样品共有挥发性物质的峰面积数据导入IBM SPSS Statistic 22.0软件中,选择分析-降维-因子分析,得到其特征值和方差贡献率,结果可知,特征值大于1的主成分有3个,累计贡献率为80.24%,表明3个主成分能够较好反映出16种花椒挥发性成分的基本特征值和主要信息,具有良好的代表性。
如图4所示,由空间散点的距离可知,云华七叶青(YHQYQ)为单独一类,林州大红袍(LZDHP)、长把子(CBZ)、实生大红袍(SSDHP)、秦安一号(QAYH)、汉源青椒(HYQJ)、无刺大红袍母株(WCDHPMZ)距离较为相近,聚为一类,嫁接无刺大红袍(JJWCDHP)、组培梅花椒(ZPMHJ)、嫁接梅花椒(JJMHJ)、茂汶大红袍(MWDHP)、郭嘉大红袍(GJDHP)、韩城无刺(HCWC)、七月椒(QYJ)距离相近聚为一类,狮子头(SZT)、八月椒(BYJ)聚为一类,这与聚类结果相一致,进一步说明2种分析方法的结果较为一致,16种花椒满足现行构建指纹图谱的要求。

图4 花椒样品挥发性成分的PCA得分图
Fig.4 PCA score plot of volatile components in Zanthoxylum bungeanum
2.5 指纹图谱的构建
2.5.1 指纹图谱测定
将16种花椒色谱峰的保留时间和峰面积等参数导入“中药色谱指纹图谱相似度评价系统(2012A版),经多点校正后进行色谱峰匹配生成指纹图谱(图5)。结果显示,在35 min内出峰较多,对图谱进行比较、分析,最终筛选出11个共有峰为指纹峰,由于2号峰(D-柠檬烯)峰面积最大,分离最好且最稳定,设定为参照峰,将保留时间和峰面积设为1,计算各共有峰的相对保留时间和相对峰面积,结果表明16种花椒挥发性成分的GC-MS指纹图谱共有峰的相对保留时间差别较小,RSD在1.8%~4.41%,说明16种花椒样品挥发性特征成分基本相同;但共有峰的相对峰面积差别较大,RSD在30.35%~169.96%,说明16种花椒果皮挥发性物质的主要特征成分含量差别较大。可能是因为花椒挥发性成分含量随品种、栽培条件、成熟时间、遗传背景、贮藏和提取方法的不同而不同有关[22-24]。

图5 不同品种花椒挥发性成分的GC-MS 指纹图谱
Fig.5 GC-MS fingerprinting of volatile components in different kinds of Zanthoxylum bungeanum
所建立的白龙江武都区段花椒指纹图谱不同于叶洵等[25]以汉源花椒、武都花椒及茂县花椒的10批样品建立的GC-MS指纹图谱,汉源花椒归为一类,茂县与武都花椒聚为一类;不同于课净璇等[26]以17个不同产区的花椒为样品建立花椒挥发油GC-MS指纹图谱,红花椒和青花椒之间存在明显差异;说明武都区段16个品种的花椒在品种之间具有一定相似性,这与处于相同的栽培环境相关。利用NIST11谱库的质谱数据进行检索,为验证质谱检索结果,并对花椒的主要挥发性组分进行了保留指数定性,11种化合物主要为3种烯烃类、5种醇类、1种脂类和2种烷类,按出峰时间依次为α-水芹烯、D-柠檬烯、顺式-1-甲基-4-(1-甲基乙烯基)-环己醇、芳樟醇、萜品烯-4-醇、乙酸-4-甲基-1-(1-甲基乙基)-3-环己烯-1-醇、乙酸芳樟酯、乙酸-α,α,4-三甲基-3-环己烯-1-甲醇、顺式-α-法呢烯、(E,Z)-5,6-双(2,2-二甲基亚丙基)-癸烷、二十一烷。不同于叶洵等[25]、课净璇等[26]所测共有峰物质,11种物质可作为白龙江武都区段花椒的特征性物质。
2.5.2 相似度分析
本研究采用夹角余弦和皮尔逊相关系数对各色谱峰进行相似度分析,结果见表3。夹角余弦法的结果在0.938 0~0.988 5,相关系数法的结果在0.909 6~0.979 6,2种算法的结果都大于0.9,说明16种花椒样品相似性较好,所得到的GC-MS标准指纹图谱(R)能较全面地表述花椒GC-MS中有效成分的信息,故所构建的16个品种的花椒的特征指纹图谱信息具有可靠性。
表3 十六个品种花椒果皮香味物质的相似度
Table 3 Similarity of peel aroma components in 16 varieties of Zanthoxylum bungeanum
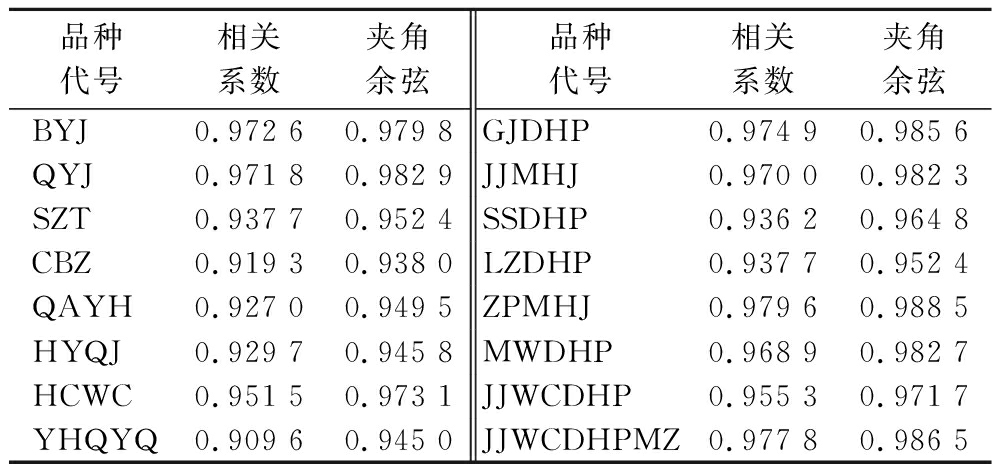
品种代号相关系数夹角余弦品种代号相关系数夹角余弦BYJ0.972 60.979 8GJDHP0.974 90.985 6QYJ0.971 80.982 9JJMHJ0.970 00.982 3SZT0.937 70.952 4SSDHP0.936 20.964 8CBZ0.919 30.938 0LZDHP0.937 70.952 4QAYH0.927 00.949 5ZPMHJ0.979 60.988 5HYQJ0.929 70.945 8MWDHP0.968 90.982 7HCWC0.951 50.973 1JJWCDHP0.955 30.971 7YHQYQ0.909 60.945 0JJWCDHPMZ0.977 80.986 5
3 结论
16个品种花椒种植于陇南武都特定的生长区域,依赖于得天独厚的地理环境和适宜的气候条件,成为了区域特色农产品。本研究对16种花椒挥发性成分进行分析,发现挥发性成分相近,种类差别较小,按化学结构性质可分为醇类、烯烃类、酯类、酮类、醛类及苯类,其中醇类、烯烃类的成分数量较多,其相对含量也比较高。聚类分析和主成分分析结果显示,不存在差异性较大的品种。GC-MS指纹图谱标定了α-水芹烯、D-柠檬烯、顺式-1-甲基-4-(1-甲基乙烯基)-环己醇、芳樟醇、萜品烯-4-醇、乙酸-4-甲基-1-(1-甲基乙基)-3-环己烯-1-醇、乙酸芳樟酯、乙酸-α,α,4-三甲基-3-环己烯-1-甲醇、顺式-α-法呢烯、(E,Z)-5,6-双(2,2-二甲基亚丙基)-癸烷、二十一烷物质作为花椒的特征性物质。结合夹角余弦和皮尔逊相关系数对各色谱峰进行相似度分析,结果表示两者均在0.9以上,表明指纹图谱建立的方法有效,可为武都花椒的产地识别、品质检测、品种分类、探讨进化关系等等提供一定的科学依据。
[1] 杨建宇, 李杨, 范竹雯, 等.道地药材川椒的研究近况[J].光明中医, 2020, 35(1):146-148.
YANG J Y, LI Y, FAN Z W, et al.Series of recent research situation of genuine regional drug (5)recent research situation of genuine regional drug Sichuan pepper[J].Guangming Journal of Chinese Medicine, 2020, 35(1):146-148.
[2] TSUNOZAKI M, LENNERTZ R C, VILCEANU D, et al.A ‘toothache tree’ alkylamide inhibits A delta mechanonociceptors to alleviate mechanical pain[J].The Journal of Physiology, 2013, 591(13):3 325-3 340.
[3] 周杰, 刘璐, 邱盛敏, 等.不同产地花椒精油的化学成分分析及花椒精油固体制剂的抗真菌作用考察[J].中国实验方剂学杂志, 2021, 27(2):153-160.
ZHOU J, LIU L, QIU S M, et al.Analysis of chemical composition in essential oil of Zanthoxyli pericarpium from different producing areas and investigation of antifungal effect of Zanthoxyli pericarpium essential oil solid preparation[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(2):153-160.
[4] YE Q.Rapid analysis of the essential oil components of dried Zanthoxylum bungeanum Maxim by Fe2O3-magnetic-microsphere-assisted microwave distillation and simultaneous headspace single-drop microextraction followed by GC-MS[J].Journal of Separation Science, 2013, 36(12):2 028-2 034.
[5] YANG X G.Aroma constituents and alkylamides of red and green Huajiao (Zanthoxylum bungeanum and Zanthoxylum schinifolium)[J].Journal of Agricultural &Food Chemistry, 2008, 56(5):1 689-1 696.
[6] EPIFANO F, CURINI M, CARLA MARCOTULLIO M, et al.Searching for novel cancer chemopreventive plants and their products:The genus Zanthoxylum[J].Current Drug Targets, 2011, 12(13):1 895-1 902.
[7] 高逢敬, 蒲彪.青花椒香气成分的抑菌性研究[J].四川食品与发酵, 2007, 43(3):28-30.
GAO F J, PU B.The study on fragrant composition of the Green Zanthoxylum Bungeanum about the bacteriostatic function[J].Sichuan Food and Fermentation, 2007, 43(3):28-30.
[8] QI H, WANG W X, DAI J L, et al. In vitro anthelmintic activity of Zanthoxylum simulans essential oil against Haemonchus contortus[J].Veterinary Parasitology, 2015, 211(3-4):223-227.
[9] 赵晨. 植物挥发油抗氧化活性的研究[J].中国调味品, 2008, 33(11):40-43.
ZHAO C.Research of antioxidative capacity in essential oils of plants[J].China Condiment, 2008, 33(11):40-43.
[10] 臧林泉, 胡枫, 韦敏, 等. 花椒挥发油抗肿瘤药理作用研究. 蛇志, 2006, 18(3):183-186.
ZANG L Q, HU F, WEI M, et al.The anti-tumor effect of Zanthoxylunm maxim and its mechanism of essential oil of Zanthoxylunm maxim[J].Journal of Snake, 2006, 18(3):183-186.
[11] 樊丹青, 刘荣, 杨丽, 等.不同产地花椒挥发油含量及组成成分比较研究[J].中药与临床, 2014, 5(2):16-19.
FAN D Q, LIU R, YANG L, et al.Analysis on volatile oil of Zanthoxylum bungeanum Maxim from different origin[J].Pharmacy and Clinics of Chinese Materia Medica, 2014, 5(2):16-19.
[12] 陈光静, 阚建全, 李建, 等.不同产地红花椒挥发油化学成分的比较研究[J].中国粮油学报, 2015, 30(1):81-87.
CHEN G J, KAN J Q, LI J, et al.Analysis of essential oil compounds in Zanthoxylum bungeanum Maxim from different habitats[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(1):81-87.
[13] 刘静, 亓超凡, 绪扩, 等.指纹图谱技术在食品质量与安全中的应用研究进展[J].食品安全质量检测学报, 2022, 13(10):3 189-3 197.
LIU J, QI C F, XU K, et al.Research progress on the application of fingerprint technology in the field of food quality and safety[J].Journal of Food Safety &Quality, 2022, 13(10):3 189-3 197.
[14] 张晶莹, 魏彦锋, 梁红敏, 等.指纹图谱技术在葡萄及葡萄酒研究上的应用[J].中外葡萄与葡萄酒, 2019(1):57-63.
ZHANG J Y,WEI Y F, LIANG H M, et al.Application of fingerprint technique in grape and wine research[J].Sino-Overseas Grapevine Wine, 2019(1):57-63.
[15] 徐妍, 杨华蕊, 杨永寿, 等.中药指纹图谱研究现状及展望[J].世界最新医学信息文摘, 2018, 18(76):91-94.
XU Y, YANG H R, YANG Y S, et al.Research and prospect of fingerprint of traditional Chinese medicine[J].World Latest Medicine Information, 2018, 18(76):91-94.
[16] 罗凯, 朱琳, 阚建全.水蒸汽蒸馏、溶剂萃取、同时蒸馏萃取法提取花椒挥发油的效果比较[J].食品科技, 2012,37(10):234-236;240.
LUO K, ZHU L, KAN J Q.Comparison on extraction of steam distillation, solvent, simultaneous distillation for Zanthoxylum essential oil[J].Food Science and Technology, 2012,37(10):234-236;240.
[17] 李宝丽, 朱宇轩, 邓建玲, 等.基于GC-MS指纹图谱和化学计量分析鉴别预包装纯葡萄汁及葡萄汁制品[J].食品科学, 2015, 36(8):156-161.
LI B L, ZHU Y X, DENG J L, et al.Discrimination of prepackaged pure grape juice and its commercial products based on gas chromatography-mass spectrometry fingerprints and chemometrics methods[J].Food Science, 2015, 36(8):156-161.
[18] 霍归国, 梁婷玉, 史金涵, 等.武都‘大红袍’花椒品质研究[J].中国农学通报, 2021, 37(22):120-125.
HUO G G, LIANG T Y, SHI J H, et al.Study on the quality of Zanthoxylum bungeanum ‘Dahongpao’ from Wudu[J].Chinese Agricultural Science Bulletin, 2021, 37(22):120-125.
[19] FENG S J, LIU Z S, CHEN L, et al.Phylogenetic relationships among cultivated Zanthoxylum species in China based on cpDNA markers[J].Tree Genetics &Genomes, 2016, 12(3):45.
[20] FENG S J, YANG T X, LIU Z S, et al.Genetic diversity and relationships of wild and cultivated Zanthoxylum germplasms based on sequence-related amplified polymorphism (SRAP) markers[J].Genetic Resources and Crop Evolution, 2015, 62(8):1 193-1 204.
[21] 李立新, 司守霞, 魏安智, 等.基于花椒转录组序列SSR分子标记开发及花椒种质鉴定[J].华北农学报, 2017, 32(5):69-77.
LI L X, SI S X, WEI A Z, et al.Study on development of SSR molecular markers based on transcriptome sequencing and germplasm identification in Zanthoxylum germplasm[J].Acta Agriculturae Boreali-Sinica, 2017, 32(5):69-77.
[22] FARDHYANTI D S, SEDIAWAN W B, HISYAM A.Kinetics of mace (Myristicae arillus) essential oil extraction using microwave assisted hydrodistillation:Effect of microwave power[J].Industrial Crops and Products, 2019, 131:315-322.
[23] SHI J W, FEI X T, HU Y, et al.Identification of key genes in the synthesis pathway of volatile terpenoids in fruit of Zanthoxylum bungeanum Maxim[J].Forests, 2019, 10(4):328.
[24] KIM J H.Seasonal variations in the content and composition of essential oil from Zanthoxylum piperitum[J].Journal of Ecology and Environment, 2012, 35(3):195-201.
[25] 叶洵, 刘子博, 张婷, 等.基于GC-MS结合保留指数法建立花椒挥发油指纹图谱[J].中国调味品, 2022, 47(4):68-73.
YE X, LIU Z B, ZHANG T, et al.Establishment of the fingerprint of Zanthoxylum Bungeanum volatile oils based on GC-MS combined with retention index method[J].China Condiment, 2022, 47(4):68-73.
[26] 课净璇, 瞿瑗, 黎杉珊, 等.基于GC-MS建立花椒挥发油指纹图谱及在汉源红花椒鉴定中的应用[J].中国粮油学报, 2018, 33(11):116-126.
KE J X, QU Y, LI S S, et al.Establishment of GC-MS fingerprint based on essential oil components in Zanthoxylum and application on Hanyaun Zanthoxylum bungeanum[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(11):116-126.