高级醇是一类广泛存在于啤酒[1]、葡萄酒[2]、黄酒[3]和蒸馏酒[4]等饮料酒中的风味物质,主要包括异丙醇、烯丙醇、正丙醇、异丁醇、正丁醇、叔丁醇、异戊醇、正戊醇、苯甲醇和2-苯乙醇等[5]。不同的高级醇具有不同的香气特征,如异戊醇微甜带苦,具有独特的苦杏仁味;正己醇有淡淡的枝叶和果香味;2-苯乙醇有蜜香及玫瑰香。因此适量高级醇可使饮料酒的口感更加丰满和协调。然而,高级醇作为脂肪醇,具有毒性且毒性随着醇的分子质量增加而增加。饮料酒中过高的高级醇含量不仅会破坏饮料酒的口味,导致酒体辛辣苦涩,增添油臭味、汗臭味和腐败味[6],而且还会引起饮酒宿醉,甚至中毒,给人体带来不可逆的损伤。
目前对于饮料酒中高级醇含量的限定并没有统一标准。研究表明[7],优质啤酒中高级醇含量应小于50 mg/L,葡萄酒的高级醇最适含量应低于300 mg/L,黄酒中高级醇含量的适宜范围为80~540 mg/L,液态发酵白酒为600~2 500 mg/L,固态发酵白酒为500~1 800 mg/L,白兰地为1 000~2 000 mg/L,朗姆酒为650~2 000 mg/L,威士忌为500~1 500 mg/L。高级醇属于酵母菌的初级代谢产物,主要通过分解代谢途径(Ehrlich pathway)及合成代谢途径(Harris pathway)在饮料酒主发酵期产生。为降低饮料酒中高级醇含量,一方面可以在主发酵期,通过发酵工艺控制,降低高级醇的合成或促进高级醇的酯化;另一方面,可以通过后处理工艺,加速酒体陈酿。正丙醇、异丁醇、异戊醇与2-苯乙醇为饮料酒中含量最高的高级醇,其风味阈值分别为0.6、50、30、14 mg/L[8],降低高级醇不应低于其风味阈值,避免破坏酒体风味。
据此,本文综述酒体中高级醇对人体的危害与作用机理,探讨发酵工艺调控及后处理工艺,以降低饮料酒中高级醇的含量,为饮料酒生产中控制高级醇提供借鉴。
1 高级醇的危害
高级醇是碳原子数≥3的脂肪醇,其毒性随着分子质量的增加而增加。当高级醇进入人体后,在醇脱氢酶的作用下生成相应的醛或酮,接着进一步代谢生成相应的酸,最后氧化成水和CO2,排出体外。由此可见,高级醇对人体的毒害性不仅源于高级醇本身,而且也源于其代谢产生相应的醛或酮。
1.1 高级醇对人体的危害
高级醇具有急性毒性作用和神经毒性作用(图1),研究表明,过量饮酒会导致一系列的宿醉症状,如头晕、头痛、恶心、疲劳和肌肉疼痛[9],这些症状与饮酒过程中高级醇摄入引起的酒精中毒密切相关[10-11]。酒精引起的肝毒性主要是由醇的溶剂特性引起的膜损伤[12],因此饮料酒中高级醇摄入可能会导致慢性肝病与肝硬化[13]。高级醇和乙醇的协同作用可加剧人体酒精中毒程度[14],且不同高级醇与乙醇的协同效应产生的效果各不相同,其中1-丁醇和2,3-丁二醇对乙醇造成的中毒效应具有拮抗作用,而其他高级醇则会明显协同乙醇,加剧酒精中毒,其中2-苯乙醇的协同效应最明显,其次是异戊醇、异丁醇和正丙醇。同时,过量的高级醇摄入还会导致细胞损伤、原发性头痛、血管扩张、呼吸急促、心跳加快、中枢神经系统受损[15]及人体免疫功能抑制,从而增加酗酒者对传染病的易感性[16]。目前尚缺乏饮酒爱好者血液中的乙醇及高级醇的含量与高级醇危害浓度相关数据以及通过酒精的协同作用建立的相关动物模型,该模型的建立不仅能指导饮料酒生产者调控酒体中高酒醇的含量,而且能指导饮酒爱好者科学饮酒。
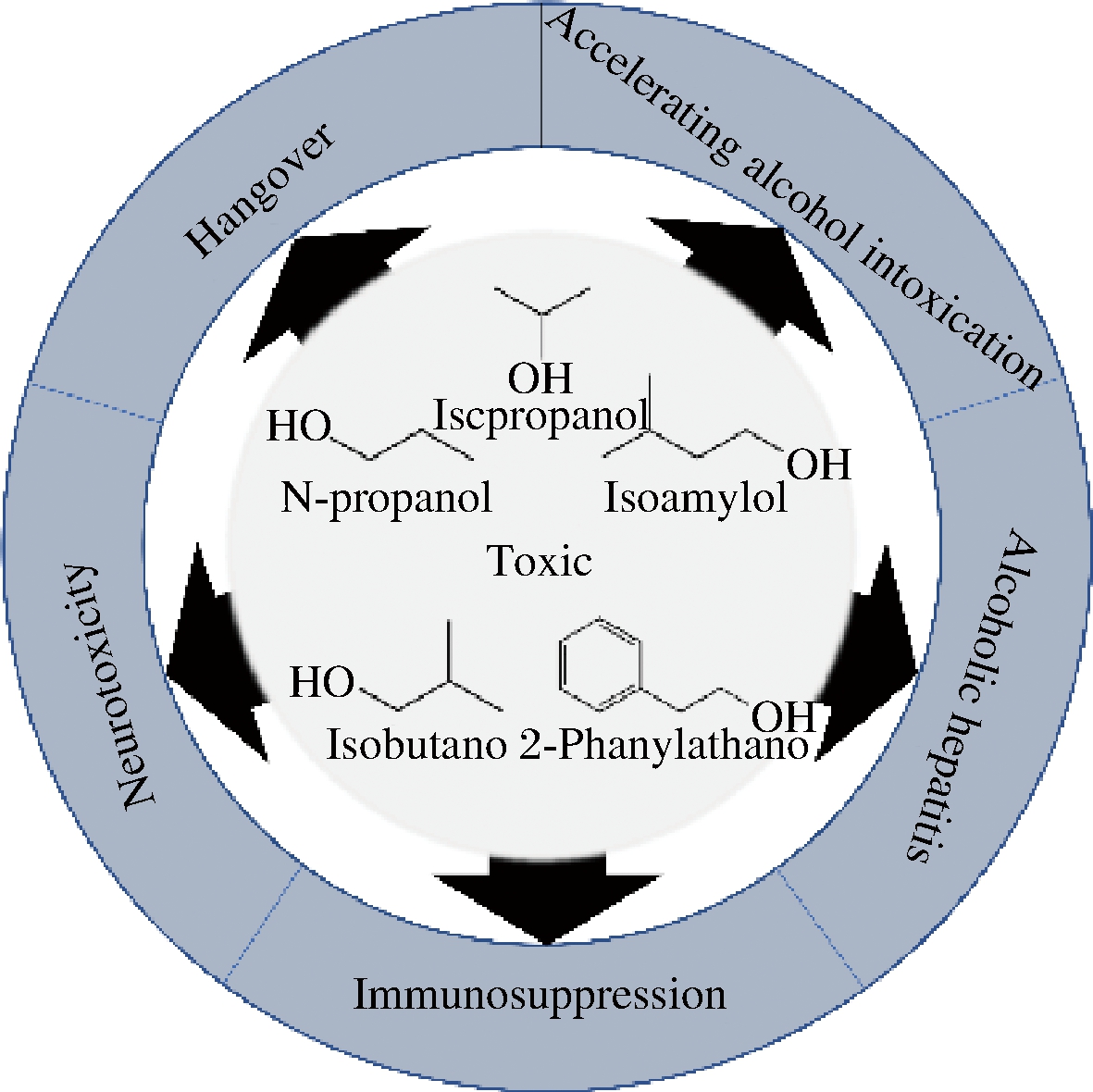
图1 高级醇的毒性
Fig.1 The toxicity of higher alcohols
1.2 高级醇对人体危害的机理
基于高级醇在人体中的代谢可知,它对人体的危害既源于高级醇本身,也来自其代谢产生的醛或酮类物质带来的二次伤害。这类伤害主要集中于免疫抑制、肝毒性以及神经毒性。醇类物质进入血液后,因醇的溶剂特性引起的膜损伤[12],从而造成一次伤害;接着在醇脱氢酶作用下,转化成相对应的醛类物质,在长期饮酒的人体内,肝醛脱氢酶的活性显著降低[17],导致脂肪醛物质在人体大量积累,显著抑制粒细胞和单细胞吞噬功能,从而带来二次伤害[18]。同时,与高级醇代谢生成的脂肪醛相比,肝醛脱氢酶对乙醛具有更高的特异性,使得高级醇代谢产生的醛类比乙醛更容易在人体内积累,从而对人体造成持续性伤害[19]。将小鼠肝上皮细胞暴露于11种不同的短链醇中,研究发现这些醇能够与细胞膜相互作用,改变质膜的完整性,膜的破坏程度与短链醇的疏水性呈正相关[12]。高级醇相较于乙醇,其疏水性更强,因此,高级醇的肝毒性比乙醇强。多形核白细胞(polymorphonuclear leukocytes,PMNLs)在肝损伤部位的累积是造成肝炎的重要因素之一,研究表明,高级醇的摄入会增加人体内粒细胞的膜流动性和迁移活性,从而增加PMNLs迁移至肝脏进而引发肝炎的风险[20]。不同高级醇对人体的危害机理也存在差异。丁醇能与人脑神经元细胞结合,抑制磷脂酶的信号分子脂质磷脂酸形成,导致磷脂酶功能的改变,引发神经中毒[21];正丁醇与毒蕈碱受体相互作用,抑制卡巴胆碱介导的神经突起生长[22],从而破坏星形胶质细胞的增殖,并导致大脑病变;丁醇也能通过母体进入胎循环,影响胎儿神经发育,引发胎儿酒精谱系障碍[23]。异丙醇能刺激胃肠黏膜,导致胃肠功能紊乱[24]。异丙醇也能抑制脑干从而影响中枢神经系统,引发呼吸动力减弱和低血压等病症。而芳香族高级醇能穿过血脑屏障,抑制神经递质的释放和酶的活性,从而抑制中枢神经系统[15]。
高级醇对人体的危害不可忽视。但高级醇作为饮料酒中的特征风味成分,又不可或缺。因此,在饮酒时不可避免要摄取高级醇。为保证饮料酒的产品安全及饮酒爱好者的饮用安全,针对饮料酒中高级醇与乙醇的协同作用对人体的危害方面的研究、高级醇调控技术有待加强。
2 发酵调控降高级醇
在酵母菌中,高级醇主要通过Ehrlich途径及Harris途径进行合成(图2)。在Ehrlich途径中,各氨基酸在氨基转移酶的催化作用下生成各高级醇对应的前体物α-酮酸,α-酮酸在脱羧酶的作用下生成相应的脂肪醛和CO2;脂肪醛在醇脱氢酶的作用下,通过加氢作用还原生成相应的高级醇[7]。通过Ehrlich途径,苏氨酸、缬氨酸、亮氨酸和苯丙氨酸可以转化成对应的高级醇正丙醇、异丁醇、异戊醇和β-苯乙醇。在Harris途径中,糖通过糖酵解途径生成丙酮酸,丙酮酸在ILVs基因编码的乙酰乳酸合酶、羟酸还原异构酶和二羟酸脱水酶及LEUs基因编码的2-异丙基苹果酸合酶、3-异丙基苹果酸脱水酶和3-异丙基苹果酸脱氢酶的催化作用下生成α-酮酸,α-酮酸通过脱羧和加氢还原反应生成相应的高级醇。研究表明,葡萄酒中异丁醇、异戊醇和2-甲基-1-丁醇总量的75%来自Harris途径,25%来自Ehrlich途径[25]。在发酵的前期,氮源充足,发酵液中游离的氨基氮较多,高级醇的产生主要源于氨基酸分解代谢途径。而在发酵的中后期,发酵液中的游离氨基态氮被大量消耗,此时,合成代谢途径为高级醇合成的主要途径。因此,在发酵过程中通过调控发酵液中的碳源、氮源种类含量以及碳氮比C/N,可有效调控高级醇的合成,提高乙酸酯等风味物质含量,同时提升饮料酒主体风味。

图2 酵母高级醇合成代谢网络
Fig.2 Biosynthetic pathways for higher alcohols formation in yeast
2.1 可同化氮源外源添加降高级醇
可同化氮(yeast assimilable nitrogen,YAN)是指在发酵过程中酵母优先利用的氮源,包括无机氮(铵盐等)和有机氮(氨基酸、尿素),其参与酵母的糖运输和蛋白质合成,对酵母的生长与代谢至关重要。研究表明,YAN通过影响高级醇代谢途径中相关基因的表达,从而影响高级醇的合成。在含氮量较低的发酵液中,外源添加YAN会激活Ehrlich途径,促进氨基酸分解,增加高级醇的合成。当发酵液中YAN达到200~300 mg/L时,外源添加YAN可有效下调Harris途径相关基因的表达,降低高级醇的合成[26]。当发酵液中YAN含量超过500 mg/L时,易诱导产生氨基甲酸乙酯及生物胺等有害物质[27-28]。因此,在发酵过程中,控制发酵液中YAN源的含量,可以有效调控高级醇的合成。
2.1.1 可同化氮源外源添加降高级醇的应用研究
目前,通过YAN的外源添加降高级醇的研究已广泛报道(表1)。研究表明,在黄酒发酵过程中添加200 mg/L NH4Cl或200 mg/L (NH4)2HPO4,高级醇含量分别降低64%及23.99%~24.72%[28-30];在巴西白酒发酵过程中,添加440 mg/L (NH4)2SO4,高级醇含量降低15.6%[31];在葡萄酒发酵过程中,分别添加250 mg/L (NH4)2HPO4、240 mg/L的混合YAN[m(氨基酸)∶m(铵盐)=2∶3]及320 mg/L的混合氨基酸,高级醇含量分别降低43.4%、47.2%及51.8%[27,32-33];在白酒发酵过程中添加苏氨酸,高级醇含量降低41.4%[34]。与有机氮源相比,无机氮的氨基能参与丙酮酸-乙酰乳酸系统,用于合成氨基酸且同时抑制Ehrlich途径,降低氨基酸的消耗,因此无机YAN的添加更能有效降低饮料酒中高级醇含量[29]。当添加等量YAN时,铵盐的降醇效果要比氨基酸显著,其中NH4Cl添加效果最佳,其次为(NH4)2HPO4、NH4HCO3与(NH4)2SO4,高级醇含量分别降低64%、56.5%、43%及39.9%。除苯丙氨酸和亮氨酸的外源添加会激活Ehrlich途径并显著提升发酵液中苯乙醇和异戊醇的含量外,氨基酸外源添加都有适量的降醇效果,其中最显著的是精氨酸的添加,高级醇含量降低36.3%[28]。
表1 外源添加可同化氮源降饮料酒中高级醇
Table 1 Total higher alcohols changing after YAN adding during alcoholic beverage brewing
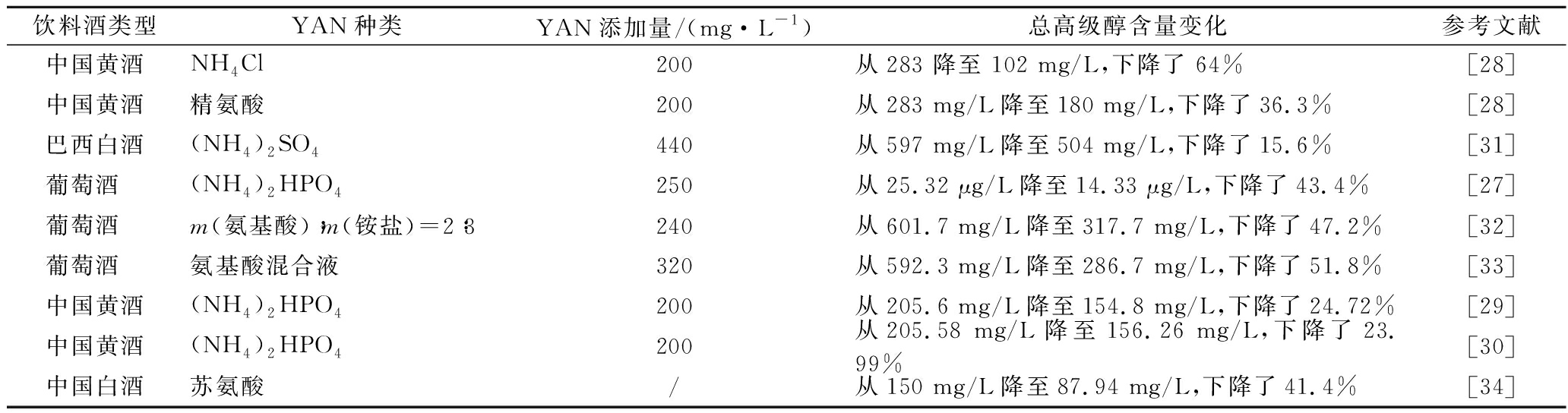
饮料酒类型YAN种类YAN添加量/(mg·L-1 )总高级醇含量变化参考文献中国黄酒NH4Cl200从283 降至 102 mg/L,下降了 64%[28]中国黄酒精氨酸200从283 mg/L降至180 mg/L,下降了36.3%[28]巴西白酒(NH4)2SO4440从597 mg/L降至504 mg/L,下降了15.6%[31]葡萄酒 (NH4)2HPO4250从25.32 μg/L降至14.33 μg/L,下降了43.4%[27]葡萄酒 m(氨基酸)∶m(铵盐)=2∶3240从601.7 mg/L降至317.7 mg/L,下降了47.2%[32]葡萄酒 氨基酸混合液320从592.3 mg/L降至286.7 mg/L,下降了51.8%[33]中国黄酒(NH4)2HPO4200从205.6 mg/L降至154.8 mg/L,下降了24.72%[29]中国黄酒(NH4)2HPO4200从205.58 mg/L降至156.26 mg/L,下降了23.99%[30]中国白酒苏氨酸/从150 mg/L降至87.94 mg/L,下降了41.4%[34]
注:/表示引用文献未注明添加量
适量的YAN添加不仅能降低发酵过程中高级醇的产生,还能给饮料酒带来其他益处。LIU等[28]在发酵初期添加YAN,不仅降低黄酒中高级醇含量,还增加黄酒中酯类物质和氨基酸含量,丰富黄酒的风味,提升黄酒的营养价值。YAN的添加还能在降醇的同时提升饮料酒中乙酸酯与乙酯的含量,增添饮料酒的风味,如添加257 mg/L (NH4)2HPO4,饮料酒中乙酸异丁酯、乙酸异戊酯、乙酸乙酯、己酸乙脂及辛酸乙酯从0.1、1.38、32.15、1.78与2.73 mg/L分别提升至0.22、2.69、36.8、1.94、3.25 mg/L[35-36]。与此同时,YAN的添加对饮料酒中乙醇、总酸及生物胺含量并不会产生显著影响,如添加200 mg/L NH4Cl,饮料酒中生物胺含量从34 mg/L提高到36 mg/L,乙醇含量从17.4%将至17.0%,差异不显著[28];添加200 mg/L (NH4)2HPO4,饮料酒中有机酸含量从2.935 g/L提升到3.032 g/L,差异不显著[29]。即在饮料酒发酵过程中适量添加YAN,可有效降低高级醇的合成,同时提高饮料酒中的酯类物质含量[28,31]。
目前YAN源添加的相关研究主要集中在发酵前期一次性添加,因此后续可探究YAN的不同发酵阶段添加或分阶段多次添加对饮料酒中高级醇合成的影响。有机氮大量存在于天然原料中,易被利用添加到发酵食品中,特别是在饮料酒生产中,选择相应的含氮量高的天然原料代替铵盐、氨基酸等进行外源添加不仅降低生产成本,还能起到降高级醇的作用。
2.1.2 可同化氮源外源添加降高级醇的机制解析
目前研究发现[7,28],酵母中高级醇代谢相关基因主要包括氨基酸跨膜运输途径上BAP2、高级醇合成通路Ehrlich途径与Harris途径上BATs、ILVs、PDCs、THI3、ADHs与SFA1(图2)、乙酸酯合成途径ATFs(图3)以及三羧酸循环(tricarboxylic acid cycle,TCA)通路上相关基因,而YAN的添加能显著影响上述基因的表达[28]。研究发现,相较于200 mg/L,YAN的外源添加为400 mg/L时,BAP2在稳定期下调显著,BAP2编码支链氨基酸通透酶,BAP2的下调降低酵母胞内支链氨基酸水平,进而削弱Ehrlich高级醇合成途径。YAN的添加也可显著影响Ehrlich途径上BATs与Harris途径上ILVs基因表达,降低前体物α-酮酸的积累,抑制高级醇的合成。BAT2编码胞质支链氨基酸转移酶,YAN的添加显著下调BAT2基因的表达[30],抑制氨基酸的转氨作用,降低α-酮酸合成;BAT1编码线粒体支链氨基酸转移酶,催化α-酮酸转化为支链氨基酸,(NH4)2HPO4的添加显著上调BAT1基因的表达[28]。PDC1、PDC5、PDC6、THI3等基因编码的脱羧酶催化α-酮酸转化为醛类物质,ADH3、ADH4、ADH5、ADH6、SFA1编码醇脱氢酶催化醛类物质在加氢还原作用下生成相应的高级醇,此类基因在添加YAN后均表现出下调,从而降低高级醇的生成[31]。SEGUINOT等[36]通过CO2失重试验发现,在发酵初期及稳定期添加(NH4)2HPO4与氨基酸混合液均会促进糖酵解,且上调谷氨酸脱氢酶I基因(GDH1) 与谷氨酰胺合成酶1基因 (GLN1) 表达,促进α-酮戊二酸转化为谷氨酸,从而竞争性抑制Harris途径,最终降低饮料酒中高级醇含量[29,37]。YAN的外源添加,不仅能降低高级醇的合成,还能增强高级醇转化为乙酸酯(图3)。研究发现,YAN的添加,尤其是在稳定期的添加,会上调编码乙酰基转移酶基因ATF1和ATF2的表达,强化高级醇转化为乙酸酯,从而降低饮料酒中高级醇含量[36]。
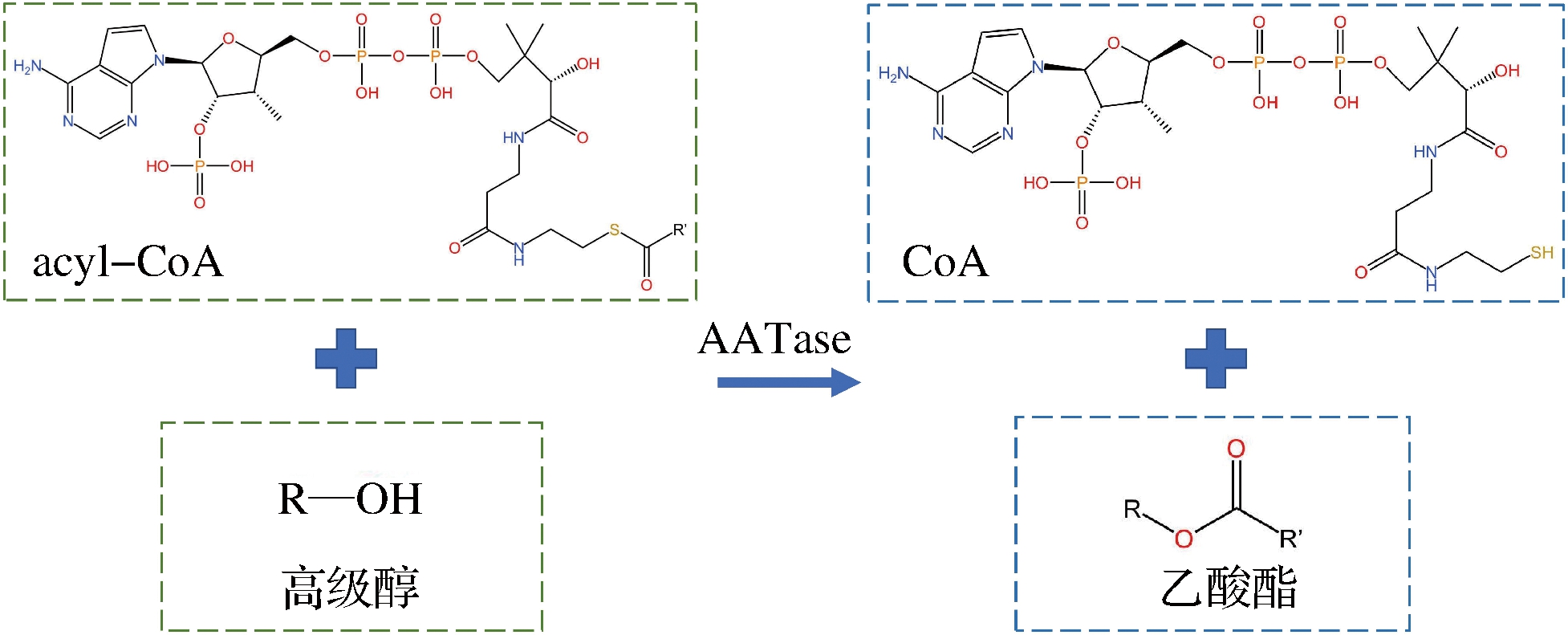
图3 高级醇合成乙酸酯的代谢通路
Fig.3 The pathway of acetate esters formation from higher alcohols
注:acyl-CoA-酰基辅酶A;CoA-辅酶A;AATase-醇乙酰基转移酶,由基因ATF1、ATF2、Lg-ATF1编码
2.2 碳源种类、含量及碳氮比对发酵产高级醇的影响
饮料酒生产所用的可发酵碳源主要包括葡萄糖、果糖、蔗糖、麦芽糖、麦芽三糖和糊精等。糖类型及其浓度直接影响酒精发酵效率和酵母代谢。研究表明外源添加不同碳源,饮料酒发酵产高级醇含量不同,其中添加不同碳源发酵所产高级醇含量按大小顺序为果糖>麦芽糖>蔗糖>葡萄糖[38]。因此,在酒体酿造过程中通过添加不同类型的碳源,可有效降低高级醇的合成。
除碳源种类外,碳源的浓度也对酵母发酵产高级醇的能力具有显著影响。研究表明,当发酵底物中蔗糖的含量增加时,高级醇的产量会随之上升[39]。与14°P的麦汁为底物发酵产高级醇相比,艾尔酵母在18°P的麦汁下高级醇含量提高12.9%,其中正丙醇含量提高最为显著,提升53.8%[40]。推测高糖浓度可以促进氨基转移酶相关基因表达[41-42],而正丙醇主要通过Ehrlich途径产生,因而其产量变化受碳源浓度影响最大。因此,通过调控发酵液中的碳源浓度,也可有效降低饮料酒发酵过程中高级醇的含量。
外源添加适量的可同化碳氮源可以有效降低高级醇,在实际操作过程中,除了考虑YAN的添加量,还应考虑发酵液初始碳氮比(C/N)。研究表明,高级醇的含量随初始发酵液C/N的降低而增加[43]。在发酵初期,YAN添加会在一定程度降低C/N,因此应该同时考虑同步添加一定碳源,维持合适的C/N,以降低高级醇的生成。当发酵液中氨基酸含量充足时,微生物并不需要通过丙酮酸合成途径生成氨基酸,Harris途径被抑制。在发酵中后期,随着氨基酸的大量消耗,Harris途径被激活,大量高级醇通过Harris途径合成产出。因此,为降低高级醇的含量,在发酵中后期维持一定浓度的YAN含量可有效抑制Harris途径,降低高级醇的合成。若在发酵初期添加过量YAN可能促使正丙醇的大量合成,同时也增加生物胺和氨基甲酸乙酯累积的风险。因此在发酵中后期,通过补料的方式维持合适的YAN含量以及适宜的C/N能有效地降低高级醇合成。
3 其他工艺调控降高级醇
在发酵过程中,除了调控碳源、氮源等直接参与高级醇合成代谢的发酵工艺外,其他工艺如发酵参数、曲种工艺及后处理陈化工艺同样能够降低饮料酒中高级醇的含量,如图4所示。

图4 降低高级醇的措施
Fig.4 The way to reduce higher alcohols
3.1 发酵温度对高级醇合成的影响
发酵温度影响着微生物体内各类酶系活性从而影响代谢活动。在饮料酒发酵过程中,温度作为关键调控因素之一,影响着酵母的生长及代谢,高级醇作为重要代谢产物之一受温度影响较大。研究表明,YAN含量是影响高级醇合成的主要参数之一,其影响程度受温度的调控[35]。低温会降低酵母的YAN利用率,从而降低高级醇的合成速率[44]。Ehrlich与Harris途径中相关基因表达也受温度调控。研究表明,在低温条件下,高级醇的产量与发酵温度呈正相关。当温度进一步提高时,发酵温度对高级醇合成影响的显著性下降。在20 ℃条件下进行啤酒酿造,高级醇的含量远高于10 ℃,而在25 ℃条件下,高级醇的含量与20 ℃相比差异不显著。YIN等[34]通过响应面法研究发现,在32 ℃条件下,白酒发酵产生的高级醇含量最低。温度对于各类高级醇生成的影响也存在差异。研究表明,温度对2-苯乙醇的影响效果最为显著,发酵温度从20 ℃降至10 ℃,2-苯乙醇的含量降低76.4%;其次是异丙醇、异戊醇和异丁醇,分别降低64.8%、43.8%和18%[45],此差异可能与Ehrlich途径和Harris途径中相关酶活力对温度的敏感度不同有关[46]。总体而言,对于不同饮料酒发酵产高级醇,温度的影响效果虽有不同,但低温发酵有利于降低饮料酒中高级醇的含量。同时,低温发酵有利于增加饮料酒中乙酯与乙酸酯的含量。研究发现,20 ℃下,榴莲酒中辛酸乙酯、壬酸乙酯、癸酸乙酯、乙酸乙酯与乙酸异戊酯的含量显著高于30 ℃,分别提升了43.1%、170.7%、128.0%、35.2%与157.9%[45];13 ℃下,葡萄酒中乙酸异戊酯、己酸乙酯与辛酸乙酯的含量显著高于25 ℃,分别提升了81.8%、13.9%与4.2%[47]。
3.2 曲种对高级醇合成的影响
高级醇是酵母生长代谢过程中产生的一类副产物,不同的酵母菌株,在相同环境下代谢产生的高级醇含量亦有不同[48]。除酵母菌株差异外,酵母的状态也对饮料酒发酵产高级醇具有影响。研究发现,与鲜酵母酿酒相比,采用干粉酵母进行酿酒,酒体中高级醇含量较高[49]。采用混菌发酵酿造葡萄酒以及采用曲种发酵酿造黄酒或是传统白酒,酿造体系皆是多菌株混合发酵。研究表明,相较于酿酒酵母单菌株发酵,酿酒酵母与毕赤酵母混合发酵产生较少高级醇[50],这可能与酿酒酵母与毕赤酵母之间的物理接触(细胞接触),调节微生物代谢活性,抑制Ehrlich途径,从而降低异丁醇、异戊醇及2-苯乙醇的合成有关[51]。毕赤酵母与酿酒酵母的比例对高级醇的合成具有显著影响,JIANG等[43]通过响应面优化和模型预测,发现当毕赤酵母与酿酒酵母的比例为104.08∶105时,高级醇含量下降65.1%。目前,在部分饮料酒生产过程中,通过外源添加非酿酒酵母协同酿酒酵母作为混合发酵剂进行酒体酿造,除降低高级醇含量外,还有助于增加饮料酒的风味物质[52]。因此,可通过选育一株低产高级醇的非酿酒酵母,将其外源添加协同酿酒酵母进行混合发酵,从而降低酿酒酵母的丰度,增加酵母间物理接触,以降低高级醇的合成。
制曲工艺对曲种的菌群丰度及菌株类型具有显著影响。机械化生产工艺是饮料酒发展的必由之路。白酒发酵从传统工艺转向新机械工艺必然会带来微生物群落与风味物质的变化。与传统工艺相比,新机械工艺白酒发酵前期,酿酒酵母的含量较高,产生更多的高级醇[53]。宏基因组测序结果显示,在高级醇生产的主要阶段,与新工艺相比,传统工艺基因丰度高,酵母菌数少,因此高级醇含量低,即酵母含量高可能是新工艺中高级醇含量高于传统工艺的主要原因[53]。
3.3 后处理及陈化工艺降高级醇
饮料酒的陈化工艺,可以增加酒精分子和水分子间缔合度,促进酒体中酯类物质的化学合成;可以增加物质的活化能,加强分子间的有效碰撞促进酯化、氧化和缩合等反应,从而提升酒体香气;还可以加速低沸点物质如硫化氢、乙醛等的挥发,消除酒体的辛辣等异味[54]。传统陈化工艺所需时间长,效果不稳定,于是诞生出许多催陈工艺技术,这些工艺技术皆有助于降低饮料酒中高级醇含量,但同时亦会影响饮料酒的主体风味。
3.3.1 传统吸附剂降低饮料酒高级醇
活性炭是一种疏水吸附剂,其表面由大量大小不同、形状不一的微孔组成,具有较大的比表面积(600~1 600 m2/g)。活性炭可有效吸附一些大分子,如高级醇。除吸附大分子外,活性炭的表面富含各种金属离子和微量元素,可加速饮料酒中一系列复杂的陈酿反应,从而有效催陈饮料酒。据报道,在饮料酒中添加0.5‰~1‰的活性炭处理24 h,可有效降低饮料酒中高级醇的含量[55]。但是,活性炭作为一种非特异吸附剂,在吸附高级醇的同时,也会吸附饮料酒中的风味物质,其吸附效果与活性炭添加量成正比,研究发现,当添加量为0.05‰时,活性炭对白酒中酯类风味物质吸附较少,其中乙酸乙酯、乳酸乙酯及丁酸乙酯分别下降了21%、22.8%及5.7%[55]。因此采用活性炭吸附高级醇时需注意添加量,避免吸附过多的风味物质,对饮料酒风味造成破坏。研究表明,粉末状活性炭的吸附效果要优于颗粒状活性炭,但粉末状活性炭的添加会造成酒体后期过滤困难等问题,因此粉状活性炭的添加量不宜过大,可与颗粒状活性炭按比例混合添加,以催陈酒体[56]。
大孔吸附树脂是一类不含交换基团且具有大孔结构的高分子吸附树脂,可有效吸附饮料酒中高级醇。在实际应用中,采用大孔吸附树脂对饮料酒进行高级醇吸附,无需额外增加新工艺且不会引入不良杂质。在黄酒发酵过程中,添加5、10、15 g/L的吸附树脂,在80 r/min、30 ℃下处理2 h,黄酒中的高级醇含量分别降低到1年自然陈黄酒、3年自然陈黄酒和8年自然陈黄酒的水平[57]。
3.3.2 超声波催陈降低饮料酒中高级醇
相比活性炭和树脂催陈,超声波催陈是一种绿色加工技术,不会引入外来物质,造成二次污染。与传统自然陈酿方法相比,它具有高效、低能耗的优点。超声波的声学振动通过物理效应形成微机械冲击与化学效应形成的自由基改变饮料酒中化学成分,从而改善饮料酒的品质,其陈化原理与传统自然陈化相似,只是加速该过程[58]。超声波处理工艺分为超声波探头和超声浴两种,不同饮料酒适用不同处理工艺。研究表明,在超声波作用时间为30 min、温度为30 ℃、功率为150 W的条件下,高级醇的降解率最大,最终含量为306.75 mg/L,降解率为40.44%[59]。基于饮料酒模型可知,葡萄酒中的酒石酸和离子等物质会影响葡萄酒中高级醇的降解率,这可能是由于超声空化及其后续反应产生的自由基所致[58]。同时,超声波与SO2的联用处理白葡萄酒,可获得口感宜人、风味独特的葡萄酒[60]。
4 结语
高级醇普遍存在于饮料酒中,适量高级醇可使饮料酒的口感更加丰满和协调,但过高的高级醇含量会破坏酒体风味且在饮用后给人体健康造成危害。因此,综述高级醇的危害及机理,在饮料酒酿造过程中,通过优化发酵工艺及后处理工艺等方法调控高级醇的合成,既保证饮料酒的风味,又不会对人体造成危害具有重要的意义及价值。
目前,高级醇对人体危害方面的研究仅停留在高级醇本身,对其代谢副产物如醛和酮相关危害的报道较少。饮料酒中高级醇的种类繁多,高级醇之间、高级醇与乙醇之间存在协同或拮抗作用,相关的作用机制尚有待于进一步研究。以饮料酒为高级醇的来源进行细胞、动物和临床实验,以探究饮料酒中高级醇对人体造成危害的阈值范围,并结合现有的高级醇调控策略与技术,包括发酵工艺调控及后处理工艺,以降低饮料酒中高级醇含量,为酿造高品质饮料酒及科学饮酒提供借鉴。
[1] MISSBACH B, MAJCHRZAK D, SULZNER R, et al. Exploring the flavor life cycle of beers with varying alcohol content[J]. Food Science &Nutrition, 2017, 5(4):889-895.
[2] LYTRA G, MIOT-SERTIER C, MOINE V, et al. Influence of must yeast-assimilable nitrogen content on fruity aroma variation during malolactic fermentation in red wine[J]. Food Research International, 2020, 135:109294.
[3] ZHENG N, JIANG S, HE Y H, et al. Production of low-alcohol Huangjiu with improved acidity and reduced levels of higher alcohols by fermentation with scarless ALD6 overexpression yeast[J]. Food Chemistry, 2020, 321:126691.
[4] 格绒泽仁, 皇甫洁, 韩兴林, 等. 浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J]. 食品与发酵工业, 2019, 45(14):191-195.
GE R, HUANGFU J, HAN X L, et al. A method for determining associations between drinking discomforts and key higher alcohols in strong-aroma Baijiu[J]. Food and Fermentation Industries, 2019, 45(14):191-195.
[5] ZHANG C Y, QI Y N, MA H X, et al. Decreased production of higher alcohols by Saccharomyces cerevisiae for Chinese rice wine fermentation by deletion of Bat aminotransferases[J]. Journal of Industrial Microbiology &Biotechnology, 2015, 42(4):617-625.
[6] 崔云前, 叶国超, 魏丽培, 等. 降低上面发酵小麦啤酒头痛感的酿造条件优化[J]. 中国酿造, 2016, 35(5):134-138.
CUI Y Q, YE G C, WEI L P, et al. Optimization of top-fermented wheat beer brewing technology to reduce headache[J]. China Brewing, 2016, 35(5):134-138.
[7] 孙中贯, 刘琳, 王亚平, 等. 酿酒酵母高级醇代谢研究进展[J]. 生物工程学报, 2021, 37(2):429-447.
SUN Z G, LIU L, WANG Y P, et al. Higher alcohols metabolism by Saccharomyces cerevisiae: A mini review[J]. Chinese Journal of Biotechnology, 2021, 37(2):429-447.
[8] WANG L H, ZHU L, ZHENG F P, et al. Determination and comparison of flavor (retronasal) threshold values of 19 flavor compounds in Baijiu[J]. Journal of Food Science, 2021, 86(5):2 061-2 074.
[9] PENNING R, MCKINNEY A, VERSTER J C. Alcohol hangover symptoms and their contribution to the overall hangover severity[J]. Alcohol and Alcoholism, 2012, 47(3):248-252.
[10] XIE J A, TIAN X F, HE S G, et al. Evaluating the intoxicating degree of liquor products with combinations of fusel alcohols, acids, and esters[J]. Molecules, 2018, 23(6):1239.
[11] LANG K, V LI M, SZÜCS S, et al. The composition of surrogate and illegal alcohol products in Estonia[J]. Alcohol and Alcoholism, 2006, 41(4):446-450.
LI M, SZÜCS S, et al. The composition of surrogate and illegal alcohol products in Estonia[J]. Alcohol and Alcoholism, 2006, 41(4):446-450.
[12] LACHENMEIER D W, REHM J, GMEL G. Surrogate alcohol: What do we know and where do we go?[J]. Alcoholism: Clinical and Experimental Research, 2007, 31(10):1 613-1 624.
[13] World Health Organization.Global status report on alcohol and health .Geneva:World Health Organization,2018.
[14] PENEDA J, BAPTISTA A, LOPES J M. Interaction of the constituents of alcoholic beverages in the promotion of liver damage[J]. Acta Medica Portuguesa, 1994, 7(Suppl 1): S51-S55.
[15] RUPPERT M, FRANZ M, SARATSIS A, et al. Hangover links nuclear RNA signaling to cAMP regulation via the phosphodiesterase 4d ortholog dunce[J]. Cell Reports, 2017, 18(2):533-544.
[16] DÉSY O, CARIGNAN D, DE CAMPOS-LIMA P O. Short-term immunological effects of non-ethanolic short-chain alcohols[J]. Toxicology Letters, 2012, 210(1):44-52.
[17] LIEBER C S. Ethanol metabolism, cirrhosis and alcoholism[J]. Clinica Chimica Acta, 1997, 257(1):59-84.
[18]  RNYAS E M, P
RNYAS E M, P L L, BARANYI G, et al. Metabolites of aliphatic alcohols detected in alcoholic beverages inhibit phagocytosis[J]. Alcohol and Alcoholism, 2016, 51(4):388-394.
L L, BARANYI G, et al. Metabolites of aliphatic alcohols detected in alcoholic beverages inhibit phagocytosis[J]. Alcohol and Alcoholism, 2016, 51(4):388-394.
[19] KLYOSOV A A. Kinetics and specificity of human liver aldehyde dehydrogenases toward aliphatic, aromatic, and fused polycyclic aldehydes[J]. Biochemistry, 1996, 35(14):4 457-4 467.
[20] P L L, BUJDOS
L L, BUJDOS O, SZÜCS S, et al. How do methanol and higher alcohols found in alcoholic beverages affect membrane fluidity and migration of granulocytes?[J]. Journal of Food Biochemistry, 2018, 42(5): e12593.
O, SZÜCS S, et al. How do methanol and higher alcohols found in alcoholic beverages affect membrane fluidity and migration of granulocytes?[J]. Journal of Food Biochemistry, 2018, 42(5): e12593.
[21] WATANABE H, YAMAZAKI M, MIYAZAKI H, et al. Phospholipase D2 functions as a downstream signaling molecule of MAP kinase pathway in L1-stimulated neurite outgrowth of cerebellar granule neurons[J]. Journal of Neurochemistry, 2004, 89(1):142-151.
[22] GUIZZETTI M, MOORE N H, GIORDANO G, et al. Ethanol inhibits neuritogenesis induced by astrocyte muscarinic receptors[J]. Glia, 2010, 58(12):1 395-1 406.
[23] BALE A S, LEE J S. An overview of butanol-induced developmental neurotoxicity and the potential mechanisms related to these observed effects[J]. Neurotoxicology and Teratology, 2016, 53:33-40.
[24] SLAUGHTER R J, MASON R W, BEASLEY D M G, et al. Isopropanol poisoning[J]. Clinical Toxicology, 2014, 52(5):470-478.
[25] 秦伟帅. 葡萄酒酵母遗传操作构建高级醇低产菌株的研究. 泰安: 山东农业大学, 2013.
QIN W S. Construction of wine yeast strain with low-yield higher alcohols by genetic manipulation. Taian: Shandong Agricultural University, 2013.
[26] WANG Y P, SUN Z G, ZHANG C Y, et al. Comparative transcriptome analysis reveals the key regulatory genes for higher alcohol formation by yeast at different α-amino nitrogen concentrations[J]. Food Microbiology, 2021, 95:103713.
[27] GOBBI M, COMITINI F, D’IGNAZI G, et al. Effects of nutrient supplementation on fermentation kinetics, H2S evolution, and aroma profile in Verdicchio DOC wine production[J]. European Food Research and Technology, 2013, 236(1):145-154.
[28] LIU S P, MA D L, LI Z H, et al. Assimilable nitrogen reduces the higher alcohols content of Huangjiu[J]. Food Control, 2021, 121:107660.
[29] ZHONG X F, WANG A L, ZHANG Y B, et al. Reducing higher alcohols by nitrogen compensation during fermentation of Chinese rice wine[J]. Food Science and Biotechnology, 2020, 29(6):805-816.
[30] HUANG G D, REN H, WANG A L, et al. iTRAQ-based proteomic analysis reveals the molecule mechanism of reducing higher alcohols in Chinese rice wine by nitrogen compensation[J]. Annals of Microbiology, 2021, 71:1-13.
[31] VIDAL E E, DE BILLERBECK G M, SIM ES D A, et al. Influence of nitrogen supply on the production of higher alcohols/esters and expression of flavour-related genes in cachaça fermentation[J]. Food Chemistry, 2013, 138(1):701-708.
ES D A, et al. Influence of nitrogen supply on the production of higher alcohols/esters and expression of flavour-related genes in cachaça fermentation[J]. Food Chemistry, 2013, 138(1):701-708.
[32] JIMÉNEZ-MART E, ARANDA A, MENDES-FERREIRA A, et al. The nature of the nitrogen source added to nitrogen depleted vinifications conducted by a Saccharomyces cerevisiae strain in synthetic must affects gene expression and the levels of several volatile compounds[J]. Antonie Van Leeuwenhoek, 2007, 92(1):61-75.
E, ARANDA A, MENDES-FERREIRA A, et al. The nature of the nitrogen source added to nitrogen depleted vinifications conducted by a Saccharomyces cerevisiae strain in synthetic must affects gene expression and the levels of several volatile compounds[J]. Antonie Van Leeuwenhoek, 2007, 92(1):61-75.
[33] TORREA D, VARELA C, UGLIANO M, et al. Comparison of inorganic and organic nitrogen supplementation of grape juice-Effect on volatile composition and aroma profile of a Chardonnay wine fermented with Saccharomyces cerevisiae yeast[J]. Food Chemistry, 2011, 127(3):1 072-1 083.
[34] YIN Y J, HAN X L, LU Y F, et al. Control of N-propanol production in simulated liquid state fermentation of Chinese Baijiu by response surface methodology[J]. Fermentation, 2021, 7(2):85.
[35] MOURET J R, CAMARASA C, ANGENIEUX M, et al. Kinetic analysis and gas-liquid balances of the production of fermentative aromas during winemaking fermentations: Effect of assimilable nitrogen and temperature[J]. Food Research International, 2014, 62:1-10.
[36] SEGUINOT P, ROLLERO S, SANCHEZ I, et al. Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J]. Food Microbiology, 2018, 76:29-39.
[37] MARA P, FRAGIADAKIS G S, GKOUNTROMICHOS F, et al. The pleiotropic effects of the glutamate dehydrogenase (GDH) pathway in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2018, 17(1):1-13.
[38] 谢克林, 冯涛, 庄海宁, 等. 外源可发酵糖对葡萄酒挥发性化合物的影响[J]. 食品科学, 2016, 37(18):113-119.
XIE K L, FENG T, ZHUANG H N, et al. Influence of different exogenous fermentable sugars on volatile compounds of wine[J]. Food Science, 2016, 37(18):113-119.
[39] HE Y, DONG J J, YIN H, et al. Wort composition and its impact on the flavour-active higher alcohol and ester formation of beer-a review[J]. Journal of the Institute of Brewing, 2014, 120(3):157-163.
[40] SAERENS S M G, VERBELEN P J, VANBENEDEN N, et al. Monitoring the influence of high-gravity brewing and fermentation temperature on flavour formation by analysis of gene expression levels in brewing yeast[J]. Applied Microbiology and Biotechnology, 2008, 80(6):1 039-1 051.
[41] RAUTIO J J, HUUSKONEN A, VUOKKO H, et al. Monitoring yeast physiology during very high gravity wort fermentations by frequent analysis of gene expression[J]. Yeast, 2007, 24(9):741-760.
[42] EDEN A, VAN NEDERVELDE L, DRUKKER M, et al. Involvement of branched-chain amino acid aminotransferases in the production of fusel alcohols during fermentation in yeast[J]. Applied Microbiology and Biotechnology, 2001, 55(3):296-300.
[43] JIANG J A, LIU Y C, LI H H, et al. Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J]. Journal of Agricultural and Food Chemistry, 2019, 67(38):10 694-10 701.
[44] PIZARRO F J, JEWETT M C, NIELSEN J, et al. Growth temperature exerts differential physiological and transcriptional responses in laboratory and wine strains of Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2008, 74(20):6 358-6 368.
[45] LU Y Y, VOON M K W, HUANG D J, et al. Combined effects of fermentation temperature and pH on kinetic changes of chemical constituents of durian wine fermented with Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2017, 101(7):3 005-3 014.
[46] SUN Z G, WANG M Q, WANG Y P, et al. Identification by comparative transcriptomics of core regulatory genes for higher alcohol production in a top-fermenting yeast at different temperatures in beer fermentation[J]. Applied Microbiology and Biotechnology, 2019, 103(12):4 917-4 929.
[47] BELTRAN G, NOVO M, GUILLAM N J M, et al. Effect of fermentation temperature and culture media on the yeast lipid composition and wine volatile compounds[J]. International Journal of Food Microbiology, 2008, 121(2):169-177.
N J M, et al. Effect of fermentation temperature and culture media on the yeast lipid composition and wine volatile compounds[J]. International Journal of Food Microbiology, 2008, 121(2):169-177.
[48] 张兴亚. 黄酒中高级醇含量控制的工艺研究. 杭州: 浙江工商大学, 2012.
ZHANG X Y. Process study on higher alcohols control in Chinese rice wine. Hangzhou: Zhejiang Gongshang University, 2012.
[49] ROMANO P, PIETRAFESA R, ROMANIELLO R, et al. Impact of yeast starter formulations on the production of volatile compounds during wine fermentation[J]. Yeast, 2015, 32(1):245-256.
[50] CIANI M, CAPECE A, COMITINI F, et al. Yeast interactions in inoculated wine fermentation[J]. Frontiers in Microbiology, 2016, 7:555.
[51] HU K, ZHAO H Y, EDWARDS N, et al. The effects of cell-cell contact between Pichia kluyveri and Saccharomyces cerevisiae on amino acids and volatiles in mixed culture alcoholic fermentations[J]. Food Microbiology, 2022, 103:103960.
[52] PETITGONNET C, KLEIN G L, ROULLIER-GALL C, et al. Influence of cell-cell contact between L. thermotolerans and S. cerevisiae on yeast interactions and the exo-metabolome[J]. Food Microbiology, 2019, 83:122-133.
[53] HU Y L, YANG Q, CHEN D, et al. Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J]. Food Research International, 2021, 140:109876.
[54] JIA W, FAN Z B, DU A, et al. Molecular mechanism of high pressure shear grinding on Feng-flavour Chinese Baijiu ageing[J]. Food Research International, 2022, 153:110957.
[55] 胡莉, 鲁珍, 李伟. 酒用活性炭对粮食白酒的催熟[J]. 酿酒, 2017, 44(2):99-101.
HU L, LU Z, LI W. The ripening of grain liquor with activated carbon[J]. Liquor Making, 2017, 44(2):99-101.
[56] 余东, 文静, 蒋安华, 等. 酒用活性炭去除酒尾异杂味的研究[J]. 酿酒, 2019, 46(1):67-69.
YU D, WEN J, JIANG A H, et al. Study on removal of bad flavor from tail wine by activated carbon[J]. Liquor Making, 2019, 46(1):67-69.
[57] 闫春明. 降低新酿黄酒中高级醇含量研究. 合肥: 合肥工业大学, 2017.
YAN C M. Study on reducing the content of higher alcohols in semi-dry yellow wine. Hefei: Hefei University of Technology, 2017.
[58] ![]() K,
K, ![]() N, et al. Quality characteristics of white wine: The short- and long-term impact of high power ultrasound processing[J]. Ultrasonics Sonochemistry, 2020, 68:105194.
N, et al. Quality characteristics of white wine: The short- and long-term impact of high power ultrasound processing[J]. Ultrasonics Sonochemistry, 2020, 68:105194.
[59] ZHANG Q G, XU B W, CHEN B Y, et al. Ultrasound as an effective technique to reduce higher alcohols of wines and its influencing mechanism investigation by employing a model wine[J]. Ultrasonics Sonochemistry, 2020, 61:104813.
[60] CUI Y, LV W, LIU J F, et al. Effect of different ending fermentation technologies on microbial-stability of Italian Riesling low alcohol sweet white wine[J]. Advanced Materials Research, 2011, 393-395:1 165-1 168.