中国作为粮食生产消费大国,对粮食作物的开发利用是国内研究的热点内容。玉米和小麦是我国传统的种植作物,利用酶解等方法对粮食原料进一步加工可从中获得相应的低聚肽[1]。相关研究表明玉米低聚肽(以下简称玉米肽)和小麦低聚肽(以下简称小麦肽)在抗肿瘤[2]、抗氧化[3-4]、降血压[5-6]等方向展现了多样的生物活性,在作为功能性食品基础原料等研究中有巨大的应用价值。肽可作为主体与客体金属离子配位,进而形成肽-金属螯合物。该类结构利用肽的吸收机制提高了金属离子的生物利用率,可进一步发展为新型金属离子补充剂,有助于对微量元素的吸收[7-10]。
随着人们对自身健康的重视程度提高,食品药品的抗氧化能力和抗过敏活性成为该领域的研究重点。肽-金属螯合物独特的功能结构使其在食药领域有广阔的发展前景,但目前肽-金属螯合物的研究主要集中在制备工艺、金属离子吸收和抗菌活性等方向[11-13],对螯合物的抗氧化作用和抗过敏活性的研究则相对少见[14-15]。钙和铁作为人体的必需元素常被选为螯合物研究中的客体金属离子,但该两种元素与小麦肽、玉米肽的螯合物研究并不常见,注重于该类螯合物的抗氧化作用和抗过敏活性的研究也更为稀少。
本文选择无水氯化钙和氯化亚铁分别作为钙源和铁源制得的新型的玉米肽-Ca螯合物和小麦肽-Fe螯合物,对玉米肽、小麦肽和两种螯合物的抗氧化和抗过敏活性进行研究,为相关螯合物在生物活性方向和食品应用方向研究的进一步发展提供帮助。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料与试剂
玉米低聚肽、小麦低聚肽,浙江海氏生物科技有限公司;DPPH(色谱纯),Biotopped公司;乙腈(色谱纯),Fisher公司;水杨酸(分析纯),天津市光复精细化工研究所;无水氯化钙、七水合硫酸亚铁、氯化铁、抗坏血酸、磷酸二氢钠、磷酸氢二钠、无水乙醇(均为分析纯),北京化工厂;三氯乙酸、氯化亚铁、铁氰化钾(均为分析纯),天津市福晨化学试剂厂;30%过氧化氢(分析纯),西陇化工股份有限公司;三氟乙酸(分析纯),美国Alfa Aesar公司;去离子水,实验室自制。
1.1.2 仪器与设备
F30200150凯氏定氮仪,意大利Velp Scientifica公司;KQ-250E超声波振荡器,昆山市超声仪器有限公司;Dynex Spectra Mr酶标仪、EL20pH计,瑞士Mettler Toledo公司;1204007恒温水浴锅,苏州珀西瓦尔实验设备有限公司;DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司;LC-20AD高效液相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 原料低聚肽理化性质分析
参考QB/T 5298—2018和QB/T 4707—2014,分别对原料小麦肽和玉米肽进行理化性质分析[16-17]。
1.2.2 肽-金属螯合物的合成
1.2.2.1 玉米低聚肽-Ca螯合物
配制质量分数为8%的玉米低聚肽水溶液。调节溶液pH=5后,加入一定量无水氯化钙使玉米低聚肽与无水氯化钙质量比为8∶1。50 ℃下搅拌反应60 min。冷却至室温后,加入4倍体积95%(体积分数)乙醇进行醇沉,静置过夜。在4 000 r/min下离心20 min后,将沉淀取出置于37 ℃烘箱干燥,得到目标螯合物。
1.2.2.2 小麦低聚肽-Fe螯合物
配制质量分数为5%的小麦低聚肽水溶液。向溶液中加入一定量抗坏血酸使其质量分数为1%。调节溶液pH=5后,加入一定量氯化亚铁使小麦低聚肽与氯化亚铁质量比为10∶1。75 ℃下搅拌反应65 min。冷却至室温后,加入4倍体积95%乙醇进行醇沉,静置过夜。在4 000 r/min下离心20 min后,将沉淀取出置于37 ℃烘箱干燥,得到目标螯合物。
1.2.3 抗氧化能力测试
1.2.3.1 DPPH自由基清除能力测定[18]
配制不同质量浓度的样品水溶液,于96孔板中分别加入200 μL样品溶液与等体积0.1 mmol/L DPPH乙醇溶液混合,室温避光反应30 min后,测定反应液在517 nm的吸光度(AX1)。将DPPH乙醇溶液替换为无水乙醇作为对照组,将样品溶液替换为去离子水作为空白组,将无水乙醇与去离子水等体积混合溶液作为溶剂组,进行相似实验操作,并分别测定各反应液的吸光度(空白组为A01,对照组为A11,溶剂组为AS1)。对样品DPPH自由基清除率(X1)的计算如公式(1)所示:
(1)
1.2.3.2 羟自由基清除能力测定[19]
配制浓度为5 mmol/L的水杨酸乙醇溶液、过氧化氢水溶液和硫酸亚铁水溶液,以及不同浓度的样品水溶液。分别取100 μL样品溶液、200 μL水杨酸溶液和200 μL硫酸亚铁溶液依次加入到2 mL离心管中。加入100 μL过氧化氢溶液启动反应,摇匀后置于37 ℃水浴。反应1 h后取反应液200 μL加入到96孔板中,测定其在510 nm的吸光度(AX2)。对照组将过氧化氢溶液替换为去离子水启动反应。空白组将样品溶液替换为去离子水,溶剂组将样品溶液和过氧化氢溶液均替换为去离子水,进行相同实验操作,分别测定反应液吸光度(空白组为A02,对照组为A12,溶剂组为AS2)。对样品羟自由基清除率(X2)的计算如公式(2)所示:
(2)
1.2.3.3 还原能力测定[20]
配制0.1 mol/L的磷酸盐缓冲溶液(pH=6.8),质量浓度10 g/L的铁氰化钾水溶液,质量浓度100 mg/mL 的三氯乙酸水溶液和质量浓度1 mg/mL的氯化铁水溶液,以及不同浓度的样品水溶液。分别取100 μL磷酸盐缓冲溶液、铁氰化钾溶液和样品溶液置于2 mL离心管中,摇匀后在50 ℃水浴下保温。保温20 min后加入100 μL三氯乙酸溶液。取100 μL 反应液置于96孔板中,加入100 μL去离子水和20 μL氯化铁溶液,放置10 min后测定反应液在700 nm处吸光度AX3。
1.2.4 螯合物抗过敏活性测试[21]
配制0.1 mol/L醋酸-醋酸钠缓冲液(pH=5.6)和不同浓度的样品水溶液。取0.5 mL样品溶液和0.5 mL 500 unit/mL透明质酸酶溶液(醋酸-醋酸钠缓冲液作溶剂)混合。37 ℃下保温20 min后,加入0.1 mL 2.5 mol/L氯化钙水溶液,37 ℃下保温20 min。加入0.5 mL 0.6 mg/mL透明质酸钠溶液(醋酸-醋酸钠缓冲液作溶剂)。37 ℃保温40 min后,室温放置10 min。加入0.5 mL去离子水、0.1 mL 5 mol/L 氢氧化钠水溶液、1 mL新鲜配制乙酰丙酮溶液(3.5 mL乙酰丙酮溶于50 mL 1.0 mol/L碳酸钠溶液)混合,沸水水浴15 min后立即冰浴10 min,放置室温10 min后加入1 mL P-DAB试剂(0.8 g对二甲氨基苯甲醛溶于15 mL浓盐酸和15 mL无水乙醇混合均匀),充分振荡后加无水乙醇至8 mL,放置30 min显色。将透明质酸酶溶液和透明质酸钠溶液均替换为醋酸-醋酸钠缓冲液作为对照组,将样品溶液替换为去离子水作为空白组,将对照组中样品溶液替换为去离子水作为溶剂组,分别测定4组反应液在530 nm下的吸光度(样品组为Ax4,空白组为A04,对照组为A14,溶剂组为As4)。对样品透明质酸酶抑制率(X4)的计算如公式(3)所示:
(3)
2 结果与分析
2.1 原料低聚肽理化性质分析
参考QB/T 5298—2018和QB/T 4707—2014及其中国标测试方法,测定了2种低聚肽的理化性质(表1)。由表1可知,2种低聚肽样品中水分和灰分含量均小于5%,蛋白含量则均高达86%,表明样品中蛋白含量高。样品酸溶蛋白含量均超过80%,重均分子量<500,表明2种低聚肽成分多为二肽或三肽,易于被人体消化吸收,适用于进一步的食品加工。
表1 原料低聚肽理化性质参数
Table 1 Physicochemical properties of oligopeptides
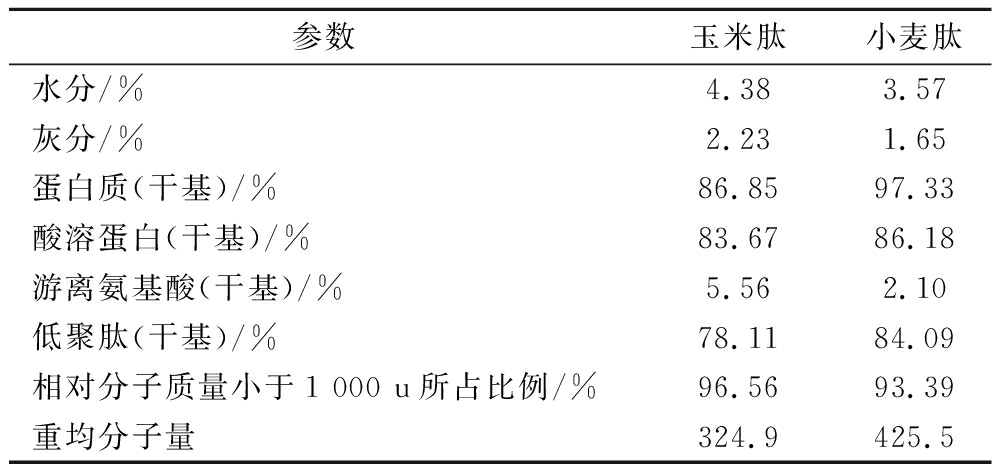
参数玉米肽小麦肽水分/%4.383.57灰分/%2.231.65蛋白质(干基)/%86.8597.33酸溶蛋白(干基)/%83.6786.18游离氨基酸(干基)/%5.562.10低聚肽(干基)/%78.1184.09相对分子质量小于1 000 u所占比例/%96.5693.39重均分子量324.9425.5
注:%表示质量分数
2.2 螯合物抗氧化能力
2.2.1 DPPH自由基清除能力
DPPH结构中苯环的位阻效应和π-π共轭使其中心氮原子上的不成对电子可稳定存在,形成自由基。抗氧化剂的电子可与自由基的电子配对进而清除自由基,故采用测定DPPH自由基清除率的方式可评价样品的抗氧化能力。由图1可知,底物多肽和相应的螯合物均有很好的DPPH自由基清除能力,实验最终清除率均可达到84%,但均远弱于抗坏血酸的DPPH自由基清除能力。利用样品的DPPH自由基清除率随浓度变化的曲线可计算样品的IC50(表2)。玉米肽-Ca螯合物的IC50虽小于玉米肽的IC50,但在最终质量浓度10 mg/mL时玉米肽-Ca螯合物的清除率大于玉米肽本身,质量浓度>1 mg/mL时两样品清除率之间也均没有显著性差异(P>0.05)。结合清除率随浓度变化的曲线和显著性分析综合判断,可认为玉米肽与其钙螯合物的DPPH自由基清除能力基本相同,无还原性钙离子的加入对玉米肽的DPPH自由基清除能力没有明显影响。小麦肽-Fe螯合物的清除率随浓度增长则明显快于其他低聚肽或螯合物,其IC50也因此更小,推测原因是螯合物本身带有的Fe2+具有强还原性,使螯合物在极低浓度下清除率即可达到85%,表明小麦肽-Fe螯合物的DPPH自由基清除能力明显强于小麦肽本身。

a-玉米肽、小麦肽、玉米肽-Ca;b-小麦肽-Fe;c-抗坏血酸
图1 螯合产物、低聚肽和抗坏血酸的DPPH自由基清除能力
Fig.1 The DPPH radical scavenging ability of chelates, oligopeptides, and ascorbic acid
表2 螯合产物、低聚肽和抗坏血酸清除DPPH自由基IC50和实验最终清除率
Table 2 The IC50 value and ending ratio for DPPH radical scavenging of chelates, oligopeptides and ascorbic acid
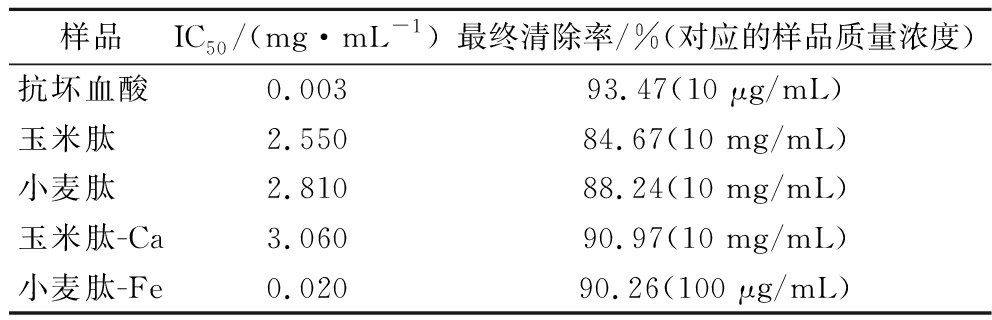
样品IC50/(mg·mL-1)最终清除率/%(对应的样品质量浓度)抗坏血酸0.00393.47(10 μg/mL)玉米肽2.55084.67(10 mg/mL)小麦肽2.81088.24(10 mg/mL)玉米肽-Ca3.06090.97(10 mg/mL)小麦肽-Fe0.02090.26(100 μg/mL)
2.2.2 羟自由基清除能力
羟自由基具有极强的得电子能力,氧化电位为2.8 V,仅次于单质氟,因此常被用于评价样品的抗氧化能力。如图2所示,所测样品中两类肽-金属螯合物有较强的羟自由基清除能力,清除率可达80%,但弱于作为对照的抗坏血酸。而用于合成螯合物的原料低聚肽和金属离子(钙离子一般无还原性故省略)的清除能力不强,在实验浓度范围中清除率未过40%,其中具有强还原性的氯化亚铁清除率约为11%。利用样品的羟自由基清除率随浓度变化的曲线可计算样品的IC50(表3)。由上述现象,可见低聚肽与金属离子螯合后其羟自由基清除能力明显增强,各浓度下螯合物样品清除率显著高于单体的清除率(P<0.05)。螯合物客体金属离子所测得的清除率最低,由此推测实验中样品清除羟自由基主要依靠低聚肽结构。螯合物的清除能力强于低聚肽本身,且清除率也大于低聚肽和金属离子清除率的加和,推测其原因是客体金属离子与主体低聚肽配位改变了低聚肽的电荷分布,使低聚肽更偏向于负电性,更易向自由基提供电子进而将自由基清除。

a-螯合产物、低聚肽、氯化亚铁;b-抗坏血酸
图2 螯合产物、低聚肽、氯化亚铁和抗坏血酸的羟自由基清除能力
Fig.2 The hydroxyl radical scavenging ability of chelates, oligopeptides, ferrous chloride, and ascorbic acid
表3 螯合产物、低聚肽、氯化亚铁和抗坏血酸清除羟自由基IC50和实验最终清除率
Table 3 The IC50 value and ending ratio for hydroxyl radical scavenging of chelate, oligopeptide, ferrous chloride and ascorbic acid
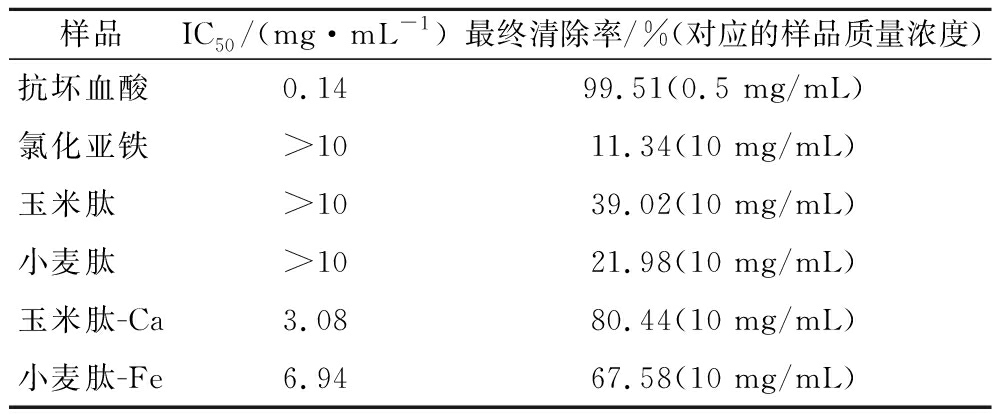
样品IC50/(mg·mL-1)最终清除率/%(对应的样品质量浓度)抗坏血酸0.1499.51(0.5 mg/mL)氯化亚铁>1011.34(10 mg/mL)玉米肽>1039.02(10 mg/mL)小麦肽>1021.98(10 mg/mL)玉米肽-Ca3.0880.44(10 mg/mL)小麦肽-Fe6.9467.58(10 mg/mL)
2.2.3 还原能力测试
利用铁氰化钾和氯化铁与样品产生普鲁士蓝进行的还原能力测试也是评价抗氧化能力的常见方式。图3显示出与图1类似的现象。玉米肽与其螯合物吸光度随浓度变化相似,在实验浓度范围内吸光度可达0.3~0.4,在约10 mg/mL时吸光度已没有显著性差异(P>0.05)。小麦肽-Fe螯合物与氯化亚铁因其内含有铁元素,其吸光度可达3.5~4.0,与小麦肽本身(实验吸光度最大值为0.45)有明显不同。小麦肽-Fe螯合物与氯化亚铁两者实验最终吸光度没有显著性差异(P>0.05),但吸光度增长趋势发生明显变化的浓度不同。氯化亚铁在4 mg/mL开始曲线趋于平缓,而小麦肽-Fe螯合物则在8 mg/mL曲线不再上升,推测该现象是因为相同浓度的两种样品中铁元素浓度不同,氯化亚铁的铁元素浓度更大也因此增长趋势发生明显变化的浓度较小。也由此推测小麦肽-Fe螯合物的还原能力主要依靠客体亚铁离子。以具有强还原性的抗坏血酸作为对照,其曲线趋于平缓的浓度远小于其他样品,实验最终吸光度可达0.4,与不含铁元素的样品类似。氯化亚铁和抗坏血酸均是强还原剂,表明4种样品均有较强的还原能力。

a-玉米肽、小麦肽、玉米肽-Ca;b-FeCl2、小麦肽-Fe;c-抗坏血酸
图3 螯合产物、低聚肽、氯化亚铁和抗坏血酸的还原能力
Fig.3 The reductive ability of chelates, oligopeptides, ferrous chloride, and ascorbic acid
2.3 螯合物抗过敏活性测试
透明质酸酶是一种糖苷酶,其活性与常见的I型过敏反应有很强的相关性[22-23],有文献表明小分子质量低聚肽具有一定透明质酸酶抑制能力进而获得了抗过敏活性[24],该法也因此被应用于比较分子抗过敏活性强弱[25]。本文以透明质酸酶抑制率为指标,对小麦肽、玉米肽、玉米肽-Ca螯合物和小麦肽-Fe螯合物的抗过敏活性进行评价。
首先在100 mg/mL,对上述4种样品进行透明质酸酶抑制实验,结果如图4所示。小麦肽的抗过敏活性很高,100 mg/mL的小麦肽透明质酸酶抑制率可达83%。玉米肽也具有一定的抗过敏活性但与小麦肽相比较低,100 mg/mL的玉米肽透明质酸酶抑制率仅有51.79%。在螯合物方面,100 mg/mL的小麦肽-Fe螯合物具有66.07%的透明质酸酶抑制率,相较于同浓度的玉米肽-Ca螯合物表现出更好的透明质酸酶抑制性。进一步,对4种样品抑制透明质酸酶的量效关系进行研究。由图4可知,在低质量浓度时(0~20 mg/mL)螯合物与相应低聚肽的抑制率均存在显著性差异(P<0.05),小麦肽-Fe螯合物、玉米肽-Ca螯合物抑制率可分别达到25.86%、44.83%,与小麦肽和玉米肽(均小于10%)相比具有更好的透明质酸酶抑制性。中高质量浓度时(20~100 mg/mL)小麦肽和玉米肽对透明质酸酶的抑制率随浓度的变化出现了明显的增大趋势:在100 mg/mL,玉米肽与玉米肽-Ca螯合物的抑制率已无显著性差异(P>0.05),小麦肽的抑制率则已显著高于小麦肽-Fe螯合物(P<0.05)。然而两种螯合物的抑制率在中高浓度区间的增长则趋于平缓。不同浓度范围下螯合物和低聚肽对透明质酸酶抑制率的增长趋势有明显区别,螯合物在低浓度时已经具有相对较高的透明质酸酶抑制活性,而低聚肽本身则需要更大的浓度获得相同的抑制活性。
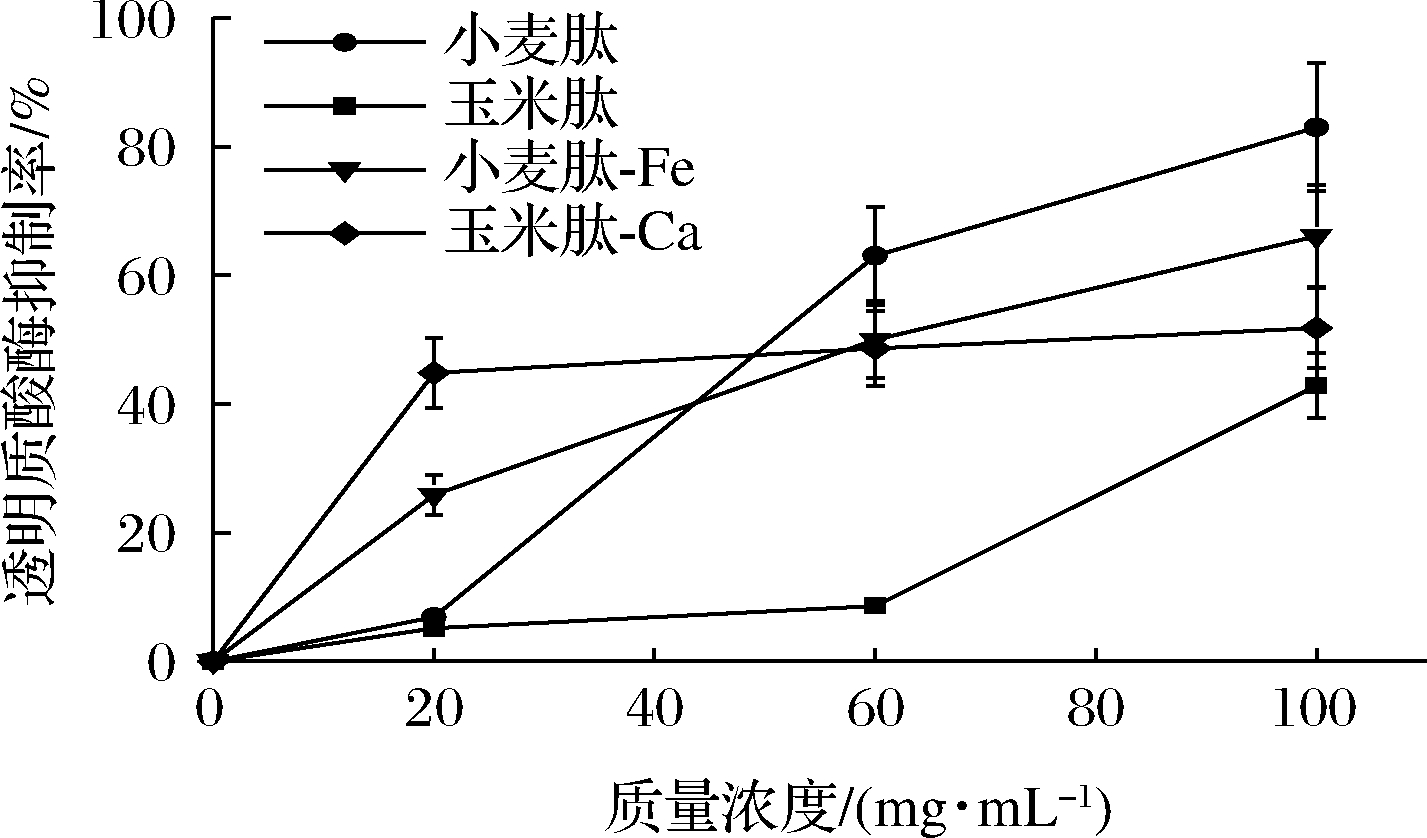
图4 螯合产物、低聚肽对透明质酸酶抑制活性
Fig.4 Hyaluronidase inhibition activity of chelates and oligopeptides
3 结论
本文利用DPPH自由基清除能力、羟自由基清除能力和还原能力三类指标,对样品的抗氧化能力进行评价。实验表明玉米肽、小麦肽、玉米肽-Ca螯合物和小麦肽-Fe螯合物均有很强的还原能力和DPPH自由基清除能力,其中小麦肽-Fe螯合物因含有亚铁离子表现尤甚。在羟自由基清除能力的测试中,螯合物则明显强于低聚肽和螯合所用盐,证明螯合物的抗氧化能力并非是简单的单体叠加而是依靠了螯合的工艺。此外,利用透明质酸酶抑制法对相同样品的抗过敏活性进行测试,样品在低浓度范围内的实验结果与羟自由基清除实验近似,均是螯合物的能力强于低聚肽,由此可推测物质的抗氧化能力与抗过敏活性存在一定的正相关联系;在中高浓度范围内低聚肽的抑制能力增长则明显快于螯合物,这种抑制率增长趋势随浓度变化而变化的现象可应用于样品抗过敏活性的进一步精细研究。
铁和钙是人体必需的元素,中国营养学会推荐成人的每日钙摄入量800 mg,摄入过量则会增加动脉斑块堆积和心脏损伤等风险[26];推荐成年男性摄入铁元素12 mg,成年女性摄入铁元素20 mg,摄入过量会引发肝纤维化、肝癌等疾病[27]。因此市面上的食品和药品中铁和钙元素的含量需严格控制,应处于低浓度范围。本文中的抗氧化能力和透明质酸酶抑制测试说明小麦肽-Fe螯合物和玉米肽-Ca螯合物在低浓度(0~20 mg/mL)时已经具有较高的抗氧化能力和抗过敏活性,表明两类螯合物在抗过敏、抗氧化食品药品方向具有广阔的发展前景和巨大的应用潜能。
[1] 李勇, 蔡木易.肽营养学[M].北京:北京大学医学出版社, 2007.
LI Y, CAI M Y.Peptide Nutrition[M].Beijing:Peking University Medical Press, 2007.
[2] ORTIZ-MARTINEZ M, GONZALEZ DE MEJIA E, GARC A-LARA S, et al.Antiproliferative effect of peptide fractions isolated from a quality protein maize, a white hybrid maize, and their derived peptides on hepatocarcinoma human HepG2 cells[J].Journal of Functional Foods, 2017, 34:36-48.
A-LARA S, et al.Antiproliferative effect of peptide fractions isolated from a quality protein maize, a white hybrid maize, and their derived peptides on hepatocarcinoma human HepG2 cells[J].Journal of Functional Foods, 2017, 34:36-48.
[3] WANG L Y, DING L, YU Z P, et al.Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal -derived antioxidant peptides in HepG2 cells[J].Food Research International, 2016, 90:33-41.
[4] 周伟, 赵泽龙, 张丽萍.小麦低聚肽的结构及抗氧化能力分析[J].食品工业, 2017, 38(9):196-200.
ZHOU W, ZHAO Z L, ZHANG L P.Structure and antioxidant capacity of wheat oligopeptide[J].The Food Industry, 2017, 38(9):196-200.
[5] HUANG W H, SUN J, HE H, et al.Antihypertensive effect of corn peptides, produced by a continuous production in enzymatic membrane reactor, in spontaneously hypertensive rats[J].Food Chemistry, 2011, 128(4):968-973.
[6] MUGURUMA M, AHHMED A M, KATAYAMA K, et al.Identification of pro-drug type ACE inhibitory peptide sourced from porcine myosin B:Evaluation of its antihypertensive effects in vivo[J].Food Chemistry, 2009, 114(2):516-522.
[7] CAETANO-SILVA M E, NETTO F M, BERTOLDO-PACHECO M T, et al.Peptide-metal complexes:Obtention and role in increasing bioavailability and decreasing the pro-oxidant effect of minerals[J].Critical Reviews in Food Science and Nutrition, 2021,61(9):1 470-1 489.
[8] PALIKA R, MASHURABAD P C, NAIR M K, et al.Characterization of iron-binding phosphopeptide released by gastrointestinal digestion of egg white[J].Food Research International, 2015, 67:308-314.
[9] DE LA HOZ L, PONEZI A N, MILANI R F, et al.Iron-binding properties of sugar cane yeast peptides[J].Food Chemistry, 2014, 142:166-169.
[10] ZHAO L N, HUANG S L, CAI X X, et al.A specific peptide with calcium chelating capacity isolated from whey protein hydrolysate[J].Journal of Functional Foods, 2014, 10:46-53.
[11] 刘艳, 鲁军, 陈亮, 等.牡蛎肽锌螯合物的制备工艺研究[J].食品工业科技, 2016, 37(8):257-261.
LIU Y, LU J, CHEN L, et al.Preparation of oyster peptide-zinc chelates[J].Science and Technology of Food Industry, 2016, 37(8):257-261.
[12] 蒲传奋, 唐文婷.玉米醇溶蛋白肽钙螯合物的制备及其抑菌性能研究[J].食品科技, 2015, 40(12):246-250.
PU C F, TANG W T.Preparation and antibacterial properties of zein peptide-calcium chelate[J].Food Science and Technology, 2015, 40(12):246-250.
[13] 王子怀, 胡晓, 李来好, 等.肽-金属离子螯合物的研究进展[J].食品工业科技, 2014, 35(8):359-362.
WANG Z H, HU X, LI L H, et al.Research progress in peptide-mineral ion complexes[J].Science and Technology of Food Industry, 2014, 35(8):359-362.
[14] 汪婧瑜, 张业辉, 张友胜, 等.不同结构的乌鳢螯合肽对抗氧化活性的影响[J].中国食品学报, 2019, 19(10):93-99.
WANG J Y, ZHANG Y H, ZHANG Y S, et al.The effect of different structure of chelated peptides of Channa argus on antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(10):93-99.
[15] 张智, 刘慧, 刘奇, 等.玉米肽-锌螯合物结构表征及抗氧化活性分析[J].食品科学, 2017, 38(3):131-135.
ZHANG Z, LIU H, LIU Q, et al.Structural characteristics and antioxidant activity of corn peptide-Zn complex[J].Food Science, 2017, 38(3):131-135.
[16] 中华人民共和国工业与信息化部. QB/T 5298—2018 小麦低聚肽粉[S].北京:中国轻工业出版社, 2018.
Ministry of Industry and Information Technology of the People′s Republic of China.QB/T 5298—2018 Oligopeptides powder of wheat[S].Beijing:China Light Industry Press, 2018.
[17] 中华人民共和国工业与信息化部. QB/T 4707—2014 玉米低聚肽粉[S].北京:中国轻工业出版社, 2014.
Ministry of Industry and Information Technology of the People’s Republic of China.QB/T 4707—2014 Oligopeptides powder of corn[S].Beijing:China Light Industry Press, 2014.
[18] 韦献雅, 殷丽琴, 钟成, 等.DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9):317-322.
WEI X Y, YIN L Q, ZHONG C, et al.Advances in the DPPH radical scavenging assay for antioxidant activity evaluation[J].Food Science, 2014, 35(9):317-322.
[19] LIU X, SUN Z L, ZHANG M S, et al.Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J].Carbohydrate Polymers, 2012, 90(4):1 664-1 670.
[20] ZOVKO ![]() M, KREMER D, GRUZ J, et al.Antioxidant and antimicrobial properties of Moltkia petraea(Tratt.) Griseb.flower, leaf and stem infusions[J].Food and Chemical Toxicology, 2010, 48(6):1 537-1 542.
M, KREMER D, GRUZ J, et al.Antioxidant and antimicrobial properties of Moltkia petraea(Tratt.) Griseb.flower, leaf and stem infusions[J].Food and Chemical Toxicology, 2010, 48(6):1 537-1 542.
[21] 刘超, 孙培冬, 章姝敏.鸢尾苷的提取分离及其对透明质酸酶活性的影响[J].应用化工, 2012, 41(1):133-136.
LIU C, SUN P D, ZHANG S M.Extraction and separation of tectoridin and its influence on the activity of hyaluronidase[J].Applied Chemical Industry, 2012, 41(1):133-136.
[22] ARLIAN L G. Arthropod allergens and human health[J].Annual Review of Entomology, 2002, 47:395-433.
[23] METCALFE D D.Food hypersensitivity[J].Journal of Allergy and Clinical Immunology, 1984, 73(6):749-762.
[24] 方磊, 李国明, 徐珊珊, 等.牡蛎肽和三文鱼皮胶原肽低致敏性和抗过敏活性研究[J].食品与发酵工业, 2018, 44(9):91-97.
FANG L, LI G M, XU S S, et al.Study of low sensitization and antiallergic activity of oyster peptides and salmon skin collagen peptides[J].Food and Fermentation Industries, 2018, 44(9):91-97.
[25] MIURA K, MORISHITA Y, MATSUNO H, et al.Anti-allergic activity of monoacylated ascorbic acid 2-glucosides[J].Molecules, 2017, 22(12):2202.
[26] 侯安存. 关于补钙的研究进展[J].临床和实验医学杂志, 2016, 15(18):1 862-1 865.
HOU A C.Research progress in calcium supplement[J].Journal of Clinical and Experimental Medicine, 2016, 15(18):1 862-1 865.
[27] 王方海, 赵维, 陈建芳, 等.补铁剂研究进展[J].药学进展, 2016, 40(9):680-688.
WANG F H, ZHAO W, CHEN J F, et al.Research progress in iron supplement[J].Progress in Pharmaceutical Sciences, 2016, 40(9):680-688.