1960年,百里香精油(thyme essential oil, TEO)具有抗菌特性已被报道[1]。由于TEO中含有百里酚和香芹酚[2]等酚类活性物质,使其具有广谱的抑菌活性,从而被广泛应用于制药、化妆品、农业和食品工业等领域[3-4]。然而,由于精油(essential oils, EOs)的水溶性较低、挥发性较高、伴随风味因素的影响且具有高浓度潜在毒性[5],使其在食品工业中的应用受到限制。通过将EOs乳化以增强其分散性并防止EOs降解成为一种替代方案[6]。
乳液根据液滴大小可分为粗乳液、微乳液和纳米乳液(nanoemulsions, NEs)[7],其中NEs是指平均粒径在10~100 nm的均匀分散系统,是有前景且可行的封装EOs方法[8]。GUO等[9]研究表明,百里香精油纳米乳液(thyme essential oil nanoemulsion, TEON)具有很强的抗菌作用,其研究重点偏向于超声和乳液协同抗菌,通过研究探索抑菌机制来判断抑菌效果[9-11],然而,NEs液滴大小对抗菌性影响的相关研究仍不够深入,大多都是探索微米和纳米级别EOs的抗菌性能的差异[3]。
NEs具有动力学稳定的优势,不受温度和pH在内的物理和化学变化的影响,更适用于各类研究及应用[12],而且NEs对细菌的抑菌效果是纯EOs的10倍[9]。已有研究表明,相比于TEO,TEON不易降解,稳定性得到提升,具有更高的活性成分负载能力[13],能够极大提升其抗菌活性[14]。NEs可以通过高能量或低能量的方法制备得到[15],其中超声波法作为一种空化辅助技术,具有安全、健康和对环境无害的优点[16],同时也能避免NEs在制备过程中的质量损耗并保证其化学成分不受影响[15],已成为一种很有前景的方法。因此,本文选取了环境卫生和食品卫生学中典型的4种细菌,在探索了不同TEO浓度下制备的TEON对抑菌性影响的基础上,再探索其粒径大小对不同菌株抑菌性的影响。
1 材料与方法
1.1 材料与试剂
氯化钠,天津北辰方正试剂厂;无水磷酸氢二钠,天津大茂化学试剂厂;磷酸二氢钾,国药集团化学试剂有限公司;氯化钾,天津博迪化工股份有限公司;琼脂粉、蛋白胨,北京奥博星生物技术有限责任公司;酵母提取物,OXOID公司;TEO、Tween 80,上海源叶生物科技有限公司;磷钨酸,北京索莱宝科技有限公司;普通碳支持膜,北京中镜科仪技术有限公司。
微生物菌株:大肠杆菌CMCC 44102、铜绿假单胞菌CMCC 10104、枯草芽孢杆菌CMCC 63501、金黄色葡萄球菌CMCC 26003,上海保藏技术中心。
1.2 仪器与设备
Scientz-IID超声波细胞粉碎机,宁波新芝生物科技有限公司;Zetasizer Nano ZS90纳米激光粒度仪,英国Malvern公司;HT7700-日立透射电子显微镜,日本Advanced Microscope公司;傅里叶红外光谱仪德国Bruker公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂。
1.3 TEON的制备
使用超声粉碎机对TEO进行超声处理。制备相同超声功率下不同浓度的TEON,将1 mL的Tween 80和不同体积的TEO混合,定容至100 mL,于磁力搅拌器上混合5 min。将混合液在20 kHz的频率、380 W的功率下超声处理20 min,反应过程通过冰水浴控制体系温度为20 ℃。
在相同TEO浓度下,通过改变超声功率制备不同粒径的TEON,将1 mL的Tween 80和1.2 mL的TEO混合,定容至100 mL,于磁力搅拌器上混合5 min。设置不同超声功率,其余制备过程与上述一致。
1.4 接种物的制备
LB培养基(g/L):胰蛋白胨10、酵母提取物5,氯化钠10,pH 7.0。在121 ℃灭菌锅中灭菌20 min。
LB固体培养基(g/L):在LB培养基中加入16 g琼脂粉。
PBS缓冲液:4 g氯化钠、0.1 g氯化钾、0.71 g无水磷酸氢二钠和0.135 g磷酸二氢钾,将混合物定容至400 mL,调pH值至7.4,定容至500 mL。
以上培养基均在121 ℃灭菌锅中灭菌20 min。
1.5 乳液粒径的测定
使用纳米粒度仪在173°的散射角下通过动态光散射(dynamic light scattering, DLS)测量油滴尺寸。为避免多重散射效应,测量前用去离子水对TEON进行稀释。
1.6 透射电子显微镜(transmission electron microscope, TEM)观察液滴形态
用TEM观察TEON的微观结构。在TEM观察前,样品用去离子水以1∶100的比例进行稀释,将稀释后的TEON置于普通碳支持膜上,等待干燥后,用2%的磷钨酸水溶液负染15 min,滤纸吸干多余液体,干燥后观察。
1.7 傅里叶红外光谱仪(Fourier transform infrared spectrometer, FT-IR)
TEON的FT-IR于衰减全反射(attenuated total reflection, ATR)模式下在4 000~500 cm-1进行记录。
1.8 抗菌活性的测定
采用平板计数法检测抗菌活性。4种微生物接种在LB培养基中,于摇床培养12 h(37 ℃,200 r/min),得到细菌菌悬液。使用PBS缓冲液对菌悬液进行梯度稀释,使1 mL菌悬液在20 mL的LB固体培养基中的菌落数为30~300 CFU,做空白对照组。取10 mL稀释过的菌悬液,分别加入适量TEON,并通过0.45 μm 过滤器过滤灭菌,使1 mL混合液在20 mL的LB固体培养基中的菌落数为0~300 CFU。将接种后的培养皿(直径9 cm)放入37 ℃培养箱中,48 h后观察细菌菌落数。
1.9 数据处理与分析
使用Nano Measure 1.2软件对TEM图片进行粒径分析,使用OriginPro 9.0软件对试验数据进行绘图,抗菌试验每组设置3个平行,用SPSS 20.0软件进行差异显著性分析,结果以平均值±标准差表示,以P<0.05表示差异显著。
2 结果与分析
2.1 TEON的形态
采用纳米粒度仪和TEM对TEON的粒径分布情况和形态进行表征分析,以便直观地观察TEON的微观结构。如图1和图2所示,1.2%(体积分数)的TEO在380 W的超声功率下获得的TEON的平均粒径在50 nm左右,乳化后的TEON清晰可见,液滴的形态呈现球形,尺寸分布均匀,与纳米粒度仪分析结果相似,两者微小差异可能是DLS测量过程中,乳液球体倾向于包裹在水膜中,导致数值偏大[17]。

图1 TEON的粒径分布
Fig.1 The droplet size distribution for TEON

图2 TEON的透射电子显微镜图像
Fig.2 Transmission electron microscope image for TEON
2.2 FT-IR分析
采用FT-IR对不同超声功率下获得的TEON进行表征分析,通过官能团的变化判断超声功率的改变是否会影响TEON的化学结构。如图3所示,在3 367~3 382 cm-1出现的吸收峰归因于TEON的香芹酚和百里酚[18]上的—OH伸缩振动。在2 920 cm-1和2 865 cm-1处出现的峰是酚环上甲基和异丙基的C—H 的拉伸,在1 617~1 621 cm-1波数之间出现的峰与C![]() C有关,1 455 cm-1和1 425~1 429 cm-1处出现的峰则是因为芳香族环上C—C的存在。而在1 097~1 100 cm-1出现的峰是Tween 80的—COO—伸缩拉动。不同超声功率处理的TEON具有相似的光谱,并未产生新的官能团,结果表明超声未改变TEON的化学结构,与JADHAV等[19]实验结论一致。
C有关,1 455 cm-1和1 425~1 429 cm-1处出现的峰则是因为芳香族环上C—C的存在。而在1 097~1 100 cm-1出现的峰是Tween 80的—COO—伸缩拉动。不同超声功率处理的TEON具有相似的光谱,并未产生新的官能团,结果表明超声未改变TEON的化学结构,与JADHAV等[19]实验结论一致。
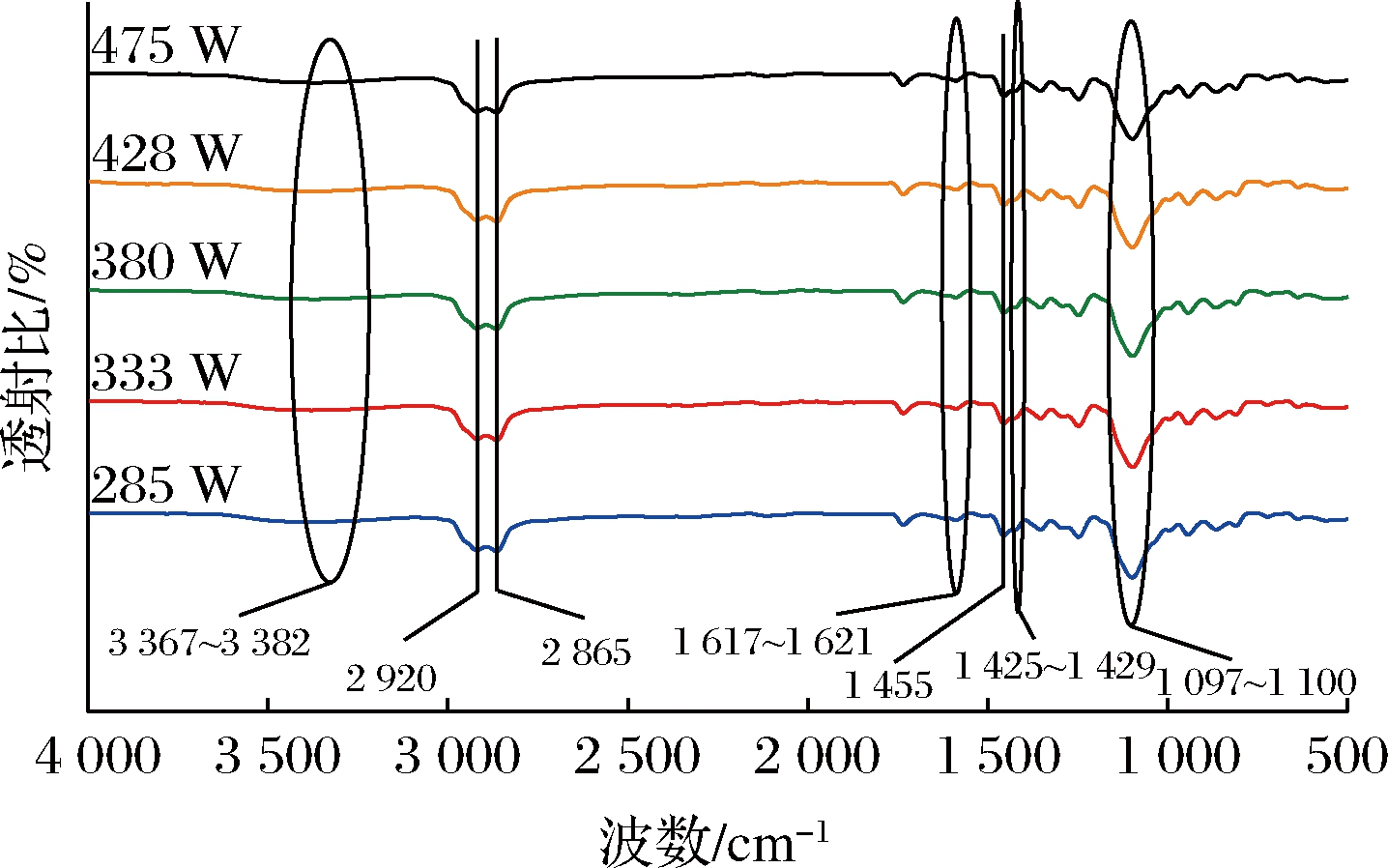
图3 相同TEO浓度、不同超声功率下制备的TEON的FT-IR光谱
Fig.3 FT-IR Spectra of TEON prepared at the same concentration of TEO and different ultrasonic power
2.3 TEO浓度对抗菌性的影响
不同TEO浓度下制备的TEON的粒径大小如图4 所示,当添加0.7%~1%(体积分数)的TEO时,TEON的平均粒径随浓度增加而减小。体积分数为1.1%~1.7% 时,TEON的平均粒径随浓度增大而增大,并且平均粒径在100 nm以内,表明在此浓度区间内通过超声处理均能获得NEs[8]。并且在TEO和Tween 80为1∶1比例时得到最小粒径的TEON。在后续浓度与抑菌效果的关系研究中,为控制菌落数在0~300 CFU,并且菌落数小于空白对照组,选择TEO体积分数为1%~1.7%。

图4 不同TEO浓度下制备的TEON粒径
Fig.4 The droplet size diagram of TEON prepared at different concentration of TEO
注:数据表示为3次测定平均值±标准差(下同)
2.3.1 TEO浓度对革兰氏阴性菌抑菌性能的影响
对革兰氏阴性菌的抗菌特性的探究中,选取了大肠杆菌和铜绿假单胞菌2个典型的菌株。为控制空白对照组的菌落数在30~300 CFU,将大肠杆菌菌悬液梯度稀释到10-7,又为了方便观察TEON对大肠杆菌的影响规律,各浓度梯度均添加0.8 mL的TEON用于抗菌性研究。如图5所示,相较于未添加TEON的空白对照组,添加了TEON的实验组随着TEO浓度的增加,细菌生长受到抑制,菌落数显著减少(P<0.05)。当TEO体积分数达到1.7%之后,大肠杆菌无法生存。

图5 不同TEO浓度下制备的TEON对大肠杆菌的抑菌效果
Fig.5 The bacteriostatic effect of TEON perpared at different concentration of TEO on Escherichia coli
注:图中对照为未添加精油,不同字母表示存在显著差异(P<0.05)(下同)
将铜绿假单胞菌菌悬液梯度稀释到10-6,并添加0.5 mL的TEON。如图6所示,相较于空白对照组,添加了TEON的实验组,当TEO浓度达到一定后,随着浓度的增加,细菌生长受到抑制,菌落数显著减少(P<0.05)。由此可以判断,随着TEO浓度的增加,其对TEON革兰氏阴性菌的抗菌性也逐渐提升,与FADLI等[20]研究结论一致。本研究通过对多组浓度梯度进行探究,更具说服力,也便于观察浓度与抑菌性之间的规律关系。

图6 不同TEO浓度下制备的TEON对铜绿假单胞菌的抑菌效果
Fig.6 The bacteriostatic effect of TEON perpared at different concentration of TEO on Pseudomonas aeruginosa
2.3.2 TEO浓度对革兰氏阳性菌的抑菌性能的影响
对革兰氏阳性菌的抗菌特性的探究中,选取了金黄色葡萄球菌和枯草芽孢杆菌2个典型的菌株。将金黄色葡萄球菌菌悬液梯度稀释到10-7,添加0.5 mL的TEON。如图7所示,相较于空白对照组,随着TEO浓度的增加,细菌生长受到抑制,菌落数显著减少(P<0.05)。当TEO体积分数达到1.7%之后,金黄色葡萄球菌生长完全受到抑制。

图7 不同TEO浓度下制备的TEON对金黄色葡萄球菌的抑菌效果
Fig.7 The bacteriostatic effect of TEON perpared at different concentration of TEO on Staphylococcus aureus
将枯草芽孢杆菌菌悬液梯度稀释到10-5。当添加0.2 mL的TEON时,所有浓度下都未显示出其对枯草芽孢杆菌的抗菌性,但当添加0.25 mL的TEON时,所有浓度下枯草芽孢杆菌几乎全部失活,这可能与枯草芽孢杆菌特殊的细胞结构有关。
以上结果表明,革兰氏阳性菌比革兰氏阴性菌对TEON更敏感。但GUERRA-ROSAS等[21]研究发现,与革兰氏阳性菌相比,革兰氏阴性菌对柠檬草精油纳米乳液更加敏感。造成研究结果不同的原因,可能是因为不同微生物物种的细胞包膜的结构存在差异,而且不同的微生物种对不同的EOs的NEs也表现不同反应。
2.4 乳液粒径对抗菌性的影响
控制TEO体积分数为1.2%,其他超声条件一致,仅改变超声功率,获得的TEON的粒径大小如图8 所示。随着超声功率的增加,TEON的粒径逐渐减小,但是变化幅度也越来越小,说明当超声功率达到一定强度后,对粒径的影响有限。

图8 相同TEO浓度下制备不同粒径的TEON粒径
Fig.8 The droplet size diagram of TEON with different droplet size perpared at the same concentration of TEO
2.4.1 粒径对革兰氏阴性菌的抑菌性能的影响
TEON对大肠杆菌的抗菌性能如图9所示,当超声功率达到333 W之后,随着NE粒径的减小,不同粒径之间的抗菌性能不存在显著差异。但当功率为285 W时,存在显著差异(P<0.05),这说明当粒径差异较大时,粒径大小能够影响NEs对大肠杆菌的抗菌性能。

图9 不同粒径TEON对大肠杆菌的抑菌效果
Fig.9 The bacteriostatic effect of TEON with different droplet size on Escherichia coli
TEON对铜绿假单胞菌的抗菌性能如图10所示,随着粒径的减小,不同粒径乳液球体的抗菌性能出现显著差异(P<0.05),即抗菌性能逐渐增加。这可能是因为较小尺寸的液滴具有更大的比表面积,能够让NEs与细胞膜更加充分地接触,从而使细胞活力快速丧失[22]。

图10 不同粒径TEON对铜绿假单胞菌的抑菌效果
Fig.10 The bacteriostatic effect of TEON with different droplet size on Pseudomonas aeruginosa
2.4.2 粒径对革兰氏阳性菌的抑菌性能的影响
TEON对金黄色葡萄球菌的抗菌性能如图11所示,随着粒径的减小,不同粒径乳液球体的抗菌性能不存在显著差异。TEON的粒径大小对抑制金黄色葡萄球菌的生长没有影响,LIAO等[23]研究得出类似的结论。

图11 不同粒径TEON对金黄色葡萄球菌的抑菌效果
Fig.11 The bacteriostatic effect of TEON with different droplet size on Staphylococcus aureus
将枯草芽孢杆菌菌悬液梯度稀释到10-5。当添加0.2 mL的TEON时,所有粒径下都未显示出其对枯草芽孢杆菌的抗菌活性,但当添加0.25 mL的TEON时,所有浓度下枯草芽孢杆菌几乎被完全杀死,这与添加不同浓度TEO制备的NEs时的结果一样。
3 结论
通过超声制备不同浓度和粒径的TEON,对几种典型革兰氏细菌的抑菌性能进行了检测分析。结果表明,TEON抗菌性能随着TEO浓度的增加而增强,当控制TEO浓度不变,制备不同粒径的TEON,随粒径的减小,抗菌性能得到提升,且革兰氏阴性菌比革兰氏阳性菌更易受到影响。对于枯草芽孢杆菌而言,可能是因为特殊的细胞结构,其对TEON的敏感性大于其他种类的菌株,可在后续深入研究NEs对芽孢类细菌的作用机制。NEs作为一种极具前景的抗菌剂,有效地调控其浓度和粒径,为NEs用于提高营养物质的生物利用度,改善生物活性化合物的递送等研究打下基础。
[1] LI C P, PRESCOTT B, CHI L L, et al.Antiviral and antibacterial activity of thymus extracts[J].Proceedings of the Society for Experimental Biology and Medicine, 1963, 114:504-509.
[2] 袁丽雪, 赵愉涵, 孙斐, 等.香茅精油处理对马铃薯的抑芽作用研究[J].食品与发酵工业, 2022,48(23):256-263.
YUAN L X, ZHAO Y H, SUN F,et al.Inhibition effect of citronella essential oil on potato tuber sprout[J].Food and Fermentation Industries, 2022,48(23):256-263.
[3] PANDEY A K, CH
 VEZ-GONZ
VEZ-GONZ LEZ M L, SILVA A S, et al.Essential oils from the genus Thymus as antimicrobial food preservatives:Progress in their use as nanoemulsions-a new paradigm[J].Trends in Food Science &Technology, 2021, 111:426-441.
LEZ M L, SILVA A S, et al.Essential oils from the genus Thymus as antimicrobial food preservatives:Progress in their use as nanoemulsions-a new paradigm[J].Trends in Food Science &Technology, 2021, 111:426-441.
[4] OUAKOUAK H, BENARFA A, MESSAOUDI M, et al.Biological properties of essential oils from thymus algeriensis boiss[J].Plants,2021, 10(4):786.
[5] ARTIGA-ARTIGAS M, GUERRA-ROSAS M I, MORALES-CASTRO J, et al.Influence of essential oils and pectin on nanoemulsion formulation:A ternary phase experimental approach[J].Food Hydrocolloids, 2018, 81:209-219.
[6] OZOGUL Y, KULEY ![]() E, AKYOL I, et al.Antimicrobial activity of thyme essential oil nanoemulsions on spoilage bacteria of fish and food-borne pathogens[J].Food Bioscience, 2020, 36:100635.
E, AKYOL I, et al.Antimicrobial activity of thyme essential oil nanoemulsions on spoilage bacteria of fish and food-borne pathogens[J].Food Bioscience, 2020, 36:100635.
[7] KOMAIKO J S, MCCLEMENTS D J.Formation of food-grade nanoemulsions using low-energy preparation methods:A review of available methods[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2):331-352.
[8] YANG Z H, HE Q, ISMAIL B B, et al.Ultrasonication induced nano-emulsification of thyme essential oil:Optimization and antibacterial mechanism against Escherichia coli[J].Food Control, 2022, 133:108609.
[9] GUO M M, ZHANG L J, HE Q, et al.Synergistic antibacterial effects of ultrasound and thyme essential oils nanoemulsion against Escherichia coli O157:H7[J].Ultrasonics Sonochemistry, 2020, 66:104988.
[10] HE Q, ZHANG L J, SONG L Y, et al.Inactivation of Staphylococcus aureus using ultrasound in combination with thyme essential oil nanoemulsions and its synergistic mechanism[J].LWT, 2021, 147:111574.
[11] HE Q, LIU D H, ASHOKKUMAR M, et al.Antibacterial mechanism of ultrasound against Escherichia coli:Alterations in membrane microstructures and properties[J].Ultrasonics Sonochemistry, 2021, 73:105509.
[12] ASWATHANARAYAN J B, VITTAL R R.Nanoemulsions and their potential applications in food industry[J].Frontiers in Sustainable Food Systems, 2019, 3:95.
[13] KAH M, BEULKE S, TIEDE K, et al.Nanopesticides:State of knowledge, environmental fate, and exposure modeling[J].Critical Reviews in Environmental Science and Technology, 2013, 43(16):1 823-1 867.
[14] MOGHIMI R, GHADERI L, RAFATI H, et al.Superior antibacterial activity of nanoemulsion of Thymus daenensis essential oil against E.coli[J].Food Chemistry, 2016, 194:410-415.
[15] AHARI H, NASIRI M.Ultrasonic technique for production of nanoemulsions for food packaging purposes:A review study[J].Coatings, 2021, 11(7):847.
[16] NOMAN A, JIANG Q X, XU Y S, et al.Effects of ultrasonic, microwave, and combined ultrasonic-microwave pretreatments on the enzymatic hydrolysis process and protein hydrolysate properties obtained from Chinese sturgeon (Acipenser sinensis)[J].Journal of Food Biochemistry, 2020, 44(8):e13292.
[17] WANG Y B, CEN C N, CHEN J, et al.Nano-emulsification improves physical properties and bioactivities of litsea cubeba essential oil[J].LWT, 2021, 137:110361.
[18] OMID A, HODA J.Intensification process in thyme essential oil nanoemulsion preparation based on subcritical water as green solvent and six different emulsifiers[J].Green Processing and Synthesis, 2021, 10(1):430-439.
[19] JADHAV A J, HOLKAR C R, KAREKAR S E, et al.Ultrasound assisted manufacturing of paraffin wax nanoemulsions:Process optimization[J].Ultrasonics Sonochemistry, 2015, 23:201-207.
[20] FADLI M, CHEVALIER J, BOLLA J M, et al.Thymus maroccanus essential oil, a membranotropic compound active on Gram-negative bacteria and resistant isolates[J].Journal of Applied Microbiology, 2012, 113(5):1 120-1 129.
[21] GUERRA-ROSAS M I, MORALES-CASTRO J, CUBERO-M RQUEZ M A, et al.Antimicrobial activity of nanoemulsions containing essential oils and high methoxyl pectin during long-term storage[J].Food Control, 2017, 77:131-138.
RQUEZ M A, et al.Antimicrobial activity of nanoemulsions containing essential oils and high methoxyl pectin during long-term storage[J].Food Control, 2017, 77:131-138.
[22] CHANG Y H, MCLANDSBOROUGH L, MCCLEMENTS D J.Physical properties and antimicrobial efficacy of thyme oil nanoemulsions:Influence of ripening inhibitors[J].Journal of Agricultural and Food Chemistry, 2012, 60(48):12 056-12 063.
[23] LIAO W, DUMAS E, GHNIMI S, et al.Effect of emulsifier and droplet size on the antibacterial properties of emulsions and emulsion-based films containing essential oil compounds[J].Journal of Food Processing and Preservation, 2021, 45(12):e16072.