“药食同源”植物因含有丰富的药食两用作用和营养保健功能,逐渐成为近年来营养保健产品开发的新热点[1-2]。研究发现,“药食同源”植物活性物质具有多环节、多层次、多靶点等中药药理特点,其研发亦为降尿酸药物减毒增效及辅助治疗高尿酸食品开发提供新思路[3]。痛风是一种以高尿酸为特征的代谢性疾病,黄嘌呤氧化酶(xanthine oxidase,XO)是参与痛风发生与发展过程中的关键酶。通过抑制XO,能够有效降低血浆尿酸水平,可以此预防和治疗痛风及高尿酸血症[4-5]。痛风目前尚无完全治愈的方法,从天然植物中获取有效成分用于缓解痛风症状是当前的研究热点[6-7]。
青钱柳是珍贵的药食同源植物,研究表明果胶类酸性多糖CP50是青钱柳多糖的主要活性成分之一[8-9]。分子中主要含有→4) GalA (1→、→4) Glc (1→、→4) Gal (1→糖苷键,在半乳糖的C6位存在分支结构[10]。目前多糖在其降尿酸作用方面逐渐被发现,已有文献报道黄芪多糖[11]、茯苓多糖[12]等,均可通过抑制XO活性阻碍尿酸合成,从而减少体内尿酸浓度。已有文献报道青钱柳提取物对XO存在抑制作用[13-14],但青钱柳多糖抗高尿酸血症的机理研究却鲜有报道。本研究结合青钱柳多糖功效范围广、副作用低等特点,通过探究青钱柳中多糖化合物对XO的抑制效果,探析其降尿酸作用的酶反应机制,旨在为寻找调节体内嘌呤代谢的天然降尿酸产品的研究和开发提供理论基础。
1 材料与方法
1.1 材料与试剂
青钱柳干叶购于湖南省张家界,粉碎后过40目筛,备用。
蒽酮、葡萄糖、黄嘌呤、XO、别嘌呤醇,麦克林公司;无水乙醇,天津鑫宇精细化工;乙酸乙酯,成都市科龙化工试剂厂;以上试剂均为分析纯。
1.2 仪器与设备
UV-2600紫外-可见分光光度计,日本岛津有限公司;DHG-9070A烘箱,上海齐欣科学有限公司。
1.3 实验方法
1.3.1 葡萄糖标准曲线的绘制
采用蒽酮-硫酸法,以葡萄糖为对照品,参照易剑平等[15]的测定方法制作标准曲线,得回归方程为A=0.006 3C+0.334 4(其中A为吸光度,C为葡萄糖样品质量浓度,μg/mL),R2=0.992 0,其线性范围为10~100 μg。
1.3.2 青钱柳多糖水提工艺优化及含量测定
现有研究表明,青钱柳多糖是青钱柳水提液中的主要活性成分之一[16]。青钱柳多糖的提取及含量测定参照王小江等[10]的方法略作调整。为除去青钱柳中的甙类、生物碱、有机酸等醇溶性物质,将15 g青钱柳粉末,以300 mL 80%(体积分数)的乙醇回流提取2 h,过滤,滤渣干燥用于后续多糖提取。
1.3.2.1 青钱柳多糖水提工艺优化
单因素试验:称取0.5 g上述处理过的青钱柳粉末,分别以不同料液比(1∶20、1∶40、1∶60、1∶80、1∶100, g∶mL)、浸提时间(1、1.5、2、2.5、3 h)、浸提温度(60、70、80、90、100 ℃)为单一自变量,固定其他提取条件不变,提取次数2次,考察不同单因素条件对青钱柳多糖得率的影响。
正交试验:根据正交试验设计原理,选取料液比、时间和温度3个因素,以青钱柳多糖得率为响应值,设计三因素三水平正交试验,对青钱柳多糖提取工艺进行优化。试验因素水平如表1所示。
表1 正交试验设计因素及水平表
Table 1 The factors and levels of orthogonal experiment
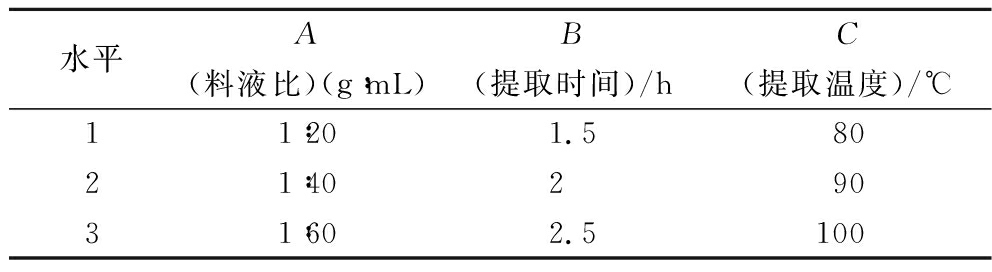
水平ABC(料液比)(g∶mL)(提取时间)/h(提取温度)/℃11∶201.58021∶4029031∶602.5100
1.3.2.2 青钱柳多糖得率计算
将青钱柳水提液浓缩、50%(体积分数)乙醇醇析、洗涤、干燥后,采用上述1.3.1中蒽酮-硫酸显色法测定青钱柳水提物中粗多糖CP50含量,按公式(1)计算样品中多糖得率。
多糖得率![]()
(1)
式中:ρ,由回归方程得出的多糖质量浓度,mg/mL;V,稀释体积,mL;m,青钱柳多糖提取物的质量,mg。
1.3.3 青钱柳粗多糖对XO抑制率研究
该实验方法参考文献[17]并稍加修改。青钱柳粗多糖、别嘌醇分别用少量二甲基亚砜 (dimethyl sulfoxide,DMSO)溶解,制备目标样品液。XO溶液(0.05 U/mL)、黄嘌呤底物溶液(1 mmol/L)均用PBS缓冲溶液配制(pH 7.5)。在1 mL的酶溶液体系中,加入1 mL不同质量浓度(1、5、10、15、20 μg/mL)的别嘌醇溶液和不同质量浓度(200、400、600、800、1 000 μg/mL)的青钱柳粗多糖溶液在室温条件下孵化10 min,再加入1 mL底物溶液启动反应。每间隔1 min在294 nm处测量形成尿酸的吸光度值,持续测量20 min。通过绘制吸光度随时间变化的曲线,根据斜率得出酶相对活力值,计算抑制XO程度至50%时所需的抑制剂的浓度值即IC50。以别嘌醇作为阳性对照。化合物对XO的抑制率计算如公式(2)所示:
抑制率![]()
(2)
式中:A1,测活体系中含抑制剂的酶活力值;A2,测活体系中不含抑制剂的空白酶活力值。
1.4 XO与青钱柳多糖CP50分子对接机制研究
Auto Dock Tools 软件可以预测青钱柳多糖与XO的相互作用信息,分子对接在Auto Dock Tools-1.5.7程序上执行。依据文献[10]得出青钱柳多糖分离纯化后的主要成分CP50的结构排列情况,将CP50的3D结构在Chem3D Pro 14.0中生成,能量处理最小化。从RCSB蛋白质数据库中获得了XO(PDB∶1FIQ)的X射线晶体结构(http://www.rcsb.org/)。用AutoDock工具检测并分配配体的旋转键,去除所有水分子和配体、添加氢原子、加电荷、分配原子类型和修复多肽链的缺失和末端残基。该蛋白质是通过定义了一个网格框,将XO的整个结合位点包围起来,尺寸为40 Å×40 Å×40 Å和0.375 Å的网格间距,设置C链的活性中心坐标为(X,Y,Z)=(37.733,20.262,18.48)。对接计算采用拉马克遗传算法,局部搜索,运行次数为50次,所有其他杂项参数均设置为默认值。经前处理和指令运行后,根据结合能最低原则,选择具有最低结合能和最高百分比频率的对接模型作为最优的结合模式。将AutoDock的输出CP50-XO配合物的主导构象用Pymol进一步渲染,以提供可见的绑定情况。
2 结果与分析
2.1 青钱柳多糖水提法最佳工艺的确定
2.1.1 单因素试验
图1~图3分别为料液比、时间及温度对青钱柳多糖得率的影响曲线。由图1可知,青钱柳多糖得率从1∶20(g∶mL)到1∶40(g∶mL)递增趋势明显,1∶40(g∶mL)到1∶100(g∶mL)递增趋势趋于平缓,从经济角度考虑,选用1∶40(g∶mL)为青钱柳多糖提取最佳料液比;由图2可知,提取时间在1~2 h青钱柳多糖得率随提取时间呈递增趋势,在2~3 h青钱柳多糖得率随提取时间逐渐递减,这是因为随着水提时间延长,多糖在高温下发生氧化分解,导致多糖得率下降。所以青钱柳多糖提取时间不宜过长。综上,本实验选取最佳提取时间为2 h;由图3可知,提取温度在60~90 ℃,青钱柳多糖得率呈递增趋势,在90~100 ℃,多糖得率仍有增加,但增加速率减小,从经济角度考虑,本实验选取90 ℃为最适提取温度。
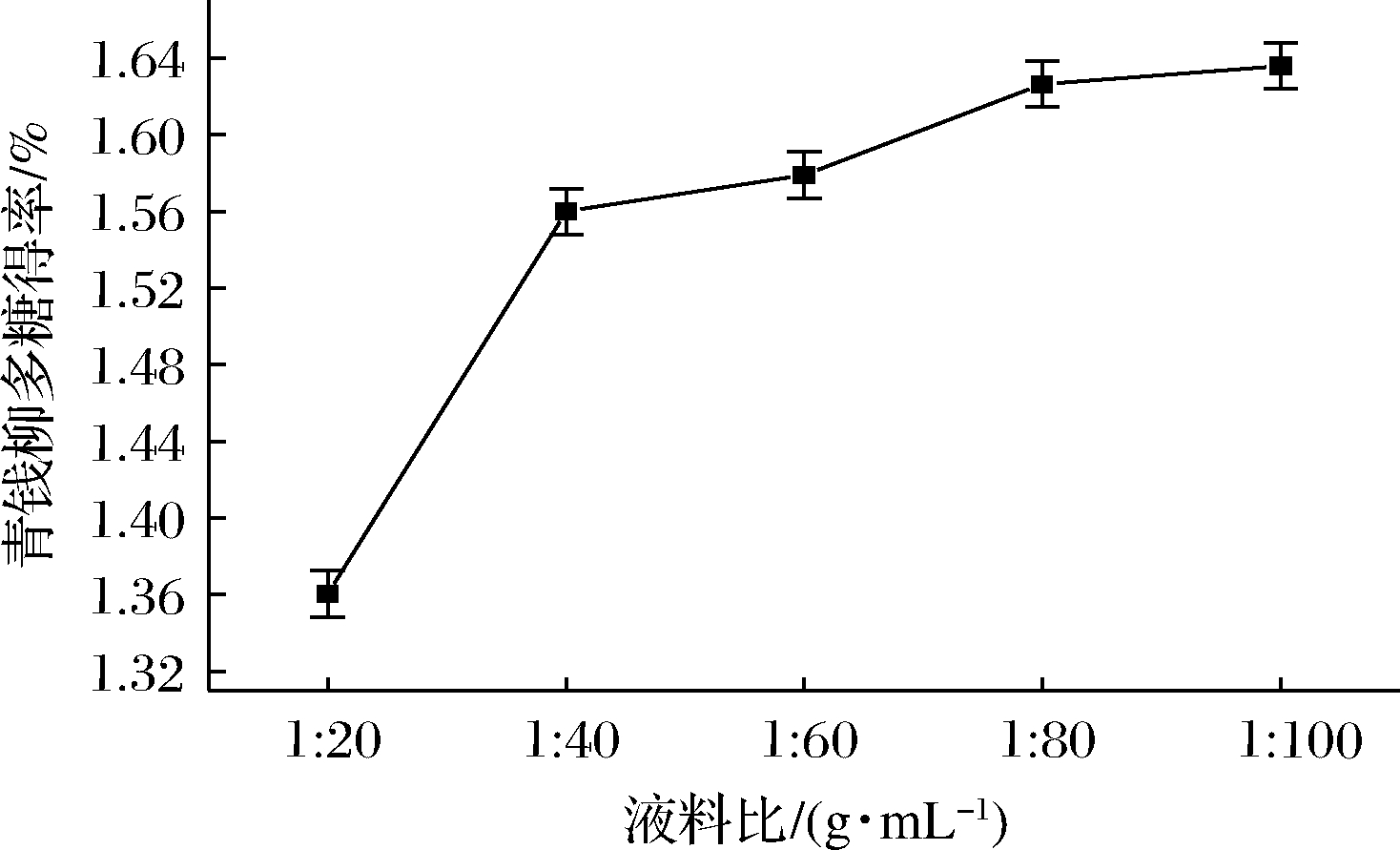
图1 不同料液比对青钱柳粗多糖提取的影响
Fig.1 Effects of different material-liquid ratio on extraction of crude polysaccharides from Cyclocarya Paliurus

图2 不同提取时间对青钱柳粗多糖提取的影响
Fig.2 Effects of different extraction times on extraction of crude polysaccharides from Cyclocarya Paliurus

图3 不同温度对青钱柳粗多糖提取的影响
Fig.3 Effects of different temperature on extraction of crude polysaccharides from Cyclocarya Paliurus
2.1.2 正交试验
青钱柳多糖的提取正交试验结果见表2。料液比、提取时间、提取温度对青钱柳多糖得率影响的顺序为A>B>C。热水浸提法提取青钱柳多糖的最佳工艺条件组合为A2B2C3,即料液比为1∶40(g∶mL),提取时间为2 h,提取温度100 ℃。在此较优提取工艺条件下,热水浸提青钱柳干叶多糖得率为1.67%。本实验得到的多糖得率与文献报道的存在差异,可能与青钱柳干叶的采集时间和测定反应条件等因素有关。
表2 正交试验结果
Table 2 The results of the orthogonal experiment

实验组序号ABC青钱柳粗多糖得率/%A11111.129A21221.360A31331.136A42121.586A52231.668A62310.717A73130.819A83210.842A93321.317均值11.2081.3971.364均值21.581.6121.468均值31.4921.2711.442极差0.2920.2600.077
2.2 XO抑制率计算结果分析
体外测定不同质量浓度(1、5、10、15、20 μg/mL)的别嘌醇和不同质量浓度(200、400、600、800、1 000 μg/mL)的青钱柳粗多糖对XO的抑制结果如图4所示,在不同质量浓度抑制剂条件下,随着抑制剂浓度的增大,XO的相对酶活性不断降低。由此推断出青钱柳提取物多糖对XO有抑制作用。由图4可知,当青钱柳粗多糖溶液质量浓度为0~1 000 μg/mL时,随着质量浓度的增加,青钱柳多糖对XO的抑制性逐渐增强基本呈线性相关,表现出剂量依赖关系,在此范围内青钱柳粗多糖对酶的活性抑制率分别可达70.4%。利用SPSS对试验数据进行回归分析,计算得别嘌醇和青钱柳粗多糖在本实验条下对XO的IC50分别为11.01、825.11 μg/mL。对XO的抑制效果,青钱柳多糖虽不及阳性对照物别嘌醇,但值得关注的是,75倍率的青钱柳水提液天然产物抑制值即可等同于相应的阳性对照。实验结果亦可为食源性青钱柳叶茶的冲泡条件提供应用数据支持。
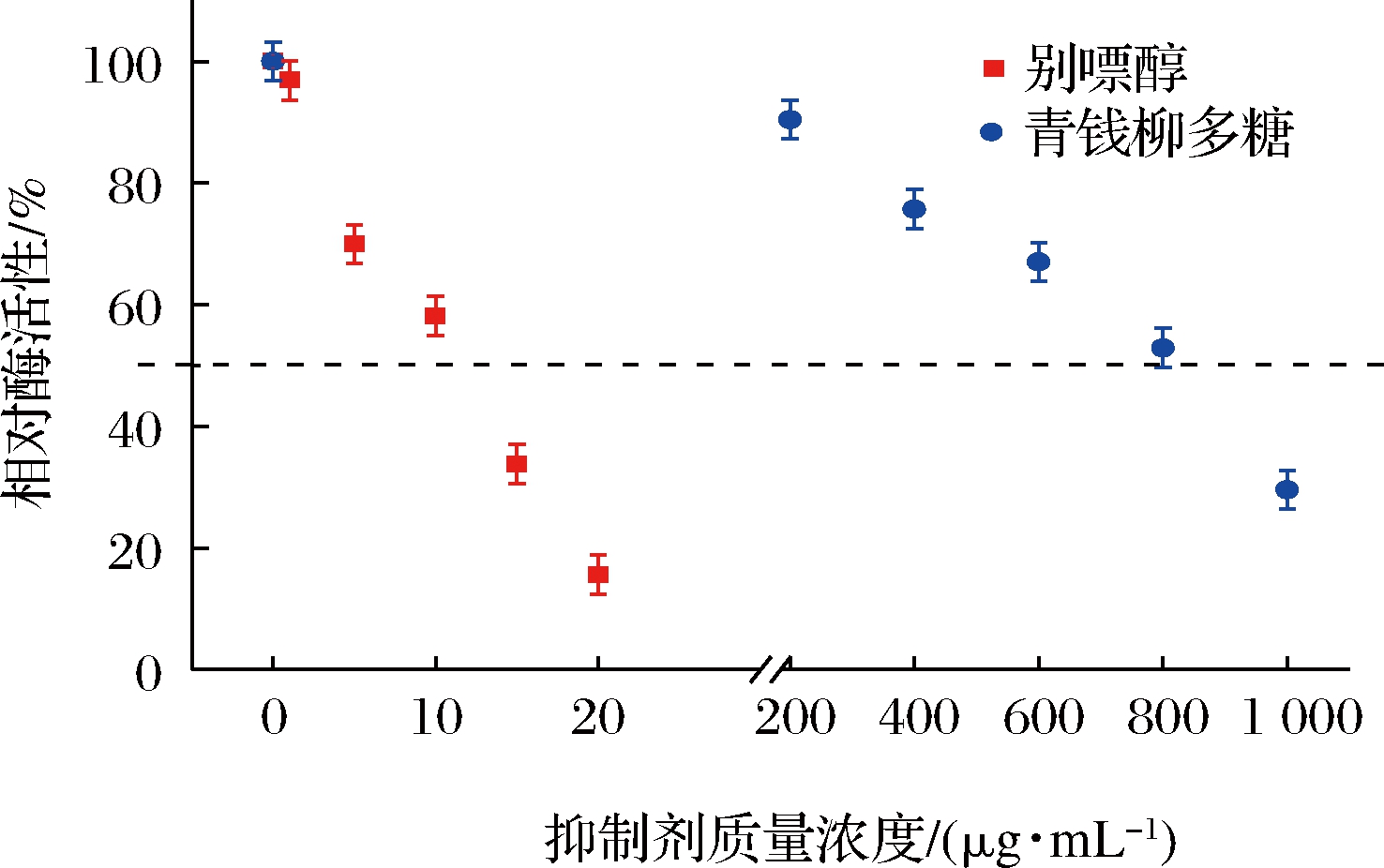
图4 别嘌醇、青钱柳粗多糖对黄嘌呤氧化酶的作用
Fig.4 Effects of the extracts of allopurinol and crude polysaccharides from Cyclocarya paliurus on xanthine oxidase
2.3 分子对接实验结果解析
分子对接是预测配体-蛋白质复合物可见结合模式的一种重要的方法[18]。文献[10]表明青钱柳多糖的主要活性物质为CP50,分子对接提高了我们对CP50和XO之间相互作用的理解,并直观地说明了CP50和XO之间的相互作用。XO(PDB代码:1FIQ)由独立的亚单位组成,每个亚单位包含C链中的一个Mo中心、链中的2个不相同的铁硫中心([2Fe-2S]簇)和B链中的一个黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)辅因子[19]。通过使用2.0 Å的均方根偏差公差进行聚类分析,根据能量大小排列构象簇的结合能。结合能为负数表示蛋白质与小分子存在结合的可能,通常数值<-5 kcal/mol被认为结合可能性较大。结合能数据如表3所示,CP50与XO的最佳结合亲和力<-5 kcal/mol,这意味着小分子CP50与XO具备较为理想的潜在活性效果,分子对接结果见图5。

图5 CP50-XO分子对接可视化图
Fig.5 Visualization of CP50-XO molecular docking
表3 分子对接获得的小分子-蛋白结合亲和力评估表
Table 3 Small molecule-protein binding affinity evaluation table based on AutoDock Vina docking

目标名称配体名称对接值/(kcal·mol-1)CP50-XOCP50-6.4
图6为CP50-XO分子对接Surface图,绿色为XO的活性孔腔,粉色stick表示CP50分子,红色是Mo-pt辅因子,图像可以看出插入活性腔的CP50分子是通向XO活性位点的狭长通道。这表明一旦抑制剂堵塞了活性腔,通道和周围空间大部分会被堵塞,这可能导致底物(黄嘌呤、次黄嘌呤)的着陆受阻,并最终降低XO的催化能力。

图6 CP50-XO分子对接表面图
Fig.6 Surface map of CP50-XO molecular docking
图7为CP50-XO分子对接二维图,CP50分子在Leu648、Leu873、Phe914、Phe1009、Leu1014、Pro1076、Ala1078、Glu1261、Glu802、Ser876、Arg880、Ala1079、Thr1010、Val1011氨基酸围绕而成的口袋当中,且与 Leu648、Leu873、Phe914、Phe1009、Leu1014、Pro1076、Ala1078和Glu1261疏水残基相邻,在结合图6中CP50分子是插入活性孔腔,说明CP50可能与相关氨基酸残基相互作用,表明CP50与XO的结合存在疏水相互作用。此外,Glu802和Arg880被证明在黄嘌呤的羟基化中起关键作用[20],表明CP50可能与基质具有相同的结合区域。

图7 CP50-XO相互作用二维图
Fig.7 Two-dimensional diagram of interaction CP50-XO
图8中CP50-XO的三维结构表明CP50分子和XO残基Glu802、Ser876、Arg880、Ala1079、Thr1010、Val1011之间形成了氢键,表明氢键是CP50和XO之间结合的另一个主要作用。综合来说,XO与青钱柳多糖CP50的主要作用为疏水和氢键作用,该作用可能是CP50对XO发生效果的主要作用类型。

图8 CP50-XO相互作用三维图
Fig.8 3D map of interaction CP50-XO
3 结论
本研究得出青钱柳粗多糖CP50的较优水提工艺为提取时间2 h,提取温度为100 ℃,料液比1∶40(g∶mL)。基于上述实验条件,青钱柳粗多糖得率为1.67%。酶促实验结果表明,青钱柳多糖对XO有抑制作用,对XO抑制作用的IC50为0.825 mg/mL,其抑制效果虽不及阳性对照别嘌呤醇,亦可为天然源青钱柳叶茶的冲泡条件提供食源性应用数据支持。分子对接进一步证实:疏水相互作用和氢键在形成稳定的复杂构象中的重要作用。CP50与酶的自发结合一般会导致XO二级结构的构象变化,从而进一步改变酶的三级结构,阻止底物与酶的结合,从而有效抑制XO的活性,减少尿酸的产生。
综上,本研究表明青钱柳多糖CP50对XO有较好的抑制效果,可为CP50作为一种有效的膳食多糖应用于高尿酸血症患者的饮食中提供实验依据。
[1] 饶智, 陈彦坤, 刘斌, 等.“药食同源”植物酵素研究进展[J].食品与发酵工业, 2020, 46(9):290-294.
RAO Z, CHEN Y K, LIU B, et al.Research progress on “herb-food homology” plant Jiaosu[J].Food and Fermentation Industries, 2020, 46(9):290-294.
[2] 李娜, 刘小杰, 梅俊, 等.药食同源植物精油在食品保鲜中的应用进展[J].食品与发酵工业, 2021, 47(23):298-304.
LI N, LIU X J, MEI J, et al.Research progress on application of medicinal and edible homologous essential oils in food preservation[J].Food and Fermentation Industries, 2021, 47(23):298-304.
[3] LU Q X, LI R, YANG Y X, et al.Ingredients with anti-inflammatory effect from medicine food homology plants[J].Food Chemistry, 2022, 368:130610.
[4] 吴世芳, 李义恒, 石承瑞, 等.乳酸菌对藏区高尿酸血症防治的研究进展[J].食品与发酵工业,2022,48(18):286-291.
WU S F, LI Y H, SHI C R, et al.Research progress of lactic acid bacteria on the prevention and treatment of hyperuricemia in Tibetan region[J].Food and Fermentation Industries, 2022,48(18):286-291.
[5] 庄林, 操俊, 李月婵, 等.壳寡糖复合固体饮料对高尿酸血症小鼠的降尿酸作用研究[J].食品与发酵工业,2023,49(4):97-102.
ZHUANG L, CAO J, LI Y C, et al.Effect of chitooligosaccharide compound solid beverage on reducing uric acid in hyperuricemia mice[J].Food and Fermentation Industries,2023,49(4):97-102.
[6] AKRAM M, USMANGHANI K, AHMED I, et al.In vitro xanthine oxidase inhibitory and in vivo hypouricemic activity of herbal coded formulation (Gouticin)[J].Pakistan Journal of Pharmaceutical Sciences, 2014, 27(3):541-550.
[7] DWIBEDI V, JAIN S, SINGHAL D, et al.Inhibitory activities of grape bioactive compounds against enzymes linked with human diseases[J].Applied Microbiology and Biotechnology, 2022, 106(4):1 399-1 417.
[8] WANG X J, ZHAO X L, LV Y J, et al.Extraction, isolation and structural characterization of a novel polysaccharide from Cyclocarya paliurus[J].International Journal of Biological Macromolecules, 2019, 132:864-870.
[9] 徐静珠. 青钱柳多糖CP50的筛选及降血糖活性研究[D].南京:南京林业大学, 2017.
XU J Z.Screening and hypoglycemic activity study of polysaccharide CP50 from the leaves of Cyclocarya paliurus[D].Nanjing:Nanjing Forestry University, 2017.
[10] 王小江, 单鑫迪, 胡明华, 等.青钱柳叶多糖的结构表征及其抑制α-葡萄糖苷酶活性研究[J].中草药, 2017, 48(8):1 524-1 528.
WANG X J, SHAN X D, HU M H, et al.Structural characterization of polysaccharide from Cyclocarya paliurus leaves and its α-glucosidase inhibitory effect[J].Chinese Traditional and Herbal Drugs, 2017, 48(8):1 524-1 528.
[11] 李晶, 姜丽丽, 李沐轩, 等.黄芪多糖对黄嘌呤氧化酶活性的抑制作用[J].食品与生物技术学报, 2021, 40(10):16-20.
LI J, JIANG L L, LI M X, et al.Inhibitory effects of Astragalus polysaccharide on activity of xanthine oxidase[J].Journal of Food Science and Biotechnology, 2021, 40(10):16-20.
[12] 于娟, 王晓梅.薏苡仁和茯苓提取物对黄嘌呤氧化酶的抑制作用[J].中国药物与临床, 2014, 14(1):30-32.
YU J, WANG X M.Inhibitory effect of Coix seed and Poria cocos extracts on xanthine oxidase[J].Chinese Remedies &Clinics, 2014, 14(1):30-32.
[13] 罗丹, 陈丹, 白曦晨, 等.富硒青钱柳-黄精复方对高尿酸血症小鼠降尿酸作用研究[J].今日药学, 2021, 31(12):909-913;917.
LUO D, CHEN D, BAI X C, et al.Effects of selenium-enriched Cyclocarya paliurus and Polygonatum sibiricum compounds on lowering uric acid in mice with hyperuricemia[J].Pharmacy Today, 2021, 31(12):909-913;917.
[14] 朱克强. 青钱柳颗粒预防痛风患者初始降尿酸阶段痛风急性发作的临床研究[D].南京:南京中医药大学, 2021.
ZHU K Q.The Clinical research of Cyclocarya paliurus (Batal.) iljin-skaja granule in preventing acute attack of gout when initial urate-lowering therapy in patients with gout[D].Nanjing:Nanjing University of Chinese Medicine, 2021.
[15] 易剑平, 毕雅静, 宋秀荣, 等.蒽酮-硫酸法测定枸杞多糖质量分数的研究[J].北京工业大学学报, 2005, 31(6):641-646.
YI J P, BI Y J, SONG X R, et al.Investigation on anthrone-H2SO4 methodology of determination of polysaccharides in Lycium barbarum[J].Journal of Beijing Polytechnic University, 2005, 31(6):641-646.
[16] 王晓敏, 舒任庚, 蔡永红, 等.青钱柳水提液对糖尿病小鼠胰岛细胞的保护作用[J].时珍国医国药, 2010, 21(12):3 146-3 147.
WANG X M, SHU R G, CAI Y H, et al.Effects of Cyclocarya paliurus water extract on islets of pancreas in alloxan-diabetes mice[J].Lishizhen Medicine and Materia Medica Research, 2010, 21(12):3 146-3 147.
[17] 余雄英, 廖永翠, 潘惠, 等.肉桂醛缩氨基脲对黄嘌呤氧化酶的抑制作用研究[J].食品与生物技术学报, 2021, 40(5):88-94.
YU X Y, LIAO Y C, PAN H, et al.Inhibitory effects of cinnamic aldehyde semicarbazone on activity of xanthine oxidase[J].Journal of Food Science and Biotechnology, 2021, 40(5):88-94.
[18] YOUN K, LEE J, HO C T, et al.Discovery of polymethoxyflavones from black ginger (Kaempferia parviflora) as potential β-secretase (BACE1) inhibitors[J].Journal of Functional Foods, 2016, 20(1):567-574.
[19] NISHINO T, OKAMOTO K, KAWAGUCHI Y, et al.Mechanism of the conversion of xanthine dehydrogenase to xanthine oxidase:Identification of the Two Cysteine Disulfide Bonds and Crystal Structure of A Non-Convertible Rat Liver Xanthine Dehydrogenase Mutant[J].The Journal of Biological Chemistry, 2005, 280(26):24 888-24 894.
[20] NISHINO T, OKAMOTO K, EGER B T, et al.Mammalian xanthine oxidoreductase-mechanism of transition from xanthine dehydrogenase to xanthine oxidase[J].The FEBS Journal, 2008, 275(13):3 278-3 289.