假小链双歧杆菌(Bifidobacterium pseudocatenulatum)在各个年龄段人群中普遍存在,是中国人群肠道中的优势双歧杆菌[1]。据报道肠道中长双歧杆菌和假小链双歧杆菌在中国儿童[2]、成年人[3]以及健康老人[4]的肠道中占据了丰度优势。研究发现,假小链双歧杆菌能调节胰岛素抵抗肥胖儿童的炎症状态和血脂水平[5]、改善肥胖表型[6]。假小链双歧杆菌C95[7]、MY40C和CCFM680[8]菌株能改善葡聚糖硫酸钠诱导的结肠炎小鼠的疾病表型。在食品工业的应用上,假小链双歧杆菌通过分泌植酸酶[9]、β-葡萄糖苷酶从而提高人体对面包矿物质、对异黄酮的利用率,展现了作为食品发酵剂的潜力。
发酵碳水化合物是肠道中大部分细菌所必须的代谢过程[10]。双歧杆菌对碳水化合物的利用一直以来是研究的重点,双歧杆菌能利用多种膳食来源的寡糖,如:低聚果糖(fructooligosaccharide,FOS)、低聚半乳糖(galactooligosaccharides,GOS)、低聚木糖等,以及母乳寡糖和少数淀粉类多糖[11]。与碳水化合物利用相关的基因在双歧杆菌基因组中的比例为12%~14%,高于其他肠道菌群的比例[12],这使得它们可以代谢各种宿主无法消化的碳水化合物,从而能够为双歧杆菌的定殖提供优势。人的肠道中含有大量复杂的碳水化合物,而这些不被人体消化的寡糖或多糖最终会成为肠道菌群的底物。通过竞争有限的碳源,这些肠道菌群得以存活和定殖。
MILANI研究发现,构成双歧杆菌的主要碳源代谢途径“Bifid Shunt”的基因属于核心基因组,许多碳水化合物利用基因具有物种特异性[13]。假小链双歧杆菌具有丰富的碳水化合物代谢基因结构,可利用大豆异黄酮苷[14]降解复杂植物多糖等[15]。长双歧杆菌长亚种能专门代谢成人饮食中发现的特定植物聚糖,大量的文献也揭示了双歧杆菌对母乳寡糖的利用[15]。但在过往的报道中,大多数研究都集中在单株假小链双歧杆菌上,缺少对假小链双歧杆菌碳水化合物利用的整体研究。
了解不同假小链双歧杆菌菌株对碳水化合物的利用及差异,找到对其具有促生长作用的碳水化合物从而提高在人肠道中的丰度,找到碳水化合物利用能力较强的假小链双歧杆菌菌株,有助于确定不同种类的碳水化合物如何搭配合适的合生元配方。
1 材料与方法
1.1 材料与试剂
1.1.1 细菌菌株
本研究使用的12株来自人体的假小链双歧杆菌信息如表1所示。
表1 实验菌株信息
Table 1 Strains information
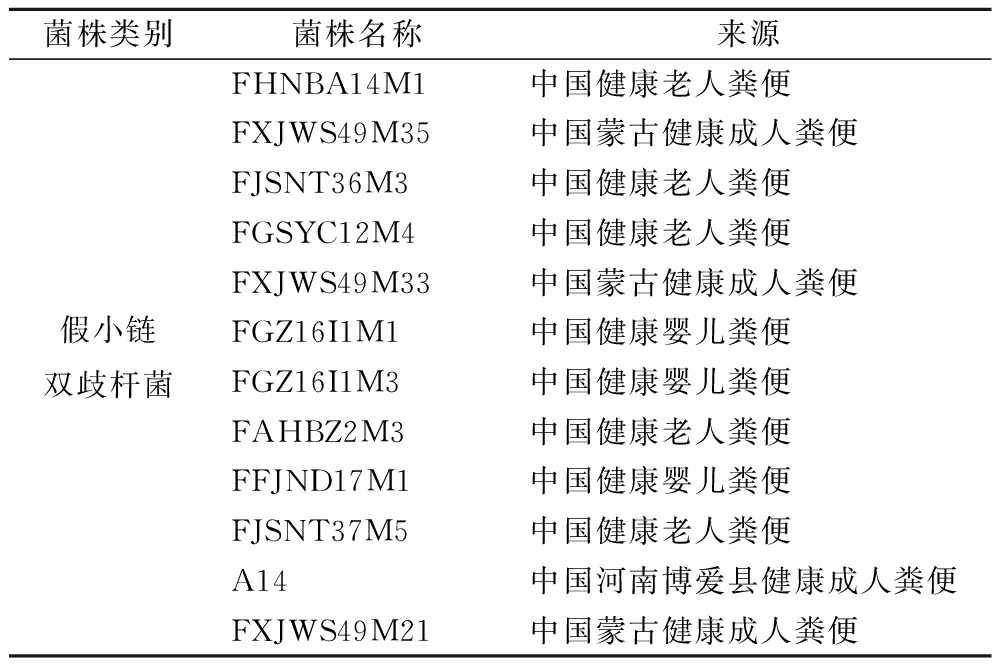
菌株类别菌株名称来源假小链双歧杆菌FHNBA14M1中国健康老人粪便FXJWS49M35中国蒙古健康成人粪便FJSNT36M3中国健康老人粪便FGSYC12M4中国健康老人粪便FXJWS49M33中国蒙古健康成人粪便FGZ16I1M1中国健康婴儿粪便FGZ16I1M3中国健康婴儿粪便FAHBZ2M3中国健康老人粪便FFJND17M1中国健康婴儿粪便FJSNT37M5中国健康老人粪便A14中国河南博爱县健康成人粪便FXJWS49M21中国蒙古健康成人粪便
1.1.2 实验试剂
低聚半乳糖,新金山生物科技股份有限公司;菊粉,上海麦克林生化科技有限公司;葡萄糖、乳糖、木糖、D-半乳糖、蔗糖、D-麦芽糖、甘露糖、海藻糖、低聚果糖、D-果糖,D-阿拉伯糖,纤维二糖、甘露醇,L-鼠李糖,可溶性淀粉以及mMRS中的其他化学品,国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒,中国北京天根生物技术有限公司;粪便基因组提取试剂盒,美国MP公司。
1.2 仪器与设备
高压蒸汽灭菌锅SX-500,日本Tomy Digital Biology公司;厌氧工作站AW500SG DG250,英国Etectrotek公司;酶标仪MULTISCAN GO,赛默飞世尔科技(中国)有限公司;全自动酶标仪Infinite F50,瑞士Tecan公司;超低温冰箱Thermo-994,美国Thermo Fisher科技公司。
1.3 实验方法
1.3.1 培养基及试剂配制
参考文献方法[16]配制mMRS培养基。
不同碳源培养基:配制不含葡萄糖的mMRS液体培养基。将菊粉、乳糖、D-半乳糖、蔗糖、L-鼠李糖、葡萄糖、D-麦芽糖、木糖、纤维二糖、FOS、GOS、甘露糖、D-阿拉伯糖、海藻糖、D-果糖、甘露醇和可溶性淀粉等17种碳源制成浓度为1 g/10 mL的糖液经滤膜过滤后加入无糖mMRS中,使糖终浓度为10 g/L。
溴甲酚紫母液的配制:使用无水乙醇溶解,用水定容(如配制20 mL 0.5%溴甲酚紫溶液,将0.1 g固体溴甲酚紫称于50 mL离心管中,加入4 mL无水乙醇溶解,反复吹打,定容至20 mL,1 L培养基中加入15 mL母液)。
体外发酵GMM培养基:参考GOODMAN等[17]的方法配制GMM培养基并进行体外发酵实验,参考LIKOTRAFITI等[18]的方法确定接种量为109 CFU/mL活菌。
1.3.2 碳水化合物利用实验
1.3.2.1 菌株活化与培养
将冷藏于-80 ℃的保菌管取出,于厌氧工作站中培养18~24 h,37 ℃,活化2~3代后开始实验。菌株培养后,取1 mL菌液,8 000 r/min离心5 min,等体积无菌生理盐水重悬。
1.3.2.2 实验菌株的碳源利用能力测定
参考文献方法[19]进行碳源利用能力测定。在不同碳源培养基中加入溴甲酚紫溶液,将菌液按接种量1%加入96孔板中,培养24 h,每隔2 h观察记录一次颜色变化,若颜色由紫变黄,即pH≤5.2,则说明该菌株可以利用该碳源进行代谢。
1.3.2.3 实验菌株在不同碳源培养基中代时的测定
参考文献方法[16]进行代时的测定。代时计算如公式(1)所示:
(1)
式中:G表示双歧杆菌的生长代时;A0表示进入对数生长期时菌株的初始吸光度;At表示t时刻双歧杆菌吸光度。
1.3.2.4 实验菌株在不同碳源培养基中吸光度OD600值的测定
以1%的接种量将菌悬液分别接种到各种碳源培养基中,37 ℃厌氧培养48 h取出,利用酶标仪测定OD600值。以葡萄糖为碳源的mMRS和去糖mMRS作为阳性和阴性实验组。
1.3.3 双歧杆菌在人粪便体外发酵培养基中的生长情况测定
将各菌株接入GMM培养基后,置于厌氧工作站中分别孵育0、24 h,结束后取出置于冰上15 min终止发酵,转移至-80 ℃保存备用。测试之前放于冰上解冻,样品经过10 000×g、4 ℃离心10 min后,取沉淀使用粪便基因组DNA提取试剂盒提取DNA用于定量PCR,通过绝对定量分析粪便中双歧杆菌的丰度变化。
1.3.3.1 粪便基因组提取
快速粪便基因组提取试剂盒用于从粪便样本中提取细菌基因组DNA,粪便基因组DNA提取方法参考肖越[20]的实验方法进行。
1.3.3.2 双歧杆菌的绝对定量
参考文献方法[20]进行标准曲线构建及绝对定量操作。假小链双歧杆菌的种特异性引物[21](BiCAT-1:CGGATGCTCCGACTCCT,BiCAT-2:CGAAGGCTTGCTCCCGAT,序列5′-3′,退火温度65 ℃,产物长度285 bp)。简述定量PCR反应体系与扩增程如下:20 μL体系,2×supermix(BIO-RAD)10 μL,DNA模板2 μL,上下游引物各2 μL,ddH2O(PCR级水)4 μL。扩增程序为:95 ℃,2 min;95 ℃、5 s,65 ℃、30 s;建立融解曲线:65~95 ℃以0.5 ℃增量且2~5 s/步,进行30个循环,95 ℃聚合酶激活和DNA变性5 min。得到Cq值。根据计数结果、稀释倍数、Cq值就可以绘制出lg(CFU)-Cq值标准曲线。将粪便原始DNA进行qRT-PCR实验得到的Cq值代入标准曲线曲即可得到粪便中所求菌种的CFU数量。
1.4 数据处理
该论文中实验均进行3次重复实验,数据显示为每组的平均值±标准偏差。使用单因素方差分析和Tukey多重比较检验来考察各组平均值的差异。P<0.05用于确定统计显著性。GraphPad Prism 9.4用于所有统计分析。
2 结果与分析
2.1 实验菌株的碳源利用能力
测定了12株假小链双歧杆菌对17种碳水化合物的利用情况,实验结果如表2所示。可知12株假小链双歧杆菌均不利用D-阿拉伯糖、甘露糖、L-鼠李糖和可溶性淀粉,均利用葡萄糖、乳糖、FOS、GOS和菊粉,仅有1株菌利用甘露醇、纤维二糖。有50%~91.67%的假小链双歧杆菌能够利用D-半乳糖、木糖、D-果糖、D-麦芽糖及蔗糖。实验结果显示12株假小链双歧杆菌对17种碳水化合物的利用具有株间差异,某些菌株能利用10种以上碳水化合物,而某些菌株仅能利用5种。
表2 假小链双歧杆菌对17种碳水化合物的利用能力
Table 2 Utilization abilities of 17 carbon sources by B.pseudocatenulatum

碳源种类FHNBA14M1FXJWS49M35FJSNT36M3FGSYC12M4FXJWS49M33FGZ16I1M1FGZ16I1M3FAHBZ2M3FFJND17M1FJSNT37M5A14FXJWS49M21菌株利用比例/%葡萄糖111111111111100.00D-半乳糖11111110111191.67木糖10110111100058.33D-果糖10001110110158.33甘露醇0000010000008.33D-阿拉伯糖0000000000000.00海藻糖01110000001141.67甘露糖0000000000000.00L-鼠李糖0000000000000.00D-麦芽糖11111111101191.67乳糖111111111111100.00纤维二糖1000000000008.33蔗糖11111111110191.67FOS111111111111100.00GOS111111111111100.00菊粉111111111111100.00可溶性淀粉0000000000000.00无糖0000000000000.00
注:“1”代表菌株实验结果为阳性,“0”代表菌株实验结果为阴性;菌株利用比例为12株假小链双歧杆菌中能利用该碳源的比例
有研究[16]检测了30株假小链双歧杆菌的碳水化合物利用情况,结果显示,90%以上的菌株能利用葡萄糖、乳糖、GOS、FOS,与本研究结果一致。另外,该文章还报道了假小链双歧杆菌对植物来源的碳源利用能力强于两歧双歧杆菌,但对于宿主来源的碳源(如粘蛋白、2′岩藻糖基乳糖等)利用能力不如两歧双歧杆菌。
2.2 实验菌株在不同碳源培养基中的生长情况
12株假小链双歧杆菌在不同碳源培养基中的生长情况也显示出碳源利用的差异性。由图1可知,12株假小链双歧杆菌在9种碳源培养基中的生长曲线具有差异性,除FJSNT37M5外其他菌株对葡萄糖的利用良好(图1-a),在接种1 250 min后,FJSNT37M5的OD600值仅达到0.39。菌株在不同培养基中的延滞期大部分为480 min左右,但个别菌株延滞期很长,如FJSNT36M3(900 min,图1-b;780 min,图1-c;),FAHBZ2M3(870 min,图1-c;780 min,图1-d;750 min,图1-i),FJSNT37M5(900 min,图1-d;990 min,图1-f;900 min,图1-g),A14(990 min,图1-d;990 min,图1-f;960 min,图1-g),FHNBA14M1(780 min,图1-i),FFJND17M1(870 min,图1-i),FXJWS49M21(990 min,图1-i)等,延滞期的差异体现了菌株对环境适应能力的不同。

a-葡萄糖培养基;b-GOS培养基;c-FOS培养基;d-菊粉培养基;e-乳糖培养基;f-木糖培养基;g-麦芽糖培养基;h-D-半乳糖培养基;i-蔗糖培养基
图1 假小链双歧杆菌在9种碳源培养基中的生长曲线
Fig.1 Growth curves of B.pseudocatenulatum in 9 kinds of carbon source media
注:每株菌N=3
有研究[22]结果显示,2株两歧双歧杆菌960 min后才进入对数期,4株链球菌120 min后即进入对数期。另外,12株假小链双歧杆菌在24 h内的生长速度、生长量也有显著差异,具体情况如下。
在生长曲线中,延滞期后的一段细胞数以几何级数增长的时期为指数期,细菌在指数期生长速率最大,代时最短,本研究把细菌在指数期时的代时计算出来如图2所示。12株假小链双歧杆菌在每种碳源培养基中的代时中位数分别为156.15、144.87、155.86、166.11、180.88、337.53、155.93、382.08、137.61 min。结果显示,每株双歧杆菌在不同碳源培养基中表现出生长速率的差异性,A14在木糖和麦芽糖培养基中的代时最短(图2-g,图2-f,P<0.05),FGSYC12M4在葡萄糖、木糖、麦芽糖和D-半乳糖培养基中的代时最短(图2-a、图2-f、图2-g、图2-h、P<0.05),FXJWS49M35在GOS、FOS、乳糖、木糖培养基中代时较长(图2-b、图2-c、图2-e、图2-f、P<0.05),FXJWS49M33在FOS、菊粉、D-半乳糖培养基中代时较长(图2-c,图2-d,图2-h,P<0.05)。

a-葡萄糖培养基;b-GOS培养基;c-FOS培养基;d-菊粉培养基;e-乳糖培养基;f-木糖培养基;g-麦芽糖培养基;h-D-半乳糖培养基;i-蔗糖培养基
图2 假小链双歧杆菌在不同碳源培养基中的代时
Fig.2 Generation time of B.pseudocatenulatum in different carbon source media
注:每株菌N=3,不同字母 (a~l) 表示不同组之间存在显着差异(P<0.05)
有研究报道了假小链双歧杆菌FGSZY20M1在GOS、FOS、葡萄糖培养基中的代时分别为110、150、100 min,与本研究测得数据相近,另外,研究还检测了短双歧杆菌在上述3种培养基中的代时分别为90、120、70 min,长双歧杆菌为100、90、145 min[16],实验证明,假小链双歧杆菌在葡萄糖培养基中的代时与长双歧杆菌相近,而在GOS和FOS培养基中的代时要高于上述2种双歧杆菌。
生长和繁殖是保证微生物获得生物量的必要前提,生长意味着原生质含量的增加,而生长量的测定可以以此为依据,通过比浊法进行间接测定。从图3-a~图3-i,12株假小链双歧杆菌在每种碳源培养基中的OD600值中位数分别为0.99、1.00、0.85、0.75、1.01、0.31、0.82、0.70、0.85。结果显示,每株双歧杆菌在不同碳源培养基中表现出生长量的差异性,FFJND17M1在葡萄糖、GOS、蔗糖培养基中的OD600值最高(图3-a、图3-b、图3-i,P<0.05),FGZ6I1M3在菊粉、木糖培养基中的OD600值最高(图3-d、图3-f,P<0.05),FXJWS49M35在葡萄糖、FOS、菊粉培养基中的OD600值较低(图3-a、图3-c、图3-d,P<0.05)。

a-葡萄糖培养基;b-GOS培养基;c-FOS培养基;d-菊粉培养基;e-乳糖培养基;f-木糖培养基;g-麦芽糖培养基;h-D-半乳糖培养基;i-蔗糖培养基
图3 假小链双歧杆菌在不同碳源培养基中的OD600值
Fig.3 OD600 of B.pseudocatenulatum in different carbon source medium
注:每株菌N=3,不同字母(a~l)表示不同组之间存在显着差异(P<0.05)
有研究[16]检测了5株假小链双歧杆菌在木糖培养基中的OD600值为0.6~0.9,高于本实验结果,其他双歧杆菌(两歧双歧、短双歧、长双歧杆菌婴儿亚种)在乳糖培养基中的OD600值在0.1~0.2。5株假小链双歧杆菌在乳糖培养基中的OD600值在0.7~1.1,与本研究一致,其他双歧杆菌(两歧双歧、短双歧、长双歧杆菌婴儿亚种,青春双歧杆菌)在乳糖培养基中的OD600值在0.6~0.8,总而言之,其他研究的实验也显示出不同假小链双歧杆菌对碳水化合物利用能力具有差异性,其在乳糖培养基中的生长能力较强。
将12株菌在每种碳源培养基中的代时处于整体代时中位数以下,或OD600值在整体OD600值中位数以上的指标记为达标,将达标数目进行统计,各株菌表现情况如表3所示。可知12株假小链双歧杆菌在碳源培养基中的生长情况也呈现出了较大的差异性,在这些实验菌株中,FGSYC12M4、FGZ16I1M1、FFJND17M1的表现最好,FXJWS49M35、FXJWS49M33、FAHBZ2M3的表现最差。有趣的是,有些菌株在代时(生长速率)和OD600值(生长量)中呈现出了相反的趋势,如FHNBA14M1在木糖、FOS、GOS培养基中代时较长,但24 h后的OD600值却较高,A14在乳糖、菊粉、D-半乳糖、D-麦芽糖、木糖、低聚果糖培养基中的代时很短,但24 h后的OD600值却较低,这表明生长速率较快的菌株最终的生长量并不一定较高。有研究显示出类似的结果,如假小链双歧杆菌在0.5% 的FOS、GOS培养基中的代时分别为160 min和110 min,但最终的OD600值分别为1.2和1.0[16]。
表3 假小链双歧杆菌在9种碳源培养基中的达标情况
Table 3 The up-to-standard status of B.pseudocatenulatum in 9 kinds of carbon source media

项目菌株编号FHNBA14M1FXJWS49M35FJSNT36M3FGSYC12M4FXJWS49M33FGZ16I1M1FGZ16I1M3FAHBZ2M3FFJND17M1FJSNT37M5A14FXJWS49M21代时233938226574OD600623727738324总计856165159514898
2.3 假小链双歧杆菌糖苷水解酶分布特征
如图4所示,假小链双歧杆菌的糖苷水解酶分布同样具有差异性。在假小链双歧杆菌含量较多的前30个糖苷水解酶中,80%以上与植物碳源相关,乳源相关的为GH42和GH2。在碳水化合物利用中表型优良的菌株FGSYC12M4、FGZ16I1M1、FFJND17M1均含有3个以上特异性糖苷水解酶,如GH5_44、GH13_13、GH1、GH36等,GH5为β-1,3-葡萄糖苷酶,GH13为蔗糖磷酸化酶/α-1,6-葡萄糖苷酶,GH1为β-葡萄糖苷酶,GH36为α-半乳糖苷酶[16],这些均为植物碳源相关的糖苷水解酶,此外,ZHU等[23]报告过植物乳杆菌QS7T在以菊粉为碳源的培养基中的最大OD600值为1.891±0.028,并且通过基因组测序和分析显示,与菊粉消耗相关的功能基因(特别是糖苷水解酶)表达显著上调。在本研究中,FFJND17M1基因组中编码GH5_44和GH13_13的基因数量分别是其他11株假小链双歧杆菌的2倍或1.5倍,这也许与FFJND17M1在葡萄糖、蔗糖培养基中的生长量显著高于其他菌株的结果有关。FXJWS49M35、FXJWS49M33、FAHBZ2M3的表型最差,基因分析也发现它们的糖苷水解酶含量低于其他菌株。研究发现假小链双歧杆菌利用乳糖的能力较强,可能与它们含有较多的乳源糖苷水解酶(GH42、GH2)有关。

图4 假小链双歧杆菌糖苷水解酶分布特征
Fig.4 Distribution of glycoside hydrolase across B.pseudocatenulatum
双歧杆菌因编码大量与碳水化合物修饰相关的酶而表现出对富含复杂碳水化合物的胃肠道环境的适应性[24]。不同的假小链双歧杆菌利用碳水化合物的能力具有差异,很可能是因为降解和转运碳水化合物的酶不同,研究表明,假小链双歧杆菌能较好的降解复杂的植物多糖[14],在本实验中,假小链双歧杆菌也表现出较强的降解植物碳源的能力。据报道,假小链双歧杆菌代表菌株C15的β-半乳糖苷酶和阿拉伯糖渗透酶等糖利用基因拷贝数显著高于其他菌株[15]。菌株IPLA因包含4个GH3家族的编码基因而被预测有利用大豆异黄酮苷的性状[14]。目前关于假小链双歧杆菌碳水化合物利用相关基因的研究还缺少针对该菌种的全面研究。
2.4 实验菌株占据肠道丰度的潜力研究
确定单一菌株对单一碳源的利用能力有利于分析菌株的生理特性,但肠道中复杂的碳水碳水化合物环境需要设计更复杂的实验来评估其对胃肠道环境的适应性及在肠道环境中占据丰度优势的潜力。选取在碳水化合物利用实验中表现差异较大的4株双歧杆菌(FHNBA14M1、FAHBZ2M3、A14、FGSYC12M4)进行人粪便体外发酵实验,将菌株接入GMM培养基发酵24 h后对其中的假小链双歧杆菌进行绝对定量,实验结果显示FGSYC12M4增殖量为5.57×107 CFU/mL,显著高于FAHBZ2M3和FHNBA14M1(图5),4株菌的增殖量大小与碳水化合物利用能力的强弱趋势一致(表3),即FGSYC12M4的碳水化合物利用能力最强,在体外发酵实验中的增殖量也最高,FAHBZ2M3的碳水化合物利用能力最弱,在体外发酵实验中的增殖量也最低。但是,FHNBA14M1和A14两株菌在表3中虽然总计差异不大,但两者却处于代时或OD600值两个极端中,而体外发酵实验结果显示,偏向于代时较短或者OD600值较高的菌株在增殖量方面并不体现差异性。即假小链双歧杆菌占据肠道丰度的潜力是基于其对于碳水化合物利用能力的综合考量。

图5 假小链双歧杆菌在GMM培养基中发酵24 h后的增殖
Fig.5 Proliferation of B.pseudocatenulatum after 24 h of fermentation in GMM medium
注:每组N=3,字母“a~c”表示显著性差异(P<0.05)
吴欢等[6]从儿童营养干预后的肠道中分离出优势菌假小链双歧杆菌C95,进行了复杂碳水化合物利用实验(包括FOS、中长链菊粉、低聚麦芽糖、抗性淀粉等),发现其对碳水化合物的利用能力很强,认为这在一定程度上可以解释双歧杆菌被复杂碳水化合物富集而在肠道中成为优势菌的现象。SONNENBURG等[25]也表明,碳水化合物饮食的高低会影响肠道菌群的丰度。因此,碳水化合物利用能力强的菌株具有占据高丰度的潜力。
3 结论
为研究不同假小链双歧杆菌对碳水化合物利用能力的差异性,本研究对12株假小链双歧杆菌在17种碳水化合物中的生长特性进行了测定,使用溴甲酚紫检测菌株对不同碳水化合物的利用情况,发现12株菌对碳水化合物利用的种类为5~11种。12株假小链双歧杆菌编码的大多为降解植源性碳水化合物的糖苷水解酶,在碳水化合物利用中展现出的株间差异可能是因为降解和转运碳水化合物的酶具有差异性。通过测定生长曲线,计算代时,检测OD600值确定了不同菌株在9种碳水化合物中的生长能力,以中位数划分每株菌的达标数量,发现12株菌的达标数目为5~16个不等。通过人粪便体外发酵实验验证了达标数量与其占据丰度的大小有正相关性。结果显示不同的假小链双歧杆菌对碳水化合物利用具有较大的差异,本研究为假小链双歧杆菌的碳水化合物利用能力的研究提供了实验数据,为假小链双歧杆菌作为益生元、益生菌的开发提供了参考。
[1] TURRONI F, FORONI E, PIZZETTI P, et al.Exploring the diversity of the bifidobacterial population in the human intestinal Tract[J].Applied and Environmental Microbiology, 2009, 75(6):1 534-1 545.
[2] 金红芝, 范小兵, 杭晓敏, 等.儿童肠道双歧杆菌和乳杆菌种群结构分析[J].微生物学报, 2005,45(4):567-570.
JIN H Z, FAN X B, HANG X M, et al.Analysis of the probiotic Bifidobacterium and Lactobacillus community in child intestinal flora[J].Acta Microbiologica Sinica, 2005, 45(4):567-570.
[3] 张敏, 范小兵, 杭晓敏, 等.青年人肠道菌群分布及关键益生菌群落结构分析[J].微生物学报,2004,44(5):621-626.
ZHANG M, FAN X B, HANG X M, et al.Distribution of youth intestinal flora and analysis of key probiotics community[J].Acta Microbiologica Sinica, 2004, 44(5):621-626.
[4] 张和春, 王劲松, 杨国, 等.健康老年人肠道双歧杆菌和乳杆菌种群多样性分析[J].中国微生态学杂志, 2006, 18(6):446-448.
ZHANG H C, WANG J S, YANG G, et al.Analysis of the probiotics Bifidobacterium and Lactobacillus community in healthy elderly intestinal flora[J].Chinese Journal of Microecology, 2006, 18(6):446-448.
[5] SANCHIS-CHORD J, DEL PULGAR E M G, CARRASCO-LUNA L J, et al.Bifidobacterium pseudocatenulatum CECT 7765 supplementation improves inflammatory status in insulin-resistant obese children[J].European Journal of Nutrition, 2019, 58(7):2 789-2 800.
J, DEL PULGAR E M G, CARRASCO-LUNA L J, et al.Bifidobacterium pseudocatenulatum CECT 7765 supplementation improves inflammatory status in insulin-resistant obese children[J].European Journal of Nutrition, 2019, 58(7):2 789-2 800.
[6] 吴欢, 王睿瑞, 赵宇峰, 等.一名肥胖儿童营养干预后肠道内假小链双歧杆菌碳水化合物利用能力的探究[J].基因组学与应用生物学, 2015, 34(7):1 384-1 391.
WU H, WANG R R, ZHAO Y F.Exploring carbohydrate utilization capacity of Bifidobacterium pseudocaten ulatum isolated from a morbidly obese child after dietary intervention[J].Genomics and Applied Biology, 2015, 34(7):1 384-1 391.
[7] 薛欣合, 翟芮, 张晨虹.一株人源假小链双歧杆菌缓解小鼠 DSS 致溃疡性结肠炎[J].基因组学与应用生物学, 2019, 38(10):4 520-4 529.
XUE X H, ZHAI R, ZHANG C H.Amelioration effects of one human Bifidobacterium pseudocatenulatum strain on murine DSS-induced colitis[J].Genomics and Applied Biology, 2019, 38(10):4 520-4 529.
[8] CHEN Y, YANG B, STANTON C, et al.Bifidobacterium pseudocatenulatum ameliorates DSS-induced colitis by maintaining intestinal mechanical barrier, blocking proinflammatory cytokines, inhibiting TLR4/NF-κ signaling, and altering gut microbiota[J].Journal of Agricultural and Food Chemistry, 2021, 69(5):1 496-1 512.
[9] GARC A-MANTRANA M I, MONEDERO V, HAROS M.Myo-inositol hexakisphosphate degradation by Bifidobacterium pseudocatenulatum ATCC 27919 improves mineral availability of high fibre rye-wheat sour bread[J].Food Chemistry, 2015, 178:267-275.
A-MANTRANA M I, MONEDERO V, HAROS M.Myo-inositol hexakisphosphate degradation by Bifidobacterium pseudocatenulatum ATCC 27919 improves mineral availability of high fibre rye-wheat sour bread[J].Food Chemistry, 2015, 178:267-275.
[10] FINEGOLD S M, SUTTER V L, MATHISEN G E.Normal Indigenous Intestinal Flora[M].Human Intestinal Microflora in Health and Disease. Amsterdam: Elsevier, 1983, 1:3-31.
[11] POKUSAEVA K, FITZGERALD G F, VAN SINDEREN D.Carbohydrate metabolism in bifidobacteria[J].Genes &Nutrition, 2011, 6(3):285-306.
[12] SCHELL M A, KARMIRANTZOU M, SNEL B, et al.The genome sequence of Bifidobacterium longum reflects its adaptation to the human gastrointestinal tract[J].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(22):14 422-14 427.
[13] MILANI C, TURRONI F, DURANTI S, et al.Genomics of the genus Bifidobacterium reveals species-specific adaptation to the glycan-rich gut environment[J].Applied and Environmental Microbiology, 2015, 82(4):980-991.
[14] ALEGR A
A  , DELGADO S, GUADAMURO L, et al.The genome of Bifidobacterium pseudocatenulatum IPLA 36007, a human intestinal strain with isoflavone-activation activity[J].Gut Pathogens, 2014, 6:31.
, DELGADO S, GUADAMURO L, et al.The genome of Bifidobacterium pseudocatenulatum IPLA 36007, a human intestinal strain with isoflavone-activation activity[J].Gut Pathogens, 2014, 6:31.
[15] WU G J, ZHANG C H, WU H, et al.Genomic microdiversity of Bifidobacterium pseudocatenulatum underlying differential strain-level responses to dietary carbohydrate intervention[J].mBio, 2017, 8(1):e02 348-e02 316.
[16] 刘时捷. 双歧杆菌碳源利用特性及种间互养机制研究[D].无锡:江南大学,2021.
LIU S J.Study on utilization characteristics of carbon source and interspecific mutualism mechanism of Bifidobacterium[D].Wuxi:Jiangnan University, 2021.
[17] GOODMAN A L, KALLSTROM G, FAITH J J, et al.Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(15):6 252-6 257.
[18] LIKOTRAFITI E, TUOHY K M, GIBSON G R, et al.An in vitro study of the effect of probiotics, prebiotics and synbiotics on the elderly faecal microbiota[J].Anaerobe, 2014, 27:50-55.
[19] MAO B Y, YIN R M, LI X S, et al.Comparative genomic analysis of Lactiplantibacillus plantarum isolated from different niches[J].Genes, 2021, 12(2):241.
[20] 肖越. 长双歧杆菌肠道定殖的研究[D].无锡:江南大学,2021.
XIAO Y.Study on intestinal colonization of Bifidobacterium longum[D].Wuxi:Jiangnan University, 2021.
[21] ISHIZUKA A, TOMIZUKA K, AOKI R, et al.Effects of administration of Bifidobacterium animalis subsp.lactis GCL2505 on defecation frequency and bifidobacterial microbiota composition in humans[J].Journal of Bioscience and Bioengineering, 2012, 113(5):587-591.
[22] 张英春. 益生菌功能特性及共生性研究[D].哈尔滨:东北农业大学,2003.
ZHANG Y C.Study on functional characteristics and symbiosis of probiotics[D].Haerbin:Northeast Agricultural University, 2003.
[23] ZHU Y T, ZHANG S L, MA Q, et al.Global genome and comparative transcriptomic analysis reveal the inulin consumption strategy of Lactiplantibacillus plantarum QS7T[J].Food Research International, 2022, 151:110846.
[24] POKUSAEVA K, FITZGERALD G F, VAN SINDEREN D.Carbohydrate metabolism in bifidobacteria[J].Genes and Nutrition, 2011, 6(3):285-306.
[25] SONNENBURG J L, B CKHED F.Diet-microbiota interactions as moderators of human metabolism[J].Nature, 2016, 535(7610):56-64.
CKHED F.Diet-microbiota interactions as moderators of human metabolism[J].Nature, 2016, 535(7610):56-64.