环糊精(cyclodextrin, CD)是一种由环糊精葡萄糖基转移酶(cyclodextrin glucosyltransferase, CGTase)以淀粉为底物合成的环状低聚糖[1],一般由6~8个吡喃葡萄糖单元构成,根据糖单元数量可分为α-环糊精(6)、β-环糊精(7)及γ-环糊精(8)。环糊精具有内部疏水及外部亲水的空腔结构,可以和客体分子形成包合物进而增加其溶解性或稳定性[2]。因此环糊精被广泛应用于制药、化妆品、食品、纺织、污水处理等领域[3]。在3种环糊精中,α-环糊精水溶性高且具有抗消化酶水解特性,因此还可以作为可溶性膳食纤维促进肠道蠕动、调节肠道菌群。然而制备α-环糊精时合成和降解同时存在限制了产量的进一步提升,甚至存在明显的产量下降趋势[4],这些问题导致α-环糊精价格昂贵。因此提高α-环糊精产量是一项极有意义的研究。
CGTase的分子改造是一种提高α-环糊精产量的方法[3]。CGTase属于α-淀粉酶家族[5],含有5个结构域[4]。催化中心由TIM(α/β)8结构组成,存在9个糖分子结合位点(-7~+2亚位点)用于结合供体分子及受体分子[4]。根据受体分子的不同,CGTase催化的反应被分为环化反应、歧化反应、偶联反应及水解反应[6]。环化反应是CGTase生产环糊精的关键反应。然而由于存在多个底物结合亚位点,CGTase的环化产物是3种环糊精的混合物[4, 7]。部分来源的CGTase在合成α-环糊精上占据一定的优势,如Klebsiella pneumoniae M5a1 CGTase的环化产物中α-环糊精质量分数为73%,Thermococcus sp. B1001 CGTase的环化产物中α-环糊精质量分数为51%[4],Paenibacillus sp. 602-1 CGTase的环化产物中α-环糊精质量分数为83%[8]。但是它们对底物的利用率均较低[4]。
此外,有研究报道指出了底物结合亚位点附近的氨基酸残基位点对CGTase催化反应的影响,如-7亚位点主要影响环化反应特异性[4,7,9],-3亚位点影响环化活性[10],+1/+2亚位点主要影响受体分子的结合[6,11]等。近些年,一些研究者展示了定向进化或定点突变改造CGTase,从而提高α-环糊精占比的相关报道[3]。如LI等[12]构建Paenibacillus macerans JFB05-01 CGTase突变体D372K/Y89R的产物中α-环糊精占比提高23.2%,WANG等[13]构建Paenibacillus macerans JFB05-01的突变体Y89D的产物中α-环糊精占比提高7.6%,CHAO等[14]构建Bacillus sp.602-1 CGTase的突变体Y167H/V536A产物中α-环糊精占比提高5.4%,WANG等[9]构建Paenibacillus macerans JFB05-01 CGTase突变体R146P/D147A的产物中α-环糊精占比提高12.9%。
本研究选择了表达水平较高[15]、总转化率较高且稳定性较好[4]的B.stearothermophilus NO2 CGTase进行研究。参照之前的研究成果[7,11],本研究在CGTase的-7亚位点构建突变体E142P以提高CGTase的α-环糊精合成特异性,+1/+2亚位点构建突变体L277M、L277F及N353A以提高转糖苷反应特异性。最终,通过检测它们的转化产物,E142P/L277M是最优的生产α-环糊精的突变体,其产量为10.15 g/L,较野生型提高1.7 g/L,并且α-环糊精占比较野生型提高14.3%。本研究为α-环糊精的工业化提供了新的思路,具有重要意义。
1 材料与方法
1.1 试剂、菌株及质粒
酵母粉、蛋白胨、琼脂粉、甲基橙、酚酞、三羟甲基氨基甲烷(Tris)、盐酸、咪唑、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、α-环糊精、β-环糊精等,上海国药生物科技有限公司;2×Phanta Max Master Mix,南京诺唯赞生物科技股份有限公司;Dpn I,大连TaKaRa生物科技有限公司。
Escherichia coli JM109作为重组DNA操作的宿主菌。E.coli BL21作为CGTase表达的宿主菌。pET20b(+)/cgtase质粒参照TAO等[15]构建。
1.2 CGTase突变体质粒构建
使用pET20b(+)/cgtase作为模板质粒,使用表1中的引物1~4构建突变体L277M及L277F的质粒。
表1 定点突变引物
Table 1 The primers for site-directed mutation

注:下划线部分为突变位点。
编号引物序列(5′-3′方向)1L277M-FTCTGGCATGAGCCTGATGGATTTCCGTTTTGGT2L277M-RACCAAAACGGAAATCCATCAGGCTCATGCCAGA3L277F-FTCTGGCATGAGCCTGTTTGATTTCCGTTTTGGT4L277F-RACCAAAACGGAAATCAAACAGGCTCATGCCAGA5N353A-FTCTCGTGGTGTTCCGGCAATCTATTATGGTACT6N353A-RAGTACCATAATAGATTGCCGGAACACCACGAGA7E142P-FACCTCTCCGGCGAGCCCAACCAACCCGAGCTAC8E142P-RGTAGCTCGGGTTGGTTGGGCTCGCCGGAGAGGT
使用pET20b(+)/L277M及pET20b(-)/L277F作为模板质粒,使用表1中的引物5~8构建突变体E142P/L277M、E142P/L277F、L277M/N353A及L277F/N353A的质粒。同时,所有质粒在目的基因的C端均含有His-tag标签,可用于蛋白纯化。在PCR仪中进行扩增后,产物使用Dpn I处理。最终转化到E.coli JM109,提取质粒并测序。测序正确的质粒转化到E.coli BL21(DE3)中用于后续目标蛋白的表达。
1.3 CGTase野生型及突变体的表达
将构建好的E.coli BL21(DE3)挑至LB(Luria-Bertani)液体培养基(含100 μg/mL的卡那抗生素)中,37 ℃、200 r/min条件下培养10 h作为种子液。按照体积分数5%的转接量将种子液转接至TB(Terrific-Broth)培养基(含100 μg/mL的卡那抗生素)中,37 ℃、200 r/min条件下培养2 h后调至25 ℃继续培养48 h后终止发酵培养。将获得的发酵液于8 000 r/min离心20 min后取上清液获得粗酶液。
1.4 CGTase的酶活力测定
1.4.1 CGTase环化反应活性检测
1.4.1.1 CGTase生成α-环糊精的酶活力检测条件
反应条件为50 ℃及25 mmol/L、pH 5.5的磷酸盐缓冲液。酶反应体系包括2 mL上述缓冲液配制的1%可溶性淀粉及0.1 mL的适量稀释的酶液。精确反应10 min后加入0.2 mL的3 mol/L HCl溶液终止反应,之后加入0.2 mL的0.44 mmol/L甲基橙溶液进行显色。生成的α-环糊精能够包埋甲基橙,使溶液在505 nm的吸光值降低,依照此制作标准曲线并计算α-环糊精的产量。α-环化反应酶活力定义为在上述反应条件下1 min内催化可溶性淀粉生成1 μmol α-环糊精所需要的酶量为1 U。
1.4.1.2 CGTase生成β-环糊精的酶活力检测条件
反应条件为50 ℃及25 mmol/L、pH 5.5的磷酸盐缓冲液。酶反应体系包括2 mL上述缓冲液配制的1%可溶性淀粉及0.1 mL的适量稀释的酶液。精确反应10 min后加入0.2 mL的0.6 mol/L HCl溶液终止反应,之后加入0.5 mL的0.6 mol/L的Na2CO3溶液并加入0.2 mL的1.2 mmol/L酚酞溶液显色。生成的β-环糊精能够包埋酚酞,使溶液在550 nm的吸光值降低,依照此制作标准曲线并计算β-环糊精的产量。β-环化反应酶活力定义为在上述反应条件下1 min内催化可溶性淀粉生成1 μmol β-环糊精所需的酶量为1 U。
1.4.2 CGTase水解反应活性检测
水解反应酶活力主要指CGTase降解可溶性淀粉生成小分子糖的能力。反应条件为50 ℃及50 mmol/L、pH 5.5的磷酸盐缓冲液。酶反应体系包括1 mL上述缓冲液配制的1%可溶性淀粉、0.9 mL上述缓冲液及0.1 mL适量稀释的酶液。精确反应10 min后加入3 mL DNS溶液终止反应,使用去离子水定容至15 mL。CGTase水解可溶性淀粉生成的小分子糖均为还原糖,能够与DNS反应并显色,依照此制作标准曲线并计算小分子糖的产量,最终检测540 nm的吸光值确定小分子糖的生成量。水解反应酶活力定义:在上述反应条件下1 min内催化可溶性淀粉生成1 μmol麦芽糖当量所需的酶量为1 U。
1.5 α-环糊精的制备
在50 ℃及50 mmol/L、pH 5.5的磷酸盐缓冲液条件下进行CGTase的催化反应制备α-环糊精。使用上述缓冲液配制5%可溶性淀粉作为底物,按照1 g底物5 U环化反应活性的加酶量添加CGTase,反应24 h并固定时间点取样。取样后煮沸灭活用于检测。
1.6 HPLC检测环糊精方法
使用HPLC检测环糊精产量,色谱柱使用Aps-2 Hypersil(4.6 mm×250 mm),柱温40 ℃,流动相为体积分数75%的乙腈,流速0.8 mL/min,检测器为2414型(示差折光检测器)。分别使用2、10、2 g/L的α-环糊精、β-环糊精及γ-环糊精作为标准品。按照1∶1的体积比添加乙腈至样品中沉淀1 h后于12 000 r/min、2 min离心去除大分子底物,用0.22 μm有机相微孔滤膜过滤后即可使用。
1.7 分子动力学(molecular dynamics, MD)结构模拟分析
以野生型B.stearothermophilus NO2 CGTase(PDB ID:1CYG)的三维结构作为模板,利用SWISS-MODEL(https://swissmodel.expasy.org/)[16]模拟突变体E142P/L277M及L277M/N353A的三维结构。利用Amber18进行MD模拟,分别采用ff14SB(蛋白残基)以及TIP3P(水分子)力场,在300 K的温度下模拟10 ns。得到的轨迹利用AMBER18的capptraj分析其均方根偏差(root mean square deviation,RMSD)、均方根波动(root mean square fluctuation,RMSF)、关键氨基酸残基Cα距离、回旋半径(radius of gyration, Rg)及溶剂可及表面积(solvent accessible surface area, SASA)。
2 结果与分析
2.1 突变体质粒的构建及异源表达
参照KONG等[11]对CGTase的Leu277位点转苷水解反应的研究结果,因其具有提高歧化反应并降低水解反应的作用,本文研究L277M及L277F突变体对α-环糊精产量的影响。同时,参照ZUO等[7]对α-环糊精产量的研究,在L277M及L277F突变体的基础上组合E142P及N353A突变体进行研究。
使用E.coli JM109作为宿主,构建突变体L277M、L277F、E142P/L277M、E142P/L277F、L277M/N353A及L277F/N353A的质粒。使用E.coli BL21(DE3)作为表达宿主表达上述突变体。野生型及相关突变体CGTase的十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析如图1所示,均在60 kDa附近有可溶性条带。环化反应活力检测如表2所示,所有突变体的环化反应活力均比野生型低。此外,突变体E142P/L277M及E142P/L277F的α/β值分别提高至野生型的2.52及2.07倍,说明这2个突变体的环化反应特异性向合成α-CD方向偏移。此外,由于Leu277及Gln353位点相关突变体对CGTase水解反应的抑制,所有突变体的水解反应活力均低于野生型,其中L277M/N353A及L277F/N353A组合突变体的水解活力不足野生型的50%。
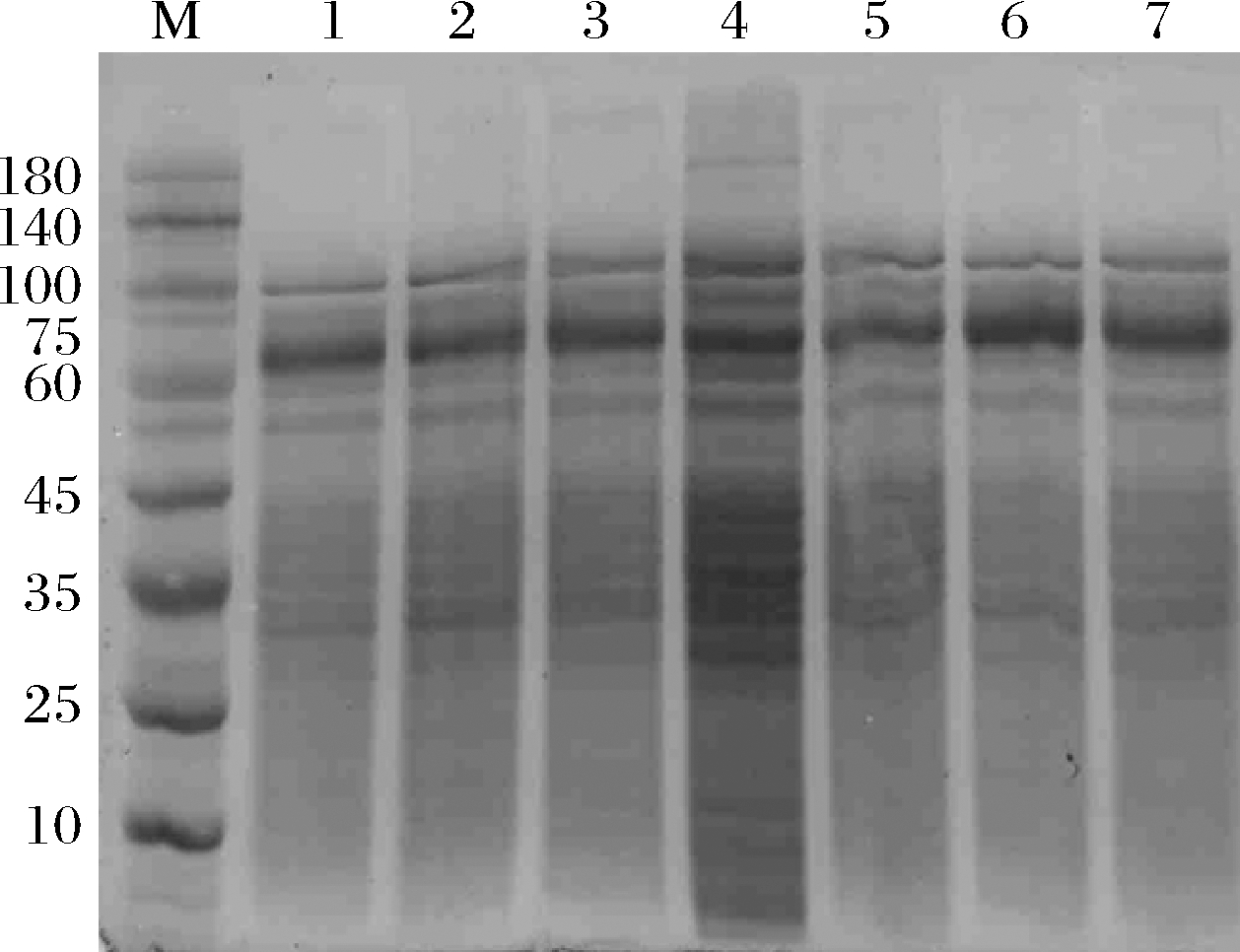
M-markers;1-野生型CGTase;2-L277M突变体;3-L277F突变体;4-E142P/L277M突变体;5-E142P/L277F突变体;6-L277M/N353A突变体;7-L277F/N353A突变体
图1 野生型和突变体CGTase的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of wild-type and mutants CGTase
表2 野生型与L277相关突变体CGTase的环化及水解活性
Table 2 Cyclization and hydrolysis activity of wild-type and L277 related mutant CGTase
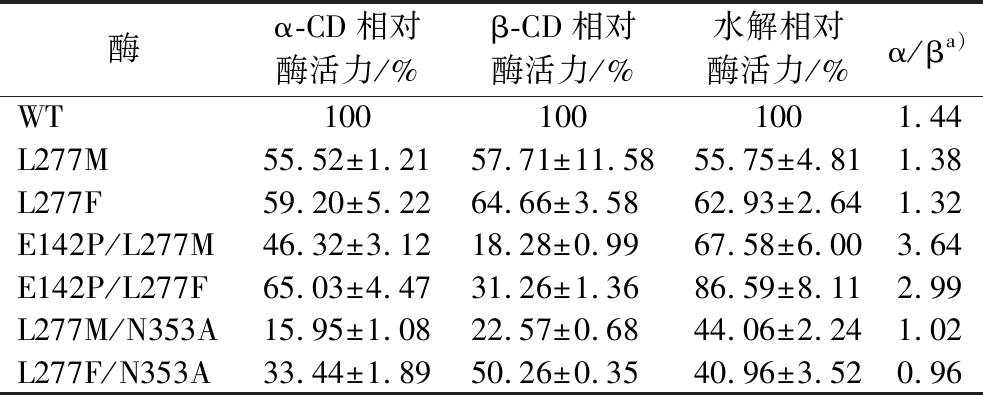
注a):α-CD环化活性与β-CD环化活性的比值。
酶α-CD相对酶活力/%β-CD相对酶活力/%水解相对酶活力/%α/βa)WT1001001001.44 L277M55.52±1.2157.71±11.5855.75±4.811.38 L277F59.20±5.2264.66±3.5862.93±2.641.32 E142P/L277M46.32±3.1218.28±0.9967.58±6.003.64 E142P/L277F65.03±4.4731.26±1.3686.59±8.112.99 L277M/N353A15.95±1.0822.57±0.6844.06±2.241.02 L277F/N353A33.44±1.8950.26±0.3540.96±3.520.96
2.2 L277M及L277F突变体制备α-环糊精的应用
为了确定单突变体对环糊精产量的影响,使用5%可溶性淀粉作为底物进行酶转化反应。L277M、L277F催化生成α-环糊精的最高产量分别为8.97和8.39 g/L(图3),相较于野生型(8.45 g/L,图2)均无明显增加。同时,2种突变体在α-环糊精占比方面也未体现出明显的优势,均为35%左右,较野生型下降3%(表3)。参照KONG等[11]对Leu277相关突变体的分析,该位点影响受体亚位点附近的疏水性以及提高受体底物的亲和力。根据之前的CGTase突变体的相关研究[4]:影响环糊精比例的氨基酸残基位点位于供体位点,特别是—7亚位点。因此,L277M及L277F突变体可能并不能明显提高α-环糊精的产量及占比。但是,由于2个突变体均降低了水解反应(表2),这导致反应体系中小分子糖的减少,从而能够降低α-环糊精的降解。虽然单突变体L277M及L277F能够减弱α-环糊精的降解,但由于其并未从根本改变α-环糊精的产量,因此并不能展现其优势,进而导致突变体的α-环糊精产量及占比与野生型相当。
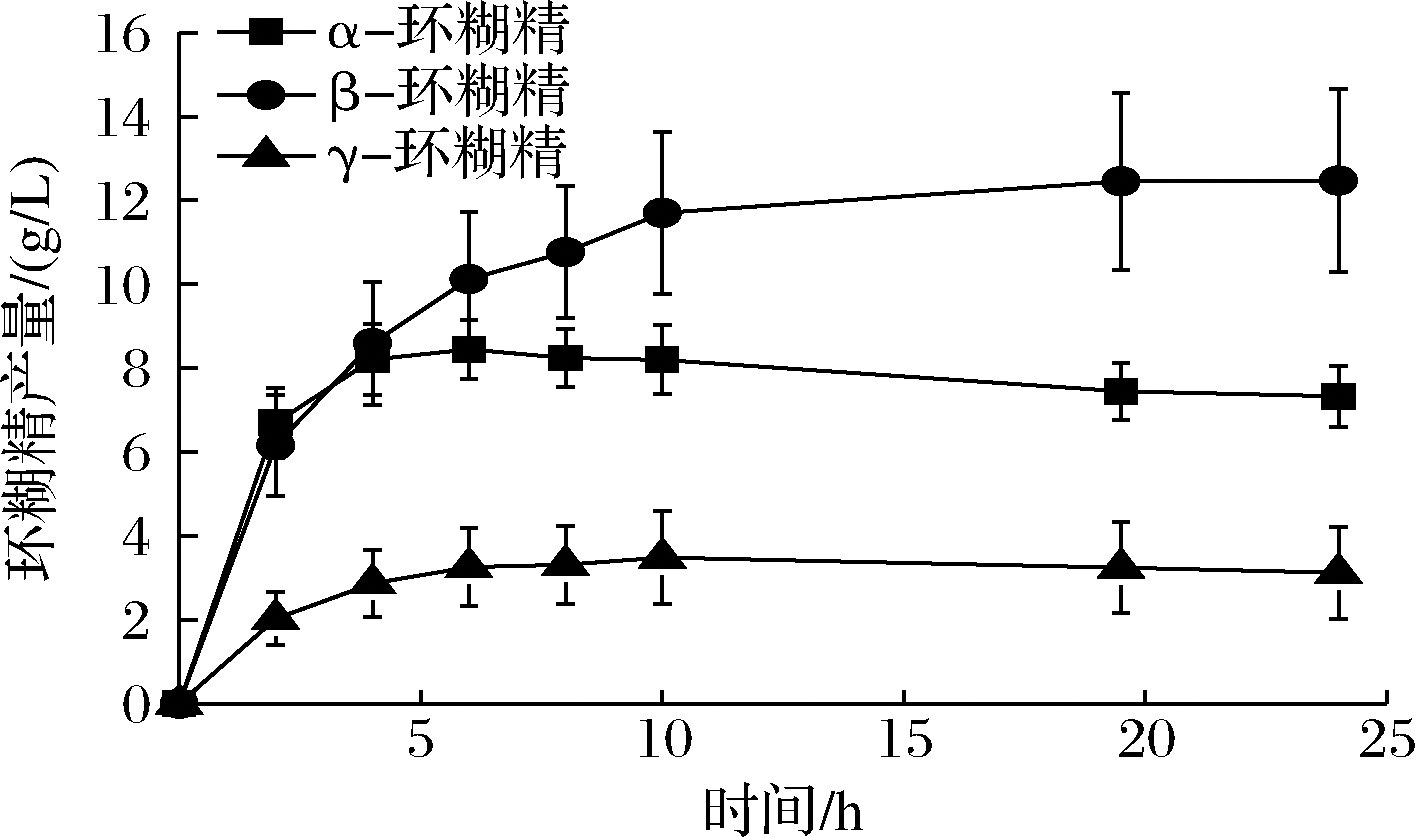
图2 24 h内野生型CGTase合成环糊精的产量变化
Fig.2 Yield change of CD produced by wild-type CGTase within 24 h

a-L277M合成环糊精的产量变化;b-L277F合成环糊精的产量变化
图3 24 h内L277M及L277F突变体CGTase合成环糊精的产量变化
Fig.3 The yield change of CD produced by L277M and L277F mutants CGTase within 24 h
表3 野生型及突变体CGTase的环糊精产物比较
Table 3 Comparison of CD products between wild-type and mutants of CGTase
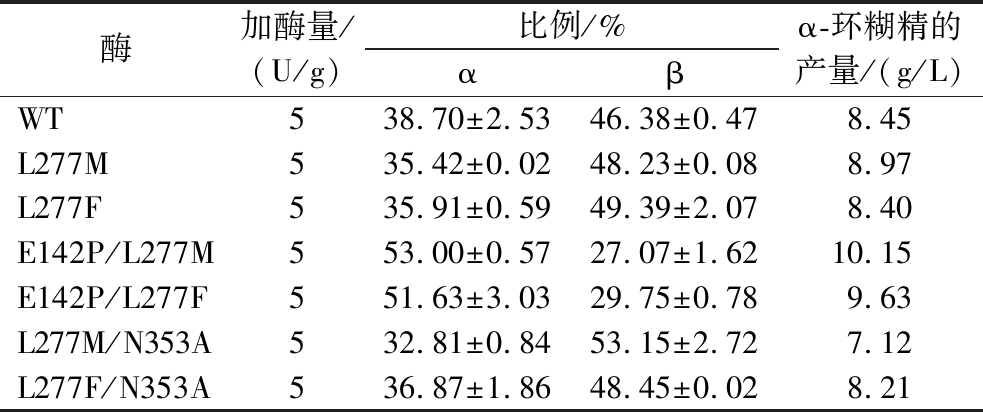
酶加酶量/(U/g)比例/%αβα-环糊精的产量/(g/L)WT538.70±2.5346.38±0.478.45L277M535.42±0.0248.23±0.088.97L277F535.91±0.5949.39±2.078.40E142P/L277M553.00±0.5727.07±1.6210.15E142P/L277F551.63±3.0329.75±0.789.63L277M/N353A532.81±0.8453.15±2.727.12L277F/N353A536.87±1.8648.45±0.028.21
2.3 E142P/L277M及E142P/L277F制备α-环糊精的应用
为了更好地利用L277M及L277F降低水解反应的优势,本研究引入了突变体E142P。该位点能够有效地提高产物中α-环糊精的占比(比野生型高9.65%[7]),但在反应后期存在严重的α-环糊精降解现象[4,7,9]。酶转化结果显示(图4),E142P/L277M最高催化产生了10.15 g/L的α-环糊精,而E142P/L277F最高催化产生了9.63 g/L的α-环糊精。相较于野生型,两者的产量均有提高。同时,对比ZUO等[7]报道的E142P最高催化产生约9.4 g/L的α-环糊精,该研究中的双突变体的α-环糊精产量出现了小幅的提升。同时,相较于E142P突变体,E142P/L277M及E142P/L277F在催化反应后期较为稳定,α-环糊精未出现显著的降解,这可能是由于Leu277突变体降低了水解的作用。
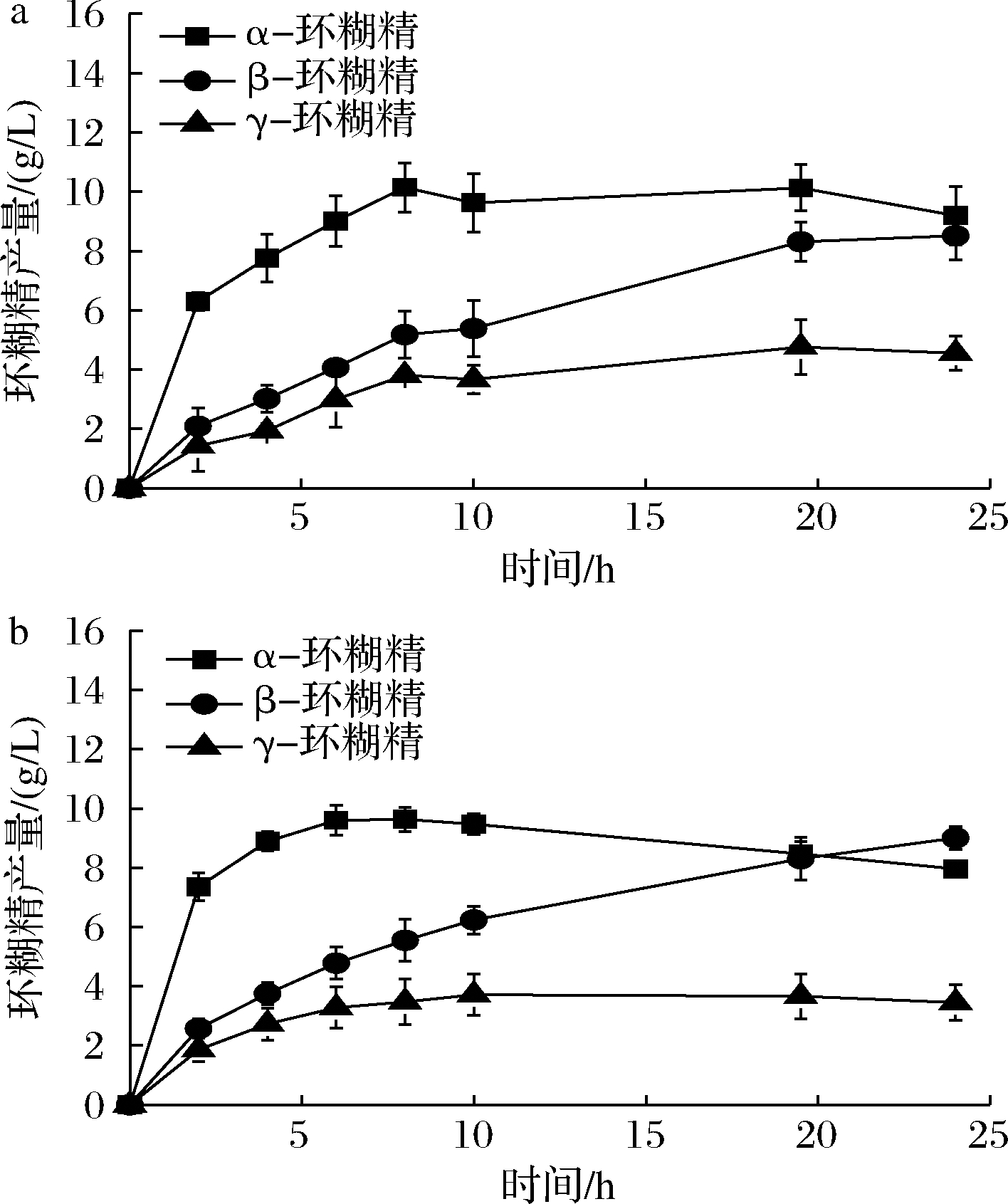
a-E142P/L277M合成环糊精的产量变化;b-E142P/L277F合成环糊精的产量变化
图4 24 h内E142P/L277M及E142P/L277F突变体CGTase合成环糊精的产量变化
Fig.4 Yield change of CD produced by E142P/L277M and E142P/L277F mutants CGTase within 24 h
2.4 L277M/N353A及L277F/N353A制备α-环糊精的应用
为了进一步降低CGTase的水解反应,本研究引入了突变体N353A。该位点同样能够有效降低CGTase的水解反应,约为野生型的21.3%[7]。将其与L277M或L277F组合,尝试以组合突变体制备α-环糊精。结果如图5所示,L277M/N353A及L277F/N353A最高催化产生α-环糊精分别为7.12及8.21 g/L,较野生型更低。同时α-环糊精占比也比野生型更低(表3)。这可能是由于Asn353和Leu277在空间结构上距离较近,同时突变2个氨基酸残基位点时,该处存在的疏水簇结构[11]或电荷平衡[7]可能遭到破坏,导致CGTase的结构较野生型更不稳定。

a-L277M/N353A;b-L277F/N353A
图5 24 h内L277M/N353A及L277F/N353A突变体CGTase合成环糊精的产量变化
Fig.5 The yield change of CD produced by L277M/N353A and L277F/N353A mutants CGTase within 24 h
2.5 MD结构模拟分析
为解析突变体E142P/L277M的优势所在以及L277M/N353A转化率降低的原因,本研究使用MD结构模拟分析了野生型及2个突变体在10 ns内的轨迹变化。RMSD结果如图6-a所示,3个结构在10 ns内均达到平衡状态,其中L277M/N353A较其他2种结构更晚达到平衡。RMSF结果如图6-b所示,L277M/N353A的RMSF在300位氨基酸残基附近波动较大。此外,图6-c显示2个突变体中L277与N353之间的Cα距离高于野生型。上述结果表明L277M/N353A结构波动更大。针对L277及N353所在疏水簇[11]分析SASA,结果如图6-d所示,L277M/N353A的SASA明显增大,这可能是因为双突变体破坏了疏水簇结构所致。此外,L277位点突变后自旋半径增大(图6-e),这与甲硫氨酸(M)侧链长度增大有关;N353位点突变后自旋半径降低,这与丙氨酸(A)侧链长度降低有关。MD结果说明E142P/L277M突变体由于突变位点相互影响并不大,因此对α-环糊精的转化产生了正向效应。与之相反,L277M/N353A突变体由于突变位点均位于疏水簇,对该区域影响较大,导致酶催化活力降低,因此对α-环糊精的转化产生了负向效应。
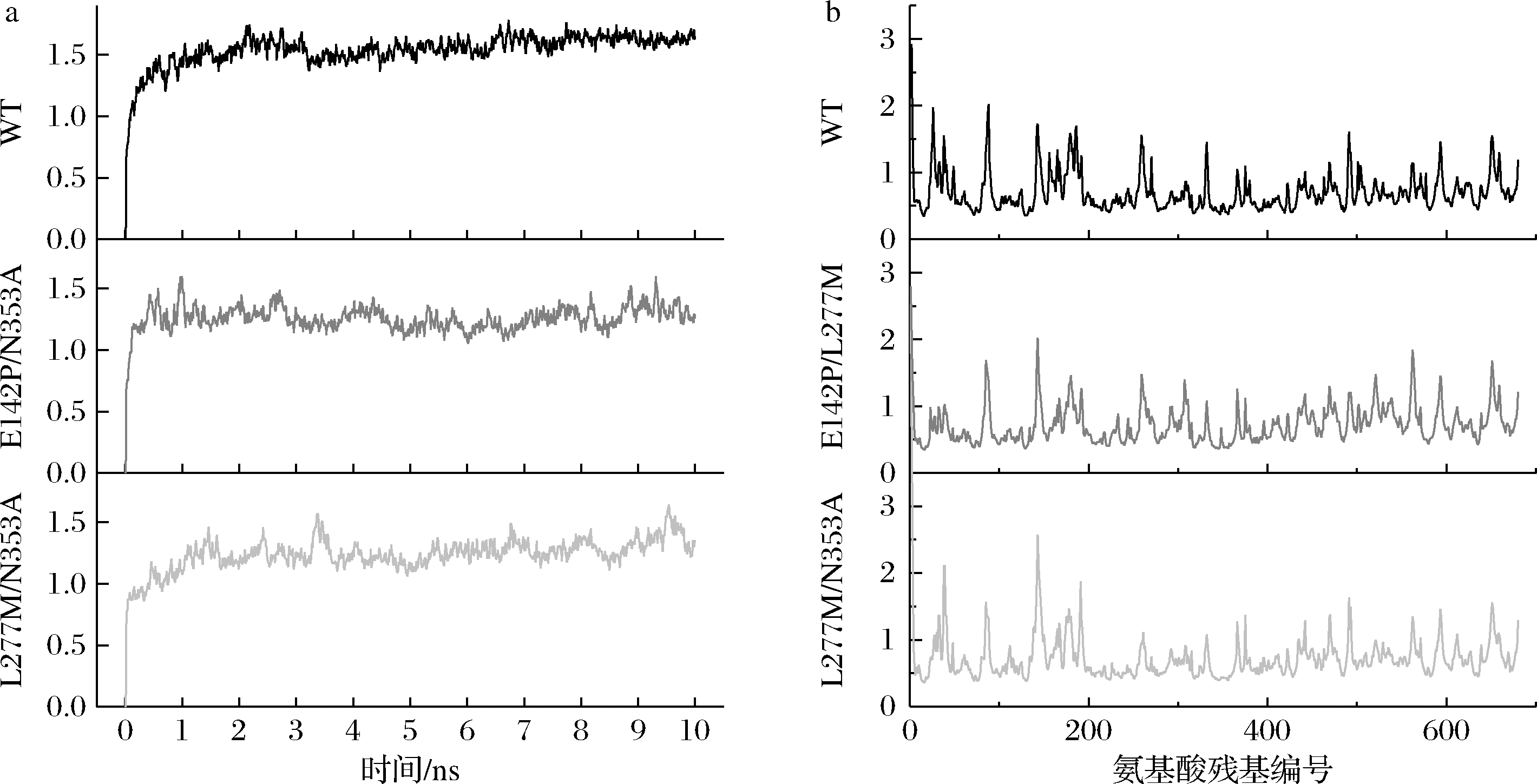

a-野生型及突变体RMSD的结果;b-野生型及突变体RMSF的结果;c-L277与N353A的Cα距离;d-突变体及野生型的SASA变化;e-L277位点的自旋半径;f-N353位点的自旋半径
图6 分子动力学模拟分析野生型、突变体E142P/L277M及突变体L277M/N353A的结构在10 ns的变化规律
Fig.6 Molecular dynamics was used to simulate and analyze the structural changes of wild type, mutants E142P/L277M and L277M/N353A in 10 ns
3 结论
本研究从降低CGTase水解反应及提高环化反应活力对其进行分子改造。L277M、L277F及N353A突变体虽然降低了CGTase的水解反应活力,但其本身对α-环糊精的特异性生产无明显影响。L277M/N353A及L277F/N353A则导致CGTase的α/β值明显降低,因此α-环糊精转化率明显降低。最终的优势突变体为E142P/L277M,在24 h内最高催化生成了10.15 g/L的α-环糊精,较野生型α-环糊精产量提高1.7 g/L。此外突变体E142P/L277M生成的α-环糊精占比较野生型提高14.3%。整体而言,该研究为α-环糊精的生产应用提供了新的思路。
[1] VAN DER VEEN B A, VAN ALEBEEK G J W M, UITDEHAAG J C M, et al.The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans (strain 251) proceed via different kinetic mechanisms[J].European Journal of Biochemistry, 2000, 267(3):658-665.
[2] JANICKA P, KAYKHAII M, P OTKA-WASYLKA J, et al.Supramolecular deep eutectic solvents and their applications[J].Green Chemistry, 2022, 24(13):5035-5045.
OTKA-WASYLKA J, et al.Supramolecular deep eutectic solvents and their applications[J].Green Chemistry, 2022, 24(13):5035-5045.
[3] LEEMHUIS H, KELLY R M, DIJKHUIZEN L.Engineering of cyclodextrin glucanotransferases and the impact for biotechnological applications[J].Applied Microbiology and Biotechnology, 2010, 85(4):823-835.
[4] KELLY R M, DIJKHUIZEN L, LEEMHUIS H.The evolution of cyclodextrin glucanotransferase product specificity[J].Applied Microbiology and Biotechnology, 2009, 84(1):119-133.
[5] STAM M R, DANCHIN E G J, RANCUREL C, et al.Dividing the large glycoside hydrolase family 13 into subfamilies:Towards improved functional annotations of α-amylase-related proteins[J].Protein Engineering, Design and Selection, 2006, 19(12):555-562.
[6] VAN DER VEEN B A, LEEMHUIS H, KRALJ S, et al.Hydrophobic amino acid residues in the acceptor binding site are main determinants for reaction mechanism and specificity of cyclodextrin-glycosyltransferase[J].Journal of Biological Chemistry, 2001, 276(48):44557-44562.
[7] ZUO F Y, SU L Q, KONG D M, et al.Molecular modification of Bacillus stearothermophilus NO2 cyclodextrin glucosyltransferase and preparation of α-cyclodextrin[J].Systems Microbiology and Biomanufacturing, 2022, 2(4):695-704.
[8] XIE T, SONG B H, YUE Y, et al.Site-saturation mutagenesis of central tyrosine 195 leading to diverse product specificities of an α-cyclodextrin glycosyltransferase from Paenibacillus sp.602-1[J].Journal of Biotechnology, 2014, 170:10-16.
[9] WANG L, DUAN X G, WU J.Enhancing the α-cyclodextrin specificity of cyclodextrin glycosyltransferase from Paenibacillus macerans by mutagenesis masking subsite-7[J].Applied and Environmental Microbiology, 2016, 82(8):2247-2255.
[10] PARSIEGLA G, SCHMIDT A K, SCHULZ G E.Substrate binding to a cyclodextrin glycosyltransferase and mutations increasing the γ-cyclodextrin production[J].European Journal of Biochemistry, 1998, 255(3):710-717.
[11] KONG D M, WANG L, SU L Q, et al.Effect of leu277 on disproportionation and hydrolysis activity in Bacillus stearothermophilus no2 cyclodextrin glucosyltransferase[J].Applied and Environmental Microbiology, 2021, 87(12):e03151-20.
[12] LI Z F, ZHANG J Y, WANG M, et al.Mutations at subsite -3 in cyclodextrin glycosyltransferase from Paenibacillus macerans enhancing α-cyclodextrin specificity[J].Applied Microbiology and Biotechnology, 2009, 83(3):483-490.
[13] 王宁, 吴丹, 陈晟, 等.利用来源于Paenibacillus macerans的α-CGTase突变体Y89D制备α-环糊精[J].食品科学, 2011, 32(3):165-170.
WANG N, WU D, CHEN S, et al.Preparation of α-cyclodextrin by mutation Y89D of cyclodextrin glycosyltransferase from Paenibacillus macerans[J].Food Science, 2011, 32(3):165-170.
[14] SONG B H, YUE Y, XIE T, et al.Mutation of Tyrosine167Histidine at remote substrate binding subsite -6 in α-cyclodextrin glycosyltransferase enhancing α-cyclodextrin specificity by directed evolution[J].Molecular Biotechnology, 2014, 56(3):232-239.
[15] TAO X M, WANG T A, SU L Q, et al.Enhanced 2-O-α-D-glucopyranosyl-L-ascorbic acid synthesis through iterative saturation mutagenesis of acceptor subsite residues in Bacillus stearothermophilus NO2 cyclodextrin glycosyltransferase[J].Journal of Agricultural and Food Chemistry, 2018, 66(34):9052-9060.
[16] WATERHOUSE A, BERTONI M, BIENERT S, et al.SWISS-MODEL:Homology modelling of protein structures and complexes[J].Nucleic Acids Research, 2018, 46(W1):W296-W303.