菠萝又名凤梨,其含有丰富的有机酸、氨基酸、维生素与矿物质等营养成分,并且味道清甜、气味芬芳[1]。菠萝原产于美洲热带地区,我国菠萝的种植区域主要在广东、广西、福建、台湾等地区,是我国华南地区主要的外销水果[2]。我国的菠萝加工制品主要有菠萝罐头与菠萝汁,在菠萝加工过程中会产生大量的加工副产物,约占菠萝总量的50%[3],其营养成分与菠萝果肉基本相同[4]。如果菠萝加工副产物不加以有效利用,不仅会造成资源的浪费,也会成为环境污染源之一。目前关于菠萝加工副产物再利用方面的研究,主要集中在以其为原料提取多酚[5]和多糖[6]等活性成分,以及发酵制备果酒[7]、果醋[8]等发酵产品。
发酵是果蔬加工副产物再利用的最常用方法之一。微生物发酵可使果蔬加工副产物中的总酚、有机酸等活性物质增加,并可提高超氧化物歧化酶(superoxide dismutase, SOD)等酶的活力,也可赋予发酵产品更丰富的风味[9]。乳酸菌和酵母菌是果蔬发酵最常用的菌种,而且很多研究表明混菌发酵的效果更好[10-11]。在混合发酵过程中,酵母菌代谢可产生多种营养物质,而这些营养物质对乳酸菌的生长具有促进作用,同时酵母菌也能从乳酸菌的发酵产物中获得有益于生长繁殖的物质与能量[12]。而利用土著菌混合发酵菠萝及其加工副产物的研究还鲜有报道。
由于菠萝加工副产物中蛋白质含量较低,添加蛋白质可以提高发酵体系的蛋白质含量,有利于发酵的进行。乳清蛋白是奶酪加工的副产物之一,有研究表明其在发酵过程中可产生多种生物活性肽,具有抗氧化、提高机体免疫力等多种保健功能[13]。本实验利用乳酸菌和酵母菌发酵添加了乳清蛋白的菠萝加工副产物,分别以发酵产品中的总酚含量和SOD酶活力为指标对发酵培养基和发酵工艺进行优化,并对发酵产品中的有机酸含量进行分析,以探究土著菌对果蔬发酵产品质量的影响。
1 材料与方法
1.1 材料与试剂
菠萝,市售;乳酸菌和酵母菌,实验室从菠萝果肉中筛选,经鉴定为乳酸乳球菌(Lactococcus lactis LA5)和仙人掌有孢汉逊酵母(Hanseniaspora opuntiae SA2);YPD液体培养基、MRS肉汤培养基、MRS培养基,广东环凯微生物科技有限公司;Folin-Ciocalteu试剂、SOD活性检测试剂盒、没食子酸(标准品),北京索莱宝科技有限公司;乳清蛋白,上海源叶生物有限公司;有机酸标准溶液、甲醇(色谱级),上海阿拉丁生化科技有限公司;NaOH、HCl溶液(均为食品级),诺尔化工有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Evolution 260分光光度计,美国赛默飞世尔科技公司;Spark 10M多功能酶标仪,瑞士帝肯公司;ZQZY-78BV振荡培养箱,上海知楚仪器有限公司;恒温恒湿培养箱,上海坤天实验室仪器有限公司;HH-1数显恒温水浴锅,常州澳华仪器有限公司;压力蒸汽灭菌器,上海三申医疗器械有限公司;1260高效液相色谱仪,美国安捷伦科技公司。
1.3 实验方法
1.3.1 工艺流程
选取新鲜菠萝→榨汁→收集菠萝加工副产物→添加蛋白→调节pH→65 ℃水浴15 min→加入酵母菌与乳酸菌→发酵→得发酵液→冷冻干燥48 h→菠萝加工副产物发酵产品
1.3.2 发酵菌种子液的制备
将乳酸菌与酵母菌分别接入MRS与YPD液体培养基中。应用MRS和YPD液体培养基对乳酸菌和酵母菌进行活化复壮,然后培养14 h作为种子液。
1.3.3 菠萝预处理
将采购的新鲜菠萝去皮后榨汁,对榨汁后的残渣即菠萝加工副产物进行收集。按一定的质量比例加入蒸馏水,与菠萝加工副产物进行搅拌混合成果浆后,添加乳清蛋白,用1 mol/L NaOH溶液与1 mol/L HCl溶液调节pH,之后置于65 ℃热水中水浴灭菌15 min。冷却后在无菌条件下接种活化后的乳酸菌与酵母菌,置于培养箱内暗处静置发酵。发酵结束后收集发酵液,冷冻干燥48 h后得到菠萝加工副产物-乳清蛋白发酵产品。
1.3.4 发酵配方与发酵工艺优化单因素试验设计
研究不同梯度的菠萝加工副产物添加量(30%、40%、50%、60%和70%)、乳清蛋白添加量(1.0%、1.4%、1.8%、2.2%和2.6%)、初始pH(3.0、3.5、4.5、5和5.5)对发酵产品的SOD酶活力与总酚含量的影响,进而对发酵配方进行优化。同时研究不同梯度的发酵时间(12、18、24、30和36 h)、发酵温度(5、30、35、40和45 ℃)、乳酸菌接种量(1.0%、1.5%、2.0%、2.5%和3.0%)、发酵菌种接种比例(7∶1、6∶1、5∶1、4∶1和3∶1)对发酵产品中总酚含量与SOD酶活力的影响,对发酵工艺进行优化。单因素变化时,其他发酵参数固定,菠萝加工副产物添加量设为50%,乳清蛋白添加量设为1.8%,乳酸菌与酵母菌的接种比例设为5∶1,乳酸菌的接种量设为2%(体积分数),发酵初始pH设为4.5,发酵时间设为24 h。
1.3.5 指标测定
SOD酶活力的测定参照试剂盒说明书的步骤进行;总酚含量的测定参照夏国灯等[14]的方法略作修改,结果以每克样品中所含的没食子酸的量(gallic acid equivalent, GAE)表示(mg GAE/g);有机酸的测定采用液相色谱法[15],通过高效液相色谱系统与紫外检测器进行测定,有机酸的含量以mg/g表示。
1.3.6 发酵配方正交优化实验
根据单因素试验筛选出最佳菠萝副产物添加量、乳清蛋白添加量、初始pH值,设计三因素三水平的L9(33)正交试验,根据总酚含量进一步确定菠萝加工副产物发酵的最优配方。正交试验各因素水平如表1所示。
表1 正交试验设计表
Table 1 The design of orthogonal experiments
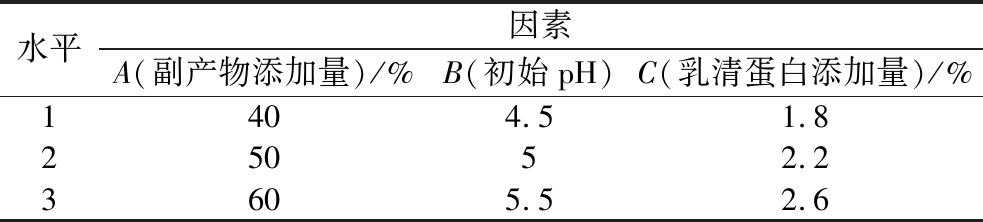
水平因素A(副产物添加量)/%B(初始pH)C(乳清蛋白添加量)/%1404.51.825052.23605.52.6
1.3.7 发酵工艺响应面优化
根据单因素试验结果,对菠萝加工副产物发酵温度、发酵时间、乳酸菌接种量以及发酵菌接种比例4个因素进行四因素三水平Box-Benhnken Design试验,以发酵产品中的SOD活力为响应值,以得到菠萝加工副产物最优发酵工艺。响应面实验各因素水平如表2所示。
表2 Box-Behnken实验因素和水平设计
Table 2 Experiment design for factors and levels of Box-Behnken

水平因素A(发酵时间)/hB(发酵温度)/℃C(乳酸菌接种量)/%D(发酵菌接种比例)-1183015∶1024351.56∶11304027∶1
1.4 数据处理
每次实验均进行3次重复操作,实验数据处理、统计分析和图表绘制采用Excel、Design-Expert11、SPSS 23和Origin软件。
2 结果与分析
2.1 单因素试验结果
菠萝加工副产物的添加量、乳清蛋白添加量、初始pH、发酵时间、发酵温度、乳酸菌接种量、接种比例对发酵产品SOD活性与总酚含量的影响如图1所示。结果表明,随着菠萝加工副产物添加量的增加,总酚含量与SOD活性随之增加,当菠萝加工副产物添加量为50%时,总酚含量达到最大值,为0.55 mg GAE/g,SOD活力也达到峰值,为149.84 U/g。当继续增大菠萝加工副产物添加量时,总酚与SOD活性则下降,这可能是由于随着菠萝加工副产物的增加,发酵培养基中糖含量增加,对微生物生长具有抑制作用[16]。

a-菠萝加工副产物添加量;b-乳清蛋白添加量;c-初始pH;d-发酵时间;e-发酵温度;f-乳酸菌接种量;g-乳酸菌∶酵母菌
图1 各因素对发酵产物中总酚含量及SOD活力的影响
Fig.1 Effects of different factors on total phenol content and SOD activity of fermentation products
注:在同一图中,不同小写字母表示差异显著(P<0.05)(下同)。
随着乳清蛋白添加量的增加,发酵体系中的SOD活性与总酚含量呈上升的趋势。当乳清蛋白添加量为2.2%与2.6%时,发酵产品中总酚与SOD活力无显著性差异。乳清蛋白添加量为2.6%时,SOD活性(155.80 U/g)和总酚含量(0.69 mg GAE/mL)达到峰值。综合考虑,选择乳清蛋白添加量1.8%~2.6%进行下一步的正交试验。
如图1-c所示,随着初始pH值的增大,SOD活性与总酚含量呈先上升后下降的趋势,当初始pH为5时,发酵体系中的SOD活力与总酚含量均达到最大值。当初始pH为5.5时,随着初始pH的增大,SOD活性与总酚含量呈下降的趋势。这可能是由于高的pH值抑制了乳酸菌与酵母菌的生长代谢,导致活性物质的产量降低。
如图1-d所示,随着发酵时间的延长发酵液的总酚含量与SOD活力呈现出先增加后减少的趋势,当发酵时间为24 h时,SOD活力与总酚含量达到最大值。当发酵时间大于24 h,总酚含量与SOD活性呈下降趋势,这可能是由于发酵基质的微生物数量增加导致的。
发酵温度对发酵产物总酚含量及SOD活力的影响如图1-e所示。随着发酵温度的增加,总酚含量与SOD活力呈先上升后下降的趋势,当发酵温度达到35 ℃时,SOD活力达到最大值为155.39 U/g,总酚含量同样达到最大值为0.71 mg GAE/g。当发酵温度过高时,SOD活力与总酚含量减少,这可能由于过高的发酵温度抑制了乳酸菌与酵母菌的生长。
乳酸菌接种量对发酵产物SOD活力与总酚含量的影响如图1-f所示。随着乳酸菌接种量的增加,SOD活力与总酚含量呈先上升后下降的趋势,当乳酸菌接种量为1.5%时,SOD活力达到最大值为154.74 U/g,总酚含量达到最大值为0.67 mg GAE/g,然而随着乳酸菌接种量的增加两者均呈下降的趋势。这可能是由于接种量过大导致发酵产物减少。
发酵菌接种比例对发酵液SOD活力与总酚含量的影响如图1-g所示。随着乳酸菌接种比例的增大,发酵产品中SOD活力与总酚含量呈现先增加后减少的趋势,当乳酸菌∶酵母菌为6∶1时,SOD活力与总酚含量达到最大值。当继续增大乳酸菌接种比例时,SOD活力与总酚含量呈现下降的趋势,这可能是由于当接种比例不适宜时,混合菌种间相互竞争生长空间与养分,继而导致微生物生长不佳,使次级代谢产物减少。
2.2 正交试验设计及结果
根据单因素试验结果设计正交试验,在不同发酵配方下测定各组发酵产品的总酚含量,结果如表3所示。
表3 正交试验结果
Table 3 Results of orthogonal experiments

编号A(副产物添加量)/%B(初始pH)C(乳清蛋白添加量)/%总酚含量/(mg GAE/g)11110.531 3 21230.607 1 31320.701 2 42120.665 9 52210.569 8 62330.532 0 73130.562 3 83220.671 6 93310.786 6 K11.839 6 1.759 5 1.887 7 K21.767 7 1.848 5 2.038 7 K32.020 5 2.019 8 1.701 4 k10.613 2 0.586 5 0.629 2 k20.589 2 0.616 2 0.679 6 k30.673 5 0.673 3 0.567 1 R0.084 3 0.086 8 0.112 5
由极差R可知,各因素对混菌发酵菠萝加工副产物中总酚含量的影响顺序为乳清蛋白添加量(C)>初始pH(B)>加工副产物添加量(A)。根据k1、k2、k3可知,最优发酵配方水平组合为A3B3C2,其总酚含量如表4所示,较优化前提高了2.5倍,三者间存在显著性差异,可确定最优发酵配方为:菠萝加工副产物添加量60%、乳清蛋白添加量2.6%、初始pH 5.0。
表4 正交试验的验证
Table 4 Verification of orthogonal experiments
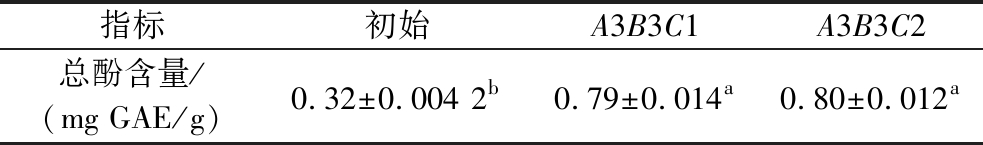
注:数据为均值±标准差;在同一行中,肩标字母不同表示差异显著(P<0.05)(表7同)。
指标初始A3B3C1A3B3C2总酚含量/(mg GAE/g)0.32±0.004 2b0.79±0.014a0.80±0.012a
2.3 响应面实验结果
2.3.1 响应面实验设计与结果
根据单因素结果,进行响应面分析。响应面二次多项式回归方程的方差分析结果如表5所示。可得该模型的F=17.35,P<0.000 1,表明该模型极显著;回归系数R2=0.945 5,表明该模型能较好地对实验的真实情况进行拟合,自变量与响应值之间的关系显著,表明该模型可以用来分析与预测菠萝加工副产物的最佳发酵工艺。由4个因素的F值可得出,各因素对菠萝加工副产物发酵产品中SOD活力的影响程度为:B(发酵温度)>A(发酵时间)>C(乳酸菌接种量)>D(发酵菌接种比例)。
表5 回归模型方差分析
Table 5 Analysis of variance of regression model

方差来源平方和自由度均方F值P值显著性Model1 367.951497.7117.35<0.000 1∗∗A(发酵时间)133.131133.1323.630.000 3∗∗B(发酵温度)629.421629.42111.74<0.000 1∗∗C(乳酸菌接种量)52.70152.709.360.008 5∗∗D(发酵菌接种比例)8.7418.741.550.233 3AB0.987 010.98700.175 20.681 9AC0.003 510.00350.000 60.980 4AD38.28138.286.800.020 7∗BC9.8419.841.750.207 4BD0.996 010.996 00.176 80.680 5CD1.4411.440.255 60.621 0A2219.701219.7039.00<0.000 1∗∗B2302.411302.4153.69<0.000 1∗∗C260.94160.9410.820.005 4∗∗D2141.431141.4325.110.000 2∗∗残差78.86145.63失拟项65.81106.582.020.260 5纯误差13.0643.26总离差1 446.8228
2.3.2 响应面交互分析
根据响应面实验设计原理,三维曲面弯曲程度越大,表明两因素交互作用对响应值即SOD活力的影响越显著。响应面实验等高线图为三维曲线在底部的投影,可以反映出因素之间交互相的强弱,为椭圆则表明两因素之间交互作用显著,呈圆形则与之相反,结果如图2所示。

图2 各因素交互作用对发酵产品中SOD酶活力影响的响应面图
Fig.2 Response surface diagram of interaction of various factors on SOD activity in fermented products
采用Design-Expert软件,根据所建立的模型进行参数最优化分析,得到最佳的发酵工艺为发酵时间25.83 h,发酵温度37.45 ℃,乳酸菌接种量1.6%,发酵菌接种比例为乳酸菌∶酵母菌=6.15∶1,在此条件下发酵产物的SOD活力为168.17 U/g。为了验证实验结果以便于实际操作,调整发酵工艺为发酵时间26 h,发酵温度37.5 ℃,乳酸菌接种量1.6%,发酵菌接种比例为乳酸菌∶酵母菌=6.2∶1。在此条件下,发酵产物的SOD活力为168.03 U/g,与理论值差异不显著(P>0.05),表明可利用该模型对菠萝加工副产物的发酵工艺条件进行优化,具有实际价值。
2.4 发酵产品的理化指标
SOD与总酚是果蔬发酵产品中主要的活性物质。采用最优发酵工艺混菌发酵菠萝加工副产物-乳清蛋白,将所得发酵产物与其他果蔬发酵产品进行了比较,如表6所示。菠萝加工副产物-乳清蛋白发酵产品的SOD活力高于发酵菠萝浆与香蕉酵素,较未发酵菠萝提高1.95倍,但低于蓝莓枸杞发酵果汁与蓝靛果-沙棘发酵果汁;其总酚含量高于发酵菠萝浆与苹果梨酵素,较未发酵菠萝提高了2.53倍,但低于草莓酵素、青梅酵素等发酵产品。这可能是由于选取的原料、发酵菌种以及处理方式的不同造成的。
表6 菠萝加工副产物-乳清蛋白发酵产品与其他果蔬发酵类发酵产品的比较分析
Table 6 Comparative analysis of pineapple waste and whey protein fermentation products and other fruit and vegetable fermentation products
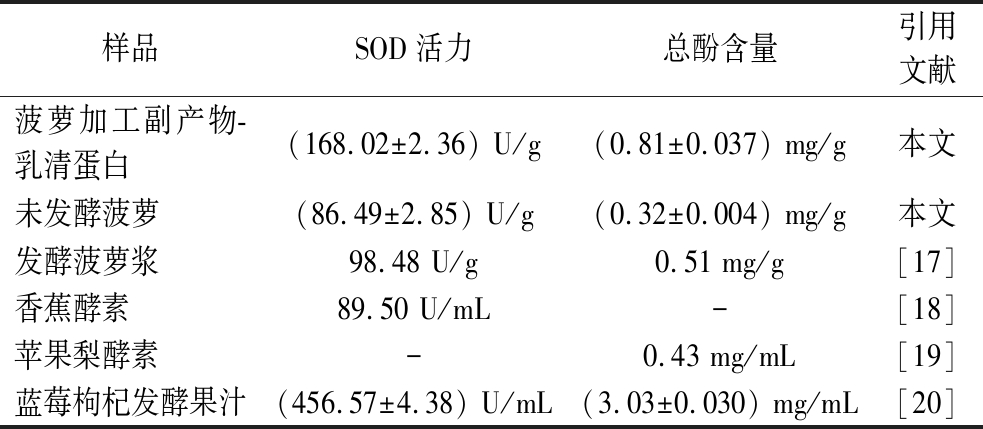
注:表中“-”表示文献中未对该物质进行检测。
样品SOD活力总酚含量引用文献菠萝加工副产物-乳清蛋白(168.02±2.36) U/g(0.81±0.037) mg/g本文未发酵菠萝(86.49±2.85) U/g(0.32±0.004) mg/g本文发酵菠萝浆98.48 U/g0.51 mg/g[17]香蕉酵素89.50 U/mL-[18]苹果梨酵素-0.43 mg/mL[19]蓝莓枸杞发酵果汁(456.57±4.38) U/mL(3.03±0.030) mg/mL[20]
有机酸是发酵产品的主要风味属性来源,其组成和含量是影响发酵产品酸味的重要因素。由于有机酸具有降低肠道pH值和改善肠道菌群的作用,其在世界范围内被广泛应用。表7显示了菠萝加工副产物发酵前后7种主要有机酸的变化。与发酵前相比,苹果酸含量下降了63.49%,这与MENDES 等[21]的研究结果一致,可能是由于苹果酸在发酵过程中容易被大多数微生物利用引起的;柠檬酸含量从2.91 mg/g下降到2.07 mg/g,可能是由于乳酸菌将柠檬酸作为底物,经过三羧酸循环代谢产生乳酸、双乙酰或其他物质而引起的[22]。与发酵前相比,总酸、乳酸、琥珀酸、酒石酸和草酸的含量显著增加,这与萝卜腌制前后有机酸的变化趋势一致[23]。如表7所示,乳酸(4.28 mg/g)和琥珀酸(3.51 mg/g)是发酵产物中的主要有机酸。乳酸通常是由于乳酸菌在发酵过程中产生的[24],而琥珀酸是酵母发酵过程中产生的一种重要代谢产物[25]。
表7 菠萝加工副产物-乳清蛋白发酵前后有机酸含量的变化
Table 7 Changes in organic acid content before and after fermentation of pineapple processing wastes-lactalbumin
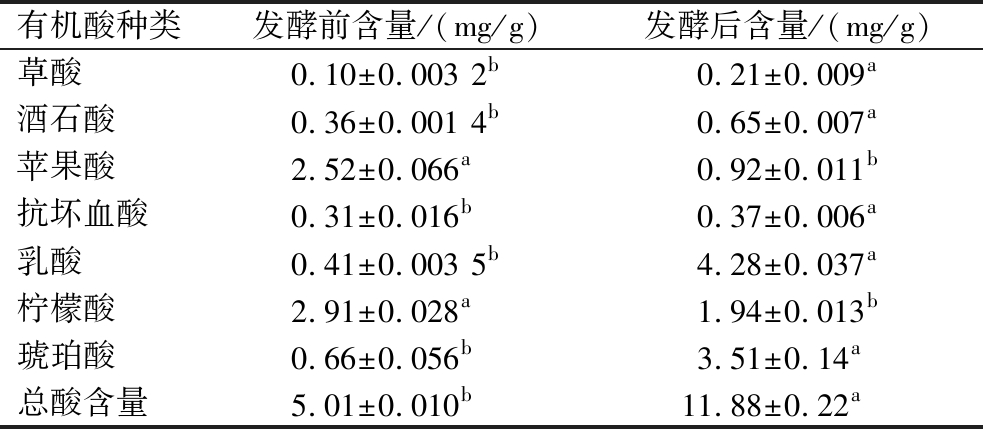
有机酸种类发酵前含量/(mg/g)发酵后含量/(mg/g)草酸0.10±0.003 2b0.21±0.009a酒石酸0.36±0.001 4b0.65±0.007a苹果酸2.52±0.066a0.92±0.011b抗坏血酸0.31±0.016b0.37±0.006a乳酸0.41±0.003 5b4.28±0.037a柠檬酸2.91±0.028a1.94±0.013b琥珀酸0.66±0.056b3.51±0.14a总酸含量5.01±0.010b11.88±0.22a
3 结论
本实验利用从新鲜菠萝中筛选的乳酸菌与酵母菌发酵添加了乳清蛋白的菠萝加工副产物,对其发酵配方与发酵工艺进行优化。得到的最佳发酵条件为:菠萝加工副产物添加量为60%,乳清蛋白添加量为2.6%,初始pH为5.0,发酵时间26 h,发酵温度37.5 ℃,乳酸菌添加量1.6%、发酵菌接种比例为乳酸菌∶酵母菌=6.2∶1。在此发酵条件下发酵产品中总酚含量为0.81 mg GAE/g,较未发酵前提高了2.53倍;发酵产品中SOD活力为168.02 U/g,较未发酵前提高了1.95倍;总酸、酒石酸、乳酸、琥珀酸含量较发酵前均显著提高。本研究为提高菠萝加工副产物的利用率提供了一定的数据参考。
[1] 刘玉琦, 邢艺煊, 贾静莹, 等.菠萝山药复合酸奶的研制[J].中国果菜, 2021, 41(12):17-21.
LIU Y Q, XING Y X, JIA J Y, et al.Development of pineapple and Chinese yam compound yogurt[J].China Fruit &Vegetable, 2021, 41(12):17-21.
[2] 杨剑铖, 张德生.我国菠萝生产与贸易分析[J].广西热带农业, 2010(4):45-47.
YANG J C, ZHANG D S.Analysis of pineapple production and trade in China[J].Guangxi Tropical Agriculture, 2010(4):45-47.
[3] SANTOS D I, MARTINS C F, AMARAL R A, et al.Pineapple (Ananas comosus L.) by-products valorization:Novel bio ingredients for functional foods[J].Molecules, 2021, 26(11):3216.
[4] 刘显茜, 邹三全, 徐梽宇, 等.菠萝皮渣热风对流干燥工艺研究[J].食品与发酵科技, 2020, 56(1):39-43;53.
LIU X X, ZOU S Q, XU Z Y, et al.Study on hot air convection drying process of pineapple peel dregs[J].Food and Fermentation Sciences &Technology, 2020, 56(1):39-43;53.
[5] 胡会刚, 赵巧丽.菠萝皮渣多酚的提取分离及其抗氧化活性评价[J].食品科技, 2020, 45(1):286-293.
HU H G, ZHAO Q L.Extraction, separation and antioxidant activities of polyphenols from pineapple pomace[J].Food Science and Technology, 2020, 45(1):286-293.
[6] 秦紫琼, 杭瑜瑜, 裴志胜, 等.菠萝皮渣多糖的酶法制备及体外抗氧化活性研究[J].农产品加工, 2018(16):10-13.
QIN Z Q, HANG Y Y, PEI Z S, et al.Extraction of polysaccharides from pineapple peels by enzymatic method and its antioxidant activity[J].Farm Products Processing, 2018(16):10-13.
[7] PORNPUNYAPAT J, CHOTIGEAT W, CHETPATTANANONDH P.Bioethanol production from pineapple peel juice using Saccharomyces cerevisiae[J].Advanced Materials Research, 2014(875-877):242-245.
[8] 顾采琴, 陈婉玲, 郑志茂, 等.菠萝皮渣半固态法酿醋工艺[J].食品科学, 2010, 31(16):56-60.
GU C Q, CHEN W L, ZHENG Z M, et al.Vinegar production from pineapple waste by semi-solid state fermentation[J].Food Science, 2010, 31(16):56-60.
[9] 刘娜. 乳酸菌与酵母菌协同发酵米酸特征风味形成机理研究[D].贵阳:贵州大学, 2021.
LIU N.Study on the formation mechanism of characteristic flavor of rice acid fermented by lactic acid bacteria and yeast[D].Guiyang:Guizhou University, 2021.
[10] 赖婷, 刘汉伟, 张名位, 等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展[J].中国酿造, 2015, 34(3):1-4.
LAI T, LIU H W, ZHANG M W, et al.Effect of lactic acid bacteria fermentation on active components and physiological function of fruit and vegetable[J].China Brewing, 2015, 34(3):1-4.
[11] 张丽. 龙葵果高压微射流与混菌发酵工艺优化及生物活性研究[D].北京:北京林业大学, 2020.
ZHANG L.Study on optimization of high-pressure microfluidization and mixed fermentation processes and biological activity of Solanum nigrum L.[D].Beijing:Beijing Forestry University, 2020.
[12] ALVAREZ-MARTIN P, FLOREZ A B, HERN NDEZ-BARRANCO A, et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J].Food Control, 2008, 19(1):62-70.
NDEZ-BARRANCO A, et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J].Food Control, 2008, 19(1):62-70.
[13] 李达, 周洋, 牛春华.乳清蛋白的功能成分及其保健功能[J].农产食品科技, 2012(2):57-60.
LI D, ZHOU Y, NIU C Y.The functional ingredients and health functions of whey protein[J].Jiangxi Food Industry, 2012, 6(2):57-60.
[14] 夏国灯, 严成, 李林柯, 等.采用Box-Behnken设计优化玫瑰花酵素发酵工艺及其抗氧化活性的测定[J].食品工业科技, 2021, 42(13):193-201.
XIA G D, YAN C, LI L K, et al.Fermentation technology optimization of rose flower enzyme using box-behnken design and its antioxidant activity determination[J].Science and Technology of Food Industry, 2021, 42(13):193-201.
[15] SARKAR T, SALAUDDIN M, HAZRA S K, et al.The impact of raw and differently dried pineapple (Ananas comosus) fortification on the vitamins, organic acid and carotene profile of dairy rasgulla (sweetened cheese ball)[J].Heliyon, 2020, 6(10):e05233.
[16] 陈秀秀, 孙洪浩, 孙小涵, 等.1株优良酿酒酵母的分离鉴定及特性分析[J].现代畜牧兽医, 2022(4):32-37.
CHEN X X, SUN H H, SUN X H, et al.Isolation, identification and stress resistance of superior Saccharomyces cerevisiae[J].Modern Journal of Animal Husbandry and Veterinary Medicine, 2022(4):32-37.
[17] 李依娜, 邹颖, 余元善, 等.不同乳酸菌发酵对菠萝浆品质的影响[J].中国酿造, 2021, 40(2):111-116.
LI Y N, ZOU Y, YU Y S, et al.Effect of different lactic acid bacteria fermentation on the quality of pineapple pulp[J].China Brewing, 2021, 40(2):111-116.
[18] 阙斐, 黄涵年, 赵粼.香蕉酵素发酵过程中的组分及抗氧化活性变化研究[J].食品工业科技, 2019, 40(16):290-293;303.
QUE F, HUANG H N, ZHAO L.Change of components and antioxidant activity of banana enzymes during fermentation process[J].Science and Technology of Food Industry, 2019, 40(16):290-293;303.
[19] 范昊安, 沙如意, 方晟, 等.苹果梨酵素发酵过程中的褐变与抗氧化活性[J].食品科学, 2020, 41(14):116-123.
FAN H A, SHA R Y, FANG S, et al.Browning and antioxidant activity of apple-pear jiaosu during fermentation[J].Food Science, 2020, 41(14):116-123.
[20] 姜瑞. 蓝莓枸杞发酵果汁的研制及其功能性评价[D].哈尔滨:东北农业大学, 2021.
JIANG R.Development and functional evaluation of blueberry and wolfberry fermented fruit juice[D].Harbin:Northeast Agricultural University, 2021.
[21] MENDES FERREIRA A, MENDES-FAIA A.The role of yeasts and lactic acid bacteria on the metabolism of organic acids during winemaking[J].Foods, 2020, 9(9):1231.
[22] GARC A-QUINT
A-QUINT NS N, REPIZO G, MART
NS N, REPIZO G, MART N M, et al.Activation of the diacetyl/acetoin pathway in Lactococcus lactis subsp.lactis bv.diacetylactis CRL264 by acidic growth[J].Applied and Environmental Microbiology, 2008, 74(7):1988-1996.
N M, et al.Activation of the diacetyl/acetoin pathway in Lactococcus lactis subsp.lactis bv.diacetylactis CRL264 by acidic growth[J].Applied and Environmental Microbiology, 2008, 74(7):1988-1996.
[23] CHEN A J, LUO W, PENG Y T, et al.Quality and microbial flora changes of radish Paocai during multiple fermentation rounds[J].Food Control, 2019, 106:106733.
[24] BUJNA E, FARKAS N A, TRAN A M, et al.Lactic acid fermentation of apricot juice by mono- and mixed cultures of probiotic Lactobacillus and Bifidobacterium strains[J].Food Science and Biotechnology, 2018, 27(2):547-554.
[25] JIANG M, WANG Q N, CHEN K Q, et al.Research on the production of succinic acid by anaerobic fermentation with yeast zymolysis solution as organic nitrogen source[J].Food Science and Technology, 2007, 32(10):238-242.