阿胶是马科动物驴(Equus asinus L.)的皮通过煎煮加工后浓缩制成的固体胶[1],主要成分为蛋白质、氨基酸、微量元素、多糖、硫酸软骨素以及透明质酸等[2]。蛋白质是阿胶的主要生物活性物质,其口服后经胃肠道消化、降解为小肽,发挥对血液的滋补与机体调节作用[3]。微量元素铁是红细胞合成血红素必不可少的成分[4],人体缺铁会造成血红素合成减少从而发生缺铁性贫血(iron-deficiency anemia, IDA),同时引起体内含铁酶活性降低,影响能量代谢,引起精神不振、疲倦[5]。全球疾病负担研究显示IDA是2013年全球健康寿命减损的前5位病因,铁的缺乏已经成为一个世界性的营养问题。补铁剂前后经历四代发展,第一代为以FeSO4为代表的无机亚铁盐补铁剂,第二代为以乳酸亚铁为代表的有机酸盐补铁剂,第三代以甘氨酸亚铁为代表,目前以多肽铁为代表的第四代补铁剂因稳定性好、生物利用率高、成本低廉已被广泛应用[6-8]。前期研究表明,阿胶肽铁螯合物(Ejiao peptide-iron chelate,EPI)可以通过提高铁的生物利用度,改善膳食缺铁小鼠贫血症状,是阿胶补血的功效成分[9-10]。微胶囊化技术是用天然或者合成的高分子成膜材料作为壁材,把分散的固态物质、液体甚至气体作为芯材完全包埋起来,形成具有密封或半透性囊膜的微型颗粒的技术[11-12]。为了提高稳定性、增强缓释作用以及遮蔽不良风味(铁锈味),本文对EPI进行微胶囊化包埋。通过对EPI微胶囊制备工艺优化,并对制得的微胶囊进行理化性质表征、稳定性分析及肠道缓释行为分析,为新型阿胶补血产品的开发提供科学依据,为新型补铁剂的开发提供新思路。
1 材料与方法
1.1 材料与试剂
阿胶粉,山东东阿阿胶股份有限公司;102型果胶、D-150型大豆分离蛋白(soy protein isolate,SPI),苏州赛迈尔生物科技有限公司。
无水乙醇、FeSO4·7H2O、NaOH、浓盐酸、Na2CO3、CuSO4·5H2O、四水合酒石酸钾钠、抗坏血酸、1,10-邻菲啰啉、一水合乙酸钠、三水合乙酸钠、冰醋酸、一水合柠檬酸、KH2PO4,均为分析纯,国药集团化学试剂有限公司;碱性蛋白酶(≥200 U/mg),北京索莱宝科技有限公司;木瓜蛋白酶(BR,800 U/mg)、胃蛋白酶(猪胃黏膜,USP级,1∶30 000)、胰蛋白酶(猪胰,BR,1∶250),上海源叶生物科技有限公司。
1.2 仪器与设备
Centrifuge 5804R台式冷冻离心机、Centrifuge 5430R台式高速冷冻离心机,德国Eppendorf公司;HH-3A恒温水浴锅,常州国华电器有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物股份有限公司;纳米粒度及Zeta电位仪,英国马尔文公司;冷场发射扫描电子显微镜,日本株式会社日立高新技术公司;AR224CN电子天平,奥豪斯仪器有限公司;THZ-C-L台式冷冻恒温振荡器,金坛荣华公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;XH-C旋涡混合器,无锡沃信仪器制造有限公司;AMM系列多点磁力搅拌器9T(加热),天津奥特赛恩斯仪器有限公司;XH-800B智能温压双控微波消解仪,北京祥鹄科技发展有限公司产品。
1.3 实验方法
1.3.1 EPI的制备
根据实验室前期研究所建立的方法制备EPI[9-10]。以阿胶为原料,采用胃蛋白酶和胰蛋白酶对阿胶进行酶解,按一定质量比与膳食铁溶液混合,37 ℃恒温振荡酶解120 min。采用固定化金属亲和层析方法分离铁螯合肽,向溶液中加入FeSO4溶液37 ℃振荡30 min,同时加入抗坏血酸防止Fe2+氧化,螯合完毕经冷冻干燥得EPI。
1.3.2 EPI微胶囊的制备
选用大豆分离蛋白与果胶制备EPI微胶囊,根据MENDANHA等[13]、李颖杰等[14]的方法稍作改动,制备流程如下:
EPI→大豆油-螯合物乳液(油∶螯合物=3∶1)→加大豆分离蛋白溶液(pH 8.0)→均质得到O/W乳液→加果胶溶液→磁力搅拌→预冷(-20 ℃,36 h)→冷冻干燥(-65 ℃,24 h)→EPI微胶囊粉末
1.3.3 EPI微胶囊制备单因素试验
以包埋率为指标,考察壁芯质量比、大豆分离蛋白与果胶质量比、包埋时间对EPI微胶囊工艺的影响,确定最佳微胶囊制备工艺参数。
壁芯比对微胶囊工艺的影响:取0.2 g EPI粉末,加入0.6 g大豆油,二档均质5 min。设计壁芯质量比为3∶1、2∶1、1∶1、1∶2、1∶3,保持壁材中m(SPI)∶m(果胶)=5∶5。向大豆油-螯合物乳液体系中分别加入质量分数为10%的SPI溶液12.0、8.0、4.0、2.0、1.3 g,采用二档均质10 min后得到O/W乳液,转移至磁力搅拌器,分别加入质量分数为10%的果胶溶液12.0、8.0、4.0、2.0、1.3 g,以900 r/min搅拌20 min。将所得产物进行冷冻干燥,测定包埋率。
m(SPI)∶m(果胶)对微胶囊工艺的影响:取0.2 g EPI粉末,加入0.6 g大豆油,二档均质5 min。设计壁材中m(SPI)∶m(果胶)为3∶7、4∶6、5∶5、6∶4、7∶3,保持壁芯质量比为2∶1。向大豆油-螯合物乳液体系中分别加入质量分数为10%的SPI溶液4.8、6.4、8.0、9.6、11.0 g,采用二档均质10 min后得到O/W乳液,转移至磁力搅拌器,分别加入质量分数为10%的果胶溶液11.2、9.6、8.0、6.4、4.8 g,以900 r/min的转速包埋20 min。将所得产物进行冷冻干燥,测定包埋率。
包埋时间对微胶囊工艺的影响:取0.2 g EPI粉末,加入0.6 g大豆油,二档均质5 min。保持壁芯质量比为2∶1,壁材中m(SPI)∶m(果胶)为5∶5。向大豆油-螯合物乳液体系中分别加入8.0 g质量分数为10%的SPI溶液,采用二档均质10 min后得到O/W乳液,转移至磁力搅拌器,分别加入8.0 g质量分数为10%的果胶溶液,以900 r/min的转速分别搅拌10、20、30、40、50 min。将所得产物进行冷冻干燥,测定包埋率。
1.3.4 EPI微胶囊制备正交试验
根据EPI微胶囊单因素试验结果,考虑适应生产需求,以壁芯质量比、SPI与果胶质量比例、包埋时间为考察因素(表1),并考虑交互作用,以包埋率作为参考指标设计三因素三水平正交表L27(313),探究最佳微胶囊化配方。
表1 EPI微胶囊的正交试验因素水平
Table 1 Orthogonal design of microencapsulation of EPI
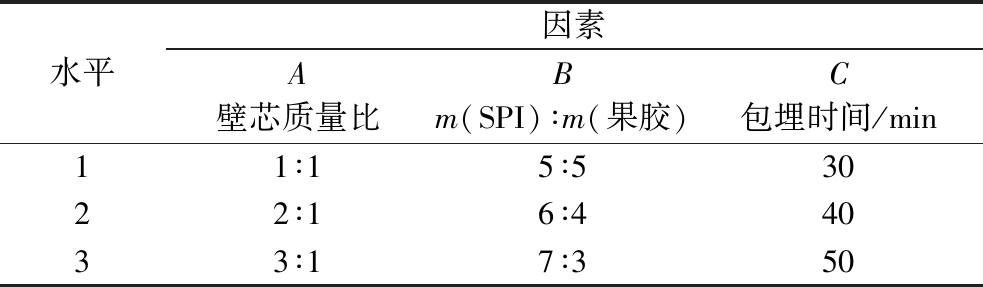
水平因素A壁芯质量比Bm(SPI)∶m(果胶)C包埋时间/min11∶15∶53022∶16∶44033∶17∶350
1.3.5 EPI微胶囊的理化性质表征
1.3.5.1 包埋率的测定与计算
以Fe2+的含量为指标,按公式(1)计算包埋率。
(1)
式中:X,包埋率;x1,1.0 mg EPI总铁质量,μg;x2,1.0 mg EPI微胶囊中铁质量,μg。
铁含量测定:取适量样品与5 mL浓HNO3混合,按照表2的消解程序参数进行消解,将消解后的溶液用10%(体积分数)稀HNO3溶液定容,并根据Fe2+含量稀释至合适浓度,采用原子吸收法测定样品中的铁含量[15]。
表2 样品微波消解参数
Table 2 Microwave digestion parameters of samples
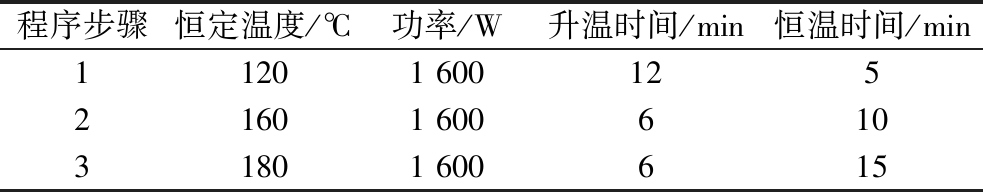
程序步骤恒定温度/℃功率/W升温时间/min恒温时间/min11201 60012521601 60061031801 600615
1.3.5.2 EPI与微胶囊的形态与显微结构对比
实物形态对比:取在阴凉、密闭条件下储存的EPI和微胶囊,拍照进行形态对比分析。
粒径对比:参考李颖杰等[14]的方法,使用激光粒度仪分别测定螯合物与微胶囊的粒径分布。
显微结构对比:采用冷场发射扫描电子显微镜(field emission scanning electron microscopy,FESEM)扫描,分别放大1 000倍、5 000倍对比观察螯合物与微胶囊的结构。
1.3.6 EPI微胶囊的稳定性分析
消化稳定性的测定方法参考王俊强[16]与胡乔迁[17]的方法并加以改动,具体方法如下。
分别制备2.0 mg/mL EPI溶液和EPI微胶囊分散体,各取5.0 mL置于50 mL离心管,37 ℃预热10 min后加入5.0 mL模拟胃液,模拟胃液、肠液的配制参考《中华人民共和国药典》[18],振荡混匀后置于37 ℃水浴锅避光保温2 h,于消化开始0、15、30、60、90、120 min时分别取1.0 mL反应液,采用邻菲罗啉比色法立即对所取样品进行Fe2+含量测定。
在上述胃消化2 h后剩余的4.0 mL体系中,加入2.0 mL模拟肠液,振荡混匀后置于37 ℃水浴锅避光保温3 h,每隔30 min分别取0.5 mL反应液,采用邻菲罗啉比色法立即对所取样品Fe2+含量进行测定。
热稳定性分析:称取一定质量的EPI加入适量去离子水溶解,分别置于20、30、40、50、60、70和80 ℃水浴2 h,采用邻菲罗啉法测量不同温度条件下EPI的铁螯合率。
1.3.7 肠道缓释行为测定
购买SPF级C57BL/6 J小鼠50只,40只饲喂低铁饲料建立IDA小鼠模型,10只饲喂正常饲料,从第2周开始,每周定期对小鼠进行尾静脉采血,测定正常组和模型组小鼠血液中血红蛋白(hemoglobin,HGB)含量,直至小鼠HGB 含量低于标准浓度(90 g/L)即造模成功。收集小鼠各个时段的粪便,并进行铁含量测定,将小鼠粪便冷冻干燥后分别取50~100 mg转移到聚四氟乙烯消解罐中,加入5 mL浓HNO3按照表2的消解程序进行微波消解,得到澄清溶液,转移消解液超纯水定容至25 mL,用原子吸收分光光度法测定小鼠粪便中的铁合量。分别对模型组动物以中剂量2.0 mg Fe/kg BW对小鼠灌胃EPI和微胶囊溶液,灌胃后2 h开始,每间隔1 h收集小鼠粪便进行低温冷冻干燥,称量各时段粪便样品质量并测定铁含量。
2 结果与分析
2.1 单因素分析
2.1.1 壁芯比对包埋率的影响
壁材与芯材的比例是决定芯材包埋率的一个重要因素。本实验中的壁材为SPI和果胶,芯材为EPI和大豆油。SPI具有较高的电荷性和较多的亲水、疏水基团,在体系中具有强乳化性,能较好地起到稳定芯材的作用[19];果胶具有较高的稳定性、胶凝性,可以作为乳化稳定剂稳定水油乳浊液[20]。如图1-a所示,随着壁芯比的逐渐增大,芯材的包埋率先增加后减小。当壁芯质量比为1∶3和1∶2时,芯材的包埋率较低,此时体系中的SPI与果胶含量过少,难以形成凝胶网络状体系,因此对芯材的包覆能力不足。当壁芯质量比为2∶1时,芯材的包埋率达最大值74.30%。当壁芯比为3∶1时,芯材的包埋率开始出现下降,可能因为此时SPI与果胶过多,造成两者在溶液中凝集,不利于对芯材的包埋。因此,最适宜的壁芯质量比为2∶1。

a-壁芯质量比;b-m(SPI)∶m(果胶);c-包埋时间
图1 各因素对包埋率的影响
Fig.1 Effect of various factors on the embedding rate
注:不同小写字母表示差异显著(P<0.05)。
壁芯比的变化反映了体系中大豆油的含量变化,随着壁芯比的增加,大豆油含量也随之减少。在大豆油含量减少的过程中,包埋率呈现先上升后下降的趋势,在大豆油占乳液总含量1/4时达到最高包埋率。在包埋过程中,大豆分离蛋白可以自发地结合到油-水界面,通过非共价相互作用在油滴周围形成凝胶状膜,可抵抗油滴的聚结,使乳液具有优秀的稳定性[21]。随着大豆油相对含量的适度减少与壁材的增多,降低了在乳化过程中油滴分布不均匀的几率,避免了油滴聚集,形成了更稳定的O/W体系。当大豆油含量过少时,油水比例失衡,包埋率反而下降。
此外,随着大豆油的增加,经冷冻干燥后得到的微胶囊粉末也呈现出表面更湿润的特点,可能是大豆油过多时油-水比例失衡,导致形成的O/W体系不稳定,使部分油滴聚结、外泄,导致包埋率下降的同时,微胶囊的外观也受到了较大的影响,表现出不良感官体验。
2.1.2 SPI与果胶比例对包埋率的影响
如图1-b所示。当m(SPI)∶m(果胶)为3∶7至5∶5之间时,即SPI含量小于果胶时,随着比例的增大,包埋率上升。当m(SPI)∶m(果胶)为5∶5时,芯材包埋率达最大值73.61%。当m(SPI)∶m(果胶)比例继续增大时,即SPI含量大于果胶时,随着比例的增大,包埋率先下降后保持平稳。因为在包埋的体系中,SPI具有强乳化性;而果胶具有较高的稳定性、胶凝性。当SPI含量过高时,果胶含量过低时,体系缺乏稳定性,无法形成足够稳定的凝胶结构将芯材完全包覆,使包埋率下降;当SPI含量过低时,果胶含量过高时,由于果胶过于黏稠,无法使壁材与芯材充分接触,从而影响包埋率。因此,最适宜的SPI与果胶质量比例为5∶5。
2.1.3 包埋时间对包埋率的影响
如图1-c所示,在不改变其他工艺条件时,包埋时间越长,包埋率逐渐升高后降低,在40 min处达到最大值78.72%。当搅拌时间<40 min时,随着搅拌时间的延长,包埋率逐渐增大。充分的搅拌可以促使体系变得均一稳定,让果胶能够更好地包覆在芯材和SPI表面,因此包埋率逐渐增大。当搅拌时间足够充分后,继续搅拌,对包埋率的影响并不明显,故搅拌时间50 min处的包埋率与40 min时未呈现显著性差异(P>0.05)。因此,最适宜的搅拌时间在40 min左右。
2.2 正交试验分析
根据单因素试验结果得到制备EPI微胶囊适宜的壁芯质量比、SPI与果胶的质量比例以及包埋时间。为了进一步考察各因素对EPI微胶囊芯材包埋率影响的主次关系和交互作用,并得到最优的制备工艺条件,以上述指标为3个因素,并选取适当水平,进行正交试验。对实验结果进行极差和方差分析,如表3和表4所示。
表3 正交试验结果和极差分析
Table 3 Orthogonal experimental results and range analysis
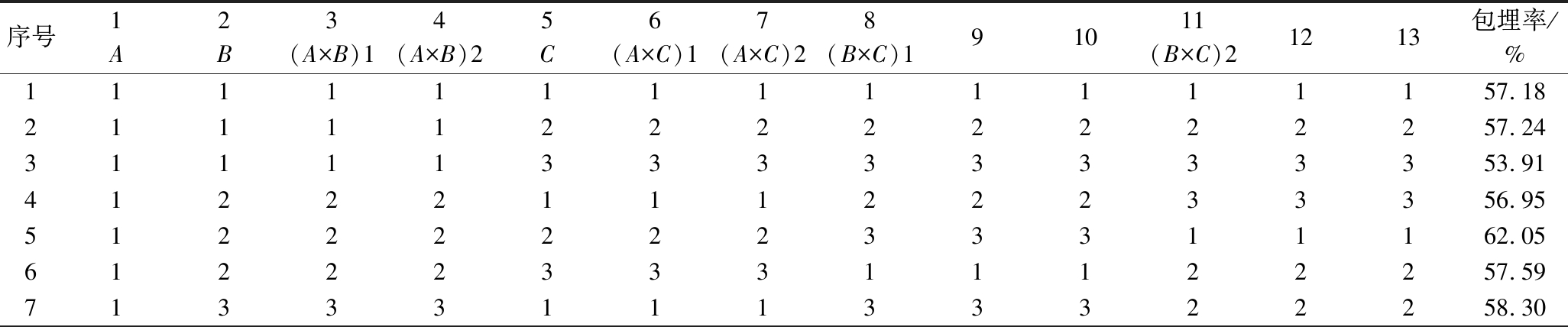
序号1A2B3(A×B)14(A×B)25C6(A×C)17(A×C)28(B×C)191011(B×C)21213包埋率/%1111111111111157.182111122222222257.243111133333333353.914122211122233356.955122222233311162.056122233311122257.597133311133322258.30
续表3

序号1A2B3(A×B)14(A×B)25C6(A×C)17(A×C)28(B×C)191011(B×C)21213包埋率/%8133322211133350.389133333322211162.0610211312312312370.9011212323123123170.4312213331231231271.2513221112323131275.8814222123131212376.9915223131212323174.6716231212331223179.0417232223112331280.1918233231223112376.2619313213213213273.9720313221321321377.8921313232132132173.2022321313221332186.6923321321332113284.7824321332113221383.7525332113232121384.7026332121313232182.4927332132121313277.55K1515.66605.97649.38640.61643.61639.76634.55631.12634.55630.40641.74654.95647.82K2675.61659.36648.94637.14642.43630.00637.20640.95644.70643.74643.62639.66636.74K3725.02650.97617.98638.54630.26646.54644.54644.23637.05642.15630.94621.69631.73k157.3067.3372.1571.1871.5171.0870.5170.1270.5170.0471.3071.4071.98k275.0773.2672.1070.7971.3870.0070.8071.2271.6371.5371.5171.0770.75k380.5672.3368.6670.9570.0371.8471.6271.5870.7871.3570.1069.0869.34R23.265.933.490.391.481.841.111.461.131.481.412.322.64因素主次 A>B>(A×B)>(A×C)>C>(B×C)最优组合 A3B2C1
表4 正交试验结果的方差分析
Table 4 ANOVA of orthogonal experiment results
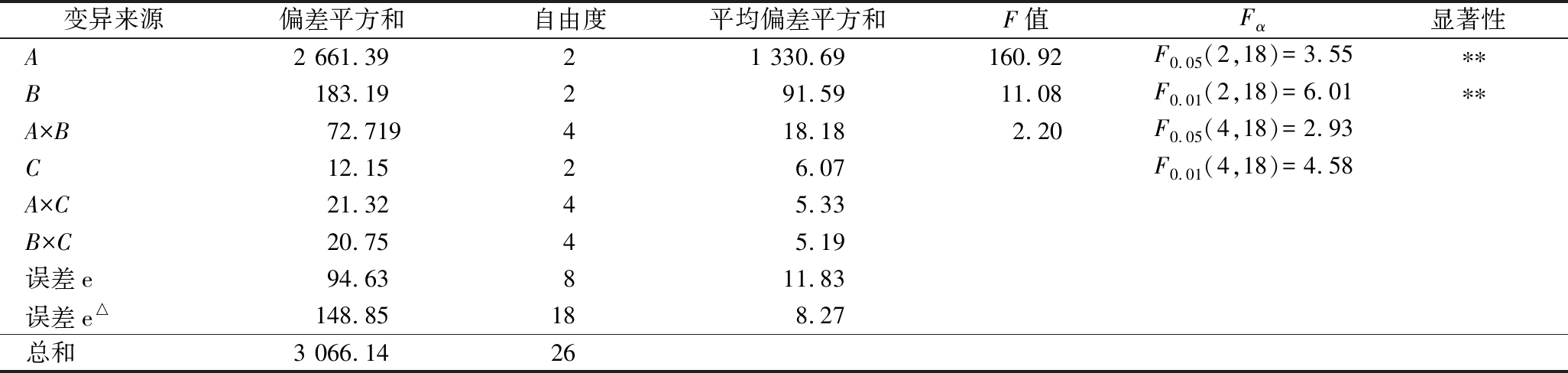
变异来源偏差平方和自由度平均偏差平方和F值Fα显著性A2 661.3921 330.69160.92F0.05(2,18)=3.55∗∗B183.19291.5911.08F0.01(2,18)=6.01∗∗A×B72.719418.182.20F0.05(4,18)=2.93C12.1526.07F0.01(4,18)=4.58A×C21.3245.33B×C20.7545.19误差e94.63811.83误差e△148.85188.27总和3 066.1426
由表3可知,正交试验极差的顺序比较依次为:A(壁芯比)>B(SPI:果胶)>C(包埋时间),表明壁芯比为排名第一位的影响因素,第二重要的影响因素是SPI与果胶的比例,最后的影响因素是搅拌时间。对正交试验数据进行方差分析(表4),当各变异来源的平均偏差平方和大于误差e△的平均偏差平方和时即具备F值,当F值大于相应自由度下的Fα时表明该因素差异显著。方差分析结果显示,因素A、B具有显著性(P<0.05),表明壁芯质量比、SPI与果胶的质量比例对实验结果有重要影响,且A与B条件存在交互作用,而C(搅拌时间)对包埋率的影响不显著(P>0.05)。制备EPI微胶囊的最优参数组合为A3B2C1,即:壁芯质量比为3∶1、m(SPI)∶m(果胶)为6∶4、搅拌时间为30 min,为序号22的实验。该组合能使包埋率最高,包埋率达86.69%,验证后发现大于表3中各组包埋率,可确定该组合是最优工艺参数。
2.3 理化性质表征
2.3.1 EPI微胶囊实物形态
对最优工艺参数制备得到的EPI微胶囊进行感官评价,评估其色泽、气味和组织状态。品质较好的微胶囊具备以下特征:光滑、颗粒均匀、无异味、呈圆球形且结构紧密[22]。如图2所示,EPI粉末呈棕褐色,颗粒小,存在轻微铁锈味,EPI微胶囊呈浅褐色,颗粒变大,外观蓬松,略带乳粉香气。大豆分离蛋白和果胶的包覆使得微胶囊颜色变浅,且包埋掩盖了EPI的铁锈味,使其具备更加优良的气味特征。

a-EPI;b-EPI微胶囊
图2 EPI和EPI微胶囊样品的感官状态
Fig.2 Sensory state of EPI and EPI microcapsule samples
2.3.2 EPI微胶囊粒径分布
EPI微胶囊的粒度测定结果如图3所示,EPI粒度呈偏态分布,分布较为分散,推测可能是样品在进行粒径测定时发生了聚集,导致粒度分布范围广,不均一,平均粒度为89.48 μm。而经过包埋处理后制得的EPI微胶囊粒径分布范围变窄,呈正态分布,平均粒径为119.50 μm。可见微胶囊化包埋处理改善了EPI粒径分布过于分散的问题。

a-EPI;b-EPI微胶囊
图3 EPI和EPI微胶囊的粒径分布图
Fig.3 Particle size distribution of EPI and EPI microcapsules
2.3.3 EPI微胶囊显微结构
如图4所示, EPI呈大小不一的片状结构,表面光滑平整,呈折叠聚集状,并形成了部分断裂聚集的团状颗粒。这是由于Fe2+与多肽链中的羧基氧和氨基氮结合,导致多肽链发生折叠造成的[11]。经过包埋制得的EPI微胶囊形态上发生了较明显的变化,呈凝聚黏连的球状结构,表面致密,无棱角,表明壁材对EPI进行了完整包覆。但EPI微胶囊并未呈完美的球状或椭球状微胶囊形态,推测这是由于EPI本身的不规则片状结构,且果胶包埋后相互之间出现了黏连所导致的。

a-EPI 1 000×;b-EPI微胶囊1 000×;c-EPI 5 000×;d-EPI微胶囊5 000×
图4 EPI和EPI微胶囊的扫描电镜显微照片
Fig.4 FESEM photos of EPI and EPI microcapsules
2.3.4 含水量和吸水性
MENDANHA等[13]的研究显示含水量和吸水性是显著评价微胶囊效果的参考指标,也是评价微胶囊稳定性的指标。EPI与EPI微胶囊的含水量和吸水性的测定结果表明(表5),两者含水量相差不大,但EPI的吸水性约为微胶囊产品的2倍,即EPI微胶囊自由状态下的吸水性较芯材EPI显著降低,更便于储藏。
表5 EPI和EPI微胶囊的含水量和吸水性
Table 5 The water content and water absorption of EPI and EPI microcapsule samples

试验处理组特性含水量/%吸水性/%EPI7.41±0.53a49.44±1.86aEPI微胶囊6.45±0.67a25.64±0.97b
2.4 稳定性分析
2.4.1 消化稳定性
以大豆分离蛋白和果胶包埋EPI的目的在于保护EPI在胃部免受胃酸破坏,能更稳定地到达肠道吸收部位,并在消化过程中尽量减少Fe2+的产生。因此对EPI和EPI微胶囊的胃肠道消化稳定性进行考察。如图5-a所示,在胃消化过程中(0~120 min),EPI及其微胶囊均释放出Fe2+,但初始状态下EPI即释放出更多Fe2+。在胃消化前60 min,两者Fe2+含量均显著升高,胃消化60~120 min,Fe2+升高幅度明显减缓。总体而言,EPI在胃消化过程中游离Fe2+的浓度均高于EPI微胶囊,表明EPI微胶囊具备更高的胃消化稳定性。

a-模拟胃消化;b-模拟肠消化
图5 模拟胃消化过程中铁释放量曲线
Fig.5 Simulation of iron release profiles during gastrointestinal digestion
如图5-b所示,在肠消化过程中,EPI与EPI微胶囊消化性能差异显著。胃消化后进入肠消化的过程中,由于pH的快速改变,EPI及其微胶囊的Fe2+浓度发生了较大的改变。肠消化初期,EPI溶液中Fe2+依然逐步上升,而EPI微胶囊Fe2+含量发生了下降。推测可能是由于本实验所采用的大豆分离蛋白(等电点pI=8.0)在酸性环境下更容易溶解释放出部分EPI,且实验所采用的低酯果胶在较高pH值条件下更为稳定,因此在肠消化段,果胶再次发生聚集。在肠消化开始30 min之后,EPI和EPI微胶囊的Fe2+释放趋势相同,均呈现缓慢增长,但微胶囊释放的Fe2+显著低于EPI,表明在肠道消化环境下,微胶囊比EPI更稳定。其原因可能是微胶囊以大豆分离蛋白和果胶作为壁材,对EPI起到了保护的作用,从而使Fe2+在消化道中保持结合形态,便于EPI直接以肽铁螯合物分子的形式被人体吸收,能够提高其利用率[23-24]。
有研究表明,果胶的胶链之间可通过作用力形成三维网状凝胶结构包覆益生菌,其中高酯果胶靠氢键连接,低酯果胶靠静电相互作用连接,包覆后形成的微胶囊可帮助益生菌抵抗胃肠道的强酸性环境[25]。ZHANG等[26]利用Ca2+交联甜菜果胶法提高了唾液乳杆菌在胃肠道模拟消化条件下的存活率。因此包埋有利于保持EPI的螯合率及活性。在肠消化60~90 min过程中,EPI和EPI微胶囊所释放的Fe2+浓度均有所下降。氨基酸残基与金属相互作用的有效性与pH有关,肽的净电荷也是如此,它可能变成中性、负性或正电荷,从而阻碍或促进静电相互作用[27],因此推测此时游离Fe2+与肽重新发生了螯合。
2.4.2 热稳定性
EPI和EPI微胶囊的热稳定性测定结果如图6所示,EPI的铁螯合率随着温度的升高逐渐下降,50 ℃时螯合率达到最低值,50 ℃以上趋于稳定。EPI微胶囊在所测定的各个温度下,螯合率均高于EPI。表明EPI微胶囊具有更高的热稳定性。陈忠宝[28]利用离子交联法,以果胶与壳聚糖作为壁材包埋制备得到的蓝靛果多酚微胶囊,其在 100 ℃下的稳定性较芯材多酚提升了27.3%,与本文得出的结果类似。

图6 EPI和EPI微胶囊的热稳定性
Fig.6 Thermal stability of EPI and EPI microcapsule samples
2.5 肠道缓释行为分析
灌胃前小鼠各个时段的粪便铁含量测定结果如图7-a所示。由于期间仍摄食低铁饲料,故IDA小鼠粪便中仍含有微量铁,铁含量呈小范围波动,总体保持平稳。如图7-b所示,灌胃EPI后4 h,粪便中铁含量快速上升,在接近6 h时达到最高值9.66 μg/h,随后逐渐下降,8 h处略微升高,之后下降并趋于平缓。灌胃EPI微胶囊后6 h,粪便铁含量快速上升,在接近8 h时达到最高值6.80 μg/h,随后铁含量降低,在9~10 h略有上升后趋于平缓。从结果中可以发现,补充EPI及EPI微胶囊后粪便中的铁含量都出现了快速上升的高峰,这是由于灌胃补铁剂引起瞬时铁浓度上升,机体消化吸收后排出的剩余铁所引起的粪便铁含量升高。但EPI微胶囊的铁含量的达峰时间较EPI延迟2 h,分析原因可能是微胶囊有壁材包裹,胃肠道中的酶先对果胶和大豆分离蛋白进行酶解消化,故延缓了EPI释放的时间,表明EPI微胶囊达到了缓释的效果。
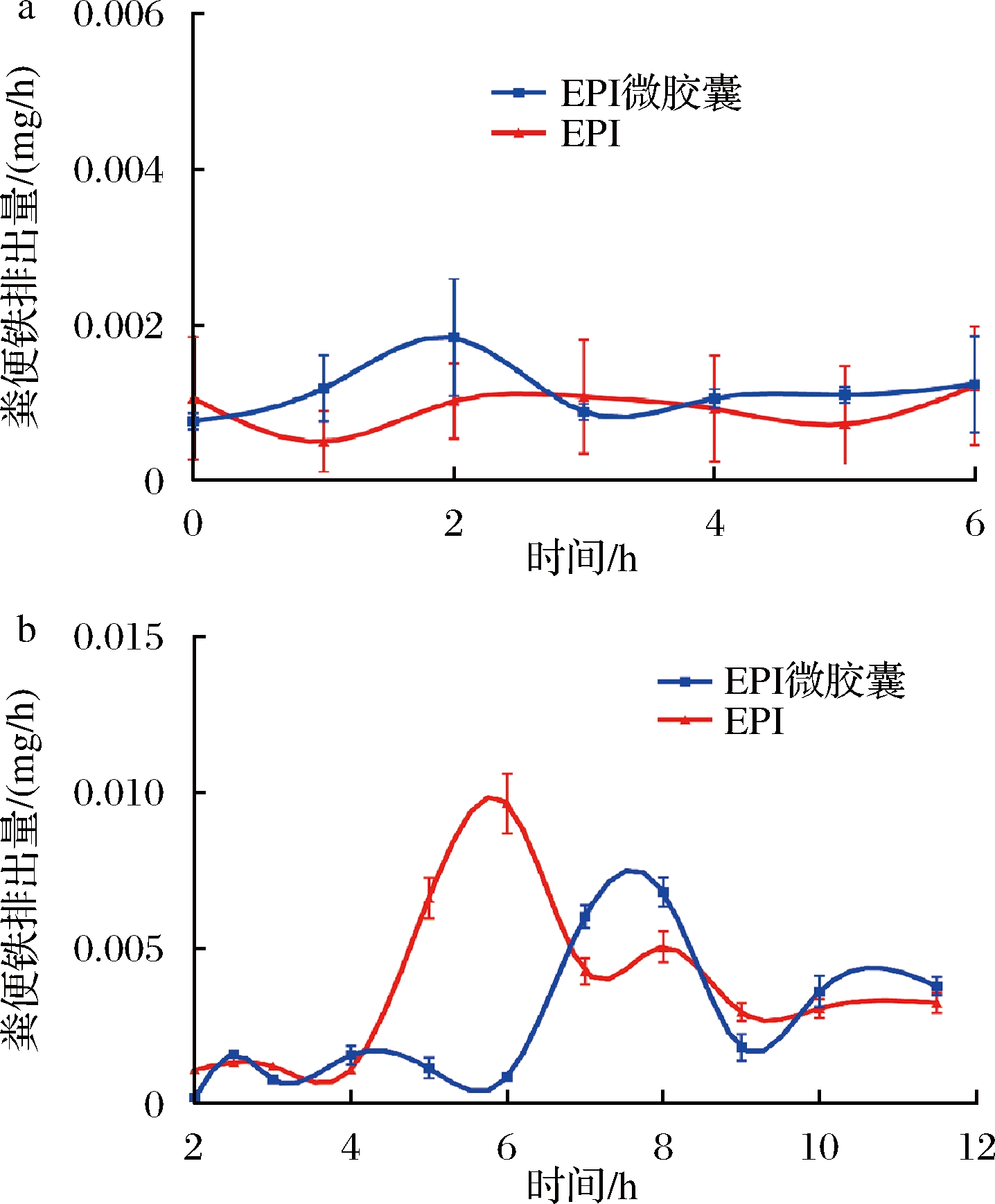
a-灌胃前;b-灌胃后
图7 样品摄入前后小鼠肠道铁含量变化
Fig.7 Change of intestinal iron content in mice before and after sample intake
分别计算EPI铁含量曲线4~7 h和EPI微胶囊铁含量曲线6~9 h下的面积(最高峰出现时段),其面积大致可以反映粪便排出的最大铁量,结果表明,摄入EPI曲线面积为37.67 μg,EPI微胶囊的曲线面积为26.92 μg,未被吸收的铁越多,表明机体吸收利用越少。以上结果显示EPI微胶囊可以降低粪便中残余铁的含量,并降低铁排出瞬时浓度,提高铁的吸收利用度,达到缓释效果。徐军等[29]研究表明,口服琥珀酸亚铁缓释片可以降低铁的释放速率和铁吸收进入机体的速率,避免胃肠道Fe2+峰浓度过大,与本研究结果相似。此外,相较于缓释处理前的药物,该缓释片减小了对妊娠期IDA女性的胃肠道刺激性,极大减少恶心呕吐、胃疼、腹泻等不良反应。故EPI微胶囊有望更好地调控IDA小鼠的肠道健康,但其功效仍需进一步研究。
3 结论
本研究采用单因素试验和正交试验方法探究EPI微胶囊化最优工艺,通过单因素试验分别考察壁芯质量比、SPI与果胶质量比例、搅拌时间对包埋率的影响,得到最适宜的壁芯质量比为2∶1,SPI与果胶质量比为5∶5,搅拌时间为40 min。通过正交试验进一步考察各因素影响EPI微胶囊芯材包埋率的主次关系,并得到最优参数组合:壁芯质量比3∶1、SPI与果胶质量比6∶4、搅拌时间30 min,包埋率达86.69%。对最优条件下制得的EPI微胶囊进行理化性质的表征,结果表明EPI微胶囊的粒径分布更窄,平均粒径为119.50 μm;吸水性显著降低至(25.64±0.97)%。EPI微胶囊在胃肠道模拟消化过程中释放的Fe2+含量显著低于EPI(P<0.05),在20~80 ℃下的铁螯合量显著高于EPI(P<0.05),表明其消化稳定性和热稳定性提高。此外,EPI微胶囊还可以降低粪便中残余铁的含量,将肠道铁含量达峰时间延迟2 h。研究结果为阿胶产品开发的多样化提供了科学基础。
[1] 上海市药品监督管理局. 上海市中药饮片炮制规范:2018年版[M].上海:上海科学技术出版社, 2019:752.
Shanghai Medical Products Administration.Processing Standard of TCM Decoction Pieces in Shanghai (2018 Edition)[M].Shanghai:Shanghai Scientific and Technical Publishers, 2019:752.
[2] 李敏. 阿胶肽-铁螯合物的制备及其初步药效学研究[D].济南:山东中医药大学, 2018.
LI M.Preparation of gelatin peptide-iron chelate and its preliminary pharmacodynamic research[D].Jinan:Shandong University of Traditional Chinese Medicine, 2018.
[3] 梁传亭, 梁家胜, 梁家汇.中药理性撰要[M].北京:中医古籍出版社, 2019:824.
LIANG C T, LIANG J S, LIANG J H.Rational Record of Traditional Chinese medicine[M].Beijing:Traditional Chinese Medicine Ancient Books Publishers, 2019:824.
[4] PILO F, ANGELUCCI E.A storm in the niche:Iron, oxidative stress and haemopoiesis[J].Blood Reviews, 2018, 32(1):29-35.
[5] 赵聪, 黄浩, 陈贵堂.缺铁性贫血与补铁剂研究概况[J].食品安全质量检测学报, 2016, 7(8):3216-3221.
ZHAO C, HUANG H, CHEN G T.Research progress on iron deficiency anemia and new types of iron supplement agents[J].Journal of Food Safety &Quality, 2016, 7(8):3216-3221.
[6] 管玲娟, 曹丛丛, 屠飘涵, 等.缺铁对肠道免疫功能的影响及新型补铁剂的研究进展[J].食品与发酵工业, 2020, 46(19):264-270.
GUAN L J, CAO C C, TU P H, et al.Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J].Food and Fermentation Industries, 2020, 46(19):264-270.
[7] 王方海, 赵维, 陈建芳, 等.补铁剂研究进展[J].药学进展, 2016, 40(9):680-688.
WANG F H, ZHAO W, CHEN J F, et al.Research progress in iron supplement[J].Progress in Pharmaceutical Sciences, 2016, 40(9):680-688.
[8] WU W F, YANG Y Y, SUN N, et al.Food protein-derived iron-chelating peptides:The binding mode and promotive effects of iron bioavailability[J].Food Research International, 2020, 131:108976.
[9] 曹丛丛. 阿胶促铁吸收的活性成分及其铁螯合物的补血作用研究[D].无锡:江南大学, 2021.
CAO C C.Study on the active components of Colla corii asini promoting iron absorption and hematopoietic effect of their iron chelates[D].Wuxi:Jiangnan University, 2021.
[10] 曹丛丛, 管玲娟, 屠飘涵, 等.具有潜在补血活性的阿胶肽铁螯合物的结构表征[J].食品与发酵工业, 2021, 47(24):28-34.
CAO C C, GUAN L J, TU P H, et al.Structural characterization of Ejiao peptide-iron chelates with potential hematopoietic effect[J].Food and Fermentation Industries, 2021, 47(24):28-34.
[11] 侯泽淇, 孔欣欣, 张杰.食品微胶囊技术应用现状及其发展前景[J].现代食品, 2022, 28(10):50-53;57.
HOU Z Q, KONG X X, ZHANG J.Application status and development prospect of food microencapsulation technology[J].Modern Food, 2022, 28(10):50-53;57.
[12] 李佳釔, 方佳兴, 李亚隆, 等.酶解大豆蛋白复合凝聚微胶囊的制备及其性质表征[J].食品与发酵工业, 2021, 47(10):1-7.
LI J Y, FANG J X, LI Y L, et al.Preparation and characterization of hydrolyzed soy protein isolate microcapsules by complex coacervation[J].Food and Fermentation Industries, 2021, 47(10):1-7.
[13] MENDANHA D V, MOLINA ORTIZ S E, FAVARO-TRINDADE C S, et al.Microencapsulation of casein hydrolysate by complex coacervation with SPI/pectin[J].Food Research International, 2009, 42(8):1099-1104.
[14] 李颖杰, 林慧敏, 吕耿强.鱼糜酶解蛋白亚铁螯合肽微胶囊工艺及抗氧化研究[J].中国食品学报, 2017, 17(10):116-121.
LI Y J, LIN H M, LYU G Q.Preparation and antioxidant activity of ferrous chelating peptide from haitail hydrolysis microcapsules[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(10):116-121.
[15] 何凤芹, 李拥军, 梁雪琪, 等.原子吸收分光光度法测定蔬菜中的微量元素铁[J].安徽农业科学, 2013, 41(3):1236;1264.
HE F Q, LI Y J, LIANG X Q, et al.Determination of trace element iron in vegetables by atomic absorption spectrophotometry[J].Journal of Anhui Agricultural Sciences, 2013, 41(3):1236;1264.
[16] 王俊强. 大豆肽钙螯合物的结合机理及其性质研究[D].无锡:江南大学, 2019.
WANG J Q.Study on binding mechanism and properties of calcium-binding soy peptides[D].Wuxi:Jiangnan University, 2019.
[17] 胡乔迁. 酶解芝麻蛋白肽及其亚铁螯合物的制备与特性[D].扬州:扬州大学, 2019.
HU Q Q.Preparation and characteristics of enzymatic hydrolyzed sesame protein peptide and its ferrous chelate[D].Yangzhou:Yangzhou University, 2019.
[18] 中华人民共和国卫生部药典委员会. 中华人民共和国药典:一九八五年版增补本[M].北京:人民卫生出版社:1988:127.
The State Pharmacopoeia Commission of the People’s Republic of China.Pharmacopoeia of the People’s Republic of China (supplementary edition at 1985)[M].Beijing:People’s Medical Publishing House, 1988:127.
[19] 陈敬鑫, 刘族昕, 吕静祎, 等.大豆分离蛋白/可溶性大豆多糖作为生物活性物质包埋载体的研究进展[J].中国粮油学报, 2021, 36(4):193-202.
CHEN J X, LIU Z X, LYU J Y, et al.Research progress of soy protein isolate/soluble soybean polysaccharide as embedding carrier for bioactive substances[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(4):193-202.
[20] 陈芳, 张悦.果胶作为生物活性成分包埋载体研究进展[J].食品研究与开发, 2019, 40(6):220-224.
CHEN F, ZHANG Y.Advances of pectin as embedded carrier with biological active ingredients[J].Food Research and Development, 2019, 40(6):220-224.
[21] DAMODARAN S.Protein stabilization of emulsions and foams[J].Journal of Food Science, 2006, 70(3):R54-R66.
[22] 窦晓凤, 邓波, 熊华, 等.中链甘油三酯微胶囊的理化性质表征[J].中国油脂, 2012, 37(4):25-28.
DOU X F, DENG B, XIONG H, et al.Physicochemical properties of medium-chain triglyceride microcapsule[J].China Oils and Fats, 2012, 37(4):25-28.
[23] BEARD J L.Iron biology in immune function, muscle metabolism and neuronal functioning[J].The Journal of Nutrition, 2001, 131(2):568S-580S.
[24] 刘成梅, 刘琪, 陈军, 等.果胶功能性质新进展[J].食品工业科技, 2019, 40(21):344-351.
LIU C M, LIU Q, CHEN J, et al.New advances in functional properties of pectin[J].Science and Technology of Food Industry, 2019, 40(21):344-351.
[25] SUN R, NIU Y F, LI M H, et al.Emerging trends in pectin functional processing and its fortification for synbiotics:A review[J].Trends in Food Science &Technology, 2023, 134:80-97.
[26] ZHANG Y, LIN J, ZHONG Q X.S/O/W emulsions prepared with sugar beet pectin to enhance the viability of probiotic Lactobacillus salivarius NRRL B-30514[J].Food Hydrocolloids, 2016, 52:804-810.
[27] WALTERS M E, ESFANDI R, TSOPMO A.Potential of food hydrolyzed proteins and peptides to chelate iron or calcium and enhance their absorption[J].Foods, 2018, 7(10):172.
[28] 陈忠宝. 蓝靛果多酚微胶囊的制备及其稳定性研究[D].哈尔滨:黑龙江大学, 2021.
CHEN Z B.Preparation and stability of indigo edulis polyphenol microcapsules[D].Harbin:Helongjiang University, 2021.
[29] 徐军, 王巧美.琥珀酸亚铁缓释片治疗妊娠中期缺铁性贫血的疗效探讨[J].系统医学, 2020, 5(2):110-113.
XU J, WANG Q M.Efficacy of ferrous succinate sustained-release tablets in the second trimester of iron deficiency Anemia[J].Systems Medicine, 2020, 5(2):110-113.