胶原蛋白由3条相互缠绕的多肽α链组成,形成三螺旋结构,分子质量为105 kDa[1]。因其具备良好的低抗原性、生物降解性和生物相容性等特性,在食品、化妆品和医药等领域均有广泛应用[2]。牛、猪等陆生动物是胶原蛋白的主要来源,但由于牛海绵状脑病和口蹄疫等人畜共患疾病及宗教约束,限制了陆生动物胶原蛋白的使用[3],因此迫切需要寻找胶原蛋白替代来源。水产来源的胶原蛋白因其不存在传染性疾病和宗教伦理问题而备受关注,目前已开发应用且研究较多的水产源胶原蛋白主要是鱼皮、鱼鳞和鱼骨胶原蛋白,如云南鲷鱼骨胶原蛋白[4]、大眼金枪鱼皮和鱼骨胶原蛋白[5]。
海参属于棘皮动物门、海参纲,是重要的海洋生物资源,主要分布于印度洋、西太平洋海区,全球有900多种,我国约140种[6]。我国海参分布在温带区和热带区,其中西沙群岛、南沙群岛和海南岛是我国热带海参的主要产地。海参在各类山珍海味中位尊“八珍”,具有补益养生功效,药用价值较高;此外海参具有“吐脏、再生”等特性,再生和创伤修复能力强,可能与其体壁富含胶原蛋白有关[7]。糙刺参(Stichopus horrens),俗称黄肉、方参,是一种广泛分布于我国南海海域的野生热带海参,资源量大,但目前对其加工利用甚少。关于糙刺参食品化学特性特别是胶原蛋白组成及其特性分析方面尚未见报道。
胶原蛋白传统提取方法有酸法、酶法、热水提取等。近年来,超声波辅助提取技术因高效节能、经济可行、绿色环保等特点应用广泛[8]。热水提取时的高温会破坏胶原蛋白的三螺旋结构,此法不具备应用价值;酸法提取的优点是纯度高,缺点是提取时间长、污染环境;酶法提取虽具备提取过程无污染、产率高等优点,但成本较高是限制其发展的一个因素;而超声波辅助提取作为一种新兴的胶原蛋白提取方法,具有产率高、提取时间短、不破坏结构等诸多优点,但使用时应控制超声波时间和频率。本研究以糙刺参为原料,采用酸法、酶法、超声波辅助酸法、超声波辅助酶法等提取糙刺参体壁胶原蛋白,比较分析不同方法提取的胶原蛋白提取率、结构特征及理化性质,以期为后续糙刺参体壁胶原蛋白的深入研究提供依据。
1 材料与仪器
1.1 材料与试剂
糙刺参购于海南省琼海市潭门海鲜市场,去除内脏和内壁肌肉后于-20 ℃冻藏。
胃蛋白酶(猪胃黏膜)(高纯,1∶10 000),上海源叶生物科技有限公司;EDTA、NaOH、NaCl、乙酸等均为国产分析纯,西陇科学股份有限公司;三羟甲基氨基甲烷(Tris)、羟脯氨酸含量检测试剂盒,北京索莱宝科技有限公司;SDS-PAGE凝胶快速配制试剂盒、SDS-PAGE蛋白上样缓冲液、考马斯亮蓝超快染色液,上海碧云天生物技术有限公司。
1.2 主要仪器与设备
HJ-6AS六联恒速恒温磁力搅拌器,常州金坛良友仪器有限公司;Thermo Lynx 6000高速落地离心机,赛默飞世尔科技有限公司;FS-1200N超声波处理器,上海生析超声仪器有限公司;Cary 60紫外可见分光光度计,上海精科实业有限公司;TENSOR 27傅里叶红外光谱仪,德国Bruker公司;GelDoc XR+凝胶成像系统,美国伯乐公司;Chirascan V100圆二色光谱仪,英国应用光物理公司;DSC-300C差示扫描量热仪,南京大展检测仪器有限公司。
2 实验方法
2.1 糙刺参体壁预处理
解冻后的糙刺参体壁切成碎块,称取40 g碎块,以1∶10(g∶mL)的料液比加入蒸馏水磁力搅拌30 min,清洗糙刺参,纱布过滤,取糙刺参碎块,按料液比1∶10(g∶mL)加入0.1 mol/L Tris-HCl(pH 8.0,4 mmol/L EDTA),搅拌24 h。纱布过滤,糙刺参碎块清洗2遍后于蒸馏水中搅拌24 h,糙刺参溶解于溶液中,13 000 r/min离心30 min,所得胶原沉淀按料液比1∶20(g∶mL)加入0.1 mol/L NaOH,去除色素和非胶原蛋白,搅拌72 h,沉淀反复水洗至中性备用。所有操作步骤均在4 ℃下进行。
2.2 糙刺参体壁胶原蛋白的提取
2.2.1 酸法提取
参考AHMED等[9]的方法,稍作修改。预处理后的胶原沉淀按料液比1∶25(g∶mL)加入0.5 mol/L乙酸溶液,搅拌48 h。13 000 r/min离心45 min,取上清液,加入NaCl至终浓度为0.9 mol/L,搅拌2 h,静置过夜。离心收集沉淀,加入少量0.5 mol/L乙酸复溶后装入透析袋,用0.1 mol/L乙酸透析1 d、蒸馏水透析2 d,直至1% AgNO3检验不出现白色沉淀即表示透析结束,冷冻干燥后制得酸溶性胶原蛋白(acid-soluble collagen, ASC)。
2.2.2 酶法提取
参考ABEDIN等[10]的方法,稍作修改。预处理后的胶原沉淀按料液比1∶20(g∶mL)加入含有2%(质量分数)胃蛋白酶的0.5 mol/L乙酸溶液,搅拌48 h。13 000 r/min离心45 min,取上清液,加入NaCl至终浓度为0.9 mol/L,搅拌2 h,静置过夜。离心取沉淀复溶于少量0.5 mol/L乙酸,装入透析袋内于0.02 mol/L Na2HPO4(pH 8.0)中透析2 d使胃蛋白酶失活,再分别用0.1 mol/L乙酸和蒸馏水透析1 d和2 d,透析检验方法同2.2.1节,冷冻干燥后制得酶溶性胶原蛋白(pepsin-solubilized collagen, PSC)。
2.2.3 超声波辅助酸法提取
参考ALI等[11]的方法,稍作修改。预处理后的胶原沉淀按料液比1∶15(g∶mL)加入0.5 mol/L乙酸溶液,360 W超声波处理20 min。超声波处理过程中利用低温恒温槽将样品的温度保持在4 ℃,使用温度传感器实时监测温度。为避免过热,采取脉冲模式,即超声波10 s,暂停5 s。处理结束后,连续搅拌48 h进行提取。盐析、透析操作过程同2.2.1节,冷冻干燥后制得超声波辅助酸溶性胶原蛋白(ultrasound-assisted extraction of acid-soluble collagen, UASC)。
2.2.4 超声波辅助酶法提取
参考ALI等[11]的方法,稍作修改。预处理后的胶原沉淀按料液比1∶15(g∶mL)加入0.5 mol/L乙酸溶液,480 W超声波处理20 min,并使用如2.2.3节所述的脉冲模式。超声波处理结束后,加入质量分数2%的胃蛋白酶,搅拌48 h进一步提取。盐析、透析操作过程同2.2.2节,冷冻干燥后制得超声波辅助酶溶性胶原蛋白(ultrasound-assisted extraction of pepsin-solubilized collagen, UPSC)。
2.3 胶原蛋白提取率的测定
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》测定样品中羟脯氨酸含量。糙刺参胶原蛋白提取率计算如公式(1)所示:
(1)
式中:X,胶原蛋白提取率,%;ω,样品的羟脯氨酸质量浓度,μg/mL;V,样品体积,mL;D,稀释倍数;11.1,羟脯氨酸与胶原蛋白的换算系数;m,糙刺参体壁的胶原蛋白含量,g。
2.4 SDS-PAGE分析
参考SONG等[12]的方法,稍作修改。采用8%分离胶和5%浓缩胶,并用6.5~270 kDa的蛋白标准品计算蛋白质条带分子质量。取胶原蛋白冻干品2 mg溶于0.5 mol/L乙酸溶液,配制质量浓度为1 mg/mL的胶原蛋白溶液,与2×上样缓冲液以1∶1的体积比例混匀,100 ℃加热8 min,5 000 r/min离心5 min,取15 μL上清液上样。采用直流恒压电源进行电泳,电流40 mA,电压100 V。电泳结束后进行染色和脱色,直至背景颜色为无色后进行凝胶成像系统分析。
2.5 紫外光谱分析
参考LI等[13]的方法,稍作修改。称取10 mg胶原蛋白冻干品溶于0.5 mol/L乙酸溶液,配制质量浓度为1 mg/mL的胶原蛋白溶液,12 000 r/min离心15 min,取上清液进行扫描分析。扫描波段为200~400 nm,速度为2 nm/s,波长间隔1 nm。以0.5 mol/L乙酸溶液作为空白对照。
2.6 傅里叶变换红外光谱分析
取1 mg胶原蛋白冻干品与100 mg干燥的KBr混合,置于玛瑙研钵中研磨均匀,使用压片机压片。扫描区间400~4 000 cm-1,扫描次数32次,速度0.2 cm/s,分辨率4 cm-1。以KBr作为测量时的背景光谱。
采用PeakFit v4.12软件对红外光谱的酰胺I带(1 600~1 700 cm-1)进行基线校正,Gaussian去卷积,利用二阶导数进行多次拟合将最小残差重叠的不同谱带分开,并根据各子峰与二级结构之间的对应关系,计算各子峰面积占比,从而得到各二级结构的相对含量。
2.7 热稳定性分析
胶原蛋白冻干品以料液比1∶40(g∶mL)溶于0.5 mol/L乙酸溶液,在4 ℃下静置2 d后测定热变性温度(Td)和熔融温度(Tm)。称取10 mg胶原蛋白溶液置于铝坩埚中,以空坩埚为参比,扫描温度范围为20~150 ℃,升温速率3 ℃/min,所有测定均在N2气氛下进行。
2.8 圆二色光谱分析
取适量胶原蛋白冻干品溶于0.5 mol/L乙酸溶液,配制质量浓度为0.3 mg/mL的胶原蛋白溶液,10 000 r/min离心15 min,取200 μL上清液于光程为0.5 mm的比色皿中进行扫描测定。N2压力为0.4 MPa,扫描波长范围为190~260 nm,宽带1 nm,响应时间0.5 s。以0.5 mol/L乙酸溶液作为空白对照。
2.9 数据处理
所有实验均重复3次,结果使用JMP 14.0软件进行差异显著性分析(P<0.05),应用Origin 9.8软件绘图。
3 结果与分析
3.1 糙刺参胶原蛋白提取率
如图1所示,与胶原蛋白传统提取方法相比,超声波辅助提取方法的提取率更高,即UASC和UPSC的提取率显著高于ASC和PSC(P<0.05)(以湿重计),推测是由于超声波产生的空化效应在一定程度上增大了胶原蛋白的孔隙度,促进了胶原蛋白的溶出。

图1 不同提取方法下糙刺参体壁胶原蛋白的提取率
Fig.1 Extraction rate of collagens from the body wall of S.horrens by different methods
注:不同小写字母表示组间存在显著性差异(P<0.05)。
由图1可知,ASC的提取率仅为0.15%,其原因可能是胶原蛋白端肽区域的交联导致胶原蛋白在酸性条件下较难溶解,PSC的提取率为2.14%,加入胃蛋白酶后,裂解了端肽区域的交联分子,促使胶原蛋白在酸性条件下的溶解度提高,进而导致PSC的提取率高于ASC[10]。该结果与大红海参皮ASC(3.4%)和PSC(20.8%)(以干重计)[14]、黄鳍金枪鱼鱼囊ASC(1.07%)和PSC(12.10%)(以干重计)[15]的结果类似。以上结果表明,胃蛋白酶通过裂解胶原的端肽区域促进胶原蛋白的提取,超声波的空化效应也促进了溶液的分子运动。这2种作用综合在一起同时促进了胃蛋白酶的渗透和基质的传递,因此超声波与胃蛋白酶的结合有效提高了胶原蛋白的提取率,与RAN等[16]的研究结果一致。由于糙刺参ASC提取率极低,未作为后续研究对象。
3.2 胶原蛋白的SDS-PAGE分析
如图2所示,3种方法提取的胶原蛋白的亚基组成及分子质量分布趋势基本一致,均由α1、α2、β、γ等4条链组成,与海蜇胶原蛋白[2]、斑点叉尾鮰鱼皮胶原蛋白[17]的电泳结果一致。α1链的分子质量为135 kDa,α2链的分子质量为116 kDa,并且α1的条带光密度是α2的2倍,因此3种胶原蛋白亚基组成可能为(α1)2α2,符合I型胶原蛋白的结构特征[18]。β链的出现说明胶原蛋白存在分子内或分子间的交联作用[19]。图2显示PSC和UPSC存在一些低分子条带,推测是因为提取过程中胃蛋白酶使部分胶原蛋白降解成小分子组分所致[19],UASC的低分子条带则可能是由于超声波产生的剪切力使一部分胶原蛋白三螺旋结构被破坏而发生降解。综上,3种胶原蛋白的基本组成类似,说明超声波不会破坏胶原蛋白的亚基组成[20]。

1-PSC;2-UPSC;3-UASC
图2 糙刺参体壁胶原蛋白的SDS-PAGE图谱
Fig.2 SDS-PAGE pattern of collagens from the body wall of S.horrens
3.3 胶原蛋白的紫外光谱分析
胶原蛋白肽链含有—C![]() O、—COOH和—CONH2等生色基团,存在很强的紫外吸收特性,可作为判断胶原蛋白类型的一个重要标志[21]。大多数蛋白质在280 nm出现吸收峰的原因是由于含有色氨酸、酪氨酸和苯丙氨酸等芳香族氨基酸,而胶原蛋白基本不含这些氨基酸,因此在280 nm处应无明显吸收峰的出现。据研究报道,胶原蛋白的紫外特征吸收波长一般为230 nm左右[22]。由图3可知,PSC、UPSC在225 nm出现最大吸收峰,UASC在230 nm出现最大吸收峰,主要由肽键—C
O、—COOH和—CONH2等生色基团,存在很强的紫外吸收特性,可作为判断胶原蛋白类型的一个重要标志[21]。大多数蛋白质在280 nm出现吸收峰的原因是由于含有色氨酸、酪氨酸和苯丙氨酸等芳香族氨基酸,而胶原蛋白基本不含这些氨基酸,因此在280 nm处应无明显吸收峰的出现。据研究报道,胶原蛋白的紫外特征吸收波长一般为230 nm左右[22]。由图3可知,PSC、UPSC在225 nm出现最大吸收峰,UASC在230 nm出现最大吸收峰,主要由肽键—C![]() O的n→π*跃迁所产生[21],3种胶原蛋白在280 nm处几乎无吸收,说明胶原蛋白的芳香族氨基酸含量较少。以上结果符合I型胶原蛋白的紫外吸收特征,与海参胶原蛋白[23]、鲽鱼皮胶原蛋白[19]的研究结果类似。
O的n→π*跃迁所产生[21],3种胶原蛋白在280 nm处几乎无吸收,说明胶原蛋白的芳香族氨基酸含量较少。以上结果符合I型胶原蛋白的紫外吸收特征,与海参胶原蛋白[23]、鲽鱼皮胶原蛋白[19]的研究结果类似。
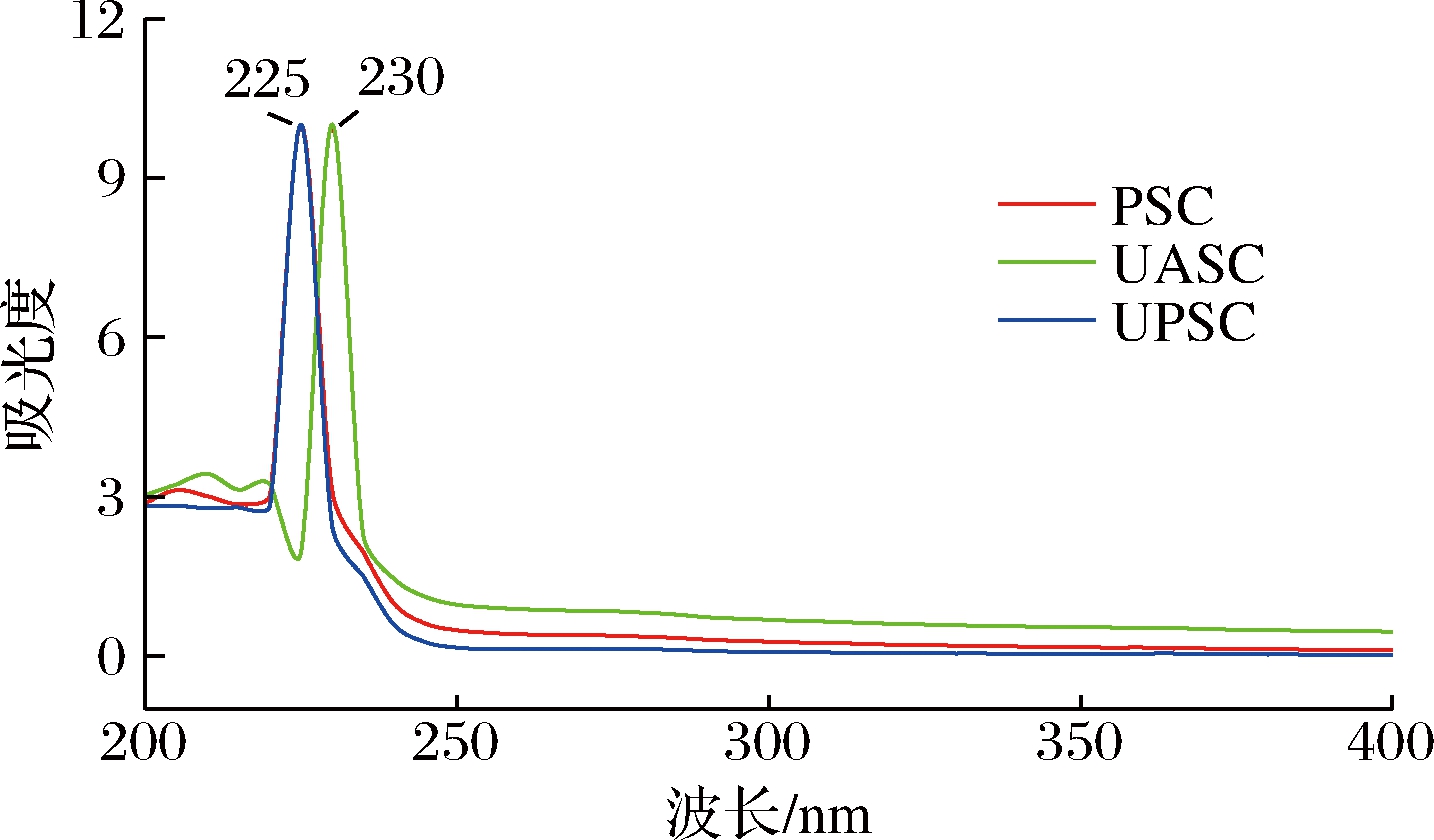
图3 糙刺参体壁胶原蛋白的紫外吸收光谱图
Fig.3 Ultraviolet absorption spectrum of collagens from the body wall of S.horrens
3.4 胶原蛋白的傅里叶变换红外光谱分析
由图4可知,3种方法提取的糙刺参体壁胶原蛋白的红外光谱图趋势基本一致,表明3种方法所得胶原蛋白的结构相似,均具有酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ和酰胺Ⅲ带5个胶原蛋白的特征吸收峰,与鲽鱼皮胶原蛋白[22]的研究结果极为相似。酰胺A带与N—H基团伸缩振动有关,通常在3 400~3 440 cm-1产生吸收峰,当N—H基团的肽段参与氢键的形成时,N—H的伸缩振动会向低频率移动,使吸收峰降低到3 300 cm-1左右[9]。如图4所示,PSC、UPSC、UASC酰胺A带的吸收峰分别为3 311、3 321、3 323 cm-1,符合酰胺A带的特征吸收,说明3种胶原蛋白均含有氢键。3种胶原蛋白酰胺B带的吸收峰主要与CH2不对称伸缩振动有关,分别为2 935、2 940、2 933 cm-1。酰胺Ⅰ带的特征吸收峰因C![]() O的伸缩振动通常位于1 600~1 700 cm-1之间[24], 3种胶原蛋白的酰胺Ⅰ带的吸收峰分别出现在1 664、1 659、1 661 cm-1处,符合酰胺Ⅰ带的出峰位置。酰胺Ⅱ带的特征吸收峰一般位于1 500~1 600 cm-1范围内[25],主要由C—N伸缩振动和N—H弯曲振动引起。3种胶原蛋白分别在1 547、1 547、1 544 cm-1出现酰胺Ⅱ带的吸收峰,与文献报道一致。酰胺Ⅲ带与胶原蛋白结构的完整性相关,3种胶原蛋白酰胺Ⅲ带的特征吸收峰分别位于1 236、1 241、1 238 cm-1,说明3种提取方法均保持了胶原蛋白完整的三螺旋结构。如上所述,各吸收峰位置相差不大,说明在提取过程中超声波不会对胶原蛋白的三螺旋结构产生明显影响。
O的伸缩振动通常位于1 600~1 700 cm-1之间[24], 3种胶原蛋白的酰胺Ⅰ带的吸收峰分别出现在1 664、1 659、1 661 cm-1处,符合酰胺Ⅰ带的出峰位置。酰胺Ⅱ带的特征吸收峰一般位于1 500~1 600 cm-1范围内[25],主要由C—N伸缩振动和N—H弯曲振动引起。3种胶原蛋白分别在1 547、1 547、1 544 cm-1出现酰胺Ⅱ带的吸收峰,与文献报道一致。酰胺Ⅲ带与胶原蛋白结构的完整性相关,3种胶原蛋白酰胺Ⅲ带的特征吸收峰分别位于1 236、1 241、1 238 cm-1,说明3种提取方法均保持了胶原蛋白完整的三螺旋结构。如上所述,各吸收峰位置相差不大,说明在提取过程中超声波不会对胶原蛋白的三螺旋结构产生明显影响。

图4 糙刺参体壁胶原蛋白的红外吸收光谱图
Fig.4 Fourier transform infrared spectrum of collagens from the body wall of S.horrens
通过对酰胺Ⅰ带进行去卷积处理,可以反映蛋白质二级结构的变化趋势。1 600~1 640、1 640~1 650、1 650~1 660、1 660~1 670 cm-1分别表示β折叠、无规则卷曲、α螺旋、β转角。图5为糙刺参胶原蛋白酰胺I带的高斯曲线拟合图,结合图6可发现,3种胶原蛋白的二级结构相对含量有所不同。与PSC相比,UPSC、UASC的α螺旋含量降低,β折叠和β转角含量增加,并且经过超声波处理后,胶原蛋白不存在无规则卷曲结构,这与黄丹丹等[26]的研究结果相似。以上结果说明超声波处理破坏了维持胶原蛋白二级结构的分子间作用力,使氢键断裂,促使α螺旋转变为β折叠和β转角,超声波处理的过程中暴露了更多的三螺旋区位点,促进了胶原蛋白的溶出。

a-PSC;b-UPSC;c-UASC
图5 糙刺参体壁胶原蛋白酰胺Ⅰ带高斯曲线拟合图
Fig.5 Gaussian curve fitting of amide Ⅰ of collagens from the body wall of S.horrens

图6 糙刺参体壁胶原蛋白二级结构的相对含量
Fig.6 Relative contents of secondary structures of collagens from the body wall of S.horrens
3.5 胶原蛋白的热稳定性分析
胶原蛋白的热稳定性通常由热变性温度(Td)和熔融温度(Tm)描述。热变性温度指的是胶原蛋白的三螺旋结构被破坏,分解成无规则卷曲的温度。熔融温度定义为胶原蛋白的物理形态由固体转变为液体的温度。胶原蛋白的热稳定性与亚氨基酸含量、栖息地环境温度和生物体体温有关[9]。
糙刺参PSC、UPSC、UASC的热稳定性如图7和表1所示,3种胶原蛋白均有2个吸热峰,第1个吸热峰为胶原蛋白的热变性温度,分别为21.3、25.9、27.0 ℃,与刺参(22.3 ℃)[6]相近,低于尖吻鲈鱼鳞(37.54 ℃)和鱼皮胶原蛋白(36.74 ℃)[27]、小牛皮胶原蛋白(40.07 ℃)[28],但高于大红海参皮(18.5 ℃)和结缔组织胶原蛋白(17.9 ℃)[14]。第2个吸热峰为胶原蛋白的熔融温度,与多肽链的断裂有关[18],分别为92.4、91.3、90.1 ℃,低于鲟鱼皮Ⅰ型(116.01 ℃)和Ⅴ型胶原蛋白(122.86 ℃)[18]、中华鳖酸溶性胶原蛋白(111.0 ℃)和UASC(120.66 ℃)[29]。综上所述,与传统提取方法相比,超声波辅助提取显示出更高的热变性温度,说明经过超声波处理后,胶原蛋白的结构更稳定,热稳定性更好[8]。
表1 糙刺参体壁胶原蛋白的热稳定性
Table 1 Thermal stability of collagens from the body wall of S.horrens

提取方法热变性温度(Td)/℃熔融温度(Tm)/℃PSC21.392.4UPSC25.991.3UASC27.090.1
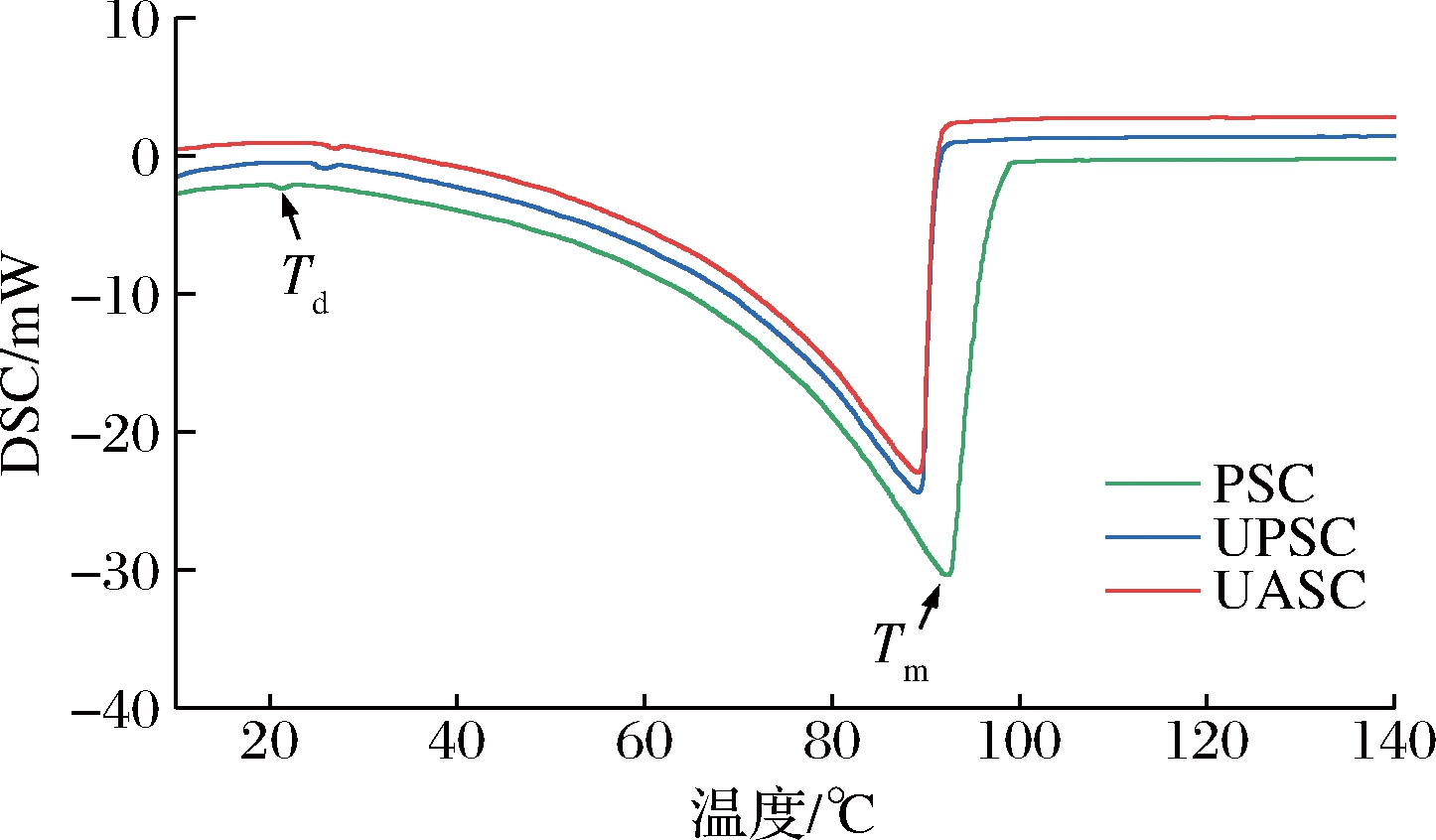
图7 糙刺参体壁胶原蛋白的DSC曲线
Fig.7 Differential scanning calorimetry curves of collagens from the body wall of S.horrens
3.6 胶原蛋白的圆二色光谱分析
蛋白质的圆二色性可较直观的反映蛋白质的立体结构信息,因此常用于蛋白质二级结构的分析。如图8所示,椭圆度略有偏差,表明3种胶原蛋白的结构发生了微小的变化。PSC、UPSC、UASC分别在223、222、223 nm存在较弱的正吸收峰,主要表现为β折叠及无规则卷曲的叠加吸收,是左旋聚脯氨酸构型的圆二色谱典型特征[30]。PSC、UPSC、UASC分别在199、198、198 nm出现明显的负吸收峰。正吸收峰与负吸收峰的比值(Rpn)是表征胶原三螺旋结构完整性的参数,其比值越大,说明胶原蛋白的三螺旋结构越完整。图8结果显示,UPSC的Rpn大于PSC和UASC,表明UPSC具有更完整的三螺旋结构,再次说明超声波不会破坏胶原蛋白的三螺旋结构,与鲤鱼皮胶原蛋白[11]的结果相似。
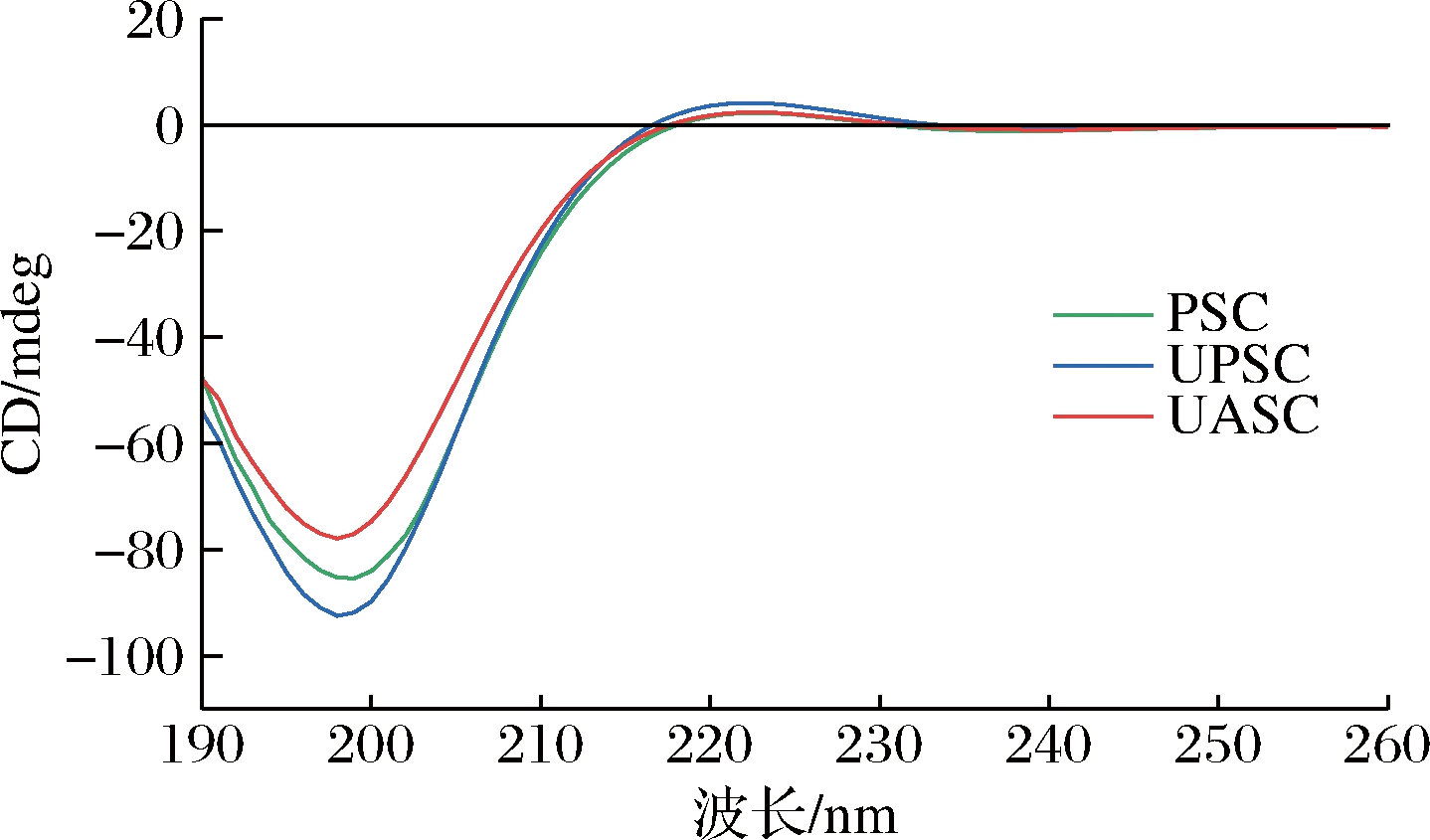
图8 糙刺参体壁胶原蛋白的圆二色光谱图
Fig.8 Circular dichromatic spectrum of collagens from the body wall of S.horrens
4 结论
本研究以糙刺参体壁为对象,采用酸法、酶法、超声波辅助酸法和超声波辅助酶法提取胶原蛋白,对比分析了不同方法提取的胶原蛋白的结构和性质。结果表明,UASC和UPSC的提取率显著高于ASC和PSC(P<0.05);SDS-PAGE图谱显示PSC、UPSC、UASC亚基组成均为(α1)2α2;紫外光谱表明,PSC、UPSC、UASC在280 nm处均无吸收峰;红外光谱显示,PSC、UPSC、UASC均含有典型的胶原蛋白特征吸收峰,酰胺Ⅰ带去卷积结果显示超声波处理使胶原蛋白α螺旋含量降低,β折叠和β转角含量增加;DSC曲线显示,与传统提取方法相比,超声波辅助提取显示出更好的热稳定性;圆二色光谱表明UPSC具有更完整的三螺旋结构。
综上,糙刺参体壁胶原蛋白为I型胶原蛋白,3种提取方法均保持了胶原蛋白完整的三螺旋结构,且在不影响胶原蛋白结构和理化性质的前提下,超声波处理能有效提高胶原蛋白的提取率。本研究不仅为糙刺参体壁的精深加工提供基础依据,还为糙刺参体壁胶原蛋白在食品、化妆品和生物医药等领域中的应用提供一定科学依据。
[1] KARIM A A, BHAT R.Fish gelatin:Properties, challenges, and prospects as an alternative to mammalian gelatins[J].Food Hydrocolloids, 2009, 23(3):563-576.
[2] 冯玲玲, 冯进, 李春阳.海蜇I型胶原蛋白的提取及结构特性研究[J].食品工业科技, 2021, 42(7):15-21.
FENG L L, FENG J, LI C Y.Extraction and structural characteristics of type I collagen from Rhopilema esculenta[J].Science and Technology of Food Industry, 2021, 42(7):15-21.
[3] SHAHIDI F, VARATHARAJAN V, PENG H, et al.Utilization of marine by-products for the recovery of value-added products[J].Journal of Food Bioactives, 2019, 6:10-61.
[4] 宫萱, 包建强, 黄可承, 等.鱼骨胶原蛋白提取、纯化工艺及应用的研究进展[J].食品与发酵工业, 2022, 48(24):346-351.
GONG X, BAO J Q, HUANG K C, et al.Progress on extraction, purification, and application of fish bone collagen[J].Food and Fermentation Industries, 2022, 48(24):346-351.
[5] COPPOLA D, OLIVIERO M, VITALE G A, et al.Marine collagen from alternative and sustainable sources:Extraction, processing and applications[J].Marine Drugs, 2020, 18(4):214.
[6] 侯虎, 孙江, 毛家楠, 等.海参胶原纤维形态及胶原蛋白理化性质研究[J].现代食品科技, 2013, 29(7):1491-1495.
HOU H, SUN J, MAO J N, et al.Collagen fibers morphology and physical and chemical properties of collagen of sea cucumber[J].Modern Food Science and Technology, 2013, 29(7):1491-1495.
[7] CHARAN-DIXON H, GOLDSTIEN S J, VANDERHAVEN B J, et al.Effects of traditional fishing techniques on internal organ regeneration, physiology, and biochemistry in the tropical sea cucumber Stichopus horrens[J].Journal of Experimental Marine Biology and Ecology, 2019, 510:15-22.
[8] 邹烨, 蔡盼盼, 王立, 等.超声辅助酶法提取中华鳖裙边胶原蛋白及其热稳定性能[J].食品科学, 2018, 39(2):254-259.
ZOU Y, CAI P P, WANG L, et al.Ultrasonic-assisted enzymatic extraction and thermal stability of collagen from soft-shelled turtle calipash[J].Food Science, 2018, 39(2):254-259.
[9] AHMED R, HAQ M, CHUN B S.Characterization of marine derived collagen extracted from the by-products of bigeye tuna (Thunnus obesus)[J].International Journal of Biological Macromolecules, 2019, 135:668-676.
[10] ABEDIN M Z, KARIM A A, AHMED F, et al.Isolation and characterization of pepsin-solubilized collagen from the integument of sea cucumber (Stichopus vastus)[J].Journal of the Science of Food and Agriculture, 2013, 93(5):1083-1088.
[11] ALI A M M, KISHIMURA H, BENJAKUL S.Extraction efficiency and characteristics of acid and pepsin soluble collagens from the skin of golden carp (Probarbus jullieni) as affected by ultrasonication[J].Process Biochemistry, 2018, 66:237-244.
[12] SONG Z L, LIU H M, CHEN L W, et al.Characterization and comparison of collagen extracted from the skin of the Nile tilapia by fermentation and chemical pretreatment[J].Food Chemistry, 2021, 340:128139.
[13] LI P H, LU W C, CHAN Y J, et al.Extraction and characterization of collagen from sea cucumber (Holothuria cinerascens) and its potential application in moisturizing cosmetics[J].Aquaculture, 2020, 515:734590.
[14] LIU Z Y, OLIVEIRA A C M, SU Y C.Purification and characterization of pepsin-solubilized collagen from skin and connective tissue of giant red sea cucumber (Parastichopus californicus)[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):1270-1274.
[15] KAEWDANG O, BENJAKUL S, KAEWMANEE T, et al.Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares)[J].Food Chemistry, 2014, 155:264-270.
[16] RAN X G, WANG L Y.Use of ultrasonic and pepsin treatment in tandem for collagen extraction from meat industry by-products[J].Journal of the Science of Food and Agriculture, 2014, 94(3):585-590.
[17] TAN Y Q, CHANG S K C.Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J].Food Chemistry, 2018, 242:147-155.
[18] WANG L, LIANG Q F, WANG Z B, et al.Preparation and characterisation of type I and V collagens from the skin of Amur sturgeon (Acipenser schrenckii)[J].Food Chemistry, 2014, 148:410-414.
[19] 蔡路昀, 马帅, 李秀霞, 等.不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响[J].食品与发酵工业, 2017, 43(5):240-246.
CAI L Y, MA S, LI X X, et al.Effects of different extraction methods on structure characteristics and functional properties of collagen from the skin of flounder(Pleuronichthys cornutus)[J].Food and Fermentation Industries, 2017, 43(5):240-246.
[20] AKRAM A N, ZHANG C H.Effect of ultrasonication on the yield, functional and physicochemical characteristics of collagen-II from chicken sternal cartilage[J].Food Chemistry, 2020, 307:125544.
[21] 温慧芳, 陈丽丽, 白春清, 等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学, 2016, 37(1):74-81.
WEN H F, CHEN L L, BAI C Q, et al.Comparative study on physical and chemical properties of collagens obtained by different extraction methods from the skin of the Chinese longsnout catfish Leiocassis longirostris[J].Food Science, 2016, 37(1):74-81.
[22] 马帅, 王静, 曹爱玲, 等.不同部位鲽鱼皮酸溶性胶原蛋白的制备及理化特性分析[J].中国食品学报, 2018, 18(8):154-161.
MA S, WANG J, CAO A L, et al.Preparation and analysis of physical and chemical characteristics of acid-soluble collagen from different parts of the skin of flounder(Pleuronichthys cornutus)[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(8):154-161.
[23] ADIBZADEH N, AMINZADEH S, JAMILI S, et al.Purification and characterization of pepsin-solubilized collagen from skin of sea cucumber Holothuria parva[J].Applied Biochemistry and Biotechnology, 2014, 173(1):143-154.
[24] ZHU B W, DONG X P, ZHOU D Y, et al.Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicus[J].Food Hydrocolloids, 2012, 28(1):182-188.
[25] AHMAD M, BENJAKUL S.Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J].Food Chemistry, 2010, 120(3):817-824.
[26] 黄丹丹, 马良, 韩霜, 等.超声预处理影响金枪鱼皮胶原酶解工艺及机理初探[J].食品与发酵工业, 2017, 43(4):141-146.
HUANG D D, MA L, HAN S, et al.The effect of ultrasonic pretreatment on hydrolysate of Tuna skin and study on its mechanism[J].Food and Fermentation Industries, 2017, 43(4):141-146.
[27] 廖伟, 夏光华, 李川, 等.尖吻鲈鱼鳞和鱼皮胶原蛋白的提取及其理化特性分析[J].食品科学, 2018, 39(1):36-41.
LIAO W, XIA G H, LI C, et al.Extraction and characterization of collagen from scales and skin of Asian seabass[J].Food Science, 2018, 39(1):36-41.
[28] NALINANON S, BENJAKUL S, KISHIMURA H, et al.Type I collagen from the skin of ornate threadfin bream (Nemipterus hexodon):Characteristics and effect of pepsin hydrolysis[J].Food Chemistry, 2011, 125(2):500-507.
[29] ZOU Y, WANG L, CAI P P, et al.Effect of ultrasound assisted extraction on the physicochemical and functional properties of collagen from soft-shelled turtle calipash[J].International Journal of Biological Macromolecules, 2017, 105:1602-1610.
[30] 张强, 黄鑫, 符安卫, 等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业, 2019, 45(12):176-182.
ZHANG Q, HUANG X, FU A W, et al.Extraction and characterization of collagens in Chinese sturgeon calipash[J].Food and Fermentation Industries, 2019, 45(12):176-182.