乌鸡,又称乌骨鸡,是我国传统滋补食材、药材,具有补气血、益肝肾等功效。乌鸡肉中含有20种氨基酸、27种微量元素和多种脂肪酸,鲜肉中氨基酸含量较高,必需氨基酸齐全,且第一、二、三限制性氨基酸含量较高,营养价值较高,是典型的药食同源原料[1-3]。乌鸡富含微量元素,血液中所含γ球蛋白、血清酶类、血小板均高于普通鸡。此外,还具有增加血红素和血细胞、增强免疫力、调节生理机能的功能[4]。王勇[4]基于血虚小鼠模型评价了乌骨鸡多肽的功能活性,发现其通过提高小鼠的红细胞数和血红蛋白含量发挥补血养血的作用。以乌鸡为主药的乌鸡白凤丸具有补养气血、调经止带的主要功效[5]。乌鸡肽是乌鸡肉蛋白经过蛋白酶酶解工艺优化,再经一定分离纯化得到的多肽混合物,乌鸡肽对5-氟尿嘧啶贫血模型有恢复作用,作用机制与乌鸡肽促进促红细胞生成素的表达、调节白细胞介素3及干扰素γ的表达有关[4]。但乌鸡肽发挥补血养血作用的核心功能肽段目前尚不明确。因此,本研究以乌鸡肽为考察对象,对乌鸡肽的总蛋白、肽含量、氨基酸组成、分子质量分布以及潜在功能活性的特征肽段进行研究,为乌鸡肽发挥补血养血作用和营养保健功能应用奠定理论研究基础。
1 材料与方法
1.1 材料与试剂
乌鸡肽,北京中食海氏生物技术有限公司;低聚肽标准品:谷氨酰精氨酸二肽(glutyl-arginine dipeptide,ER)、异亮氨酰精氨酸二肽(isoleucyl-arginine,IR)、天冬酰胺酰精氨酸二肽(asparagyl-arginine,NR)、脯氨酰天冬氨酰精氨酸三肽(prolyl-aspartyl-arginine,PDR)、丙氨酰丙氨酰精氨酸三肽(alanyl-alanyl-arginine,AAR) (纯度均≥99%),苏州强耀生物科技有限公司;乙腈(色谱纯),德国Merck公司;甲酸(色谱纯),迪马科技;蒸馏水,屈臣氏;其余药品均为分析纯。
1.2 仪器与设备
DU-20恒温水浴锅,上海一恒科学仪器有限公司;L-8900日立全自动氨基酸分析仪,天美(中国)科学仪器有限公司;LC-20AD型高效液相色谱仪、色谱仪Nexera X2、LCMS-8060三重四极杆质谱仪联用系统(配有LabSolutions Ver.5.91色谱工作站),日本岛津公司。
1.3 分子质量分布的测定
首先将乌鸡肽用流动相配成1 mg/mL的溶液,经聚四氟乙烯过滤膜(孔径0.2 μm)过滤后上样分析,以乙氨酸-乙氨酸-乙氨酸(分子质量189)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451)、杆菌酶(分子质量1 450)、细胞色素C(分子质量12 500)为肽标准品建立标准曲线,采用高效凝胶过滤色谱法测定分子质量的分布[6-7]。
1.4 乌鸡肽蛋白和氨基酸组成测定
蛋白质含量测定按照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》方法,氨基酸含量按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》方法。
1.5 乌鸡肽结构序列的鉴定
参照文献[8-10]的液相色谱-三重四级杆串联质谱法,将乌鸡肽配制成20 μg/mL的水溶液,10 000 r/min离心10 min后取上清液,用0.22 μm孔径的尼龙过滤膜过滤后,制得待测样品。按照原创肽段数据库进行产物离子扫描,将Inertsil ODS-3色谱柱连接在液相色谱仪,进样体积10 μL。在正离子模式下,碰撞能量设置为-25 V和-35 V,将乌鸡肽进行前体离子扫描(precursor ion scan,PIS),然后对碰撞后生成的产物离子进行分析。
乌鸡肽肽段标准品经LCMS-8060进行Q3扫描、PIS扫描,多反应监测(multiple reaction monitoring,MRM)优化及肽段序列定量,MRM参数如表1所示。
表1 肽段序列的MRM优化参数
Table 1 MRM optimization parameters of peptide sequences
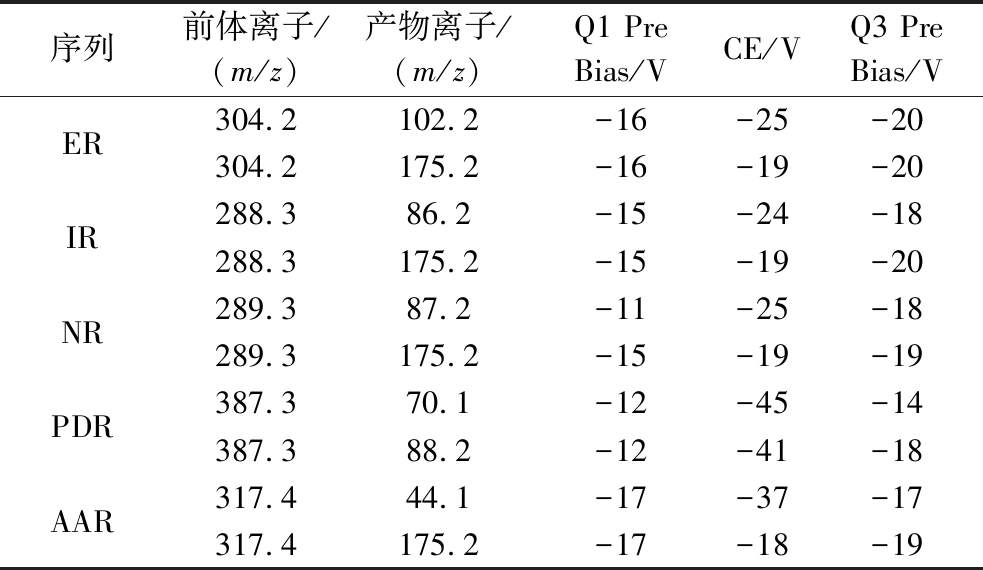
序列前体离子/(m/z)产物离子/(m/z)Q1 Pre Bias/VCE/VQ3 Pre Bias/VER304.2102.2-16-25-20304.2175.2-16-19-20IR288.386.2-15-24-18288.3175.2-15-19-20NR289.387.2-11-25-18289.3175.2-15-19-19PDR387.370.1-12-45-14387.388.2-12-41-18AAR317.444.1-17-37-17317.4175.2-17-18-19
液相色谱条件:色谱柱:Inertsil ODS-3(2.1 mm×250 mm,5 μm);流动相A为纯水(含0.1%甲酸),流动相B为100%乙腈(含0.1 %甲酸),流速0.2 mL/min。梯度洗脱程序:0~15 min,流动相B 0%~50%;15~20 min,流动相B 50%~100%;20~25 min,流动相B 100%;25.1~35 min,流动相B 0%;进样体积10 μL;柱温40 ℃。质谱条件:离子化模式:ESI,正离子模式;离子喷雾电压+4.5 kV;雾化气N2 3.0 L/min;加热气N2流速 10 L/min;干燥气N2流速10 L/min;DL温度250 ℃;加热模块温度400 ℃;离子源温度300 ℃;扫描模式MRM;驻留时间100 ms;延迟时间3 ms。
1.6 统计学处理
采用Origin 9软件对试验数据进行处理。
2 结果与分析
2.1 乌鸡肽的蛋白质和氨基酸组成
乌鸡肽中总蛋白质含量(干基,除去水分所占比例)为94.88%,肽含量(干基)为78.93%,其蛋白质和肽含量均较高。肽的基本组成单位是氨基酸,氨基酸的种类和含量对其功能活性有非常大的影响。从表2可知,乌鸡肽含有17种氨基酸,其中含有人体必需的7种氨基酸和2种半必需氨基酸(组氨酸和精氨酸),其含量分别为25.25%和7.11%,对人体的营养价值较高。欧金秀等[11]采用柱前衍生反相高效液相色谱法测定了驴胶补血颗粒中水解氨基酸,分别是谷氨酸[Glu(E)]、甘氨酸[Gly(G)]、丙氨酸[Ala(A)]、精氨酸[Arg(R)]、脯氨酸[Pro(P)]。张虹等[12]通过鱼皮脱脂、脱杂蛋白处理制备鱼皮明胶粗提物,经多孔型亲水聚合物离子交换层析和葡聚糖柱色谱串联分离得到活性组分,最终通过环磷酰胺致小鼠血虚模型,并使用高分辨的液相色谱串联质谱技术鉴定出7条补血肽段,其中肽段序列中含有较多的Gly(G)、Pro(P)、Ala(A)。上述研究结果说明这些氨基酸可作为补血养血作用的优势氨基酸,从而肽段发挥补血养血作用。此外,乌鸡肽中Glu(E)、Ala(A)、天冬氨酸[Asp(D)]、Gly(G)、Arg(R)含量较高,有助于乌鸡肽发挥补血养血作用,说明乌鸡肽中也存在潜在的补血养血活性功能肽段。
表2 乌鸡肽的氨基酸含量 单位:%
Table 2 Amino acid content of silky fowl peptides

注:a天冬氨酸+天冬酰胺;b谷氨酸+谷氨酰胺;半胱氨酸符号缩写是Cys,表格中数据为胱氨酸含量,符号为(Cys)2。
氨基酸含量氨基酸含量天冬氨酸(Asp)a6.93亮氨酸(Leu)5.45谷氨酸(Glu)b12.61酪氨酸(Tyr)1.90苏氨酸(Thr)2.48苯丙氨酸(Phe)1.48丝氨酸(Ser)3.20赖氨酸(Lys)7.99甘氨酸(Gly)5.23组氨酸(His)2.23丙氨酸(Ala)7.00精氨酸(Arg)4.88缬氨酸(Val)3.39脯氨酸(Pro)2.98蛋氨酸(Met)1.83胱氨酸[(Cys)2]0.48异亮氨酸(Ile)2.63必需氨基酸总量25.25
2.2 乌鸡肽的分子质量分布
通过对图1中色谱峰进行分析计算,得到乌鸡肽的分子质量分布,结果如表3所示。

图1 乌鸡肽的凝胶色谱图
Fig.1 Gel chromatogram of silky fowl peptides
表3 乌鸡肽的分子质量分布
Table 3 Molecular weight distribution of silky fowl peptides
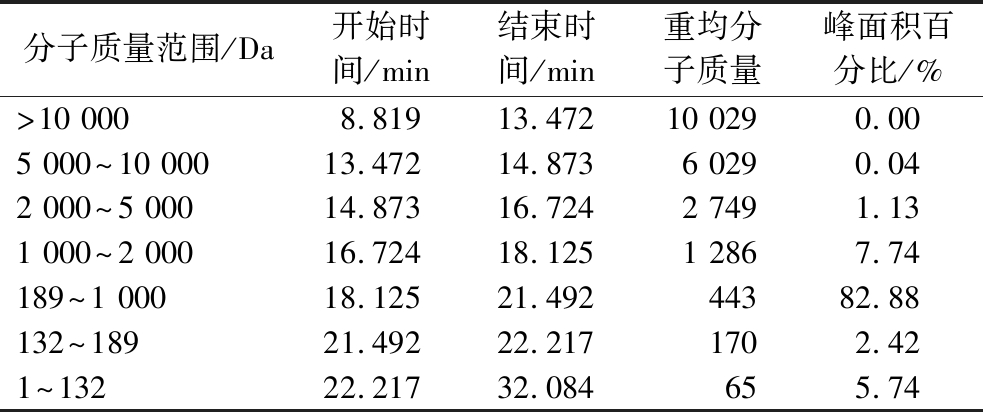
分子质量范围/Da开始时间/min结束时间/min重均分子质量峰面积百分比/%>10 0008.81913.47210 0290.005 000^10 00013.47214.8736 0290.042 000^5 00014.87316.7242 7491.131 000^2 00016.72418.1251 2867.74189^1 00018.12521.49244382.88132^18921.49222.2171702.421^13222.21732.084655.74
乌鸡肽的分子质量1 000 Da以上的只有8.91%,主要分布在1 000 Da以下,占分子质量总量的91.04%,其中主要集中在189~1 000,重均分子质量为507.8 Da。相对分子质量的大小与肽的吸收速率有直接的关系。目前认为,分子质量1 000 Da以下的多数为二肽、三肽和四肽,二肽和三肽的转运吸收存在独立系统以及相应的载体,三肽以上的转运机制还具有一定的争议[13]。小分子多肽进入人体后不需要进行消化可直接被人体吸收,具有主动性、完整性和载体功能等特点,且吸收速度比游离氨基酸快,并具有氨基酸不可比拟的生理功能和改善食品感官的效应[14-16]。
2.3 乌鸡肽的结构序列鉴定
原创肽段数据库包含二肽及三肽的肽段前体离子信息,无需再对样品进行分离纯化和Q3扫描,可以缩短结构鉴定周期,基于原创肽段数据库直接对乌鸡肽进行PIS扫描,采集肽段的碎片离子信息,以便获得其产物离子信息,若质谱图解析后有对应的产物离子信息,说明乌鸡肽中含有对应的肽段结构,结合已有文献报道的具有补血养血肽段的氨基酸组成含有Glu(E)、Gly(G)、Ala(A)、Arg(R)、Pro(P)[11-12]的特点,以及天冬氨酸和天冬酰胺对补血养血也有重要作用,从中筛选潜在的功能活性肽段。
在正离子模式碰撞能量分别为-25 V和-35 V的条件下对肽段前体离子进行碰撞,然后对产物离子谱图进行解析,以ER肽段为例说明,图2-a谱图解析后发现304.2是ER的前体离子,然后基于前体离子进一步碰撞得到产物离子谱图,如图2-b、图2-c所示,102.1是E的亚胺离子、130.2是E的b1离子、175.4和158.4分别是R的y1离子和z1离子,从而确定乌鸡肽样品中存在ER肽段,同理其他肽段经谱图解析共得到5条主要肽段序列,分别为Glu-Arg(ER)、Ile-Arg(IR)、Asn-Arg(NR)、Pro-Asp-Arg(PDR)、Ala-Ala-Arg(AAR)如表4所示。

a-前体离子;b、c-产物离子
图2 ER肽段的前体离子和产物离子
Fig.2 Precursor ions and product ions of ER peptide
表4 乌鸡肽中鉴定出的5条肽段序列
Table 4 Sequences of five peptides identified in silky fowl peptides

序号m/z序列相关的碎片离子信息1304.2Glu-Arg(ER)102.1-E(∗);130.2-E(b1);175.2-R(y1);158.1-R(z1)2288.3Ile-Arg(IR)86.0-I(∗);175.3-R(y1)l;158.2-R(z1)3289.3Asn-Arg(NR)87.1-N(∗);116.1-N(z1);175.4-R(y1);158.5-R(z1)4387.3Pro-Asp-Arg(PDR)70.0-P(∗);116.1-P(y1);116.1-D(b1);129.5-R(∗);158.0-R(z1);175.3-R(y1);185.3-PD(∗2);213.3-PD(y2)5317.4Ala-Ala-Arg(AAR)44.0-A(∗);72.1-A(b1);129.1-R(∗);143.1-AA(b2)
利用高效液相色谱-串联质谱法(high-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)自动优化功能对标准品进行了定量离子对和电压的优化,利用MRM优化参数对乌鸡肽各肽段进行了定量,肽段定量色谱图及校准曲线如图3所示。根据表5中校准曲线计算各肽段含量,分别为ER(4.28 mg/g)、IR(0.61 mg/g)、NR(0.38 mg/g)、PDR(0.38 mg/g)、AAR(0.14 mg/g)。乌鸡肽肽段含量大小为:ER>IR>PDR=NR>AAR。研究表明,细胞穿膜肽能够穿过细胞膜或组织屏障达到细胞内部,大多数细胞穿膜肽都具有精氨酸结构,因为精氨酸的胍基在细胞穿膜肽表面提供正电荷,与细胞膜中带负电荷的羧酸、磷酸基团能够相互作用形成氢键,从而穿过细胞膜进入细胞,含有精氨酸的肽段可能具有较好的生物功能活性,并且是潜在细胞渗透肽和分子载体[17-18]。从乌鸡肽中鉴定出的5条肽段的C端均有精氨酸残基,可能具有分子载体的潜力作为细胞穿膜进入细胞,从而发挥生理活性作用。

a-肽段标准品定量色谱图;b-乌鸡肽定量色谱图;c-校准曲线
图3 肽段标准品和乌鸡肽定量色谱图及校准曲线
Fig.3 Standards and silky fowl peptides quantitative chromatogram and calibration curve of peptides
表5 五条肽段的校准曲线方程
Table 5 Calibration curve equations of 5 peptides

肽段校准曲线方程R2值ERY=12 804.4X+511.6080.998IRY=59 081.0X+2 469.880.996NRY=4 651.78X-2 247.900.996PDRY=21 165.2X-2 951.850.996AARY=19 667.1X-13 801.30.995
3 结论
乌鸡肽的总蛋白含量为94.88%,肽含量(干基)为78.93%,氨基酸组成丰富,富含人体必需氨基酸和半必需氨基酸(组氨酸和精氨酸);乌鸡肽的分子质量<1 000 Da的肽段含量高达91.04%,以二肽和三肽为主;经超快速液相色谱串联三重四极杆质谱对乌鸡肽产物离子以及MRM优化进行扫描,并从中分离鉴定出5条潜在补血养血功能的肽段序列,包含3条二肽序列(ER、IR、NR)和2条三肽序列(PDR、AAR),为乌鸡肽补血养血的营养保健应用提供了一定的理论支持,但对于这些肽段补血养血的作用机制尚需进一步探讨。
[1] 王景升, 张时煌, 王彤, 等.泰和乌鸡肉营养成分特征分析[J].经济动物学报, 2019, 23(1):23-28.
WANG J S, ZHANG S H, WANG T, et al.Characteristics analysis of nutritional components in meat of Taihe silky fowl[J].Journal of Economic Animal, 2019, 23(1):23-28.
[2] 魏颖, 谷瑞增, 林峰, 等.乌鸡肽免疫调节作用的研究[J].食品研究与开发, 2014, 35(16):1-5.
WEI Y, GU R Z, LIN F, et al.The effect of black-bone chicken peptide on immunomodulatory[J].Food Research and Development, 2014, 35(16):1-5.
[3] 尚柯, 米思, 李侠, 等.泰和乌鸡、杂交乌鸡与市售白羽肉鸡的营养成分比较研究[J].肉类研究, 2017, 31(12):11-16.
SHANG K, MI S, LI X, et al.Comparative analysis of nutrients in breast muscles from Taihe black-bone silky fowls, crossbred black-boned silky fowls and AA broilers[J].Meat Research, 2017, 31(12):11-16.
[4] 王勇. 泰和乌骨鸡多肽若干功能活性研究[D].南昌:南昌大学, 2011.
WANG Y.Study on several functionalities of Taihe black-bone silky fowl peptides[D].Nanchang:Nanchang University, 2011.
[5] 孙磊. 乌鸡肽对于再生性贫血小鼠的治疗作用及其机制[D].大连:大连医科大学, 2021.
SUN L.Therapeutic effect of black chicken peptide on mice with regenerative Anemia and its mechanism[D].Dalian:Dalian Medical University, 2021.
[6] 林峰, 马勇, 徐亚光, 等.基于分子质量分布的食源性低聚肽品质评价[J].食品与发酵工业, 2008, 34(9):128-131.
LIN F, MA Y, XU Y G, et al.Study on the quality evaluation of food-derived oligopeptides based on the molecular weight distribution[J].Food and Fermentation Industries, 2008, 34(9):128-131.
[7] 张江涛, 冯晓文, 秦修远, 等.海洋蛋白低聚肽的抗氧化与降血压作用[J].中国食品学报, 2020, 20(11):63-70.
ZHANG J T, FENG X W, QIN X Y, et al.Antioxidation and blood pressure lowering effects of marine protein oligopeptides[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):63-70.
[8] 王雨晴, 姜盛, 郭颖, 等.紫苏籽低聚肽中营养及特征成分研究[J].食品与发酵工业, 2020, 46(18):19-23.
WANG Y Q, JIANG S, GUO Y, et al.Nutrition and characteristic components of perilla(Perilla frutescens L.Britt.)seed oligopeptides[J].Food and Fermentation Industries, 2020, 46(18):19-23.
[9] 陈亮, 王雨晴, 冀峰, 等.玉米低聚肽中焦谷氨酰亮氨酸(pEL)二肽的研究[J].食品与发酵工业, 2021, 47(3):49-52.
CHEN L, WANG Y Q, JI F, et al.Study on pEL dipeptide in corn oligopeptides[J].Food and Fermentation Industries, 2021, 47(3):49-52.
[10] 王雨晴, 毕园, 张瑞雪, 等.豌豆低聚肽中具有发挥功能活性潜力的结构研究[J].食品与发酵工业, 2020, 46(17):54-59.
WANG Y Q, BI Y, ZHANG R X, et al.Study on the structures of pea oligopeptides with potential functional activities[J].Food and Fermentation Industries, 2020, 46(17):54-59.
[11] 欧金秀, 谷陟欣, 张妮瑜, 等.柱前衍生HPLC同时测定驴胶补血颗粒中6种水解氨基酸[J].中国实验方剂学杂志, 2012, 18(16):93-96.
OU J X, GU Z X, ZHANG N Y, et al.Determination of 6 amino acids in Lujiao Buxue Keli by pre-column derivation HPLC[J].Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(16):93-96.
[12] 张虹, 曹广生, 卢延斌.一种从鱼皮中提取补血肽的方法及其制品:中国, CN112661809A[P].2021-4-16.
ZHANG H, CAO G S, LU Y B.A kind of method and product of extracting hemopeptide from fish skin:China, CN112661809A[P].2021-4-16.
[13] 张江涛, 秦修远, 周明, 等.林蛙低聚肽的体外抗氧化与ACE抑制作用[J].中国食品添加剂, 2019, 30(6):46-53.
ZHANG J T, QIN X Y, ZHOU M, et al.Antioxidant and ACE inhibition of Rana oligopeptides in vitro[J].China Food Additives, 2019, 30(6):46-53.
[14] 白芳, 李映红, 黄飞娟, 等.乌鸡肽的营养成分及其功能特性研究[J].食品研究与开发, 2019, 40(2):17-21.
BAI F, LI Y H, HUANG F J, et al.Study on nutritional composition and functional properties of peptides from black-bone silky fowl(Gallus gallus domesticus brisson)[J].Food Research and Development, 2019, 40(2):17-21.
[15] 方磊, 李国明, 徐珊珊, 等.牡蛎肽和三文鱼皮胶原肽低致敏性和抗过敏活性研究[J].食品与发酵工业, 2018, 44(9):91-97.
FANG L, LI G M, XU S S, et al.Study of low sensitization and antiallergic activity of oyster peptides and salmon skin collagen peptides[J].Food and Fermentation Industries, 2018, 44(9):91-97.
[16] SHEN W L, MATSUI T.Current knowledge of intestinal absorption of bioactive peptides[J].Food &Function, 2017, 8(12):4306-4314.
[17] WENDER P A, GALLIHER W C, GOUN E A, et al.The design of guanidinium-rich transporters and their internalization mechanisms[J].Advanced Drug Delivery Reviews, 2008, 60(4-5):452-472.
[18] SHIRAZI A N, EL-SAYED N S, MANDAL D, et al.Cysteine and arginine-rich peptides as molecular carriers[J].Bioorganic &Medicinal Chemistry Letters, 2016, 26(2):656-661.