鸡蛋是食品工业中非常重要的原料,也是人类日常食物来源,具有很高的营养价值,但其诱发的过敏反应,对健康不利,对婴幼儿来说更为严重[1]。卵清蛋白(ovalbumin, OVA)是主要的鸡蛋过敏原,分子质量为45 kDa,PI 4.5,有385个氨基酸残基[2],其致敏表位分布在整个氨基酸序列和空间构象中,由其引发的过敏反应极大地限制了蛋类制品的应用和发展[3]。
微波[2]、热处理[4]、辐照[5]、高压[6]以及糖基化修饰[7]等被用来消减过敏蛋白的致敏性,其中糖基化修饰是一种行之有效的蛋白质脱敏技术。糖基化反应不仅能够提高蛋白质的功能性质,还能显著影响蛋白质的致敏性[1-2]:课题组研究发现,糖基化修饰能够破坏α-乳白蛋白的过敏表位,使其IgE结合能力显著降低[8];胥伟等[9]报道,糖基化修饰可提高OVA的凝胶硬度、弹性、凝聚性与持水性等功能特性;杨逸鹏[10]采用单糖对OVA进行糖基化修饰,发现不同单糖显著增加OVA中的β-折叠含量和分子动力学稳定性,同时降低其致敏性。糖基化修饰能改变蛋白的结构,提高其功能活性,但以葡萄糖为单体的不同糖链如麦芽糖、麦芽三糖和麦芽五糖对OVA的结构、抗氧化能力和致敏性的影响鲜有报道。
本文以OVA为原料,选用葡萄糖、麦芽糖、麦芽三糖、麦芽五糖分别对OVA进行糖基化修饰,通过电泳、光谱等技术分析其结构和抗氧化能力变化,并采用酶联免疫吸附实验,KU812细胞模型研究糖基化修饰前后OVA致敏性的变化。
葡萄糖,北京索莱宝科技有限公司;麦芽糖、OVA、山羊抗人IgE-辣根过氧化物酶、山羊抗兔IgG-辣根过氧化物酶,美国Sigma公司;麦芽三糖,上海源叶生物科技有限公司;麦芽五糖、邻苯二甲醛,上海阿拉丁生化科技股份有限公司;鸡蛋过敏血清,美国Plasma Lab International公司;兔血清,实验室自制;其他试剂均为分析纯。受试人员信息见表1。
表1 鸡蛋过敏患者信息
Table 1 The information of egg allergy patients

血清编号年龄性别IgE/(kU/L)临床症状PL 2532924女22.0过敏性鼻炎PL 2583031男25.3过敏性鼻炎,食物过敏PL 2636420女25.6过敏性鼻炎
Spectrum-one型傅里叶变换红外光谱仪,美国Perkin Elmer公司;超滤离心管(3 kDa),美国Millipore公司;Mini-Protean电泳仪,美国Bio-Rad公司;U-2910型紫外可见分光光度计、F-7000型荧光光谱仪,日本Hitachi公司;Synergy H1型酶标仪,美国BioTek公司。
1.3.1 样品制备
参考刘俊[11]的实验方法。分别将1.0 mg/mL葡萄糖、麦芽糖、麦芽三糖、麦芽五糖溶于等质量的OVA溶液中,混匀后冻干,采用干法制备糖基化样品。葡萄糖、麦芽糖、麦芽三糖、麦芽五糖共价修饰的OVA分别命名为OVA-G、OVA-M、OVA-MT和OVA-MP。
1.3.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳
参照LIU等[12]报道的方法,采用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)法分析OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的分子质量变化。
1.3.3 游离氨基含量和反应程度
参照刘俊[11]的方法略作修改。使用邻苯二甲醛法测定1.0 mg/mL OVA、OVA-G、OVA-M、OVA-MT和OVA-MP中的游离氨基含量。反应程度按照公式(1)计算:
反应程度![]()
(1)
式中:ρ,OVA中游离氨基含量,mg/mL;ρ0,OVA与葡萄糖、麦芽糖、麦芽三糖和麦芽五糖反应生成络合物的游离氨基含量,mg/mL。
1.3.4 荧光性晚期糖基化终末产物(advanced glycation end products, AGEs)的测定
采用荧光光谱仪测定。
1.3.5 红外吸收强度
将冻干样品和KBr粉末以1∶10的质量比混合研磨,然后将粉末压薄放入傅里叶变换红外光谱仪内,设定波段为4 000~400 cm-1,分辨率为4 cm-1。
1.3.6 紫外吸收强度
采用紫外可见分光光度计测定1.0 mg/mL OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的紫外吸收强度。
1.3.7 内源荧光强度
采用刘俊等[8]的方法,用荧光光谱仪测定。
1.3.8 抗氧化能力测定
1.3.8.1 ABTS阳离子自由基清除能力测定
参照张露等[13]的方法并略作修改。将样品分别稀释至3、2、1.5、1、0.5 mg/mL,并配制相同质量浓度的谷胱甘肽溶液作为阳性对照,取50 μL样品溶液,加入稀释后的阳离子自由基溶液150 μL,室温反应30 min后,在734 nm下测其吸光值。其清除率按公式(2)计算:
清除率![]()
(2)
式中:As,50 μL样品溶液+150 μL ABTS阳离子自由基溶液的吸光值;Ab,蒸馏水代替ABTS阳离子自由基溶液的吸光值;Ac,蒸馏水代替样品溶液的吸光值。
1.3.8.2 DPPH自由基清除能力
参照王晗等[14]的方法并略作修改。配制DPPH母液,室温避光条件下保存,将其稀释至在517 nm的吸光值为0.7左右。将样品分别用蒸馏水稀释至3、2、1.5、1、0.5 mg/mL,谷胱甘肽溶液作为阳性对照,取50 μL样品溶液,加入150 μL DPPH溶液,反应30 min后,在酶标仪517 nm条件下测其吸光值。其清除率按公式(3)计算:
清除率![]()
(3)
式中:A1,50 μL样品溶液+150 μL DPPH溶液的吸光值;A2,蒸馏水代替DPPH溶液的吸光值;A0,蒸馏水代替样品溶液的吸光值。
1.3.8.3 ![]() 清除能力的测定
清除能力的测定
参照李利华[15]的方法略作修改。OVA、OVA-G、OVA-M、OVA-MT和OVA-MP样品分别用蒸馏水稀释至3、2、1.5、1、0.5 mg/mL,将75 μL样品溶液和75 μL Tris-HCL加入酶标板中,室温静置10 min后,加入50 μL的焦性没食子酸溶液,5 min后,酶标仪320 nm下测定其吸光值,每间隔1 min测定1次,测定10 min。谷胱甘肽代替样品作为阳性对照,水代替样品作为空白对照。其清除率按公式(4)计算:
清除率![]()
(4)
式中:ΔA0,空白对照组的吸光值曲线斜率;ΔAs,样品组的吸光值曲线斜率。
1.3.9 IgG/IgE结合能力测定
参照毛积华等[16]的方法略作修改,采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法测定。IgG所用的一抗稀释度为1∶1×106,二抗为山羊抗兔IgG-辣根过氧化物酶,稀释度为1∶5 000;IgE所用的一抗稀释度为1∶160,二抗为山羊抗人IgE-辣根过氧化物酶,稀释度为1∶400。以IC50为指标,IgG/IgE结合能力的抑制率按照公式(5)计算:
抑制率![]()
(5)
式中:A,添加样品的吸光值;A0,用抗体稀释液代替样品的阳性对照吸光值。
1.3.10 KU812细胞脱颗粒实验
参照APPEL等[17]的方法,在37 ℃ 5% CO2培养箱中,用含有10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基培养KU812细胞,当细胞数量达到1×106个时,将细胞按照1 mL/孔接种于24孔板培养24 h后用10 μL鸡蛋过敏患者血清被动激活24 h,加入50 μL/孔(1.0 mg/mL)OVA、OVA-G、OVA-M、OVA-MT和OVA-MP刺激4 h,用PBS缓冲液处理的细胞作为阴性对照,采用ELISA法测定KU812细胞释放白介素-6(interleukin-6,IL-6)和β-氨基己糖苷酶(β-animo hexosidase, Hex)的能力。
1.3.11 数据处理
所有实验均重复3次,采用SPSS 24.0软件分析单因素数据间的显著性差异(P<0.05),所有数据作图均采用Origin 2021软件。
2.1.1 SDS-PAGE
由图1所示,OVA分子质量为45 kDa,有385个氨基酸残基[2]。与OVA的条带相比,OVA-G、OVA-M、OVA-MT和OVA-MP蛋白条带有明显上移,且未见其他蛋白条带,说明葡萄糖、麦芽糖、麦芽三糖、麦芽五糖分别共价交联了OVA,生成了高分子质量糖基化产物[18]。

图1 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的SDS-PAGE图
Fig.1 SDS-PAGE patterns of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.1.2 游离氨基含量和反应程度
如表2所示,与OVA相比,OVA-G、OVA-M、OVA-MT和OVA-MP的游离氨基含量显著降低(P<0.05),顺序依次为OVA-MP、OVA-MT、OVA-M、OVA-G。表明4种还原糖与OVA发生了糖基化反应,其中OVA-G游离氨基含量最低;与OVA-G的反应程度相比,OVA-M、OVA-MT和OVA-MP的反应程度逐渐减弱(P<0.05),可能是由于分子质量越小的糖越容易与OVA发生糖基化反应,被糖基化修饰的位点越多,游离氨基含量越少[19],而麦芽糖、麦芽三糖、麦芽五糖随着糖链长度的增加,空间位阻变大,导致糖基化反应程度趋弱,糖基化的反应程度由强到弱依次为:OVA-G、OVA-M、OVA-MT、OVA-MP。
表2 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的游离氨基含量和反应程度
Table 2 Free amino content and reaction extent of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
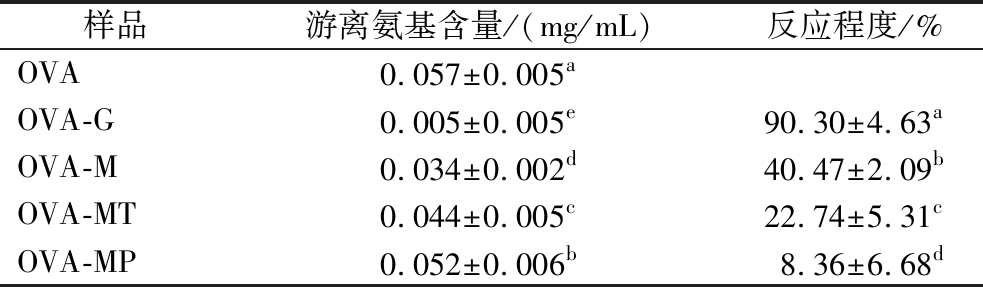
注:不同小写字母表示显著性差异(P<0.05)(下同)。
样品游离氨基含量/(mg/mL)反应程度/%OVA0.057±0.005aOVA-G0.005±0.005e90.30±4.63aOVA-M0.034±0.002d40.47±2.09bOVA-MT0.044±0.005c22.74±5.31cOVA-MP0.052±0.006b8.36±6.68d
2.1.3 荧光AGEs含量
如图2所示,与OVA相比,OVA-G、OVA-M、OVA-MT和OVA-MP的AGEs含量均显著升高(P<0.05),顺序依次为OVA-G、OVA-M、OVA-MT、OVA-MP。这是因为葡萄糖的空间位阻小,容易与OVA发生糖基化反应,生成更多的糖基化产物,而麦芽糖、麦芽三糖、麦芽五糖随着糖链长度的增加,空间位阻增大,糖基化反应程度趋弱,生成的糖基化产物少[20]。结果表明糖基化反应程度由强到弱依次为葡萄糖、麦芽糖、麦芽三糖、麦芽五糖,这与游离氨基含量的趋势相同。

图2 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的荧光AGEs含量
Fig.2 Fluorescent AGEs content of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.1.4 红外吸收强度
如图3所示,在波数3 500~3 200 cm-1,OVA-G、OVA-M、OVA-MT和OVA-MP的吸收峰值与OVA相比均有不同程度的增大,而此范围是羟基伸缩振动的区域,说明不同的糖分子与OVA以共价方式结合,从而导致羟基含量增加。在波长1 000~1 250 cm-1处OVA-G、OVA-M、OVA-MT和OVA-MP吸收峰强度增加,可能是OVA发生了糖基化反应,从而导致C—O和C—N的伸缩振动[21]。

图3 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的红外光谱图
Fig.3 Infrared spectra of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.1.5 紫外吸收强度
如图4所示,OVA、OVA-G、OVA-M、OVA-MT和OVA-MP在最大吸收峰在278 nm左右,说明发色基团主要是色氨酸和酪氨酸[22]。与OVA相比,OVA-G、OVA-M、OVA-MT和OVA-MP紫外吸收强度都有不同程度降低,可能是在反应过程中不同糖分子的接入,使得芳香族氨基酸残基被遮蔽,降低了紫外吸收强度,结果说明糖基化修饰能改变OVA的构象结构,且糖基化反应程度越高,对OVA结构的影响越明显。

图4 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的紫外-可见吸收光谱
Fig.4 UV-Vis absorption spectra of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.1.6 内源荧光强度
如图5所示,与OVA相比,OVA-MP、OVA-MT、OVA-M、OVA-G的荧光强度逐渐降低,这是由于不同糖分子的接入,会使OVA的色氨酸区域遮蔽,同时糖基化反应可以使OVA结构展开,使得荧光发色团与溶剂相互作用,发生荧光淬灭,改变其三级结构,导致OVA荧光强度降低[16,23]。葡萄糖与OVA的反应最剧烈,对OVA构象的影响最大,其次为麦芽糖、麦芽三糖和麦芽五糖。

图5 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的内源荧光强度
Fig.5 Fluorescence intensity of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.2.1 ABTS阳离子自由基清除能力
如图6所示,OVA的IC50为1.72 mg/mL,OVA-G、OVA-M、OVA-MT和OVA-MP的IC50分别为1.37、1.39、1.49、1.63 mg/mL。这说明糖基化处理能够增加OVA的ABTS阳离子自由基清除能力,主要是由于糖基化反应过程中产生具有供氢能力的中间产物和具有较强还原性的糖基化产物,从而提高了抗氧化能力[24],其中OVA-G的ABTS阳离子自由基清除能力最强,这是因为葡萄糖分子量小,空间位阻小,越容易与OVA发生糖基化反应,生成具有抗氧化能力的糖基化产物,而麦芽糖、麦芽三糖、麦芽五糖随着糖链长度的增加,糖基化程度趋弱,生成的糖基化产物少,抗氧化能力趋弱。

图6 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的ABTS阳离子自由基清除能力
Fig.6 ABTS cationic free radical scavenging ability of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
2.2.2 DPPH自由基清除能力
如图7所示,与OVA相比,糖基化修饰的OVA的DPPH自由基清除能力有不同程度提高,由强至弱依次为OVA-G、OVA-M、OVA-MT、OVA-MP,其中OVA-G最高达到了58.75%,说明糖基化反应会提高蛋白质的DPPH自由基清除能力,这种现象是由于糖基化反应产生的还原酮提供了H+等抗氧化物质,并且糖基化反应程度越高,抗氧化能力越强[25],这与ABTS阳离子自由基清除能力的研究结果一致。

图7 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的DPPH自由基清除能力
Fig.7 DPPH free radical scavenging ability of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
![]() 清除能力
清除能力
如图8所示,OVA的![]() 清除能力很低,但OVA-G、OVA-M、OVA-MT和OVA-MP的
清除能力很低,但OVA-G、OVA-M、OVA-MT和OVA-MP的![]() 清除能力有不同程度提高,且其抑制率随着浓度的升高而增强。说明糖基化修饰能够提高OVA的
清除能力有不同程度提高,且其抑制率随着浓度的升高而增强。说明糖基化修饰能够提高OVA的![]() 清除能力,由强到弱依次为OVA-G、OVA-M、OVA-MT、OVA-MP。
清除能力,由强到弱依次为OVA-G、OVA-M、OVA-MT、OVA-MP。

图8 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的![]() 清除能力
清除能力
Fig.8 The superoxide anion scavenging ability of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
图9-a显示了IgG结合能力,OVA的IC50值为8.65 μg/mL,OVA-G、OVA-M、OVA-MT和OVA-MP的IC50值分别为15.17、13.38、12.48和9.34 μg/mL,与OVA的IgG结合能力相比,不同糖均能降低OVA的IgG结合能力;图9-b为IgE结合能力,可以观察到与IgG结合能力呈现相同趋势。IgG/IgE结合能力趋势由低至高依次为OVA-MP、OVA-MT、OVA-M、OVA-G,这是由于葡萄糖的糖链短,分子活力强,更容易与OVA发生糖基化反应,破坏其过敏表位,而麦芽糖、麦芽三糖、麦芽五糖的糖链逐渐增长,分子活力趋弱,对过敏表位影响趋弱[26]。结果表明,不同糖分子对OVA进行糖基化处理能够降低其IgG/IgE结合能力,糖链越短,糖基化反应程度越高,对OVA的过敏表位影响越大,导致消减致敏性的能力越强。

a-IgG;b-IgE
图9 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的IgG和IgE结合能力
Fig.9 IgG and IgE binding capacity of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP
如图10所示,与对照组相比,OVA、OVA-G、OVA-M、OVA-MT和OVA-MP的IL-6和Hex含量显著增加(P<0.05),说明OVA可诱导过敏相关因子的释放。与OVA相比,OVA-G、OVA-M、OVA-MT和OVA-MP刺激后的KU812细胞释放的IL-6和Hex含量均显著降低(P<0.05),这是由于糖基化修饰的OVA诱导嗜碱性粒细胞脱颗粒的程度较弱,减弱了效应细胞分泌IL-6和Hex的能力[27],其中OVA-G的IL-6和Hex的释放量最低(P<0.05),然后依次是OVA-M、OVA-MT和OVA-MP,这与IgG/IgE结合能力的结果一致。结果表明,不同糖修饰的OVA能够降低IL-6和Hex的分泌含量,降低过敏反应。

a-IL-6;b-Hex
图10 OVA、OVA-G、OVA-M、OVA-MT和OVA-MP对KU812细胞释放IL-6和Hex能力的影响
Fig.10 Effects of OVA, OVA-G, OVA-M, OVA-MT, and OVA-MP on the release of IL-6 and Hex in KU812 cells
本研究表明OVA经过葡萄糖、麦芽糖、麦芽三糖和麦芽五糖修饰后,其结构发生改变,表现在OVA的分子质量、AGEs含量、糖基化程度增强,游离氨基含量、紫外吸收强度和内源荧光吸收强度的降低;同时不同糖分子均能增加OVA的抗氧化能力和降低其致敏性。糖链的长短与OVA的抗氧化能力密切相关,糖链越短,糖基化程度越高,越有利于糖基化产物的生成,导致具有较高的抗氧化活性。此外,糖链的长短也会影响OVA的致敏性。葡萄糖的分子量小,糖链短,空间位阻小,更易与OVA发生糖基化反应,显著破坏其过敏表位,降低其致敏性,而麦芽糖、麦芽三糖、麦芽五糖随着糖链的增加,空间位阻变大,与OVA的反应程度变弱,对OVA的过敏表位破坏能力也减弱。综上所述,不同长度的糖链能不同程度地改变OVA的结构,提高其抗氧化能力和降低其致敏性。本研究结果可为生产高抗氧化能力和低致敏性蛋类制品提供理论基础,但功能活性的评价并不完全,未来将进行动物实验以及临床实验来验证其效果。
[1] 王亚婷. 不同二糖糖基化修饰在卵清蛋白改性中的应用研究[D].南昌:南昌大学, 2021.
WANG Y T.Application of glycation of different disaccharides in modification of ovalbumin[D].Nanchang:Nanchang University, 2021.
[2] 胡月明. 微波场内卵清蛋白糖基化反应的研究[D].南昌:南昌大学, 2014.
HU Y M.The research on ovalbumin glycation under microwave field[D].Nanchang:Nanchang University, 2014.
[3] TAN J W, JOSHI P.Egg allergy:An update[J].Journal of Paediatrics and Child Health, 2014, 50(1):11-15.
[4] BLOOM K A, HUANG F R, BENCHARITIWONG R, et al.Effect of heat treatment on milk and egg proteins allergenicity[J].Pediatric Allergy and Immunology, 2014, 25(8):740-746.
[5] LI Z X, LIN H, CAO L M, et al.The influence of gamma irradiation on the allergenicity of shrimp (Penaeus vannamei)[J].Journal of Food Engineering, 2007, 79(3):945-949.
[6] 豆玉新. 动态超高压微射流均质对卵清蛋白改性机理的研究[D].南昌:南昌大学, 2008.
DOU Y X.Study of the dynamic high pressure microfluidization on modification and mechanism of ovalbumin[D].Nanchang:Nanchang University, 2008.
[7] AN H J, PEAVY T R, HEDRICK J L, et al.Determination of N-glycosylation sites and site heterogeneity in glycoproteins[J].Analytical Chemistry, 2003, 75(20):5628-5637.
[8] 刘俊, 王阳, 熊子豪, 等.糖基化、磷酸化及乙酰化修饰对α-乳白蛋白致敏性和人肠道菌群的影响[J].食品与发酵工业, 2021, 47(17):91-97.
LIU J, WANG Y, XIONG Z H, et al.Effects of glycation, phosphorylation and acetylation on allergenicity and human intestinal microbiota of α-lactalbumin[J].Food and Fermentation Industries, 2021, 47(17):91-97.
[9] 胥伟, 迟玉杰, 孙强.糖基化卵清蛋白的凝胶性与凝胶稳定性[J].食品科学, 2012, 33(15):15-18.
XU W, CHI Y J, SUN Q.Gelling properties and stability of glycated egg white protein[J].Food Science, 2012, 33(15):15-18.
[10] 杨逸鹏. 糖基化修饰制备低敏卵清蛋白及其机初探[D].南昌:南昌大学, 2020.
YANG Y P.Preparation of hypoallergenic ovalbumin by glycation and its modification mechanism[D].Nanchang:Nanchang University, 2020.
[11] 刘俊. 超声波辅助糖基化修饰对蛋白质功能性质的影响及机制初探[D].南昌:江西师范大学, 2018.
LIU J.Effect and mechanism of ultrasonication assisted with glycation on the functional properties of proteins[D].Nanchang:Jiangxi Normal University, 2018.
[12] LIU J, TU Z C, ZHANG L, et al.Influence of ultrasonication prior to glycation on the physicochemical properties of bovine serum albumin:Galactose conjugates[J].Food Science and Technology Research, 2018, 24(1):35-44.
[13] 张露, 刘鹏飞, 涂宗财, 等.香榧不同部位提取物的抗氧化和酶抑制活性比较分析[J].食品科学, 2018, 39(10):78-83.
ZHANG L, LIU P F, TU Z C, et al.Comparison of antioxidant activity and enzyme inhibitory activity of different plant parts of Torreya grandis cv.merrillii[J].Food Science, 2018, 39(10):78-83.
[14] 王晗, 朱华平, 李文钊, 等.桑葚提取物中花青素分析及其体外抗氧化活性研究[J].食品与发酵工业, 2019, 45(15):170-175.
WANG H, ZHU H P, LI W Z, et al.Anthocyanins in mulberry extract and their in vitro antioxidant activity[J].Food and Fermentation Industries, 2019, 45(15):170-175.
[15] 李利华. 黑胡椒提取物的抗氧化活性研究[J].中国调味品, 2016, 41(9):36-39.
LI L H.Study on antioxidant activity of the extracts from black pepper[J].China Condiment, 2016, 41(9):36-39.
[16] 毛积华, 王辉, 涂宗财, 等.己糖修饰的糖基化卵清蛋白产物及其致敏性分析[J].食品与机械, 2020, 36(6):11-15;98.
MAO J H, WANG H, TU Z C, et al.Analysis of glycation products and sensitization of ovalbumin modified by different hexoses[J].Food &Machinery, 2020, 36(6):11-15;98.
[17] APPEL K, MUNOZ E, NAVARRETE C, et al.Immunomodulatory and inhibitory effect of immulina®, and immunloges® in the Ig-E mediated activation of RBL-2H3 cells.A new role in allergic inflammatory responses[J].Plants, 2018, 7(1):13.
[18] 张敏, 涂宗财, 王辉, 等.糖基化鳕鱼小清蛋白消化过程中的致敏性[J].食品与机械, 2020, 36(6):16-22.
ZHANG M, TU Z C, WANG H, et al.Study on the sensitization of glycated parvalbumin from Alaska pollock during simulated digestion[J].Food &Machinery, 2020, 36(6):16-22.
[19] NAKAMURA A, WATANABE K, OJIMA T, et al.Effect of Maillard reaction on allergenicity of scallop tropomyosin[J].Journal of Agricultural and Food Chemistry, 2005, 53(19):7559-7564.
[20] CHEN Y J, LIU X M, LABUZA T P, et al.Effect of molecular size and charge state of reducing sugars on nonenzymatic glycation of β-lactoglobulin[J].Food Research International, 2013, 54(2):1560-1568.
[21] 陈思如. 低聚木糖糖基化改性酪蛋白的功能特性及应用[D].长春:吉林大学, 2022.
CHEN S R.Functional characteristics and application of glucosylated casein modified by xylooligosaccharides[D].Changchun:Jilin University, 2022.
[22] BI H N, TANG L, GAO X, et al.Spectroscopic analysis on the binding interaction between tetracycline hydrochloride and bovine proteins β-casein, α-lactalbumin[J].Journal of Luminescence, 2016, 178:72-83.
[23] CHEN W M, CHEN Q Z, ZHOU H Z, et al.Structure and allergenicity of α-lactalbumin:Effects of ultrasonic prior to glycation and subsequent phosphorylation[J].Food Science and Human Wellness, 2023, 12(3):825-831.
[24] 卜单, 涂宗财, 刘光宪, 等.不同还原糖糖基化对超声波预处理α-乳白蛋白结构和抗氧化活性的影响[J].食品科学, 2022, 43(24):1-6.
BU D, TU Z C, LIU G X, et al.Effect of glycation with different reducing saccharides on conformation and antioxidant activities of ultrasonic pretreated α-lactalbumin[J].Food Science, 2022, 43(24):1-6.
[25] MA Y E, LIU Y E, YU H Y, et al.Biological activities and in vitro digestion characteristics of glycosylated α-lactalbumin prepared by microwave heating:Impacts of ultrasonication[J].LWT, 2022, 158:113141.
[26] LI J L, LIU J, YE Y H, et al.Reduced IgE/IgG binding capacities of bovine α-lactalbumin by glycation after dynamic high-pressure microfluidization pretreatment evaluated by high resolution mass spectrometry[J].Food Chemistry, 2019, 299:125166.
[27] WU Y T, LU Y Y, HUANG Y H, et al.Glycosylation reduces the allergenicity of turbot (Scophthalmus maximus) parvalbumin by regulating digestibility, cellular mediators release and Th1/Th2 immunobalance[J].Food Chemistry, 2022, 382:132574.