羊乳是世界公认最接近母乳的乳品,被誉为“乳中珍品”。来自联合国粮食及农业组织的数据显示,2018年全球羊奶产量已达1 500万t以上,成为全球第三大生产类型的乳品[1]。乳清是奶酪制作过程中的副产物,由水(93%~94%)、乳糖、可溶性乳蛋白α-乳白蛋白(α-lactalbumin, α-La)和β-乳球蛋白(β-lactoglobulin, β-Lg)、乳铁蛋白、免疫球蛋白、酪蛋白大肽、乳脂、钙、B族维生素、支链氨基酸、含硫氨基酸和8种必需氨基酸组成[2],质量较高的乳清可应用于婴幼儿奶粉的添加。乳清蛋白约占乳品中总蛋白20%,钙和磷含量约为总钙和总磷的38%和50%[3]。乳清中含有的生物活性因子可增强肠道免疫应答,并促进学习以及记忆能力,可能有助于婴儿生长发育[4]。
常用乳清蛋白的分离方法有等电点沉淀法(碱溶酸沉)、盐析法、膜过滤法、泡沫分离法和离子交换色谱法等[5]。MARUYAMA等[6]研究表明,在pH为7时泡沫分离法对乳清蛋白的分离效果最好和分离速率最高[6]。SANMART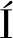 N等[7]利用热钙沉淀法分离出澄清乳清,通过膜技术生产绵羊乳清浓缩蛋白。邵钺馨等[3]发现单一处理不能较好去除羊奶中的酪蛋白,使用离心结合等电点沉淀法对羊奶中酪蛋白去除率较高。陈静廷等[8]研究发现超速离心和等电点沉淀法均可以有效去除乳制品中的酪蛋白,并且一些含量较低的蛋白检出的灵敏度增加。酸法等电点沉淀和酶解法对牛奶中酪蛋白的去除率较高,其中乳酸去除酪蛋白和保留乳清蛋白的效果比柠檬酸和盐酸法好[9]。然而大多数分离方法都具有一定缺点,如色谱法效率低且成本太高;碱、热等条件可能会影响蛋白结构,造成蛋白质变性,破坏营养蛋白等,对乳清蛋白的分离效果都并不理想。酸沉淀法能快速将乳中的酪蛋白分离,得到酸乳清。这种方法得到乳清的成本低,耗时短,是常用的乳清分离方法,但是不同酸对酪蛋白的去除效果和对乳清成分的影响尚不明确。
N等[7]利用热钙沉淀法分离出澄清乳清,通过膜技术生产绵羊乳清浓缩蛋白。邵钺馨等[3]发现单一处理不能较好去除羊奶中的酪蛋白,使用离心结合等电点沉淀法对羊奶中酪蛋白去除率较高。陈静廷等[8]研究发现超速离心和等电点沉淀法均可以有效去除乳制品中的酪蛋白,并且一些含量较低的蛋白检出的灵敏度增加。酸法等电点沉淀和酶解法对牛奶中酪蛋白的去除率较高,其中乳酸去除酪蛋白和保留乳清蛋白的效果比柠檬酸和盐酸法好[9]。然而大多数分离方法都具有一定缺点,如色谱法效率低且成本太高;碱、热等条件可能会影响蛋白结构,造成蛋白质变性,破坏营养蛋白等,对乳清蛋白的分离效果都并不理想。酸沉淀法能快速将乳中的酪蛋白分离,得到酸乳清。这种方法得到乳清的成本低,耗时短,是常用的乳清分离方法,但是不同酸对酪蛋白的去除效果和对乳清成分的影响尚不明确。
本研究拟以鲜羊奶为原料,研究5种乳清提取方法(离心法、盐酸法、乙酸法、柠檬酸法和乙醇分级沉淀法)对酪蛋白的去除率的效果,并对5种方法得到的乳清进行指标测定,评估各方法的分离提取效果,期望获得纯度较高和品质较好的乳清蛋白。
1 材料与方法
1.1 材料与试剂
鲜羊奶购买于陕西省西安市长安区奶山羊养殖大户,羊奶采集后放置在冰盒中于4 ℃,带回实验室。盐酸、乙酸、柠檬酸、无水乙醇、尿素,均为分析纯,天津市科密欧化学试剂有限公司;5,5′-二硫双(2-硝基苯甲酸)(dithio-bis-nitrobenzoic acid,DTNB)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),美国Thermo Fisher Scientific公司;甘氨酸,美国Sigma公司;三羟甲基氨基甲烷(Tris),北京Biotopped公司。
1.2 主要仪器
NanoBrook 90Plus PALS型激光粒度Zeta电位仪,美国布鲁克海仪器公司;TM3030型台式扫描电子显微镜,日本日立公司;Nicolet iS10型傅里叶红外光谱分析仪,美国赛默飞世尔公司;NS800型色差仪,深圳三恩驰科技有限公司;TGL-16gR型离心机,上海安亭科学仪器厂;UV-1200紫外可见分光光度计,上海美析仪器有限公司;PHS-3C型雷磁精密pH计,上海精密科学仪器有限公司。
1.3 乳清制备
鲜羊奶在4 ℃下7 500 r/min离心20 min进行脱脂,得到的脱脂羊奶分5组,每组50 mL。离心法提取乳清:4 ℃、12 000 r/min离心30 min,收集上清液;盐酸法、乙酸法和柠檬酸法提取乳清:分别用1 mol/L盐酸、10%(体积分数)乙酸和1 mol/L柠檬酸调pH值至4.3后,4 ℃、5 000 r/min离心10 min,获得的上清液为乳清;乙醇分级沉淀提取乳清参考邵钺馨等[3]的方法。
1.4 酪蛋白去除率测定
1.4.1 乳清中总蛋白浓度测定
乳清中蛋白浓度依据二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒进行测定。
1.4.2 SDS-PAGE分析
参考CHEN等[10]的方法,并稍作改进。配制12%分离胶灌入胶板中,待分离胶凝固后,配6%浓缩胶于胶板中,并快速插好梳子等待凝固。将乳清与蛋白上样缓冲液混合后95 ℃加热5 min使蛋白质完全变性,每个样品上样10 μL,进行凝胶电泳。电泳结束后,使用考马斯亮蓝R250染色2 h,用脱色液脱色直至条带清晰可见,使用凝胶成像仪对蛋白条带进行拍照,得到的条带使用Image J进行灰度分析。
1.5 酪蛋白去除率测定
1.5.1 色泽测定
取5 mL分离的乳清于培养皿中进行感官颜色观察,后使用色差仪进行色泽测定。首先,色差仪进行黑白板矫正,待矫正结束后进行乳清色泽测定。
1.5.2 乳清微观结构观察
参考TANG等[11]的方法,并稍作改进。将不同分离方法得到的乳清进行冷冻干燥,取乳清粉放置在导电胶上,喷金后进行扫描电子显微镜观察。
1.5.3 粒径和Zeta电位测定
参考MARKOSKA等[12]的方法,并稍作改进。取适量乳清稀释100倍,使用激光粒度Zeta电位仪进行粒度和电位测定。测定粒度的参数:测定温度25 ℃,平衡时间60 s,测定时间90 s;测定Zeta电位的参数:测定温度25 ℃,平衡时间90 s,循环次数20次。
1.5.4 傅里叶红外光谱测定
参考TANG等[11]的方法。取少量烘干的乳清粉与KBr以1∶200的质量比例研磨并均匀混合后压片,使用傅里叶红外光谱仪进行测定。参数设置:波束范围4 000~400 cm-1,分辨率4 cm-1,扫描次数30次。
1.5.5 游离巯基含量测定
参考沈海斌等[13]的方法。取0.5 mL稀释后样品,加入5 mL尿素缓冲溶液(尿素240 g,Tris 5.2 g,甘氨酸3.45 g,EDTA 0.6 g,蒸馏水定容至500 mL,pH 8.0),再加入20 μL的埃尔曼试剂(DTNB 200 mg,溶解于Tris 520 mg,甘氨酸 345 mg,EDTA 60 mg,pH 8.0,定容至50 mL溶液),避光反应15 min,使用紫外分光光度计在412 nm处测定吸光度。根据公式(1)计算游离巯基含量[14]:
(1)
式中:SH,游离巯基含量,μmol/g;D,稀释系数;C,乳清的蛋白质量浓度,mg/mL;A412,样品在412 nm处的OD值。
1.6 数据统计分析
每个指标测定3次,最终试验结果表示为平均值±标准差,使用SPSS 19进行单因素方差分析,Origin 2018进行绘图。
2 结果与分析
2.1 乳清中总蛋白浓度分析
如图1所示,离心法提取乳清的蛋白质量浓度显著高于其他各组的蛋白质量浓度(P<0.05),其中离心法提取乳清的蛋白质量浓度高于乙醇分级沉淀法1.86倍(P<0.05)。盐酸法、乙酸法和柠檬酸法提取乳清的蛋白质量浓度无显著差异(P>0.05),蛋白质量浓度分别为(8.102±1.091)、(7.467±0.132)、(7.831±1.076) mg/mL。
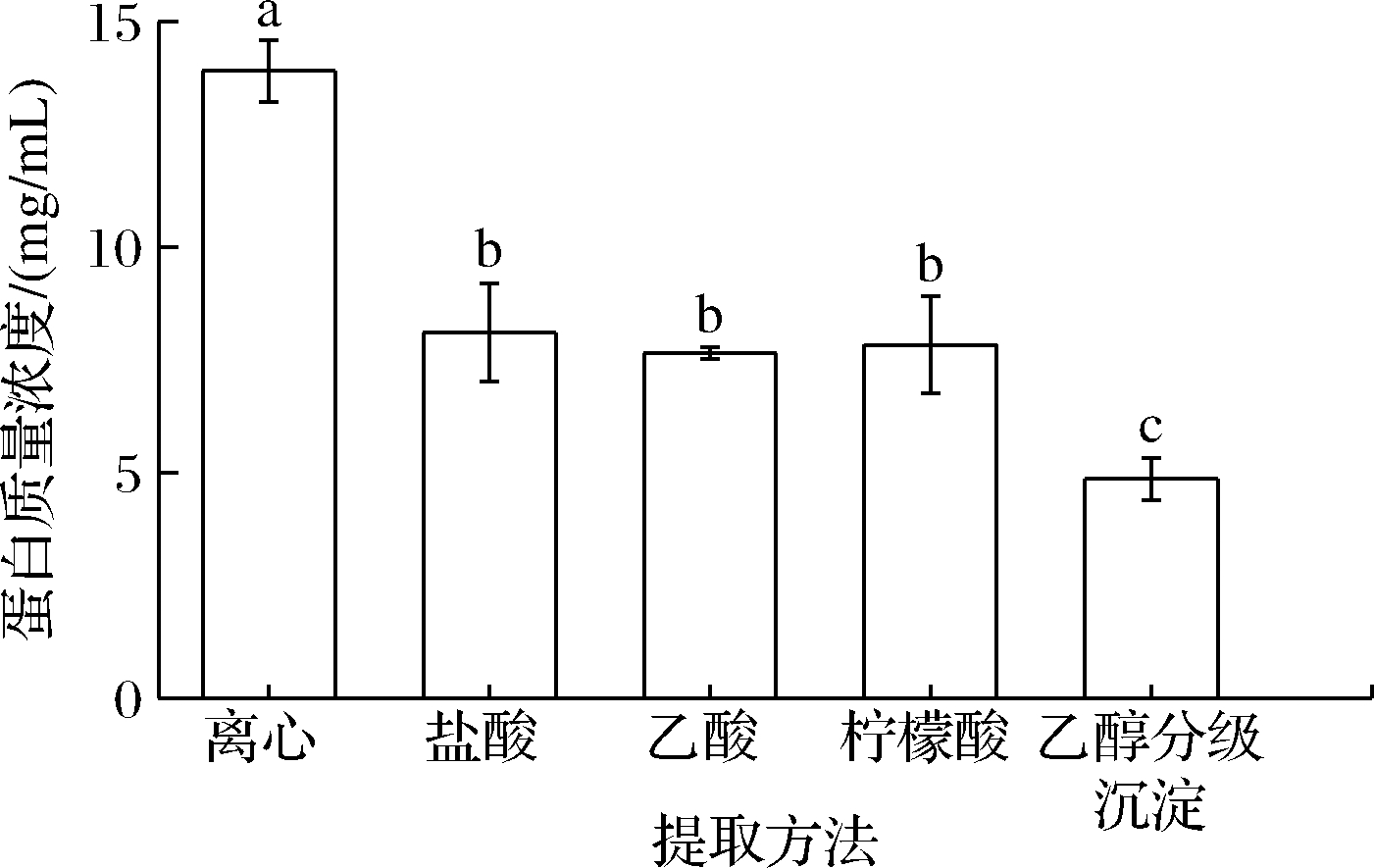
图1 不同分离方法得到乳清的蛋白含量
Fig.1 Protein concentration of whey obtained by different isolation methods
注:不同字母表示各处理组间具有显著性差异(P<0.05)(图3、图6、图8同)。
2.2 乳清中蛋白组分酪蛋白去除率分析
2.2.1 乳清中蛋白组分分析
如图2所示,离心法和乙醇分级沉淀提取乳清中酪蛋白的去除效果较差,但是3种酸处理后得到乳清样品的酪蛋白条带较窄而且比较浅,说明这3种方法去除酪蛋白的效果比较好。盐酸法和乙醇分级沉淀法提取乳清中,α-La条带的亮度较浅,离心法、乙酸法和柠檬酸法提取的乳清中α-La的亮度与鲜羊奶相比无明显变化。乙醇分级沉淀法提取乳清中β-Lg条带亮度明显比其他4种方法暗。因此,乙酸法和柠檬酸法能更好保留乳清中的蛋白质。

图2 不同分离方法得到的乳清的SDS-PAGE图
Fig.2 SDS-PAGE diagram of whey obtained by different isolation methods
2.2.2 酪蛋白去除率分析
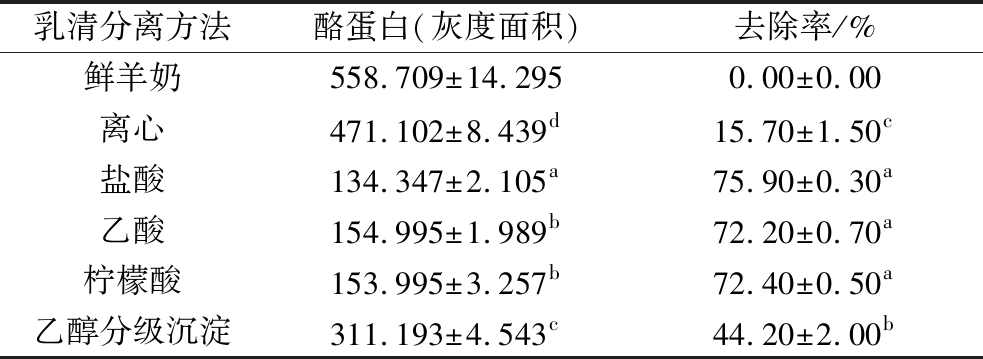
如表1所示,离心方法提取乳清的酪蛋白去除率只有(15.70±1.50)%,乙醇分级沉淀法酪蛋白去除率为(44.20±2.00)%,但是经过盐酸、乙酸和柠檬酸处理后,酪蛋白去除率达到了72%以上。因此,盐酸法、乙酸法和柠檬酸法提取乳清残留量显著低于离心法和乙醇分级沉淀法(P<0.05)。
表1 不同分离方式得到的乳清的酪蛋白去除率结果
Table 1 Casein removal rate of whey obtained by different isolation methods
注:同一列不同字母表示处理组间具有显著性差异(P<0.05)。
乳清分离方法酪蛋白(灰度面积)去除率/%鲜羊奶558.709±14.2950.00±0.00离心471.102±8.439d15.70±1.50c盐酸134.347±2.105a75.90±0.30a乙酸154.995±1.989b72.20±0.70a柠檬酸153.995±3.257b72.40±0.50a乙醇分级沉淀311.193±4.543c44.20±2.00b
2.2.3 酪蛋白灰度值分析
如图3所示,离心法与柠檬酸法得到的乳清相比,乳铁蛋白的灰度值无显著差异,但是显著高于盐酸法、乙酸法和柠檬酸法乳清。乙酸法和柠檬酸法获得乳清中β-Lg的灰度无显著差异(P>0.05),但显著高于离心法、盐酸法和乙醇分级沉淀法获得的乳清。离心处理对乳清中α-La的影响较小,分别比盐酸、乙酸、柠檬酸和乙醇分级沉淀法得到的乳清高50.81%、11.30%、14.70%和2.09倍(P<0.05)。离心和柠檬酸法提取乳清中免疫球蛋白的灰度值无显著差异(P<0.05),但是显著高于盐酸、乙酸和乙醇分级沉淀法得到的乳清(P<0.05)。

图3 不同分离方法得到的乳清组分的灰度值
Fig.3 The grayscale value of whey components obtained by different isolation methods
2.3 乳清的理化特性分析
2.3.1 色泽分析
如表2所示,乙醇分级沉淀提取乳清的L*值显著高于其他4组乳清(P<0.05),而且盐酸法与乙酸法提取乳清的L*值无显著差异(P>0.05)。盐酸法与柠檬酸法提取乳清的a*值无显著差异(P>0.05),显著高于离心法和乙醇分级沉淀法得到的乳清(P<0.05)。而柠檬酸法提取乳清的a*值与乙酸法提取的乳清无显著差异(P>0.05)。乙酸法获得乳清的b*值显著高于其他4组乳清(P<0.05),盐酸法和柠檬酸法提取乳清的b*值无显著差异(P>0.05)。
表2 不同分离方式乳清的色泽分析
Table 2 Color analysis of whey in different isolation methods

注:同一行不同字母表示处理组间具有显著性差异(P<0.05)(下同)。
提取方法离心盐酸乙酸柠檬酸乙醇分级沉淀L∗53.72±0.05b10.48±0.04d10.35±0.05d12.05±0.02c58.95±0.14aa∗-3.61±0.04d-0.32±0.01a-0.39±0.02b-0.36±0.03ab-1.81±0.01cb∗-11.30±0.04d-4.56±0.01b-4.24±0.05a-4.45±0.06b-7.81±0.08c
如图4所示,离心法和乙醇分级沉淀法得到的乳清呈现浑浊的白色,但盐酸、乙酸和柠檬酸法提取的乳清澄清,主要表现为黄色。

a-离心法;b-盐酸法;c-乙酸法;d-柠檬酸法;e-乙醇分级沉淀法
图4 不同分离方法乳清的感官图
Fig.4 Visual diagram of whey obtained by different isolation methods
2.3.2 微观结构分析
如图5所示,离心法获得的乳清呈片状,结构表面粗糙度较高。盐酸法和乙酸法提取的乳清呈现片状,表面都较为光滑、粗糙度低。柠檬酸和乙醇分级沉淀得到的乳清由破碎的玻璃或薄片状结构逐渐转变为不规则的块状,其中经乙醇分级沉淀得到的乳清出现了更多的裂纹、片状结构边缘更加粗糙。

a-离心法;b-盐酸法;c-乙酸法;d-柠檬酸法;e-乙醇分级沉淀法
图5 不同分离方法提取乳清的SEM图
Fig.5 SEM images of whey obtained by different isolation methods
2.3.3 粒径和Zeta电位分析
如图6-a所示,乙酸法提取乳清的粒径分别比离心法、盐酸法、柠檬酸法和乙醇分级沉淀法提取的乳清大5.77倍、13.09%、15.32%和1.75倍(P<0.05),盐酸法和柠檬酸法提取乳清的粒径无显著差异(P>0.05)。如图6-b所示,盐酸法、乙酸法和柠檬酸法提取乳清的Zeta电位无显著差异(P>0.05),且3种方法提取乳清的Zeta电位的绝对值显著大于离心法和乙醇分级沉淀法提取的乳清(P<0.05)。

a-乳清粒径;b-乳清的Zeta电位
图6 不同分离方法提取乳清的粒径和Zeta电位结果图
Fig.6 Particle size and Zeta potential of whey obtained by different isolation methods
2.3.4 傅里叶红外光谱分析
如图7所示,傅里叶红外光谱图反映不同制备方法对羊奶乳清蛋白二级结构的影响。蛋白二级结构主要在酰胺Ⅰ带(1 600~1 700 cm-1)发生的变化,其中1 620~1 644 cm-1为β-折叠、1 644~1 652 cm-1为无规则卷曲(C![]() O与水形成氢键)、1 652~1 660 cm-1为α-螺旋结构、1 660~1 685 cm-1为β-转角结构[14]。
O与水形成氢键)、1 652~1 660 cm-1为α-螺旋结构、1 660~1 685 cm-1为β-转角结构[14]。

图7 不同分离方法提取乳清的FTIR结果
Fig.7 FTIR results of whey extracted by different isolation methods
对所得到的谱图进行高斯拟合,得到乳清蛋白二级结构的比例如表3所示。离心法提取乳清中蛋白的二级结构主要以β-折叠为主,显著高于其他4种方法提取乳清(P<0.05)。盐酸法提取乳清的无规则卷曲结构和α-螺旋结构显著大于其他4种方法提取乳清(P<0.05)。乙酸法和柠檬酸法提取乳清的β-折叠、无规则卷曲和α-螺旋结构无显著差异(P>0.05),但是柠檬酸法提取乳清的β-转角结构高于乙酸法提取乳清49.74%(P<0.05)。乙醇分级沉淀法提取乳清中以β-转角结构为主,高于离心法、盐酸法、乙酸法和柠檬酸法提取乳清的β-转角1.60倍、32.96%、2.61倍和1.41倍;无规则卷曲结构则显著低于其他4种方法提取的乳清(P<0.05);其α-螺旋结构显著高于离心法、乙酸法和柠檬酸法(P<0.05)。
表3 不同方法提取的乳清中二级结构的含量 单位:%
Table 3 Content of the secondary structure in whey extracted by different methods
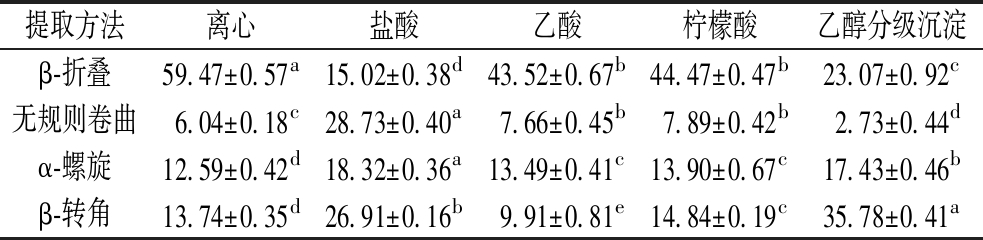
提取方法离心盐酸乙酸柠檬酸乙醇分级沉淀β-折叠59.47±0.57a15.02±0.38d43.52±0.67b44.47±0.47b23.07±0.92c无规则卷曲6.04±0.18c28.73±0.40a7.66±0.45b7.89±0.42b2.73±0.44dα-螺旋12.59±0.42d18.32±0.36a13.49±0.41c13.90±0.67c17.43±0.46bβ-转角13.74±0.35d26.91±0.16b9.91±0.81e14.84±0.19c35.78±0.41a
2.3.5 乳清中游离巯基含量分析
如图8所示,乙酸法提取乳清中游离巯基含量显著低于其他4组乳清,为(1.394±0.228) μmol/g(P<0.05)。离心和盐酸法提取乳清中游离巯基含量无显著差异(P>0.05),因此乙酸对乳清中的β-Lg二聚体间的二硫键影响最大,但乙醇分级沉淀法使β-Lg间的二硫键减少,导致游离巯基含量增大。

图8 不同分离方法提取乳清的游离巯基含量
Fig.8 Content of free sulfhydryl groups extracted from whey with different isolation methods
3 讨论与结论
本研究采用离心、酸(盐酸、乙酸、柠檬酸)等电点沉淀和乙醇分级沉淀提取乳清,发现离心法得到的乳清浓度高于其他各组,可能是由于离心无法有效去除脱脂羊奶中的酪蛋白胶束,使乳清的蛋白浓度增大[3]。为了进一步明确这几种方法去除酪蛋白的效果,采用SDS-PAGE对得到乳清中的蛋白质进行分离,结果表明离心和乙醇分级沉淀提取的乳清中酪蛋白残留较多,3种酸沉淀法提取的乳清中酪蛋白残留较少,这与上述蛋白浓度测定结果相似。通过对SDS-PAGE条带的灰度分析表明,酸等电点沉淀(盐酸、乙酸和柠檬酸)对酪蛋白的去除率可以达到72%以上。邵钺馨等[3]研究证明离心结合等电点沉淀乳制品中的酪蛋白,沉淀率可达到63%以上,本研究酪蛋白去除率比较高可能是因为调节pH结束后在摇床上振荡了30 min,使酸与酪蛋白能有充分的时间变性进行沉淀。在提取乳清时需要考虑乳清蛋白能否充分保留,乙酸和柠檬酸法提取的乳清中α-La和β-Lg的条带亮度和鲜羊奶没有明显差异,但盐酸法提取的乳清的α-La条带的亮度变暗、宽度变窄,这与刁梦雪等[9]的研究相似。因此,乙酸和柠檬酸酸法能更好除去酪蛋白,并且能更多保留乳清中的乳清蛋白含量。邵钺馨等[3]研究证明离心结合等电点沉淀乳制品中的乳清蛋白,保留率可以达到74.95%,本研究结果乙酸沉淀法能更有效去除酪蛋白,保留乳清蛋白。
离心和乙醇分级沉淀法得到的乳清颜色为白色且不透明,这主要是由于乳清中残留的酪蛋白以蛋白胶束的形式存在于乳清中,影响乳清的透明度。盐酸法、乙酸法和柠檬酸法分离得到的乳清清澈透亮,呈现黄绿色,酪蛋白残留较少,且乳清中核黄素使溶液的颜色为黄绿色[15]。通过SEM观察乳清的结构发现,离心、盐酸和乙酸法得到的乳清呈片状,柠檬酸和乙醇分级沉淀法得到的乳清呈块状结合在一起,MA等[16]研究表明,使用喷雾干燥工艺形成的乳清是球形结构,而通过冷冻干燥工艺处理得到的样品呈破碎的片状结构,这也与本试验结果一致。乳清表面的小孔是由于冷冻干燥时乳清中被冻结的水升华造成的[17]。
由于酪蛋白表面的静电荷相互排斥,使酪蛋白聚集程度较低,仅能形成较短的酪蛋白胶束结构,而离心处理所得样品酪蛋白去除率低,仍含有大量酪蛋白颗粒,乳清蛋白纯度低,所以平均粒径远低于酸处理法所得样品,这与李子超等[18]的试验结果一致。王美玉等[19]研究发现,有机溶剂对蛋白质的疏水相互作用、氢键和静电相互作用的稳定性会产生一定影响,一些有机溶剂在低浓度条件下可以提高蛋白质的稳定性,但在高浓度条件时,这些有机溶剂也会导致蛋白质变性。这是由于它们破坏了氨基酸非极性侧链之间的疏水相互作用,同时增强静电相互作用、改变蛋白质天然结构、促进蛋白质聚集。乙醇分级沉淀制备的样品无法有效提取乳清蛋白,未去除的酪蛋白在乙醇的作用下形成较大聚集体,故平均粒径大于离心处理。Zeta电位是衡量样品长期储藏能力的一个重要指标[20]。Zeta电位绝对值越大则说明乳状液液滴表面具有越多静电荷,液滴间具有越大的静电斥力和距离[21]。盐酸、乙酸和柠檬酸法分离乳清的Zeta电位均显著大于离心法和乙醇分级沉淀法得到的乳清,这可能是因为酸处理使蛋白质的结构展开,暴露了内部带负电荷的氨基酸残基,导致Zeta电位的绝对值较高。此外,样品Zeta电位绝对值在30 mV以上时,样品处于稳定状态。因此,本试验获得的乳清具有良好的稳定性。傅里叶红外光谱分析表明,经酸处理的样品α-螺旋含量增加,显示出明显的吸收峰,可能是因为酸诱导α-螺旋结构形成,这与HUANG等[22]的研究结果一致。乙酸酸性较弱,相比于盐酸法提取乳清,经乙酸法提取乳清蛋白二级结构变化较小。乙醇处理会使蛋白质二级结构中的β-折叠转变为α-螺旋和β-转角,这2种结构增加可以增强蛋白质分子的无序性和柔韧性[23],这与本试验结果相似。乳清中的蛋白是一种典型的球状蛋白,游离巯基及其他功能基团隐藏在其紧密的分子结构内部。乙酸法和柠檬酸法提取的乳清中游离巯基含量较低,可能是由于酸处理导致蛋白质结构舒展、暴露出隐藏的巯基形成二硫键,稳定存在于溶液中。LIU等[24]提出二硫键在酸性环境中较稳定,不易断裂。乙醇分级沉淀法得到乳清的游离巯基含量高,可能是由于醇类极性低于水,加入蛋白溶液中会使溶液介电常数降低、分子间静电相互作用增强,削弱或破坏稳定蛋白质结构的非共价相互作用,改变蛋白质的分子构象,包裹在蛋白分子中的二硫键暴露之后又被重新包裹在变性的蛋白质分子中,引起游离巯基含量增大[25]。
在5种羊奶乳清分离提取方法中,离心法乳清蛋白和酪蛋白的分离效果差,乙醇分级沉淀法不仅无法有效去除酪蛋白,且α-La和β-Lg损失较大。乙酸处理不仅有效的除去了大量酪蛋白、获得了纯度较高的乳清蛋白、α-La和β-Lg损失小,且对乳清蛋白的二级结构影响较弱,是一种有效、科学的羊奶乳清分离方法。
[1] CAMPOS M I F, DE SOUZA BARBOSA P P, CAMARGO L J, et al.Characterization of goat whey proteins and their bioactivity and toxicity assay[J].Food Bioscience, 2022, 46:101591.
[2] BALLATORE M B, BETTIOL M D R, VANDEN BRABER N L, et al.Antioxidant and cytoprotective effect of peptides produced by hydrolysis of whey protein concentrate with trypsin[J].Food Chemistry, 2020, 319:126472.
[3] 邵钺馨, 曲赫选, 钟玉玲, 等.羊奶乳清蛋白的分离方法研究[J].中国奶牛, 2019(4):41-45.
SHAO Y X, QU H X, ZHONG Y L, et al.Study on goat milk whey separation method[J].China Dairy Cattle, 2019(4):41-45.
[4] 刘永峰, 赵晓微, 刘满顺, 等.牛奶乳清液对小鼠学习记忆能力的影响[J].陕西师范大学学报(自然科学版), 2016, 44(4):108-113;124.
LIU Y F, ZHAO X W, LIU M S, et al.Effect of whey liquid from milk on learning and memory ability of mice[J].Journal of Shaanxi Normal University(Natural Science Edition), 2016, 44(4):108-113;124.
[5] 刘龙. 牦牛乳清蛋白泡沫分离及功能特性改善研究[D].西宁:青海师范大学, 2018.
LIU L.Foam separation of whey protein, preparation of antioxidant products and improvement of functional properties[D].Xining:Qinghai Normal University, 2018.
[6] MARUYAMA H, SEKI H.Recovery of milk whey proteins by foam separation[J].Process Safety and Environmental Protection, 2022, 159:566-574.
[7] SANMART N B, D
N B, D AZ O, RODR
AZ O, RODR GUEZ-TURIENZO L, et al.Properties of heat-induced gels of caprine whey protein concentrates obtained from clarified cheese whey[J].Small Ruminant Research, 2015, 123(1):142-148.
GUEZ-TURIENZO L, et al.Properties of heat-induced gels of caprine whey protein concentrates obtained from clarified cheese whey[J].Small Ruminant Research, 2015, 123(1):142-148.
[8] 陈静廷, 卜登攀, 马露, 等.不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析[J].食品科学, 2014, 35(20):180-184.
CHEN J T, BU D P, MA L, et al.2-DE analysis of whey protein extracted by different isoelectric precipitations and ultracentrifugation methods from cow milk[J].Food Science, 2014, 35(20):180-184.
[9] 刁梦雪, 颜蜜, 陈思如, 等.牛乳中α-乳白蛋白的分离纯化工艺研究[J].中国乳品工业, 2021, 49(9):8-11;37.
DIAO M X, YAN M, CHEN S R, et al.Study on separation and purification of α-lactalbumin from bovine milk[J].China Dairy Industry, 2021, 49(9):8-11;37.
[10] CHEN Q X, YIN Q L, XIE Q G, et al.Elucidating the physicochemical properties and surface composition of goat milk-based infant formula powders[J].Food Chemistry, 2022, 377:131936.
[11] TANG L Q, LIU H C, HUANG G D, et al.The structural characterization, physicochemical properties, and stability of gardenia yellow pigment microcapsules[J].LWT, 2022, 162:113507.
[12] MARKOSKA T, HUPPERTZ T, GREWAL M K, et al.FTIR analysis of physiochemical changes in raw skim milk upon concentration[J].LWT, 2019, 102:64-70.
[13] 沈海斌, 杨航, 王月慧, 等.壳聚糖对小麦面团流变学特性的影响[J].食品工业科技, 2018, 39 (20):30-34;40.
SHEN H B, YANG H, WANG Y H, et al.Effect of chitosan on the rheological properties of wheat flour dough[J].Science and Technology of Food Industry, 2018, 39 (20):30-34;40.
[14] LIU J X, ZHANG J W, ZHU G R, et al.Effects of water deficit and high N fertilization on wheat storage protein synthesis, gluten secondary structure, and breadmaking quality[J].The Crop Journal, 2022, 10(1):216-223.
[15] 田木. 山羊奶乳清蛋白的制备及其包埋大豆异黄酮体系研究[D].哈尔滨:东北农业大学, 2021.
TIAN M.Goat milk whey protein preparation and its application in whey protein-soy isoflavones delivery system[D].Harbin:Northeast Agricultural University, 2021.
[16] MA J J, MAO X Y, WANG Q, et al.Effect of spray drying and freeze drying on the immunomodulatory activity, bitter taste and hygroscopicity of hydrolysate derived from whey protein concentrate[J].LWT - Food Science and Technology, 2014, 56(2):296-302.
[17] CHRANIOTI C, TZIA C.Arabic gum mixtures as encapsulating agents of freeze-dried fennel oleoresin products[J].Food and Bioprocess Technology, 2014, 7(4):1057-1065.
[18] 李子超, 王丽娜, 李昀锴, 等.3种乳源酪蛋白粒径及胶束结构的差异性[J].食品科学, 2012, 33(5):58-61.
LI Z C, WANG L N, LI Y K, et al.Differences in particle size and structure of casein micelle from different milk sources[J].Food Science, 2012, 33(5):58-61.
[19] 王美玉, 王愈, 陈振家, 等.pH及离子强度对燕麦分离蛋白功能特性及亚基特性的影响[J].食品与机械, 2019, 35(10):1-5.
WANG M Y, WANG Y, CHEN Z J, et al.Functional properties and subunits properties of oat protein isolate under different pH and ionic strength[J].Food &Machinery, 2019, 35(10):1-5.
[20] 闫舟, 郝利平, 梁亚萍, 等.小米蛋白提取、测定以及SDS-PAGE电泳[J].食品科技, 2018, 43(9):227-232.
YAN Z, HAO L P, LIANG Y P, et al.Extraction, assay and SDS-PAGE electrophoresis of millet protein[J].Food Science and Technology, 2018, 43(9):227-232.
[21] XU J, MUKHERJEE D, CHANG S K C.Physicochemical properties and storage stability of soybean protein nanoemulsions prepared by ultra-high pressure homogenization[J].Food Chemistry, 2018, 240:1005-1013.
[22] HUANG L, XU Y, ZHOU Y M.Improvement of nutritional quality of soybean meal by Fe(II)-assisted acetic acid treatment[J].Food Chemistry, 2019, 283:475-480.
[23] FENG Y Y, MA X L, KONG B H, et al.Ethanol induced changes in structural, morphological, and functional properties of whey proteins isolates:Influence of ethanol concentration[J].Food Hydrocolloids, 2021, 111:106379.
[24] LIU Q A, GENG R, ZHAO J Y, et al.Structural and gel textural properties of soy protein isolate when subjected to extreme acid pH-shifting and mild heating processes[J].Journal of Agricultural and Food Chemistry, 2015, 63(19):4853-4861.
[25] 房天琪. 液态浓缩乳清蛋白的制备与功能特性修饰及应用研究[D].长春:吉林大学, 2019.
FANG T Q.The preparation and application of liquid whey protein concentrate prepared from sweet whey[D].Changchun:Jilin University, 2019.