贻贝是一种常见的食用性贝类,其营养丰富,蛋白质含量高,且富含多种生理活性物质,具有抗菌、调节血压、抗凝血等功能[1],在我国山东、辽宁、浙江等沿海省份大量养殖。我国目前对贻贝的利用主要局限于可食用的贝肉部分,对占总质量60%以上的贝壳却很少涉及。未被利用的贝壳作为固体废弃物丢弃在海边,不但占用了土地资源,还会造成环境污染和部分沿海区域生态系统的严重退化[2]。贻贝壳的主要成分是CaCO3,作为海洋源CaCO3,其安全性优于矿石和动物骨源CaCO3,这是由于矿石源CaCO3常残留有重金属等有害成分,而动物骨源CaCO3品质易受畜禽疫情的影响[3]。
钙是动物体内仅次于碳、氢、氧、氮的第5种重要元素,对维持生物体正常结构和功能有重要作用。以贝壳为钙源,已制备出乳酸钙、葡萄糖酸钙、氨基酸螯合钙等一系列补钙产品[4-6]。贻贝壳由外及内可分为角质层、棱柱层、珍珠层[7]。角质层主要由硬质蛋白组成,其中含有大量天然黑色素[8]。棱柱层和珍珠层是CaCO3晶体,主要有方解石CaCO3和球霰石CaCO3[9],是贝壳的主要成分。黑色素溶解性差,不易分离,且因含有吲哚环、芳香环、氨基和烃基等官能团[10]而具有吸附性,使贻贝壳表面含有一定量的其他元素和重金属[11]。这些成分不仅影响钙补充剂制备效率,甚至会影响其品质和安全性。在已有以贝壳为钙源制备各种钙补充剂的相关研究中[12-13],均未对贝壳表面的角质层及黏连角质层的低纯CaCO3进行脱除,因此产品品质存在一定的不确定性。
贻贝壳中的黑色素易溶于碱溶液[14],表面黏连有硬质蛋白的低纯CaCO3可与酸反应生成可溶的钙离子化合物[15]。鉴于此,本研究拟采用NaOH-乳酸溶液协同处理,以明暗度和质量损失率为指标,筛选出对贻贝壳表面角质层和黏连有角质层的低纯CaCO3具有最佳净化效果的条件。为减少所使用试剂对环境可能带来的污染,本探究所选用的NaOH浓度较低(pH 9~13),且选用有机酸乳酸(pH 2~5)进行酸处理剂。对净化后贻贝壳的微观结构和表面残留成分的化学组成进行分析,对其表面元素组成、表面钙含量、重金属含量等进行测定,综合评判NaOH-乳酸协同处理对贻贝壳的净化作用,为高品质贻贝壳源钙补充剂的制备提供参考。
1 材料与方法
1.1 材料与试剂
贻贝壳,杭州朝晖六区农贸市场;NaOH(食品级),湖北鑫润德化工有限公司;乳酸(食品级),上海鼎通生物工程有限公司;盐酸(食品级),武汉三勤化工科技有限公司;KBr(光谱级),上海泰坦科技股份有限公司。
1.2 仪器与设备
电热鼓风干燥箱,上海一恒科学仪器有限公司;KQ-300DE超声清洗设备,昆山清洗设备有限公司;DLH-250型高速多功能粉碎机,武义祺腾电器有限公司;Color Quest色差仪,美国HunterLab公司;PHS-E pH计,上海仪电科学仪器股份有限公司;Prisma-E扫描电镜,美国FEI公司;Nicolet 6700傅里叶变换红外光谱仪,Thermo Nicolet公司;NexION 300X电感耦合等离子质谱仪,美国PerkinElmer公司;真空冷冻干燥机,北京四环起航科技有限公司;高速冷冻台式离心机,美国Danaher Corporation公司。
1.3 贻贝壳的NaOH-乳酸净化处理
将贻贝壳外表面刷洗干净并去除内表面黏附的贝肉,将贝壳放入65 ℃干燥箱中烘干3 h,将烘干后贝壳用小锤敲打破碎成小块(直径约2~3 cm)。称取破碎的贻贝壳25 g,向其中加入250 mL不同浓度(0.01 mmol/L、0.3 mmol/L、2.5 mmol/L、12.5 mmol/L、0.125 mol/L)的NaOH溶液(pH 9~13)浸泡处理24~72 h。在浸泡处理的第1小时和最后1小时分别进行超声波协同处理,超声波频率40 kHz,功率300 W。处理后的贝壳用清水冲洗干净并置入65 ℃干燥箱烘干3 h,为NaOH处理样品。
称取NaOH处理且干燥后的贻贝壳25 g,向其中加入250 mL不同浓度(700、7、0.07、7×10-4 mmol/L)的乳酸溶液(pH 2~5)浸泡处理1~5 h。处理后的贝壳用清水冲洗并置于65 ℃干燥箱中烘干3 h。为叙述方便,本文将经NaOH溶液处理后再经乳酸溶液处理简述为NaOH-乳酸处理。
1.4 贻贝壳明暗度L值的测定
用高速多功能粉碎机将未经处理、NaOH处理、NaOH-乳酸处理的贻贝壳进行粉碎,过80目筛,将筛下物置于105 ℃烘箱干燥至恒重,制备贻贝壳粉。将干燥后的贝壳粉置于PE自封袋中并压紧,用色差仪对样品的色泽进行测定。
1.5 扫描电子显微镜(scanning electron microscope,SEM)和X-射线能谱分析仪(energy dispersive spectrometer,EDS)
分别选取未处理、NaOH处理和NaOH-乳酸处理的贻贝壳,在载物盘上黏附导电胶,取喷金处理后样品黏附于导电胶上,使用吸耳球清除未黏附的粉末杂质。对样品进行扫描电镜观察和EDS能谱分析。
1.6 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
取适量贻贝壳粉与KBr按质量比1∶100混合、研磨、压片。对样品进行FTIR测定,扫描范围为4 000~400 cm-1,分辨率为4 cm-1。采用同样方法对碱溶酸提的贻贝壳黑色素进行测定。黑色素的碱溶酸提流程为:用pH 13的NaOH溶液浸泡处理贻贝壳36 h(参照1.3节),取10 g脱落的角质层并向其中加入40 mL NaOH溶液(2 mol/L)浸泡处理4 h,10 000 r/min离心10 min,取上清液,用6 mol/L盐酸溶液调节其pH至2.0后析出沉淀物,取沉淀物进行真空冷冻干燥(-40 ℃、≤5 Pa)处理12 h获得黑色素。
1.7 重金属检测
参照VOICA等[16]的方法使用电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)对贻贝壳粉的金属元素含量进行检测。称取0.5 g样品并加入10 mL浓硝酸,室温静置1 h,随后利用微波消解仪进行消解,前5 min升温至120 ℃,恒温处理5 min;5 min内升温至150 ℃并恒温处理10 min;然后5 min内升温至190 ℃并恒温处理20 min。冷却后缓慢打开罐盖排气,用少量水冲洗内盖,再将消解罐置于控温电热板上,于100 ℃加热30 min。随后用去离子水定容至25 mL备用。以不添加贝壳粉样品、但经相同处理的溶液为空白对照。将空白溶液和试样溶液分别注入电感耦合等离子体质谱仪中,设定射频功率1 500 W,辅助气和雾化气的流速分别为1.2和1.03 L/min,等离子体流速为18 L/min,泵速为2.0 mL/min。测定待测元素和内标元素的信号响应值,根据标准曲线得到消解液中待测元素的浓度。
1.8 数据统计及分析
每组实验平行进行3次,使用Origin 2017对数据进行分析,SPSS 26.0进行显著性分析,P<0.05认为具有显著性差异。
2 结果与讨论
2.1 pH和浸泡时间对NaOH溶液脱除黑色素效果的影响
如图1-a所示,未经NaOH处理的对照样品明暗度为67.28,而经pH 9的NaOH溶液浸泡处理24 h后,其明暗度增加至82.26。若NaOH溶液pH为13,其明暗度则增加至84.06。在pH 10~13范围内,样品明暗度虽略有增加但并无显著性差异(P>0.05),但黑色素的脱除效果却有明显差别。如图1-a插图所示,pH 12的NaOH溶液处理后贻贝壳表面仍有部分黑色素残留,而pH 13的NaOH溶液处理后黑色素基本脱落。上述结果表明NaOH溶液pH对其脱除贻贝壳表面的黑色素有明显影响,随着溶液pH的升高,脱除作用增强。后续研究中选定的NaOH溶液pH为13。

a-pH对明暗度的影响(插图分别为pH 12和13处理时贻贝的图片);b-浸泡时间对明暗度的影响(pH=13)
图1 NaOH溶液处理对贻贝壳粉明暗度的影响
Fig.1 Effect of NaOH treatment on the brightness of M.edulis shell powder
注:组间不同小写字母表示差异显著(P<0.05)(下同)。
如图1-b所示,pH=13时,在0~72 h,随着浸泡时间的延长,贻贝壳粉明暗度呈先上升后下降的趋势。当浸泡时间为24、36 h时,贻贝壳粉明暗度由对照组的67.28分别增加至84.06、90.64。进一步延长浸泡时间至48、60、72 h,其明暗度则分别减小至88.61、87.43、89.28。长时间浸泡导致其明暗度减小的原因可能是长时间NaOH处理使得贻贝壳棱柱层暴露增加,结构愈加松散,孔隙率不断上升,从而增加了其对溶解的黑色素的吸附作用[17]。因此,后续研究中选定的NaOH浸泡时间为36 h。
2.2 乳酸溶液pH和浸泡时间对脱除黏连有角质层的低纯CaCO3的影响
由图2-a可知,随着乳酸溶液pH的降低,贻贝壳粉明暗度呈现上升趋势。只经pH 13的NaOH浸泡处理36 h的贻贝壳粉明暗度为90.64,若再用pH2~5的乳酸溶液浸泡处理4 h后,其明暗度分别增加至94.03、93.95、93.02、92.36。虽然随着pH升高,样品间明暗度有一定程度减少,但并无显著性差异(P>0.05)。如图2-b所示。pH 2的乳酸溶液处理后样品的质量损失率为9.78%,显著高于pH 3~5的乳酸溶液处理的样品(P<0.05)。综上可知,乳酸处理能明显进一步脱除贻贝壳表面黏连有角质层的低纯CaCO3,溶液pH对其脱除效果有一定影响。后续研究中选取的乳酸pH为2。

a-乳酸溶液pH对贻贝壳粉明暗度的影响(浸泡处理4 h);b-乳酸溶液pH对贻贝壳质量损失率的影响(浸泡处理4 h);c-处理时间对贻贝壳粉明暗度的影响(乳酸pH 4);d-处理时间对贻贝壳质量损失率的影响(乳酸pH 4)
图2 乳酸溶液处理对贻贝壳粉明暗度和质量损失率的影响
Fig.2 Effects of lactic acid treatment on the brightness and mass loss rate of M.edulis shell powder
如图2-c所示,对照组(pH 13的NaOH溶液浸泡36 h)贻贝壳粉的明暗度为90.64,经pH 2的乳酸浸泡处理1、2、3、4、5 h后,贻贝壳粉的明暗度分别增加至92.48、92.72、92.97、93.02、93.57,呈现上升趋势,并无显著性差异(P>0.05),但其质量损失率却存在显著性差异(P<0.05)。处理4和5 h的样品质量损失率显著高于处理3 h样品。后续研究中选择乳酸的浸泡处理时间为4 h。
2.3 微观结构表征
利用扫描电镜对最佳净化条件下NaOH和NaOH-乳酸处理的贻贝壳微观结构进行了分析(见图3)。结合FENG等[18]对贻贝壳矿物相的结构和晶体取向研究结果发现,未处理样品因表面含有大量的有机质而呈致密、光滑形态[19];NaOH处理组样品表面黑色素脱落,角质层出现明显的断裂;而经NaOH-乳酸处理后,与棱柱层黏连的角质层发生明显脱落,柱状棱柱层清晰可见。SEM分析结果表明,NaOH-乳酸协同处理可有效脱除贻贝壳表面的黑色素及黏连有角质层的低纯CaCO3。

a-对照组(×2 000);b-NaOH处理组(×2 000);c-NaOH-乳酸处理组(×2 000);d-对照组(×5 000);e-NaOH处理组(×5 000);f-NaOH-乳酸处理组(×5 000)
图3 对照及NaOH、NaOH-乳酸处理贻贝壳的扫描电镜图
Fig.3 SEM images of the M.edulis shells注: NaOH处理组-pH 13 NaOH溶液浸泡36 h;NaOH-乳酸处理组-pH 13 NaOH溶液浸泡36 h 后,pH 2乳酸溶液浸泡4 h(下同)。
2.4 FTIR分析
如图4所示。未净化贻贝壳粉在707、870、1 404、1 458、1 625、3 415 cm-1等处均有特征谱带。其中,707、870、1 458 cm-1处特征峰分别来自CaCO3中C—O面内弯曲振动、CO32-面外弯曲振动和C—O反对称伸缩振动[20]。1 404和1 625 cm-1处特征谱带在黑色素FTIR谱中同样存在,前者来源于黑色素吡咯类杂环的伸缩振动,而后者则主要是黑色素吲哚环中C![]() C的振动以及C
C的振动以及C![]() O的反对称伸缩振动所致[21]。此外,1 520、1 230 cm-1处特征谱带为黑色素吡咯环中NH基团和C—N的伸缩振动[22]。经NaOH-乳酸处理后,1 404和1 625 cm-1处特征谱带峰强度均明显减弱,这表明净化后贻贝壳粉中的黑色素含量显著减少。另外,经NaOH-乳酸处理后,1 083、2 515 cm-1处出现了新的特征峰,其分别为CO32-对称伸缩振动峰和HCO3-的伸缩振动峰[23]。且经NaOH-乳酸处理后,棱柱层球霰石CaCO3特征峰(870 cm-1)强度也明显增强,这是由于处理后样品棱柱层暴露,其中球霰石CaCO3相对含量增加所致。上述结果表明,NaOH-乳酸处理后,贻贝壳表面的黑色素及黏连有角质层的低纯度CaCO3得到了有效脱除,贻贝壳粉中CaCO3的纯度明显提高。
O的反对称伸缩振动所致[21]。此外,1 520、1 230 cm-1处特征谱带为黑色素吡咯环中NH基团和C—N的伸缩振动[22]。经NaOH-乳酸处理后,1 404和1 625 cm-1处特征谱带峰强度均明显减弱,这表明净化后贻贝壳粉中的黑色素含量显著减少。另外,经NaOH-乳酸处理后,1 083、2 515 cm-1处出现了新的特征峰,其分别为CO32-对称伸缩振动峰和HCO3-的伸缩振动峰[23]。且经NaOH-乳酸处理后,棱柱层球霰石CaCO3特征峰(870 cm-1)强度也明显增强,这是由于处理后样品棱柱层暴露,其中球霰石CaCO3相对含量增加所致。上述结果表明,NaOH-乳酸处理后,贻贝壳表面的黑色素及黏连有角质层的低纯度CaCO3得到了有效脱除,贻贝壳粉中CaCO3的纯度明显提高。

a-红外光谱;b-1 000~2 000 cm-1内红外光谱
图4 净化、未净化的贝壳粉及黑色素的FTIR图谱
Fig.4 FTIR spectra of the purified and unpurified M.edulis shell powder and melanin
2.5 表面元素分析
基于EDS的贻贝壳表面元素分析结果如图5和表1所示。未处理的贻贝壳表面含有C、O、Na、Br、S、Cl、Ca等多种元素,其中C、O含量最高,其质量比分别达66.22%、27.96%,二者主要来自贻贝壳表面的角质层。Na、Br、S、Cl等主要来自角质层的吸附作用,其中Br元素含量较高,其质量分数为3.96%。虽然贻贝壳中含有大量的CaCO3,但由于角质层的包被,观测到的Ca元素强度较低,其质量分数仅为0.39%。经NaOH处理后,C元素质量分数减小至27.63%,O、Ca元素质量分数则分别增加至40.95%、30.15%,而Br元素则未检出。而经最佳净化条件下NaOH-乳酸处理后,C元素质量分数进一步减小至12.80%,而O、Ca元素质量分数则分别增加至49.25%、37.58%,三者均接近纯CaCO3中各元素质量比(C∶O∶Ca=12∶48∶40)。上述结果进一步表明,NaOH-乳酸处理可有效脱除贻贝壳表面角质层及其吸附的其他元素,从而提高贻贝壳中CaCO3纯度。
表1 各处理组表面元素组成
单位:%
Table 1 Element composition of each treatment group
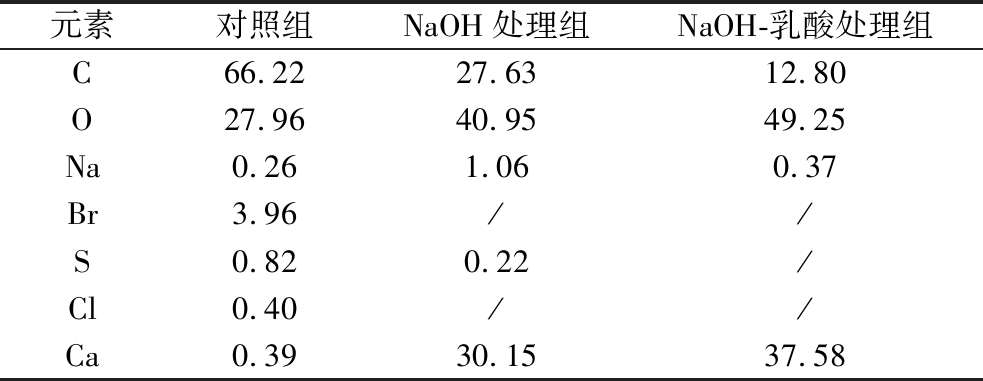
注:/表示未检出(下同)。
元素对照组NaOH处理组NaOH-乳酸处理组C66.2227.6312.80O27.9640.9549.25Na0.261.060.37Br3.96//S0.820.22/Cl0.40//Ca0.3930.1537.58

a-未处理;b-NaOH处理;c-NaOH-乳酸处理
图5 未净化、NaOH处理及NaOH-乳酸处理的贻贝壳EDS图谱
Fig.5 EDS spectra of unpurified, NaOH-treated, and NaOH-lactic acid-treated M.edulis shell
2.6 重金属含量分析
海水及沉积物中含有镉、铅、铜和锌等重金属,而贝壳角质层中的有机质具有较强的吸附性能,可与重金属结合形成重金属-有机络合物[24]。利用ICP-MS对最佳净化条件下NaOH-乳酸处理的贻贝壳中4种重金属进行了检测,并与未经净化处理的对照组进行比较,结果如表2所示。本研究所用贻贝壳含有一定量的Cu、Zn、Pb等元素,Cd未检出。所检出重金属含量均未超过GB 2762—2022《食品安全国家标准 食品中污染物限量》的规定。经NaOH-乳酸净化处理后,Zn、Pb含量有一定程度下降,分别由净化前的5.86、0.80 mg/kg降低至4.79 mg/kg和未检出。但Cu含量却有少许增加,这可能与贻贝壳对不同离子的吸附部位相关。
表2 净化前后贻贝壳中重金属元素含量变化表 单位:mg/kg
Table 2 Changes of heavy metals in M.edulis shells before and after purification

样品CuZnPbCd对照组3.125.860.80/NaOH-乳酸处理组3.334.79//
3 结论
NaOH-乳酸协同处理可有效脱除贻贝壳表面的角质层,最佳净化处理条件为:pH 13 NaOH溶液浸泡36 h,再经pH 2的乳酸溶液浸泡处理4 h。最佳处理条件下贻贝壳制备的粉末的明暗度由未处理组的67.28增加至93.02。SEM-EDS、FTIR及ICP-MS分析显示,NaOH-乳酸协同处理有效脱除了贻贝壳表面的黑色素、黏连角质层的低纯CaCO3及其吸附的Br、Zn、Pb等元素,净化后贻贝壳中CaCO3纯度显著提高,各元素质量比接近CaCO3中元素的理论质量比。本研究结果可为贻贝壳源高品质钙源补充剂的制备提供一定的借鉴和参考。
[1] GRIENKE U, SILKE J, TASDEMIR D.Bioactive compounds from marine mussels and their effects on human health[J].Food Chemistry, 2014, 142:48-60.
[2] ZHAN J X, LU J S, WANG D.Review of shell waste reutilization to promote sustainable shellfish aquaculture[J].Reviews in Aquaculture, 2022, 14(1):477-488.
[3] 叶剑, 徐仰丽, 张井, 等.海洋生物钙的开发利用研究进展[J].中国海洋药物, 2021, 40(5):71-78.
YE J, XU Y L, ZHANG J, et al.Research progress on exploitation and utilization of marine biological calcium[J].Chinese Journal of Marine Drugs, 2021, 40(5):71-78.
[4] LEE G W, YOON I S, LEE H J, et al.Properties of calcium lactate prepared from calcined littleneck clam Ruditapes philippinarum shell powder[J].Korean Journal of Fisheries and Aquatic Sciences, 2016, 49(4):436-444.
[5] 赵桂丰, 杨林, 陈雷, 等.微波高温加热法分解贝壳制取葡萄糖酸钙[J].大连工业大学学报, 2009, 28(6):438-440.
ZHAO G F, YANG L, CHEN L, et al.Production of calcium gluconate from shell by microwave high-temperature refining[J].Journal of Dalian Polytechnic University, 2009, 28(6):438-440.
[6] WANG Z, WANG K Y, FENG Y N, et al.Preparation, characterization of L-aspartic acid chelated calcium from oyster shell source and its calcium supplementation effect in rats[J].Journal of Functional Foods, 2020, 75:104249.
[7] YARRA T, RAMESH K, BLAXTER M, et al.Transcriptomic analysis of shell repair and biomineralization in the blue mussel, Mytilus edulis[J].BMC Genomics, 2021, 22(1):437.
[8] YAO Z T, XIA M S, LI H Y, et al.Bivalve shell:Not an abundant useless waste but a functional and versatile biomaterial[J].Critical Reviews in Environmental Science and Technology, 2014, 44(22):2502-2530.
[9] EPPLE M.Book review:Biomineralization principles and concepts in bioinorganic materials chemistry.by Stephen Mann[J].Angewandte Chemie International Edition, 2003, 42(4):381-382.
[10] 刘雅玫. 基于贻贝壳黑色素光热效应的抗菌活性对耐药性金黄色葡萄球菌感染伤口愈合的影响[D].青岛:青岛大学, 2020.
LIU Y M.Effect of antibacterial activity based on the photothermal effect of mussel shell melanin on wound healing of drug-resistant Staphylococcus aureus infection[D].Qingdao:Qingdao University, 2020.
[11] STEWART B D, JENKINS S R, BOIG C, et al.Metal pollution as a potential threat to shell strength and survival in marine bivalves[J].Science of the Total Environment, 2021, 755:143019.
[12] SONG J L, LIU G F, SONG Y H, et al.Positive effect of compound amino acid chelated calcium from the shell and skirt of scallop in an ovariectomized rat model of postmenopausal osteoporosis[J].Journal of the Science of Food and Agriculture, 2022, 102(4):1363-1371.
[13] 邵江娟, 王唯, 陈斌寅, 等.以牡蛎壳为钙源的L-天冬氨酸螯合钙的合成及其生物利用度研究[J].南京中医药大学学报, 2012, 28(4):371-373.
SHAO J J, WANG W, CHEN B Y, et al.Synthesis of L-aspartate chelating calcium with oysters as calcium source and investigation of its bioavailability[J].Journal of Nanjing University of Traditional Chinese Medicine, 2012, 28(4):371-373.
[14] XIE J W, LI H Y, CHE H X, et al.Extraction, physicochemical characterisation, and bioactive properties of ink melanin from cuttlefish (Sepia esculenta)[J].International Journal of Food Science &Technology, 2021, 56(7):3 627-3 640.
[15] MITITELU M, MORO AN E, NICOAR
AN E, NICOAR A C, et al.Development of immediate release tablets containing calcium lactate synthetized from black sea mussel shells[J].Marine Drugs, 2022, 20(1):45.
A C, et al.Development of immediate release tablets containing calcium lactate synthetized from black sea mussel shells[J].Marine Drugs, 2022, 20(1):45.
[16] VOICA C, DEHELEAN A, KOVACS M H, et al.The use of inductively coupled plasma mass spectrometry (ICP-MS) for the determination of toxic and essential elements in different types of food samples[C]//AIP Conference Proceedings.AIP, 2012.
[17] 邹德靓, 陈庆国, 杨平, 等.改性贻贝壳对亚甲基蓝的吸附去除研究[J].环境科学与技术, 2014, 37(12):214-217;252.
ZOU D L, CHEN Q G, YANG P, et al.Study on adsorption removal of methylene blue by modified mussel shell[J].Environmental Science &Technology, 2014, 37(12):214-217;252.
[18] FENG Q L, LI H B, PU G, et al.Crystallographic alignment of calcite prisms in the oblique prismatic layer of Mytilus edulis shell[J].Journal of Materials Science, 2000, 35(13):3337-3340.
[19] YANG X F.A self-constraint strengthening mechanism and its application to seashells[J].Journal of Materials Research, 1995, 10(6):1485-1490.
[20] 王芬, 余军霞, 肖春桥, 等.CO2碳化法制备微米级球霰石型食品碳酸钙的研究[J].硅酸盐通报, 2017, 36(1):43-50;56.
WANG F, YU J X, XIAO C Q, et al.Preparation of micro-size food-grade vaterite CaCO3 by CO2 carbonization method[J].Bulletin of the Chinese Ceramic Society, 2017, 36(1):43-50;56.
[21] CENTENO S A, SHAMIR J.Surface enhanced Raman scattering (SERS) and FTIR characterization of the sepia melanin pigment used in works of art[J].Journal of Molecular Structure, 2008, 873(1-3):149-159.
[22] TU Y G, SUN Y Z, TIAN Y G, et al.Physicochemical characterisation and antioxidant activity of melanin from the muscles of Taihe Black-bone silky fowl (Gallus Gallus domesticus Brisson)[J].Food Chemistry, 2009, 114(4):1345-1350.
[23] 周佑洲. 海水养殖中壳类废弃物的应用研究[D].杭州:浙江大学, 2018.
ZHOU Y Z.Study on application of shell waste from marine aquaculture[D].Hangzhou:Zhejiang University, 2018.
[24] 孙美玲, 冶育芳, 赵志西, 等.不同有机质对砷在针铁矿上吸附过程的影响[J].生态学杂志,2023,42(5):1115-1122.
SUN M L, YE Y F, ZHAO Z X, et al.Effects of different organic matter on the adsorption process of arsenic on goethite[J].Chinese Journal of Ecology, 2023,42(5):1115-1122.