酸面团是由谷物、水和活性微生物,如乳酸菌和(或)酵母菌,经过发酵制得的面团,是一种历史悠久的面食发酵剂。这些微生物将内在化学成分发酵成有机酸、风味化合物和其他重要代谢物,影响发酵面团或烘焙食品的质地、感官、营养和保质期特性[1]。目前,除小麦或黑麦外,其他谷物面粉,如鹰嘴豆,由于其独特的营养和功能特征,已被提议用于制作烘焙产品的酸面团[2]。在小麦粉中加入豆类面粉可以制成富含蛋白质的面制品,鹰嘴豆的氨基酸分布均衡和纤维含量高[3],可提高面包营养特性,为消费者提供一系列健康益处。
γ-氨基丁酸(gamma-aminobutyric acid, GABA)是神经系统中重要的抑制性神经递质[4],在预防糖尿病[5]、抗焦虑[6]、降血压[7]以及促进睡眠[8]等方面具有十分重要的作用。同时GABA还是食品当中重要的生物活性成分添加剂。因此富含GABA的功能性新食品的开发越来越受研究者关注,可将其用于发酵健康食品,制作富含GABA的功能性食品,以满足消费者需求。豆类含有丰富的底物谷氨酸,是乳酸菌产GABA重要的发酵基质。其中,鹰嘴豆蛋白质含量是小麦等谷物的2倍,它们是高质量、低成本且环境友好的蛋白质来源,可以用于控制和预防高血压等疾病[9]。利用高产GABA乳酸菌发酵酸面团以增加面制品中GABA含量,将GABA以面包等成品的形式呈现,使其成为消费者日常补充GABA的良好途径。
本研究以鹰嘴豆为发酵基质,通过胞外多糖(exopolysaccharides, EPS)、GABA等活性成分指标,选择短乳杆菌作为发酵菌株。以小麦面包面团(wheat bread dough, WBD)、鹰嘴豆面包面团(chickpea bread dough, CBD)和化学酸化鹰嘴豆面包面团(lactic/acetic acid acidified bread dough, LA/AA-BD)为对照,研究富集GABA乳酸菌发酵鹰嘴豆添加对面包面团的流变特性等影响,为开发富集GABA功能性发酵食品的应用奠定理论基础。
1 材料与方法
1.1 主要材料和试剂
金龙鱼面包用高筋小麦粉(淀粉质量分数68.54%,蛋白质质量分数11.56%),益海嘉里粮油;高活性干酵母(高糖型),安琪酵母有限公司;优级白砂糖,中粮集团(中国)有限公司;食用盐、新疆卡布里鹰嘴豆,市售;上述均为食品级。MRS固/液体培养基、酸面团,由实验室自制。
1.2 主要仪器设备
ZCZY-CS8型恒温培养摇床、DNP-9082型恒温培养箱,上海知楚仪器有限公司;GI54DWS型立式高压灭菌锅,厦门致微仪器有限公司;高效液相色谱系统(VWD检测器),美国安捷伦(Agilent)公司;TA.XT Plus物性分析仪,英国SMS公司;DISCOVERY HR-3流变仪,美国TA仪器公司。
1.3 实验方法
1.3.1 具GABA富集能力的乳酸菌初筛及酸面团发酵
1.3.1.1 鹰嘴豆发酵基质的制备
将保藏的6株乳酸菌作为发酵菌株,分别为嗜热乳杆菌ST(Streptococcus thermophilus HH-ST08)、保加利亚乳杆菌IB(Lactobacillus bulgaricus HH-IB57)、植物乳杆菌LP(Lactobacillus plantarum HH-LP56)、植物乳杆菌FS(Lactobacillus plantarum FSB7)、植物乳杆菌CI(Lactobacillus plantarum CICC21796)和短乳杆菌CG(Lactobacillus brevis CGMCC1.214)。取上述乳酸菌以体积分数1%接种量接种至液体MRS培养基中,30 ℃培养6 h。将菌液在4 ℃、6 000 r/min离心10 min,弃上清液,用生理盐水洗涤菌体2次并重悬于无菌水中。水与生鹰嘴豆粉按质量比1∶1混合,使其总菌落数达到107 CFU/g,于30 ℃发酵24 h。为提高乳酸菌鹰嘴豆酸面团中EPS产量,将10%(质量分数)的鹰嘴豆粉用蔗糖替代。发酵完成后得到上述6株乳酸菌对应的鹰嘴豆酸面团,分别简称为SCSD、ICSD、LCSD、FCSD、CCSD和BCSD;未发酵的鹰嘴豆面团为CD。
1.3.1.2 不同乳酸菌发酵鹰嘴豆中pH、可滴定酸度(titratable acid,TTA)和菌落总数的测定
按配方制备的发酵基质在30 ℃培养箱中观察24 h,定时取样。参考KATINA等[10]的方法,测定鹰嘴豆酸面团发酵前后pH和TTA。
用90 mL 8.5 g/L 的生理盐水稀释10 g鹰嘴豆酸面团,测定样品中的乳酸菌菌落数,继续稀释并在MRS琼脂上接种100 μL的稀释液,30 ℃恒温培养箱中培养48 h用于菌落计数。
1.3.1.3 鹰嘴豆酸面团冻干粉的制备
将样品放入-80 ℃冰箱中冷冻2 h后,置于冷冻干燥机中冻干。完成后使用研钵研磨成粉状,置于干燥器中以备后续实验使用。
1.3.1.4 鹰嘴豆酸面团中理化性质的测定
参照程新[11]的方法利用HPLC测定有机酸含量,并计算发酵熵。发酵熵是酸面团产生的乳酸与乙酸的比值。
参考TANG等[12]的方法测定EPS的含量;参考罗昆等[13]的方法测定多肽分子质量的分布;参考张宾乐[14]的方法测定游离氨基酸和GABA含量。
1.3.2 鹰嘴豆酸面团对面包面团性质的影响
1.3.2.1 面包面团制作
面包面团配方详见表1。将除黄油外的所有配料倒入搅拌缸中,设置搅拌参数:慢速搅拌3.0 min,使原料混合均匀;快速搅拌3.0 min,将原料搅拌成团。加入黄油后慢速搅拌1 min,再快速搅拌3.0 min,至面筋网络结构形成。将搅拌好的面团取出,覆上保鲜膜,室温下挤压走气泡,松弛10 min后收于自封袋中,备用。WBD、CBD、LA/AA-BD和BCSBD分别代表小麦面包面团、鹰嘴豆面包面团、乳酸/乙酸酸化面包面团和鹰嘴豆酸面包面团。其中,LA/AA-BD是在CBD配方的基础上,将850 g/L乳酸与醋酸按4∶1的体积比额外添加,面团pH值约为4.20,30 ℃培养箱中密封孵育24 h。
表1 四种面包面团的配方 单位:g
Table 1 Recipe of four types of bread
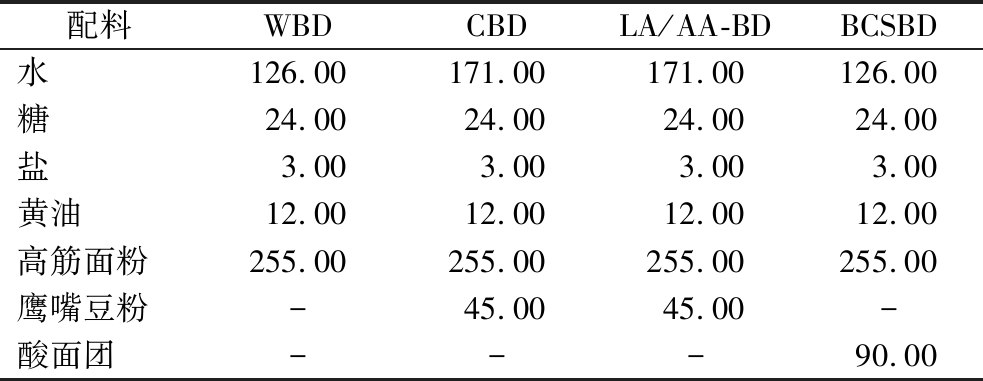
配料WBDCBDLA/AA-BDBCSBD水126.00171.00171.00126.00糖24.0024.0024.0024.00盐3.003.003.003.00黄油12.0012.0012.0012.00高筋面粉255.00255.00255.00255.00鹰嘴豆粉-45.0045.00-酸面团---90.00
1.3.2.2 酸面团动态流变学特性分析
应用具有平板(直径40 mm,间隙1 mm)的动态流变仪,在25 ℃下对面团进行振荡频率扫描测试。取2~3 g面团放置于帕尔贴板上,平衡松弛1 min,进行频率扫描(0.1~10 Hz)测试,应变为0.20%。记录弹性模量(G′)、黏性模量(G″)和损耗角正切(tanδ=G″/G′)。
1.3.3 数据处理分析
采用Origin Pro 2018以及SPSS 26等软件对数据进行分析,数据重复3次,数值以平均值±标准差表示。
2 结果与分析
2.1 不同菌株发酵鹰嘴豆酸面团pH、TTA和菌落总数的测定
如图1所示,酸面团的初始接种量为7 lg CFU/g。在鹰嘴豆发酵基质中,乳酸菌经过短暂的迟缓期迅速进入对数生长期。短乳杆菌CG(即BCSD中乳酸菌)在12 h趋于稳定,菌落总数达到10.30 lg CFU/g左右。随着发酵时间的延长,乳酸菌继续保持良好的生长繁殖的平衡态势。短乳杆菌CG在整个过程中对数期最长、后期生长最稳定。

图1 不同菌株发酵时期的菌落总数
Fig.1 Total viable counts of sourdough during fermentation using different strains
发酵过程中,乳酸菌代谢产生多种有机酸。这一过程降低了酸面团的pH,提高了TTA值,并影响了发酵基质中的内源性酶活力,进而改变了酸面团的各种生化特性[15]。整个对数生长期正是乳酸菌快速累积产酸的时期,发酵后期pH变化趋于平缓,可能是因为代谢产物的积累通过反馈调节从而减缓后期pH下降速率。如表2所示,酸面团在30 ℃下发酵24 h时pH下降至4.00左右。与酸面团的pH变化趋势相反的是,鹰嘴豆酸面团的可滴定酸含量随着发酵时间的延长而逐渐上升,从最初的TTA为5.75~6.35 mL增加到发酵24 h时26.20~27.65 mL。6株乳酸菌中,BCSD的pH值最高,且TTA最大,表明反应到达滴定终点时所需的碱液含量最多,推测其发酵后可能形成了更多pKa大的有机酸,从而使酸性环境更加稳定、缓冲能力更强。
表2 不同菌株发酵时期的pH和TTA
Table 2 pH and TTA of sourdough fermented using different strains during fermentation
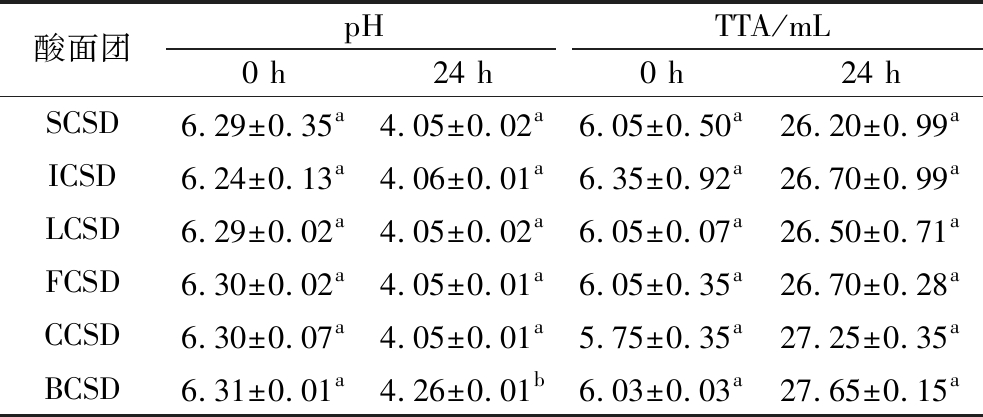
注:同列不同字母表示组间差异显著(P<0.05)。
酸面团pHTTA/mL0 h24 h0 h24 hSCSD6.29±0.35a4.05±0.02a6.05±0.50a26.20±0.99aICSD6.24±0.13a4.06±0.01a6.35±0.92a26.70±0.99aLCSD6.29±0.02a4.05±0.02a6.05±0.07a26.50±0.71aFCSD6.30±0.02a4.05±0.01a6.05±0.35a26.70±0.28aCCSD6.30±0.07a4.05±0.01a5.75±0.35a27.25±0.35aBCSD6.31±0.01a4.26±0.01b6.03±0.03a27.65±0.15a
2.2 酸面团有机酸分析
酸面团发酵时,微生物代谢发酵基质中的糖类物质并生成以乳酸和乙酸为主的有机酸[16]。发酵熵是影响酸面团发酵品质的重要参数,常用来关联酸化和风味的发酵参数之一[17]。发酵24 h后,BCSD的乳酸和乙酸的含量最低,分别为28.10和7.38 mmol/100 g。有机酸的差异导致不同酸面团的TTA值不同,主要是因为不同有机酸跃变范围不同[18],从而滴定时消耗的碱液量不同。从表3中可知,CCSD和BCSD最终发酵熵均在1.5~4的适宜范围内。
表3 不同菌株发酵前后有机酸含量和发酵熵
Table 3 Organic acid content and fermentation entropy of unfermented sourdough and sourdough fermented using different strains
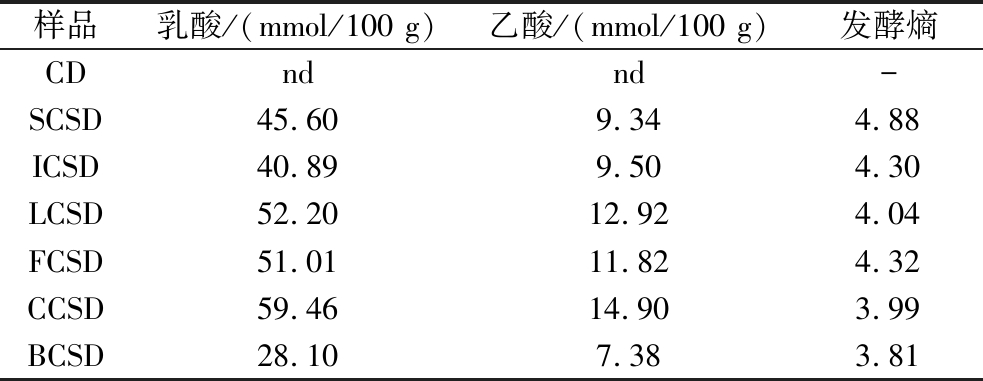
样品乳酸/(mmol/100 g)乙酸/(mmol/100 g)发酵熵CDndnd-SCSD45.609.344.88ICSD40.899.504.30LCSD52.2012.924.04FCSD51.0111.824.32CCSD59.4614.903.99BCSD28.107.383.81
2.3 酸面团EPS含量测定
如图2所示,BCSD中发酵产生的EPS量最多,为1 396.29 mg/L。结果表明,在乳酸菌发酵过程中,添加质量分数10%的蔗糖更加有利于菌种的生长代谢,加快其产酸速率。高糖和低pH等压力条件使得乳酸菌在保护机制作用下更偏向于合成EPS来增强自身存活能力[19]。

图2 不同菌株发酵产生的EPS含量
Fig.2 EPS content produced by of sourdough fermented using different strains
2.4 酸面团游离氨基酸和GABA含量的分析
在乳酸菌发酵鹰嘴豆酸面团过程中,鹰嘴豆的内源蛋白酶和乳酸菌自身酶系会促进蛋白和糖类代谢产生氨基酸,其对面包的营养性、特征风味的形成以及整体感官有很大的积极影响[20]。图3-a显示,经短乳杆菌CG发酵得到的鹰嘴豆酸面团(BCSD)中总游离氨基酸含量为1 645.73 mg/100 g,与未经发酵的鹰嘴豆酸面团(755.18 mg/100 g)相比,游离氨基酸含量显著提高。经乳酸菌发酵后,BCSD中必需氨基酸含量占总游离氨基酸的比例从鹰嘴豆面团(CD)的10.92%增至31.53%;由图3-b可知,6组发酵乳酸菌组中,BCSD组的GABA含量最高,是CD组的49.43倍。GABA在鹰嘴豆酸面团发酵过程中得到富集,面团的营养价值增强。

a-游离氨基酸含量;b-GABA含量
图3 不同菌株发酵前后的游离氨基酸和GABA含量
Fig.3 Free amino acid and GABA content of unfermented sourdough and sourdough fermented using different strains
2.5 酸面团多肽分子质量分布的分析
由图4所示,与对照组CD相比,经过6株乳酸菌发酵的鹰嘴豆酸面团的蛋白质得到很大程度的水解。经过24 h发酵,分子质量>5 000 Da的部分占比显著降低,从65.95%降到5.89%~3.9%,而分子质量在3 000~5 000 Da的大肽含量提高了1.25~2.08倍。尤其是分子质量<1 000 Da的低聚肽含量增加的最为显著,分别提高了47.37%~49.48%,BCSD中的低聚肽含量最多。小分子低聚肽直接被人体吸收,进而更好地发挥其生物学功能[21],增强产品的营养价值。实验表明乳酸菌发酵能有效地水解蛋白质,提高鹰嘴豆酸面团的低聚肽含量。6株乳酸菌中短乳杆菌CG水解效果最好,可能是因为其自身产生的蛋白酶和肽酶更活跃[22],酸面团酸化的环境更有利于激活蛋白酶水解,从而提高了低聚肽含量。小分子低聚肽能参与酶的合成、激发酶的活性,从而形成蛋白水解的良性循环促进。该结果与鹰嘴豆酸面团中游离氨基酸的含量较一致。

图4 不同菌株发酵前后的多肽分子质量分布图
Fig.4 Molecular weight distribution of peptides before and after fermentation of different strains
2.6 流变学特性分析
如图5所示,在同一扫描频率下,各面团的G′、G″大小为WBD>BCSBD>LA/AA-BD>CBD。与WBD比,BCSBD的G′和G″均明显下降。OSBORNE[23]和TAKEDA等[24]认为面筋蛋白在酸性pH下溶解度增加,可能是酸性环境中存在相当多的正净

a-弹性模量;b-黏性模量;c-损耗角正切值
图5 四种面团的弹性模量、黏性模量和损耗角正切值
Fig.5 Elastic modulus, viscous modulus and tangent value of loss angle of four types of dough
电荷[25],分子间静电排斥增大导致面筋蛋白的展开和疏水基团的暴露增加,促进部分化学键的断裂和阻止新键的形成,从而导致酸面团中的面筋网络更加柔软[26]。与LA/AA-BD相比,BCSBD的G′和G″都显著提高。这可能因为乳酸菌产生的EPS可以作为亲水胶体[27],改善面团的网络结构并促进其与谷蛋白交联,增强面团的黏弹性。与CAD相比,BCSBD的G′和G″都显著提高。这可能是因为鹰嘴豆粉的添加稀释了面团面筋,鹰嘴豆中的大分子蛋白质和淀粉颗粒等影响蛋白质分子之间二硫键的生成。损耗角(δ)表示面筋蛋白的弱化程度,tanδ值越大,表明弱化程度越显著。从图5-c可看出,随着频率的增加,4组面包面团的tanδ值均呈现先降低、后增大的趋势。BCSBD的tanδ值较接近于WBD,说明其有类似的硬度,易于加工成型。而CBD的tanδ值最大,面团的流动性较强,不易成型。
3 结论
本研究以新疆鹰嘴豆作为发酵基质,筛选短乳杆菌CG发酵成富集EPS和GABA的酸面团。鹰嘴豆酸面团发酵工艺参数为:菌种接种时期为6 h,发酵温度为30 ℃,发酵时间为24 h。此条件下,短乳杆菌CG在鹰嘴豆酸面团中生长良好,酸化能力强且GABA产量高。发酵后,鹰嘴豆蛋白降解效果最为明显,能促进大分子质量蛋白降解为小分子蛋白和低聚肽,且游离氨基酸和必需氨基酸含量显著增加。鹰嘴豆直接添加和化学酸化均不利于面团的形成及稳定,并且破坏面团的黏性和弹性之间的平衡。而乳酸菌发酵能够降低其产生的不利影响,赋予面团良好的流变特性,使其更加稳定。为开发富集GABA功能性发酵食品的应用奠定理论基础,此外,提高了鹰嘴豆在生产中的应用潜力。
[1] LAZO-VÉLEZ M A, GARZON R, GUARDADO-FÉLIX D, et al.Selenized chickpea sourdoughs for the enrichment of breads[J].LWT, 2021, 150:112082.
[2] MISHRA S, MISHRA H N.Effect of synbiotic interaction of fructooligosaccharide and probiotics on the acidification profile, textural and rheological characteristics of fermented soy milk[J].Food and Bioprocess Technology, 2013, 6(11):3166-3176.
[3] 武盟. 高产α-半乳糖苷酶乳酸菌的筛选及其在三种豆粉酸面团面包中的应用[D].无锡:江南大学, 2020.
WU M.Screening of high-producing α-galactosidase lactic acid bacteria and its application in three legume flour sourdough breads[D].Wuxi:Jiangnan University, 2020.
[4] WONG C T, BOTTIGLIERI T, SNEAD O C III.GABA, γ-hydroxybutyric acid, and neurological disease[J].Annals of Neurology, 2003, 54(S6):S3-S12.
[5] HUANG C Y, KUO W W, WANG H F, et al.GABA tea ameliorates cerebral cortex apoptosis and autophagy in streptozotocin-induced diabetic rats[J].Journal of Functional Foods, 2014, 6:534-544.
[6] SOMKUTI G A, RENYE J A Jr, STEINBERG D H.Molecular analysis of the glutamate decarboxylase locus in Streptococcus thermophilus ST110[J].Journal of Industrial Microbiology &Biotechnology, 2012, 39(7):957-963.
[7] YANG N C, JHOU K Y, TSENG C Y.Antihypertensive effect of mulberry leaf aqueous extract containing γ-aminobutyric acid in spontaneously hypertensive rats[J].Food Chemistry, 2012, 132(4):1796-1801.
[8] WU C L, HUANG Y H, LAI X F, et al.Study on quality components and sleep-promoting effect of GABA Maoyecha tea[J].Journal of Functional Foods, 2014, 7:180-190.
[9] XIAO Y, XING G L, RUI X, et al.Enhancement of the antioxidant capacity of chickpeas by solid state fermentation with Cordyceps militaris SN-18[J].Journal of Functional Foods, 2014, 10:210-222.
[10] KATINA K, SALMENKALLIO-MARTTILA M, PARTANEN R, et al.Effects of sourdough and enzymes on staling of high-fibre wheat bread[J].LWT - Food Science and Technology, 2006, 39(5):479-491.
[11] 程新. 湿热-多菌发酵对白芸豆面包营养及风味特性的影响[D].无锡:江南大学, 2021.
CHENG X.Effect of heat moisture treatment and multi-bacterial fermentation on nutrition and flavor characteristics of white kidney bean bread[D].Wuxi:Jiangnan University, 2021.
[12] TANG X J, LIU R S, HUANG W N, et al.Impact of in situ formed exopolysaccharides on dough performance and quality of Chinese steamed bread[J].LWT, 2018, 96:519-525.
[13] 罗昆, 曹伟超, 马子琳, 等.高产植酸酶乳酸菌发酵对黑豆面包蛋白质品质及烘焙特性的影响[J].食品科学, 2021, 42(6):111-117.
LUO K, CAO W C, MA Z L, et al.Effect of high-yield phytase lactic acid bacteria fermentation on protein and baking quality of black bean sourdough bread[J].Food Science, 2021, 42(6):111-117.
[14] 张宾乐. 红豆酸面团乳酸菌发酵及其提高冷冻面团烘焙品质机制研究[D].无锡:江南大学, 2021.
ZHANG B L.Red bean sourdough fermented by lactic acid bacteria and its mechanism studies on improving frozen dough baking properties[D].Wuxi:Jiangnan University, 2021.
[15] LI F H, DING Z T, KE W C, et al.Ferulic acid esterase-producing lactic acid bacteria and cellulase pretreatments of corn stalk silage at two different temperatures:Ensiling characteristics, carbohydrates composition and enzymatic saccharification[J].Bioresource Technology, 2019, 282:211-221.
[16] SAHIN A W, RICE T, ZANNINI E, et al.Leuconostoc citreum TR116:In-situ production of mannitol in sourdough and its application to reduce sugar in burger buns[J].International Journal of Food Microbiology, 2019, 302:80-89.
[17] CODA R, NIONELLI L, RIZZELLO C G, et al.Spelt and emmer flours:Characterization of the lactic acid bacteria microbiota and selection of mixed starters for bread making[J].Journal of Applied Microbiology, 2010, 108(3):925-935.
[18] XU Y, CODA R, SHI Q A, et al.Exopolysaccharides production during the fermentation of soybean and fava bean flours by Leuconostoc mesenteroides DSM 20343[J].Journal of Agricultural and Food Chemistry, 2017, 65(13):2805-2815.
[19] YANG H, HE M W, WU C D.Cross protection of lactic acid bacteria during environmental stresses:Stress responses and underlying mechanisms[J].LWT, 2021, 144:111203.
[20] PAN C X, CUI H P, HAYAT K, et al.Exogenous glutamic acid effectively involved in N-(1-deoxy-D-galulos-1-yl)-glutamic acid degradation for simultaneous improvement of both milk-like and baking flavor[J].Food Bioscience, 2022, 47:101697.
[21] ZHU X P, SUN-WATERHOUSE D, TAO Q A, et al.The enhanced serotonin (5-HT) synthesis and anti-oxidative roles of Trp oligopeptide in combating anxious depression C57BL/6 mice[J].Journal of Functional Foods, 2020, 67:103859.
[22] 方芳, 冀林立, 张彦斌, 等.产耐热蛋白酶乳酸菌的筛选、产酶条件及其酶学性质的研究[J].食品科学, 2008, 29(10):375-379.
FANG F, JI L L, ZHANG Y B, et al.Screening of thermoduric proteinase-producing lactic acid bacteria, conditions of enzyme production and properties of produced thermoduric proteinase[J].Food Science, 2008, 29(10):375-379.
[23] OSBORNE T B.The Proteins of The Wheat Kernel[M].Washington, D.C.:Carnegie Institution, 1907.
[24] TAKEDA K, MATSUMURA Y, SHIMIZU M.Emulsifying and surface properties of wheat gluten under acidic conditions[J].Journal of Food Science, 2001, 66(3):393-399.
[25] CLARKE C I, SCHOBER T J, DOCKERY P, et al.Wheat Sourdough Fermentation:Effects of Time and Acidification on Fundamental Rheological Properties[M]//Using Cereal Science and Technology for the Benefit of Consumers.Amsterdam:Elsevier, 2005:163-168.
[26] WOLTER A, HAGER A S, ZANNINI E, et al.Evaluation of exopolysaccharide producing Weissella cibaria MG1 strain for the production of sourdough from various flours[J].Food Microbiology, 2014, 37:44-50.
[27] B RCENAS M E, DE LA O-KELLER J, ROSELL C M.Influence of different hydrocolloids on major wheat dough components (gluten and starch)[J].Journal of Food Engineering, 2009, 94(3-4):241-247.
RCENAS M E, DE LA O-KELLER J, ROSELL C M.Influence of different hydrocolloids on major wheat dough components (gluten and starch)[J].Journal of Food Engineering, 2009, 94(3-4):241-247.