草莓是一种非呼吸跃变型水果,凭借独特的外观、良好的口感和极高的营养价值,成为消费者中意的水果之一[1]。草莓营养丰富,但采收后易受到微生物污染,将其加工制作成果脯可有效延长其货架期[2]。在果脯加工中,渗糖是最重要的环节,对果脯风味质地的形成起着关键作用[3]。
目前果脯加工仍主要沿用传统工艺方法,即以白砂糖为渗透介质进行渗透并结合热风进行脱水干燥[4]。糖渍方式可以分为液态渗透和固态渗透。液态渗透(liquid osmotic dehydration,LOD)是指将果蔬等浸入渗透溶液;固态渗透(solid osmotic dehydration,SSD)是指将果蔬等直接接触固体渗透剂。渗透过程包括3种传质流动[5-6]:果蔬内的水和溶质向渗透环境中传递;从果蔬中渗出的物质又从渗透环境回入果蔬内;渗透环境中的渗透剂(糖、盐等)向果蔬内渗透。另外,果脯类产品的质地与高甲氧基果胶的形成息息相关[7],这种形成依赖于蔗糖与草莓内果胶在渗透过程中的相互作用,且这种作用有时间依赖性[8]。糖渍过程中糖含量的增加与水分的脱除一直是草莓果脯加工中的关注点,不同的渗糖工艺也会对果脯品质造成显著影响[9],但研究多针对最终产品品质和不同渗透剂及其浓度的选择,对不同的工艺以及过程中变化关注较少。
本文分别对液态渗透中草莓果(G-LOD)和浸渍液(Y-LOD)以及固态渗透中草莓果(G-SSD)和浸出液(Y-SSD)的水分、总酸、总糖、花青素(以花色苷表示)、主要有机酸和主要可溶性糖进行测定,分析草莓糖渍体系中这些成分在固(草莓果)、液(浸渍液/浸出液)两相中动态变化,从而为草莓果脯工艺的改进、质量的提升提供理论依据。
1 材料与方法
1.1 材料与主要设备
材料:速冻蒙特瑞草莓购于云南曲靖。
主要试剂:苯酚、盐酸,成都市科龙化工试剂厂;葡萄糖、果糖、蔗糖、柠檬酸、苹果酸、NaHCO3、酚酞、浓H2SO4、CH3COONa(均为分析纯),国药集团化学试剂有限公司;色谱纯甲醇,德国Merck公司;色谱纯乙腈、色谱级磷酸,美国TEDIA公司。
主要设备:FE20实验室pH计,上海梅特勒-托利多仪器有限公司;HH-8数显恒温水浴锅,上海江星仪器有限公司;TG16-WS台式高速离心机,上沙湘仪离心机仪器有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;安捷伦1200高效液相色谱仪,美国Agilent公司。
1.2 试验方法
1.2.1 原料处理
大小、形状、成熟度一致的冷冻草莓(每只草莓约5 g),于3 g/L的Na2SO3溶液解冻6 h。解冻后分装为19份,每份30 g,取其中一份,用吸水纸除去表面水分,匀浆于-80 ℃冰箱冻存作为未糖渍样品。其余18份分为2组,每组6个,一组按照料液比1∶4(g∶mL)加入300 g/L的蔗糖溶液即对应每份30 g草莓加入120 mL蔗糖溶液(共36 g蔗糖)做为液态浸渍,另一组按照草莓质量的30%添加蔗糖(每份30 g草莓加入9 g蔗糖)做为固态浸渍。2种浸渍方法均每隔8 h由此至浸渍72 h,2种浸渍方法各有9个不同浸渍时间的样品。样品浸渍过程中包覆容器密闭,避免水分挥发及外源污染,试验重复3次。浸渍后的草莓表面用蒸馏水冲洗、沥干、研磨匀浆,于-80 ℃冰箱冻存待指标测定。
1.2.2 浸渍液/浸出液的分离
至每个浸渍设定时间时,用镊子沿容器壁取出草莓,采用移液枪吸去草莓表面以及容器内液体,分离出的液体转移至量筒测定体积,并采用pH计测定其pH值。最后分装入具盖离心管于-80 ℃冰箱冻存,待指标测定。
1.2.3 总糖和主要可溶性糖含量测定
参照文献[10-11],并加以调整。
草莓中糖的提取:称取0.5 g解冻搅匀后的草莓浆于离心管,加入30 mL蒸馏水,45 ℃、180 W超声波水浴60 min提取,将匀浆液在9 000 r/min离心8 min,取上清液作为提取液。
总糖的测定:取糖提取液稀释50倍,吸取1 mL于20 mL试管,加入2 mL蒸馏水,再加入60 g/L苯酚溶液1 mL,混匀后加浓H2SO4 6 mL,混合均匀,放置30 min冷却至室温。以水为空白对照,在490 nm处测吸光值,结果以葡萄糖等价值表示(g/100 g)。
主要可溶性糖的测定,取糖的提取液,过0.45 μm滤膜,采用高效液相色谱对果糖、葡萄糖和蔗糖含量进行测定。采用Agilent Zorbax Carbohydrate色谱柱(150 mm×4.6 mm,5 μm),示差折光检测器(differential refraction detector,RID),流动相为V(乙腈)∶V(水)=75∶25,流速0.8 mL/min,柱温30 ℃,进样量20 μL。定性定量方法:通过与标准样品保留时间比对进行定性,外标法定量。
浸渍液/浸提液稀释30倍,同上述方法进行总糖和游离糖的测定。
1.2.4 总酸和有机酸含量测定
总酸测定:参考GB 12456—2021《食品安全国家标准 食品中总酸的测定》酸碱指示滴定法。称取2.0 g草莓浆加入8 mL蒸馏水在研钵中匀浆,转移至离心管中。在85 ℃下水浴1 h后9 000 r/min离心15 min,取上清液5 mL用0.01 mol/L的NaOH溶液进行滴定,浸渍液则吸取5 mL直接进行滴定,结果以无水柠檬酸等价值表示(mg/g)。
有机酸的测定:草莓果中有机酸提取条件同1.2.3节糖的提取。高效液相色谱条件:采用ZORBAX Eclipse XDB-C18色谱柱;流动相V(0.1% KH2PO4,体积分数)∶V(甲醇)=96∶4,流速1 mL/min,柱温25 ℃,紫外检测器(ultraviolet detector,DAD),λ=214 nm,进样量20 μL。定性定量方法:通过与柠檬酸、苹果酸标准样品比对进行定性,外标法定量。
1.2.5 花青素的测定
采用pH示差法。称取草莓浆1.0 g,以酸乙醇[V(99%无水乙醇)∶V(0.2 mol/L盐酸)=3∶2]为提取剂,料液比1∶10(g∶mL),样品溶解后,在50 ℃水浴下提取60 min,提取液离心20 min,转速4 000 r/min。取上清液,分别用pH 1.0的KCl缓冲液和pH 4.5的无水CH3COONa缓冲液稀释10倍,平衡110 min,在525和700 nm波长处测定稀释液的吸光度。按照下列公式计算花色苷含量:
花色苷![]()
A=(A525-A700)pH 1-(A525-A700)pH 4.5
式中:MW,矢车菊花素-3-葡萄糖苷的重均分子质量,449.2 g/mol;DF,稀释因子;ε,矢车菊花素-3-葡萄糖苷的消光系数,26 900 L/(mol·cm);L,光程。
1.2.6 数理统计
采用Excel、Origin 2019对数据进行分析处理。采用SPSS 26软件进行统计学分析,数据采用单因素方差分析。另外采用RStudio中corrplot数据包,进行相关性分析。
2 结果与分析
2.1 浸渍过程中浸渍/浸出液体积与pH
一般而言,LOD渗透过程主要是渗透环境中的溶质向物料内迁移,SSD则主要为组织内的水分向外界渗透,过程进行的程度取决于细胞膜两侧的渗透压差异[12]。成熟草莓的含糖量在4%~8%,含水量在90%左右,因此试验中LOD和SSD条件足以形成渗透压使草莓部分脱水。如图1所示,LOD中,前8 h浸渍液增加了1 mL,应该是草莓中的水分在渗透压作用下逸出进入浸渍液,使浸渍液体积增加;但随后至72 h体积无显著变化(P<0.05),可能是由于细胞结构和草莓内糖对水分的束缚作用[13],渗透压难以将草莓中水分进一步脱除。而在SSD过程中,外界渗透压远高于LOD,其水分迅速渗出,糖渍8 h时浸出液达13 mL,此后仍缓慢增加,至24 h时浸出液增加至15 mL并保持至48 h无显著变化(P<0.05);48 h后浸出液的体积出现下降趋势,但下降幅度较小,有可能是存在水分回渗现象[6]。试验草莓每份30 g,SSD浸渍24 h时浸出液15 mL,据此估算草莓脱水超过1/2,与LOD浸渍中脱水1 mL相比,显然SSD相比LOD有更好的脱水效果。

图1 LOD和SSD过程中渗透环境的体积变化
Fig.1 Changes in volume of the osmotic environment during LOD and SSD
如图2所示,LOD在浸渍8 h时pH值为3.96,在24 h时下降为3.72,随后趋于稳定。SSD浸渍8 h时浸出液pH值为3.43,至16 h时基本未变,但随后出现上升趋势,在32 h上升至3.9,其后又略有下降,在56~72 h无显著变化(P<0.05),pH稳定在3.77。pH与H+浓度相关,在草莓浸出液中,H+应来自于草莓中有机酸的逸出。由SSD浸渍过程中pH 变化推测,可能是由于在8~32 h水分的渗出速度大于有机酸,有机酸被稀释,使浸出液的pH值呈现上升趋势。但是水分的渗出速度和有机酸并不同步,随着渗透环境中水分不再增加,而有机酸继续渗出,pH又有所下降。另外SSD的pH最低值(8 h时,3.43)与新鲜草莓汁的pH(3.3左右)接近,鉴于SSD中浸出液全部来自于草莓,因此推测在浸渍初期,水分大量渗出之时也是有机酸渗出最集中的时段,此时其浓度甚至可能接近草莓汁中有机酸浓度。

图2 LOD和SSD过程中渗透环境的pH的变化
Fig.2 Changes in pH of the osmotic environment during LOD and SSD
2.2 浸渍过程中总糖和可溶性糖含量
脱水是果脯制作过程中的重要步骤,而果蔬的含糖量,是渗糖效果的重要体现[14]。图3为草莓果和浸渍液/浸出液中总糖含量在渗透过程的变化曲线。LOD和SSD 草莓果和浸渍液/浸出液中总糖总体变化趋势相同,均表现为浸渍/浸出液中糖浓度下降和果中糖含量上升,并且最后二者趋于相等,说明2种渗透方式都符合报道中基本的渗透脱水规律[15]。但是,LOD过程中,浸渍液中总糖浓度变化幅度较小,浸渍至72 h时总糖浓度为初始值的88.7%,而SSD中总糖浓度则为8 h时的64.6%;另外浸渍至72 h时,G-LOD中的总糖增加至23.23 g/100 g,G-SSD中的总糖增加至31.44 g/100 g,G-SSD的总糖含量显著高于G-LOD(P<0.05)。LOD和SSD两种糖渍体系中虽然外源蔗糖与草莓的质量的比值分别为9∶30和36∶30,但SSD体系中没有外源水,其中的蔗糖均为草莓中水的渗出而溶解和稀释,而LOD体系中存在大量外源水,因此Y-LOD相比Y-SSD糖浓度变化幅度更小,但是,整个浸渍过程中Y-SSD总糖浓度均高于Y-LOD,如浸渍8 h时二者分别为46.9 g/100 mL和25.2 g/100 mL,显然SSD能形成更高的渗透压,能促进G-SSD更高效地摄入糖。

图3 LOD和SSD过程中总糖含量变化
Fig.3 Changes in total sugar content during LOD and SSD
另外,2种渗透过程中,草莓果的糖含量变化均表现为先快后慢,其中0~16 h均为G-LOD和G-SSD的糖含量快速增长期,16 h时G-LOD和G-SSD含糖量分别达到浸渍过程最高值的62.03%和66.80%;其中8 h时二者含糖量由3.37 g/100 g分别上升至9.21 g/100 g和18.98 g/100 g,分别上升2.73和5.63倍。糖渍过程中草莓果中糖含量增加的这种先快后慢的现象,可能一方面因为外源糖向果皮和从果表皮向果肉内的渗透速度不是匀速的[14],另一方面因为渗透过程中浸渍液中糖浓度不断降低,渗透压差逐渐减小。而SSD渗糖效率更高,除了有更高的渗透压差外,还可能与外源糖渗入草莓内部即外皮至果肉传递路径的长短有关[16],SSD体系中草莓失水更多,草莓体积明显较LOD体系中的小,糖的渗透路径较短。相比LOD,G-SSD中糖含量的增加更早进入渗透的“缓速期”[14],前8 h总糖增加量比LOD大26.07%,但8~16 h的糖增加量开始减小,而G-LOD总糖含量增加量在前8 h和8~16 h差异较小。
图4为果糖、葡萄糖和蔗糖在草莓果和浸渍液/浸出液的含量变化图。可以看到仅浸渍/浸出液中蔗糖含量随时间延长表现为下降趋势,果糖、葡萄糖2种糖含量无论是在草莓果还是浸渍/浸出液,均表现为上升趋势。糖渍前草莓中含有果糖、葡萄糖和蔗糖,浸渍体系中仅添加了蔗糖,因此浸渍体系中果糖和葡萄糖含量的增加,很可能是因为存在蔗糖分解为葡萄糖和果糖的过程[17]。另外,LOD体系中葡萄糖和果糖变化曲线与SSD浸渍明显不同,如图4-a所示,在LOD体系中,无论是浸渍液还是草莓果中,2种糖的含量变化曲线几乎重合;但如图4-b所示,在SSD体系中2种糖的含量随时间延长差距变大,并表现为果中的葡萄糖含量高于果糖,而浸出液中果糖的含量高于葡萄糖。未浸渍处理的草莓中葡萄糖和果糖的含量分别为1.73 g/100 g和1.64 g/100 g,至浸渍结束时,浸渍液和草莓果中葡萄糖和果糖的含量均表现为SSD>LOD,对于葡萄糖,G-SSD为G-LOD的2.90倍,Y-SSD为Y-LOD的3.35倍;对于果糖,G-SSD为G-LOD的1.45倍,Y-SSD为Y-LOD的4.90倍。蔗糖可以转化为同摩尔数的葡萄糖与果糖,在LOD中果糖和葡萄糖含量同步同量增加现象应该体现了蔗糖的这种转化作用,而SSD中葡萄糖和果糖在草莓果和浸出液中并未等同分布,这可能说明在SSD过程中,葡萄糖更易与草莓中某些物质形成络合,与果糖形成渗透差别[17]。

a1-Y-LOD;a2-G-LOD;b1-Y-SSD;b2-G-SSD
图4 LOD和SSD过程中可溶性糖含量变化
Fig.4 Changes in soluble sugar content during LOD and SSD
浸渍液/浸出液中蔗糖的变化趋势与图3中总糖的变化相似。但是草莓中的蔗糖含量出现了新的趋势:(1)如图4-a1所示,在LOD体系中草莓中蔗糖含量在32 h上升至最高值12.18 g/100 g,之后含量在12.10 g/100 g和8.24 g/100 g之间上下波动;(2)如图4-b2所示,在SSD体系中草莓蔗糖含量在24 h达到12.63 g/100 g,随后呈下降趋势,至72 h时蔗糖含量降至3.1 g/100 g,其中在40 h时出现的小幅上升有可能与浸出液体积的减小(如图1所示)使得果外渗透压增加有关。另外虽然LOD和SSD草莓中蔗糖含量的最高值接近,但在浸渍72 h时,G-SSD中蔗糖含量仅为G-LOD的31.63%。在浸渍72 h时,相比LOD,SSD中蔗糖含量较低,而葡萄糖、果糖含量较高,据报道有机酸可以促进蔗糖的分解[18],推测具有更低pH的SSD体系(如图2所示)更加促进了蔗糖的分解。SSD体系中浸渍后期草莓和浸出液中蔗糖含量均在降低,猜测蔗糖在草莓果内外均存在转化。果脯中转化糖的含量对果脯质量至关重要[19],草莓中有机酸对蔗糖的转化如何作用仍需进一步分析。
2.3 浸渍过程中总酸和主要有机酸含量
图5为浸渍过程中总酸含量的变化图。总酸是水果及水果制品品质分析中的重要指标,浸渍前草莓中总酸含量为8.50 mg/g。
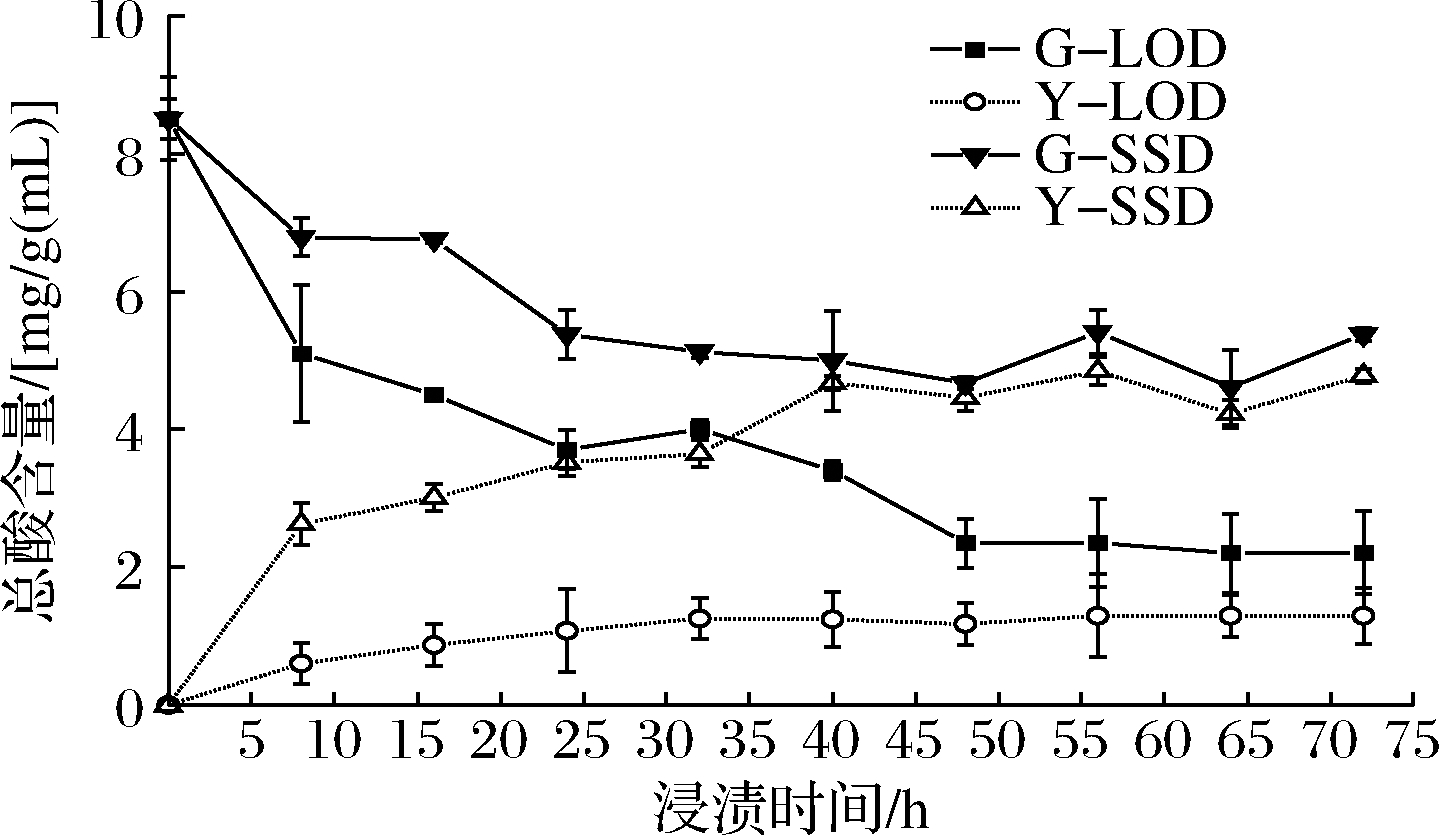
图5 LOD和SSD过程中总酸含量变化
Fig.5 Changes in total acid content during LOD and SSD
随浸渍时间延长2种浸渍体系中草莓总酸含量均呈下降趋势,同时浸渍液/浸出液中总酸含量上升,随后趋于平衡。2种浸渍体系中,草莓果中总酸含量的下降速度均表现为先快后慢,其中G-LOD和G-SSD在前8 h内总酸损失量占据了总损失的54.05%和55.00%。草莓果中总酸的减少与总糖的增加(图3)表现出同步性,说明糖和酸的传质存在一定的互斥性。在48~72 h Y-LOD和G-LOD无显著变化(P<0.05),说明总酸在浸渍液和草莓果内的变化趋于平缓,而Y-SSD和G-SSD在24 h时这种现象就开始出现,至浸渍结束时,LOD和SSD两种体系中草莓果总酸含量分别为2.21和5.38 mg/g,分别为初始含量的26.00%和63.29%。这可能是因为SSD中外源蔗糖浓度较高,较高浓度蔗糖阻碍着总酸的释放[20]。另外,至浸渍结束时,综合浸渍/浸出液中总酸浓度与体积(图1)计算,LOD浸渍液中总酸达156.09 mg,草莓果总酸减少6.29 mg/g;而SSD体系中浸出液中的总酸为64.53 mg,草莓果总酸减少3.13 mg/g,显然SSD相比LOD保留了更多的总酸,这有可能是因为Y-SSD有机酸浓度较Y-LOD高,减缓了草莓果中有机酸向外渗出。
柠檬酸和苹果酸为草莓中主要的有机酸,不同品种或者成熟度草莓中柠檬酸与苹果酸之间的比值存在较大差异[21],本试验草莓2种酸含量接近,柠檬酸含量略高于苹果酸。图6为LOD和SSD体系中柠檬酸和苹果酸的含量变化曲线。

a1-Y-LOD;a2-G-LOD;b1-Y-SSD;b2-G-SSD
图6 LOD和SSD过程中主要有机酸含量变化
Fig.6 Changes in major organic content during LOD and SSD
2种浸渍体系中柠檬酸和苹果酸的含量变化与总酸的变化趋势类似:浸渍液中2种酸含量在浸渍早期显著上升,随后上升幅度减小最后趋于平衡;草莓果中2种酸则表现为下降趋势。但是2种浸渍体系中有机酸含量在草莓果内外分布则表现出明显不同:(1)如图6-a1所示,Y-LOD中2种有机酸的含量在浸渍初期(8 h)接近,但随着浸渍时间延长,苹果酸的含量显著高于柠檬酸(24 h),并且32~72 h酸的浓度呈同步增长,2种酸的浓度差别小。而对于Y-SSD,正如图6-b1所示,2种酸的浓度在16~64 h时表现出显著差异(P<0.05),并表现为柠檬酸高于苹果酸的不规则比例分布。另外,浸渍72 h时 Y-LOD中2种有机酸的浓度和(1.1 mg/mL)低于Y-SSD(5.26 mg/mL),这同样与LOD体系中浸渍液体积大于SSD的浸出液体积有关。(2)两种体系草莓果中两种酸含量均呈波动下降趋势,并且变化幅度接近。如图6-a2所示,其中G-LOD苹果酸含量由2.15 mg/g下降至1.5 mg/g,柠檬酸含量由2.20 mg/g下降至1.43 mg/g,保留率分别为69.77%和65.00%;由图6-b2可知,G-SSD中苹果酸的含量由8 h的1.89 mg/g下降至1.36 mg/g,柠檬酸含量由2.12 mg/g下降至1.46 mg/g,保留率分别为71.96%和68.87%。G-SSD的苹果酸和柠檬酸的保留率均高于LOD,与G-SSD总酸的损失量较少一致。
2.4 浸渍过程中花青素含量
图7为浸渍过程中花青素含量变化图,花青素是一种水溶性酚类物质,在草莓中广泛存在,是草莓中重要的营养物质[22]。G-LOD和G-SSD中花青素均随渗透时间先下降而Y-LOD和Y-SSD中含量上升。本研究中浸渍前草莓花青素含量为8.62 mg/100 g,浸渍结束时,G-LOD花青素下降为4.01 mg/100 g,保留率为46.52%;G-SSD中花青素下降至1.50 mg/100 g,保留率为18.40%,LOD体系中草莓果中花青素保留率显著高于SSD体系。糖渍会使果实内酚类物质含量降低,在芒果中的研究发现SSD较LOD更有利于总酚的保留[23],但本研究中SSD过程较LOD损失更严重,并且SSD中花青素在0~8 h损失量达总损失量的70.22%,而此阶段LOD中花青素损失量为总损失量的69.48%,鉴于0~8 h也是SSD体系中浸出液体积上升最迅速的时间段,鉴于花青素易溶于水,因此推测SSD体系中花青素可能伴随水分渗出而损失。另外,LOD和SSD中草莓果和浸渍/浸出液的花青素含量与总糖和总酸含量趋于相等不同,花青素随浸渍时间延长含量变化曲线均在40 h出现交叉,浸渍/浸出液中花青素含量随后高于草莓果。天然花青素可与一个或多个葡萄糖通过糖苷键形成花色苷,与一些含羧基成分形成酸基化的花色素[24],因此推测糖渍过程中糖和有机酸等成分的渗入渗出也可能对草莓浸渍体系中花青素分布产生了影响。

图7 LOD和SSD过程中花青素含量变化
Fig.7 Changes in anthocyanin content during LOD and SSD
2.5 浸渍过程中各指标相关性分析
图8为浸渍过程中各指标相关性图,体现了渗糖过程中各指标之间的关系。

图8 不同渗透方式下指标间相关性图
Fig.8 Correlation graph between indicators under different osmotic dehydration methods
注:S表示G-SSD,SY表示Y-SSD,L表示G-LOD,LY表示Y-LOD;*P<0.05,**P<0.01,***P<0.001。
在草莓的糖渍体系中,无论是LOD还是SSD,在渗透压的作用下,蔗糖作为溶质均会渗入草莓内,同时草莓内水分、有机酸、花青素逸出;据报道,由于各自的作用方式有所差别,各指标的变化趋势也不同[25]。2种糖渍过程中总糖、总酸在浸渍液和草莓果中均表现为显著负相关(P<0.01),草莓果内的总糖与葡萄糖和果糖均存在极显著的正相关(P<0.001),进一步说明外源蔗糖进入草莓果内后发生了转化为葡萄糖和果糖的反应。花青素含量在浸渍液和草莓果中呈负相关性,但未达到显著水平,另外,和柠檬酸、苹果酸含量之间的正相关性也不显著,这可能是由于糖渍后期果实中外源糖的比重增加,改变了花青素在果实中的质量比例。然而,仅在SSD浸渍中,草莓果中的总糖以及葡萄糖和果糖的含量与花青素含量均呈现了极显著的负相关性(P<0.001),这似乎说明糖与花青素之间存在着竞争关系。另外,LOD浸渍液和SSD浸出液中pH值变化与柠檬酸、苹果酸及总酸均表现为显著的负相关关系(P<0.01),说明草莓内的有机酸等酸性物质渗出使得pH降低,但在LOD中相关性更为显著(P<0.001)。
蔗糖会在酸性条件下形成转化糖,添加柠檬酸可以促进这种转化,草莓糖渍体系中由于草莓含有有机酸,这可能促进蔗糖转化为葡萄糖和果糖,并且果糖和葡萄糖由于具有更小的分子质量,更易进入到果实内部[26]。无论是LOD还是SSD,果实中和浸出液中葡萄糖和果糖之间均极显著正相关(P<0.001),并且SSD果实中和浸出液中蔗糖含量和2种转化糖含量表现均为极显著的负相关关系(P<0.001),说明了草莓糖渍体系中确实存在着蔗糖转化为葡萄糖和果糖的过程,并且果实内3种糖含量的增加速度趋于一致。LOD果实中蔗糖与2种转化糖含量未表现出显著相关关系,这可能说明果实中3种糖在糖渍体系中均可能存在“往复渗透”现象[6],并且LOD体系中蔗糖浓度低于SSD体系,蔗糖渗透压较低,果实内蔗糖增加速度较慢,使得3种可溶性糖的相关性不明显(P>0.05)。
3 结论
LOD和SSD均为蜜饯类产品加工的常用方式,本研究发现2种浸渍方式均可实现草莓果内水分流失与糖含量的增加,但SSD相比LOD可脱除更多的水分并表现出更高的渗糖效率。草莓果内糖含量的增加均表现为先快后慢的变化规律,在快速渗糖的浸渍前期酸和花青素也大量流失。另外,浸渍过程中,渗透体系中的蔗糖向葡萄糖和果糖发生着转化,其中具有更低pH浸出液的SSD更加促进了这种转化。总之,SSD相比LOD,具有糖用量少、可更有效脱水、渗糖效率高、酸保留率高的优势。但是SSD浸渍中如何控制花青素的流失和浸渍过程中糖的转化程度值得进一步研究。
[1] NAYAK S L, SETHI S, SHARMA R R, et al.Aqueous ozone controls decay and maintains quality attributes of strawberry (Fragaria×ananassa Duch.)[J].Journal of Food Science and Technology, 2020, 57(1):319-326.
[2] 李宇泽, 韩爱云.草莓保鲜技术的研究进展[J].农产品加工, 2021(6):88-90;93.
LI Y Z, HAN A Y.Research progress in strawberry storage preservation technology[J].Farm Products Processing, 2021(6):88-90;93.
[3] 潘莹瑛. 芒果果脯热风干燥及组合干燥对比研究[D].南宁:广西大学, 2013.
PAN Y Y.Hot air drying of mango preserved fruit and combined-drying comparative study[D].Nanning:Guangxi University, 2013.
[4] 刘艳, 唐小闲, 张巧, 等.微波渗糖加工低糖大果山楂果脯工艺研究[J].中国果菜, 2020, 40(6):52-57.
LIU Y, TANG X X, ZHANG Q, et al.Processing technology of low-sugar preserved Malus domeri(bois)chev.by microwave-assisted sugar permeation[J].China Fruit &Vegetable, 2020, 40(6):52-57.
[5] PARK K J, BIN A, PEDRO REIS BROD F.Drying of pear d’Anjou with and without osmotic dehydration[J].Journal of Food Engineering, 2003, 56(1):97-103.
[6] 程璐. 渗透脱水在果蔬加工中的研究进展[J].畜牧与饲料科学, 2010, 31(8):94-97.
CHENG L.Research advance on application of osmotic dehydration in fruit and vegetable’s processing[J].Animal Husbandry and Feed Science, 2010, 31(8):94-97.
[7] KARBOUNE S, KHODAEI N. Structures, isolation and health-promoting properties of pectic polysaccharides from cell wall-rich food by-products: A source of functional ingredients[J]. Current Opinion in Food Science, 2016, 8:50-55.
[8] RAO M A, COOLEY H J.Dynamic rheological measurement of structure development in high-methoxyl pectin/fructose gels[J].Journal of Food Science, 1993, 58(4):876-879.
[9] LIU Z L, XIE L, ZIELINSKA M, et al.Pulsed vacuum drying enhances drying of blueberry by altering micro-, ultrastructure and water status and distribution[J].LWT, 2021, 142(8):111013.
[10] 蔡红梅, 田子玉.苯酚-硫酸法测定草莓中总糖含量[J].吉林农业, 2019(4):46.
CAI H M, TIAN Z Y.Determination of total sugar content in strawberry by phenol-sulfuric acid method[J].Agriculture of Jilin, 2019(4):46.
[11] 桂远方. 真空冷冻干燥草莓粉品质评价研究[D].南京:南京师范大学, 2016.
GUI Y F.Research on quality evaluation of vacuum freeze-dried strawberry powder[D].Nanjing:Nanjing Normal University, 2016.
[12] ZOU K J, TENG J W, HUANG L, et al.Effect of osmotic pretreatment on quality of mango chips by explosion puffing drying[J].LWT - Food Science and Technology, 2013, 51(1):253-259.
[13] DE OLIVEIRA M M, TRIBST A A L, DE CASTRO LEITE B R Jr, et al.Effects of high pressure processing on cocoyam, Peruvian carrot, and sweet potato:Changes in microstructure, physical characteristics, starch, and drying rate[J].Innovative Food Science &Emerging Technologies, 2015, 31:45-53.
[14] 李勤勤, 李佳慧, 马晓敏, 等.果脯渗糖工艺研究进展[J].食品工业, 2021, 42(6):362-366.
LI Q Q, LI J H, MA X M, et al.Research progress in sugar permeation technology of preserved fruits[J].The Food Industry, 2021, 42(6):362-366.
[15] ASSIS F R, MORAIS R M S C, MORAIS A M M B.Mass transfer in osmotic dehydration of food products:Comparison between mathematical models[J].Food Engineering Reviews, 2016, 8(2):116-133.
[16]  SPIR A, TO
SPIR A, TO RUL
RUL  T.Osmotic dehydration of apricot:Kinetics and the effect of process parameters[J].Chemical Engineering Research and Design, 2009, 87(2):166-180.
T.Osmotic dehydration of apricot:Kinetics and the effect of process parameters[J].Chemical Engineering Research and Design, 2009, 87(2):166-180.
[17] 莫崧鹰. 用反渗透法分离果糖和葡萄糖[J].广州食品工业科技, 1986, 2(4):48-50.
MO S Y.Separation of fructose and glucose by reverse osmosis[J].Modern Food Science and Technology, 1986, 2(4):48-50.
[18] 高海生, 张烨.果脯蜜饯生产中容易出现的质量问题与解决方法[J].中国农村小康科技, 2000(7):33-34.
GAO H S, ZHANG Y.Quality problems and solutions in the production of preserved fruits and preserves[J].Chinese Counfryside Well-Off Technology, 2000(7):33-34.
[19] 邢英丽, 郝义, 徐凌.果脯生产中的质量问题及解决方法[J].农村实用工程技术, 1998, 18(9):30-31.
XING Y L, HAO Y, XU L.Quality problems and solutions in preserved fruit production[J].Agricultural Engineering Technology, 1998, 18(9):30-31.
[20] 胡丽菊, 孟宪军, 孙希云, 等.不同预处理方式对冻藏草莓品质的影响[J].食品科学, 2014, 35(22):293-296.
HU L J, MENG X J, SUN X Y, et al.Effect of different pretreatments on the quality of frozen strawberries[J].Food Science, 2014, 35(22):293-296.
[21] 严嘉玮, 路洪艳, 李莉, 等.2种草莓成熟过程中果实特征品质指标的变化[J].食品科学, 2017, 38(4):125-132.
YAN J W, LU H Y, LI L, et al.Variations in quality characteristics of two strawberry cultivars during fruit ripening[J].Food Science, 2017, 38(4):125-132.
[22] 段文凯, 尹涛, 解玲琴.草莓花青素的微波提取工艺研究[J].现代食品, 2016(20):79-84.
DUAN W K, YIN T, XIE L Q.Research on the microwave technology of anthocyanin from strawberry[J].Modern Food, 2016(20):79-84.
[23] 王俊涛. 固体糖渍对芒果脱水传质和品质的影响研究[D].南宁:广西大学, 2020.
WANG J T.Study on the effect of solid sugar cane on dehydration mass transfer and quality of mango[D].Nanning:Guangxi University, 2020.
[24] 赵宇瑛, 张汉锋.花青素的研究现状及发展趋势[J].安徽农业科学, 2005, 33(5):904-905;907.
ZHAO Y Y, ZHANG H F.Current situation and investigation of anthocyanidin and its progressive trend[J].Journal of Anhui Agricultural Sciences, 2005, 33(5):904-905;907.
[25] KHAN M A M, AHRNÉ L, OLIVEIRA J C, et al.Prediction of water and soluble solids concentration during osmotic dehydration of mango[J].Food and Bioproducts Processing, 2008, 86(1):7-13.
[26] 黄静, 杨政水.莴笋渗糖的影响因素分析[J].贵州农业科学, 2006, 34(3):13-15.
HUANG J, YANG Z S.Analysis of affecting factors infiltration sugar of lettuce[J].Guizhou Agricultural Sciences, 2006, 34(3):13-15.