我国柑橘生产长达4 000多年,历史悠久、资源丰富,品种齐全,以宽皮柑橘、橙类、柚类、柠檬和金柑5大类为主。2019年我国柚类产量达598.28万t,占总柑橘产量的13.05%,仅次于宽皮柑橘和甜橙类。根据地理、气候和品种类型自然组合,我国的柚产区形成了东南沿海柚区、华南柚区、西南柚区3个主产区。其中,梁平柚、沙田柚、龙安柚和东风早等为西南柚区主要栽培品种。柚类主要用于果汁、糖果、果酱罐头及精油等制备,但柚类加工量不到柚类产量的1%[1-2]。柚果实营养丰富,富含类黄酮[3-6]、酚酸[4-5, 7]、香豆素[5, 8]、类柠檬苦素[9]、类胡萝卜素[10]、生物碱[11]、肌醇[12-13]和挥发性物质[14]等多种生物活性成分。这些功能性成分,在柚果不同部位、不同成熟期其组成也有很大的差异[15]。
目前,国内外对柚果实营养功能成分报道主要集中于单一品种和单一成分,而不同成熟期的研究较少。胡阳等[16]比较了不同生长期琯溪蜜柚囊衣和外皮层中柚皮苷含量变化,其含量随成熟期呈下降趋势。XU等[7]研究了不同成熟期胡柚果皮和果肉中酚酸的组成和分布,结果表明,肉桂型在酚酸中占主导地位,阿魏酸最为丰富,且果皮含量高于果肉;每个部位的酚酸含量随着成熟度急剧降低。CANCALON等[17]利用HPLC-MS研究了成熟度、加工和贮藏对葡萄柚及其果汁中6′,7′-二羟基香柠檬亭、香柠檬素、香柑醇等呋喃香豆素的影响。SUN等[9]分析了不同成熟期胡柚、佛香柚、温州密柑和椪柑等4个柑桔品种不同组织中柠檬素和诺米林的含量变化,结果表明,柠檬素和诺米林的含量从4月开始增加,9月初达到峰值,随后下降,直到10月下旬达到一个稳定的低水平。CHAUDHARY等[14]利用顶空固相微萃取气质联用(headspace-solid phase microextraction-gas chromatography-mass spectrometer,HS-SPME-GC-MS)技术鉴定了葡萄柚汁中的挥发性化合物,且成熟度对柚汁的挥发性成分有显著影响。NIE等[18]利用主成分分析对不同采收期马家柚的抗氧化能力综合评价,结果表明,抗坏血酸、番茄红素、类胡萝卜素、总酚和总黄酮等成分与抗氧化能力呈显著正相关,确定最佳采收期为11月初。但俊峰等[19]分析了浙江省一带的4个柚品种不同组织部位、不同生长期主要功能性成分的含量差异。
本文基于超高效液相色谱-三重四极杆串联质谱(ultra-performance liquid chromatography-quadrupole-tandem mass spectrometry,UPLC-QqQ-MS/MS)快速确证分析多种次生代谢产物技术,选取了西南地区6种特色柚果(东风早柚、琯溪蜜柚、长寿沙田柚、梁平柚、龙安柚和丰都红心柚),靶向筛查和定量分析不同成熟期柚果重要部位(外皮层、内皮层和果肉)中主要营养功能成分,旨在为柚果功能食品的开发、品种选育及深加工领域提供可靠的数据支撑。
1 材料与方法
1.1 材料与试剂
东风早柚、琯溪蜜柚、长寿沙田柚、梁平柚、龙安柚均来自于中国农业科学院柑桔研究所国家果树种质重庆柑桔圃,丰都红心柚采集于重庆丰都县。采集成熟度以时期[幼果期(简称M1)、膨大期(M2)、生长膨大期(M3)、成熟转色期(M4)和商业成熟期(M5)]及果实大小为依据,东风早柚属于早熟柚,其他5个品种属于中熟柚,具体采摘信息如表1所示,分别制取外皮层、内皮层和果肉3个部位样品。
表1 柚果实信息
Table 1 Sample information of six pomelo fruits

品种简称资源编号M1M2M3M4M5东风早DFLG02752021-06-012021-07-152021-08-052021-09-052021-10-10琯溪蜜柚GXLG00382021-06-202021-08-102021-09-152021-10-152021-11-15长寿沙田柚CSLG01252021-06-202021-08-102021-09-152021-10-152021-11-15梁平柚LPLG00062021-06-202021-08-102021-09-152021-10-152021-11-15丰都红心柚FD重庆丰都2021-06-202021-08-102021-09-152021-10-152021-11-15龙安柚LALG01912021-06-202021-08-102021-09-152021-10-152021-11-15
甲酸(色谱纯),上海麦克林生化科技有限公司;86种标准物质包括42种类黄酮、27种香豆素、8种酚酸、6种生物碱和3种类柠檬苦素;半齿泽兰素-5-甲醚、4′,5,6,7-四甲氧基黄酮和3′,4,7,8-四甲氧基黄酮,纯度均≥95.0%;4′,5,7,8-四甲氧基黄酮、5-羟基-3′,4′,7-三甲氧基黄酮、异橙黄酮、4′,5,7,8-四甲氧基黄酮、水仙苷、芹菜素、栎精-3,7,3′,4′-四甲醚、牡荆素、异牡荆素、异槲皮苷、槲皮素、佛手柑内酯、花椒毒素、异橙皮内酯、香柑醇、水合氧化前胡素、氧化前胡素、异紫花前胡内酯、珊瑚菜素、蛇床子素、8-氧甲基异欧前胡内酯、绿原酸和黄柏酮,纯度均≥98.0%;柠檬内酯(纯度≥98.2%)、异欧前胡素和欧前胡素(纯度均≥99.0%),上海源叶生物技术有限公司;橙皮苷(纯度≥97.1%)、甜橙黄酮和芥子酸(纯度均≥98.0%)、牡荆素-2-O-鼠李糖苷和原儿茶酸(纯度均≥98.1%)、枸橘苷(纯度≥98.4%)、野漆树苷和桔皮素(纯度均≥98.5%)、柚皮苷和橙皮素(纯度均≥98.6%)、新橙皮苷和香草酸(纯度均≥98.8%),根皮素(纯度≥98.9%)、芦丁(纯度≥99.1%)、香蜂草苷和咖啡酸(纯度均≥99.3%)、金合欢素(纯度≥99.4%)、川陈皮素(纯度≥99.7%)、p-香豆酸(纯度≥99.8%)、对羟基苯甲酸和阿魏酸(纯度均≥99.9%),上海安谱实验科技股份有限公司;3′,4′,5,7-四甲氧基黄酮、维采宁-2、5-羟基-4′,7,8-三甲氧基黄酮、斯皮诺素、5-降甲基蜜桔黄素、蔓荆子黄素、圣草次苷、栀子黄素B、地奥司明、新地奥司明、异鼠李素-3-O-新橙皮苷、香蒲新苷、甲基橙皮苷、柚皮素、异补骨脂素、东莨菪亭、香叶木素、甜菜碱、诺米林和柠檬苦素,纯度均≥98.0%,成都克洛玛生物科技有限公司;橙皮内酯水合物、橙皮内酯(纯度均≥90.0%)、6′,7′-二羟基香柠檬亭(纯度≥95.1%)、大麦芽碱(纯度≥97.5%)、6′,7′-环氧香柠檬亭(纯度≥97.8%)、橙皮油素和酪胺(纯度均≥98.5%)、辛弗林(纯度≥98.8%)、甲醇(色谱纯)、乙腈(色谱纯),美国Sigma-Aldrich公司;滨蒿内酯(纯度≥95.0%)、香柠檬素(纯度≥96.9%)、8-牻牛儿醇基补骨脂素(纯度≥98.5%)、补骨脂素(纯度≥99.1%)、N-甲基酪胺(纯度≥99.5%)、5-牻牛儿醇基-7-甲氧基香豆素(纯度≥99.9%),美国ChromaDex公司;伞形花内酯(纯度≥99.0%)、章鱼胺(纯度≥99.3%),德国Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
Nexera X2 UPLC超高效液相色谱,日本岛津公司;SCIEX 6500+三重四极杆串联质谱,美国AB SCIEX公司;ACQUITY UPLC BEH T3色谱柱(2.1 mm×100 mm, 1.7 μm),美国Waters公司;Milli-Q Advantage A10超纯水器,美国Millpore公司;XS205电子天平(感量0.01 mg),PB3002-S/FACT分析天平(感量0.01 g),瑞士梅特勒-托利多公司;0.22 μm有机相针式滤器,上海安谱科学仪器有限公司;KQ5200DE超声波清洗仪,昆山市超声仪器有限公司;3K15高速冷冻离心机,Sigma-Aldrich (USA)。
1.3 实验方法
1.3.1 液相条件
色谱柱:ACQUITY UPLC HSS T3(2.1 mm×100 mm, 1.7 μm);柱温度40 ℃;流速为0.3 mL/min;进样量1.0 μL;流动相:体积分数0.1%的甲酸水溶液(A)和乙腈(B);梯度洗脱程序见表2。
表2 流动相梯度洗脱
Table 2 Gradient elution of mobile phase
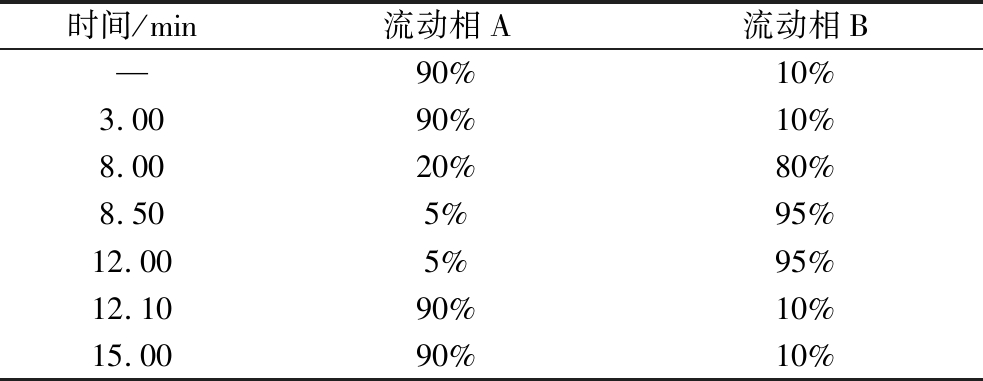
时间/min流动相A流动相B—90%10%3.0090%10%8.0020%80%8.505%95%12.005%95%12.1090%10%15.0090%10%
1.3.2 质谱条件
Sciex QTrap®6500的质谱数据是采用多反应监测模式(multiple reaction monitoring,MRM),质谱条件、86种目标化合物及其MRM参数参考文献[20]和[21]。
1.3.3 混合标准溶液配制
将86种目标化合物配制为0.01、0.02、0.05、0.10、0.20、0.50、1、2、5、10、20、25、50和100 μg/L一系列质量浓度的混标。所有混标均置于棕色进样小瓶中。
1.3.4 样品前处理
分别称取5.00 g鲜重样品于50 mL离心管中,加入甲醇(外皮层、内皮层中加入10 mL,果肉中加入5 mL),25 ℃、200 W超声波提取30 min;10 000 r/min离心5 min,保留取上清液。残渣重复4次,将上清液合并,并用甲醇定容(外皮层、内皮层定容至50 mL,果肉定容至25 mL),0.22 μm微孔有机滤膜过滤,上机检测。
1.4 数据处理
采用Origin 2022软件绘图、处理数据,所有样品均为3次平行。
2 结果与分析
2.1 柚果实不同成熟期功能成分的靶向筛查
柚果实外皮层、内皮层和果肉3个重要部位提取物中筛查出功能成分的种类及数量见表3,同一品种、同一成熟期、不同部位筛查出的种类数量均呈以下规律:外皮层>内皮层>果肉;随成熟期的延长,同一品种、同一部位筛查出的种类数量有明显变化,变幅为2~9种,平均变幅为4.6种,最高为梁平柚外皮层由幼果期到膨大期的转变;随成熟期的延长,外皮层和内皮层筛查出的种类数量大致呈增加趋势,而果肉则大致呈减少趋势。3个部位累计筛查出72种物质,14种未筛查出的物质如下:3′,4′,5,7-四甲氧基黄酮、4′,5,7,8-四甲氧基黄酮、5-羟基-3′,4′,7-三甲氧基黄酮、甲基橙皮苷、芦丁、蔓荆子黄素、新地奥司明、斯皮诺素等8种类黄酮,佛手柑内酯、异欧前胡素、香柠檬素、异补骨脂素、花椒毒素等5种香豆素和大麦芽碱1种生物碱。其中,梁平柚外皮层,最高可达70种,东风早最少(56种);丰都红心柚内皮层,最高可达61种,琯溪蜜柚最少(50种);东风早果肉,最高可达56种,琯溪蜜柚最少(45种)。
表3 柚果实中筛查的功能成分的种类及数量
Table 3 Types and quantities of functional components screened in six pomelo fruits

注:F代表类黄酮;P代表酚酸;C代表香豆素;L代表类柠檬苦素;A代表生物碱。
品种成熟期外皮层内皮层果肉FPCLA总计FPCLF总计FPCLF总计DFM1268153456268163457278143355M2248163556248163354268153456M3268153557278143355258123452M4298143458288143356258133352M5278153558258163355258153455GXM1308153561238143452248153353M2298173562258133352228103346M332816356429811345524863445M43081735632888335024893448M531718356425813345322893446CSM1297143558258132452238153453M2288143558258133453258123452M3317143560268133454238113348M4318143561268113452248113349M5318153562288153458258103450LPM1308153561258143454248153353M2338213570258163456258123250M3308183564268153456238143351M4328183566278153457258113451M5318193566268163457248103449FDM1308183564308163461238153352M2278183561268163356218113346M327818356127816335723893346M4298183563268163356268113351M5318193566268163457228103346LAM1328173565278152456248153353M2318183565248163455248133351M3308183564238153453228133450M4318173564268163457268133353M5318163563278163458238113449
就类黄酮而言,同一品种、同一成熟期不同部位筛查出种类数量也呈以下规律:外皮层>内皮层>果肉。川陈皮素、牡荆素-2-O-鼠李糖苷、野漆树苷、维采宁-2、桔皮素、甜橙黄酮、根皮素、5-降甲基蜜桔黄素、5-羟基-3′,4′,7-三甲氧基黄酮、圣草次苷、水仙苷、牡荆素、异牡荆素、柚皮苷、柚皮素、槲皮素16种类黄酮在不同品种、不同成熟期、不同部位均有检出。柚果实的类黄酮主要以黄烷酮为主,包括柚皮苷和圣草次苷。有关柚果中多甲氧基黄酮的研究较少,如有文献报道:在柚果中鉴定出川陈皮素、桔皮素和甜橙黄酮等多甲氧基黄酮[19];而在本论文中6个柚果样品中均有桔皮素、甜橙黄酮、5-降甲基蜜桔黄素、5-羟基-3′,4′,7-三甲氧基黄酮等多甲氧基黄酮检出。梁平柚外皮层,最高可达33种,东风早最少(24种);丰都红心柚内皮层,最高可达30种,琯溪蜜柚和龙安柚最少(23种);东风早果肉,最高可达27种,丰都红心柚最少(21种)。这与筛查出功能成分的总种类数量规律基本吻合。
就香豆素而言,外皮层筛查出的种类数量略高于内皮层和果肉,其中梁平柚外皮层最高可达21种。随着成熟期的延长,柚果肉中香豆素种类显著性减少,而外皮层和内皮层香豆素种类变化不大。佛手柑内酯、异欧前胡素、香柠檬素、异补骨脂素、花椒毒素等5种香豆素在不同品种、不同成熟期、不同部位均未有检出;异橙皮内酯、橙皮油素、6′,7′-环氧香柠檬亭、异紫花前胡内酯、珊瑚菜素、蛇床子素等6种香豆素在外皮层中未检出,而在果肉和内皮层中部分检出;欧前胡素、补骨脂素、滨蒿内酯、柠檬内酯、东莨菪亭、香叶木素等6种香豆素在果肉中未检出,而在外皮层和内皮层中部分检出。
就酚酸而言:随成熟期的延长,同一品种、同一部位筛查出的酚酸种类数量没有明显变化;对羟基苯甲酸、芥子酸、对香豆酸、原儿茶酸、阿魏酸和绿原酸等6种酚酸在不同品种、不同成熟期、不同部位均有检出;香草酸在商业成熟期的琯溪蜜柚外皮层中未检出,咖啡酸在幼果期和生长期的长寿沙田柚外皮层中未检出。
就类柠檬苦素而言:柠檬苦素在不同品种、不同成熟期、不同部位均有检出;诺米林在幼果期的龙安柚内皮层中未检出,黄柏酮在幼果期的长寿沙田柚内皮层中未检出。
就生物碱而言:随成熟期的延长,同一品种、同一部位筛查出的生物碱种类数量没有明显变化;辛弗林和酪胺在不同品种、不同成熟期、不同部位均有检出,而大麦芽碱均未检出;章鱼胺和N-甲基酪胺在不同品种、不同成熟期的外皮层中均检出,这2种生物碱在内皮层和果肉中均未检出。
2.2 柚果实不同成熟期功能成分的定量分析
对筛查出的功能成分进行了定量分析,共计26种物质高于定量限,包括11种类黄酮、8种香豆素、4种酚酸和3种类柠檬苦素,分别是野漆树苷、维采宁-2、根皮素、圣草次苷、水仙苷、牡荆素、异牡荆素、地奥司明、柚皮苷、香蒲新苷、柚皮素、香柑醇、橙皮油素、6′,7′-环氧香柠檬亭、6′,7′-二羟基香柠檬亭、伞形花内酯、橙皮内酯水合物、蛇床子素、橙皮内酯、香草酸、对羟基苯甲酸、对香豆酸、阿魏酸、诺米林、柠檬苦素、黄柏酮。对不同成熟期外皮层、内皮层和果肉功能成分的含量做了热图,其含量用不同颜色表示,红色代表该物质在样品中的含量高,蓝色则代表该物质在样品中的含量低,绿色代表其含量低于定量限,结果如图1所示。就整体而言,类黄酮、香豆素和类柠檬苦素是6种柚果的3类主要生物活性成分,而酚酸和生物碱的含量相对较低。

a-外皮层;b-内皮层;c-果肉
图1 柚果不同成熟期外皮层、内皮层和果肉的功能成分含量热图
Fig.1 Heat map functional of components in flalbedo, albedo, and pulp of pomelo fruits at different maturity stages
26种功能成分在外皮层中变化趋势,如图1-a所示。外皮层的类黄酮主要以柚皮苷、维采宁-2和野漆树苷为主,6个品种在同一成熟期基本呈现柚皮苷>维采宁-2>野漆树苷的规律;柚皮苷含量随着成熟期呈现先升高后降低趋势,6个品种柚皮苷含量均在生长膨大期达到最大值(图2-a),这与文献报道基本吻合[16];而维采宁-2和野漆树苷含量基本呈现下降趋势(图2-b和图2-c)。生长膨大期龙安柚的柚皮苷可达最高(3 772.20 mg/kg FW),丰都红心柚最低(813.13 mg/kg FW);幼果期琯溪蜜柚的维采宁-2可达最高(832.30 mg/kg FW),长寿沙田柚最低(126.23 mg/kg FW);幼果期琯溪蜜柚的野漆树苷可达最高(681.97 mg/kg FW),丰都红心柚最低(8.87 mg/kg FW)。较于内皮层和果肉,外皮层中的香豆素更丰富,其中以橙皮内酯、6′,7′-环氧香柠檬亭和橙皮内酯水合物为主,橙皮油素和蛇床子素次之,大多数品种其含量随着成熟期均呈现下降趋势(图3-a~图3-e):膨大期梁平柚的橙皮内酯可达2 416.18 mg/kg FW,丰都红心柚的仅为4.32 mg/kg FW;幼果期琯溪蜜柚的6′,7′-环氧香柠檬亭高达1 449.22 mg/kg FW,龙安柚的仅为69.47 mg/kg FW;幼果期东风早的橙皮内酯水合物高达886.58 mg/kg FW,龙安柚的仅为6.11 mg/kg FW。龙安柚、丰都红心柚外皮层中酚酸以香草酸最为丰富,其他品种酚酸含量不高,组成和分布也不尽相同。类柠檬苦素以柠檬苦素和诺米林为主,还有少量的黄柏酮,其含量随着成熟期均呈现降低的趋势,这与文献报道基本吻合[19]:膨大期丰都红心柚的柠檬苦素可达178.41 mg/kg FW,东风早的仅为24.69 mg/kg FW;膨大期长寿沙田柚的诺米林可达224.17 mg/kg FW,龙安柚的仅为0.013 mg/kg FW(图4-a、图4-b)。

a~c-外皮层;d~f-内皮层;g~i-果肉
图2 柚果不同成熟期外皮层、内皮层和果肉的主要类黄酮含量
Fig.2 The contents of main flavonoids in flalbedo, albedo, and pulp of pomelo fruits at different maturity stages

a~e-外皮层;f-内皮层;g~i-果肉
图3 柚果不同成熟期外皮层、内皮层和果肉的主要香豆素含量
Fig.3 The contents of main coumarins in flalbedo, albedo, and pulp of pomelo fruits at different maturity stages

a~b-外皮层;c~d-内皮层;e~f-果肉
图4 柚果不同成熟期外皮层、内皮层和果肉的主要类柠檬苦素含量
Fig.4 The contents of main limonoids in flalbedo, albedo and pulp of pomelo fruits at different maturity stages
26种功能成分在内皮层中变化趋势,如图1-b所示。内皮层的类黄酮也是以柚皮苷、野漆树苷和维采宁-2为主,6个品种在同一成熟期均呈现柚皮苷>野漆树苷>维采宁-2的规律;与外皮层相似,柚皮苷含量随着成熟期呈现先升高后降低趋势,柚皮苷含量均在生长膨大期达到峰值(图2-d),而野漆树苷和维采宁-2含量大致呈现下降趋势(图2-f和图2-e)。较于外皮层和果肉,内皮层中的柚皮苷普遍更为丰富。生长膨大期龙安柚的柚皮苷可达最高(9 537.83 mg/kg FW),丰都红心柚最低(2 784.68 mg/kg FW),这与外皮层柚皮苷分布规律吻合;幼果期琯溪蜜柚的野漆树苷可达最高(180.72 mg/kg FW),梁平柚最低(14.33 mg/kg FW);膨大期琯溪蜜柚的维采宁-2可达最高(56.21 mg/kg FW),梁平柚最低(5.31 mg/kg FW),这与内皮层野漆树苷分布规律吻合。内皮层的香豆素以橙皮内酯水合物为主,还有少量的6′,7′-环氧香柠檬亭和6′,7′-二羟基香柠檬亭,其含量随着成熟期呈现下降的趋势(图3-f):幼果期东风早的橙皮内酯水合物可达最高(172.89 mg/kg FW),丰都红心柚的仅为3.54 mg/kg FW。较外皮层,内皮层中酚酸的含量偏低,其变化趋势也不尽相同。类柠檬苦素以柠檬苦素和诺米林为主,黄柏酮次之,其含量随着成熟期均呈现降低趋势,这与文献报道基本吻合[19]:幼果期琯溪蜜柚的柠檬苦素可达75.86 mg/kg FW,东风早的仅为23.59 mg/kg FW;幼果期长寿沙田柚的诺米林可达228.34 mg/kg FW,梁平柚的仅为44.00 mg/kg FW(图4-c、图4-d)。
26种功能成分在果肉中变化趋势,如图1-c所示。果肉的类黄酮以柚皮苷、野漆树苷和维采宁-2为主,其含量随着成熟期而下降,这与文献报道的结果相似[19]:随着成熟度的上升,四季柚、文旦(授粉和未授粉)和早香柚4种柚果实果肉中的黄酮类物质含量多数在下降,并且初期急剧下降。在本论文中,幼果期琯溪蜜柚的柚皮苷可达最高(906.01 mg/kg FW),长寿沙田柚最低(49.77 mg/kg FW);幼果期梁平柚的野漆树苷可达最高(572.40 mg/kg FW),琯溪蜜柚最低(低于定量限);幼果期长寿沙田柚的维采宁-2可达最高(302.50 mg/kg FW),龙安柚最低(52.32 mg/kg FW)(图2-g~图2-i)。果肉中香豆素以6′,7′-二羟基香柠檬亭、6′,7′-环氧香柠檬亭和橙皮油素为主,其含量随着成熟期整体呈现下降的趋势,这与文献报道较吻合[17]:白马叙葡萄柚汁中6′,7′-二羟基香柠檬亭和香柠檬素含量会随着成熟度延长而显著降低,而香柑醇含量随着成熟度延长先升高后降低。在本论文中,幼果期琯溪蜜柚的6′,7′-二羟基香柠檬亭可达354.32 mg/kg FW,龙安柚的仅为0.003 mg/kg FW;膨大期东风早的6′,7′-环氧香柠檬亭高达212.07 mg/kg FW,梁平柚的仅为0.019 mg/kg FW;幼果期东风早的橙皮油素高达139.11 mg/kg FW,梁平柚仅为0.069 mg/kg FW(图3-g~图3-i)。与外皮层和内皮层相似,果肉中酚酸的含量均偏低,此结果与提取方式有直接关系[22];酚酸含量大多随成熟期而降低,这与文献报道吻合[7]。类柠檬苦素以柠檬苦素和诺米林为主,其含量也随着成熟期先上升再下降,大多在膨大期附近达到最高值,这与文献报道一致[9]:膨大期长寿沙田柚的柠檬苦素可达88.17 mg/kg FW,梁平柚的仅为4.06 mg/kg FW;成熟转色期琯溪蜜柚的诺米林可达126.73 mg/kg FW,丰都红心柚的仅为16.86 mg/kg FW(图4-e、图4-f)。
3 结论
本文选取了西南地区6种特色柚果(东风早柚、琯溪蜜柚、长寿沙田柚、梁平柚、龙安柚和丰都红心柚),利用超高效液相色谱-三重四极杆串联质谱技术,靶向筛查和定量分析了5个成熟期、3个重要部位(外皮层、内皮层和果肉)中主要生物活性成分。结果表明,5个成熟期,累计筛查出72种活性成分;对筛查出的活性成分进行了定量分析,共计26种,包括11种类黄酮、8种香豆素、4种酚酸和3种类柠檬苦素。就整体而言,类黄酮、香豆素和类柠檬苦素是6种柚果的3类主要生物活性成分,而酚酸和生物碱的含量相对较低。随着成熟度的延长,外皮层和内皮层的柚皮苷均呈现先升高后降低趋势,且在生长膨大期达到最大值,果肉的柚皮苷和3个部位的维采宁-2和野漆树苷整体呈现下降趋势。3个部位的香豆素和类柠檬苦素含量随着成熟度大多呈现下降趋势。此研究结果明确了柚果实生长过程中生物活性成分的动态变化规律,为柚果功能食品的开发、品种选育及深加工领域提供可靠的数据支撑。
[1] 郑淑娟, 罗金辉.中国柚类产业现状与发展分析[J].广东农业科学, 2010, 37(1):192-194.
ZHENG S J, LUO J H.Present situation and development analysis of pomelo industry in China[J].Guangdong Agricultural Sciences, 2010, 37(1):192-194.
[2] 沈兆敏. 我国柑橘生产销售现状及发展趋势[J].果农之友, 2021(3):1-4.
SHEN Z M.Present situation and development trend of citrus production and sales in China[J].Fruit Growers’ Friend, 2021(3):1-4.
[3] XI W P, FANG B, ZHAO Q Y, et al.Flavonoid composition and antioxidant activities of Chinese local pummelo (Citrus grandis Osbeck.) varieties[J].Food Chemistry, 2014, 161:230-238.
[4] 张桂伟, 张秋云, 江东, 等.中国主栽葡萄柚果肉酚类物质组成及其抗氧化活性[J].中国农业科学, 2015, 48(9):1785-1794.
ZHANG G W, ZHANG Q Y, JIANG D, et al.Phenolic composition and antioxidant activities of grapefruit varieties cultivated in China[J].Scientia Agricultura Sinica, 2015, 48(9):1785-1794.
[5] 龚蕾. 不同柚类中酚类物质的检测及差异性研究[D].重庆:西南大学, 2016.
GONG L.Detection and difference of phenols in different pomelos[D].Chongqing:Southwest University, 2016.
[6] CHEN Q Y, WANG D, TAN C, et al.Profiling of flavonoid and antioxidant activity of fruit tissues from 27 Chinese local citrus cultivars[J].Plants, 2020, 9(2):196.
[7] XU G H, YE X Q, LIU D H, et al.Composition and distribution of phenolic acids in Ponkan (Citrus poonensis Hort.ex Tanaka) and Huyou (Citrus paradisi Macf.Changshanhuyou) during maturity[J].Journal of Food Composition and Analysis, 2008, 21(5):382-389.
[8] DUGRAND-JUDEK A, OLRY A, HEHN A, et al.The distribution of coumarins and furanocoumarins in citrus species closely matches citrus phylogeny and reflects the organization of biosynthetic pathways[J].PLoS One, 2015, 10(11):e0142757.
[9] SUN C D, CHEN K S, CHEN Y, et al.Contents and antioxidant capacity of limonin and nomilin in different tissues of citrus fruit of four cultivars during fruit growth and maturation[J].Food Chemistry, 2005, 93(4):599-605.
[10] 陶俊, 张上隆, 徐建国, 等.柑橘果实主要类胡萝卜素成分及含量分析[J].中国农业科学, 2003, 36(10):1202-1208.
TAO J, ZHANG S L, XU J G, et al.Analysis of major carotenoid composition and its content in citrus fruit[J].Scientia Agricultura Sinica, 2003, 36(10):1202-1208.
[11] SERVILLO L, CASTALDO D, GIOVANE A, et al.Tyramine pathways in citrus plant defense:Glycoconjugates of tyramine and its N-methylated derivatives[J].Journal of Agricultural and Food Chemistry, 2017, 65(4):892-899.
[12] 王磊. 柑桔汁中肌醇和可溶性糖的检测及含量特征分析[D].重庆:西南大学, 2009.
WANG L.Simultaneous determination of inositols and carbohydrates and content analysising in citrus juice[D].Chongqing:Southwest University, 2009.
[13] 张耀海, 赵其阳, 张雪莲, 等.柱前衍生-气相色谱法同时测定不同柑橘汁中的糖和肌醇[J].食品科学, 2012, 33(10):173-178.
ZHANG Y H, ZHAO Q Y, ZHANG X L, et al.Simultaneous determination of inositols and carbohydrates in different citrus juices by gas chromatography with pre-column derivatization[J].Food Science, 2012, 33(10):173-178.
[14] CHAUDHARY P R, JAYAPRAKASHA G K, PATIL B S.Identification of volatile profiles of Rio Red grapefruit at various developmental to maturity stages[J].Journal of Essential Oil Research, 2018, 30(2):77-83.
[15] LADO J, GAMBETTA G, ZACARIAS L.Key determinants of citrus fruit quality:Metabolites and main changes during maturation[J].Scientia Horticulturae, 2018, 233:238-248.
[16] 胡阳, 晏幸, 伍菱, 等.琯溪蜜柚幼果中柚皮苷含量变化规律[J].食品科学, 2021, 42(12):159-165.
HU Y, YAN X, WU L, et al.Variation of naringin content in young Guanxi honey pomelo(Citrus grandis) fruit[J].Food Science, 2021, 42(12):159-165.
[17] CANCALON P F, BARROS S M, HAUN C, et al.Effect of maturity, processing, and storage on the furanocoumarin composition of grapefruit and grapefruit juice[J].Journal of Food Science, 2011, 76(4):C543-C548.
[18] NIE Z P, WAN C P, CHEN C Y, et al.Comprehensive evaluation of the postharvest antioxidant capacity of Majiayou pomelo harvested at different maturities based on PCA[J].Antioxidants, 2019, 8(5):136.
[19] 但俊峰. 不同生长期柚果中功能性成分的分析研究[D].杭州:浙江大学, 2008.
DAN J F.Research of the functional components in pummelo (citrus grandis osbeck) fruits during growth periods[D].Hangzhou:Zhejiang University, 2008.
[20] 秦艳. 酸橙果实次生代谢产物的检测及差异研究[D].重庆:西南大学, 2022.
QIN Y.Analysis of the secondary metabolites in the Citrus aurantium L.fruits and their difference researches[D].Chongqing:Southwest University, 2022.
[21] GUO P M, PANG W H, ZHAO X J, et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in satsuma mandarin[J].European Food Research and Technology, 2021, 247(7):1725-1736.
[22] 徐贵华, 关荣发, 叶兴乾, 等.不同成熟期蜜桔中酚酸的组成与分布[J].食品科学, 2008, 29(2):137-141.
XU G H, GUAN R F, YE X Q, et al.Composition and distribution of phenolic acids in Satsuma mandarin (Citrus unshiu Marc.) during maturity[J].Food Science, 2008, 29(2):137-141.