塑料已经成为人类的必需品、易耗品,据统计每年产生2.5亿t塑料垃圾,其中有60%被收集处理[1]。收集的塑料垃圾通过填埋或其他直接方式进入环境,在自然环境中塑料垃圾经过风化、紫外线、机械粉碎等方式被分解成不同粒径的塑料,包括大塑料(粒径>2.5 cm)、中塑料(粒径0.5~2.5 cm)、微塑料(粒径1 μm~5 mm)和纳米塑料(粒径<1 μm)。其中微塑料按照来源分为初级微塑料和次级微塑料;按照形状可以分为纤维、泡沫、碎片、薄膜、条状、薄片和颗粒等;按照化学成分可分为聚丙烯(polypropylene,PP)、聚苯乙烯(polystyrene,PS)、聚乙烯(polyethylene,PE)、聚氯乙烯(polyvinyl chloride,PVC)、聚氨酯(polyurethane,PU)和聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)等。
研究发现在土壤、淡水、海水、空气、植物、无脊椎动物和脊椎动物,包括人类体内都发现了微塑料。微塑料可以在脊椎动物的肌肉和肝脏中生物累积,有致癌性、遗传和生长相关的毒性,会导致嗅觉、心脏、生殖、消化、免疫、神经和内分泌问题。微塑料会在无脊椎动物中累积,导致呼吸速率增加、溶酶体膜的稳定性降低、压力、免疫力受损,并最终死亡。COLLARD等[2]收集了关于淡水鱼类中微塑料污染的数据,在200多个鱼种中检测到微塑料,微塑料的生物积聚对鱼类消化、繁殖和发育产生不利影响。微塑料积聚在鸟类的肠道中,给鸟类造成物理损伤和化学毒性,导致营养缺乏、脂肪沉积和体重下降。微塑料在土壤中累积,会导致土壤质地发生变化、水分蒸发加快、土壤微生态的毒性,会延缓植物生长;同时,微塑料在植物呼吸过程中通过气孔进入间叶细胞,之后会抑制叶绿素的形成,进而影响光合作用。微塑料进入食物链后,由于难降解性和周期长,放大生物累积后进入人的身体,在人体的血液、胎盘、肺部等部位都发现了微塑料。人体吸入较小尺寸的微塑料后会在肺部累积,而较大的微塑料则会从体内排出。在体内累积的微塑料会通过血液循环到达不同的器官,导致内脏炎症和氧化应激。另一方面,微塑料有荷电性、高比表面积和疏水性,这些特点使它们成为其他污染物的理想载体。微塑料的载体特性会让水生动物暴露在农药、化妆品、干扰内分泌的药、多溴二苯醚、持久性的有机污染物等有害物质下,最终这些物质会进入食物链,对环境和人类造成很大的影响。
微塑料对人体和环境的危害越来越大,微塑料的降解和处理也是迫在眉睫的事情。目前根据微塑料降解的机制,降解方法可分为光热降解、臭氧诱导降解、催化降解和生物降解。在自然界中,微塑料的降解从光降解开始,随后是水解和热氧化,随后分解成低分子质量的化合物,被微生物代谢为CO2(CH4)和H2O,此过程需要多年才能完成。微塑料在自然环境下生物降解,产物没有二次污染,对于自然界和人类,选择生物降解微塑料是经济和合理的。
文章综述了微塑料的种类、危害以及生物降解微塑料的影响因素,降解微塑料的昆虫、微生物、酶类,分析昆虫、微生物、酶降解微塑料的机制。根据目前生物降解微塑料的研究进展以及影响因素,结合代谢组学、蛋白质组学,使用高通量测序技术,提出将来生物降解微塑料的研究方向和研究思路,为生物降解微塑料提供理论基础。
1 生物降解微塑料的影响因素
微塑料的物理化学特性(聚合物链的长度和主链成分、聚合物结晶度、分子质量、添加剂、疏水性、表面积)和环境因素(机械磨损、pH值、温度、光照等)均会影响其生物降解过程。
1.1 物理化学特性对微塑料降解率的影响
微塑料的物理化学特性在生物降解中起重要作用。如稳定的C—C和C—H键,聚合物中有无可水解和氧化的基团;高分子质量和在极性溶剂中的低溶解度等,都会影响在自然环境条件下生物降解过程。首先是微塑料聚合物的主链成分和长度,长碳链(如PP)聚合物不易生物降解。在塑料中加入杂原子,如在PET和PU加入氧原子后,就会变成易生物降解和热降解的塑料。聚合物的疏水性也会影响降解效率,亲水性越高,降解率越好。此外,降解率也与聚合物的结晶度有关,聚合物的结晶度越高,在降解时需要的H2O和O2会更多。因此,长链或高结晶度会降低生物降解率。另一方面,无定形聚合物结构更容易被H2O和O2攻击,因此聚合物无定形区域被认为更适合热氧化,也会提高生物降解率[3]。聚合物的分子质量也会影响降解速度,高分子质量的聚合物相对表面积较低,降解速度较慢。在生产工艺和添加剂使用方面,生产工艺对微塑料的生物降解率有很大影响。例如,通过质量聚合或加入Ziegler-Natta催化剂制造的PP比共聚合制造的PP更易发生光降解和生物降解。微塑料中的一些添加剂(如稳定剂),会降低生物降解率。
1.2 环境因素对微塑料降解率的影响
微塑料环境影响因素有机械磨损、温度、pH值和光照射等。进入自然界的塑料在风化、海浪和粉尘等摩擦机械外力的作用下,塑料会被磨损或撕裂为小颗粒。模拟微塑料在海滩上的降解实验表明,在没有紫外线的情况下,微塑料不易机械磨损;在没有沙粒的机械磨损下,紫外线照射在微塑料的表面诱发裂缝,但没有裂损。紫外线照射和沙粒磨损相结合,微塑料易被降解和撕裂。紫外线照射降解微塑料时,加入机械外力可以加快微塑料的破碎。机械磨损是促进微塑料生物降解率的一个重要因素,粉碎后,比表面积减少,与酶或者微生物反应接触面积增加,会加快微塑料的降解。
除了机械磨损外,温度也会影响微塑料的生物降解效率。热能可以改变塑料的氧化机制,CHEN等[4]证明,与高温堆肥相比,超高温堆肥将塑料的降解率提高了约6.6倍。原因是在极度嗜热的条件下,—C—C—可以迅速被氧化为—C—O—键和—C![]() O—键,促进功能性微生物在微塑料表面形成生物膜,增强疏水性,从而提高降解率。ABRUSCI等[5]发现,在30 ℃条件下用短芽孢杆菌(Brevibacillus borstelensis)降解PE,90 d后,降解率在0.7%~1.2%;当温度提高到45 ℃时,降解率增加到11.5%。原因是温度会影响聚合物链的流动性,影响微生物降解过程中的酶活性,进而影响自由基的形成、O2扩散率和湿度来影响降解的速率。
O—键,促进功能性微生物在微塑料表面形成生物膜,增强疏水性,从而提高降解率。ABRUSCI等[5]发现,在30 ℃条件下用短芽孢杆菌(Brevibacillus borstelensis)降解PE,90 d后,降解率在0.7%~1.2%;当温度提高到45 ℃时,降解率增加到11.5%。原因是温度会影响聚合物链的流动性,影响微生物降解过程中的酶活性,进而影响自由基的形成、O2扩散率和湿度来影响降解的速率。
光降解是有氧户外环境中最重要的非生物降解途径。光照会导致微塑料的表面氧化,增加微塑料聚合物的亲水性,加快聚合物表面的微生物生物膜的形成。优化pH值条件可以促进微生物的生长和活性,从而使微塑料降解率最大化。红球菌(Rhodococcus sp.)36菌株在pH值为8.96时生长最快,并达到最佳的微塑料降解率[6]。在微生物降解过程中,产生一些代谢产物,影响环境的pH值,破坏微塑料的结构,促进其降解。
在生物降解微塑料时,微塑料的化学结构以及降解过程中的环境因素对降解率有影响。提高微塑料的生物降解率可以通过改变微塑料的化学组成或在生产工艺中加入添加剂,在自然界降解时选择适宜pH值、较高温度以及更强烈的机械磨损配合O2和光照、多微生物共协也有利于生物降解率的提高。微塑料在自然界的降解过程,首先通过光、热等物理或者化学方法分解,但这些降解方法有缺点,如使用高温有利于微塑料的分解,但微塑料不能完全矿化;如果使用昂贵的化学药品催化降解会导致二次污染。生物降解微塑料,降解产物无污染,将光降解、催化降解等物理化学降解方法与生物降解联合使用,是降解微塑料的不错选择。
2 生物降解微塑料
生物降解微塑料的方法有:(1)昆虫摄食微塑料并进行降解;(2)从土壤、垃圾场、海洋筛选分离可降解微塑料的细菌、真菌降解;(3)利用微生物菌株分泌的酶进行降解。
2.1 昆虫摄食降解微塑料研究现状及降解机制
2.1.1 昆虫摄食降解微塑料研究现状
昆虫可以以塑料为食,维持正常的生命活动,并将塑料转化为无害的化合物。昆虫及其幼虫对PS、PP、PVC和PE等塑料的降解研究越来越多,降解微塑料的昆虫种类见表1。表1表明,摄食塑料并进行降解的昆虫研究较多的为黄粉虫、大蜡螟、印度谷螟等,这些昆虫在降解微塑料时,降解微塑料的种类不同,降解效果也各不相同,如黄粉虫、大蜡螟、印度谷螟、超级蠕虫能降解多种微塑料,可以作为生物降解微塑料的潜在昆虫资源。下面主要对黄粉虫、大蜡螟、超级蠕虫的降解机制进行综述,为这几种昆虫降解微塑料可能性提供更多理论参考。
表1 降解微塑料的昆虫种类及其降解效果
Table 1 Insect species with microplastics degrading capacity and its degrading effect

昆虫种类降解微塑料种类降解效果参考文献黄粉虫(Tenebrio molitor)PS、PVC、PEPS:0.07 mg /(100 只·d);PE:(0.87±0.0) g/(120只·d) ; PVC: 有效降解[7]超级蠕虫(Zophobas atratus)幼虫PS、低密度PEPS:43.3 mg/(100只·d),平均粒径由174 μm减少到6.3 μm;低密度PE:52.9 mg/(100只·d),平均粒径由185 μm减少到5.9 μm[8]中国黑粉虫(Tenebrio obscurus)幼虫PS32 mg/(100只·d)[9]灰粪种蝇(Achroia grisella)高密度PE1.83 mg/(只·d) [10]米蛾(Corcyra cephalonica)幼虫低密度PE用25只幼虫实验,使用抗生素喂养的质量减少21%,无抗生素喂养质量减少25%[11]大蜡螟(Galleria mellonella)幼虫PE、低密度PE、PSPE: 1.95 g /(150只);低密度PE: 25 μg /(只·d),PS: 0.88g/(150只)[12]印度谷螟(Plodia interpunctella)PE、低密度PE质量减少6.1%[13]黑菌虫(Alphitoibius diaperinus)幼虫PS质量减少20%/(17 500只)[14]硕步甲(Carabus davidis)幼虫聚苯乙烯泡沫231 mg/(50只)[15]赤拟谷盗(Tribolium castaneum)PS质量减少(12.14±1.4)% [16]拟步甲(Uloma sp.)PS质量减少(1.04±0.02) g[17]
2.1.2 昆虫摄食降解微塑料降解机制
对超级蠕虫、黄粉虫和大蜡螟幼虫降解PS的比较研究表明,超级蠕虫幼虫将PS降解为低分子质量化合物,黄粉虫切断苯环解聚PS[7]。PS微塑料在蜡螟幼虫的肠道中通过苯酚-4-羟基苯甲醛-4-羟基苯甲酸甲酯和苯乙烯氧化物-苯乙醛途径完全解聚,与质谱分析和代谢组学分析结果相同。PE和PS的解聚随着结晶度的增加而减少,脂肪酸降解途径参与了塑料中间物的降解[18]。超级蠕虫和黄粉虫的幼虫对PS和PU泡沫的降解中有氧化变化[19]。昆虫幼虫能对塑料降解是由于肠道微生物群和消化酶的作用,昆虫幼虫的肠道微生物群会根据喂养塑料的种类而发生变化。黄粉虫幼虫摄食包装和膨胀的PS时,肠道微生物中含有丰富的乳球菌、肠球菌和肠杆菌属[20]。用PS喂养超级蠕虫、黄粉虫和大蜡螟时,肠球菌和肠杆菌科的细菌在内脏微生物中占主导地位,表明它们参与了PS降解[7]。对用PE喂养的黄粉虫幼虫的肠道微生物进行分析,结果显示,硝化单胞菌、农杆菌、硝化芽孢杆菌和乳酸杆菌占主导地位,酯酶和磷酸酶较多[21]。用PS、PE和PU泡沫喂养超级蠕虫幼虫时,肠道微生物主要是肠球菌属、柠檬杆菌属、拟杆菌门和鞘氨醇杆菌,同时蛋白酶的分泌增加[22]。
为更好研究昆虫摄食、降解微塑料的机制,在体外对降解微塑料的昆虫肠道共生菌进行筛选。REN等[23]用大蜡螟幼虫肠道匀浆进行了筛选,使用液体培养基,PE作为唯一的碳源,筛选出优势菌肠杆菌。用肠杆菌悬浮液处理PE塑料14 d,PE膜表面出现了凹陷、裂缝,结构中出现羰基和醚类,对上清液进行色谱分析发现了与PE生物降解有关的代谢物。ZHANG等[24]用大蜡螟筛选出了具有降解低密度PE和高密度PE潜力的微生物。一种真菌菌株被分离出来,并被确定为黄曲霉PEDX3,其中有2个漆酶样多铜氧化酶AFLA_006190和AFLA_053930的基因在降解PE中表达上调,这2种酶可能与PE降解有关。
MONTAZER等[25]从能降解PE的大蜡螟幼虫肠道中分离出纺缍形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)、阿氏芽孢杆菌(Bacillus aryabhattai)和氧化微杆菌(Microbacterium oxydans),将这3种菌与其他可生物降解低密度PE的菌株(如杀虫贪铜菌H16(Cupriavidus necator H16)、恶臭假单胞菌LS46(Pseudomonas putida LS46)、恶臭假单胞菌IRN22)联合共协,共协后的菌群在生物降解低密度PE方面比单个菌种更有效。为确定大蜡螟降解微塑料的机制,除了肠道微生物外,还研究了昆虫的其他部分。PEYDAEI等[26]认为大蜡螟的唾液腺可能参与PE的生物降解在对喂养了10 d PE的幼虫腺体进行蛋白质组学研究时发现,在大蜡螟幼虫食用PE过程中蛋白质被明显诱导,能量水平发生变化,这与脂肪酸β-氧化中的酶途径被刺激有关。
基于代谢组学和色谱分析,WANG等[19]提出了大蜡螟肠道中降解PS的2条潜在代谢途径:氧化苯乙烯-苯乙醛和氧化4-甲基苯酚-4-羟基苯甲醛-4-羟基苯甲酸酯代谢路径,其中有多种内源酶的共同作用(细胞色素P450 s酶、烷烃羟化酶、单氧酶和环羟基化二加氧酶),有O2或自由基存在的情况下可以将PS解聚为单体,但负责PS解聚的酶以及酶促反应机制仍然未知[19]。YANG研究黄粉虫幼虫的PS生物降解过程,步骤如下:(1) 首先,聚合物通过咀嚼被分解成更小的颗粒,增加塑料的接触面,有利于微生物和胞外酶的作用;(2) 摄入的颗粒被肠道微生物群分泌的细胞外酶解成小分子物质;(3)小分子物质被各种微生物降解或生物矿化成CO2,小分子物质中的碳元素被进一步同化到生物质中;(4) 最后,残留的碎片和其他中间产物在幼虫的粪便中被排出[27]。YIN等[28]从黄粉虫中分离出了不动杆菌属(Acinetobacter sp.)NyZ450菌株和芽孢杆菌(Bacillus sp.)NyZ451菌株,与单一细菌相比,两菌共协对PS的生物降解效率更高,复杂的肠道微生物可能更利于生物降解。
昆虫摄食微塑料后,通过咀嚼增加微塑料的表面积,昆虫分泌解聚微塑料的酶类和肠道微生物群共同作用下可降解微塑料。昆虫摄食降解微塑料在理论层面比单用微生物降解微塑料更具可行性。但是目前对于昆虫摄食微塑料后体内酶分泌的机制和触发酶分泌的机制研究不多。在将来研究中,昆虫摄食微塑料后,研究昆虫、肠道微生物群、微塑料三方的互作机制,可为昆虫降解微塑料提供参考。
2.2 微生物降解微塑料的研究现状及降解机制
2.2.1 微生物降解微塑料的研究现状
微塑料的微生物降解方法分为好氧和厌氧微生物降解。前者通常发生在自然界,降解产物为CO2和H2O;后者发生在沉积物和垃圾填埋场,产物为CO2、H2O和CH4。在自然环境中,微塑料被大量的微生物包围,这些微生物共协完成微塑料的降解。从各种环境如海洋、垃圾场等环境中筛选分离的可降解微塑料的菌株见表2。
表2 降解微塑料的微生物菌株及其效果
Table 2 Microbial strains with microplastics degrading capacity and its degroding effect
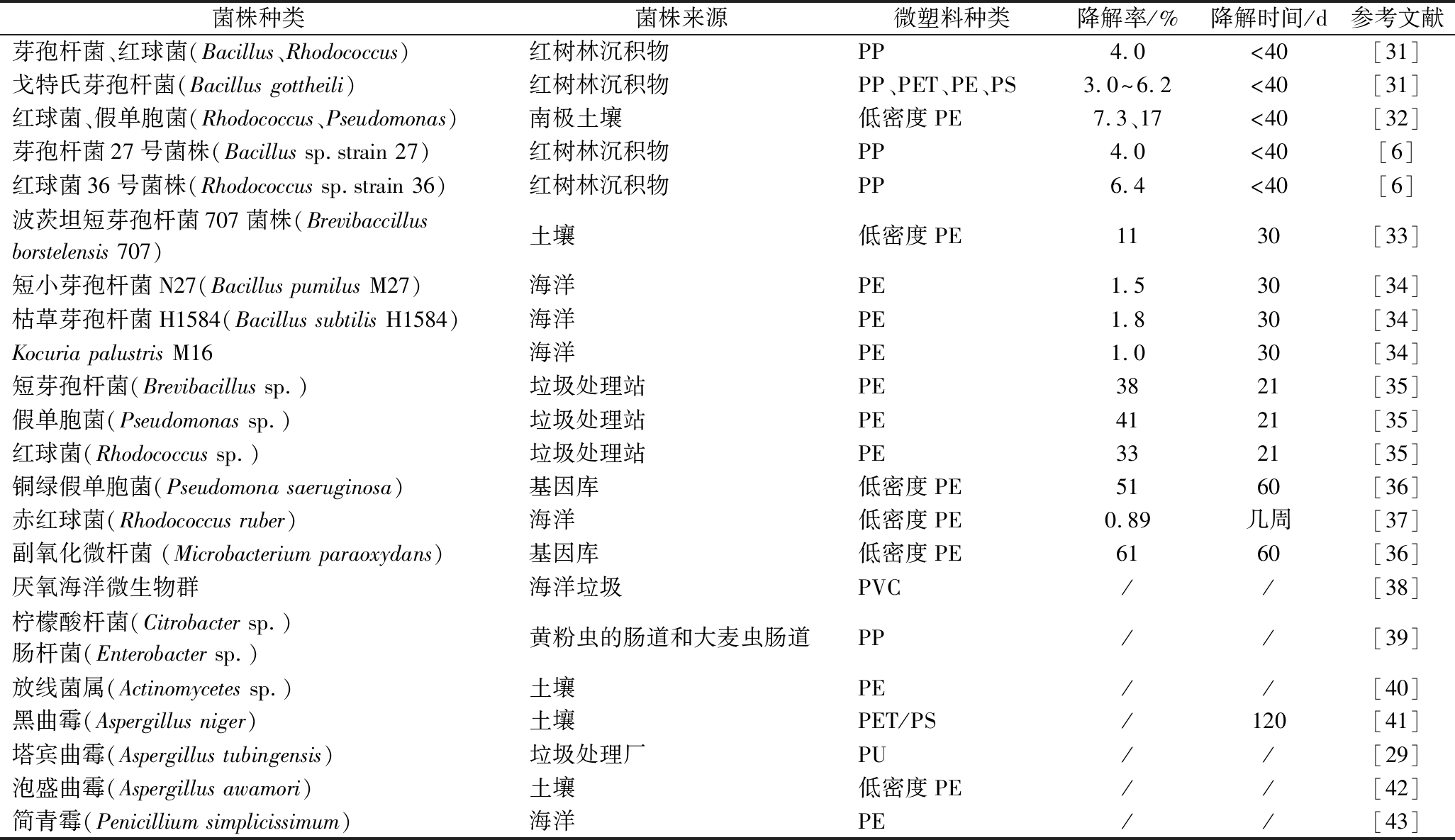
菌株种类菌株来源微塑料种类降解率/%降解时间/d参考文献芽孢杆菌、红球菌(Bacillus、Rhodococcus)红树林沉积物PP4.0<40[31]戈特氏芽孢杆菌(Bacillus gottheili)红树林沉积物PP、PET、PE、PS 3.0^6.2<40[31]红球菌、假单胞菌(Rhodococcus、Pseudomonas)南极土壤低密度PE7.3、17<40[32]芽孢杆菌27号菌株(Bacillus sp.strain 27)红树林沉积物PP4.0<40[6]红球菌36号菌株(Rhodococcus sp.strain 36)红树林沉积物PP6.4<40[6]波茨坦短芽孢杆菌707菌株(Brevibaccillus borstelensis 707)土壤低密度PE1130[33]短小芽孢杆菌N27(Bacillus pumilus M27)海洋PE1.530[34]枯草芽孢杆菌H1584(Bacillus subtilis H1584) 海洋PE1.830[34]Kocuria palustris M16 海洋PE1.030[34]短芽孢杆菌(Brevibacillus sp.)垃圾处理站PE3821[35]假单胞菌(Pseudomonas sp.)垃圾处理站PE4121[35]红球菌(Rhodococcus sp.)垃圾处理站PE3321[35]铜绿假单胞菌(Pseudomona saeruginosa)基因库低密度PE5160[36]赤红球菌(Rhodococcus ruber)海洋低密度PE0.89几周[37]副氧化微杆菌 (Microbacterium paraoxydans)基因库低密度PE6160[36]厌氧海洋微生物群海洋垃圾PVC//[38]柠檬酸杆菌(Citrobacter sp.)肠杆菌(Enterobacter sp.)黄粉虫的肠道和大麦虫肠道PP//[39]放线菌属(Actinomycetes sp.)土壤PE//[40]黑曲霉(Aspergillus niger)土壤PET/PS/120[41]塔宾曲霉(Aspergillus tubingensis)垃圾处理厂PU//[29]泡盛曲霉(Aspergillus awamori)土壤低密度PE//[42]简青霉(Penicillium simplicissimum)海洋PE//[43]
由表2可知,微生物降解微塑料的降解率不高,原因是塑料的物理化学特性使微生物难以完成塑料为底物的代谢。同时发现不同的微生物可以降解同一种微塑料,可能是不同的微生物在代谢活动中有共同特性,如分泌同种细胞外酶或者细胞内酶,降解聚合物。KHAN等[29]从巴基斯坦一个城市垃圾处理场的土壤中分离并鉴定了一种降解PU的真菌塔宾曲霉(A.tubingensis),这种真菌可以破坏PU的化学键,并在降解过程中可以使PU的表面开裂、侵蚀,形成孔隙,减弱微塑料的拉伸强度。
青霉、曲霉等真菌可以降解微塑料(表2),真菌降解微塑料的机制是因为真菌菌丝范围广,可以穿透微塑料表面直接接触聚合物,进行降解;同时,真菌菌丝可以分泌解聚酶(细胞外酶),将聚合物分解成低聚物、二聚物和单聚物,相对细菌,真菌分泌的酶浓度更高。多种微生物共协的降解率可能高于单一菌种,用单一菌种降解微塑料,在降解的后期,会产生有毒代谢物,这些有毒物质抑制微生物的生长。而多种微生物共协降解可以消除有毒代谢物,呈现更好的降解效果。PARK等[30]从一个垃圾场分离出的微塑料降解微生物,其中有芽孢杆菌(Bacillus sp.)和类芽孢杆菌(Paenibacillus sp.),将这些菌株接种在以PE为唯一碳源的培养基共同培养60 d,结果PE干重损失为14.7%。ABRUSCI等[5]从土壤中分离3种降解PE的微生物蜡状芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillus subtilis),在45 ℃下共同培养90 d,3种微生物共协的降解率为7%~10%。WANG等[20]的研究表明海底的热塑性微塑料(3-羟基丁酸-co-3-羟基己酸)的生物降解是由厌氧菌类Cloacamonales和热袍菌目(Thermotogales)共协完成。
多种微生物共协降解的降解率理论上高于单一菌株的降解率,目前这方面的研究较少,原因是多种微生物共协降解,需要考虑微生物的最适生长温度、pH值、厌氧或好氧等方面的因素,只有多种微生物同时具有共同的生长条件,并在生长过程中没有竞争或者排斥,微生物共协降解才能有更好的效果。
2.2.2 微生物降解微塑料的降解机制
微生物降解微塑料的机制分生物定植、生物侵蚀、生物粉碎、生物同化和生物矿化等5步。首先,微生物在微塑料表面定植,在此过程,参与的微生物组成联合体,代谢产生多种蛋白质和多糖,形成生物膜,黏附到微塑料聚合物的表面,引起微塑料聚合物表面严重损害。黏附到微塑料表面的蛋白质和多糖渗入到微塑料聚合物孔隙中,导致孔隙大小改变。如丝状真菌利用其菌丝体渗透到微塑料聚合物中,以增加孔隙的大小并诱发微塑料聚合物裂缝的形成,导致微塑料聚合物阻力和耐久性下降。另外,微生物分泌的细胞外物质会影响微塑料的疏水性或亲水性,提高微生物的渗透率。同时,微生物也会产生一些酶类,如脂肪酶、酯酶、尿素酶和蛋白酶,以克服微塑料聚合物的结晶性。由于定植、侵蚀,聚合物中的小裂解片段(约500 Da的低聚物)被释放出来。微生物使用不同的机制来裂解聚合物小裂解片段,如分泌氧化还原酶、水解酶等特殊酶类,或者产生自由基。参与此过程的微生物内生和外生酶不是立即合成的,它需要时间来启动细胞机制合成特定的酶。此外,酶的浓度随着时间的推移而增加,活性随着底物的消失而终止,这些导致微生物降解塑料需要较长的时间。水解阶段是由各种酶的活性强烈决定的。由于微塑料聚合物的高疏水性,聚合物链的裂解反应是复杂的,该反应需要多种酶共协来改变聚合物结构。例如,形成酒精或过氧基团的单氧酶和双氧酶可以增加聚合物结构的极性,使生物降解过程更加有效。
另一方面,自由基氧化能增加或形成更多羟基、羰基、羧基,从而增加分子的极性(亲水性),亲水性增加,微生物更易黏附。聚合物的氧化反应由多种酶催化,产生自由基,诱发氧化应激,导致连锁反应,诱发聚合物结构转换和降解。降解中,由于酶不能与这些聚合物的内部结构相互作用,通过酶反应降解线性高分子化合物受到极大的限制。此外,一些微生物,如细菌、真菌和藻类,降解中可以产生H2O2[44],促进聚合物的氧化,加快降解。
微塑料聚合物在酶或者氧化自由基的作用下,裂解为单体、二聚体或低聚体。单体被微生物同化,产生细胞生物量。生物量作为基本成分被微生物完全代谢,并被微生物分解成CO2或CH4(与O2是否可用有关)和H2O。
ZAMPOLLI等[45]对生长在PE上的浑浊红球菌(Rhodococcus opacus)R7转录组分析,阐明PE的生物降解机制。转录组测序技术恢复参与氧化第一步的基因,证实了编码为漆酶样酶的基因的激活。转录组数据分析确定短链脂肪族进一步氧化的候选基因,是编码为烷烃单氧酶的alkB基因、编码为细胞色素P450羟化酶的cyp450基因和编码膜运输工具的基因。KIRSTEIN等[46]使用下一代测序技术和16S rDNA引物分析海水中多种微塑料基质中生物膜的细菌成员,发现PVC可通过屈挠曲菌属(Flexithrix)来区分,聚酯型PU可通过海氏菌属(Hirschia)和红杆菌属(Erythrobacter)与其他塑料区分,这些表明,微塑料表面生物膜的生成是由塑料种类来决定的。
自然界微生物种类繁多,来源方便,降解产物无污染,使用微生物降解微塑料是可行方法。微生物降解微塑料推广中有几点需要克服。首先,微生物降解微塑料机制中需要分泌降解塑料的多种酶类以及增加酶类浓度,此过程有时长限制,影响微塑料的降解周期;将来研究确定降解塑料的酶的具体种类进行量产,量产的酶类投入微生物塑料降解过程,增加塑料降解酶的浓度,缩短微塑料的降解周期。其次,微塑料聚合物表面疏水性改变是微生物降解的一个关键步骤,疏水性的变化会影响微生物在塑料表面的黏附性。因此,将来研究以确定能降解微塑料的微生物为对象,研究微生物改变微塑料的疏水物质,确定其种类,开启降解微塑料的钥匙。再次,降解中如果有自由基存在,会增加降解可能性。在微生物降解塑料中,配合诱发产生自由基的氧化分子,如光照、催化剂等可加快降解速率。
2.3 酶降解微塑料的研究现状及机制
2.3.1 酶降解微塑料的研究现状
微塑料由于自身的物理化学特性,很难直接被微生物和昆虫降解,在降解中,微生物或者昆虫分泌的酶类将长链聚合物切断,变成短链或者更小的分子,被微生物代谢利用。降解微塑料聚合物的酶可分为细胞内酶和细胞外解聚酶[34]。降解不同微塑料的酶的种类见表3。
表3 降解微塑料的不同酶类
Table 3 Different enzymes of degrading microplastics

酶的种类微生物来源降解微塑料的类型参考文献酯酶(胞内酶、胞外酶)红球菌PE、PET、PVC[47]脂肪酶荧光假单胞菌、黏质沙雷菌PU、PET[48]角质酶特异腐质霉PET[49]聚苯乙烯氧化异构酶积云红球菌1CPPS[50]聚-β-羟丁酸解聚酶拟杆菌、链霉菌聚(3-羟基丁酸)[51]羟基丁酸戊酸共聚酯解聚酶芽孢杆菌、微球菌羟基丁酸戊酸共聚酯[52]聚乳酸解聚酶拟无枝菌酸菌聚乳酸[53]聚丁二酸-己二酸丁二酯解聚酶链霉菌属、德氏假单孢菌(Acidovorax delajieldii)聚丁二酸-己二酸丁二酯[54]聚ε-己内酯解聚酶海棠酵母菌(Pseudozyma japonica sp.nov)聚ε-己内酯[55]
表3表明,目前能降解微塑料的酶类主要来源于各种微生物,来源单一,且种类少。昆虫能摄食微塑料并进行生物降解,在昆虫的降解机制中有酶的参与,利用昆虫资源,研究昆虫中的降解酶,为微塑料酶降解提供参考。
2.3.2 酶降解微塑料的降解机制
酶降解微塑料的机制研究不多,大多数集中在酶解PET方面。细胞内酶中的酯酶和脂肪酶能水解PET中的酯键,胞外酶可以将复杂的聚合物分解成短链或更小的分子,如低聚物、二聚物或单聚物,它们可以穿过微生物的外膜,然后作为碳源被微生物吸收。PET降解具体机制是PET在解聚酶的作用下水解,脱氢、氧化,最后降解为小分子,被微生物吸收利用。其他类型聚合物的降解过程与PET相似,由不同的解聚酶参与生化反应,进而水解和氧化[31]。此过程有2种酶参与PET的降解。首先,PET酶将PET转化为单(2-羟乙基)对苯二甲酸(monohydroxyethyl terephthalate, MHET),并以微量的对苯二甲酸和双(2-羟乙基)对苯二甲酸作为次级产物。其次,MHET酶参与代谢,将MHET转化为对苯二甲酸和乙二醇。另一方面,代谢途径上,乙二醇可以作为三羧酸循环底物的前体,既可以通过乙酰辅酶A转化为乙酸,也可以转化为异柠檬酸。对苯二甲酸分子经过一系列反应,从对苯二甲酸合成原儿茶酸,原儿茶酸经过β-酮基己二酸代谢途径代谢[56]。
WRIGHT等[57]从海洋中分离2种微生物, 硫棒菌(Thioclava sp.)BHET1和芽孢杆菌(Bacillus sp.)BHET2,代谢组学证实这2种分离物都能降解PET,高通量蛋白质组学显示,硫棒菌BHET1使用了在陆地环境中确定的降解途径,但在芽孢杆菌BHET2中却没有采用陆地环境的降解途径,这表明该细菌使用的酶与以前确定的酶没有同源性,或者该细菌使用一种新的途径来降解PET。
微生物和昆虫在降解微塑料过程中分泌细胞外和细胞内的酶来降解塑料聚合物,但微生物降解酶的分泌量受微生物本身调控机制限制,量少且时间久。昆虫在微塑料降解中也分泌酶类,但分泌机制和种类以及酶和肠道微生物、宿主之间的互作研究不多,同时在昆虫宿主和肠道微生物互作下酶对降解率的影响也不清楚。已知的是,酶在微塑料生物降解中起重要的作用,研究酶降解微塑料的机制,寻找更多的能降解微塑料的酶类,将现有的降解微塑料的酶类人工合成,明确在微生物或者昆虫降解微塑料时触发酶分泌的机制,为将来更进一步实现微塑料的生物降解。
3 展望
塑料已成为人类生活重要不可或缺的物品,由于处理不当,导致微塑料无处不在,根据微塑料的物理化学特性,结合目前研究现状,在解决微塑料问题上提出未来研究方向。
(1)利用高通量测序技术,结合基因组学、蛋白质组学和代谢组学,研究昆虫肠道微生物菌群、宿主、营养摄食的三方共协关系,昆虫摄食微塑料后,昆虫宿主体内微生物群落的变化,利用代谢组学,分析脂肪、蛋白质、以及以微塑料为碳源的代谢机制,分析代谢中昆虫分泌消化酶的种类和触发机制,为昆虫摄食降解微塑料提供可能性参考。
(2)微生物降解微塑料中,由于微生物分泌降解酶的调控代谢机制,降解酶分泌有时间限制,微塑料降解的周期变长。在今后的研究中,利用蛋白质组学和代谢组学,研究微生物胞外、胞内分泌酶的种类,借助人工合成技术,合成分泌酶,利用合成的外酶,加快对微塑料内部结构渗透、解聚。研究微生物降解微塑料的机制,以及在降解中影响降解的生物性和非生物性因素,确定微生物不竞争、和平共生的条件,采用多种微生物联合共协,配合微塑料物理化学降解方法,在微生物降解微塑料周期长的问题上提供一种新思路。
(3)在目前已知的微塑料降解酶的基础上,找寻更多的降解酶。对目前确定能降解微塑料的酶类采用人工合成,将昆虫摄食降解和人工酶、微生物降解和人工酶、分别与微塑料物理化学降解方法联合使用,找寻生物降解可行办法。
降解微塑料的方法中,生物降解污染最小,对自然界和人类来说是一种可靠办法。生物降解需要解决很多问题,目前看来,有的问题在研究中,也有许多问题在逐步解决,生物降解微塑料让人类解决塑料和微塑料的污染问题有了希望。
[1] SKOCZINSKI P, KRAUSE L, RASCHKA A, et al.Current status and future development of plastics:Solutions for a circular economy and limitations of environmental degradation[J].Methods in Enzymology, 2021, 648:1-26.
[2] COLLARD F, GASPERI J, GABRIELSEN G W, et al.Plastic particle ingestion by wild freshwater fish:A critical review[J].Environmental Science &Technology, 2019, 53(22):12974-12988.
[3] LI J H, WANG Y T, WANG X D, et al.Crystalline characteristics, mechanical properties, thermal degradation kinetics and hydration behavior of biodegradable fibers melt-spun from polyoxymethylene/poly(l-lactic acid) blends[J].Polymers, 2019, 11(11):1753.
[4] CHEN Z, ZHAO W Q, XING R Z, et al.Enhanced in situ biodegradation of microplastics in sewage sludge using hyperthermophilic composting technology[J].Journal of Hazardous Materials, 2020, 384:121271.
[5] ABRUSCI C, PABLOS J L, CORRALES T, et al.Biodegradation of photo-degraded mulching films based on polyethylenes and stearates of calcium and iron as pro-oxidant additives[J].International Biodeterioration &Biodegradation, 2011, 65(3):451-459.
[6] AUTA H S, EMENIKE C U, JAYANTHI B, et al.Growth kinetics and biodeterioration of polypropylene microplastics by Bacillus sp.and Rhodococcus sp.isolated from mangrove sediment[J].Marine Pollution Bulletin, 2018, 127:15-21.
[7] JIANG S, SU T T, ZHAO J J, et al.Biodegradation of polystyrene by Tenebrio molitor, Galleria mellonella, and Zophobas atratus larvae and comparison of their degradation effects[J].Polymers, 2021, 13(20):3539.
[8] PENG B Y, SUN Y, WU Z Y, et al.Biodegradation of polystyrene and low-density polyethylene by Zophobas atratus larvae:Fragmentation into microplastics, gut microbiota shift, and microbial functional enzymes[J].Journal of Cleaner Production, 2022, 367:132987.
[9] PENG B Y, SU Y M, CHEN Z B, et al.Biodegradation of polystyrene by dark (Tenebrio obscurus) and yellow (Tenebrio Molitor) mealworms (Coleoptera:Tenebrionidae)[J].Environmental Science &Technology, 2019, 53(9):5256-5265.
[10] KUNDUNGAL H, GANGARAPU M, SARANGAPANI S, et al.Efficient biodegradation of polyethylene (HDPE) waste by the plastic-eating lesser waxworm (Achroia grisella)[J].Environmental Science and Pollution Research, 2019, 26(18):18509-18519.
[11] SURESH KESTI S, CHANDRABANDA THIMMAPPA S.First report on biodegradation of low density polyethyleneby rice moth larvae, Corcyra cephalonica(stainton)[J].The Holistic Approach to Environment, 2019, 9(4):79-83.
[12] LOU Y, EKATERINA P, YANG S S, et al.Biodegradation of polyethylene and polystyrene by greater wax moth larvae (Galleria mellonella L.) and the effect of co-diet supplementation on the core gut microbiome[J].Environmental Science &Technology, 2020, 54(5):2821-2831.
[13] YANG J, YANG Y, WU W M, et al.Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J].Environmental Science &Technology, 2014, 48(23):13776-13784.
[14] CUCINI C, LEO C, VITALE M, et al.Bacterial and fungal diversity in the gut of polystyrene-fed Alphitobius diaperinus (Insecta:Coleoptera)[J].Animal Gene, 2020, 17-18:200109.
[15] PEYDAEI A, BAGHERI H, GUREVICH L, et al.Mastication of polyolefins alters the microbial composition in Galleria mellonella[J].Environmental Pollution, 2021, 280:116877.
[16] WANG Z, XIN X, SHI X F, et al.A polystyrene-degrading Acinetobacter bacterium isolated from the larvae of Tribolium castaneum[J].Science of the Total Environment, 2020, 726:138564.
[17] KUNDUNGAL H, SYNSHIANG K, DEVIPRIYA S P.Biodegradation of polystyrene wastes by a newly reported honey bee pest Uloma sp.larvae:An insight to the ability of polystyrene-fed larvae to complete its life cycle[J].Environmental Challenges, 2021, 4:100083.
[18] ZHONG Z, NONG W Y, XIE Y C, et al.Long-term effect of plastic feeding on growth and transcriptomic response of mealworms (Tenebrio molitor L.)[J].Chemosphere, 2022, 287:132063.
[19] WANG S, SHI W, HUANG Z C, et al.Complete digestion/biodegradation of polystyrene microplastics by greater wax moth (Galleria mellonella) larvae:Direct in vivo evidence, gut microbiota independence, and potential metabolic pathways[J].Journal of Hazardous Materials, 2022, 423:127213.
[20] WANG S L, LYDON K A, WHITE E M, et al.Biodegradation of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) plastic under anaerobic sludge and aerobic seawater conditions:Gas evolution and microbial diversity[J].Environmental Science &Technology, 2018, 52(10):5700-5709.
[21] PRZEMIENIECKI S W, KOSEWSKA A, CIESIELSKI S, et al.Changes in the gut microbiome and enzymatic profile of Tenebrio molitor larvae biodegrading cellulose, polyethylene and polystyrene waste[J].Environmental Pollution, 2020, 256:113265.
[22] LUO L P, WANG Y M, GUO H Q, et al.Biodegradation of foam plastics by Zophobas atratus larvae (Coleoptera:Tenebrionidae) associated with changes of gut digestive enzymes activities and microbiome[J].Chemosphere, 2021, 282:131006.
[23] REN L, MEN L N, ZHANG Z W, et al.Biodegradation of polyethylene by Enterobacter sp.D1 from the guts of wax moth Galleria mellonella[J].International Journal of Environmental Research and Public Health, 2019, 16(11):1941.
[24] ZHANG J Q, GAO D L, LI Q H, et al.Biodegradation of polyethylene microplastic particles by the fungus Aspergillus flavus from the guts of wax moth Galleria mellonella[J].Science of the Total Environment, 2020, 704:135931.
[25] MONTAZER Z, HABIBI NAJAFI M B, LEVIN D B.In vitro degradation of low-density polyethylene by new bacteria from larvae of the greater wax moth, Galleria mellonella[J].Canadian Journal of Microbiology, 2021, 67(3):249-258.
[26] PEYDAEI A, BAGHERI H, GUREVICH L, et al.Impact of polyethylene on salivary glands proteome in Galleria melonella[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 2020, 34:100678.
[27] YANG Y, YANG J, WU W M, et al.Biodegradation and mineralization of polystyrene by plastic-eating mealworms:Part 2.role of gut microorganisms[J].Environmental Science &Technology, 2015, 49(20):12087-12093.
[28] YIN C F, XU Y, ZHOU N Y.Biodegradation of polyethylene mulching films by a co-culture of Acinetobacter sp.strain NyZ450 and Bacillus sp.strain NyZ451 isolated from Tenebrio molitor larvae[J].International Biodeterioration &Biodegradation, 2020, 155:105089.
[29] KHAN S, NADIR S, SHAH Z U, et al.Biodegradation of polyester polyurethane by Aspergillus tubingensis[J].Environmental Pollution, 2017, 225:469-480.
[30] PARK S Y, KIM C G.Biodegradation of micro-polyethylene particles by bacterial colonization of a mixed microbial consortium isolated from a landfill site[J].Chemosphere, 2019, 222:527-533.
[31] YUAN J H, MA J, SUN Y R, et al.Microbial degradation and other environmental aspects of microplastics/plastics[J].Science of the Total Environment, 2020, 715:136968.
[32] HABIB S, IRUTHAYAM A, ABD SHUKOR M Y, et al.Biodeterioration of untreated polypropylene microplastic particles by Antarctic bacteria[J].Polymers, 2020, 12(11):2616.
[33] HADAD D, GERESH S, SIVAN A.Biodegradation of polyethylene by the thermophilic bacterium Brevibacillus borstelensis[J].Journal of Applied Microbiology, 2005, 98(5):1093-1100.
[34] HARSHVARDHAN K, JHA B.Biodegradation of low-density polyethylene by marine bacteria from pelagic waters, Arabian Sea, India[J].Marine Pollution Bulletin, 2013, 77(1-2):100-106.
[35] NANDA S, SAHU S S.Biodegradability of polyethylene by Brevibacillus, Pseudomonas, and Rhodococcus spp[J].New York Science Journal, 2010,3:57-60.
[36] RAJANDAS H, PARIMANNAN S, SATHASIVAM K, et al.A novel FTIR-ATR spectroscopy based technique for the estimation of low-density polyethylene biodegradation[J].Polymer Testing, 2012, 31(8):1094-1099.
[37] SIVAN A, SZANTO M, PAVLOV V.Biofilm development of the polyethylene-degrading bacterium Rhodococcus ruber[J].Applied Microbiology and Biotechnology, 2006, 72(2):346-352.
[38] GIACOMUCCI L, RADDADI N, SOCCIO M, et al.Biodegradation of polyvinyl chloride plastic films by enriched anaerobic marine consortia[J].Marine Environmental Research, 2020, 158:104949.
[39] YANG S S, DING M Q, HE L, et al.Biodegradation of polypropylene by yellow mealworms (Tenebrio molitor) and superworms (Zophobas atratus) via gut-microbe-dependent depolymerization[J].The Science of the Total Environment, 2021, 756:144087.
[40] ORHAN Y, BÜYÜKGÜNGÖR H.Enhancement of biodegradability of disposable polyethylene in controlled biological soil[J].International Biodeterioration &Biodegradation, 2000, 45(1-2):49-55.
[41] ASMITA K, SHUBHAMSINGH T, TEJASHREE S.Isolation of plastic degrading micro-organisms from soil samples collected at various locations in Mumbai, India[J].Environmental Science &Technology,2015,4:77-85.
[42] NOWAK B, PAJ![]() K J, DROZD-BRATKOWICZ M, et al.Microorganisms participating in the biodegradation of modified polyethylene films in different soils under laboratory conditions[J].International Biodeterioration &Biodegradation, 2011, 65(6):757-767.
K J, DROZD-BRATKOWICZ M, et al.Microorganisms participating in the biodegradation of modified polyethylene films in different soils under laboratory conditions[J].International Biodeterioration &Biodegradation, 2011, 65(6):757-767.
[43] YAMADA-ONODERA K, MUKUMOTO H, KATSUYAYA Y, et al.Degradation of polyethylene by a fungus, Penicillium simplicissimum YK[J].Polymer Degradation and Stability, 2001, 72(2):323-327.
[44] DIAZ J M, PLUMMER S, TOMAS C, et al.Production of extracellular superoxide and hydrogen peroxide by five marine species of harmful bloom-forming algae[J].Journal of Plankton Research, 2018, 40(6):667-677.
[45] ZAMPOLLI J, ORRO A, MANCONI A, et al.Transcriptomic analysis of Rhodococcus opacus R7 grown on polyethylene by RNA-seq[J].Scientific Reports, 2021, 11:21311.
[46] KIRSTEIN I V, WICHELS A, GULLANS E, et al.The Plastisphere-uncovering tightly attached plastic “specific” microorganisms[J].PLoS One, 2019, 14(4):e0215859.
[47] GILAN I, HADAR Y, SIVAN A.Colonization, biofilm formation and biodegradation of polyethylene by a strain of Rhodococcus ruber[J].Applied Microbiology and Biotechnology, 2004, 65(1):97-104.
[48] HOWARD G T.Biodegradation of polyurethane:A review[J].International Biodeterioration &Biodegradation, 2002, 49(4):245-252.
[49] CARNIEL A, VALONI É, NICOMEDES J, et al.Lipase from Candida antarctica (CALB) and cutinase from Humicola insolens act synergistically for PET hydrolysis to terephthalic acid[J].Process Biochemistry, 2017, 59:84-90.
[50] OELSCHL GEL M, GRÖNING J A D, TISCHLER D, et al.Styrene oxide isomerase of Rhodococcus opacus 1CP, a highly stable and considerably active enzyme[J].Applied and Environmental Microbiology, 2012, 78(12):4330-4337.
GEL M, GRÖNING J A D, TISCHLER D, et al.Styrene oxide isomerase of Rhodococcus opacus 1CP, a highly stable and considerably active enzyme[J].Applied and Environmental Microbiology, 2012, 78(12):4330-4337.
[51] SAYYED R, WANI S J, SHAIKH S S, et al.Thermophilic PHB depolymerase of Stenotrophomonas sp., an isolate from the plastic contaminated site is best purified on Octyl-Sepharose CL-4B[J].Journal of Fermentation and Bioengineering, 2019,85:375-380.
[52] ALI SHAH A, HASAN F, HAMEED A, et al.Isolation and characterization of poly(3-hydroxybutyrate-co-3-hydroxyvalerate) degrading bacteria and purification of PHBV depolymerase from newly isolated Bacillus sp.AF3[J].International Biodeterioration &Biodegradation, 2007, 60(2):109-115.
[53] KAWAI F.Polylactic acid (PLA)-degrading microorganisms and PLA depolymerases[M]//ACS Symposium Series.Washington, DC:American Chemical Society, 2010:405-414.
[54] UCHIDA H, SHIGENO-AKUTSU Y, NOMURA N, et al.Cloning and sequence analysis of poly(tetramethylene succinate) depolymerase from Acidovorax delafieldii strain BS-3[J].Journal of Bioscience and Bioengineering, 2002, 93(2):245-247.
[55] ABDEL-MOTAAL F F, EL-SAYED M A, EL-ZAYAT S A, et al.Biodegradation of poly (ε-caprolactone) (PCL) film and foam plastic by Pseudozyma japonica sp.nov, a novel cutinolytic ustilaginomycetous yeast species[J].3 Biotech, 2014, 4(5):507-512.
[56] SALVADOR M, ABDULMUTALIB U, GONZALEZ J, et al.Microbial genes for a circular and sustainable bio-PET economy[J].Genes, 2019, 10(5):373.
[57] WRIGHT R J, BOSCH R, LANGILLE M G I, et al.A multi-OMIC characterisation of biodegradation and microbial community succession within the PET plastisphere[J].Microbiome, 2021, 9(1):1-22.