在“健康中国2030”的背景下,食品与消费者健康之间的关系日益密切,肉中因富含优质蛋白质、脂肪、维生素等营养成分,作为一种兼备营养和美味的食物一直以来都受到人们的青睐,肉制品加工产业也逐渐成为促进我国经济发展的支柱产业和提高国民健康水平的动力[1]。肉制品的表观色泽是影响消费者购买行为的主要因素,而亚硝酸盐是肉制品加工时常用的一种护色剂,在肉制品色泽保护中起到了重要的作用。然而亚硝酸盐也会与肉制品中蛋白质降解产生的胺类物质反应形成亚硝胺;此外如果过多的亚硝酸盐被人体摄入,也会与人体内的胺类物质发生反应形成亚硝胺,其严重的毒副作用会对人体健康造成威胁[2]。目前存在的无硝发色技术仍有色泽不稳定、不良风味、高温易分解等问题,已成为肉制品行业亟待解决的难题[3]。因此研发新型无硝发色技术迫在眉睫。
锌原卟啉(zinc protoporphyrinIX,ZnPP)是一种以Zn2+配位于原卟啉IX(protoporphyrinIX, PPIX)的形式独特存在于肉制品中稳定且鲜艳的红色素,最早发现于一种来自意大利北部帕尔玛地区长时间发酵成熟的帕尔玛火腿中,其肉质在不添加亚硝酸盐/硝酸盐的情况下,即使暴露在光或热下仍能呈现稳定的鲜红色[4]。随后在我国著名的金华火腿加工过程中也发现了这一现象,但因检测技术的限制,并未确定造成该现象的具体物质[5]。直到2004年通过多种光谱技术分析检测才确定了这种独特的红色素主要为锌原卟啉IX(ZnPP)[6]。研究表明,帕尔玛火腿中色素ZnPP的形成有3种可能的机制:厌氧条件下金属离子的非酶取代反应[7];亚铁螯合酶(ferrochelatase, FECH)直接参与的酶促反应[8];细菌的酶促反应[9]。
目前对于ZnPP的研究主要集中在传统干腌火腿制品、发酵干香肠制品及发酵肉糜中,如探究传统干腌火腿加工工艺对ZnPP形成的影响、筛选具有高ZnPP形成能力发酵菌株来提高肉制品色泽、在发酵肉制品中探究发酵条件对ZnPP形成的影响等,然而对ZnPP在肉制品中形成机制的研究尚不完善。因此,本文综述了ZnPP的化学结构及在肉制品中的形成过程、ZnPP形成速率的影响因素及ZnPP形成机理研究,以期为肉制品的无硝护色提供新的思路及理论支持。
1 肉制品中色素种类及其衍生物ZnPP形成过程
1.1 肉制品中色素种类
肉制品中主要的红色素为血红素,在肌肉中主要以肌红蛋白的形式存在,特定条件下肌红蛋白可转化为多种衍生物,直接影响肉色特征与稳定性[10]。
肌红蛋白是肌肉中的主要显色物质,它由血红素和珠蛋白构成;血红素是一种卟啉类化合物(图1为血红素结构示意图),它由4个吡咯环连接成一个大环,称为卟啉环[11]。卟啉环中心的Fe2+有6个配位部分,且其中4个分别与4个吡咯环上的氮原子以配位键的形式结合,另一个与球蛋白上的93位氨基酸残基上的氮原子相连,而第6个配位键缺乏配体,可与O2、CO等小分子配位结合这也造成了肉制品色泽的不稳定[12]。
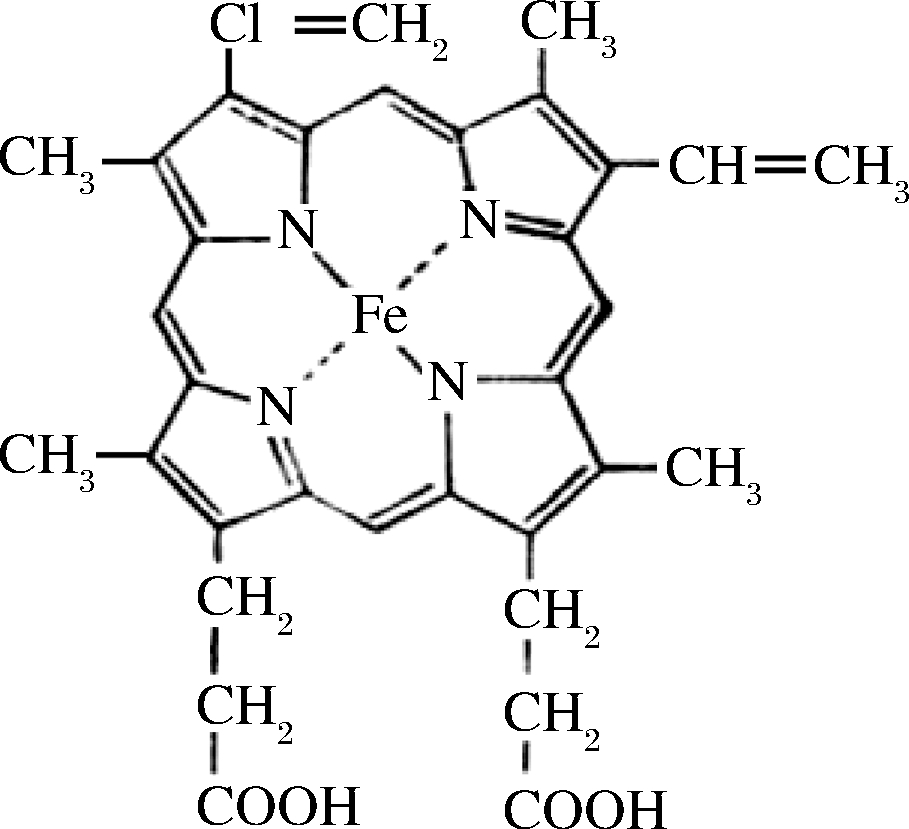
图1 血红素结构
Fig.1 Structure of heme
肉制品色泽的不稳定主要是由于肌红蛋白化学性质、铁的价态变化以及卟啉环中Fe2+的第6位配体不同造成的,表1为肉制品中常见的色素名称及对应色泽。当卟啉中心以Fe2+形式存在时,色素为正常的肌红蛋白,此时肉制品的表观色泽表现为紫红色。但这种还原态的肌红蛋白化学性质不稳定,向着2种不同形式转化[13]。当周围环境中O2含量过高时色素分子以氧合态肌红蛋白分子为主,此时肉制品的表观色泽表现为鲜红色,这便是人们喜欢的肉制品的颜色;另外一部分的肌红蛋白则被O2氧化成高铁肌红蛋白,此时肉制品的表观色泽为棕褐色[14-15]。而在帕尔玛火腿色素分子的研究中,发现导致其具有稳定鲜红色泽的特有成分为锌原卟啉。图2为锌原卟啉结构示意图,与肉制品中常见色素以不同类型肌红蛋白分子(即珠蛋白与血红素复合体)存在所不同的是,帕尔玛火腿中色素分子ZnPP是一种游离的血红素衍生物,是由同为二价的Zn2+取代卟啉环中心的Fe2+所形成[7]。此外在体内,其他二价金属离子包括钴和锡,也可形成其他金属卟啉。
表1 肉制品中的主要色素
Table 1 Main pigments in meat products

色素名称形成方式金属价态颜色肌红蛋白高铁肌红蛋白的还原Fe2+紫红色氧合肌红蛋白肌红蛋白的氧合Fe2+鲜红色高铁肌红蛋白肌红蛋白的氧化Fe3+棕褐色亚硝基肌红蛋白肌红蛋白与NO的结合Fe2+亮红色亚硝基高铁肌红蛋白高铁肌红蛋白与NO结合Fe3+深红色

图2 锌原卟啉的结构
Fig.2 Structure of zinc protoporphyrin
1.2 血红素衍生物ZnPP形成过程
血红素是由FECH化金属形成的,在其生物合成的最后一步,位于动物线粒体的内膜上的FECH催化Fe2+插入进入原卟啉形成血红素[16]。而在肉制品特别是干腌火腿中ZnPP的形成被认为源于肌红蛋白的转化过程,Fe2+从血红素分子中脱去,在适宜的外部条件下Zn2+随即插入卟啉环的中心,即铁被锌取代,同时血红素部分从天然血红素蛋白中分离,形成ZnPP[17]。另一方面Zn2+是Cu2+之后第二容易插入卟啉的金属离子,Zn2+无需催化剂也能容易地插入卟啉[18]。最近的研究表明在肉的腌制和火腿成熟过程中,肌红蛋白被内源性肽酶部分降解,随后肌红蛋白和FECH相互作用,从而促进ZnPP的形成[19]。
2 ZnPP形成机制
2.1 金属离子的非酶取代反应
肉制品中ZnPP的形成被认为是一种非酶反应,在厌氧条件下,Zn2+取代Fe2+,同时使血红素部分从血红蛋白中分离[7]。将成熟的火腿放在4 ℃的条件下储存一段时间,在火腿样品中仍然能检测出一定量的ZnPP,但研究表明大鼠中FECH活性在50 ℃最佳,小鼠中FECH活性在40 ℃最佳,而猪肉中FECH活性在25 ℃最佳;4 ℃的低温储存环境,加上火腿中较高的食盐浓度,这样严苛的外部条件显然不适于FECH发挥其活性,因此部分学者认为这种条件下ZnPP的形成为非酶的取代作用。PAROLARI等[20]将低温(3~4 ℃)条件下发酵成熟的火腿与正常加工条件下(16 ℃)成熟的火腿比较发现,低温条件下成熟的火腿仍呈现鲜艳的红色,且在发酵后期(9~12月)ZnPP增加量较正常发酵组显著提升。虽然许多体外模拟实验在一定程度上表明酶在ZnPP形成过程中发挥了作用,但在这些研究中也提出非酶促反应下ZnPP也可以形成,并且非酶促过程随着酶活性的降低在成熟的后期变得重要,但此反应过程需要较长的反应时间[8-9]。
2.2 内源酶的取代反应
FECH是亚铁血红素生物合成途径的最后一步酶,且在多种生物中这种酶几乎都会存在[21]。研究发现,FECH在ZnPP 形成的过程中起到至关重要的作用,首先还原酶把血红素中的Fe3+还原为Fe2+,然后 FECH除去Fe2+,使Zn2+插入到卟啉中形成 ZnPP[22]。此外FeCH不仅参与Fe2+的插入,而且参与各种二价金属离子的插入,例如Zn2+、Co2+、Mn2+等进入卟啉环,锌是铜之外第2个容易插入卟啉环的金属离子;在三级结构水平上人类和动物、细菌的FECH保持高度相似,仅在氨基酸序列上略有不同[23]。这些发现为ZnPP的酶促合成技术研究提供可靠的理论依据。此外组织蛋白酶B和L是意大利、西班牙和中式干腌火腿成熟过程中最常涉及的2种肽链内切酶,在火腿成熟过程中起到重要水解蛋白质的作用,蛋白质的适度水解会促进亚铁血红素的释放,更利于ZnPP的形成。GROSSI等[19]研究了组织蛋白酶在帕尔玛火腿成熟过程中对于肌红蛋白降解的作用,结果表明组织蛋白酶促进肌红蛋白的降解对亚铁血红素的转金属反应有显著作用。
2.3 细菌的酶反应
因为猪腿中初始微生物有限,早期的研究普遍认为微生物并没有参与干腌火腿中ZnPP的形成[7]。后来随着不断的研究,人们发现干腌火腿的颜色或颜色的变化可能取决于微生物的生长[5]。GHADIRI等[24]通过对比接种P.fluorescens后肉匀浆中ZnPP的含量变化,发现P.fluorescens具有形成ZnPP的能力。细菌诱导的ZnPP形成似乎强烈依赖于食物基质中作为微生物营养物质的多肽和蛋白质的可用性。在肉匀浆中肉本身的固有蛋白质和肽可以立即被微生物利用,从而导致ZnPP的形成显著增加。PAGANELLI等[25]以大肠杆菌BL21为载体,表达枯草芽孢杆菌中FECH形成的相关基因。然后以分离和纯化后的枯草芽孢杆菌FECH(BsFECH)为外源性酶与四苯基卟啉磺酸盐(TPPS)的水溶液、醋酸锌(Zn2+)和部分亚铁肌红蛋白的水解溶液作为模型底物,模拟了干腌火腿成熟过程中红色素ZnPP形成的过程。此外研究发现诸多乳酸菌在合适的条件下都可以在发酵过程中产生ZnPP[26]。这种细菌的酶反应与内源酶的酶促反应类似,都可以增加ZnPP。
通过阐述该研究领域目前存在的3种假说可以发现,现阶段对于每种假说都有一定的研究结果支持。本文认为上述的几种ZnPP形成机制是共同存在的,只是在不同类型的肉制品中及不同的成熟阶段,对ZnPP形成起到的影响程度不同。
3 ZnPP形成过程中的影响因素
3.1 FECH的数量及活性
FECH位于哺乳动物细胞线粒体内膜,催化Fe2+插入到原卟啉IX中形成原血红素[27]。实验发现在肉匀浆中添加Zn2+和PPIX会形成大量ZnPP,而在缓冲液中这一现象并不明显,这表明FECH在ZnPP形成过程中的作用以及肉制品中存在内源FECH影响ZnPP的形成。ISHIKAWA等[28]对ZnPP的合成做了进一步研究,用猪心脏以及猪心脏线粒体与肌红蛋白、ZnCl2合成ZnPP,合成量显著增大。可能因为猪心脏中富含线粒体细胞器,此前研究表明FECH位于哺乳动物细胞线粒体内膜,更多的FECH加速了ZnPP的形成,此外有学者研究发现与肌肉线粒体的猪FECH相比,位于心脏线粒体中的FECH的数量和活性更高[22]。在体外条件下Zn2+也可以被目前鉴定的FECH插入到原卟啉IX中;CHAU等[29]将猪FECH的DNA克隆在大肠杆菌中表达形成重组FECH,并进一步钝化用于研究模拟内源FECH在ZnPP形成过程中的作用,PAGANELLI等[25]也将枯草芽孢杆菌FECH做类似表达,重组FECH可短时高效提升ZnPP的形成能力。未来可在研究中分离、重组环境及生物中产生的FECH,选取优势重组酶应用于实际。
3.2 食盐添加量
在帕尔玛火腿的生产中主要的辅料为海盐,在长时间的成熟过程中,盐促进成熟并防止肉的腐败,研究发现海盐的添加量会影响ZnPP的形成,BENEDINI等[7]通过在研究值范围内对猪肉匀浆添加不同含量NaCl发现,盐的添加导致了FECH的活性显著提升,当食盐质量浓度为80 g/L时,ZnPP形成效果最好。BECKER等[30]通过控制肉糜中不同NaCl添加量检测ZnPP含量发现,在3%(质量分数)NaCl的添加量下短时间内ZnPP的形成量最多;当NaCl添加量提升至7%时发现腌制初期ZnPP含量明显低于较低NaCl添加组,表明高浓度的盐对ZnPP的形成有抑制作用,但随着腌制过程的进行,ZnPP含量呈明显上升趋势。这与传统干腌火腿中表现的结果一致,传统干腌火腿NaCl添加量大都在6%~9%,经过长时间的成熟,也能产生大量的ZnPP,使肉制品表现为稳定的鲜红色[31]。
此外有学者认为食盐能够促进ZnPP生成是通过影响肌红蛋白水解指数来实现的,研究发现适宜的食盐添加对ZnPP的形成有一定的促进作用,且在此范围内蛋白质水解指数与食盐含量呈正相关[32]。PAGANELLI等[25]通过体外模拟研究也验证了肌红蛋白水解程度促进ZnPP生成这一猜想,在肌红蛋白溶液中加入适量的胃蛋白酶促进蛋白水解,结果发现合适的水解程度下ZnPP生成量显著提升。
3.3 螯合剂
帕尔玛火腿成熟过程中铁和锌参与金属化反应,且这些金属离子可与蛋白质、各种较小的有机分子和存在于肉制品汁液中的无机阴离子强烈结合,此类螯合物的存在可能促进或抑制金属转移[33]。BECKER等[30]比较了添加不同浓度磷酸盐溶液的肉匀浆,结果表明与不含磷酸盐的肉匀浆相比,添加磷酸盐的肉匀浆中ZnPP增加。这是由于在此实验条件下,磷酸盐与血红素中Fe2+结合形成配合物,此时“血红素”以原卟啉的形式存在。由于肉中本来就存在大量的与Fe2+化学结构性质相似的Zn2+,原本Fe2+位置就被Zn2+所取代,Zn2+与原卟啉螯合形成ZnPP,起到改善肉制品色泽的作用。而EDTA作为Zn2+的强力螯合剂,会与其发生络合反应,限制Zn2+的转移,从而阻碍ZnPP的形成[34]。
3.4 微生物
因为猪腿中初始微生物有限,早期研究认为微生物并没有参与干腌火腿中ZnPP的形成[7]。WAKAMATSU等[18]研究发现,与添加抗生素组相比,在不添加时猪肉匀浆中ZnPP含量会增加,这表明微生物的存在促进了ZnPP的形成。研究表明在肉糜中添加分歧型卡诺杆菌(Carnobacterium divergens)和液化沙雷氏菌(Serratia liquefaciens),可显著增加ZnPP的形成,但这2种菌株会导致生肉和海鲜变质或成为某些疾病的病原体,因此亟待开发可用于肉制品生产的安全的发酵菌株[35-36]。ASADUZZAMAN等[37]近期对不同动物产品中使用的11种细菌以及从环境和益生菌源分离的126种细菌ZnPP的形成能力进行评估,其中3种乳酸菌,乳酸乳球菌(Lactococcus lactis)、肠膜明串珠菌(Leuconostoc mesenteroides)和粪肠球菌(Enterococcus faecium)显示出较高的ZnPP形成能力。传统的这类发酵一般控制在无氧条件下进行,KAUSER-UL-ALAM等[38]在有氧的条件下进行发酵,评价5种乳酸菌的ZnPP形成能力;结果发现,其中的4株乳酸菌在有氧条件下ZnPP形成量较无氧条件大大降低;而乳酸乳球菌亚种在这一条件下仍表现出较强的ZnPP形成能力,更适用于实际加工中改善发酵肉制品的颜色。
3.5 pH
对于ZnPP的研究主要集中在干腌火腿及发酵肉制品中。与干腌火腿不同的是,发酵肉制品的pH根据发酵剂的种类不同以及发酵时间的变化而变化,因此pH为影响发酵肉制品ZnPP形成的一个重要因素。DE MAERE等[39]的研究表明,在不同pH条件下无亚硝酸盐干发酵香肠生产过程中,天然色素ZnPP及其相关原卟啉和亚铁血红素的含量不同,ZnPP只有在pH高于4.9的干燥发酵香肠中才能形成,同样,在增加pH和生产时间的条件下,观察到亚铁血红素的分解,PPIX也在肉制品中不断积累。CHAU等[23]实验结果表明pH在5.5~6.0更利于血红素的分解,Fe2+从卟啉环中脱下;而在7.5~8.0条件下更利于Zn2+插入原卟啉,形成稳定的ZnPP。WAKAMATSU等[40]通过对不同pH、肌纤维类型的猪骨骼肌的研究发现,ZnPP和PPIX在不同的pH条件下形成机制也不同,在pH 4.75、5.5时有较多量的ZnPP形成,在pH 4.75时观察肌红蛋白的降解,ZnPP和PPIX含量均升高,血红素含量无明显降低;pH 4.75时ZnPP和PPIX的形成比pH 5.5时更明显。
3.6 酶抑制剂
在医学领域人们也对ZnPP及FECH进行了广泛研究,FECH在表达缺失或者活性受到抑制时,可导致亚铁血红素生物合成受阻以及体内原卟啉蓄积过量的游离原卟啉,与Zn2+形成ZnPP,是血红素生物合成的副产物[27]。此外Pb2+作为一种重金属离子可抑制FECH活性,影响Fe2+与原卟啉的螯合,导致原卟啉蓄积过量,进而与Zn2+的结合增加,ZnPP合成增加,医学上常提到的铅中毒就是这个原理[41]。也有研究指出Pb2+影响亚铁在PP中的插入,而不影响锌的插入,导致PP和ZnPP的积累[42]。BECKER等[30]通过在猪肉匀浆中添加不同浓度Pb2+一段时间后发现,低浓度对ZnPP形成无显著影响,高浓度添加促进了ZnPP形成。笔者认为这可以理解为不同条件Zn2+与Fe2+竞争性作用不同。首先Fe2+、Zn2+可以在适宜的条件下插入原卟啉形成对应金属卟啉化合物,也可以在FECH螯合下更高效地插入;但当FECH、Zn2+、Fe2+三者同时存在时,酶促反应优先进行,而FECH又优先插入Fe2+,当特殊条件下FECH活性被抑制,这时机体中的Zn2+优先与原卟啉结合,因此在肌肉中形成ZnPP。
3.7 硝酸盐及亚硝酸盐
硝酸盐因其具有良好的发色、抗氧化、抑菌等作用而被广泛应用于肉制品加工中,但在帕尔玛火腿加工中并未添加此类物质[43]。ADAMSEN等[31]通过对多种类型干腌肉制品的调研发现,那些含有亚硝基肌红蛋白的产品中几乎不能检测到ZnPP存在。WAKAMATSU等[18]2007年发现,与未添加亚硝酸盐的对照组相比,添加NaNO2的ZnPP含量降低了约80%。研究表明亚硝酸盐产生的NO对ZnPP形成产生抑制作用,且ZnPP的前体物质原卟啉的含量也随着NO的加入而减少[44]。对于这一现象可能存在以下2种原因:NO与肌红蛋白反应形成亚硝基肌红蛋白,这可能阻止亚铁血红素从肌红蛋白分子上解离释放,更抑制了Fe2+从血红素释放出去[37];NO可以抑制猪肉中的FECH,阻止Zn2+插入原卟啉。有研究表明,哺乳动物FECH的(2Fe-2S)铁簇受到NO的强烈抑制,NO可能抑制了猪肉中的FECH,从而抑制了ZnPP的形成[45]。
4 结语
肉制品中ZnPP的含量与其加工、成熟过程中的诸多因素有关,特别受加工时辅料的添加及成熟阶段环境的影响。因此未来对于ZnPP生成技术的改良,可通过对不同影响因素的控制,分析出不同条件下的ZnPP形成的变化及不同因素之间的交互作用,设定适宜的加工参数提升产品中ZnPP的形成量,从而改善无硝肉制品的色泽。此外可在动物肝脏中分离提取FECH,将其应用于肉制品加工环节改善肉制品色泽;还可根据微生物发酵对于ZnPP形成的促进作用,将该技术应用于动物血制品的开发利用中,提取更加稳定的天然色素,提高血产品附加值。总之,在以后的研究中应依据企业的生产需求,与其他技术如微生物发酵技术、基因重组技术密切结合发挥ZnPP形成技术在食品产业中适用性。
[1] 刘悦, 贺稚非, 李洪军, 等.非热杀菌技术在肉及肉制品中的应用研究进展[J].肉类研究, 2020, 34(10):88-95.
LIU Y, HE Z F, LI H J, et al.Advances in the application of non-thermal sterilization technologies in meat and meat products[J].Meat Research, 2020, 34(10):88-95.
[2] 沈麒亮, 钟晓红, 金萍, 等.肉制品中亚硝酸盐代替品的研究[J].轻工标准与质量, 2021(5):122-123.
SHEN Q L, ZHONG X H, JIN P, et al.Study on nitrite substitution in meat products[J].Standard &Quality of Light Industry, 2021(5):122-123.
[3] 姚芳, 刘靖, 褚洁明, 等.无硝肉脯发色技术[J].江苏农业科学, 2014, 42(9):226-231.
YAO F, LIU J, CHU J M, et al.Coloring technology of nitrate-free preserved meat[J].Jiangsu Agricultural Sciences, 2014, 42(9):226-231.
[4] MORITA H, NIU J, SAKATA R, et al.Red pigment of Parma ham and bacterial influence on its formation[J].Journal of Food Science, 1996, 61(5):1021-1023.
[5] 竺尚武, 杨耀寰, 王锡渊, 等.金华火腿肌肉颜色及呈色物质的研究[J].食品科学, 1993, 14(1):3-7.
ZHU S W, YANG Y H, WANG X Y, et al.The investigation on colours and pigments in muscles of Jin-Hua ham[J].Food Science, 1993, 14(1):3-7.
[6] WAKAMATSU J, NISHIMURA T, HATTORI A.A Zn-porphyrin complex contributes to bright red color in Parma ham[J].Meat Science, 2004, 67(1):95-100.
[7] BENEDINI R, RAJA V, PAROLARI G.Zinc-protoporphyrin IX promoting activity in pork muscle[J].LWT - Food Science and Technology, 2008, 41(7):1160-1166.
[8] 竺尚武. 干腌火腿肌肉红色色素的形成机理 条件和性质[J].食品与机械, 2007, 23(4):150-152.
ZHU S W.Mechanisms and conditions of formations and properties of red color pigments in dry-cured ham muscle[J].Food &Machinery, 2007, 23(4):150-152.
[9] MORITA H, NIU J, SAKATA R, et al. Red pigment of Parma ham and bacterial influence on its formation[J]. Journal of Food Science, 1996, 61(5):1021-1023.
[10] 郜娜, 葛玲, 薛洋洋, 等.线粒体介导高铁肌红蛋白还原活性与肉色变化关联性研究进展[J].肉类研究, 2021, 35(3):60-65.
GAO N, GE L, XUE Y Y, et al.Progress in understanding the relationship between mitochondria-mediated metmyoglobin reduction and changes in meat color[J].Meat Research, 2021, 35(3):60-65.
[11] 吴爱芳, 曾丹, 申贵隽.试纸法对肉类熟食制品中亚硝酸盐的快速检测[J].中国食物与营养, 2005, 11(6):34-36.
WU A F, ZENG D, SHEN G J.Rapid detection of nitrite in cooked meat products by test paper method[J].Food and Nutrition in China, 2005, 11(6):34-36.
[12] 吴素娟, 刘战民, 王兆明, 等.食品加工对血红蛋白结构和功能特性影响的研究进展[J].食品科学, 2021, 42(21):256-262.
WU S J, LIU Z M, WANG Z M, et al.Recent progress on understanding the effect of food processing on structural and functional properties of hemoglobin[J].Food Science, 2021, 42(21):256-262.
[13] 王玮, 汤祥明, 金邦荃.高铁肌红蛋白含量和高铁肌红蛋白还原酶活性与冷鲜肉肉色稳定性关系的研究[J].食品科学, 2008, 29(7):94-97.
WANG W, TANG X M, JIN B Q.Study on correlation of metmyoglobin content and metmyoglobin reductase activity with color stability of chilled pork[J].Food Science, 2008, 29(7):94-97.
[14] 刘成龙. 气调包装对不同部位牛肉颜色稳定性影响及机理的探究[D].泰安:山东农业大学, 2014.
LIU C L.Effect of modified atmosphere packaging on color stability and potential mechanisms in maintaining color stability of different bovine muscles[D].Taian:Shandong Agricultural University, 2014.
[15] 王永辉, 马俪珍.肌肉颜色变化的机理及其控制方法初探[J].肉类工业, 2006(4):18-21.
WANG Y H, MA L Z.Study on mechanism of color changes of muscle and possible control method[J].Meat Industry, 2006(4):18-21.
[16] AJIOKA R S, PHILLIPS J D, KUSHNER J P.Biosynthesis of heme in mammals[J].Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2006, 1763(7):723-736.
[17] KHOZROUGHI A G, BRAGA T W, WAGNER J, et al.Investigation of the post mortem zinc protoporphyrin IX fluorescence with respect to its protein-bound and unbound occurrence in aqueous meat extracts[J].Food Chemistry, 2019, 283:462-467.
[18] WAKAMATSU J I, OKUI J, HAYASHI N, et al.Zn protoporphyrin IX is formed not from heme but from protoporphyrin IX[J].Meat Science, 2007, 77(4):580-586.
[19] GROSSI A B, DO NASCIMENTO E S P, CARDOSO D R, et al.Proteolysis involvement in zinc-protoporphyrin IX formation during Parma ham maturation[J].Food Research International, 2014, 56:252-259.
[20] PAROLARI G, AGUZZONI A, TOSCANI T.Effects of processing temperature on color properties of dry-cured hams made without nitrite[J].Foods, 2016, 5(4):33.
[21] HEINEMANN I U, JAHN M, JAHN D.The biochemistry of heme biosynthesis[J].Archives of Biochemistry and Biophysics, 2008, 474(2):238-251.
[22] TAKETANI S, ISHIGAKI M, MIZUTANI A, et al.Heme synthase (ferrochelatase) catalyzes the removal of iron from heme and demetalation of metalloporphyrins[J].Biochemistry, 2007, 46(51):15054-15061.
[23] CHAU T T, ISHIGAKI M, KATAOKA T, et al.Porcine ferrochelatase:The relationship between iron-removal reaction and the conversion of heme to Zn-protoporphyrin[J].Bioscience, Biotechnology, and Biochemistry, 2010, 74(7):1415-1420.
[24] GHADIRI KHOZROUGHI A, KROH L W, SCHLÜTER O, et al.Assessment of the bacterial impact on the post-mortem formation of zinc protoporphyrin IX in pork meat[J].Food Chemistry, 2018, 256:25-30.
[25] PAGANELLI M O, GROSSI A B, DORES-SILVA P R, et al.Limited proteolysis of myoglobin opens channel in ferrochelatase-globin complex for iron to zinc transmetallation[J].Food Chemistry, 2016, 210:491-499.
[26] KAUSER-UL-ALAM M, HAYAKAWA T, KUMURA H, et al.High ZnPP-forming food-grade lactic acid bacteria as a potential substitute for nitrite/nitrate to improve the color of meat products[J].Meat Science, 2021, 176:108467.
[27] 张晓艳. 原卟啉Ⅸ蓄积与抗结核药物HRZE治疗方案致肝损伤的相关性及其机制的研究[D].合肥:安徽医科大学, 2020.
ZHANG X Y.Protoporphyrin Ⅸ accumulation induced liver injury after receiving A HRZE antitubercular regimen[D].Hefei:Anhui Medical University, 2020.
[28] ISHIKAWA H, YOSHIHARA M, AI B B, et al.Formation of zinc protoporphyrin IX from myoglobin in porcine heart extract[J].Food Science and Technology Research, 2006, 12(2):125-130.
[29] CHAU T T, ISHIGAKI M, KATAOKA T, et al.Ferrochelatase catalyzes the formation of Zn-protoporphyrin of dry-cured ham via the conversion reaction from heme in meat[J].Journal of Agricultural and Food Chemistry, 2011, 59(22):12238-12245.
[30] BECKER E M, WESTERMANN S, HANSSON M, et al.Parallel enzymatic and non-enzymatic formation of zinc protoporphyrin IX in pork[J].Food Chemistry, 2012, 130(4):832-840.
[31] ADAMSEN C E, MØLLER J K S, LAURSEN K, et al.Zn-porphyrin formation in cured meat products:Effect of added salt and nitrite[J].Meat Science, 2006, 72(4):672-679.
[32] BOU R, LLAUGER M, ARNAU J, et al.Zinc-protoporphyrin content in commercial Parma hams is affected by proteolysis index and marbling[J].Meat Science, 2018, 139:192-200.
[33] MORTVEDT J J, NORVELL W A.Reactions of Metal Chelates in Soils and Nutrient Solutions[M]//Micronutrients in Agriculture, Vol 4, 2nd Ed. Madison, WI: Soil Science Society of America, 1991.
[34] 胡宏海, 张泓.无硝干腌肉制品中锌-原卟啉Ⅸ形成的研究进展[J].肉类研究, 2014, 28(5):37-40.
HU H H, ZHANG H.Recent progress in the research of zinc protoporphyrin Ⅸ formation in nitrite-free dry-cured meat products[J].Meat Research, 2014, 28(5):37-40.
[35] GROTH LAURSEN B, BAY L, CLEENWERCK I, et al.Carnobacterium divergens and Carnobacterium maltaromaticum as spoilers or protective cultures in meat and seafood:Phenotypic and genotypic characterization[J].Systematic and Applied Microbiology, 2005, 28(2):151-164.
[36] MAHLEN S D.Serratia infections:From military experiments to current practice[J].Clinical Microbiology Reviews, 2011, 24(4):755-791.
[37] ASADUZZAMAN M, OHYA M, KUMURA H, et al.Searching for high ZnPP-forming edible bacteria to improve the color of fermented meat products without nitrite/nitrate[J].Meat Science, 2020, 165:108109.
[38] KAUSER-UL-ALAM M, TOBA Y, HIOKI S, et al.Lactococcus lactis subsp.cremoris produces zinc protoporphyrin IX both aerobically and anaerobically and improves the bright red color of fermented meat products[J].Foods, 2020, 9(11):1583.
[39] DE MAERE H, FRAEYE I, DE MEY E, et al.Formation of naturally occurring pigments during the production of nitrite-free dry fermented sausages[J].Meat Science, 2016, 114:1-7.
[40] WAKAMATSU J I, AKTER M, HONMA F, et al.Optimal pH of zinc protoporphyrin IX formation in porcine muscles:Effects of muscle fiber type and myoglobin content[J].LWT, 2019, 101:599-606.
[41] 梁嘉斌, 麦剑平, 郭嘉明, 等.铅中毒实验室检查指标的应用和探讨[J].中国工业医学杂志, 2020, 33(1):81-83.
LIANG J B, MAI J P, GUO J M, et al.Application and discussion on lead poisoning laboratory examination index[J].Chinese Journal of Industrial Medicine, 2020, 33(1):81-83.
[42] TAKETANI S, TANAKA A, TOKUNAGA R.Reconstitution of heme-synthesizing activity from ferric ion and porphyrins, and the effect of lead on the activity[J].Archives of Biochemistry and Biophysics, 1985, 242(1):291-296.
[43] MØLLER J K S, ADAMSEN C E, SKIBSTED L H.Spectral characterisation of red pigment in Italian-type dry-cured ham.Increasing lipophilicity during processing and maturation[J].European Food Research and Technology, 2003, 216(4):290-296.
[44] WAKAMATSU J I, HAYASHI N, NISHIMURA T, et al.Nitric oxide inhibits the formation of zinc protoporphyrin IX and protoporphyrin IX[J].Meat Science, 2010, 84(1):125-128.
[45] SELLERS V M, JOHNSON M K, DAILEY H A.Function of the[2Fe-2S]cluster in mammalian ferrochelatase:A possible role as a nitric oxide sensor[J].Biochemistry, 1996, 35(8):2699-2704.