单宁,又称鞣酸,多酚类化合物,源于植物的次级代谢产物,多分布于叶、种子、果肉、表皮等,主要形式为黄烷-3-醇与儿茶素、表没食子儿茶素没食子酸酯等以C4~C6或C4~C8键构成的聚合物[1],具有抗氧化、降血糖、抗肿瘤、修复口腔黏膜、提高免疫力等功效[2-3],已被广泛用于食品、医药等方面。单宁广泛存在于刺梨、石榴等多种水果中,具有保护花色苷、提高色素附着,抑制微生物侵染等作用[4-5]。单宁较高的水果,一般富含维生素类、多糖类、皂苷类等多种活性物质,是良好的酿造原料[6]。单宁在果酒中作为非挥发性成分,有助于感知口感、平衡酒体、沉淀蛋白、影响发酵过程香气物质的转化及释放[7-8]。过高的单宁含量会使酵母细胞壁蛋白的黏附性降低,导致发酵迟缓或菌体死亡,减弱发酵能力[9]。此外,部分微生物会分泌单宁酶,以降低单宁对自身的损害。目前,商业酵母在高单宁水果发酵中存在发酵不彻底、酯香不足、口味不佳等问题。国内外企业一般采用降低单宁以适应发酵,使得果酒品质不稳定。因此,从高单宁水果筛选耐受性好的野生酵母,延长酵母在酿造中的作用时间,对更好地开发高单宁水果资源具有实际意义。
本研究以单宁胁迫策略从高单宁水果(刺梨、石榴、青李)中特异性分离、筛选得到贝氏酵母1株,对其最适生长温度、最适生长pH及耐单宁、耐乙醇、耐葡萄糖、耐SO2性能进行检测,并对其发酵性能及风味组成进行评估,旨在获得适合高单宁水果发酵的酵母菌株,为丰富酵母资源及提升果酒酿造品质提供支持。
1 材料与方法
1.1 材料与仪器
刺梨、石榴、青李,贵州、四川等地区;酿酒酵母(Saccharomyces cerevisiae)SY,安琪酵母股份有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)、单宁酸,Solarbio公司;WL营养琼脂,杭州百思生物科技有限公司;纤维二糖、棉子糖、松三糖,杭州滨和微生物试剂有限公司;2-酮基-D-葡萄糖酸半钙、甲基-α-D-葡萄糖苷,上海源叶生物科技有限公司;焦亚硫酸钾,上海麦克林生化科技有限公司。
YPD培养基(g/L):葡萄糖20、蛋白胨20、酵母浸膏10、琼脂20,液体不加琼脂;TTC培养基(g/L):葡萄糖5、琼脂15、TTC 0.5;果酒发酵培养基(g/L):刺梨渣60、拐枣渣20、水150、焦亚硫酸钾0.08,调整至糖度为20 °Brix,pH为4.6。以上培养基配制完成后,均于105 ℃灭菌10 min。
MHP-160霉菌培养箱,上海精其仪器有限公司;DH5000B高压蒸汽灭菌锅,上海申安医疗器械厂;SHZ-S2气浴恒温振荡器,常州金坛良友仪器有限公司;PEN3型电子鼻,德国AIRSENSE公司;PYL-3糖度计,日本ATAGO公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 酵母菌的分离纯化
挑取刺梨、脆青李、石榴腐烂部位划线到YPD培养基中,28 ℃培养,挑选形态类似酵母的菌落,多次纯化得到单一菌落,编号斜面保藏。
1.2.2 耐单宁酵母的筛选
将上述保藏菌株,以4 g/L单宁的YPD培养基,结合WL(wallerstein laboratory)培养基显色法、TTC显色法、杜氏小管产气法、嗅闻法、显微镜法筛选优良性能的菌株。
1.2.3 耐单宁酵母N1的鉴定
形态学观察:将N1菌株划线于含有4 g/L单宁的YPD培养基上培养48 h,观察酵母菌落特征;并挑取酵母菌体制片,在100倍油镜下观察酵母微观形态。
生理生化鉴定:参考The Yeasts, a Taxonomic Study手册,进行糖发酵、碳源同化、氮源同化、37 ℃生长、无维生素生长、酸性环境生长、重氮基蓝B等试验。
分子生物学鉴定:采用通用引物ITS1/ITS4扩增ITS并测序,序列经GenBank数据库比对,采用MAGE-7软件以邻接(neighbor-joining, NJ)法构建系统发育树。
1.2.4 耐单宁酵母N1的生长及耐受特性
1.2.4.1 生长特性
种子液制备:挑取斜面菌株接入YPD液体培养基中,28 ℃,150 r/min摇床培养,使OD600在0.5~0.6之间。
最适生长温度、最适pH的确定:分别设置温度为16、20、24、28、32、36、40 ℃;pH为3、4、5、6、7、8,接种量2%(体积分数,下同),150 r/min培养24 h,测定其OD600值。
生长曲线测定:按最适生长温度、最适pH重新制备种子液,接种量2%,150 r/min摇床培养。每4 h取样,测定其OD600值。以未接种培养基为空白对照,绘制生长曲线。
1.2.4.2 耐受性
耐单宁试验:参考KANPIENGJAI等[10]的方法,分别配制单宁浓度为0、2、4、8、16、32 g/L的YPD培养基,以牙签穿刺接种,28 ℃培养48 h,记录生长状况及菌落直径。
耐葡萄糖试验:以2%接种量分别接种于200、250、300、350、400 g/L不同葡萄糖质量浓度的YPD液体培养基,28 ℃培养24 h,测定其OD600值。
耐乙醇试验:以2%接种量分别接种于4%、8%、12%、16%、20%、24%不同乙醇体积的YPD液体培养基,28 ℃培养24 h,测定其OD600值。
耐SO2试验:以K2S2O5调节SO2浓度,以2%接种量分别接种于50、100、150、200、250 mg/L不同SO2质量浓度的YPD液体培养基,28 ℃培养24 h,测定其OD600值。
1.2.5 耐单宁酵母N1的单宁降解转化试验
参考丁栋等[11]的方法,以单宁浓度为横坐标,OD530值为纵坐标,构建单宁标准曲线。取10 g刺梨干粉加50 g水,高温高压灭菌备用。以2 mL接种量接种,2 mL无菌水为空白对照,28 ℃发酵处理5 d,测定单宁含量。单宁降解率的计算如公式(1)所示:
单宁降解率![]()
(1)
1.2.6 耐单宁酵母N1的果酒发酵试验
1.2.6.1 发酵力
按8%的接种量于刺梨果酒发酵培养基,22 ℃发酵。每24 h测定质量损失以监测发酵,发酵15 d。
1.2.6.2 发酵指标测定
发酵结束后测定发酵液中酒精度、总酯、残糖、总酸、干浸出物含量。参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[12]及GB/T 10345—2022《白酒分析方法》[13]测定。
1.2.7 耐单宁酵母N1的发酵果酒风味成分分析
采用PEN3型电子鼻进行果酒风味成分测定。方法参照CAO等[14]修改,样品重复测定5次;将WinMuster数据用SPSS软件、Origin 2021进行雷达图响应值分析、传感器贡献率分析(loadings analysis)、主成分分析(principal component analysis, PCA)。
2 结果与分析
2.1 酵母菌形态及培养特征
经分离纯化,初步得到45株耐单宁酵母菌株,11株来自刺梨,11株来自脆青李,23株来自石榴。经筛选,获得1株性能良好的耐单宁酵母菌N1,见图1。酵母在4 g/L单宁的YPD培养基上呈乳白色,圆形凸起,表面湿润,黏稠,有光泽,有强烈的果香味,酒精味;显微镜下呈圆形,出芽生殖。
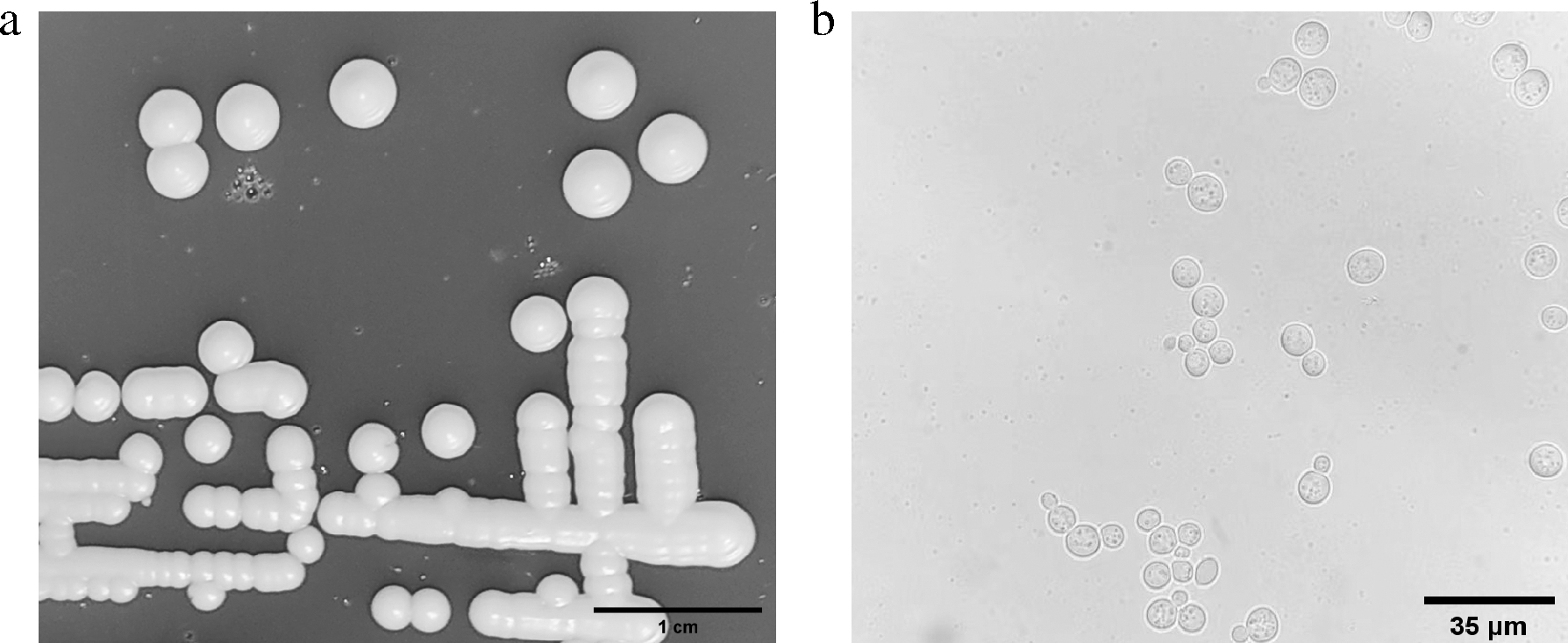
a-在YPD培养基上菌落形态;b-显微镜下细胞形态
图1 耐单宁酵母N1菌落及显微形态
Fig.1 Colony morphology of tannin-tolerant yeast N1 and cell morphology by microscope
2.2 耐单宁酵母N1的鉴定
由图2可知,菌株N1,与贝氏酵母(Saccharomyces bayanus×Saccharomyces cerevisiae)(LT577618.1)聚于一个分支,具有100%的相似度;生理生化特征也一致,见表1。最终鉴定菌株N1为贝氏酵母(Saccharomyces bayanus)。
表1 菌株N1生理生化鉴定试验结果
Table 1 Results of physiological and biochemical tests of N1

注:“+”表示生长;“-”表示未生长。
糖发酵结果碳源同化结果氮源同化结果其他生理生化试验结果葡萄糖+松三糖-蛋白胨+37 ℃生长+蔗糖+棉子糖+硫酸铵+酸性环境生长+乳糖-纤维二糖-硝酸钾-无维生素生长+麦芽糖-D-木糖-尿素+重氮基蓝B盐-可溶性淀粉-赤藓糖醇-果糖+海藻糖+2-酮基-D-葡萄糖酸半钙-甲基-α-D-葡萄糖苷-

图2 基于ITS序列菌株N1系统发育树
Fig.2 Phylogenetic tree of strain N1 based on ITS sequence
2.3 生长及耐受性试验
2.3.1 最适生长温度、最适pH及生长曲线
N1最适生长温度、最适pH及生长曲线见图3。温度能影响酵母对营养物质的代谢转化速率,影响发酵的整体风味[15]。N1受温度影响较大,吸光值呈先增加后下降的显著趋势(P<0.05),28 ℃有最大吸光值,为最适生长温度;pH能影响酵母原生质膜电荷转移,改变离子渗透性,进而影响生长[16]。N1在pH 3~8时吸光值呈先增加后下降的显著趋势(P<0.05),在pH 6时有最大吸光值,且酸性条件生长良好,能够适应低pH环境;由生长曲线可知,N1在0~8 h处于延迟期,生长缓慢;8 h后进入对数期,繁殖旺盛,24 h时增速减缓;36 h后进入稳定期,菌体密度稳定;72 h后进入衰亡期。

a-最适温度;b-最适pH;c-生长曲线
图3 耐单宁酵母N1最适温度、pH及生长曲线
Fig.3 Determination of optimal fermentation temperature, pH and the growth curve for yeast N1
2.3.2 耐受性试验
糖类是酵母增殖发酵所必需营养物质[17]。如图4-a所示,随着葡萄糖的增加,N1的吸光值呈先增加后减小趋势(P<0.05)。N1在质量浓度为400 g/L时仍有较好的耐受,满足果酒发酵要求。

a-葡萄糖耐受性;b-乙醇耐受性;c-SO2耐受性;d-单宁耐受性
图4 耐单宁酵母N1葡萄糖、乙醇、SO2、单宁耐受试验结果
Fig.4 Glucose, alcohol, SO2 and tannin tolerance of yeast N1
醇类会影响酵母相关膜及代谢通路的稳定性,阻碍酵母生长和糖利用能力[18-19]。随着乙醇浓度的增加,N1的吸光值逐渐降低,在16%后受到明显抑制(图4-b),符合低度果酒发酵。
SO2在果酒中可以提高澄清率、防止酸败,但SO2残留会影响果酒品质。如图4-c所示,SO2浓度与N1生长呈负相关性;N1在250 mg/L SO2下仍可正常生长,具有一定的SO2耐受能力。
单宁可与酵母蛋白质和相关酶系反应,从而阻碍生长[20]。随着单宁浓度的升高,N1生长受到抑制导致菌落直径减小;N1在单宁质量浓度为32 g/L时仍能生长,属于高耐单宁酵母(图4-d)。
2.4 单宁降解试验
部分微生物可在含有单宁的环境中稳定增殖,并分泌单宁酶将单宁降解,包括细菌、霉菌、酵母等[21]。依照单宁标准曲线及降解率公式计算,结果见图5。
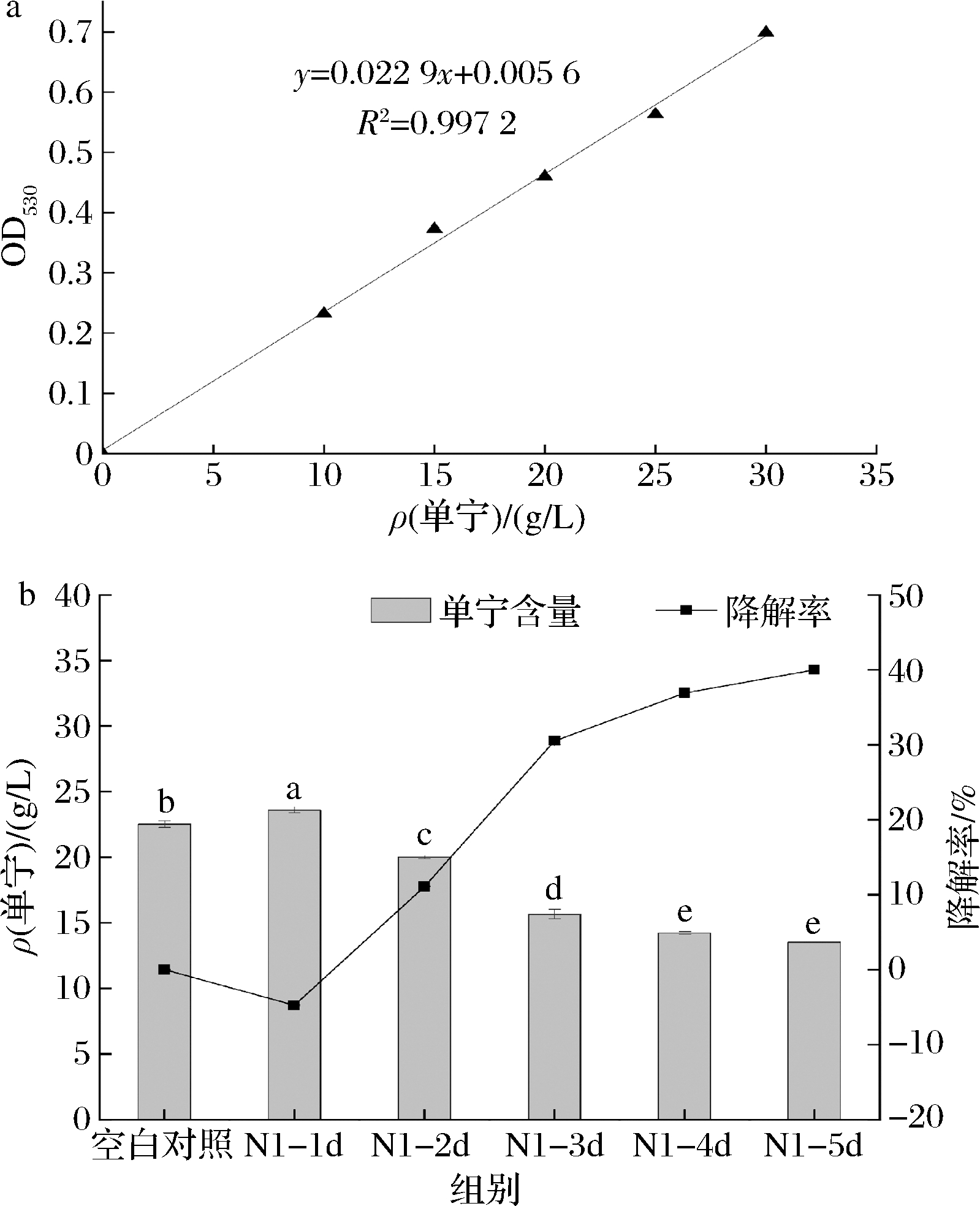
a-单宁标准曲线;b-单宁含量及降解率
图5 单宁标准曲线和菌株N1的单宁降解试验
Fig.5 Tannins standard curve and degradation ratio of tannins in fermentation by yeast N1
随着发酵时间的延长,样品中单宁含量先上升后下降(P<0.05)。相比对照组,处理组N1在发酵第2天单宁含量开始下降,这与发酵前期N1迅速增殖有关。发酵第5天时,单宁含量降至最低,降解率达到最高为40.01%。
2.5 刺梨果酒发酵试验
2.5.1 发酵力测定
酵母的发酵性能与起酵速率有关,起酵速度越快,酵母转化能力越强[22]。以SY(酿酒酵母)为对照,绘制发酵时间与质量损失的关系曲线,结果见图6。N1起酵速率快,在24 h进入发酵旺盛期。发酵后总失重量为20.15 g,质量损失主要集中在前期,这与蒲鹏飞[23]对海红果酒发酵分析结果一致。在发酵10 d时失重趋于稳定,在15 d时发酵基本结束。
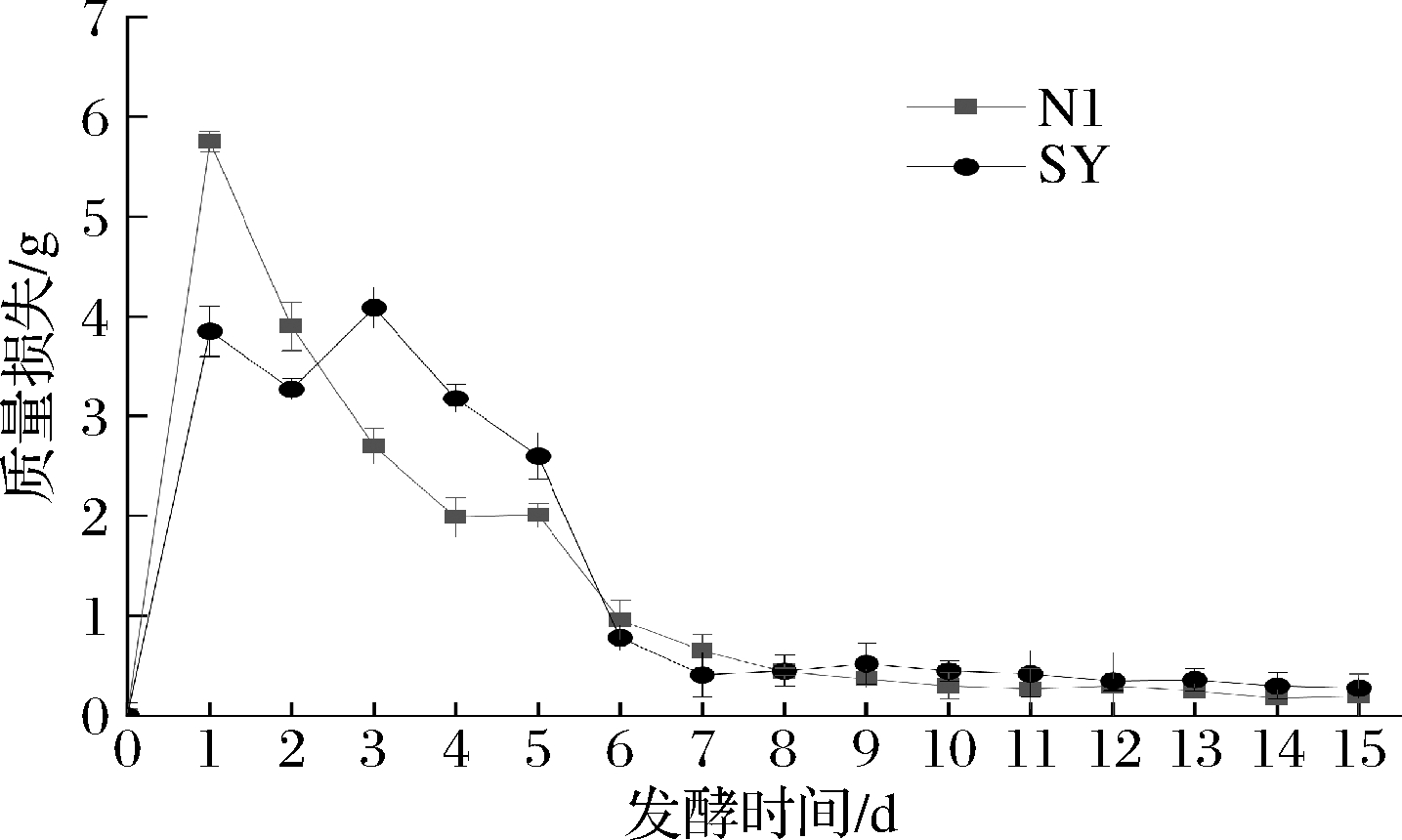
图6 各菌株发酵过程失重曲线
Fig.6 Weight loss curve in fermentation process of strain yeast
2.5.2 理化指标分析
发酵指标测定结果见表2。N1发酵液酒精度为9.23%vol低于SY,这与一般认为非酿酒酵母产酒能力普遍低于酿酒酵母的结论一致。酯类物质是果酒重要的风味物质[24]。N1总酯更高,为1.36 g/L,含有更多的香味物质;酸类物质在果酒中可以丰富果酒品质,提升口感。N1总酸为6.02 g/L,发酵液整体总酸偏高,这可能与刺梨维生素C含量高有关。对糖的利用能力能够反映菌种的发酵效能,残糖越低,效能越高[25]。N1残糖量为4.31 g/L,发酵效能良好;干浸出物与果酒原料及发酵方式有关,干浸出物含量越高则果酒品质越高[26]。N1干浸出物质量浓度为57.1 g/L,符合高品质标准。结合酒精产量、产酯及糖利用率等情况可知,N1发酵性能良好。
表2 菌株N1发酵第10天理化指标
Table 2 Physical and chemical indexes of fermentation on the 10th day by yeast N1

注:同列不同小写字母表示有显著性差异(P<0.05)。
菌株酒精度/%vol总酯/(g/L)总酸/(g/L)残糖/(g/L)干浸出物/(g/L)N19.23±0.2b1.36±0.02a6.02±0.06a4.31±0.03a57.1±1.2aSY12.10±0.5a1.24±0.05b4.54±0.17b4.20±0.19b40.6±4.4b
2.6 刺梨果酒电子鼻风味分析
2.6.1 电子鼻风味物质的响应雷达图与传感器贡献率分析
非酿酒酵母与酿酒酵母相比,参与发酵会分泌各种脂肪酶、蛋白酶、糖苷酶等酶系,产生各种高级代谢产物,提高果酒风味的复杂性[24]。由图7可知,N1在传感器W1W、W1S、W5S响应值明显高于SY,产生更多烯烃类、甲基烷烃类、氮氧化合物等成分。N1雷达图整体类似SY,与KB有明显差异。载荷图中总贡献率为99.5%。W1S传感器对第一主成分的贡献率最大,为甲基烷烃类物质;W2S传感器对第二主成分的贡献率最大,为醇类物质。传感器W1S、W1C、W3C的敏感性高,风味贡献率较大,表明发酵液主要风味为烷烃类、芳香苯类、芳香胺类。
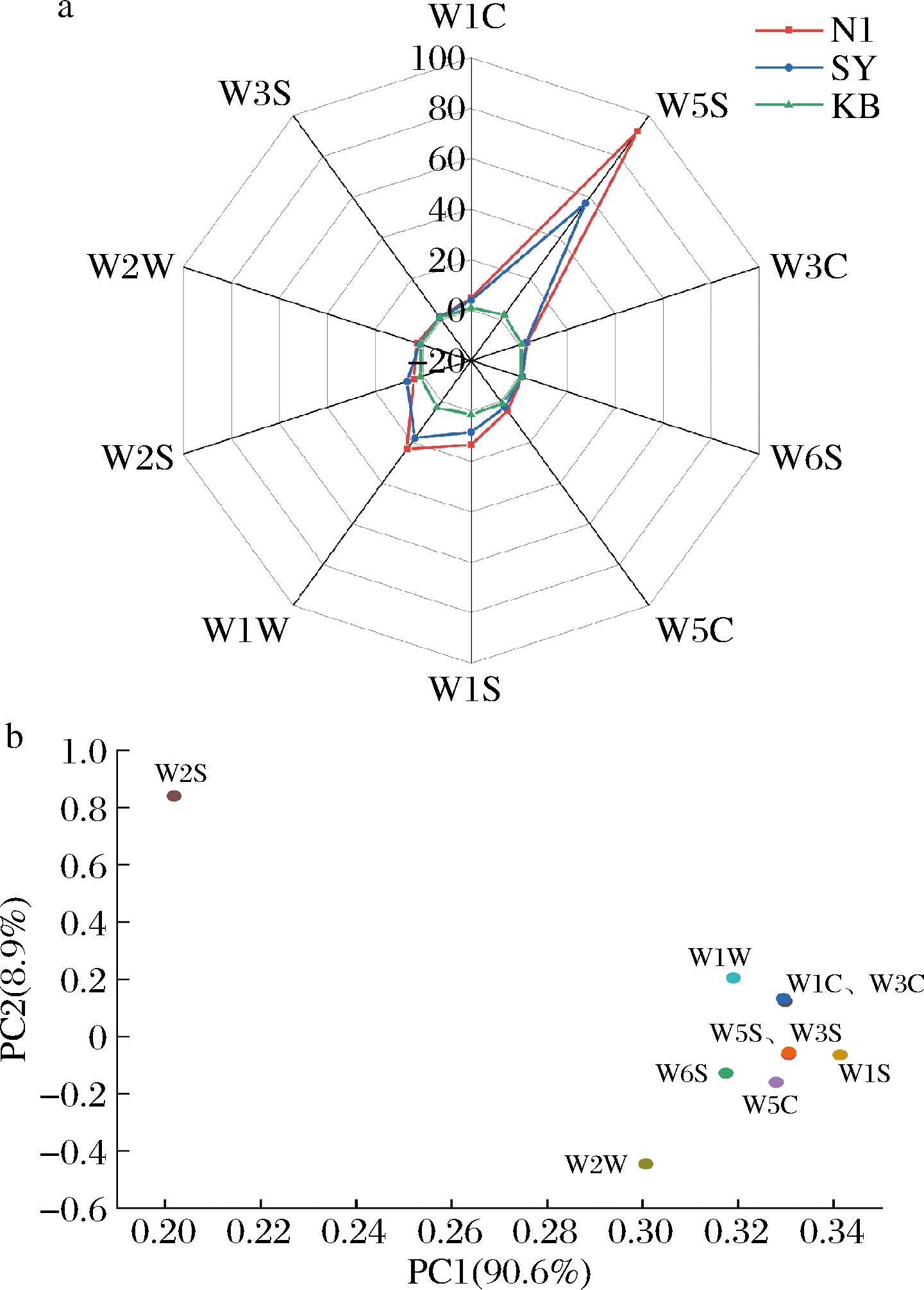
a-响应雷达图;b-传感器载荷分析图
图7 N1、SY、KB响应雷达图和载荷图
Fig.7 Response radar plot and loading plot for N1, SY, and KB
2.6.2 主成分分析法
利用PCA表示各样品风味与电子鼻结果的关系,结果见图8。第一主成分和第二主成分贡献率分别达到了90.6%和8.9%。N1分布于第四象限,SY分布于第一象限。N1与SY在第二主成分呈负相关,风味占比不同,具有一定的差异性。表明电子鼻可以有效区分不同菌株的风味物质组成,具有可靠性。
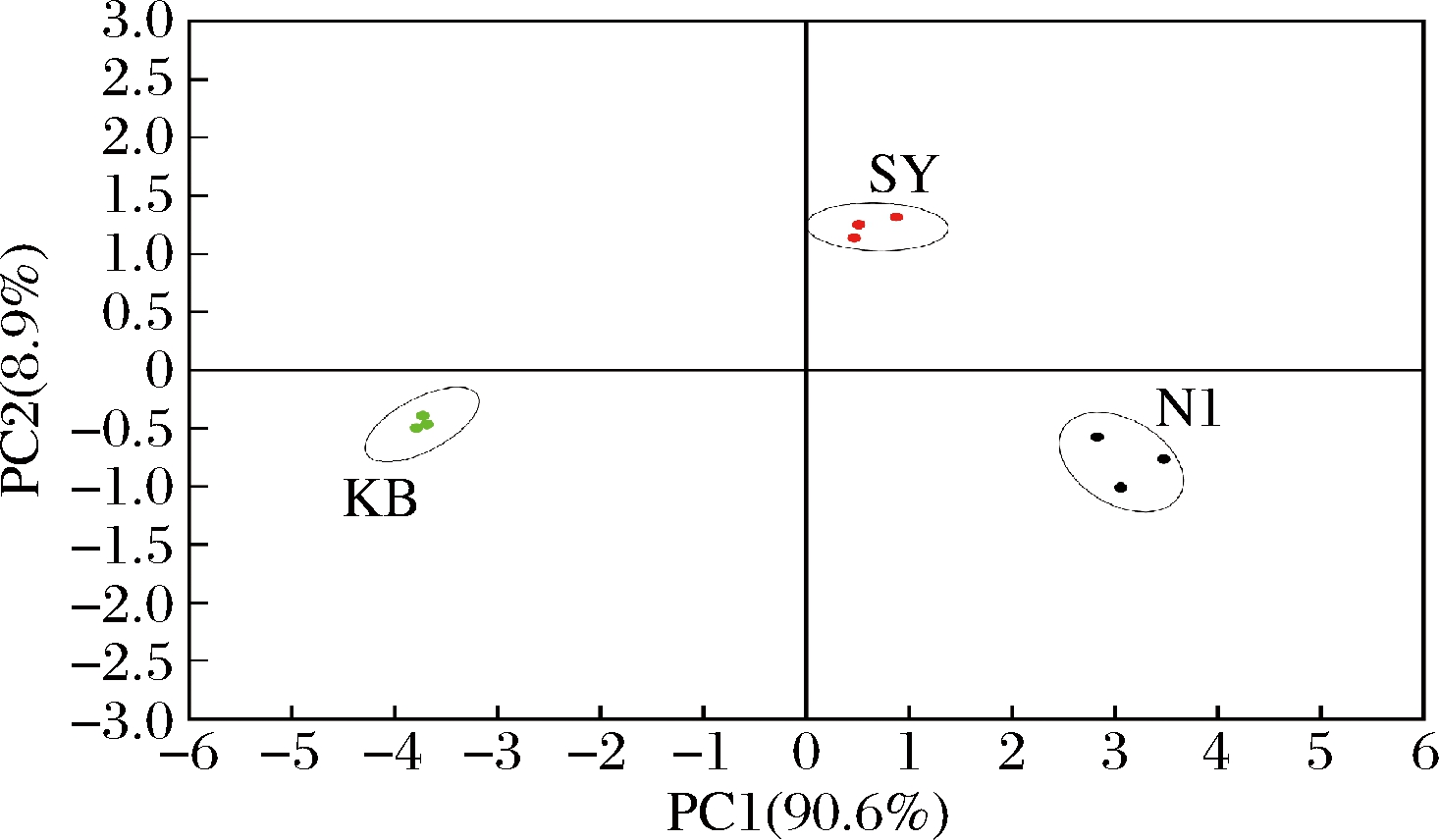
图8 N1、SY、KB电子鼻数据PCA图
Fig.8 PCA plot for N1, SY, and KB
3 讨论
传统酵母资源库已无法满足各类特色果酒开发,酵母选育已是果酒发酵最重要的环节之一。目前,从水果发酵液中筛选野生酵母,提高果酒的发酵品质,依然是主要的筛选方式。吴德光等[25]从三华李中分离出酿酒酵母,具有高产酒精的发酵潜力。杜亚军等[27]从红枣中分离出一株酿酒酵母,发酵酸度低且产香丰富,解决了枣酒残糖较高、缺少风味等共性问题。大部分水果中含有酸类、酚类、皂苷类等各种抑菌类活性物质,传统酵母缺乏一定的耐受能力,从而影响酵母增殖致使发酵效果降低。目前,对于高耐受性酵母的选育,提高水果的开发潜力,对产业升级改革具有实际意义。
贝氏酵母(Saccharomyces bayanus)是一种常用于果酒发酵的非酿酒酵母菌,通过释放酶和香气成分来增强果酒的多样性和复杂性[28]。LIU等[29]发现,贝氏酵母不仅可提高辛酸乙酯和己酸乙酯的气味活性值,还可与酿酒酵母共培养增加癸醇和萜烯-4-醇等特征风味含量。JANUSZEK等[30]利用贝氏酵母发酵苹果白兰地,产生更多高级酯类、β-葡萄糖苷酶等活性成分。KANPIENGJAI等[10]研究表明,非酿酒酵母在单宁质量浓度≥30 g/L时生长状态优于酿酒酵母,表现出更高的单宁耐受能力,与本研究结果一致。贺红早等[31]利用贝氏酵母进行刺梨果酒发酵,整体评价高于酿酒酵母、孢圆酵母。本研究也发现,N1在总酯、干浸出物含量等方面均优于酿酒酵母,风味组成更加丰富。KELLY等[32]利用贝氏酵母和酿酒酵母发酵脱水葡萄发现,2种酵母产醇水平相似,贝氏酵母可减少酒中的氧化物,提高色素浓度。本研究也发现,贝氏酵母虽属非酿酒酵母,也具有较好的产醇能力。
4 结论
本研究从高单宁水果中分离筛选获得一株发酵良好、风味突出的酵母菌株N1,经鉴定为贝氏酵母。N1能够耐受32 g/L单宁和降解40.01%的单宁,具有良好的高单宁水果利用能力;N1发酵刺梨酒酒精度9.23%vol,总酯质量浓度为1.36 g/L,具有良好的产酒产香能力;对刺梨酒进行电子鼻风味测定,烷烃类、芳香苯类、芳香胺类物质贡献主要风味。N1具有发酵高单宁水果的潜能,但仍需要进行大量的基础与应用研究,进一步验证N1菌株产酯能力和产香机制,或进一步驯化、育种提高发酵能力。此外,N1与酿酒酵母混菌发酵具有可实践性,是否适用于其他高单宁水果发酵还有待研究。对于耐单宁酵母的筛选,既丰富了酵母资源库,也为后续的实际工业生产提供了可靠思路。
[1] ECHAVE J, BARRAL M, FRAGA-CORRAL M, et al.Bottle aging and storage of wines:A review[J].Molecules, 2021, 26(3):713.
[2] 李杰, 刘巧玲, 孙红先, 等.植物单宁营养生理功能及其在反刍动物生产中的应用研究进展[J].畜牧兽医杂志, 2021, 40(6):79-82.
LI J, LIU Q L, SUN H X, et al.Research progress on the nutritional and physiological functions of plant tannin and its application in ruminantia[J].Journal of Animal Science and Veterinary Medicine, 2021, 40(6):79-82.
[3] 常丽, 陈安国, 黄思齐, 等.单宁酸在抗菌及伤口愈合中的研究进展[J].中国麻业科学, 2022, 44(1):63-68.
CHANG L, CHEN A G, HUANG S Q, et al.Research progress of tannic acid in antibacterial and wound healing[J].Plant Fiber Sciences in China, 2022, 44(1):63-68.
[4] 张宝善, 陈锦屏, 卢勇.水果的涩味研究[J].食品研究与开发, 1998, 19(1):31-34.
ZHANG B S, CHEN J P, LU Y.Study on astringency of fruit[J].Food Research and Development, 1998, 19(1):31-34.
[5] 傅长明, 黄科林, 王则奋, 等.植物单宁的性质及应用[J].企业科技与发展, 2010(22):57-60.
FU C M, HUANG K L, WANG Z F, et al.The properties and applications of vegetable tannin[J].Enterprise Science and Technology &Development, 2010(22):57-60.
[6] 师戈图, 付建华, 吴元, 等.单宁对葡萄酒香气前鼻和鼻后阈值的影响[J].食品与发酵工业, 2022, 48(17):102-107.
SHI G T, FU J H, WU Y, et al.Effect of tannins on the orthonasal and retronasal thresholds of wine aromas[J].Food and Fermentation Industries, 2022, 48(17):102-107.
[7] WANG L, ZHANG B, XIAO J E, et al.Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J].Food Chemistry, 2018, 249:127-135.
[8] HARBERTSON J F, PARPINELLO G P, HEYMANN H, et al.Impact of exogenous tannin additions on wine chemistry and wine sensory character[J].Food Chemistry, 2012, 131(3):999-1008.
[9] 韩姗姗. 柠檬形克勒克酵母(Kloeckera apiculata)在葡萄酒发酵中的应用研究[D].杨凌:西北农林科技大学, 2008.
HAN S S.The effect of using Kloeckera apiculata on fermentation and wine quality[D].Yangling:Northwest A &F University, 2008.
[10] KANPIENGJAI A, CHUI-CHAI N, CHAIKAEW S, et al.Distribution of tannin-’ tolerant yeasts isolated from Miang, a traditional fermented tea leaf (Camellia sinensis var.assamica) in northern Thailand[J].International Journal of Food Microbiology, 2016, 238:121-131.
[11] 丁栋, 李锦丽, 李长忠, 等.一株单宁降解菌的鉴定及其对青海“双低”菜籽粕中单宁降解效果[J].中国粮油学报, 2019, 34(11):106-112.
DING D, LI J L, LI C Z, et al.Identification of a tannin-degrading strain and its tannin degradation effect to Qinghai “double-low” rapeseed meal[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(11):106-112.
[12] 国家质量监督检验检疫总局, 中国国家标准化管理委员会.葡萄酒、果酒通用分析方法:GB/T 15038—2006[S].北京:中国标准出版社, 2008.
[13] 国家质量监督检验检疫总局, 中国国家标准化管理委员会.白酒分析方法:GB/T 10345—2022[S].北京:中国标准出版社, 2022.
[14] CAO Y X, WU Z F, WENG P F.Comparison of bayberry fermented wine aroma from different cultivars by GC-MS combined with electronic nose analysis[J].Food Science &Nutrition, 2020, 8(2):830-840.
[15] 章钰浛, 班世栋, 赵皓静, 等.温度对产香酵母产挥发性风味物质的影响[J].食品与发酵工业, 2022, 48(5):58-67.
ZHANG Y H, BAN S D, ZHAO H J, et al.Effect of temperature on the volatile compounds produced by aroma producing yeasts[J].Food and Fermentation Industries, 2022, 48(5):58-67.
[16] 许艳俊, 李静媛.pH和Ca2+协同作用对酵母代谢及细胞膜功能的影响[J].生物技术通报, 2018, 34(3):208-216.
XU Y J, LI J Y.Synergetic effects of pH and Ca2+ on yeast metabolism and cell membrane function[J].Biotechnology Bulletin, 2018, 34(3):208-216.
[17] 冯莉, 陈雪, 李丽, 等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报, 2018, 18(12):66-73.
FENG L, CHEN X, LI L, et al.The enology characteristics of five strains of Pichia kluyveri[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):66-73.
[18] ISHMAYANA S, KENNEDY U J, LEARMONTH R P.Further investigation of relationships between membrane fluidity and ethanol tolerance in Saccharomyces cerevisiae[J].World Journal of Microbiology and Biotechnology, 2017, 33(12):218.
[19] QIU Z L, JIANG R R.Improving Saccharomyces cerevisiae ethanol production and tolerance via RNA polymerase II subunit Rpb7[J].Biotechnology for Biofuels, 2017, 10(1):1-13.
[20] 赵湖冰, 黎华, 田野, 等.一株刺梨非酿酒酵母的分离鉴定、生理特性及混菌发酵研究[J].食品工业科技, 2020, 41(16):114-120.
ZHAO H B, LI H, TIAN Y, et al.Isolation, identification, physiological characteristics and mixed fermentation of a non-Saccharomyces cerevisiae from Rosa roxburghii[J].Science and Technology of Food Industry, 2020, 41(16):114-120.
[21] AGUILAR C N, RODR GUEZ R, GUTIÉRREZ-S
GUEZ R, GUTIÉRREZ-S NCHEZ G, et al.Microbial tannases:Advances and perspectives[J].Applied Microbiology and Biotechnology, 2007, 76(1):47-59.
NCHEZ G, et al.Microbial tannases:Advances and perspectives[J].Applied Microbiology and Biotechnology, 2007, 76(1):47-59.
[22] 李明瑕, 刘春凤, 王壬, 等.黄桃果酒酿酒酵母的筛选与发酵特性分析[J].食品与发酵工业, 2021, 47(14):113-122.
LI M X, LIU C F, WANG R, et al.Screening of Saccharomyces cerevisiae from yellow peach wine and their fermentation properties[J].Food and Fermentation Industries, 2021, 47(14):113-122.
[23] 蒲鹏飞. 非酿酒酵母与酿酒酵母的相互作用及其对海红果酒品质的影响[D].西安:陕西科技大学, 2018.
PU P F.The interaction between non Saccharomyces and Saccharomyces cerevisiae and its effect on the quality of Haihong wine[D].Xi’an:Shaanxi University of Science &Technology, 2018.
[24] 田怀香, 熊娟涓, 于海燕, 等.果酒中香气化合物的生物转化与调控机制研究进展[J].食品科学, 2022, 43(19):36-47.
TIAN H X, XIONG J J, YU H Y, et al.Biotransformation and biological regulation mechanism of aroma compounds in fruit wine:A review[J].Food Science, 2022, 43(19):36-47.
[25] 吴德光, 刘政凯, 王力腾, 等.三华李果酒生产专用酵母的筛选与酿造性能比较[J].食品科技, 2022, 47(6):24-29.
WU D G, LIU Z K, WANG L T, et al.Screening and brewing performance compares of special yeasts for Sanhua plum wine production[J].Food Science and Technology, 2022, 47(6):24-29.
[26] 黄志芬, 李循媛, 黄梦婷.葡萄酒酒精度及干浸出物的快速测定[J].现代食品, 2021(7):179-182.
HUANG Z F, LI X Y, HUANG M T.Rapid determination of wine alcohol content and dry extract[J].Modern Food, 2021(7):179-182.
[27] 杜亚军, 郭尚, 李群, 等.木枣产香酵母的分离筛选和应用[J].中国酿造, 2021, 40(10):123-128.
DU Y J, GUO S, LI Q, et al.Screening and application of aroma-producing yeast strains from jujube[J].China Brewing, 2021, 40(10):123-128.
[28] LIU J, LIU M, YE P, et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S.cerevisiae, S.bayanus, S.uvarum) and T.delbrueckii[J].European Food Research and Technology, 2020, 246(4):807-820.
[29] LIU J A, LIU M A, YE P A, et al.Characterisation of the metabolite profile and microbial community of repeated batch and coculture-fermented greengage wine[J].Process Biochemistry, 2021, 109:117-129.
[30] JANUSZEK M, SATORA P, WAJDA  , et al.Saccharomyces bayanus enhances volatile profile of apple brandies[J].Molecules, 2020, 25(14):3127.
, et al.Saccharomyces bayanus enhances volatile profile of apple brandies[J].Molecules, 2020, 25(14):3127.
[31] 贺红早, 张玉武, 刘盈盈, 等.三种酵母对无籽刺梨果酒品质的影响[J].酿酒科技, 2015(10):10-13.
HE H Z, ZHANG Y W, LIU Y Y, et al.Effects of three kinds of yeast on the quality of seedless Rosa sterilis fruit wine[J].Liquor-Making Science &Technology, 2015(10):10-13.
[32] KELLY J, YANG F, DOWLING L, et al.Characterization of Saccharomyces bayanus CN1 for fermenting partially dehydrated grapes grown in cool climate winemaking regions[J].Fermentation, 2018, 4(3):77.