乳酸菌是白酒发酵过程中的主要微生物[1],大量乳酸菌的生长使白酒酿造过程中乳酸大量积累,酒醅酸度过高[2],影响其他产酒酵母的生长与产酒,其中食果糖乳杆菌在发酵产醇阶段,通过异型乳酸发酵主导的乙醇代谢模式引起发酵体系乳酸过度积累, 造成“乳酸高酒精不低”的现象,影响后续轮次发酵[3]。因此,通过控制发酵体系生物因素来抑制酸败菌的生长尤为重要。研究证明,当乳酸含量6 g/100 g时会显著抑制酵母菌的生长与代谢[4-5]。
目前,降低酒醅中乳酸主要有2种途径:一是物理除酸,例如,浓香型酒厂通过蒸馏后期,“大气冲酸”[6],但乳酸为不易挥发性酸,效果不理想;另一种途径是生物途径,筛选能利用乳酸的微生物进行降酸,该方法能耗小、无污染且效率高,是当前的主要研究方向[7]。据统计,目前的研究主要选育具有较强乳酸耐受性的酵母菌菌株来提高白酒发酵高酸条件下的产酒力[8]。但是中国白酒的酿造属于典型的多菌种自然发酵,依靠自然富集获得的微生物发酵,产生不同特征风味的物质。在此过程中,通过酿造菌群自身降低酒醅中乳酸含量可以缓解乳酸对产酒酵母的抑制作用。毕赤酵母是白酒发酵中最常用的产酒功能菌株之一,在汾酒酒醅发酵前期毕赤酵母占真菌群落的60%以上[9],白云边出入窖酒醅中,毕赤酵母属占比约为40%[10],酱香型白酒酿造酒醅中毕赤酵母在前期轮次中占比大于80%[11]。毕赤酵母具有生长周期短、发酵能力强、容易进行大规模培养以及含有多种蛋白质、氨基酸、维生素、生物活性物质等丰富营养成分的优点,是基础研究及应用研究的主要对象,广泛应用于食品、医药等领域[12]。
研究发现,毕赤酵母有一定的降解乳酸功能[13-14]。然而,传统酿造微生物自然富集过程存在较大的波动性。不同发酵系统,甚至不同香型白酒酿造中,产乳酸的菌群结构存在较大差异[15-16]。毕赤酵母能否有效抑制酱香型白酒酿造过程中普遍存在的乳酸菌,并实现降解乳酸有待进一步验证。因此,需明确毕赤酵母对酱香型白酒中主要乳酸菌株的产乳酸抑制情况。
本研究以从酱香白酒酿造过程中筛选的耐酸毕赤酵母为研究对象,探索其在与不同类型乳酸菌混合发酵过程中产乳酸抑制效果,并通过酒醅原位发酵验证其抑制作用。以期进一步推动自然发酵过程中靶向菌群富集方法与策略,通过生物途径降低白酒发酵过程乳酸含量,为解决传统发酵体系中乳酸过度积累共性问题提供理论和实践基础。
1 材料与方法
1.1 实验材料
1.1.1 培养基
高粱汁培养基:将高粱与水按料液比1∶4(g∶mL)混合,按1 μL/g 高粱的添加量加入淀粉酶(20 000 U/mL)蒸煮液化,按5 μL/g 高粱的添加量在60 ℃时加入糖化酶(100 000 U/mL)糖化,4层纱布过滤,10 000 r/min离心10 min,上清液调节糖度至7°Bx。
富集培养基(g/L):乳酸40,葡萄糖50,蛋白胨20,酵母膏10,K2HPO4 2,NaCl 1,MgSO4 0.1,MnSO4 0.05。
筛选培养基(g/L):乳酸40,葡萄糖50,蛋白胨20,酵母膏10。
酵母浸出粉胨葡萄糖(yeast extracts peptone dextrose,YPD)液态培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10;固态培养基加入20 g/L琼脂。
上述培养基pH自然,115 ℃灭菌15~20 min。
1.1.2 检测方法
乳酸:取1 mL发酵液于2 mL离心管,12 000 r/min、4 ℃离心10 min,取一定量的上清液,超纯水稀释30倍,经0.2 μm滤膜过滤,滤液进样液相色谱分析。
乙酸:称取15 g酒醅于50 mL离心管中,加入30 mL超纯水,280 r/min振荡15 min,超声波处理5 min,4 ℃、4 000 r/min离心6 min,吸取上清液710 μL置于EP管中,加入790 μL 95%乙醇,-20 ℃冷冻2 h以上,4 ℃、12 000 r/min离心10 min,离心后上清液(不少于0.5 mL)转移至2 mL样品瓶中进样分析。
乙醇:取15 g酒醅于50 mL离心管中,加入30 mL超纯水,280 r/min振荡15 min,超声波处理5 min,4 ℃、4 000 r/min离心6 min,吸取4 mL上清液于20 mL 顶空进样瓶中进样分析。
1.2 实验菌株
菌株:库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)JP-Y08,来源于茅台酒发酵过程酒;乳酸菌:植物乳杆菌(Lactobacillus plantarum)、桥乳杆菌(Lactobacillus pontis)、面包乳杆菌(Lactobacillus panis)、乳酸片球菌(Pediococcus acidilactici)、发酵乳杆菌(Lactobacillus fermentum)、食果糖乳杆菌(Lactobacillus fructivorans),茅台酒发酵过程酒醅;毕赤酵母模式菌株(ATCC 6258),购买的模式菌株。
1.3 菌株筛选
称取样品10 g于90 mL带玻璃珠的无菌水中,振荡均匀,吸取0.1 mL上清液于100 mL富集培养基中,分别在有氧/无氧、30 ℃/37 ℃条件下静置培养2~4 d,观察培养液是否浑浊;若培养液已明显浑浊时,吸取0.1 mL富集培养液于新的100 mL液态筛选培养基中30 ℃静置培养2 d,培养3~4次后将培养液梯度稀释于YPD固体培养基上,培养3~4 d后,其单菌落即为抗乳酸特性的目标菌株。
1.4 菌株鉴定
将筛选得到的耐乳酸特性菌株接种于YPD固体培养基上,30 ℃培养4 d,观察菌落形态,将菌落圆形,且表面光滑的菌株多次纯化后,进行分子生物学鉴定。
分子生物学鉴定:采用试剂盒法提取基因组[17],以其为模板对目标菌株的26S rDNA D1/D2区基因序列进行PCR扩增。测序引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)。PCR扩增体系(25 μL):Taq-Mix酶12 μL,引物NL1和引物NL4各1 μL,模板1 μL,ddH2O 10 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶检验合格后送往生工生物工程(上海)股份有限公司进行测序。将26S rDNA D1/D2区测序结果上传NCBI数据库中进行BLAST比对分析,待鉴定菌株和与其亲缘关系最近的模式菌株的同源率大于99%,初步判定两者为同一种。
1.5 毕赤酵母对4种乳酸菌的产酸抑制
将毕赤酵母菌株接种于YPD液体培养基中,于30 ℃预培养至菌体浓度OD600值为0.3,获得毕赤酵母种子液。将从酒醅中原位筛选的植物乳杆菌、乳酸片球菌、桥乳杆菌、面包乳杆菌分别接种于MRS液体培养基中,于37 ℃预培养至OD600值达0.3。
将7.5 μL毕赤酵母种子液、毕赤酵母模式菌株(ATCC 6258)种子液分别与7.5 μL植物乳杆菌、乳酸片球菌、桥乳杆菌、面包乳杆菌种子液混合接种于1.5 mL高粱汁培养基中,37 ℃下静置培养72 h,测定发酵终点的发酵液中乳酸含量及乳酸菌菌体量。试验分组见表1。
表1 试验分组
Table 1 Experimental groups
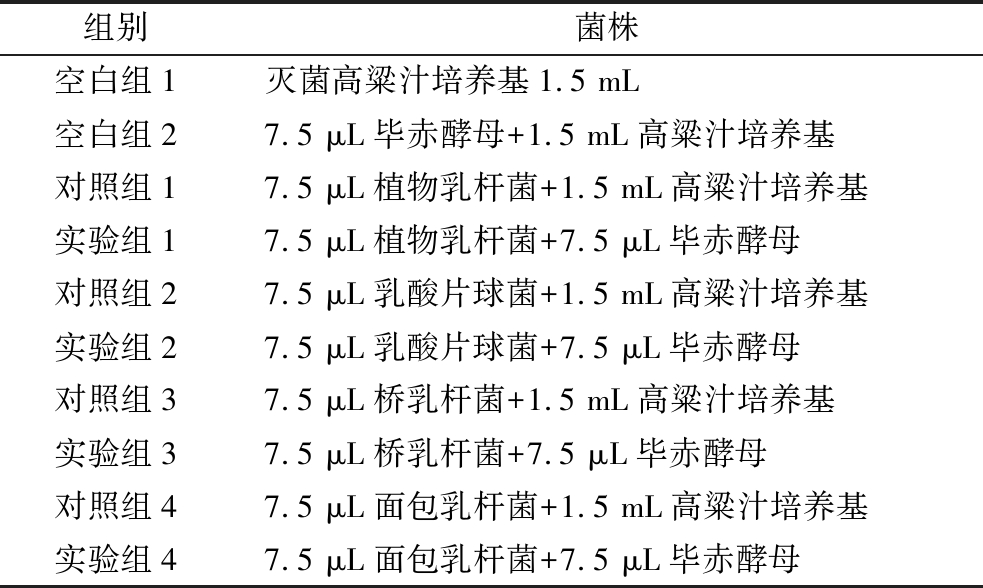
组别菌株空白组1灭菌高粱汁培养基1.5 mL空白组27.5 μL毕赤酵母+1.5 mL高粱汁培养基对照组17.5 μL植物乳杆菌+1.5 mL高粱汁培养基实验组17.5 μL植物乳杆菌+7.5 μL毕赤酵母对照组27.5 μL乳酸片球菌+1.5 mL高粱汁培养基实验组27.5 μL乳酸片球菌+7.5 μL毕赤酵母对照组37.5 μL桥乳杆菌+1.5 mL高粱汁培养基实验组37.5 μL桥乳杆菌+7.5 μL毕赤酵母对照组47.5 μL面包乳杆菌+1.5 mL高粱汁培养基实验组47.5 μL面包乳杆菌+7.5 μL毕赤酵母
1.6 毕赤酵母与同型、异型乳酸菌混合发酵
将鉴定后所得的库氏毕赤酵母菌株JP-Y08接种于YPD液体培养基中,于30 ℃预培养至菌体浓度约为109CFU/mL,获得毕赤酵母种子液。制备食果糖乳杆菌(异型乳酸菌)、发酵乳杆菌(同型乳酸菌)种子液菌体浓度约为109 CFU/mL。
(a)纯种发酵:将毕赤酵母以2%接种量接种于液体培养基(终浓度约为106CFU/mL),按流程进行发酵。
(b)混合发酵将毕赤酵母和乳酸菌以:①10∶1(2%∶0.2%);②10∶10(2%∶2%);③1∶10(0.2%∶2%)接种于液体培养基,按流程进行发酵(图1)。

图1 试验流程
Fig.1 Experimental diagram
1.7 毕赤酵母在白酒发酵过程中的降乳酸应用
为了验证库氏毕赤酵母JP-Y08菌株在发酵过程中对酒醅高酸、结块、霉变等异常发酵状态的改善情况,本试验选择前期轮次发酵程度不太理想的窖号进行实验。
将毕赤酵母接种于高粱汁液体培养基中,30 ℃恒温振荡培养48 h,将获得的培养液12 000 r/min离心10 min,弃上清液,获得毕赤酵母的菌体细胞沉淀,用无菌水洗涤数次,并用血球计数板计算酵母菌液的浓度,调节菌体量为106CFU/g菌泥,备用。
实验组:将毕赤酵母CGMCC No:14068菌剂按5%(质量百分比)的比例与制酒生产中已丢堆的糟醅(500±10) g混合均匀,疏松地装于搪瓷缸中,并用纱布封口后,埋于制酒生产轮次堆积发酵阶段酒醅中,于发酵堆深约50 cm处,设置3个平行。
对照组:将制酒生产中已丢堆的糟醅(500±10)g,疏松地装于搪瓷缸中,并用纱布封口后,与实验组同埋于制酒生产轮次堆积发酵阶段酒醅中,于发酵堆子深约50 cm处,共设置3个平行。
窖内发酵阶段,将上述实验组和对照组同时转移至窖内酒醅距窖面深约1.5 m处,窖内发酵结束,对酒醅的乳酸含量进行检测,并观察发酵感官情况。
1.8 数据处理与分析
利用SPSS 20.0分析不同组间差异显著性。
2 结果与分析
2.1 菌株筛选及鉴定
从酱香型酒醅中通过5次富集、筛选,初步分离得到具有乳酸耐受性,且稳定性较强的目标菌株45株,菌株编号分别为JP-Y01~JP-Y45。45株菌株的测序结果经BLAST比对发现,与库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)NRRL Y-5396的26S rDNA基因序列相似度大于99%的菌株有21株,从中选择抑制产乳酸效果最好的菌株JP-Y08进行后续研究。
2.2 毕赤酵母对乳酸菌的产酸抑制
由表2可知,毕赤酵母菌株JP-Y08与植物乳杆菌、乳酸片球菌、桥乳杆菌或面包乳杆菌混合发酵,可使混合发酵体系的乳酸含量下降64.0%~94.1%,而毕赤酵母模式菌株ATCC 6258的混合发酵体系乳酸含量仅下降25%~50%,产乳酸抑制效果远低于本研究的菌株,且纯乳酸菌发酵和与毕赤酵母混合发酵组别、添加JP-Y08与ATCC 6258组别之间乳酸含量差异均极显著(P<0.01)。
表2 不同培养体系发酵终点的乳酸含量
Table 2 Lactic acid content at the end of fermentation in different culture systems

注:同一乳酸菌不同组别间,不同的上标表示有极显著差异(P<0.01)。
组别乳酸含量/(g/L)乳酸下降率/%空白组10.000 0/空白组20.000 0植物乳杆菌3.698 0±0.098 9a/植物乳杆菌+JP-Y080.468 0±0.024 1c87.3植物乳杆菌+ATCC 62582.742 4±0.040 6b25.8乳酸片球菌1.817 3±0.019 3a/乳酸片球菌+JP-Y080.176 4±0.006 5c90.3乳酸片球菌+ATCC 62580.940 0±0.002 8b49.9桥乳杆菌2.965 7±0.007 8a/桥乳杆菌+JP-Y080.175 7±0.005 9c94.1桥乳杆菌+ATCC 62582.108 8±0.095 8b28.9面包乳杆菌3.210 9±0.017 9a/面包乳杆菌+JP-Y081.155 8±0.011 2c64.0面包乳杆菌+ATCC 62582.313 8±0.061 2b27.9
2.3 毕赤酵母与同型乳酸菌、异型乳酸菌混合发酵
由图2可知,毕赤酵母与同型、异型乳酸菌混合发酵时,乳酸变化趋势大致相同。

a-异型乳酸发酵;b-同型乳酸发酵
图2 毕赤酵母与乳酸菌混合发酵终点乳酸含量
Fig.2 Lactic acid content at the end of mixed fermentation of P.kudriavzevii and lactic acid bacteria
厌氧发酵结束时(图2-a),异型乳酸菌纯种发酵乳酸含量为1.27%,当与毕赤酵母混合发酵时,培养基中的乳酸含量为0.18%~0.68%;厌氧发酵结束时,同型乳酸菌纯种发酵的乳酸含量为1.50%(图2-b),与毕赤酵母混合发酵时,乳酸含量为0.37%~0.73%。整个发酵过程乳酸菌纯种发酵乳酸含量在1.2%~1.5%,添加毕赤酵母的组别乳酸含量为0.04%~0.73%,混合发酵产生的乳酸明显低于乳酸菌纯种单独发酵组别,且毕赤酵母接种量越高,乳酸含量越低;厌氧发酵结束时,同型乳酸发酵产生的乳酸大于异型乳酸发酵,该结果表明毕赤酵母对异型乳酸发酵的产乳酸抑制作用强于同型乳酸发酵。
厌氧发酵结束时,(图3)异型乳酸菌纯种发酵总醇含量峰面积1 g处理后为7.08,同型乳酸菌纯种发酵为6.29,异型乳酸菌发酵产醇能力大于同型乳酸菌;添加毕赤酵母组别总醇含量均大于乳酸菌纯种发酵。

a-异型乳酸发酵;b-同型乳酸发酵
图3 毕赤酵母与乳酸菌混合发酵终点总醇含量
Fig.3 Total alcohol content at the end of mixed fermentation with P.kudriavzevii and lactic acid bacteria
2.4 毕赤酵母在白酒发酵过程中的降乳酸应用
在搪瓷缸中添加毕赤酵母的实验组酒醅疏松、滋润、色泽正常,而未添加毕赤酵母的原位对照组酒醅结块、呈灰白色,有霉变迹象。因此,添加毕赤酵母能显著改善酒醅的发酵状态。
由表3可知,对照组酒醅中的乳酸含量为9.32 g/kg酒醅,乙酸含量为1.61 g/kg酒醅,添加毕赤酵母酒醅中的乳酸含量为3.26 g/kg酒醅,乙酸含量为0.78 g/kg酒醅,乳酸的下降率为64.9%,乙酸下降率为51.3%,与对照组相比,实验组的乳酸和乙酸含量差异极显著(P<0.05)。同时,实验组酒醅中的乙醇含量为17.47 g/kg酒醅,与对照组相比,乙醇增加量约0.5 g/kg酒醅。因此,添加毕赤酵母不仅能降低发酵过程有机酸含量,且对乙醇产量无显著影响。
表3 原位发酵组、PK添加组及乳酸和乙酸下降率
Table 3 The reduction rate of lactic acid and acetic acid in experimental group and control group
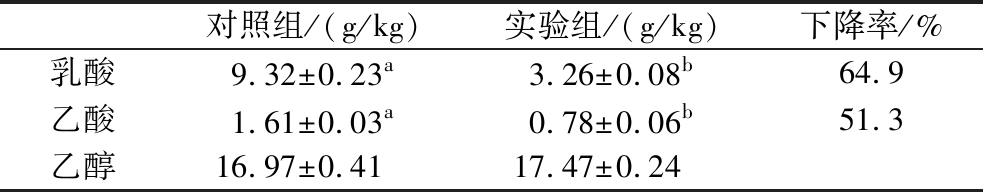
注:同一行中不同的上标表示有极显著性差异(P<0.01)。
对照组/(g/kg)实验组/(g/kg)下降率/%乳酸9.32±0.23a3.26±0.08b64.9乙酸1.61±0.03a0.78±0.06b51.3乙醇16.97±0.4117.47±0.24
通过高通量测序进一步分析发酵酒醅的微生物结构,如图4所示,添加毕赤酵母后的实验组酒醅真菌群落以毕赤酵母(Pichia)、嗜热子囊菌(Thermoascus)、酿酒酵母(Saccharomyces)和嗜热真菌属(Thermomyces)为主,与正常发酵班组酒醅的微生物结构是类似的。而未添加毕赤酵母及原位酒醅的真菌群落则以红曲霉(Monascus)和接合酵母(Zygosaccharomyces)为主。由此可见,在酱香型白酒生产过程中,添加毕赤酵母微生态制剂可以显著抑制丝状真菌的过度繁殖。结合理化指标分析可知,添加毕赤酵母的组别与对照组的乙醇含量无显著性差异,同时可以显著减低乙酸和乳酸的含量,这对于维持白酒发酵菌群结构具有重要意义。

图4 添加毕赤酵母(实验组)、原位酒醅(对照组)酒醅微生物结构分析
Fig.4 Analysis of the microbial structure of experimental group and control group
3 结论与讨论
本研究的毕赤酵母菌株与植物乳杆菌、乳酸片球菌、桥乳杆菌或面包乳杆菌混合发酵,可使混合发酵体系的乳酸含量下降64.0%~94.1%,而毕赤酵母模式菌株ATCC 6258的混合发酵体系乳酸含量仅下降25%~50%,产乳酸抑制效果远低于本研究的菌株。毕赤酵母与同型、异型乳酸菌混合发酵时,产生的乳酸明显低于乳酸菌纯种单独发酵组别,且毕赤酵母接种量越高,乳酸含量越低,毕赤酵母对异型乳酸发酵的产乳酸抑制作用强于同型乳酸发酵。毕赤酵母对发酵体系产乳酸抑制作用的原位验证试验表明,添加毕赤酵母可以显著改善酒醅的发酵状态,降低酒醅中有机酸的含量而不影响乙醇产量,这对于维持白酒发酵酿酒酵母菌群的增殖和稳定白酒产量具有重要意义,但毕赤酵母对发酵体系产乳酸抑制作用的机理尚不清楚,需后续进行更全面的文献查阅,设计相关试验进行更深入的研究。
因此,本研究的毕赤酵母菌株对发酵体系具有较强的产乳酸抑制作用,具备作为生物途径降低发酵乳酸含量微生物菌种的潜力。若通过更大规模的生产试验验证,则可作为降乳酸强化菌剂的菌种资源应用于白酒生产,也为通过主动菌群干预解决白酒酿造过程中乳酸的过度积累导致产酒酵母菌群失调和产酒率低下等行业共性难题提供了研究基础。
[1] 杨帆. 酱香型白酒中乳酸代谢机理及调控策略的研究[D].无锡:江南大学, 2020.
YANG F.Lactic acid metabolic mechanism investigation and control strategy development during Chinese Jiang-flavor liquor making[D].Wuxi:Jiangnan University, 2020.
[2] 张艳. 酱香型白酒发酵中乳酸菌群结构及功能研究[D].无锡:江南大学, 2015.
ZHANG Y.Community structure and function of lactic acid bacteria during Maotai-flavor liquor fermentation[D].Wuxi:Jiangnan University, 2015.
[3] 邓楠. 白酒酿造体系中酵母菌群的乳酸耐受机制解析[D].无锡:江南大学, 2020.
DENG N.Analysis of lactic acid tolerance mechanism of yeasts group in Baijiu fermentation system[D].Wuxi:Jiangnan University, 2020.
[4] 王莉, 陈良强, 杨帆, 等.酱香型白酒耐乳酸酵母的筛选及特性研究[J].中国酿造, 2018, 37(12):28-32.
WANG L, CHEN L Q, YANG F, et al.Screening and characteristics of lactic acid-tolerant yeast from sauce-flavor Baijiu[J].China Brewing, 2018, 37(12):28-32.
[5] YANG F, CHEN L Q, LIU Y F, et al.Identification of microorganisms producing lactic acid during solid-state fermentation of Maotai flavour liquor[J].Journal of the Institute of Brewing, 2019, 125(1):171-177.
[6] 刘明. 浓香型白酒酿造过程中酸类物质的调控[J].酿酒科技, 2014(8):62-64.
LIU M.Regulation and control of acids in the production process of Nongxiang Baijiu(liquor)[J].Liquor-Making Science &Technology, 2014(8):62-64.
[7] LIU Y F, WAN B, YANG F, et al.Metabolomics-driven elucidation of interactions between Saccharomyces cerevisiae and Lactobacillus panis from Chinese Baijiu fermentation microbiome[J].Fermentation, 2022, 8(1):33.
[8] 熊君燕, 李小东, 谢圣凯, 等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报, 2017, 44(8):1767-1776.
XIONG J Y, LI X D, XIE S K, et al.Interaction between lactic acid bacteria and yeasts in light-aroma liquor[J].Microbiology China, 2017, 44(8):1767-1776.
[9] 卫春会, 甄攀, 张兰兰, 等.汾酒酒醅发酵过程中真菌群落的变化规律[J].食品科学, 2021, 42(14):121-128.
WEI C H, ZHEN P, ZHANG L L, et al.Changes in fungal community structure in fermented grains for Fenjiu, a traditional Chinese liquor[J].Food Science, 2021, 42(14):121-128.
[10] 彭俊, 杨团元, 刘蒲临, 等.白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较[J].中国酿造, 2019, 38(8):77-84.
PENG J, YANG T Y, LIU P L, et al.Comparison of diversity of yeast and fermentation characteristic of Issatchenkia orientalis from fermented grains and surrounding soil of Baijiu production[J].China Brewing, 2019, 38(8):77-84.
[11] 郝飞, 吕锡斌, 吴耀领, 等.酱香型白酒酿造酒醅中酵母菌多样性研究[J].菌物学报, 2019, 38(5):620-630.
HAO F, LYU X B, WU Y L, et al.Diversity of yeasts from fermented grain in Maotai liquor fermentation[J].Mycosystema, 2019, 38(5):620-630.
[12] 刘冰, 黄志强, 郑潇, 等.毕赤酵母外源蛋白分泌途径的研究进展[J].微生物学杂志, 2019, 39(4):83-90.
LIU B, HUANG Z Q, ZHENG X, et al.Advances in heterologous protein secretory pathway from Komagataella phaffii[J].Journal of Microbiology, 2019, 39(4):83-90.
[13] ZHANG H X, WANG L, TAN Y W, et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].International Journal of Food Microbiology, 2021, 336:108898.
[14] DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].Journal of Agricultural and Food Chemistry, 2020, 68(17):4903-4911.
[15] 谢玉球, 钟雨, 谢旭, 等.乳酸菌在固态法白酒生产中的地位与作用[J].酿酒科技, 2008(11):83-86.
XIE Y Q, ZHONG Y, XIE X, et al.Roles &functions of lactic acid bacteria in the production of liquor by solid fermentation[J].Liquor-Making Science &Technology, 2008(11):83-86.
[16] SONG Z W, DU H, ZHANG Y, et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Frontiers in Microbiology, 2017, 8:1294.
[17] 张众, 顾沛雯, 张军翔, 等.葡萄酒病害相关酵母的分离与鉴定[J].中国酿造, 2017, 36(10):56-60.
ZHANG Z, GU P W, ZHANG J X, et al.Isolation and identification of yeasts related to wine spoilage[J].China Brewing, 2017, 36(10):56-60.