过敏是全球日益严重的公共问题,据世界过敏组织(World Allergy Organization,WAO)报道,过敏性疾病已成为全球第六大疾病,给全世界30%~40%的人群造成了生活上的困扰。近年来,我国的过敏发病率也在不断升高,估计患病人数超过2亿。对于过敏症状,积极预防和治疗是关键。然而目前治疗过敏最有效的方法之一是严格避免接触过敏源。治疗过敏的药物也存在个体差异性,更不利的是长期使用药物会产生一定副作用。因此,寻找安全的、能够降低患者敏感性的天然抗过敏物质,开发预防性或治疗性干预方法,对于降低过敏发生风险,提高过敏患者生活质量至关重要。
越来越多的证据证明,肠道菌群的健康状态影响宿主的健康状况,并且众多疾病的发生都能从肠道菌群中找到答案[1]。肠道菌群及其代谢物可作为缓解甚至治疗过敏的靶点[2-3]。研究发现过敏儿童的肠道菌群失调、促炎潜力升高、降解纤维能力减弱[4]。然而将碳源从糖类转为色氨酸(tryptophan,Trp),肠道中高度适应性的乳酸杆菌会加速生长并产生芳香烃受体(aryl hydrocarbon receptor,AhR)的配体吲哚-3-乙醛(indole-3-aldehyde, IAId),促进白介素22(interleukin,IL-22)转录[5],针对色氨酸—菌群—芳香烃受体配体—免疫调节这一通路,又发现罗伊氏乳杆菌代谢色氨酸产生吲哚-3-乙酸(indole acetic acid, IAA),促进肠上皮T细胞增殖[6]。一项哮喘小鼠实验表明色氨酸代谢物犬尿氨酸(kynurenine,Kyn)通过调控Th17、Treg比例,有利于形成免疫耐受或者逆转免疫耐受缺陷达到防治哮喘的目的[7]。这明确说明肠道菌群代谢色氨酸产生的某些物质,影响机体免疫平衡,这使菌群代谢饮食中色氨酸改善机体过敏症状成为可能。天然来源的多糖、寡糖等物质具有抗过敏的功能,其能够与过敏原结合,修饰或者包埋过敏表位;调节过敏原的呈递过程,改变T细胞的分化方向;提升肠上皮细胞的紧密连接性或阻碍肥大细胞、嗜碱性粒细胞的脱颗粒现象,减少促炎因子产生[8]。同时多糖可改变肠道微生物组成,影响基于肠道菌群作用下的色氨酸代谢通路。本研究通过体外发酵模型探究多种膳食多糖对菌群的影响,检测粪便中肠道微生物结构组成及色氨酸代谢产物的变化,筛选潜在适合过敏人群的膳食因子。
1 材料与方法
1.1 主要仪器与试剂
PB3002-N型电子天平,梅特勒托多仪器(上海)公司;厌氧工作站400TG,英国Eletrotek公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;高温高压灭菌锅,SANYO公司(日本);高速冷冻离心机,Eppendorf 公司;FE-20精密pH计,梅特勒-托利仪器(上海)有限公司;振荡器,德国IKA集团;Vanquish Q Exactive Plus超高效液相色谱-高分辨质谱联用仪,美国赛默飞世尔科技公司;llumina miseq pe300高通量测序仪,美国llumina公司。
24种膳食多糖(均为可食用型)(表1),西安圣青生物科技术有限公司;硫代乙醇酸钠、酵母提取物、胰蛋白胨、大豆蛋白胨、L-半胱氨酸、牛肉浸膏等,国药集团化学试剂有限公司;![]() 蛋白胨、消化血清粉、牛肝浸出粉、氯化血红素、维生素K,上海创赛科技有限公司;粪便DNA快速提取试剂盒,美国MP biomedicals有限公司;胶回收试剂盒,倍沃医学科技有限公司。犬尿氨酸(kynurenine,KYN)、吲哚-3-乙酸(indole acetic acid,IAA)、吲哚乳酸(indole-3-lactic acid,ILA)、吲哚丙酸(indole-3-propionic acid,IPA)、吲哚-3-甲醛(indole-3-carbaldehyde,I3C)、甲醇(色谱级)、乙腈(色谱级),Sigma-Aldrich公司;异丙酮(色谱级),国药化学试剂有限公司(中国上海);一次性无菌24细胞培养板和医用纱布等其他实验耗材,南通海之星实验器材有限公司。
蛋白胨、消化血清粉、牛肝浸出粉、氯化血红素、维生素K,上海创赛科技有限公司;粪便DNA快速提取试剂盒,美国MP biomedicals有限公司;胶回收试剂盒,倍沃医学科技有限公司。犬尿氨酸(kynurenine,KYN)、吲哚-3-乙酸(indole acetic acid,IAA)、吲哚乳酸(indole-3-lactic acid,ILA)、吲哚丙酸(indole-3-propionic acid,IPA)、吲哚-3-甲醛(indole-3-carbaldehyde,I3C)、甲醇(色谱级)、乙腈(色谱级),Sigma-Aldrich公司;异丙酮(色谱级),国药化学试剂有限公司(中国上海);一次性无菌24细胞培养板和医用纱布等其他实验耗材,南通海之星实验器材有限公司。
表1 膳食多糖分组信息
Table 1 Dietary polysaccharide grouping information
分组多糖分组多糖A灵芝多糖子实体M树舌灵芝多糖B黄芪多糖N大枣多糖C燕麦葡聚糖O猴头菇多糖D灰树花多糖P香菇多糖E蛹虫草多糖子实体Q山药多糖F桑黄多糖R银耳多糖G白桦茸多糖S白耙齿菌多糖H褐藻多糖T牛樟芝多糖I金针菇多糖U木耳多糖J氨基葡聚糖V黄精多糖K枸杞多糖W茯苓多糖L姬松茸多糖Y可溶性淀粉
1.2 体外发酵模型
体外发酵(modified gifu anaerobic broth base medium,mGAM)肉汤基础培养基[9]的配制:1 L的mGAM培养基中分别称取胰蛋白胨5.0 g、大豆蛋白胨3.0 g、![]() 蛋白胨5.0 g、消化血清粉10.0 g、酵母浸膏2.5 g、牛肉浸膏2.2 g、肝脏浸膏1.2 g、可溶性淀粉5.0 g、L-色氨酸0.2 g、L-半胱氨酸0.3 g、硫代乙醇酸钠0.3 g、L-精氨酸1.0 g、维生素K 5 mg、氯化血红素10 mg、KH2PO4 2.5 g、NaCl 3.0 g,加纯净水定容至1 L后于115 ℃灭菌15 min。
蛋白胨5.0 g、消化血清粉10.0 g、酵母浸膏2.5 g、牛肉浸膏2.2 g、肝脏浸膏1.2 g、可溶性淀粉5.0 g、L-色氨酸0.2 g、L-半胱氨酸0.3 g、硫代乙醇酸钠0.3 g、L-精氨酸1.0 g、维生素K 5 mg、氯化血红素10 mg、KH2PO4 2.5 g、NaCl 3.0 g,加纯净水定容至1 L后于115 ℃灭菌15 min。
体外发酵模型参考文献[10-11]的方法并做调整,最终发酵体积2 mL,24孔板加入0.4 mL粪便匀浆液和1.6 mL培养基。将孔板放入厌氧箱[V(N2)∶V(CO2)∶V(H2)=8∶1∶1]中发酵24 h,膳食多糖添加量为0.5%,设置2种不同的对照组(阳性对照采用可溶性淀粉,空白组不添加碳源)。所有膳食多糖平行发酵3次。发酵结束后放于4 ℃冰箱过夜以停止微生物活动。并将发酵液于8 000×g,4 ℃离心10 min,收集上清液于-20 ℃冰箱等待代谢组检测,下部沉淀菌泥等待提取DNA。
1.3 粪便收集及处理
采集7份(年龄在14~25岁,女,无特殊饮食习惯及生活方式不发生变化)新鲜粪便,要求在近6个月未患有便秘、肠炎等消化性疾病以及未长时间服用益生菌等,同时在近3个月内未服用抗生素等药物。所有人群的粪便立即收集于采集管中,并放入厌氧产气袋,尽快进行后续发酵实验。在厌氧工作箱中称取粪便样品重量,按1∶10(体积比)加入灭菌的pH 7.2的磷酸盐缓冲液(phosphate buffer,PBS)稀释粪便,涡旋混匀。
1.4 16S rRNA测序
按试剂盒要求提取发酵后粪便的DNA及其胶回收,即针对微生物rRNA V3~V4区的特异性引物进行PCR扩增。PCR时正向引物5′-CCTAYGGGRBGCASCAG-3′和反向引物5′-GGACTACNNGGGTATCT-AAT-3′。对琼脂糖凝胶电泳后的胶块进行切胶和DNA纯化。在MiSeq PE300 (Illumina)平台测序。菌群测序结果经过合并双端及质控,利用QIIME2(https://view.qiime2.org/)平台分析。利用最新的Silva 16 s rRNA v132数据库对物种进行注释。本研究选取相对丰度在一个样本中至少大于千分之一的属进行分析。基于筛选后的属水平物种丰度表作为原始数据集。产生的代表性序列操作分类单元(operational taxonomic unit,OTU)通过总和缩放进行标准化,采用Mann-Whitney/Kruskal-Wallis检验(非参数)比较两组间α多样性。通过基于Bray-Curtis index的非度量多维尺度分析(non-metric multidimensional scaling, NMDS)计算菌群β多样性,使用相似性分析(analysis of similarities,ANOSIM)进行数据统计,计算显著性。
1.5 色氨酸靶向代谢检测
吸取离心后的发酵上清液至无酶EP管中,加入混合液[V(乙腈)∶V(甲醇)∶V(异丙醇)=8∶1∶1]后置于冰上以沉淀蛋白,随后真空浓缩直至水分蒸发,加入10%甲醇水重悬离心过膜等待上机检测。采用ACQUITY UPLC® BEH C18 1.7 μm (100 mm×2.10 mm)色谱柱,柱温36.5 ℃,自动进样温度为4 ℃。流动相A为乙腈,流动相B为0.1%甲酸水。梯度洗脱时采用先A液再B液洗脱,最后平衡至20 min。
1.6 数据处理
色氨酸代谢物数据分析,使用 GraphPad Prism version 8软件进行统计分析。采用单因素方差分析(one-way variance analysis,ANOVA)比较多组间的差异,然后采用Duncan’s new multiple range检验。结果以平均值±标准误差表示。色氨酸代谢物和菌群属水平的相关指数和P值使用双端检测的spearman计算。当P<0.05时,用*表示;当P<0.01,用**表示;当P<0.001,用***表示,组间差异有统计学意义。
2 结果与分析
2.1 膳食多糖改变肠道菌群α多样性
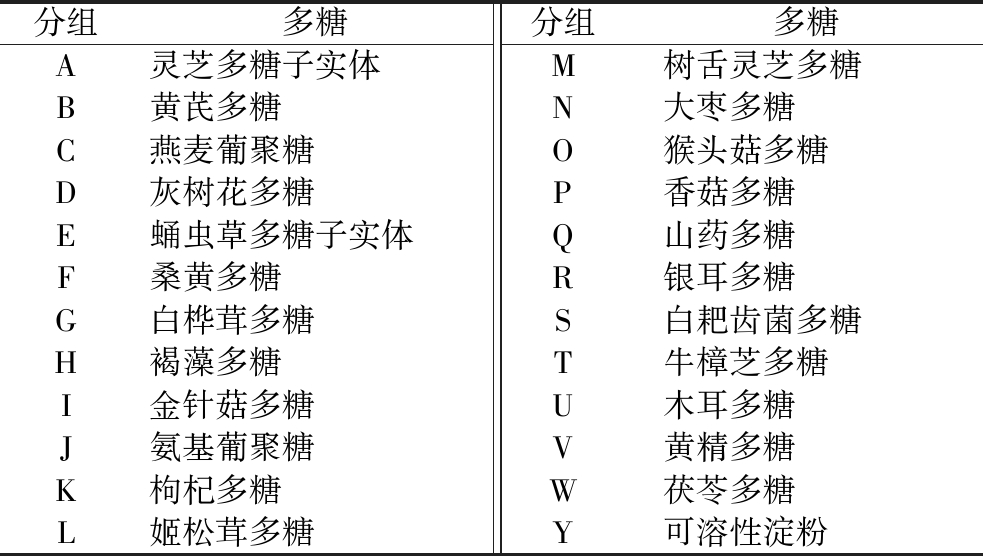
肠道微生物能够通过分泌碳水化合物活性酶(carbohydrate active enzyme,CAZyme)分解多糖[12],而多糖反过来又能增加肠道中的益生菌比例,调节微生物组成,从而维持宿主健康[13]。研究发现,与免疫功能相关的膳食多糖种类集中在菌菇类多糖,除此之外还有药食同源类植物多糖,本研究筛选了24种多糖(表1),探究了其对菌群的调节作用。菌菇的营养保健功能很大程度上归功于其含有的生物活性物质,像灵芝多糖、香菇多糖、牛樟芝多糖、猴头菇多糖等菌菇多糖,是具有药理活性的“活性多糖”,化学结构为三维螺旋状的β型多糖,可激活T、B淋巴细胞、巨噬细胞等,促进细胞因子生成,对免疫系统发挥多方面的调节作用,同时它们被肠道微生物利用,产生短链脂肪酸等有利代谢产物,起到免疫调节作用(相关数据请见增强出版附表1,https://doi.org/10.13995/j.cnki.11-1802/ts.034677)。为了验证这些多糖对人类肠道菌群的调节作用,将其加到人类新鲜粪便中进行体外发酵实验。采用Evenness、Observed OTUs和Shannon三种α多样性指数探究膳食多糖对肠道菌群的丰富度和均匀度的影响。Evenness 指数是最常用的均匀度指数,Observed OTUs指数主要表示某一群落中的物种丰富度,Shannon指数则反映群落中物种的丰富度、均匀度及稳定性。如图1所示,对比加入的可溶性淀粉的对照组,黄芪多糖、褐藻多糖、大枣多糖、山药多糖、银耳多糖、牛樟芝多糖和黄精多糖显著提升Evenness指数(P<0.05),姬松茸多糖、树舌灵芝多糖、猴头菇多糖、香菇多糖、山药多糖、白耙齿菌多糖、木耳多糖和黄精多糖显著提升Observed_OTUs指数(P<0.05),大枣多糖、牛樟芝多糖和黄精多糖显著提升Shannon指数(P<0.05)。表明大枣多糖、牛樟芝多糖、黄精多糖显著提高了肠道微生物的丰富度和均匀度,改善肠道菌群组成,而其他多糖对菌群多样性调节不显著。
a-Evenness;b-Observed_OTUs;c-Shannon
图1 膳食多糖对肠道菌群α多样性的影响
Fig.1 Effects of dietary polysaccharides on genus level of gut microbiota
注:横轴字母对应于表1中相应多糖名称(以下各图与此相同)。与可溶性淀粉组比较采用“▲”,当P<0.05时,用“▲”表示;当P<0.01,用“▲▲”表示,组间差异有统计学意义(下同)。
2.2 膳食多糖改变肠道菌群β多样性
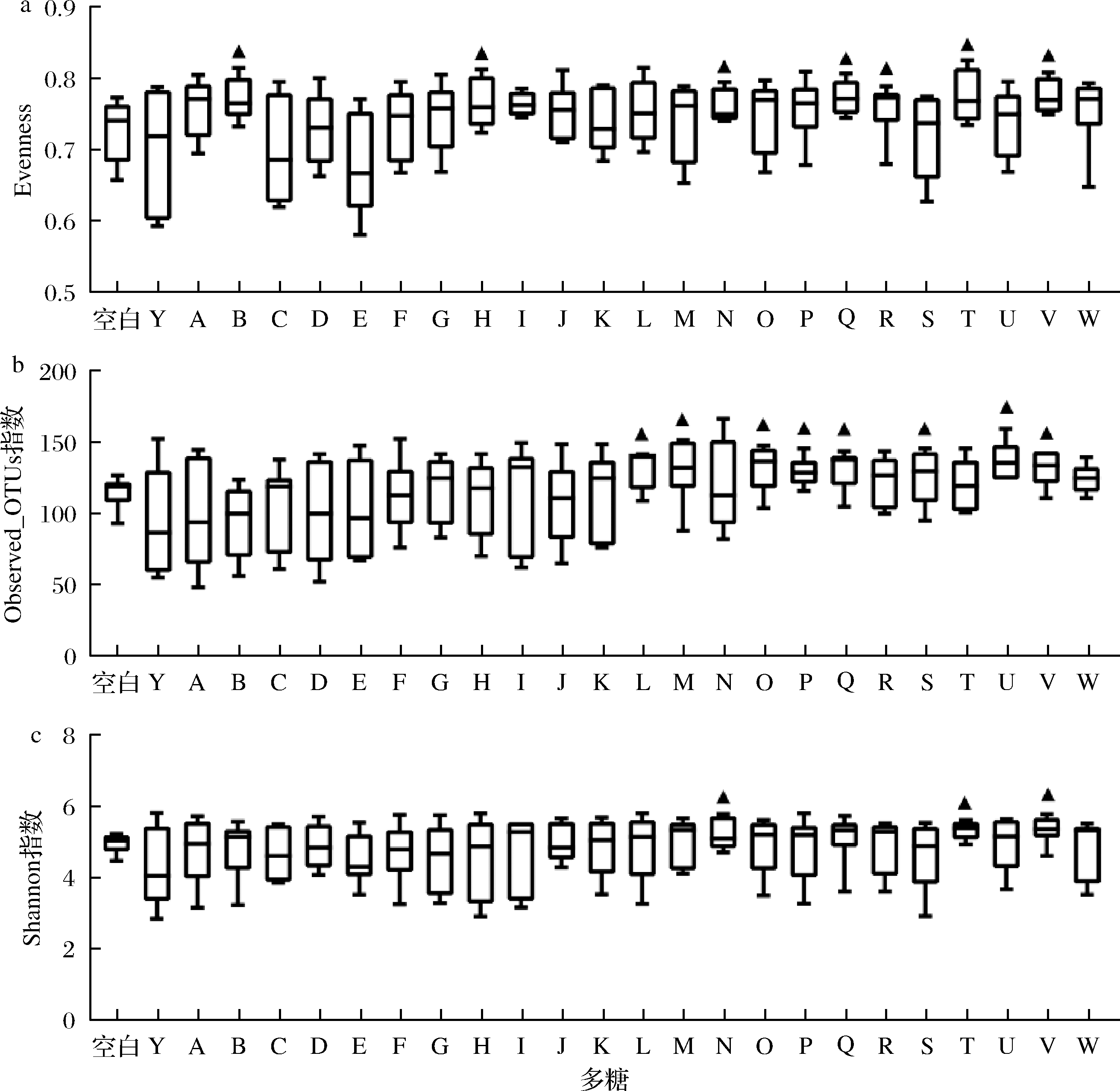
基于Bray-Curtis相似性的NMDS对膳食多糖发酵后肠道菌群的整体结构进行分析,不同的膳食多糖对菌群整体组成结构影响不同。NMDS结果的评估标准是Stress值,为样品在降维后形成的空间距离与其在原始多维空间距离的差值,越小越好,说明在低维空间更完整地捕获了高维空间的信息。通过比较2个群落微生物组成上的差异,发现灵芝多糖、蛹虫草多糖、褐藻多糖、金针菇多糖和茯苓多糖的Stress值<0.2,显著改变菌群β多样性(P<0.05)(表2,图2)。肠道中的共生菌能利用多糖,同时多糖含量及化学组成的变化也影响着肠道微生物,他们共同塑造了一个动态的、变化的肠道环境。灵芝多糖对特异性免疫和非特异性免疫都有一定作用,并且研究人员证实灵芝多糖及其水解物可以改善菌群结构及其代谢产物,从而增强肠黏膜免疫[14]。褐藻多糖在体内、体外实验中都不被消化酶降解,其可作为肠道菌群的碳源,通过调节肠道菌群,产生短链脂肪酸,直接与免疫细胞toll样受体作用并产生黏蛋白增强免疫应答[15]。喂食灵芝多糖及茯苓多糖后,降低小鼠肠道菌群OTU多样性并显著重塑肠道菌群的组成,粪便中可抗肥胖、产短链脂肪酸、降解多糖/木聚糖、产生乳酸的细菌的丰度显著增加[16]。
a-灵芝多糖;b-黄芪多糖;c-蛹虫草多糖;d-白桦茸多糖;e-褐藻多糖;f-金针菇多糖;g-猴头菇多糖;h-茯苓多糖
图2 膳食多糖对菌群β多样性的影响
Fig.2 Effects of dietary polysaccharides on the β-diversity of microbiota
表2 膳食多糖发酵后菌群结构差异值
Table 2 The difference of microbiota structure between the feces fermented by dietary polysaccharides

注:表中和空白组比较用*表示,*表示P<0.05,**表示P<0.01,NS表示没有显著性差异。
多糖Stress值R值P值多糖Stress值R值P值可溶性淀粉0.1220.1110.15NS姬松茸多糖0.0970.056 40.20NS灵芝多糖子实体0.1460.1520.05∗树舌灵芝多糖0.1210.0030.44NS黄芪多糖0.1580.1520.08NS大枣多糖0.1110.0750.21NS燕麦葡聚糖0.0810.0130.42NS猴头菇多糖0.1300.1250.09NS灰树花多糖0.1300.0900.148NS香菇多糖0.1080.1110.10NS蛹虫草多糖子实体0.0870.1710.05∗山药多糖0.1280.014 60.38NS桑黄多糖0.1420.0340.08NS银耳多糖0.1360.0830.18NS白桦茸多糖0.1200.1260.08NS白耙齿菌多糖0.0860.0460.28NS褐藻多糖0.1000.1600.05∗牛樟芝多糖0.1110.0300.31NS金针菇多糖0.1380.1420.05∗木耳多糖0.1170.1060.07NS氨基葡聚糖0.1350.0840.20NS黄精多糖0.1270.0680.22NS枸杞多糖0.1390.0690.19NS茯苓多糖0.1320.1750.038∗
2.3 膳食多糖影响肠道菌群物种组成
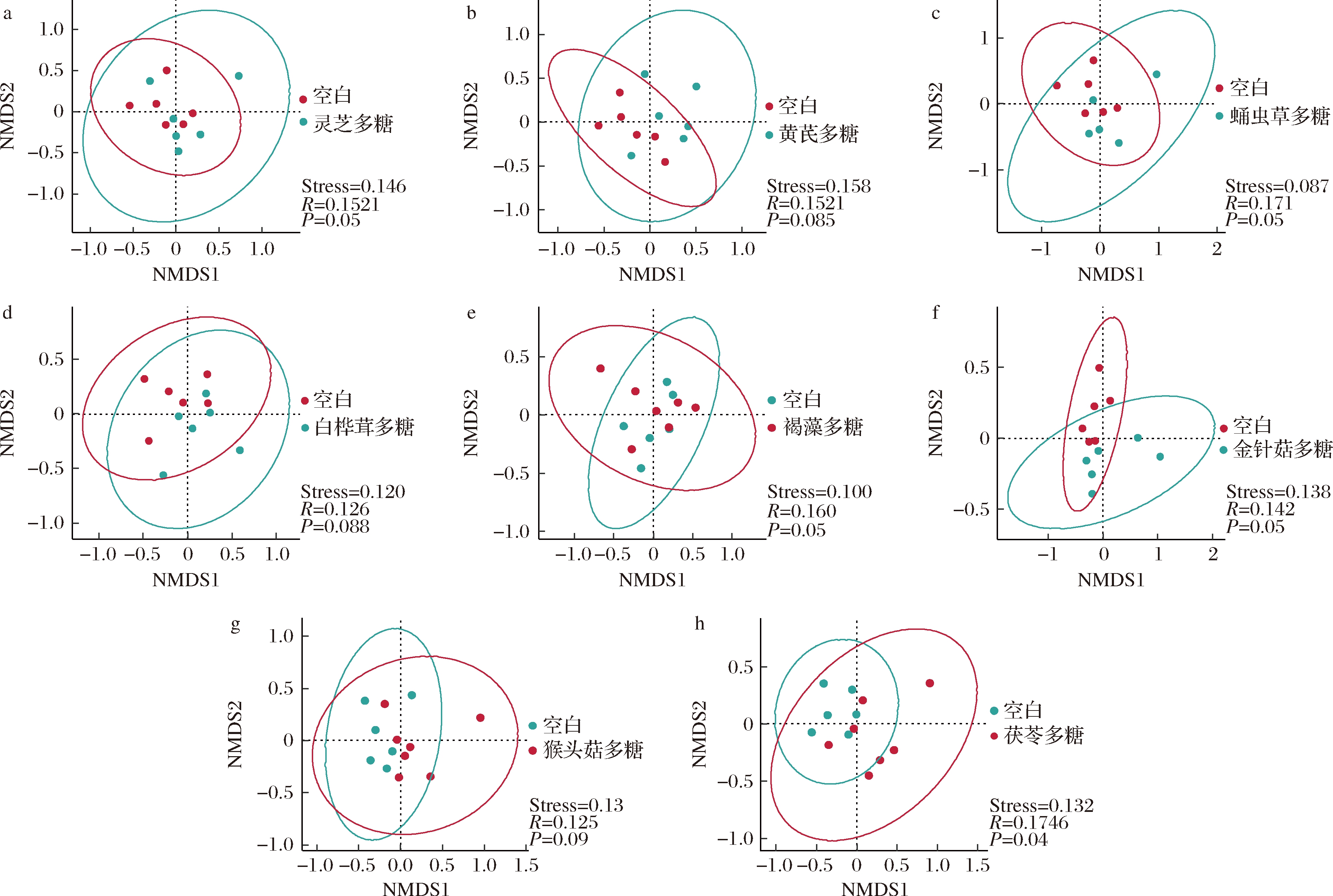
对膳食多糖干预后的肠道菌群门、属水平进行物种组成分析,计算厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的比值(F/B)。在门水平上,肠道菌群主要是由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)构成(图3)。对比空白组,灰树花多糖、金针菇多糖和猴头菇多糖可显著提高F/B值(P<0.05,图4)。从属水平上发现灵芝多糖、黄芪多糖、蛹虫草多糖、白桦茸多糖、褐藻多糖、金针菇多糖、猴头菇多糖和茯苓多糖的摄入促进Lactobacillus和Bifidobacterium的相对丰度(图5)。研究表明调节整体肠道菌群结构组成的灵芝多糖不仅可以减少胰岛素抵抗,逆转高脂饮食诱导的小鼠肥胖、高脂血症、脂肪积累等,还改善小鼠的肠道屏障功能,更为重要的是Lactobacillus在小鼠肠道内得到富集[17]。最近研究表明,白桦茸抗病毒和消炎的作用非常显著,在体外或许能够抑制RNA和DNA病毒。该研究强调了白桦茸具有强大的酶系统和防御系统,被证明可以抑制与 COVID-19 相关的促炎细胞因子,并帮助防止“细胞因子风暴”压倒免疫系统[18],这是因为从白桦茸子实体中提取的多糖是一种关键的免疫调节活性物质和信号分子,有助于支持免疫系统的恢复。金针菇多糖促进小鼠拟杆菌门丰度,降低结肠中的致病菌[19],对于免疫系统,其抑制了造模引起的血清IgA、IL-6、TNF-α升高,并且促进了抗炎因子IL-10产生[20]。
图3 肠道菌群的门水平组成
Fig.3 The composition of the gut microbiota at the phylum level
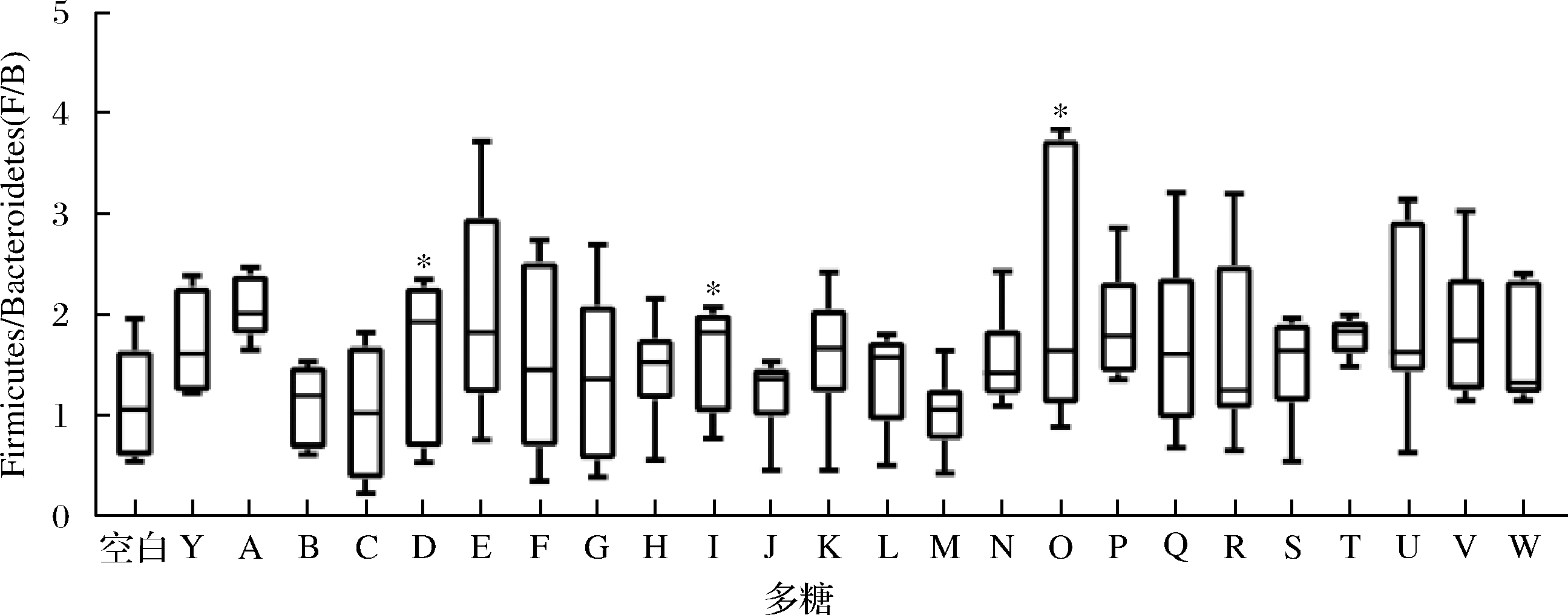
图4 肠道菌群的F/B值
Fig.4 The Firmicutes/Bacteroidetes ration
注:与空白组比较采用“*”,当P<0.05时,用“*”表示;当P<0.01,用“**”表示,当P<0.001,用“***”表示,组间差异有统计学意义(下同)。
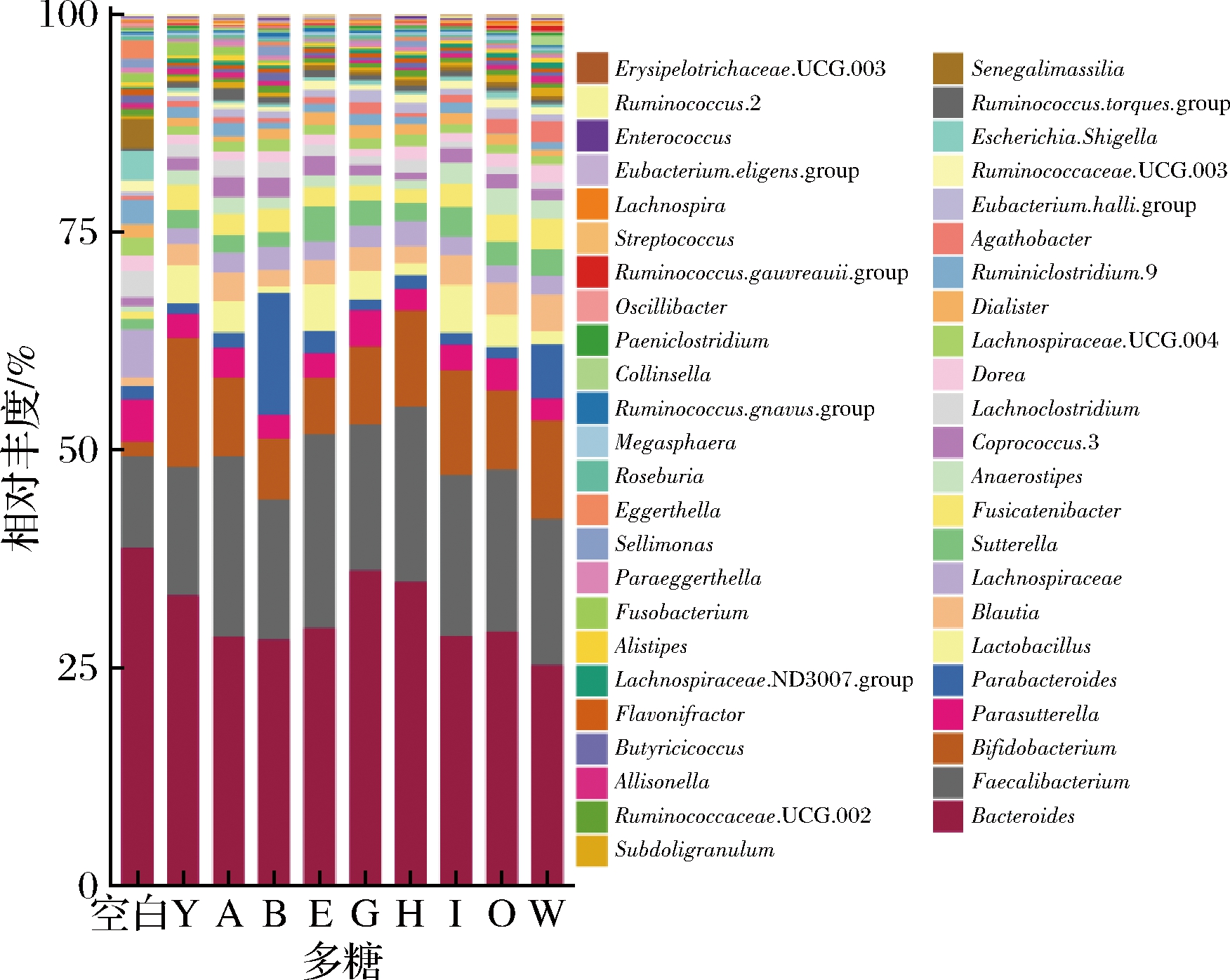
图5 膳食多糖对肠道菌群属水平组成的影响
Fig.5 The composition of the gut microbiota at the genus level
2.4 膳食多糖改变肠道菌群色氨酸代谢
多种色氨酸代谢物是有利于机体的小分子物质,其已被证实有与细胞因子表达相关的抗炎作用,促进Th1细胞的免疫反应,抑制Th2细胞免疫反应的发展和过敏抗体(IgE)产生,从机制上缓解过敏反应。通过粪便发酵液的靶向代谢组学检测色氨酸代谢物,发现前述显著改变肠道菌群β多样性的灵芝多糖、蛹虫草多糖、褐藻多糖、金针菇多糖和茯苓多糖不能增加粪便中色氨酸代谢物KYN、IPA和IAA的含量(图6-a~图6-c),但ILA和I3C含量增加(图6-d,图6-e),尤其是褐藻多糖和茯苓多糖。事实证明,增加肠道多糖的可用性可以促进微生物色氨酸降解,从而导致大肠和血清中色氨酸及其代谢物水平的改变[20-21],影响体内循环色氨酸。据报道ILA在双歧杆菌占优势的婴儿粪便中浓度很高[22],另一项研究证实双歧杆菌表达的人乳寡糖(human milk oligosaccharides,HMOs)代谢基因激活了色氨酸代谢通路,增加ILA,维护肠道及外周免疫系统稳态,抑制过度免疫反应的发生从而减少母乳喂养婴儿的肠道炎症[18]。本研究通过菌群和色氨酸代谢物关联分析,同样发现ILA与Lactobacillus和Bifidobacterium呈正相关(图7)。由此可见,肠道微生物可利用诸如褐藻多糖、茯苓多糖等物质产生有利的代谢产物,以此达到改善机体免疫促进健康的作用。
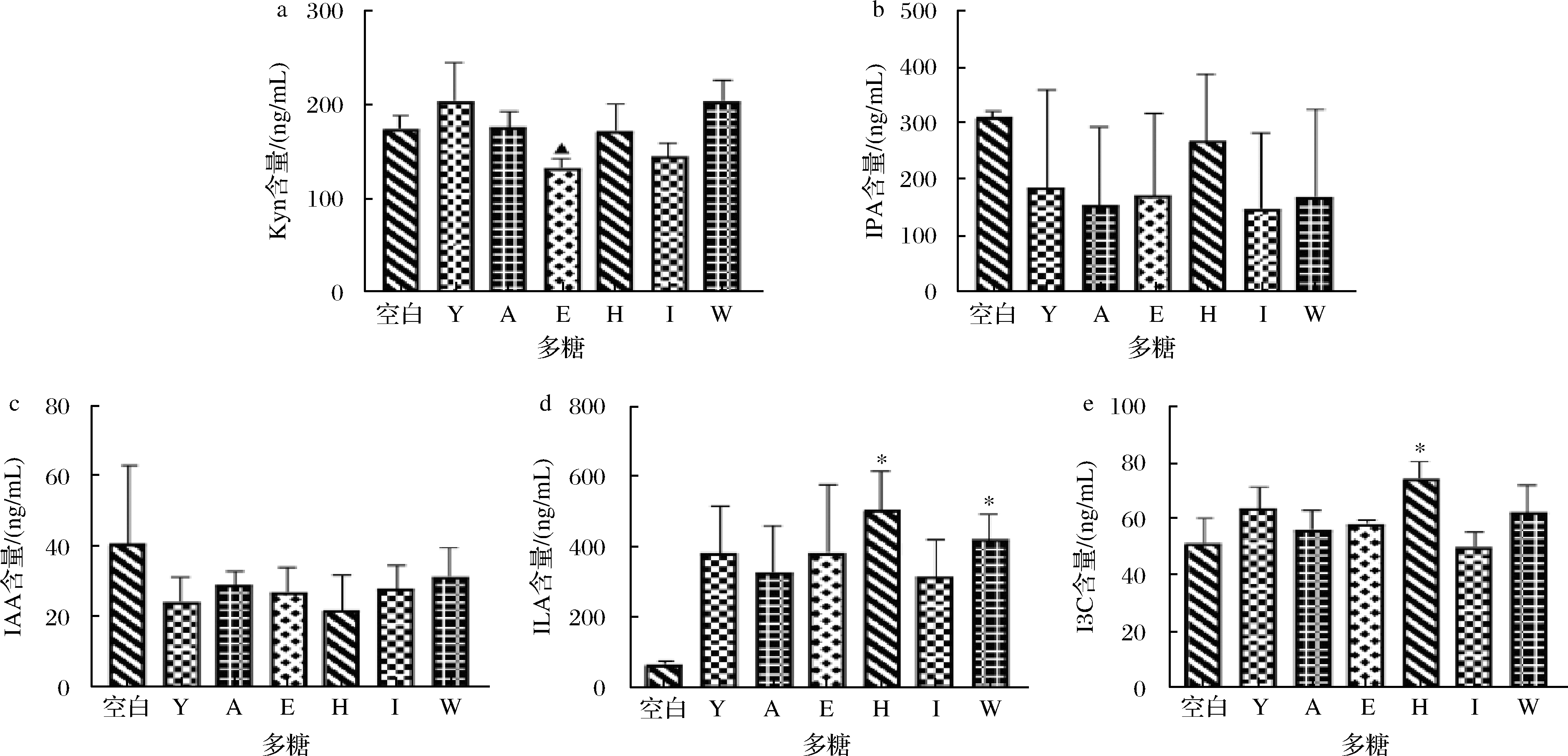
a-犬尿氨酸(Kyn);b-吲哚丙酸(IPA);c-吲哚-3-乙酸(IAA);d-吲哚乳酸(ILA);e-吲哚-3-甲醛(I3C)
图6 膳食多糖对肠道菌群色氨酸代谢物的调节
Fig.6 Regulation of dietary polysaccharides on tryptophan metabolites in gut microbiota
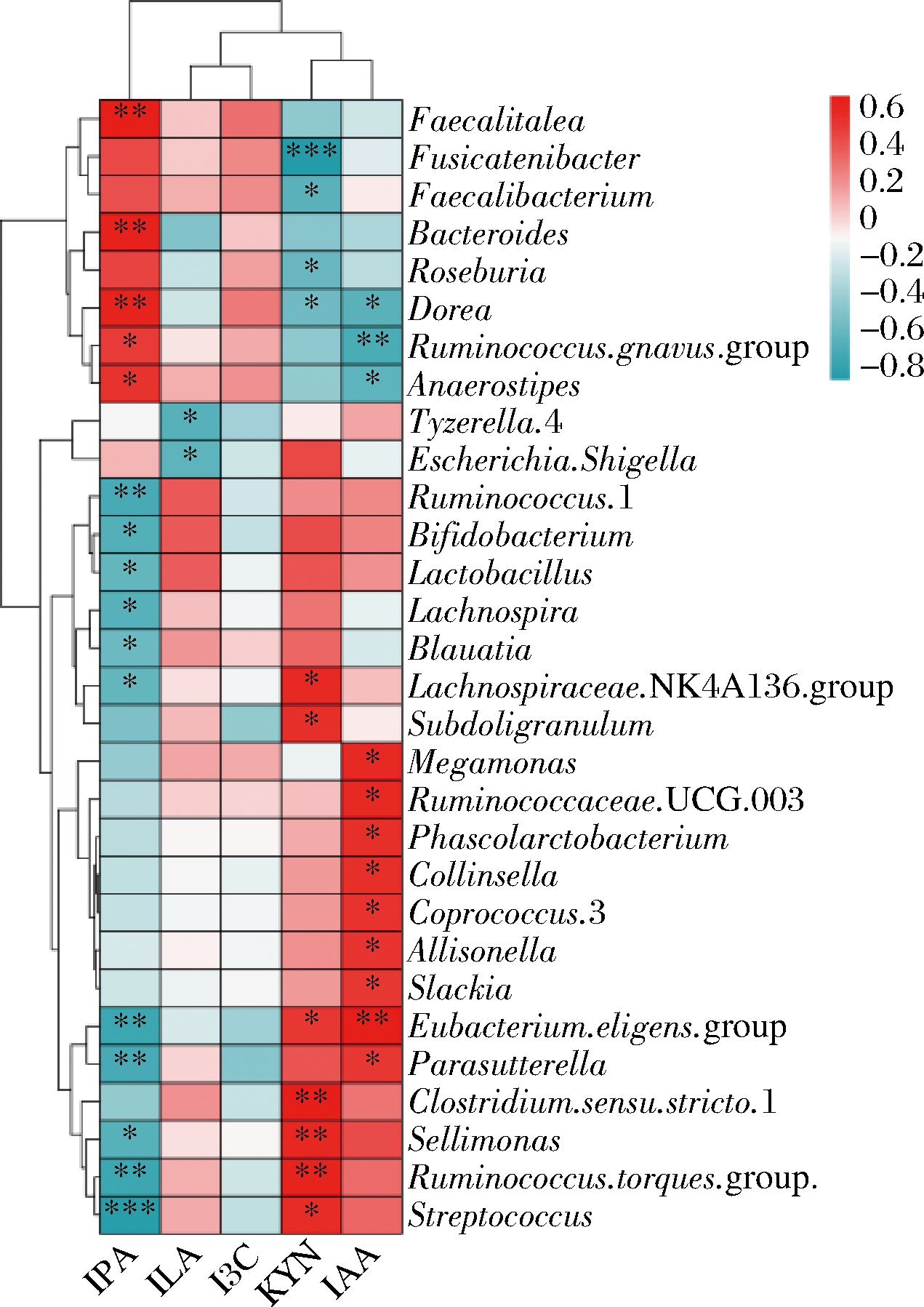
图7 肠道菌群与色氨酸代谢物的相关性分析
Fig.7 Correlation analysis between the gut microbiota and tryptophan metabolites
3 结论与讨论
全球范围内过敏发生率逐年增加,某些过敏性疾病已成为人们日益关注的公共卫生问题,这给社会、家庭和个人带来了严重负担。随着人们对过敏的发生发展研究的加深,发现肠道微生物在过敏中的作用不可忽视,多项研究也探讨了肠道微生物群落与过敏性疾病之间的联系,确定了不同过敏症的微生物特征,尽管结论不能够统一[23],但它们确定了过敏人群的α多样性指数(Chao1和Shannon)低于正常人群,过敏患者色氨酸代谢能力下降及代谢物含量降低[24]。
本研究发现在体外发酵模型中,膳食多糖不仅改变粪便菌群也促进了色氨酸代谢过程,这为改善过敏体质及开发适合过敏人群功能食品提供了基础数据。肠道微生物显著变化尤其是Lactobacillus和Bifidobacterium相对丰度增加,在褐藻多糖和茯苓多糖干预下菌群色氨酸代谢能力强,ILA、I3C含量增加。此外ILA与粪便中Lactobacillus和Bifidobacterium呈正相关。据报道,Lactobacillus和Bifidobacterium能够缓解食物过敏性腹泻或其他过敏症状[25-26],例如长双歧杆菌、短双歧杆菌能够在结肠中产生I3C和ILA,激活AhR介导的免疫反应[24,27]。由此看来褐藻多糖和茯苓多糖或许可以通过调节肠道菌群,增加Lactobacillus和Bifidobacterium丰度进而改善色氨酸代谢过程,提高ILA和I3C含量,从而改善机体过敏症状。膳食多糖到达人体结肠并被肠道菌群发酵利用,从而可能通过依赖菌群的机制影响肠道健康,后续需进行膳食多糖在口腔及胃肠道的连续消化环节,除此之外还需关注粪便菌群发酵后的多糖结构组成变化及除色氨酸代谢物以外的其他菌群代谢物含量变化,同时体外发酵实验结果并不能完全代表人们食用膳食多糖的体内情况,还需进一步开展动物实验或者人群实验验证该2种多糖物质对过敏的作用。
[1] WILMES P, MARTIN-GALLAUSIAUX C, OSTASZEWSKI M, et al.The gut microbiome molecular complex in human health and disease[J].Cell Host Microbe, 2022, 30(9):1201-1206.
[2] BUNYAVANICH S.Food allergy:Could the gut microbiota hold the key?[J].Nature Reviews Gastroenterology &Hepatology, 2019, 16(4):201-202.
[3] ARIFUZZAMAN M, WON T H, LI T T, et al.Inulin fibre promotes microbiota-derived bile acids and type 2 inflammation[J].Nature, 2022, 611(7936):578-584.
[4] DE FILIPPIS F, PAPARO L, NOCERINO R, et al.Specific gut microbiome signatures and the associated pro-inflamatory functions are linked to pediatric allergy and acquisition of immune tolerance[J].Nature Communications, 2021, 12:5958.
[5] ZELANTE T, IANNITTI R G, CUNHA C, et al.Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22[J].Immunity, 2013, 39(2):372-385.
[6] CERVANTES-BARRAGAN L, CHAI J N, TIANERO M D, et al.Lactobacillus reuteri induces gut intraepithelial CD4(+)CD8αα(+) T cells[J].Science, 2017, 357(6353):806-810.
[7] 范文婷, 钟世民, 胡琦, 等.色氨酸代谢物调控Th17/Treg分化在小鼠哮喘变应原特异性免疫治疗中的作用及机制研究[J].第三军医大学学报, 2018, 40(8):658-665.
FAN W T, ZHONG S M, HU Q, et al.Tryptophan metabolites regulate Th17/Treg differentiation to alleviate airway inflammation in asthmatic mice receiving allergen-specific immunotherapy[J].Journal of Third Military Medical University, 2018, 40(8):658-665.
[8] YANG T A, LI C, XUE W T, et al.Natural immunomodulating substances used for alleviating food allergy[J].Critical Reviews in Food Science and Nutrition, 2023, 63(15):2407-2425.
[9] TRAMONTANO M, ANDREJEV S, PRUTEANU M, et al.Nutritional preferences of human gut bacteria reveal their metabolic idiosyncrasies[J].Nature Microbiology, 2018, 3(4):514-522.
[10] PÉREZ-BURILLO S, MOLINO S, NAVAJAS-PORRAS B, et al.An in vitro batch fermentation protocol for studying the contribution of food to gut microbiota composition and functionality[J].Nature Protocols, 2021, 16(7):3186-3209.
[11] LIU Y T, LI Y W, KE Y, et al.In vitro saliva-gastrointestinal digestion and fecal fermentation of Oudemansiella radicata polysaccharides reveal its digestion profile and effect on the modulation of the gut microbiota[J].Carbohydrate Polymers, 2021, 251:117041.
[12] ZHU W, ZHOU S X, LIU J H, et al.Prebiotic, immuno-stimulating and gut microbiota-modulating effects of Lycium barbarum polysaccharide[J].Biomedicine &Pharmacotherapy, 2020, 121:109591.
[13] 刘昭曦, 王禄山, 陈敏.肠道菌群多糖利用及代谢[J].微生物学报, 2021, 61(7):1816-1828.
LIU Z X, WANG L S, CHEN M.Glycan utilization and metabolism by gut microbiota[J].Acta Microbiologica Sinica, 2021, 61(7):1816-1828.
[14] GUO C L, GUO D D, FANG L, et al.Ganoderma lucidum polysaccharide modulates gut microbiota and immune cell function to inhibit inflammation and tumorigenesis in colon[J].Carbohydrate Polymers, 2021, 267:118231.
[15] OKOLIE C L, C K RAJENDRAN S R, UDENIGWE C C, et al.Prospects of brown seaweed polysaccharides (BSP) as prebiotics and potential immunomodulators[J].Journal of Food Biochemistry, 2017, 41(5):e12392.
[16] KHAN I, HUANG G X, LI X A, et al.Mushroom polysaccharides from Ganoderma lucidum and Poria cocos reveal prebiotic functions[J].Journal of Functional Foods, 2018, 41:191-201.
[17] SANG T T, GUO C J, GUO D D, et al.Suppression of obesity and inflammation by polysaccharide from sporoderm-broken spore of Ganoderma lucidum via gut microbiota regulation[J].Carbohydrate Polymers, 2021, 256:117594.
[18] SHAHZAD F, ANDERSON D, NAJAFZADEH M.The antiviral, anti-inflammatory effects of natural medicinal herbs and mushrooms and SARS-CoV-2 infection[J].Nutrients, 2020, 12(9):2573.
[19] HAO Y T, LIAO X S, WANG X D, et al.The biological regulatory activities of Flammulina velutipes polysaccharide in mice intestinal microbiota, immune repertoire and heart transcriptome[J].International Journal of Biological Macromolecules, 2021, 185:582-591.
[20] SUN P H, WANG M L, LI Z N, et al.Eucommiae cortex polysaccharides mitigate obesogenic diet-induced cognitive and social dysfunction via modulation of gut microbiota and tryptophan metabolism[J].Theranostics, 2022, 12(8):3637-3655.
[21] HUANG J M, LIU D, WANG Y W, et al.Ginseng polysaccharides alter the gut microbiota and kynurenine/tryptophan ratio, potentiating the antitumour effect of antiprogrammed cell death 1/programmed cell death ligand 1 (anti-PD-1/PD-L1) immunotherapy[J].Gut, 2022, 71(4):734-745.
[22] SU A X, YANG W J, ZHAO L Y, et al.Flammulina velutipes polysaccharides improve scopolamine-induced learning and memory impairment in mice by modulating gut microbiota composition[J].Food &Function, 2018, 9(3):1424-1432.
[23] LEE K H, SONG Y, WU W D, et al.The gut microbiota, environmental factors, and links to the development of food allergy[J].Clinical and Molecular Allergy, 2020, 18(1):1-11.
[24] CASON C A, DOLAN K T, SHARMA G, et al.Plasma microbiome-modulated indole- and phenyl-derived metabolites associate with advanced atherosclerosis and postoperative outcomes[J].Journal of Vascular Surgery, 2018, 68(5):1552-1562.
[25] 亓学海. 游离氨基酸配方粉联合双歧杆菌四联活菌治疗婴儿牛奶蛋白过敏性腹泻的效果[J].中国妇幼保健, 2021, 36(24):5716-5718.
QI X H.Effect of free amino acid formula powder combined with tetraviable bifidobacterium on infantile milk protein allergic diarrhea[J].Maternal and Child Health Care of China, 2021, 36(24):5716-5718.
[26] 鄢梦洁, 朱磊磊, 郭润晴, 等.嗜酸乳杆菌La28和植物乳杆菌LP45对过敏小鼠的干预作用[J].微生物学报, 2022, 62(3):797-805.
YAN M J, ZHU L L, GUO R Q, et al.Anti-allergic effects of Lactobacillus acidophilus La28 and L.plantoplantum LP45 in mice[J].Acta Microbiologica Sinica, 2022, 62(3):797-805.
[27] LAURSEN M F, SAKANAKA M, VON BURG N, et al.Bifidobacterium species associated with breastfeeding produce aromatic lactic acids in the infant gut[J].Nature Microbiology, 2021, 6(11):1367-1382.