泡菜加工作为一种传统蔬菜深加工方式,在延长蔬菜产业链、增加蔬菜产品附加值方面具有重要作用[1]。然而,泡菜行业目前同质化竞争严重,难以突出产品特色。因此,根据不同需求使用不同品种蔬菜原料进行发酵,从而突出泡菜的特色风味和丰富的益生功能性尤为重要。芥菜(Brassica juncea Coss)是十字花科,芸薹属一年生或两年生草本植物,栽培面积广,是中国重要的农业经济作物[2]。相比其他区域,四川地区芥菜的分化程度最高,变种和品种数量最多,共分为根、茎、叶、薹等16个变种[3]。除了常用于鲜食外,芥菜的发酵加工也十分盛行,如生产中常用叶用芥菜中的宽柄芥发酵制作酸菜,茎用芥菜中的茎瘤芥用来发酵生产榨菜。另外,各类芥菜均可用于家庭泡菜的制作,是四川泡菜原料中重要的组成部分。
芥菜具有丰富的营养物质,如抗坏血酸、β-胡萝卜素、多酚类化合物以及钾、钙、铁等矿物质[4],除此之外还富含一类重要的次生代谢产物——硫代葡萄糖苷(glucosinolates,GSL)。GSL性质较稳定,难以被人体直接吸收利用,经酶解或微生物代谢转化后产生异硫氰酸盐、硫氰酸酯和腈类等水解产物,并产生特有的风味[5-6]。其中异硫氰酸酯类物质是重要的生物活性物质,具有抑菌、抗氧化、抗癌、缓解肥胖等功效[7-8]。基于不同的芥菜品种,前人针对其不同采后品质性状、GSL组成与含量差异、发酵加工感官风味差异等方面已有一定研究[9-11]。但在不同芥菜变种的发酵加工方面,由于其硫苷种类和含量不同,水解产物的功能特性对发酵过程的影响结果尚不明确,且基于硫苷代谢产物来评估不同芥菜变种的发酵加工性差异相关的研究尚未见报道。
本研究使用6种不同变种芥菜进行发酵,对发酵初始和发酵终止期样品的微生物数量、理化指标、有机酸含量以及挥发性化合物中的硫苷代谢产物进行测定,并且通过相关性分析不同变种芥菜发酵差异性,进而评估不同芥菜变种的发酵加工特性差异,以期为筛选具有更好发酵加工特性的芥菜品种与变种提供一定的科学依据和理论基础。
1 材料与方法
1.1 材料与试剂
基于前期对16个芥菜变种发酵预实验及芥菜变种发酵后嗅闻感官评价的差异化结果,本实验采用6个不同芥菜变种为原材料,分为叶芥和茎芥两大类,均由四川省农业科学院园艺所提供(图1),所有材料统一种植于四川省成都市新都区四川省农业科学院新都试验基地。泡菜盐、矿泉水,成都生鲜超市;MRS培养基、孟加拉红培养基,青岛海博生物技术有限公司;对氨基苯磺酸、盐酸萘乙二胺、NaNO2、NaOH标液,成都科隆试剂有限公司;乙酸锌、亚铁氰化钾、硼砂,成都金山试剂有限公司,所有试剂均为分析纯。

a-叶芥类-长柄芥;b-叶芥类-凤尾芥;c-叶芥类-宽柄芥;d-茎芥类-笋子芥;e-茎芥类-抱子芥;f-茎芥类-茎瘤芥
图1 供试芥菜变种信息
Fig.1 Varieties information of mustards
1.2 仪器与设备
Synergy HTX多功能型酶标仪,美国Bio Tek有限公司;Intuvo9000-GC System-5977b气质联用色谱仪、1260液相色谱仪,美国Agilent公司;JA5003型电子天平,上海佑科仪器仪表有限公司;Seven Compact S210型pH计,梅特勒-托利多仪器(上海)有限公司;SPME萃取纤维,50/30 μm DVB/CAR/PDMS,美国Supelco公司。
1.3 实验方法
1.3.1 泡芥菜准备
将6个不同变种的芥菜洗净,切除根部。为了芥菜整体发酵均匀,将可食用部位搅打为匀浆。准备盐度6%(质量分数,下同)的发酵盐水18瓶,各500 mL,将芥菜匀浆与发酵盐水混合置于丝口瓶中密封,25 ℃恒温发酵30 d,蔬菜与盐水的质量比为1∶2,使最终发酵混合体系的盐度在4%左右。在发酵0和30 d取样,每次取3瓶样品作为重复,微生物指标于取样当天测定,剩余样品存放于-80 ℃冰箱中进行后续指标的测定。
1.3.2 微生物计数
于无菌条件下取不同芥菜变种发酵样品50 g于均质袋中,加入450 g无菌生理盐水进行均质,梯度稀释后进行微生物计数。参考GB 4789.2—2022 《食品安全国家标准 食品微生物学检验 菌落总数测定》进行细菌总数的测定;参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》进行酵母菌数的测定。
1.3.3 理化指标检测
取5.0 g不同发酵时间和不同变种的泡芥菜样品加入45 mL蒸馏水,采用pH计测定样品pH值。泡芥菜前处理参考ZHAO等[12]的方法进行,前处理后取上清液进行理化指标的测定。样品可滴定酸含量采用酸碱中和滴定法进行测定[13];还原糖含量采用二硝基水杨酸法测定[14];参考GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中分光光度法测定样品中亚硝酸盐。
1.3.4 有机酸测定
样品前处理参考ZHAO等[12]的方法,样品提取液通过离心机10 000 r/min常温离心10 min后,上清液通过0.22 μm滤膜过滤,用于后续进行HPLC分析。采用美国Bio-Rad有机酸分析柱(Aminex HPX-87H,300 mm×7.8 mm)分离有机酸,柱温35 ℃,进样量5 μL,流速0.6 mL/min,检测波长为215 nm。流动相为0.004 mol/L H2SO4溶液,柠檬酸、苹果酸、琥珀酸、乳酸和乙酸均以相应标准品作为定量外标。
1.3.5 硫苷代谢产物测定
由于硫苷类代谢物的挥发性较强,主要使用顶空固相微萃取气相色谱质谱联用技术(headspace solid-phase microextraction gas chromatography-mass spectrometry,HS-SPME-GC-MS)进行指标测定。取不同发酵时间和不同变种的泡芥菜样品5.0 g置于20 mL的顶空进样瓶中用于GC-MS分析,GC-MS条件设定参考文献[15],测定结果经NIST17.L谱库检索,其中匹配度大于750的物质进一步进行定性分析,从检测出的所有挥发性物质中找出所有硫苷代谢物,以面积归一化法计算其相对含量。
1.4 数据处理与统计分析
采用SPSS 26.0对数据进行方差分析、多重比较(Duncan分析法,P<0.05);主成分分析(principal component analysis,PCA)以及偏最小二乘回归分析(partial least squares discriminant analysis,PLS-DA)采用SIMCA 14.1,柱状图及相关性分析热图均使用Origin 2021绘制。
2 结果与分析
2.1 不同芥菜变种发酵微生物含量差异分析
为明确不同芥菜变种在发酵中微生物的含量差异,对发酵0和30 d不同样品中的细菌和酵母菌进行计数。初始微生物计数方面,6个变种的酵母菌数量均高于细菌(表1)。随着发酵的进行,不同样品中细菌含量增加,酵母菌含量除J2样品外均低于发酵0 d,与前人研究一致[16-17]。其中,细菌的增加量为1.22~3.5 lg CFU/g,酵母菌的减少量也在1.8~4.6 lg CFU/g,叶芥中Y1的细菌增长量最高,茎芥中J1的细菌增长量最高,但其酵母菌含量在发酵30 d时几乎没有差异。J3在发酵终止时细菌含量最高,达到4.11 lg CFU/g。以上结果表明不同变种芥菜间发酵程度具有较大差异。这可能是由于不同变种芥菜中含有的硫苷及其代谢物、植物组织结构和内生初始微生物等的差异限制了Y3、J2样品在发酵过程中微生物的生长代谢[18-19]。
表1 不同芥菜变种发酵0 d和30 d微生物计数差异 单位:lg CFU/g
Table 1 Microbial counts of different mustard varieties fermented at 0 d and 30 d
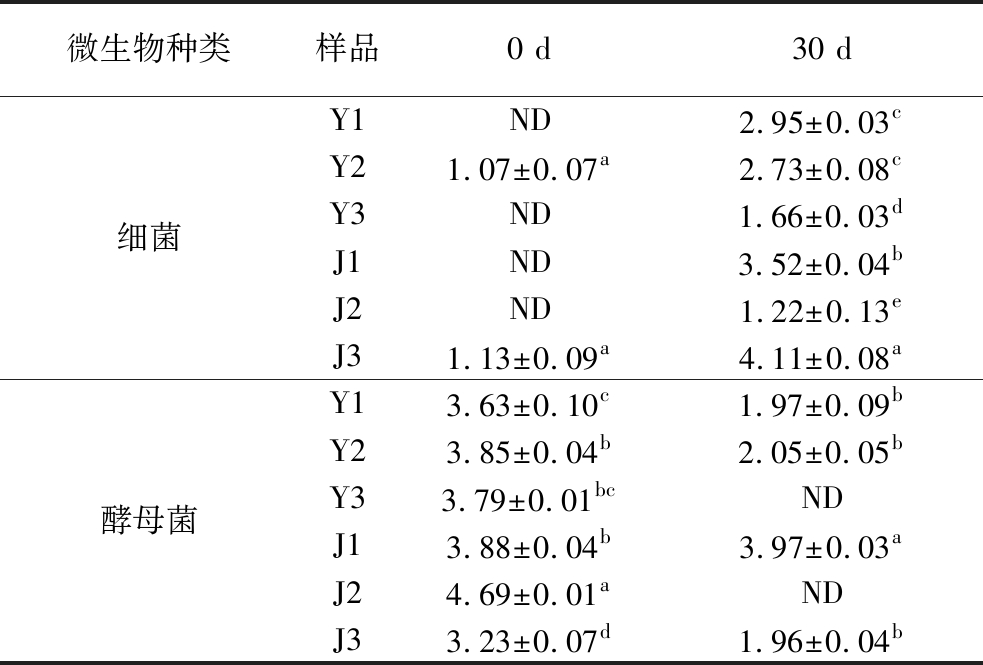
注:ND表示未检出;字母不同表示不同变种芥菜样品差异显著(P<0.05)(下同)。
微生物种类样品0 d30 d细菌Y1ND2.95±0.03cY21.07±0.07a2.73±0.08cY3ND1.66±0.03dJ1ND3.52±0.04bJ2ND1.22±0.13eJ31.13±0.09a4.11±0.08a酵母菌Y13.63±0.10c1.97±0.09bY23.85±0.04b2.05±0.05bY33.79±0.01bcNDJ13.88±0.04b3.97±0.03aJ24.69±0.01aNDJ33.23±0.07d1.96±0.04b
2.2 不同芥菜变种发酵理化指标差异分析
泡菜的理化指标可以反映发酵体系中微生物的生长情况,也与泡菜的感官风味品质密切相关[20]。不同芥菜变种在发酵0和30 d时基本理化指标的差异结果如表2所示,各个样品在不同发酵时间下pH、总酸和还原糖含量均呈现显著差异。在发酵0 d时,叶芥类样品的pH值均低于茎芥,总酸含量均显著高于茎芥类样品。但在发酵30 d 时,pH值和总酸含量体现出不同样品发酵的差异。有研究表明,泡菜总酸含量在0.6~0.8 g/100 g时酸味感官能达到最佳水平[21]。6个样品中仅有Y3、J1和J2三个样品总酸含量在0.6 g/100 g以上,J3样品在发酵过程中总酸含量增加了0.15 g/100 g,而Y1和Y2样品在30 d的发酵中pH值虽然略有上升,但总酸含量几乎没有变化。
表2 不同芥菜变种发酵0 d和30 d理化指标的差异
Table 2 Differences in physicochemical properties contents of different mustard varieties fermented at 0 d and 30 d

理化指标样品0 d30 dpHY15.90±0.02c4.83±0.00cY25.78±0.01d5.10±0.00bY35.72±0.04e3.84±0.01dJ16.46±0.01a3.83±0.01dJ26.32±0.01b3.84±0.01dJ36.41±0.01a5.30±0.01a总酸/(g/100 g)Y10.31±0.03b0.35±0.00eY20.35±0.01a0.32±0.01eY30.34±0.01ab0.61±0.03cJ10.16±0.00d0.77±0.01aJ20.19±0.01d0.72±0.01bJ30.26±0.00c0.41±0.00d还原糖/(g/100 g)Y11.48±0.18b1.80±0.04bY22.27±0.05a2.32±0.15aY31.26±0.05bc0.86±0.03cJ11.19±0.05c0.68±0.01cJ20.76±0.03d0.46±0.01dJ30.10±0.02e0.78±0.02c亚硝酸盐/(mg/kg)Y10.86±0.03a0.75±0.03aY20.84±0.02a0.73±0.01aY30.74±0.02a0.74±0.03aJ10.68±0.29a0.71±0.01aJ20.76±0.02a0.72±0.01aJ30.75±0.03a0.48±0.02b
还原糖含量的变化与总酸的变化趋势相反,Y3、J1和J2样品中还原糖至少降低了0.3 g/100 g,说明在这些样品中微生物能有效地将糖转化为酸。虽然在表1中Y3和J2发酵30 d时细菌含量均未达到2 lg CFU/g以上,但其发酵程度表明其中主要微生物可能是乳酸菌。在其他3个样品中,Y1发酵30 d时还原糖含量甚至略有增加,这可能是由于微生物未能较好消耗糖类物质,且长时间的发酵使蔬菜中糖类物质更多溶出导致。虽然J3发酵30 d时细菌含量最高,但其pH值、还原糖和总酸的变化量较低,可能是由于发酵样品中微生物的组成结构不同且乳酸菌含量较低导致。亚硝酸盐含量除了J3样品在发酵30 d后有显著降低外,其他样品不同发酵时间和不同样品间没有显著差异,且含量均远低于国家规定的20 mg/kg。
2.3 不同芥菜变种发酵有机酸含量差异分析
有机酸是蔬菜进行微生物发酵过程中的重要代谢产物[11, 20],不同芥菜变种在发酵0 d和30 d时有机酸的含量和组成具有较大差异(表3)。
表3 不同芥菜变种发酵0 d和30 d有机酸含量差异 单位:g/kg
Table 3 Differences in organic acid contents of different mustard varieties fermented at 0 d and 30 d

有机酸样品0 d30 d柠檬酸Y10.21±0.01c0.19±0.00cY21.37±0.10a1.55±0.02aY30.44±0.04b0.03±0.00eJ10.16±0.01cNDJ20.15±0.01c0.13±0.00dJ30.18±0.02c0.31±0.01b苹果酸Y10.92±0.01e0.88±0.01cY21.50±0.08b1.04±0.04bY31.11±0.07cd0.09±0.00eJ11.87±0.05a0.18±0.00dJ20.97±0.03de0.09±0.00eJ31.24±0.04c1.29±0.01a琥珀酸Y16.55±0.09c7.76±0.15cY25.95±0.41c6.31±0.10dY36.14±0.59c1.45±0.03eJ111.00±0.19b0.01±0.00fJ215.92±0.55a13.07±0.03bJ317.56±1.11a25.19±0.09a乳酸Y1ND0.16±0.01cY2ND0.47±0.03cY3ND4.25±1.03bJ1ND6.69±0.02aJ2ND6.74±0.25aJ3ND0.17±0.00c乙酸Y11.65±0.02e1.72±0.02cY23.15±0.17d4.57±0.01bY31.64±0.09e0.49±0.01eJ16.94±0.19a0.35±0.01fJ25.02±0.22b0.71±0.01dJ34.39±0.05c6.07±0.03a
总体而言,发酵0 d时叶芥类样品柠檬酸含量均高于茎芥类样品,而琥珀酸和乙酸的含量均低于3个茎芥类样品。但在发酵30 d后,除了乳酸含量均有所增加,其他有机酸的变化趋势各不相同。芥菜中含量最高的有机酸为琥珀酸,J3样品在发酵第0天和30天时含量最高,分别是17.56和25.19 g/kg;Y1、J1和J2样品乳酸增加量较多,分别增加了4.25、6.69和6.74 g/kg,乳酸增加量与总酸含量的变化体现出的结果一致。有学者[22-23]的研究表明,蔬菜在自然发酵过程中乳酸逐渐积累,其他有机酸如乙酸、琥珀酸、苹果酸和柠檬酸等均逐渐降低甚至不能检出,说明乳酸发酵是泡菜的主要发酵模式,并且在长时间的发酵过程中有机酸的多样性会逐渐降低[12]。结合6个芥菜变种中有机酸的变化趋势,发现Y3、J1和J2样品在乳酸增加的同时,其他有机酸含量均有所降低,表明以上3种芥菜主要进行乳酸发酵。与之相反的是Y1、Y2和J3样品,尽管乳酸含量略有增加,但其柠檬酸、苹果酸、琥珀酸和乙酸含量也有所增加。自然发酵条件下,Y1和J3样品琥珀酸含量分别增加了18.5%和43.5%,Y2样品和J3样品乙酸含量分别增加了45.1%和38.3%,以上结果表明这3个样品中占据主导的并非乳酸发酵,这可能是由于乳酸菌的生长在这些样品中因不同硫苷代谢产生的抑菌物质而受到抑制。
2.4 不同芥菜变种发酵硫苷代谢物差异分析
2.4.1 挥发性风味物质PCA
挥发性风味物质的组成和含量极大影响了泡菜的风味感官品质[23]。尤其对于芥菜而言,硫苷水解代谢出的异硫氰酸酯类、硫氰酸酯以及腈类物质是挥发性物质中的重要组成部分[24]。为了明确不同芥菜变种在不同发酵时期挥发性化合物的整体概况以及所鉴定出的化合物是否具有代表性,以不同物质的相对含量为X变量,不同变种样本为Y变量,分别对发酵0 d和30 d样品进行无监督的PCA。由图2-a可知,不同样品在发酵0 d时挥发性风味物质的组成上具有较好的区分度,说明不同样品在发酵初期挥发性物质的差异较大。其中3个叶芥在PCA得分图中显著区分开,Y1和Y3与第一主成分呈正相关,与第二主成分呈负相关;Y2与第一主成分呈负相关,与第二主成分呈正相关,说明3个叶芥样品间挥发性成分存在较大种间差异。在茎芥类样品中,J2样品与J3和J1样品存在显著差异,J3和J1样品则在挥发性风味物质的特征上较为接近。
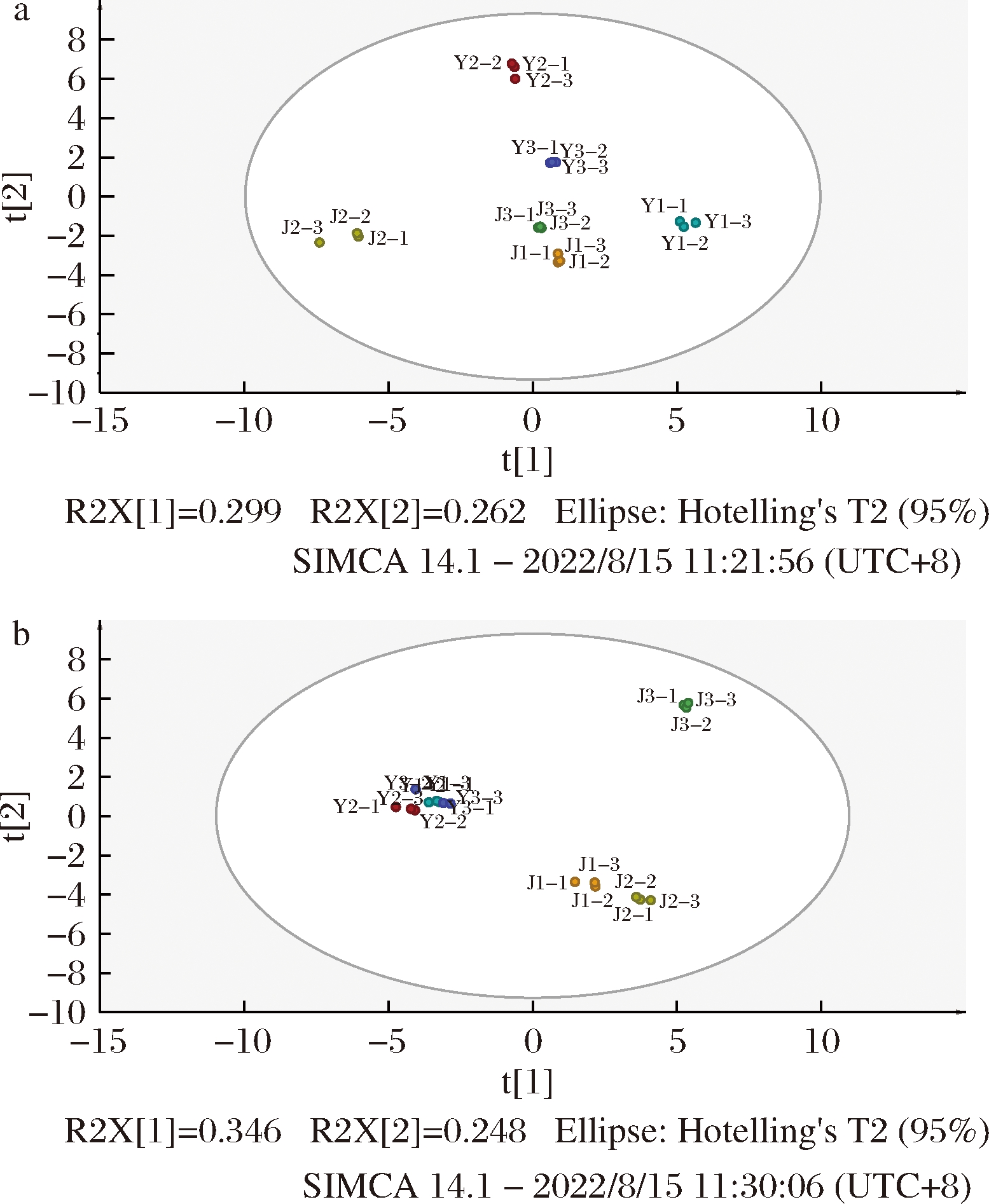
a-发酵0 d;b-发酵30 d
图2 不同芥菜变种挥发性风味物质PCA
Fig.2 PCA of volatile aroma compounds in different mustard varieties
随着发酵的进行,不同样品的挥发性风味物质特征产生了较大的变化(图2-b)。发酵30 d时,3个叶芥类样品挥发性成分特征趋于一致,均位于PCA得分图的第二象限。但在茎芥类样品中,仅J1和J2样品风味轮廓较为接近,且与J3样品明显区分开。这一结果表明,尽管3个叶芥在乳酸发酵进程和有机酸组成上存在差异,但挥发性成分还是会随着发酵时间的增加逐渐趋向归一化[23]。然而,在茎芥样品中J3样品发酵0 d时与J1相似,但在发酵30 d后在微生物含量和有机酸组成的巨大差异下,其挥发性风味物质轮廓与J1和J2样品存在显著差异,这表明J3发酵终止时风味轮廓的不同主要不是原料差异所导致,而与发酵进程有关。
2.4.2 硫苷代谢物差异分析
为了明确不同芥菜变种中具有主要差异的硫苷代谢化合物,对发酵0 d和30 d下各芥菜样品的挥发性风味物质进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),分别在发酵0 d和30 d模型中鉴定出12种和14种VIP>1.0的差异贡献化合物(电子增强出版附图1、图2、表1和表2,https://doi.org/10.13995/j.cnki.11-1802/ts.033629),其中有6种异硫氰酸酯类化合物和2种腈类化合物,具体相对含量变化如图3所示。比较发酵0 d和发酵30 d之间的硫苷代谢产物发现,发酵显著降低了主要异硫氰酸酯类物质的含量,包括异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、2-苯基乙基异硫代氰酸酯、异硫氰酸环丙酯和3-(甲硫基)丙基异硫氰酸酯,仅有异硫氰酸仲丁酯在3个叶芥样品中显著增加,在J2和J3样品中显著降低。腈类物质在各芥菜变种中差异较大,2-丁烯腈在Y3和J1样品中显著增加,其他样品显著降低或未检出;而烯丙基腈变化趋势与2-丁烯腈相反,尤其是J2和J3样品烯丙基腈增加量较高。

a-异硫氰酸烯丙酯;b-3-丁烯基异硫氰酸酯;c-2-苯基乙基异硫代氰酸酯;d-异硫氰酸环丙酯;e-异硫氰酸仲丁酯;f-3-(甲硫基)丙基异硫氰酸酯;g-2-丁烯腈;h-烯丙基腈
图3 不同芥菜变种硫苷代谢产物差异分析
Fig.3 Differential analysis of glucosinolate metabolites in different mustard varieties
异硫氰酸酯类物质是芥菜中硫苷代谢出的独特风味物质,主要贡献了辛辣、刺激和辣根类气味[25]。本实验中,异硫氰酸烯丙酯相对含量最高,在不同变种的新鲜芥菜样品中均值达到70%以上,随后其含量逐渐降低,与前人的结果一致[16,22,26]。有研究表明,由于芥子酶催化水解后硫代葡萄糖苷不稳定中间体的重排与侧链和水解条件密切相关,在pH为5~8时,硫代葡萄糖苷的主要降解产物为异硫氰酸酯,pH为2~4时形成腈类物质[22]。本试验中发酵0 d时异硫氰酸酯类物质含量最高与此结论一致,但在发酵30 d时腈类物质的生成规律不同,这可能是由于其前体物质GSL在发酵前期水解程度较高所致。除了环境因素,发酵体系微生物对GSL的水解代谢也有影响,不同微生物对GSL的代谢能力不同。研究表明[18, 27]一些乳酸菌、乳球菌和双歧杆菌均能有效代谢GSL,但大部分代谢产物是具有一定安全风险的腈类物质;而一些片球菌属微生物能代谢产生具有功能活性的异硫氰酸酯类物质。本实验中硫苷代谢物变化差异性最大的芥菜是J3样品,在发酵30 d时其中6种异硫氰酸酯类化合物包括含量最高的异硫氰酸烯丙酯均降低至未检出,而烯丙基腈相对含量从0%增加至50%左右,是J2的增加量的2.28倍,Y2增加量的18.68倍。结合表1微生物的结果推测可能是J3样品中微生物的组成与其他样品不同导致的,该结果也与图1中显示的一致。另外,进行较好乳酸发酵的Y3、J1和J2样品在硫苷代谢产物的变化规律上与大多数传统蔬菜发酵的变化规律一致[22, 24]。以上结果表明,不同变种硫苷组成差异与其微生物代谢紧密相关,且对蔬菜的发酵进程和发酵品质具有极大的影响。
2.5 不同芥菜变种发酵相关指标与硫苷代谢物相关性分析
为了进一步研究硫苷代谢产物与其他发酵指标的相关性,对微生物指标、理化品质指标和几种硫苷代谢差异化合物进行了Pearson相关分析(图4),异硫氰酸酯类化合物和腈类化合物与芥菜发酵的其他品质指标之间均有一定相关性。含量最高的异硫氰酸烯丙酯与发酵芥菜中的细菌、总酸和琥珀酸含量呈显著负相关,与酵母菌和pH值呈正相关。异硫氰酸仲丁酯与发酵芥菜中的酵母菌、苹果酸、琥珀酸和乙酸含量呈显著负相关。在腈类物质方面,2-丁烯腈和与烯丙基腈均与发酵样品中的细菌均呈显著正相关。其中2-丁烯腈与芥菜中乳酸含量呈显著正相关,而烯丙基腈与琥珀酸呈显著负相关。MULLANEY等[27]通过对比肠杆菌科、植物乳杆菌和乳酸乳球菌发酵西蓝花提取物,发现不同微生物代谢硫苷类物质产生的水解代谢产物具有较大差异,表明不同微生物种属对硫苷代谢产物具有较大影响。因此,在细菌和酵母菌对这些硫苷代谢物的相关分析结果中,需要进一步讨论不同芥菜变种发酵体系中微生物组成的差异。目前已有部分研究针对发酵蔬菜中的乳酸菌[18]、人体肠道中的多形拟杆菌[28]等细菌对GSL的代谢相关研究,对酵母菌等对硫苷代谢相关的研究较少。相关性分析结果表明,酵母菌可能通过一些协同作用从而间接影响GSL在发酵过程中的代谢过程,从而影响最终代谢产物。总的来说,GSL在发酵芥菜中代谢产生不同的水解产物,其生理功能或毒性均能影响发酵蔬菜的品质,这些指标在评估蔬菜发酵程度和最终泡菜品质方面具有重要作用,也可对未来泡菜专用品种的选育提供辅助参考。

图4 不同芥菜变种发酵相关指标与硫苷代谢物相关性热图
Fig.4 Heat map of correlations between fermentation-related properties and glucosinolate metabolites in different mustard varieties
3 结论
本研究对6个不同芥菜变种进行自然发酵,并对发酵前后的泡菜品质指标和硫苷代谢产物进行了对比分析,不同变种芥菜在发酵前后微生物、pH值、总酸、还原糖、有机酸和挥发性风味物质含量均表现出显著差异。宽柄芥(Y3)、笋子芥(J1)和抱子芥(J2)发酵样品pH值均在4以下,总酸含量均高于0.6 g/100 g,乳酸增加量在4.25 g/kg以上,以上芥菜样品主要进行乳酸发酵且发酵状况良好。长柄芥(Y1)、凤尾芥(Y2)和茎瘤芥(J3)的pH值和总酸含量没有显著变化,发酵结束时产生大量的琥珀酸而乳酸增加量较小,未进行有效的乳酸发酵。此外,本研究进一步分析了不同样品中主要差异性硫苷代谢产物的变化规律,并和发酵相关指标进行了相关性分析。结果表明,不同样品中含有的异硫氰酸酯和腈类物质的含量和种类各有差异,其中的主要挥发性化合物为异硫氰酸烯丙酯,其含量随发酵逐渐降低;发酵程度最低的茎瘤芥产生的烯丙基腈含量最高。细菌和酵母菌与硫苷代谢产物均有显著相关性,但需进一步分析发酵体系中不同微生物组成和菌株差异对硫苷类物质代谢的影响。实验结果为芥菜发酵品质评价和发酵专用芥菜变种与品种筛选提供了一定的理论基础。
[1] 张晓黎, 吴兴壮, 张华.乳酸菌功能作用及其在生产中的应用[J].农业工程技术, 2015, 35(14):36-39.
ZHANG X L, WU X Z, ZHANG H.Function of lactic acid bacteria and its application in production[J].Agriculture Engineering Technology (Agricultural Product Processing Industry), 2015, 35(14):36-39.
[2] XIE X W, ZHANG Z X, CHAI A L, et al.Grey mould on leaf mustard caused by Botrytis cinerea, a new disease in China[J].Australasian Plant Disease Notes, 2016, 11(1):23.
[3] 田艳. 华容大叶芥菜主要化学成分及其乙醇提取物抗结肠炎机理研究[D].长沙:湖南农业大学, 2020.
TIAN Y.Study on the main chemical components of Huarong large-leaf mustard and the anti-colitis mechanism of its ethanol extract[D].Changsha:Hunan Agricultural University, 2020.
[4] SOO L H, JEONG Y E, RAK C M.Changes of physiological activity of mustard leaf during its fermentation period[J].Journal of Microbiology and Biotechnology, 2000, 10(1):43-47.
[5] BELL L, OLOYEDE O O, LIGNOU S, et al.Taste and flavor perceptions of glucosinolates, isothiocyanates, and related compounds[J].Molecular Nutrition &Food Research, 2018, 62(18):1700990.
[6] FAHEY J W, ZALCMANN A T, TALALAY P.The chemical diversity and distribution of glucosinolates and isothiocyanates among plants[J].Phytochemistry, 2001, 56(1):5-51.
[7] HERR I, BÜCHLER M W.Dietary constituents of broccoli and other cruciferous vegetables:Implications for prevention and therapy of cancer[J].Cancer Treatment Reviews, 2010, 36(5):377-383.
[8] HO C L, TAN H Q, CHUA K J, et al.Engineered commensal microbes for diet-mediated colorectal-cancer chemoprevention[J].Nature Biomedical Engineering, 2018, 2(1):27-37.
[9] 胡伯凯, 徐俐, 钟潇, 等.8种芥菜的高盐腌制适应性研究及品质评价[J].广东农业科学, 2013, 40(20):88-92.
HU B K, XU L, ZHONG X, et al.Adaptability of high salinity curing process and appraisal of quality for eight different mustard cultivars[J].Guangdong Agricultural Sciences, 2013, 40(20):88-92.
[10] SUN B, LIU N, ZHAO Y T, et al.Variation of glucosinolates in three edible parts of Chinese kale (Brassica alboglabra Bailey) varieties[J].Food Chemistry, 2011, 124(3):941-947.
[11] 罗文珊, 张艳, 徐玉娟, 等.不同芥菜品种对发酵泡菜品质的影响规律[J].现代食品科技, 2022, 38(5):43-55.
LUO W S, ZHANG Y, XU Y J, et al.Effects of different mustard varieties on the quality of fermented pickle[J].Modern Food Science and Technology, 2022, 38(5):43-55.
[12] ZHAO N, GE L H, LAI H M, et al.Unraveling the contribution of pre-salting duration to microbial succession and changes of volatile and non-volatile organic compounds in Suancai (a Chinese traditional fermented vegetable) during fermentation[J].Food Research International, 2022, 159:111673.
[13] 赵楠. 四川泡菜的主要特性及其成因分析[D].无锡:江南大学, 2017.
ZHAO N.Analysis of the main characteristics of Sichuan Paocai and its formation mechanism[D].Wuxi:Jiangnan University, 2017.
[14] SHAO Y J, LIN A H M.Improvement in the quantification of reducing sugars by miniaturizing the Somogyi-Nelson assay using a microtiter plate[J].Food Chemistry, 2018, 240:898-903.
[15] 侯新磊, 赵楠, 葛黎红, 等.低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响[J].食品科学, 2022,43(21):282-290.
HOU X L, ZHAO N, GE L H, et al.Effect of cold plasma treatment on the inhibition of pellicle-spoilage and the storage quality of low-salt kimchi[J].Food Science, 2022,43(21):282-290.
[16] ZHANG C C, ZHANG J M, LIU D Q.Biochemical changes and microbial community dynamics during spontaneous fermentation of Zhacai, a traditional pickled mustard tuber from China[J].International Journal of Food Microbiology, 2021, 347:109199.
[17] 赵楠, 葛黎红, 郭壮, 等.泡辣椒发酵过程中质构劣化规律及其影响因素研究[J].中国酿造, 2020, 39(1):119-123.
ZHAO N, GE L H, GUO Z, et al.Texture change of pickled pepper during fermentation and its influence factors[J].China Brewing, 2020, 39(1):119-123.
[18] YE J H, HUANG L Y, TEREFE N S, et al.Fermentation-based biotransformation of glucosinolates, phenolics and sugars in retorted broccoli puree by lactic acid bacteria[J].Food Chemistry, 2019, 286:616-623.
[19] PE AS E, PIHLAVA J M, VIDAL-VALVERDE C, et al.Influence of fermentation conditions of Brassica oleracea L.var.capitata on the volatile glucosinolate hydrolysis compounds of sauerkrauts[J].LWT-Food Science and Technology, 2012, 48(1):16-23.
AS E, PIHLAVA J M, VIDAL-VALVERDE C, et al.Influence of fermentation conditions of Brassica oleracea L.var.capitata on the volatile glucosinolate hydrolysis compounds of sauerkrauts[J].LWT-Food Science and Technology, 2012, 48(1):16-23.
[20] MOON E W, YANG J S, YOON S R, et al.Application of colorimetric indicators to predict the fermentation stage of kimchi[J].Journal of Food Science, 2020, 85(12):4170-4179.
[21] 毛丙永, 殷瑞敏, 赵楠, 等.四川老卤泡菜基本理化指标及特征菌群分离鉴定[J].食品与发酵工业, 2018, 44(11):22-27.
MAO B Y, YIN R M, ZHAO N, et al.The physical and chemical properties of Sichuan old brined Paocai and the isolation of characteristic microbes[J].Food and Fermentation Industries, 2018, 44(11):22-27.
[22] LIU D Q, ZHANG C C, ZHANG J M, et al.Metagenomics reveals the formation mechanism of flavor metabolites during the spontaneous fermentation of potherb mustard (Brassica juncea var.multiceps)[J].Food Research International, 2021, 148:110622.
[23] ZHAO Y J, WEI W L, TANG L, et al.Characterization of aroma and bacteria profiles of Sichuan industrial Paocai by HS-SPME-GC-O-MS and 16S rRNA amplicon sequencing[J].Food Research International, 2021, 149:110667.
[24] EISENSCHMIDT-BÖNN D, SCHNEEGANS N, BACKENKÖHLER A, et al.Structural diversification during glucosinolate breakdown:Mechanisms of thiocyanate, epithionitrile and simple nitrile formation[J].The Plant Journal, 2019:tpj.14327.
[25] BELL L, KITSOPANOU E, OLOYEDE O O, et al.Important odorants of four Brassicaceae species, and discrepancies between glucosinolate profiles and observed hydrolysis products[J].Foods, 2021, 10(5):1055.
[26] GE L H, LAI H M, HUANG Y L, et al.Comparative evaluation of package types in alleviating textural softening and package-swelling of Paocai during storage:Insight into microbial invasion, cell wall pectinolysis and alteration in sugar and organic acid profiles[J].Food Chemistry, 2021, 365:130489.
[27] MULLANEY J A, KELLY W J, MCGHIE T K, et al.Lactic acid bacteria convert glucosinolates to nitriles efficiently yet differently from Enterobacteriaceae[J].Journal of Agricultural and Food Chemistry, 2013, 61(12):3039-3046.
[28] LIOU C S, SIRK S J, DIAZ C A C, et al.A metabolic pathway for activation of dietary glucosinolates by a human gut symbiont[J].Cell, 2020, 180(4):717-728.e19.