铁皮石斛富含多糖、氨基酸、生物碱等多种活性成分[1],作为药食两用物质,在中国已有2 000多年的应用历史。铁皮石斛多糖是一种中性多糖,主要由β-D-吡喃葡萄糖和β-D-甘露吡喃糖组成,这2种单糖有清除羟基自由基的作用,使得铁皮石斛多糖具有一定的抗氧化活性[2]。同时,许多研究表明,铁皮石斛多糖在增强免疫系统、抗癌、抗肿瘤等方面有显著功效。但是,铁皮石斛多糖的应用却并不广泛。一方面,是因为多糖提取液中含有的无机盐类、单糖类、寡糖类、木质素、蛋白质等多种杂质会影响多糖的应用;另一方面,乙醇和氯仿沉淀等传统的多糖纯化方法存在许多缺点,例如大量使用化学试剂、提取时间长、以及提取过程中可能导致多糖结构发生变化等。此外,土壤和水源的污染会使得重金属在植物中富集,重金属通过食物链进入人体后很难排出体外[3],而多糖作为重金属的主要结合底物,提取得到的铁皮石斛多糖可能存在重金属超标的风险。多糖中高重金属含量不仅会影响多糖的质量,也会对人体健康产生不利影响。如何在绿色环保的前提下,开发一种提高铁皮石斛多糖提取回收率及纯度的工业化提取方法,仍是铁皮石斛多糖提取领域研究的重点。
本研究选择膜分离技术对铁皮石斛粗多糖进行纯化,膜分离技术作为一种高效、低成本物理纯化方法,不使用额外的化学试剂,操作条件温和,不会改变多糖的化学结构,而且与离心、过滤相比,膜分离技术纯化多糖的效率更高。同时,本研究采用电渗析技术去除多糖中的金属离子,电渗析作为一种能够有效去除金属离子的技术,具有废弃物排放率低、化学品消耗低和模块化程度高的优点,已有研究将其应用于有机溶液的脱盐处理[4]。曾有研究证明了应用电渗析和色谱技术去除青贮汁中盐的可行性[5],并且LUIZ等[6]使用电渗析成功分离了生物精炼废水中的盐和有机物,盐的去除率达到96%。
根据现有的文献可知,虽然电渗析技术在海水淡化过程中已经得到了广泛的应用[7],但尚未有关于电渗析应用于去除有机化合物中重金属离子方面的研究[8]。本研究开发了一种纯化铁皮石斛多糖的新方法,通过两步超滤结合电渗析技术,在能够获得较高得率和纯度的铁皮石斛多糖的同时,还能有效去除铁皮石斛多糖中的金属离子,尤其是重金属离子,且提取过程更加绿色、高效、低能耗。
1 材料与方法
1.1 材料与试剂
铁皮石斛叶,购自浙江温州乐清;福林酚试剂、考马斯亮蓝、NaOH、HCl、NaCl,均为试剂纯,上海阿拉丁生化科技有限公司;截留分子质量(molecular weight cutoff,MWCO)为3、5、8、500 kDa的商用聚醚砜膜(polyether sulfone membrane, PES),北京中科锐扬科技有限公司。
1.2 仪器与设备
85-2型磁力搅拌器,杭州仪表电机有限公司;紫外分光光度计,北京高能科迪科技有限公司;Sartorius PB-10型pH计、DDSJ-308A型电导率测定仪,雷滋仪电科学仪器股份有限公司;切向流超滤系统、实验室电渗析测试仪,浙江赛特膜技术有限公司。
1.3 实验方法
1.3.1 铁皮石斛粗多糖提取
参考韩娟娟等[9]的方法提取制备铁皮石斛多糖。将铁皮石斛叶清洗后烘干粉碎脱脂,并在70 ℃去离子水中浸提3次,时间为2 h,料液比(g∶mL)为1∶25,合并水提液后利用旋转蒸发仪进行浓缩,将浓缩液用95%(体积分数)无水乙醇沉淀过夜,最后离心收集下层沉积物,将其冻干后得到铁皮石斛粗多糖粉末。根据冻干后的粗多糖质量与烘干后的铁皮石斛叶粉末质量之比计算铁皮石斛粗多糖的提取率。
1.3.2 第一步超滤过程
第一步超滤(first ultrafiltration,UF-1st)利用截留分子质量为500 kDa的PES去除部分大分子杂质,如部分木质素、蛋白质等。UF-1st通过食品级超滤纳滤膜片测试系统进行,超滤膜池的有效过滤面积为67 cm2。在实验开始前,将实验所需PES膜在去离子水中浸泡24 h,预压处理1 h,以确保膜分离过程中膜的稳定性。称取提取得到的铁皮石斛粗多糖粉末20 g加入500 mL去离子水中充分搅拌溶解后,加入HCl或NaOH调节溶液pH值,在室温[(25±1) ℃]下探究NaCl含量(0、0.5、1、1.5、2 mol/L)以及循环次数(1、2、3、4、5、6、7次)对膜渗透效果的影响,确定最佳通量。并收集透过液和截留液分别测量多糖含量,将透过液浓缩冻干后用于后续实验。
1.3.3 电渗析脱盐过程
通过电渗析快速有效地脱除盐及重金属离子。电渗析装置的膜池装备有6个阴离子交换膜(AEM-Type Ⅱ)和6个阳离子交换膜(CEM-Type Ⅱ),离子交换膜的有效面积为189 cm2,采用3%(质量分数)的无水Na2SO4溶液作为极性溶液,通入各级电渗析的阳极室和阴极室。去离子水作为浓缩室溶液,铁皮石斛多糖溶液作为淡化室溶液。实验在室温[(25±1) ℃]下进行,实验过程中极液室、浓缩室以及淡化室的流量均为300 mL/min。为了探究在5、10、15 V电压下不同电渗析操作对于多糖溶液盐及重金属离子脱除效果的影响,每5 min取淡化室溶液测量电导率(X),最终的脱盐率(DR)根据淡化液的初始电导率和最终电导率按照公式(1)计算:
(1)
1.3.4 第二步超滤过程
在电渗析完成后,通过第二步超滤工艺(UF-2nd)将脱盐后的铁皮石斛多糖溶液进行浓缩和纯化,并改变温度(25、30、35、40、45、50 ℃)和pH(4、5、6、7、8、9)进行参数优化。在这一过程中,研究使用截流分子质量为3、5、8 kDa的商用PES膜去除单糖、寡糖等小分子杂质,进一步纯化石斛多糖。收集透过液和截留液分别测量多糖含量,收集截流液并浓缩冻干用于后续实验。
1.3.5 重金属含量测定
重金属含量测定参考国标方法GB 5009.12—2017(铅)、GB 5009.13—2017(铜)、GB 5009.15—2014(镉),采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)进行测定。取铁皮石斛多糖粉末于60 ℃下干燥4 h。取样品粉末各0.2 g分别加入5 mL硝酸、2 mL过氧化氢,摇匀后放置于微波消解罐中。待消解完成后,将溶液转移至量瓶中,少量水洗涤消解罐3次后合并至量瓶中,得到待测样溶液。同时作试剂空白和标准试剂参考物质溶液[10],将空白、标准试剂和待测样液与内标溶液一同按照ICP-MS工作条件进行测定。
1.3.6 总糖含量测定
总糖含量根据苯酚-硫酸法测定,参考谭喜平等[11]的方法并进行一些修改。称取10 mg铁皮石斛叶样品加入去离子水定容至25 mL。精确吸取2 mL定容后的样品溶液于试管中,加入1 mL质量分数5%苯酚和5 mL 95%(体积分数)H2SO4后,振荡摇匀后沸水浴15 min,在水流下冷却至室温。使用紫外-可见分光光度计测量样品溶液在490 nm处吸光度,以蒸馏水为空白对照。
1.3.7 铁皮石斛多糖含量测定
铁皮石斛多糖含量由样品溶液中的总糖含量减去还原糖含量计算得到。还原糖测定采用二硝基水杨酸法[12]并稍作修改。取1 mL样品溶液加入试管中并与3 mL二硝基水杨酸试剂混合,振荡混匀后沸水浴5 min,在水流下冷却至室温。使用紫外-可见分光光度计测量样品溶液在540 nm的吸光度,以蒸馏水为空白对照。
1.3.8 铁皮石斛多糖回收率及纯度
根据铁皮石斛多糖的回收率(R)和多糖纯度(P)衡量多糖品质。多糖的纯度是经过两步超滤及电渗析实验得到的铁皮石斛多糖的质量与实验得到的产品总糖质量的比值。多糖纯度计算如公式(2)所示:
(2)
第一步超滤中的铁皮石斛多糖回收率(R1)根据该超滤过程得到的产品中多糖的质量与铁皮石斛粗多糖粉末质量的比值计算得到,如公式(3)所示:
(3)
第二步超滤中的铁皮石斛多糖回收率(R2)根据该超滤过程得到的产品中多糖的质量与超滤前的样品质量的比值计算得到,如公式(4)所示:
(4)
1.3.9 统计分析
本文所有数据均重复测定3次,实验数据为平均值±标准偏差,采用Origin 9.1进行作图,使用单因素方差分析(SPSS)进行数据处理和分析。
2 结果与分析
2.1 NaCl对UF-1st单元中多糖提取效果的影响
本研究通过在铁皮石斛多糖提取过程中加入不同含量的NaCl来减少盐溶性多糖的损失,提高了多糖的整体回收率,并探究最适宜的NaCl浓度。如图1所示,多糖的提取率随着NaCl浓度的增加而呈现先升高后降低的趋势。植物多糖的粗提取一般采用热水提取、生物酶提取、超声波提取等方法,这些方法均采用纯水作为溶剂[13]。然而有研究发现在鱼腥草、中草药、铁皮石斛及部分果蔬中含有少量的盐溶性多糖[14],与水溶性多糖相比,盐溶性多糖由于含量低而常被传统的以水为溶剂的多糖提取工艺忽视。加入0.5 mol/L的NaCl时铁皮石斛多糖的提取率最高,达到了15.7%。这可能是由于NaCl的加入增强了铁皮石斛多糖分子的表面电荷,进而使得多糖分子与水分子之间的相互作用增强,提高了多糖在水溶液中的溶解度[15]。在NaCl含量高于0.5 mol/L时铁皮石斛多糖提取率下降可能是因为多糖是由多个单糖分子组成的,含有大量羟基和一些阴离子,当加入过多的游离钠时会产生静电屏蔽效应,同时破坏多糖的双电层结构,造成了多糖的损失[16]。
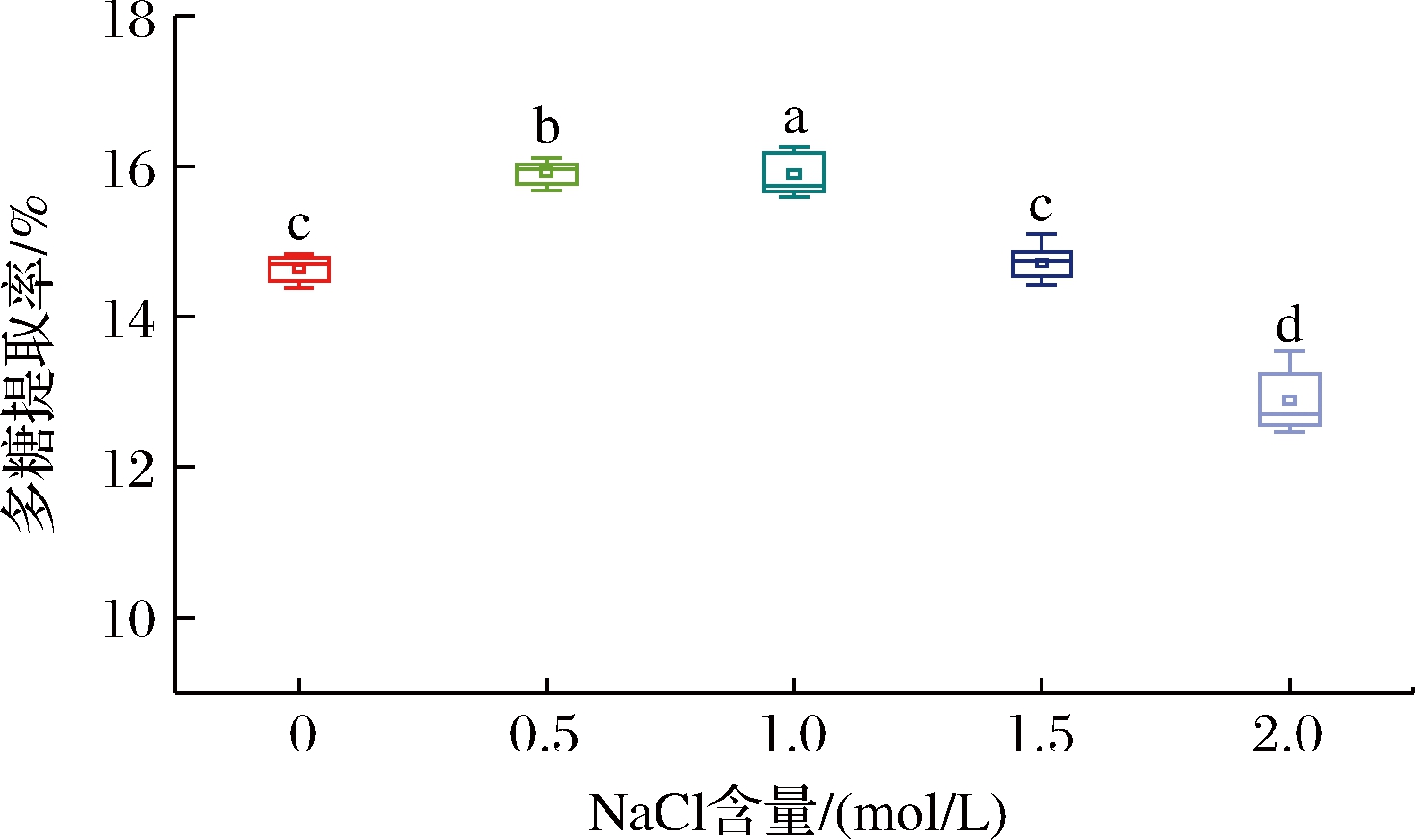
图1 NaCl含量对多糖提取率的影响
Fig.1 Effect of NaCl content on the extraction rate of polysaccharides
注:图中不同字母表示存在显著性差异(P<0.05)。
2.2 循环次数对UF-1st单元中铁皮石斛多糖提取的影响
第一步超滤过程中多糖的损失主要是由于多糖溶液具有一定黏度,在超滤管道和进料罐等中会有残留,因此在实验中采用连续循环超滤的方式来提高UF-1st单元整个过程中多糖的回收率[17]。首先使用截留分子质量为500 kDa的超滤膜将多糖溶液从500 mL浓缩至300 mL,在截留的多糖溶液中加入去离子水至500 mL后继续超滤循环,并在每次超滤循环后测量截留液中的多糖含量。图2显示了超滤提取次数对铁皮石斛多糖含量的影响。循环次数仅为1次时,多糖的回收率只有30.8%,随着循环次数的增加,多糖回收率显著提高,但多糖的纯度持续下降。多糖纯度下降可能是因为大分子的多糖之间存在架桥作用,使得分子团聚在一起,但是一些小分子的杂质能够从团聚分子的空隙中透过膜孔,随着循环的次数增加,分子架桥增多,这样的现象趋于明显,影响最后的多糖纯度。超滤循环5次后,随着循环次数增加,多糖回收率基本保持不变。同时,实验结果表明多糖的渗透通量随着循环次数的增加而基本呈现降低的趋势,这可能是由于随着循环次数的增加,溶质不断在膜表面积累,同时水不断透过膜使得膜表面的溶质浓度增加。在浓度梯度作用下,溶质与水向相反方向扩散,在膜表面形成溶质浓度分布边界层,阻碍了水的透过。在第二次循环中渗透通量略有增加,这可能是因为在多糖分子以叠加方式聚集并且在膜表面产生滤饼层前,会吸附在膜孔表面,并在膜孔内堵塞,使得原本粗糙的膜孔内表面变得光滑,这使得多糖分子与膜的摩擦力减小,从而一定程度上提升了膜的水通量[18]。随着超滤时间的延长,膜表面的浓差极化现象趋于明显,即在分离过程中,多糖溶液在压力驱动下透过膜,部分溶质被截留,使得膜与本体溶液界面或临近膜界面的区域溶液浓度逐渐升高,在浓度梯度作用下,溶质又会由膜面向本体溶液扩散,形成边界层,使流体阻力与局部渗透压增加,从而导致溶剂透过通量下降在更大程度上阻碍了水的透过,使得料液水通量下降并导致渗余物中多糖的渗透减少。另一方面,由于多糖组成复杂,分子质量分布广,部分分子质量高于膜截留分子质量的多糖分子无法通过超滤膜,也造成了部分多糖损失。
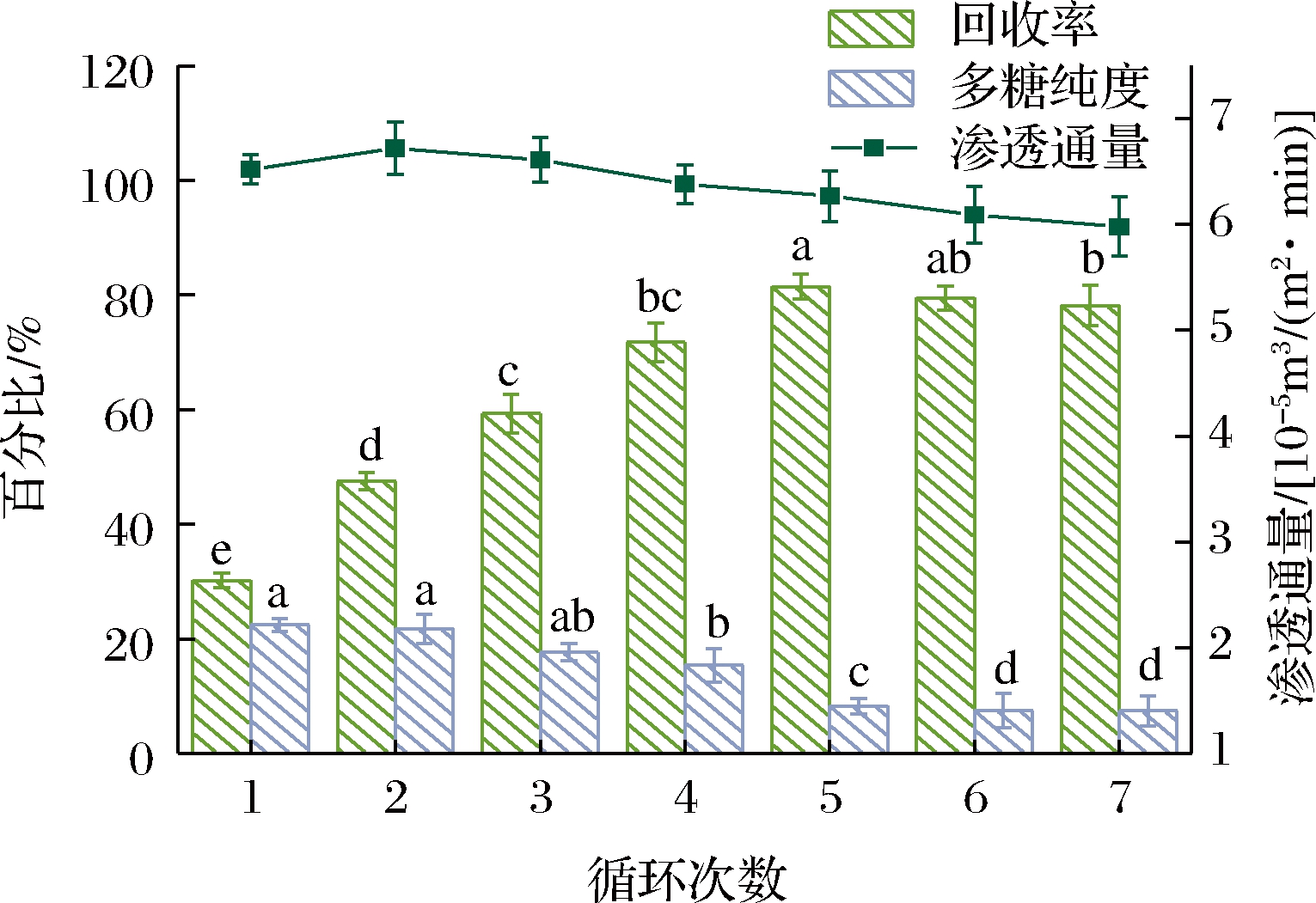
图2 连续循环超滤次数对超滤过程的影响
Fig.2 Effect of continuous cycle ultrafiltration times on the ultrafiltration process
由于多糖的纯度经过电渗析和第二步超滤后会得到更好的提升,因此主要依据多糖回收率和膜渗透通量确定第一步超滤的最佳循环次数为5次,此时的多糖回收率能达到81.44%,膜渗透通量也较高。
2.3 电渗析脱盐效果评价
在第一步超滤过程中为了提高多糖得率而添加的NaCl可能会影响多糖的后续应用,因此要通过对比是否添加NaCl的多糖电渗析过程,来检验电渗析是否能够有效去除NaCl。图3描绘了电渗析过程中稀释和浓缩容器中电导率的变化。在最初的15 min内,淡化室中铁皮石斛多糖溶液的电导率急剧下降,在电渗析开始20 min后电导率下降趋势变得非常缓慢。这是因为溶液的电导率是由离子迁移率和离子浓度决定的,当离子浓度较高时离子迁移速率更快,导致在电渗析过程前期溶液电导率下降明显。在实验中发现,在更高的电压下电导率的下降趋势更加明显。电渗析利用直流电场作为驱动力实现离子与溶液的分离,在更高的电压下,盐离子移动速度更快,从一个隔室移动到另一个隔室所需的时间更少,在不同隔室的停留时间变短,因此溶液电导率下降的速度更快。另一方面,在含有0.5 mol/L NaCl的多糖溶液中离子的迁移速率更快,虽然在理论上电流密度和局部电场不随离子浓度改变,但是离子浓度会改变膜表面的电荷密度,使得离子静电排斥作用增强,导致电导率的下降速度加快[19]。
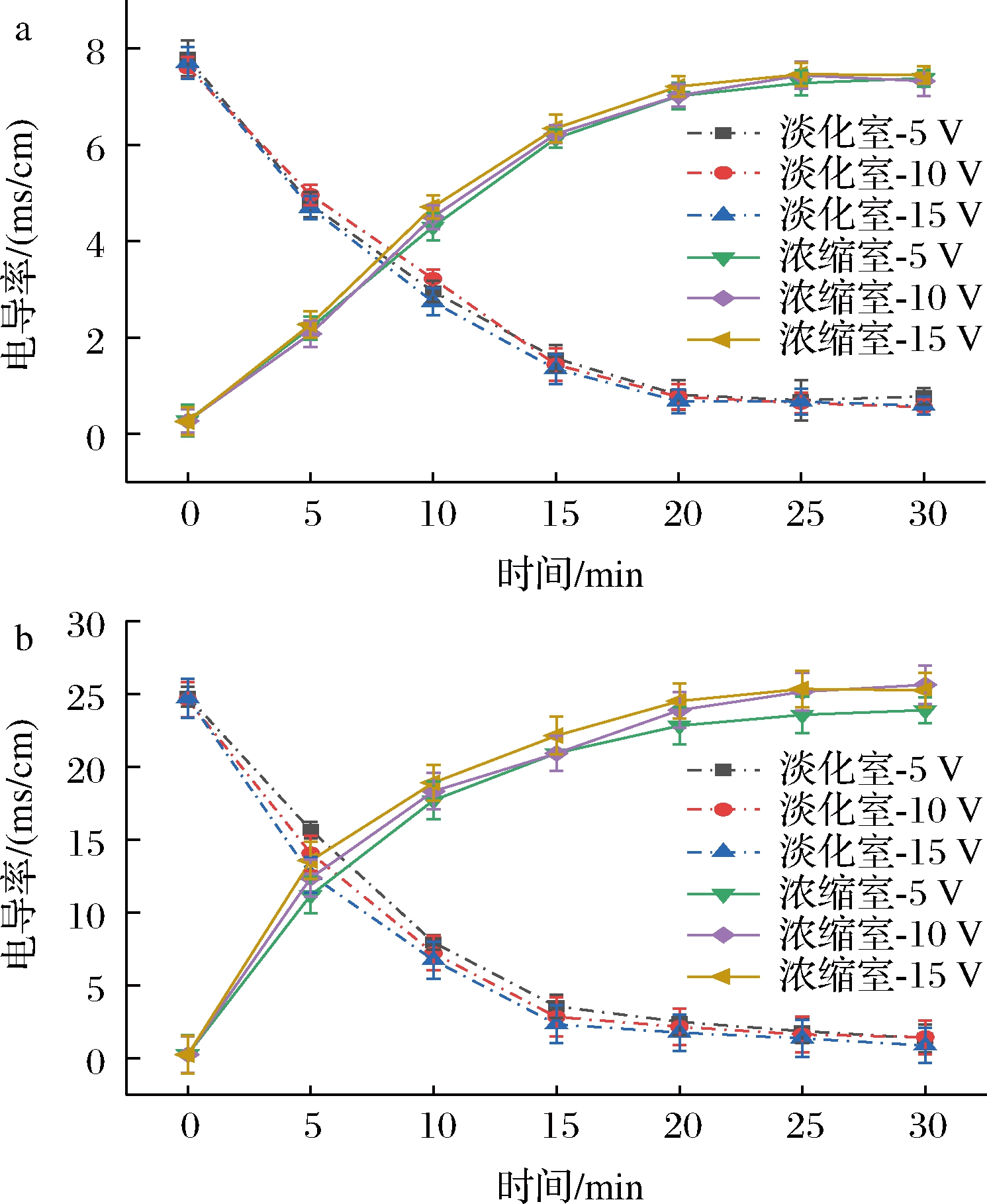
a-不含NaCl的料液电导率变化;b-含0.5 mol/L NaCl的料液电导率变化
图3 电渗析过程中电导率的变化
Fig.3 Change in the conductivity of the dilute and concentrate
由图3可知,含NaCl的铁皮石斛多糖溶液随着电渗析时间延长,在15 min后淡化室中的电导率逐步下降至与不含NaCl的铁皮石斛多糖溶液接近的水平,说明为了提高多糖提取率而添加的NaCl可以通过电渗析步骤有效地去除。
2.4 重金属脱除效果评价
电渗析法脱除铁皮石斛多糖溶液中的金属离子后,采用等离子体质谱法测定铁皮石斛多糖中残余的重金属含量。通过检测铁皮石斛粗提物中的重金属离子含量,发现其主要含有铅(Pd2+)、镉(Cd2+)和铜(Cu2+)等重金属,3种重金属离子含量分别为2.60、0.71、1.16 mg/kg,其中铅离子存在安全隐患,Cd2+和Cu2+含量也接近全球食品安全标准的警戒线[20]。由图4可知,在电渗析前铁皮石斛多糖中的铅含量为2.43 mg/kg,低于铁皮石斛粗提物中的铅含量(2.60 mg/kg)。这可能是由于一部分铅离子会与大分子多糖络合,在超滤过程去除了这部分铅离子。
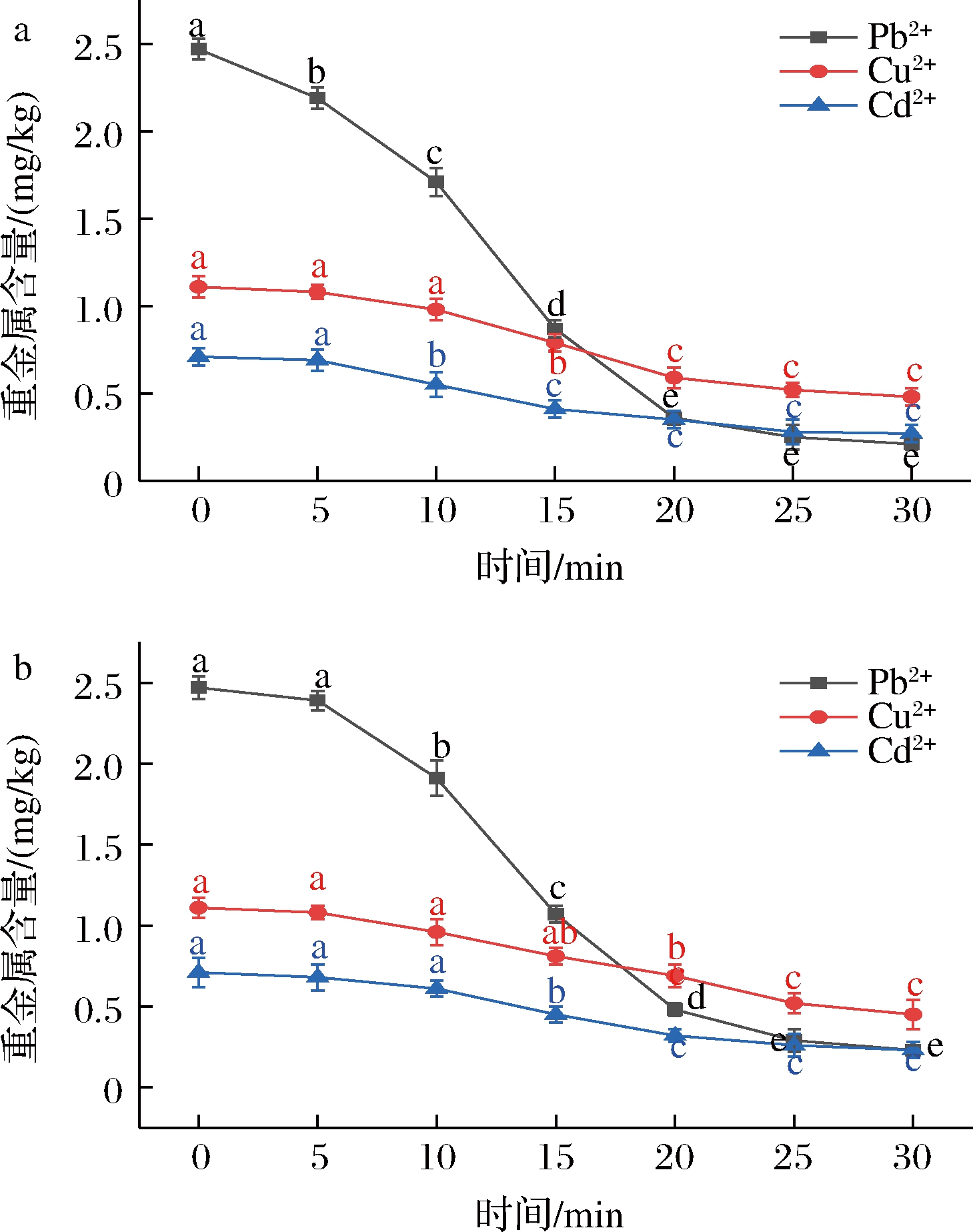
a-不含NaCl的料液重金属含量变化;b-含0.5 mol/L NaCl的料液重金属含量变化
图4 电渗析操作对于重金属的脱除效果
Fig.4 The heavy metals removal effect of electrodialysis operation
图4-a显示了不含NaCl的多糖提取液的重金属离子含量随电渗析时间的变化趋势。Pd2+含量在电渗析开始后的10 min内迅速下降。15 min后,铁皮石斛多糖提取液中的Pd2+含量降至0.11 mg/kg,铅脱除率达到95.8%。而Cu2+和Cd2+的去除速度较慢,电渗析30 min后,Cu2+和Cd2+含量分别降至0.52、0.31 mg/kg,脱除率分别为26.8%和73.3%,两者的去除率不如Pd2+显著,这可能是由于金属离子通过静电力与多糖结合,而Cu2+和Cd2+与多糖的结合力相对Pd2+更强[21]。
图4-b描绘了含NaCl(0.5 mol/L)的多糖提取液中重金属离子浓度随时间的变化曲线。在电渗析初期,料液中的重金属含量的下降速度明显低于不加入NaCl的多糖溶液,这可能是由于料液中的Na+与Cl-多为游离态且体积较小浓度较大,当NaCl与重金属离子存在竞争性透过时,在相同电驱动力下,在电渗析初期优先转移Na+与Cl-[22]。因此溶液中的NaCl含量对于电渗析过程具有一定影响,但是随着电渗析时间的延长,图4-b观察到与图4-a类似的下降趋势,表明随着电渗析时间的延长,NaCl对去除重金属离子的影响可以忽略不计。这些结果均表明结合超滤和电渗析的方法可以有效去除铁皮石斛多糖中的重金属。
2.5 UF-2nd单元超滤参数优化
在超滤过程中,温度、pH主要通过影响浓差极化,进而影响超滤膜的过滤性能,即这些因素影响多糖在膜表面的积累造成的膜污染程度。通常,这些因素的影响与进料溶液中的溶质类型无关。然而,铁皮石斛多糖溶液是一个复杂的复合体系,不同分子之间的相互作用可能会随着超滤过程中工艺参数的变化而变化[23]。在本实验中,选择在0.5%的料液浓度下探究温度和pH对超滤效果的影响。
2.5.1 温度对超滤效果的影响
如图5-a所示,随着温度的升高,3种不同截留分子质量的PES超滤膜的通量变化规律大致相同,均首先增加,在40 ℃时达到最大值,其中8 kDa的超滤膜变化尤为明显。原因可能是由于黏度的降低和布朗运动的加速。此外,随着温度从25 ℃升高到40 ℃,浓差极化层中溶质的扩散增加,进料黏度降低,从而产生更高的渗透通量,但是当温度进一步超过40 ℃时,料液通量减少可能是由于多糖在高温下变性并相互聚集[24]。

a-温度对超滤性能的影响;b-pH值对超滤性能的影响
图5 温度与pH值对超滤效果的影响
Fig.5 The influence of temperature and pH on the ultra filter effect
2.5.2 pH对超滤效果的影响
图5-b总结了渗透通量和进料pH之间的关系,随着pH值的增加,3种膜的渗透通量均呈现先减小后增加的趋势。料液的膜水通量的增加可以从膜的亲水性增加解释,当溶液的pH值改变,多糖分子带电性发生变化,由于官能团的作用,溶液在PES膜表面产生选择性吸附从而改变其亲水性,增加了料液的膜通量[25]。
综上所述,温度为40 ℃,pH为4时,3种膜孔径的PES膜渗透通量均最高,超滤效果也最好。在实际应用时,可根据实验条件和实验要求选择合适的温度及pH。
2.6 铁皮石斛多糖回收率及评价
截留分子质量不同的超滤膜超滤效果差异明显,由图6可知,截留分子质量越大,跨膜通量明显提升。超滤膜的截留分子质量表征了在能自由通过超滤膜的分子中最大分子的分子质量。较小的孔径和较快的流速导致膜污染速度较快,多糖在膜孔内发生堵塞并在超滤后期在超滤膜表面形成结垢层使得滤液通量下降从而降低了多糖的过滤效率。由于多糖组成复杂,分子质量分布广,截留分子质量大就意味着可以有更多的多糖分子通过超滤膜。为了进一步比较不同截留分子质量下超滤得到的铁皮石斛多糖的纯度并浓缩多糖,采用小分子截留分子质量(3、5、8 kDa)的超滤膜对电渗析得到的溶液进行超滤纯化。通过对多糖回收率及纯度的比较,可以发现不同截留分子质量的超滤膜过滤得到截留液中多糖的回收率与多糖纯度均呈现负相关。相较于3 kDa和8 kDa截留分子质量的超滤膜,截留分子质量为5 kDa的超滤膜得到的多糖回收率为78.2%,多糖纯度为86.4%,较为适中和均衡,经济优势较为明显。

图6 不同超滤膜对于多糖回收率及纯度的影响
Fig.6 Effects of different ultrafiltration membranes on recovery and purity of polysaccharide
3 结论
在本研究中,开发了一种超滤结合电渗析用于纯化植物多糖的工艺。结果显示通过添加NaCl能够提高铁皮石斛多糖的得率。本研究创新性地采用电渗析去除了多糖中的盐离子和重金属离子,并利用两次超滤去除不同分子质量的杂质。实验优化了超滤和电渗析的工艺操作参数,当进料温度为35 ℃,料液pH值为6时,能够达到最佳的多糖回收率和纯度,分别为78.2%和86.4%。电渗析过程可使多糖中的铅离子脱除率达到95.8%,铜和汞离子脱除率达到26.8%和73.3%,重金属总体脱除率达到80%。本实验使用的超滤结合电渗析技术是多糖提取的一次新的尝试,该技术有望应用于不同原料多糖提取物的纯化应用,值得进一步探索研究。
[1] 李佳, 杨晓丽, 杨小丹, 等.响应面法优化铁皮石斛多糖的提取及其成分分析[J].热带农业科学, 2021, 41(10):39-49.
LI J, YANG X L, YANG X D, et al.Optimization of extraction conditions for polysaccharides from Dendrobium officinale by response surface and their component analysis[J].Chinese Journal of Tropical Agriculture, 2021, 41(10):39-49.
[2] 李志华. 铁皮石斛多糖的提取、分离、纯化及结构分析[D].南宁:广西师范学院, 2012.
LI Z H.Extraction, isolation, purification, structural analysis of the polysaccharide from Dendrobium officinale[D].Nanning:Guangxi Normal University, 2012.
[3] MUCHUWETI M, BIRKETT J W, CHINYANGA E, et al.Heavy metal content of vegetables irrigated with mixtures of wastewater and sewage sludge in Zimbabwe:Implications for human health[J].Agriculture, Ecosystems &Environment, 2006, 112(1):41-48.
[4] LUIZ A, SPENCER E, MCCLURE D D, et al.Membrane selection for the desalination of bio-refinery effluents using electrodialysis[J].Desalination, 2018, 428:1-11.
[5] THANG V H, KOSCHUH W, NOVALIN S.Electrodialysis versus chromatography for desalting silage juice:Comparison of both processes with regard to energy consumption[J].Journal of Membrane Science, 2005, 256(1-2):78-88.
[6] LUIZ A, MCCLURE D D, LIM K, et al.Potential upgrading of bio-refinery streams by electrodialysis[J].Desalination, 2017, 415:20-28.
[7] 王亚敏, 刘杰, 袁俊生.海水淡化副产浓海水资源化利用制备NaCl[J].水处理技术, 2020, 46(5):60-64.
WANG Y M, LIU J, YUAN J S.Preparation of NaCl from concentrated seawater of seawater desalination by-products[J].Technology of Water Treatment, 2020, 46(5):60-64.
[8] 于晓丹, 吴哲坤.工业废水中重金属的去除技术研究进展[J].中国资源综合利用, 2016, 34(11):46-48.
YU X D, WU Z K.The review on the treatment technologies of heavy metals wastewater[J].China Resources Comprehensive Utilization, 2016, 34(11):46-48.
[9] 韩娟娟, 陈舜胜,刘克海.铁皮石斛叶多糖的提取及其免疫活性测定[J].山东农业大学学报(自然科学版), 2021, 52(3):436-422.
HAN J J, CHEN S S, LIU K H.Extraction of polysaccharide from the leaves of Dendrobium officinale and its immunomodulatory property[J].Journal of Shandong Agricultural University(Natural Science Edition), 2021, 52(3):436-422.
[10] 熊江云, 冯进仪, 吕冠欣.电感耦合等离子体质谱法测定人参健脾丸中5种重金属元素[J].广东药科大学学报, 2021, 37(3):88-92.
XIONG J Y, FENG J Y, LU G X.Simultaneous determination of five heavy metals in renshenjianpi pills by ICP-MS[J].Journal of Guangdong Pharmaceutical University, 2021, 37(3):88-92.
[11] 谭喜平, 夏新华, 罗纯清, 等.苯酚-硫酸法测定益肺通络颗粒水提液总多糖含量[J].亚太传统医药, 2014, 10(17):24-27.
TAN X P, XIA X H, LUO C Q, et al.Determination of total polysaccharides in aqueous extracts of yifei tongluo granules by phenol-sulfuric acid method[J].Asia-Pacific Traditional Medicine, 2014, 10(17):24-27.
[12] 王红静. 铁皮石斛多糖的分离纯化、结构鉴定及抗氧化活性的研究[D].武汉:华中科技大学, 2017.
WANG H J.Isolation, structural characterization and antioxidant activity of polysaccharides from Dendrobium officinale[D].Wuhan:Huazhong University of Science and Technology, 2017.
[13] ZHU J X, CHEN Z Y, CHEN L, et al.Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J].International Journal of Biological Macromolecules, 2019, 130:388-398.
[14] 王曼宇, 刘乃新, 张福顺.植物源性多糖提取及生物活性研究进展[J].中国农学通报, 2021, 37(29):34-41.
WANG M Y, LIU N X, ZHANG F S.Extraction and bioactivity of plant derived polysaccharides:A review[J].Chinese Agricultural Science Bulletin, 2021, 37(29):34-41.
[15] ZHA X Q, LUO J P, LUO S Z, et al.Structure identification of a new immunostimulating polysaccharide from the stems of Dendrobium huoshanense[J].Carbohydrate Polymers, 2007, 69(1):86-93.
[16] ARZENI C, MART NEZ K, ZEMA P, et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering, 2012, 108(3):463-472.
NEZ K, ZEMA P, et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering, 2012, 108(3):463-472.
[17] HUANG Y F, FENG X S.Polymer-enhanced ultrafiltration:Fundamentals, applications and recent developments[J].Journal of Membrane Science, 2019, 586:53-83.
[18] XIE J H, REN Y M, XIAO Y H, et al.Interactions between tapioca starch and Mesona chinensis polysaccharide:Effects of urea and NaCl[J].Food Hydrocolloids, 2021, 111:106268.
[19] 苏慧超, 张田明, 吴云奇,等.电渗析-超滤耦合技术研究进展[J].化工进展, 2020, 39(S2):1-7.
SU H C, ZHANG T M, WU Y Q, et al.Development of electrodialysis with ultrafiltration membrane technology[J].Chemical Industry and Engineering Progress, 2020, 39(S2):1-7.
[20] LIU J, YUAN J S, JI Z Y, et al.Concentrating brine from seawater desalination process by nanofiltration-electrodialysis integrated membrane technology[J].Desalination, 2016, 390:53-61.
[21] YU Y L, ZHANG M J, XIE R, et al.Thermo-responsive monodisperse core-shell microspheres with PNIPAM core and biocompatible porous ethyl cellulose shell embedded with PNIPAM gates[J].Journal of Colloid and Interface Science, 2012, 376(1):97-106.
[22] 梁杰, 刘杰, 袁俊生, 等.电渗析盐水浓缩过程中有机酸及其盐迁移规律研究[J].高校化学工程学报, 2021, 35(4):624-631.
LIANG J, LIU J, YUAN J S, et al.Study on migration of organic acids and their salts during electrodialysis brine concentration processes[J].Journal of Chemical Engineering of Chinese Universities, 2021, 35(4):624-631.
[23] DARGE H F, ANDRGIE A T, TSAI H C, et al.Polysaccharide and polypeptide based injectable thermo-sensitive hydrogels for local biomedical applications[J].International Journal of Biological Macromolecules, 2019, 133:545-563.
[24] 宫春宇, 邢悦, 单佳明, 等.玉米须多糖超滤制备工艺及成分分析[J].食品科技, 2020, 45(6):249-253.
GONG C Y, XING Y, SHAN J M, et al.Ultrafiltration technology and composition analysis of corn silk polysaccharide[J].Food Science and Technology, 2020, 45(6):249-253.
[25] 吕少丽, 王红军, 徐又一.聚醚砜超滤膜的亲水化改性研究进展[J].膜科学与技术, 2005, 25(3):80-84.
LYU S L, WANG H J, XU Y Y.Progresses in hydrophilic modification of polyethersulfone ultrafiltration membranes[J].Membrane Science and Technology, 2005, 25(3):80-84.