猕猴桃因风味独特、富含维生素C并含有膳食纤维和其他有利于健康的化合物而深受消费者喜爱[1]。如今,我国猕猴桃栽培品种有59种,主要有“中华猕猴桃”“美味猕猴桃”“软枣猕猴桃”“毛花猕猴桃”等品种[2]。截至2021年,贵州省猕猴桃种植面积全国第三,产量全国第五,已跻身全国猕猴桃五大优势产区,形成了以贵阳、六盘水为重点的产业集中发展区,主要栽培“贵长”“红阳”2个鲜食品种[3-4]。然而,由于微生物潜伏期较长,可在采收前采收、以及采后贮运期间侵染果实,导致猕猴桃果实发生腐烂[5-7],有研究表明,由真菌引起的猕猴桃侵染病害发病率高达30%[8]。因此,解决由真菌病原体所引起的侵染病害,是猕猴桃产业迫在眉睫的问题。
国内外研究者利用传统的组织培养方法,对新西兰、智利、中国、韩国地区的“Hayward”“Hort16A”“秦美”“红阳”等猕猴桃采后侵染病害进行分析,发现主要致病菌有灰霉菌(Botrytis cinerea)、间座壳菌属(Diaporthe spp.)、链格孢菌(Alternaria alternata)、镰刀菌(Fusarium acuminatum)、拟茎点霉属(Phomopsis sp.)、葡萄座腔菌属(Botryosphaeria sp.)和假尾孢菌(Pseudocercospora actinidiae)等[9-16]。有报道提出采用组培法分离致病菌,但存在操作复杂、菌群信息不足、具有一定的局限性等问题,难以对群落结构及多样性进行分析[17]。高通量测序作为一种分析微生物组结构和功能的新手段,可以从宏观角度揭示真菌群落结构的动态变化,已应用于猕猴桃、草莓、杨梅、苹果、甜樱桃等水果领域[17-20]。石浩等[17]采用高通量测序技术研究了湖南省5个地区的“红阳”红心猕猴桃软腐果实门和属的优势微生物。其中,优势门有子囊菌门(Ascomycota)和担子菌门(Basidiomycota),优势菌有间座壳属(Diaporthe)、葡萄座腔菌科(Botryosphaeriaceae)。刘娜等[21]采用高通量测序技术对贮后不同发病程度的“贵长”猕猴桃软腐病致病部位果肉进行真菌多样性分析。结果表明,“贵长”猕猴桃腐烂后的主要真菌有座囊菌纲(Dothideomycetes)、葡萄座腔属和间座壳科(Diaporthaceae)。有研究表明,由于地理、气候差异和品种不同,不同产区同种水果采后侵染病害的致病真菌有所差异[5]。
目前,未见贵州省不同产区“贵长”“红阳”品种猕猴桃采后贮藏腐烂部位病害微生物群落结构多样性相关报道。本研究选取贵州省6个县来自10个果园的“贵长”“红阳”猕猴桃样品为试验材料,采用高通量测序技术对采后贮藏果实腐烂部位进行分析,探究贵州省猕猴桃主产区“贵长”“红阳”果实采后贮藏过程中的真菌群落多样性,并结合花期、幼果期、采收期降雨量,对贵州省猕猴桃采后贮藏侵染病害发生情况进行分析。为猕猴桃产业采后病害防控及贮运提供理论参考。
1 材料与方法
1.1 材料与试剂
分别于2021年8月23、24日,10月2、3日,采集贵州省6个县10个果园的“红阳”“贵长”猕猴桃样品。其中,水城县样品分别命名为红阳1(HY1)、红阳2(HY2)、红阳3(HY3);六枝县样品命名为红阳4(HY4);纳雍县样品命名为红阳5(HY5);修文县样品分别命名为贵长1(GC1)、贵长2(GC2);息烽县样品分别命名贵长3(GC3)、贵长4(GC4);松桃县样品命名为贵长5(GC5)。果实采后均运至贵阳学院,使用自发气调袋包装,经预冷后置于1~2 ℃条件下贮藏120 d。选择自然发病、软化猕猴桃果实作为实验样品,将样品放入无菌塑料袋中,于贵州省农产品产地初加工关键技术研发与应用科技创新基地微生物实验室进行真菌群落分析。
1.2 仪器与设备
Centrifuge 5418台式高速离心机,Eppendorf;580BR10905 PCR仪,Bio-rad;QIAxtractor SN 002358,QIAGEN;HE-120电泳仪、2500凝胶成像仪,Tanon;2100 Bioanalyzert,Aglient。
1.3 实验方法
1.3.1 样本采集与处理
从无菌袋中取出猕猴桃样品,75%(体积分数)酒精进行表面擦拭,无菌水冲洗3次,灭菌棉球表面擦干。用无菌陶瓷刀取皮下腐烂的部位果肉,液氮冻样,置于-80 ℃冰箱保存备用。
1.3.2 DNA提取、扩增及ITS1测序
采用MagPure Soil DNA LQ Kit试剂盒Magen D6 356-02提取猕猴桃样品中总DNA,然后用琼脂糖凝胶电泳和NanoDrop2000检测DNA的浓度。以样本中微生物总DNA为模板,采用通用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)引物对条形码进行PCR扩增。PCR反应程序为94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸20 s;26个循环,最终72 ℃延伸5 min。重复进行二轮扩增,磁珠纯化,取5 μL进行琼脂糖凝胶电泳检测,然后取1 μL纯化过的产物使用Qubit进行浓度检测。
1.3.3 Illumina NovaSeq 6000测序处理分析
Illumina NovaSeq 6000测序生成原始双端序列,使用Cutadapt软件,剪切掉原始测序序列中的引物序列。使用DADA2方法,将上一步序列使用Qiime2默认参数进行质量过滤,降噪,拼接及去嵌合体等质控分析,得到特征序列——扩增序列变体(amplicon sequence variant, ASV)。对各个样本中分类到该ASV的tags数进行统计,可以获得各个ASV在每个样本中的丰度情况。
1.4 数据处理
利用Mothur软件计算样本的α多样性,包括ACE指数、Chao 1指数、Coverage、Shannon指数和Simpson指数,以表征真菌群落的丰富度和多样性。利用QIIME软件进行主成分分析(principal component analysis, PCA),构建系统进化树。通过皮尔森相关系数分析建立降雨量与猕猴桃果实低温贮藏致病真菌丰度相关性。
2 结果与分析
2.1 测序结果和α多样性分析
通过Illumina NovaSeq 6000高通量测序测定10个不同果园的猕猴桃样品,图1是猕猴桃贮藏期侵染病害的腐烂果实及果肉腐烂图片。测序结果为:总的序列数据量在78 011~81 993条,优化序列数据量分布在15 459~61 763条,最终用于分析的序列数据量分布在15 459~60 745条,各样本ASV的数目分布在9~160。采用ANOVA算法进行差异统计,差异ASV为89个,差异属为30个,差异门为4个。每个样品的ASV分类信息见表1。ASV数目最低的是样品HY1、HY5、GC1,ASV平均数目为15~19;ASV最高的样品是GC3,ASV数目为130~160。
表1 样品信息
Table 1 Sample information
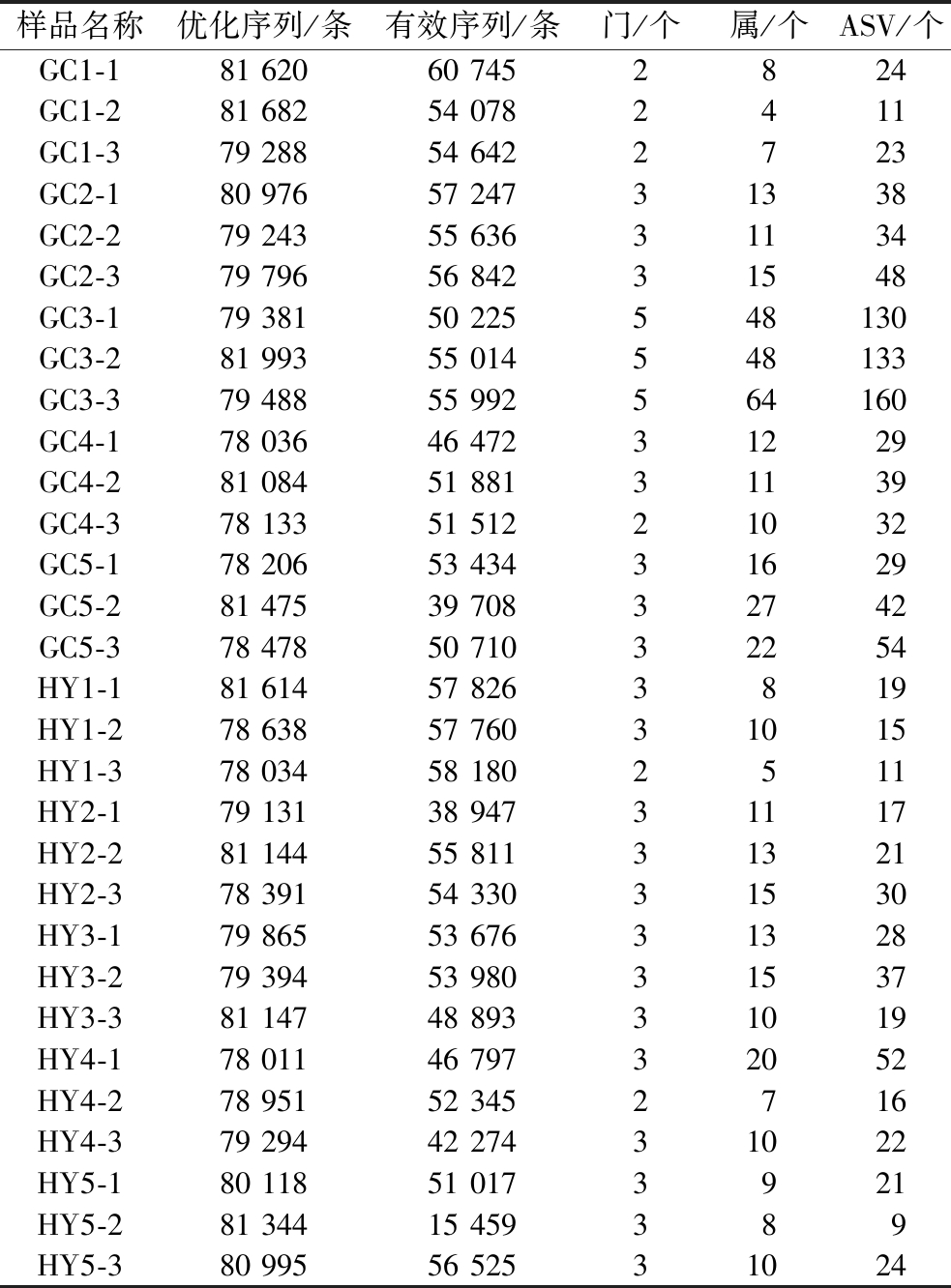
样品名称优化序列/条有效序列/条门/个属/个ASV/个GC1-181 62060 7452824GC1-281 68254 0782411GC1-379 28854 6422723GC2-180 97657 24731338GC2-279 24355 63631134GC2-379 79656 84231548GC3-179 38150 225548130GC3-281 99355 014548133GC3-379 48855 992564160GC4-178 03646 47231229GC4-281 08451 88131139GC4-378 13351 51221032GC5-178 20653 43431629GC5-281 47539 70832742GC5-378 47850 71032254HY1-181 61457 8263819HY1-278 63857 76031015HY1-378 03458 1802511HY2-179 13138 94731117HY2-281 14455 81131321HY2-378 39154 33031530HY3-179 86553 67631328HY3-279 39453 98031537HY3-381 14748 89331019HY4-178 01146 79732052HY4-278 95152 3452716HY4-379 29442 27431022HY5-180 11851 0173921HY5-281 34415 459389HY5-380 99556 52531024

a-“贵长”猕猴桃;b-“红阳”猕猴桃
图1 猕猴桃贮藏期侵染病害症状
Fig.1 Disease symptoms of kiwifruit during storage
图2是以89个差异ASV作为真菌代表序列,运用ANOVA算法建立的真菌系统发育树。该图可分为3层,内层数据在门的水平上对各样品菌种进行差异区分、分布,中间层和外层颜色区域分别代表“贵长”“红阳”样本被检测出的菌种种类,深颜色部分代表该样品对应的菌种被检测出,反之,该菌种未被检测出。由图2可知,内层图中所包含的门类有子囊菌门、担子菌门和其他门类,分别含有66、7、16个微生物菌群。由中间层和外层可知,“贵长”猕猴桃腐烂部位检出真菌有间座壳菌属(Diaporthe sp.)、镰刀菌属(Fusarium sp.)、Capnodiales sp.、格孢菌科(Pleosporaceae sp.)、小新壳梭孢(Neofusicoccum mangiferae)、卡罗莱纳葡萄孢(Botrytis caroliniana)、维多利亚隐球酵母(Cryptococcus victoriae)等。同样,“红阳”猕猴桃腐烂部位检出真菌有间座壳菌属、Nectriaceae sp.、镰刀菌属、Capnodiales sp.、格孢菌科、卡罗莱纳葡萄孢、维多利亚隐球酵母等。
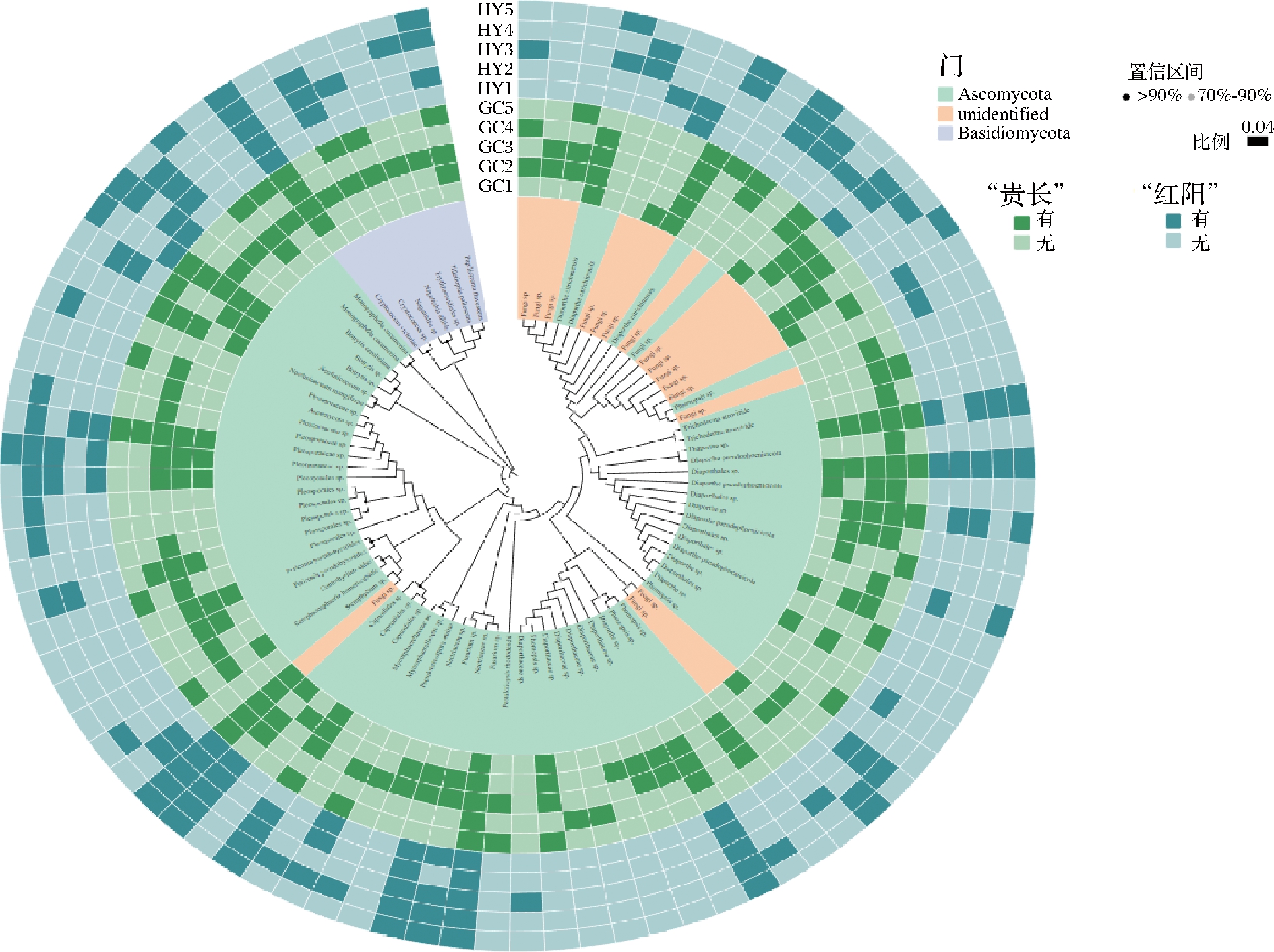
图2 真菌系统发育树
Fig.2 Phylogenetic tree of fungi
由图2可知,与“红阳”猕猴桃(外层)相比,“贵长”猕猴桃(中间层)菌群种类较为丰富,所占的菌种数量相比较多。尤其是GC3果园的真菌菌群种类最多,而对于“红阳”品种,HY1和HY5所占菌群种类最少。综上,不同果园的猕猴桃果实中的微生物多样性存在差异性。
α多样性分析指数分析包括ACE指数、Chao1指数、Shannon指数、Simpson指数和Coverage。表2通过上述指数分析了10个猕猴桃果实样品中真菌群落的丰富度和多样性。其中Coverage值越高,检测到样品中序列的概率就越大,代表了样品测序结果的真实性。ACE和Chao1指数用于评估真菌群落的丰富度。Shannon指数和Simpson指数用于表征真菌群落多样性。所有样品的Coverage均大于0.999,说明大部分低丰度ASV被检测出。从ACE和Chao1指数分析,真菌群落丰度由高到低排序为GC3>GC5>GC2>HY3>GC4>HY2>YH5>GC1>HY4>HY1。其中,GC3、HY3分别为“贵长”“红阳”猕猴桃中真菌群落丰富最高的猕猴桃。从真菌群落的多样性方面分析,“贵长”猕猴桃中GC3检测结果与其他组差异较大。除GC1之外,其他地区的“贵长”猕猴桃真菌群落丰度均高于“红阳”猕猴桃。Shannon指数和Simpson指数最高和最低的样品分别为GC3、GC5,反映出GC3样品真菌多样性较高,GC5样品真菌多样性低。这2个样品的ASV数目在所有样品中分别位居最高和最低。这说明Shannon指数和Simpson指数的高低与ASV数目呈正相关。各果园猕猴桃样品的真菌群落多样性由高到低排序为GC3>HY2>GC2>HY4>GC4>HY5>GC5>HY3>GC1>HY1,说明“贵长”猕猴桃果实腐烂部位真菌多样性大于“红阳”猕猴桃。推测原因为“红阳”猕猴桃果实在种植过程中套袋所致。总体看来,“贵长”猕猴桃组间的丰度和多样性大于“红阳”猕猴桃。然而,大多数果园“贵长”“红阳”猕猴桃的Shannon指数较低,Simpson指数较高,样品真菌ASV多样性低。推测原因可能是由于猕猴桃果实处于腐烂状态,果实表面的微生物群已破坏,致病菌通过竞争作用占优势,而呈现较低的ASV。
表2 猕猴桃贮藏期间真菌群落多样性
Table 2 Diversity of fungal communities associated with kiwifruit during storage
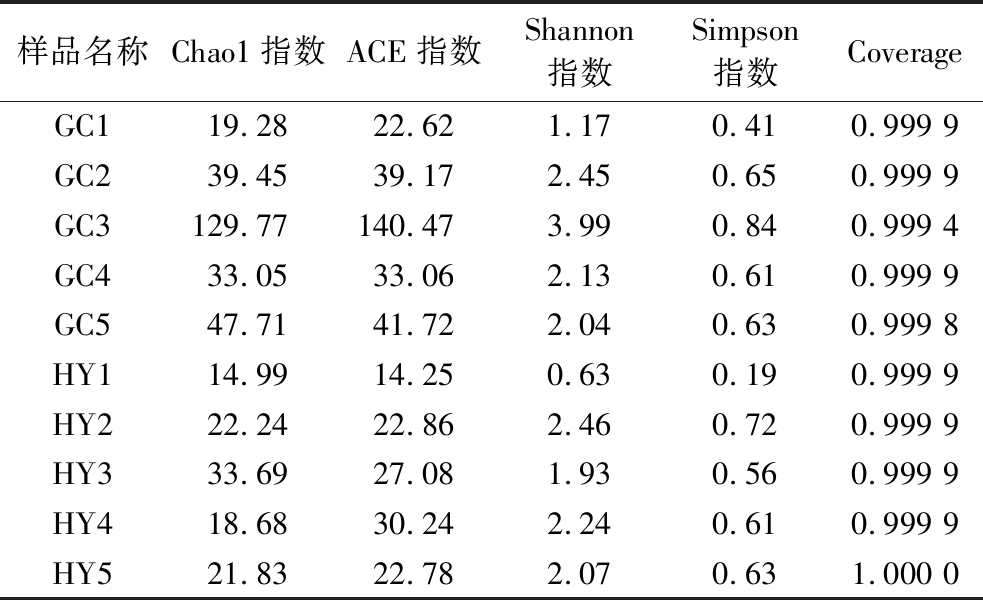
样品名称Chao1指数ACE指数Shannon指数Simpson指数CoverageGC119.2822.621.170.410.999 9GC239.4539.172.450.650.999 9GC3129.77140.473.990.840.999 4GC433.0533.062.130.610.999 9GC547.7141.722.040.630.999 8HY114.9914.250.630.190.999 9HY222.2422.862.460.720.999 9HY333.6927.081.930.560.999 9HY418.6830.242.240.610.999 9HY521.8322.782.070.631.000 0
2.2 不同品种的猕猴桃真菌群落结构分析
图3是门水平的真菌群落结构分析。检测出的门类为子囊菌门、担子菌门、接合菌门(Zygomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)和其他门类(others)。其中,子囊菌门和担子菌门在“贵长”“红阳”猕猴桃所有样品中均占优势,平均相对丰度分别为88.42%、1.08%。子囊菌门在所有样品中相对丰度最高,并且在“贵长”猕猴桃中的平均相对丰度(94.09%)大于“红阳”猕猴桃(82.76%)。这说明“贵长”“红阳”的主要优势菌群相同,但相对丰度存在差异。而接合菌门、球囊菌门、壶菌门仅在“贵长”GC3果园中的被检测到,这3种菌门在“贵长”猕猴桃中的平均相对丰度低于0.04%,相对丰度较低,不具有代表性。国内外已见报道猕猴桃果实致病菌均属于子囊菌门。综上可知,子囊菌门在猕猴桃侵染病害中起重要作用。本研究采集贮藏样品腐烂部位检测发现,子囊菌门在真菌群落结构中相对丰度较大,占有绝对主导,高达74.16%。说明贵州“贵长”“红阳”猕猴桃果实采后贮藏腐烂部位真菌也以子囊菌门为主。
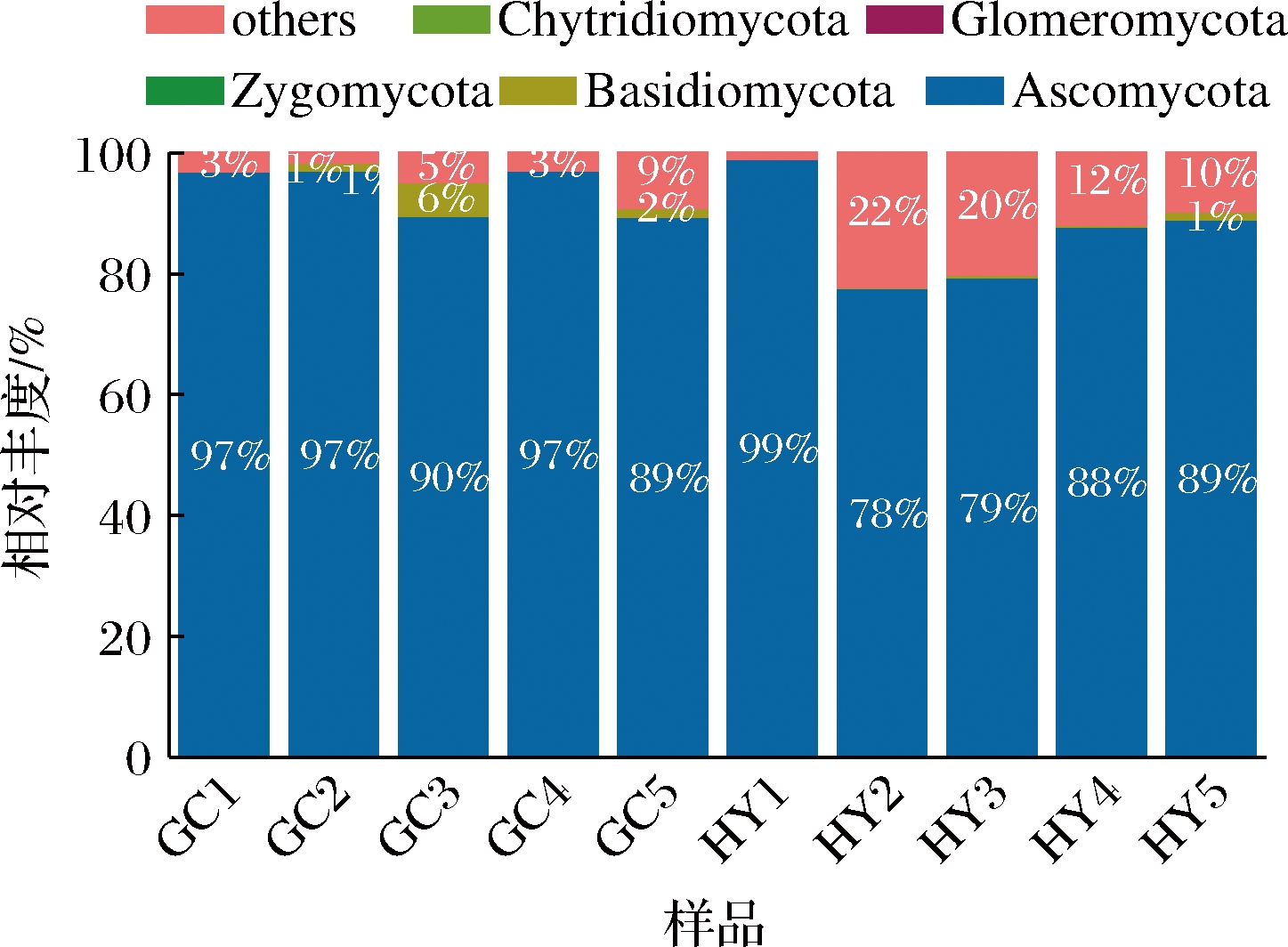
图3 猕猴桃样品门水平柱状图
Fig.3 Column chart of kiwifruit samples at phylum level
图4是在属的水平上,选取ASV丰度值位于前15个属绘制柱状图。其中相对丰度>1%的有11个属,包括葡萄孢属(Botrytis)(15.61%~96.07%)、镰刀菌属(Fusarium)(18.62%~72.28%)、新壳梭孢属(Neofusicoccum)(0%~51.39%)、间座壳菌属(Diaporthe)(21.34%~33.00%)、拟茎点霉属(Phomopsis)(0.01%~8.90%)、黑团孢属(Periconia)(0%~7.53%)、隐球菌属(Cryptococcus)(0%~2.36%)、假尾孢属(Pseudocercospora)(0%~3.57%)、木霉菌属(Trichoderma)(0%~1.44%)、Setophaeosphaeria(0%~1.29%)、担子菌酵母属(Naganishia)(0%~1.1%)。对于“贵长”猕猴桃,GC1、GC3果园主要优势属为葡萄孢属(68.57%、35.90%)和镰刀菌属(24.97%、18.62%);GC2的主要优势属为镰刀菌属(47.20%)、间座壳菌属(9.78%)和拟茎点霉属(9.04%);GC4和GC5主要优势属为新壳梭孢属(57.77%、51.75%)和间座壳菌属(25.92%、34.09%)。这说明“贵长”猕猴桃采后贮藏腐烂部位主要优势菌为葡萄孢属、镰刀菌属、新壳梭孢属、间座壳菌属和拟茎点霉属。与“贵长”猕猴桃果实不同,“红阳”猕猴桃的真菌群落多样性较低。其中,HY1的优势属为葡萄孢属(96.07%)。HY2的优势属包括镰刀菌属(28.53%)、葡萄孢属(15.6%)、拟茎点霉属(14.87%)。HY3优势属包括葡萄孢属(63.23%)、间座壳菌属(26.04%)。HY4的优势属包括假尾孢属(39.64%)、间座壳菌属(26.04%)。HY5优势属包括镰刀菌属(72.28%)、间座壳菌属(21.34%)。说明“红阳”猕猴桃采后贮藏腐烂部位优势属以葡萄孢属、镰刀菌属、间座壳菌属、假尾孢属为主。由此可见,葡萄孢属、镰刀菌属、间座壳菌属、新壳梭孢属、拟茎点霉属和假尾孢属是贵州不同果园“贵长”“红阳”猕猴桃采后贮藏腐烂部位真菌相对丰度较高的属。其中HY3、HY2、GC3三个样品的主要病害是镰刀菌属、间座壳属;HY5、HY1、GC4、GC1 4个样品的主要病害是葡萄孢属;GC5、GC2两个样品的主要病害是新壳梭孢属;HY4主要的致病菌为镰刀菌属、假尾孢属。综上可知,“贵长”“红阳”猕猴桃不同果园之间采后贮藏真菌群落多样性和结构存在差异。其中,葡萄孢属、镰刀菌属、间座壳属是10个样品的优势属。
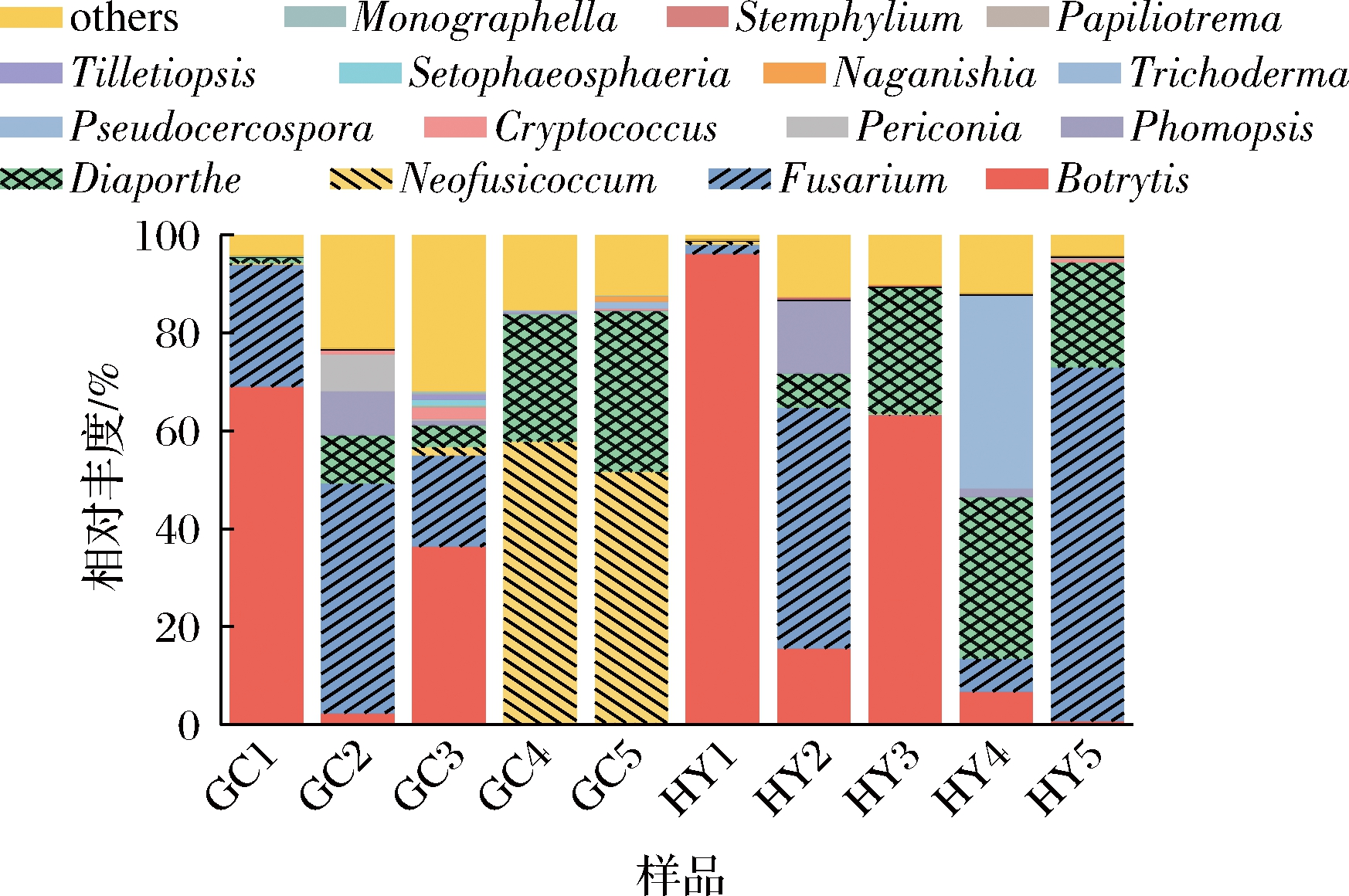
图4 猕猴桃样品属水平柱状图
Fig.4 Column chart of kiwifruit samples at genus level
2.3 β多样性分析
为了进一步探讨不同果园猕猴桃采后贮藏真菌群落结构的相似性和差异关系。以门和属水平的真菌菌群多样性数据为基础,通过PCA比较个体与群体间的差异(图5)。样本与样本之间的距离代表群落结构的差异大小。2个品种之间的距离较近,说明贮藏期间的“贵长”“红阳”猕猴桃病果的真菌群落结构差异小,多样性较为相似,这与图3门水平真菌群落分布研究结果一致。通过比较可见,“贵长”猕猴桃样品较为分散,说明“贵长”果园之间真菌群落结构存在差异。而“红阳”猕猴桃样品距离较近,说明“红阳”果园之间真菌群落多样性差异较小。这与图4属水平真菌群落分布研究结果一致。说明不同果园红阳猕猴桃之间真菌群落较为稳定,差异小。
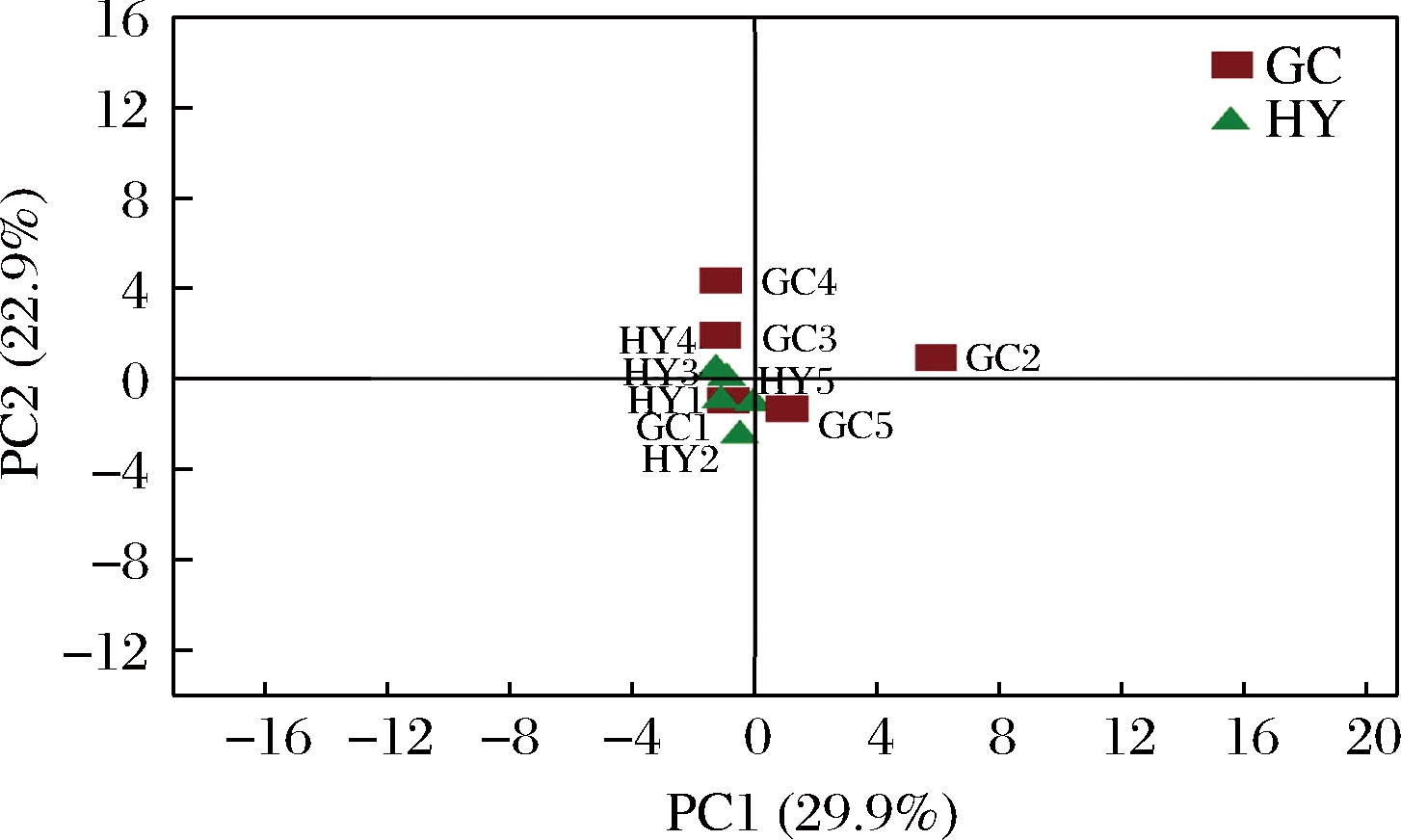
图5 不同地区猕猴桃真菌多样性的主成分分析
Fig.5 Principal components analysis of the fungal diversity in kiwifruit from different sampling sites
为阐释贵州省6县10个果园猕猴桃病果中真菌群落结构的差异性,本研究根据贵州省气象局数据[29]调查了2021年“贵长”“红阳”果实样品的花期幼果期、采收期降雨量。图6为不同地区降雨量与猕猴桃侵染病害子囊菌门丰度柱状图。如图6所示,“贵长”3个种植县各果园所在地花期幼果期(5~7月)、采收期(9~10月)的降雨量与平均降雨量有所差异。其中GC1、GC2果园所在地降雨量最大,GC3、GC4果园在采收期的降雨量最低。结合图3、图4可知,GC1、GC2果园对应的子囊菌门丰度与降雨量呈相同趋势,即“贵长”猕猴桃GC1、GC2果园所在县降雨量大,其对应的子囊菌门相对丰度高(96.95%,97.15%)。GC3果园子囊菌门相对丰度(89.65%)低于GC1、GC2果园,GC4果园子囊菌门相对丰度(97.20%)与GC1、GC2果园相近。经实地调研发现,GC3为3年初挂果新果园,这可能是由于新果园病害少、植保措施使用频次较低,其生物多样性高于GC4果园。“红阳”3个猕猴桃种植县花期幼果期(3~5月)、采收期(8~9月)各果园所在地的平均降雨量与“贵长”具有相同趋势,“红阳”品种在采收期HY1果园降雨量较多,其子囊菌门相对丰度高于其他果园。同时,本研究针对花期幼果期、采收期平均降雨量与猕猴桃侵染病害进行相关性分析。如表3所示,皮尔森相关系数为0.628,这说明降雨量与子囊菌门相对丰度有一定相关性,这与我们的分析结果一致。“贵长”猕猴桃种植县在花期幼果期、采收期的降雨量均大于“红阳”猕猴桃。其对应的"贵长"猕猴桃病果子囊菌门的平均相对丰度值高于“红阳”猕猴桃。综上所述,我们推测猕猴桃病果群落差异性可能与降雨量有关,降雨量过大时,有助于加速病原菌增值、扩繁,加大猕猴桃果实致病菌的侵染几率,导致真菌多样性降低,从而造成果实腐烂。
表3 降雨量与猕猴桃侵染病害子囊菌门相对丰度相关性分析
Table 3 Pearson correlation analysis between rainfall and abundance of Ascomycota in kiwifruit infectious diseases

变量降雨子囊菌门相对丰度降雨量 10.628子囊菌门相对丰度0.6281
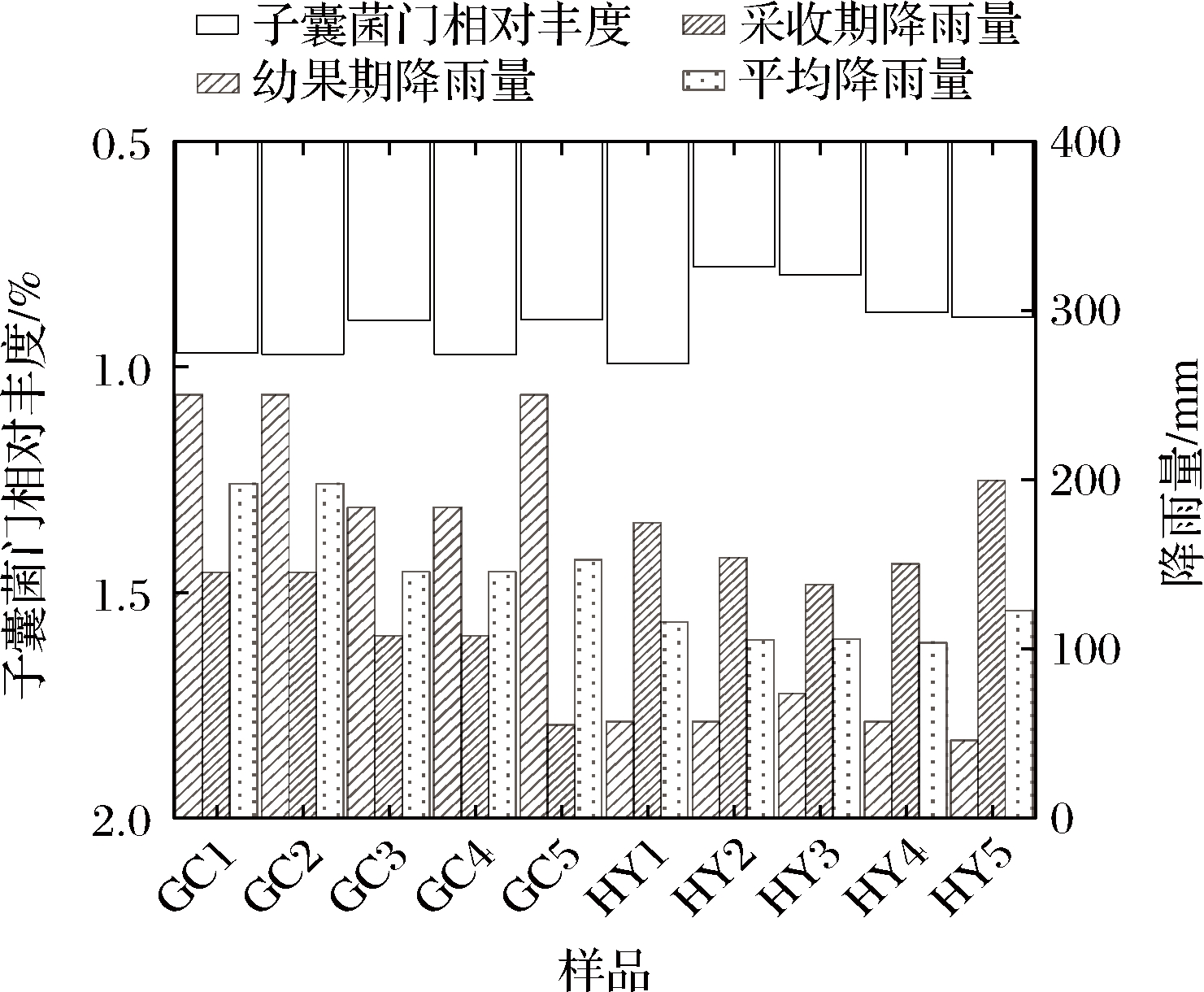
图6 不同地区降雨量与猕猴桃侵染病害子囊菌门丰度
Fig.6 Rainfall in different regions and the abundance of Ascomycota in kiwifruit infection diseases
3 结论与讨论
本文研究了贵州省6个县10个果园的“贵长”“红阳”猕猴桃低温冷藏腐烂部位真菌结构多样性及分布情况。结果表明,10个样品检测出的门类为子囊菌门、担子菌门、接合菌门、球囊菌门、壶菌门、其他门类。其中,子囊菌门为优势菌门。在属的水平上,相对丰度>1%的属类有葡萄孢属、镰刀菌属、新壳梭孢属、间座壳属、拟茎点霉属、隐球菌属、假尾孢属、木霉菌属等11个属。其中,葡萄孢属、镰刀菌属、间座壳菌属在所有果园样品中均有分布,真菌群落相对丰度较高,为贵州“贵长”、“红阳”猕猴桃真菌侵染病害主要优势属。通过真菌菌落PCA,发现本研究所采集“贵长”和“红阳”各样品间致病菌丰度虽存在差异,但真菌群落结构相差不大,在品种分布组间差异不明显,表明贵州猕猴桃采后贮藏病果中真菌群落结构相似。
前人分析我国湖南省“红阳”、贵州省“贵长”猕猴桃采后优势微生物为间座壳菌属、葡萄座腔菌科、座囊菌纲等[17,21],这与本文的高通量测序结果不完全一致,致病真菌差异可能与产地有关。通过相关性分析发现,“贵长”猕猴桃种植县的降雨量均大于“红阳”猕猴桃,其病果子囊菌门的平均相对丰度值也高于“红阳”猕猴桃。降雨量过大时,会导致采后猕猴桃真菌多样性降低。李黎等[30]研究发现猕猴桃致病菌在早春花期时侵染花蕾,随后侵染幼果并释放孢子,随着风雨的传播,进一步侵染果实导致腐烂。而猕猴桃果实在采收期易受降雨影响,是真菌病害的发病高峰期[31]。猕猴桃采后侵染病害不仅与花期、幼果期、采收期降雨量有关,也是我国猕猴桃种植端和运输过程中长期存在的问题。因此,为解决猕猴桃侵染病害问题,可以在种植端适量使用合理的杀菌剂或套袋处理抑制优势致病真菌的菌丝生长、孢子萌发等,减少贮藏期间的致病优势菌生长,保持猕猴桃果实表面的真菌多样性,减少病害侵入,从而减少其在种植端、运输端等方面的损失。同时,对具有潜在危险性的致病真菌重点防控,并结合真菌代谢组学、猕猴桃果实代谢组学、现代保鲜技术等手段和方法,对猕猴桃果实在贮藏过程中的生理特性进行分析研究。探寻猕猴桃在贮藏过程的抗性机理,提高果实防御能力。
本研究采用高通量测序技术,探讨了贵州省6个县10个果园的“贵长”“红阳”猕猴桃采后贮藏腐烂部位的真菌群落结构多样性差异,发现“贵长”猕猴桃果实贮藏腐烂部位真菌多样性和丰度较“红阳”丰富。推测原因为“红阳”猕猴桃果实在种植过程中套袋所致。两个品种腐烂部位真菌在门水平上,优势门为子囊菌门。“贵长”“红阳”猕猴桃采后贮藏致腐真菌主要优势属为葡萄孢属、镰刀菌属、间座壳菌属。通过PCA发现,贵州省的“贵长”“红阳”品种采后冷藏腐烂部位的真菌群落较为相似。对比采集样品所在地的气象条件,推测贵州猕猴桃真菌多样性与降雨量有关,降雨量与猕猴桃果实多样性成反比,与猕猴桃果实致病菌的相对丰度成正比,当降雨量较大时,会提高果实贮藏侵染病害发生几率。为贵州“贵长”“红阳”猕猴桃侵染病害的致病真菌防控新方法研究提供理论依据。
[1] LEE I, IM S, JIN C R, et al.Effect of maturity stage at harvest on antioxidant capacity and total phenolics in kiwifruits (Actinidia spp.) grown in Korea[J].Horticulture, Environment, and Biotechnology, 2015, 56(6):841-848.
[2] 姜志强, 贾东峰, 廖光联, 等.中国育成的猕猴桃品种(系)及其系谱分析[J].中国南方果树, 2019, 48(6):142-148.
JIANG Z Q, JIA D F, LIAO G L, et al.Kiwifruit varieties (lines) bred in China and their pedigree analysis[J].South China Fruits, 2019, 48(6):142-148.
[3] 方春英, 金忠秀, 尹莉.贵州猕猴桃产业蝶变升级[N].贵州日报, 2021-10-07(2).
FANG C Y, JIN Z X, YI L.Guizhou kiwifruit industry butterfly upgrade[N].Guizhou Daily, 2021-10-07(2).
[4] 吴麒宇, 祁春节, 程运江, 等.COVID-19新冠疫情对全球猕猴桃商贸影响剖析[J].果树学报, 2021, 38(10):1790-1801.
WU Q Y, QI C J, CHENG Y J, et al.Impact of the COVID-19 on global trade of kiwifruit[J].Journal of Fruit Science, 2021, 38(10):1790-1801.
[5] 韩世明, 高成密, 张佳乐, 等.贵州省猕猴桃产业发展问题及对策[J].农业技术与装备, 2022(1):61-64.
HAN S M, GAO C M, ZHANG J L, et al.Problems and countermeasures in the development of kiwifruit industry in Guizhou Province[J].Agricultural Technology &Equipment, 2022(1):61-64.
[6] MANNING M A, MEIER X, OLSEN T L, et al.Fungi associated with fruit rots of Actinidia chinensis ‘Hort16A’ in New Zealand[J].New Zealand Journal of Crop and Horticultural Science, 2003, 31(4):315-324.
[7] 张辉, 马超, 彭熙, 等.红阳猕猴桃采后生理及病害研究进展[J].广东化工, 2017, 44(3):107-108;129.
ZHANG H, MA C, PENG X, et al.Advances of research on postharvest physiology and disease of Hongyang kiwifruit[J].Guangdong Chemical Industry, 2017, 44(3):107-108;129.
[8] SPADARO D, GALLIANO A, PELLEGRINO C, et al.Dry matter, mineral composition, and commercial storage practices influence the development of skin pitting caused by Cadophora luteo-olivacea on kiwifruit ‘Hayward’[J].Journal of Plant Pathology, 2010, 92(2):349-356.
[9] D AZ G A, LATORRE, B A, JARA, S, et al.First report of Diaporthe novem causing postharvest rot of kiwifruit during controlled atmosphere storage in Chile[J].Plant Disease, 2014, 98(9):1274.
AZ G A, LATORRE, B A, JARA, S, et al.First report of Diaporthe novem causing postharvest rot of kiwifruit during controlled atmosphere storage in Chile[J].Plant Disease, 2014, 98(9):1274.
[10] KOH Y J, JUNG J S, HUR J S.Current status of occurrence of major diseases on kiwifruits and their control in Korea[J].Acta Horticulturae, 2003(610):437-443.
[11] LUONGO L, SANTORI A, RICCIONI L, et al.Phomopsis sp.associated with post-harvest fruit rot of kiwifruit in Italy[J].Journal of Plant Pathology, 2011, 93(1):205-209.
[12] LI L, PAN H, LIU W, et al.First report of Alternaria alternata causing postharvest rot of kiwifruit in China[J].Plant Disease, 2017, 101(6):1046.
[13] 冯丽, 魏洪, 黄亚励, 等.贵长猕猴桃腐烂菌的侵染途径及分离鉴定[J].中国酿造, 2018, 37(2):66-70.
FENG L, WEI H, HUANG Y L, et al.Infection pathway and identification of pathogenic fungi from Guichang kiwifruit[J].China Brewing, 2018, 37(2):66-70.
[14] 雷霁卿, 吴文能, 刘颖, 等.贵州六盘水地区“红阳”猕猴桃软腐病病原菌分离鉴定及致病力差异测定[J].北方园艺, 2019(4):31-38.
LEI J Q, WU W N, LIU Y, et al.Identification of pathogen isolation and pathogenicity difference of ‘HongYang’ kiwifruit ripe rot in Liupanshui city, Guizhou Province[J].Northern Horticulture, 2019(4):31-38.
[15] 吴文能, 张起, 雷霁卿, 等.“贵长”猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J].北方园艺, 2018(16):47-54.
WU W N, ZHANG Q, LEI J Q, et al.Identification and pharmaceutical screening of kiwifruit soft rot disease on ‘Guichang’ gooseberry[J].Northern Horticulture, 2018(16):47-54.
[16] 姜景魁, 高日霞, 林尤剑.中华猕猴桃黑斑病的研究[J].果树科学, 1995, 12(3):182-184.
JIANG J K, GAO R X, LIN Y J. Study on black spot of Actinidia chinensis[J]. Journal of Fruit Science, 1995, 12(3):182-184.
[17] 石浩, 王仁才, 王芳芳, 等.软腐猕猴桃果实真菌类病原菌的生物多样性分析[J].现代食品科技, 2020, 36(4):126-137.
SHI H, WANG R C, WANG F F, et al.Biodiversity analysis of fungal pathogens from soft-rotting kiwifruit[J].Modern Food Science and Technology, 2020, 36(4):126-137.
[18] ZHIMO V Y, KUMAR A, BIASI A, et al.Compositional shifts in the strawberry fruit microbiome in response to near-harvest application of Metschnikowia fructicola, a yeast biocontrol agent[J].Postharvest Biology and Technology, 2021, 175:111469.
[19] ANGELI D, SARE A R, JIJAKLI M H, et al.Insights gained from metagenomic shotgun sequencing of apple fruit epiphytic microbiota[J].Postharvest Biology and Technology, 2019, 153:96-106.
[20] ZHANG Q, SHI W C, ZHOU B, et al.Variable characteristics of microbial communities on the surface of sweet cherries under different storage conditions[J].Postharvest Biology and Technology, 2021, 173:111408.
[21] 刘娜, 谢国芳, 袁孟孟, 等.猕猴桃软腐病发病过程内生真菌多样性分析[J].食品科技, 2020, 45(4):31-36.
LIU N, XIE G F, YUAN M M, et al.Diversity of endophytic fungal in the pathogenesis of soft rot in kiwifruit[J].Food Science and Technology, 2020, 45(4):31-36.
[22] TANG J M, LIU Y Q, LI H H, et al.Combining an antagonistic yeast with harpin treatment to control postharvest decay of kiwifruit[J].Biological Control, 2015, 89:61-67.
[23] MICHAILIDES T J, ELMER P A G.Botrytis gray mold of kiwifruit caused by Botrytis cinerea in the United States and New Zealand[J].Plant Disease, 2000, 84(3):208-223.
[24] 封露, 陈凡可, 林杨, 等.我国主产区猕猴桃采后腐烂病病原多样性研究[J].植物病理学报, 2022, 52(1):1-8.
FENG L, CHEN F K, LIN Y, et al.Pathogen diversity of postharvest diseases of kiwifruit at major cultivation areas in China[J].Acta Phytopathologica Sinica, 2022, 52(1):1-8.
[25] 付博, 王家哲, 任平, 等.陕西省猕猴桃黑斑病病原菌鉴定[J].植物病理学报, 2020,50(1):112-116.
FU B, WANG J Z, REN P, et al.Identification of the pathogen causing black spot on kiwifruit in Shaanxi Province[J].Acta Phytopathologica Sinica, 2020,50(1):112-116.
[26] 周英, 李庚花, 胡叶开, 等.奉新猕猴桃黑斑病病原菌鉴定及室内药剂筛选[J].江西农业大学学报, 2020, 42(1):48-56.
ZHOU Y, LI G H, HU Y K, et al.Identification of pathogen causing kiwifruit black spot in Fengxin county and screening of controlling fungicides in laboratory[J].Acta Agriculturae Universitatis Jiangxiensis, 2020, 42(1):48-56.
[27] YANG C, WU Z Q, QI H, et al.Fusarium solani, a new pathogen causing postharvest fruit rot on kiwifruit (Actinidia deliciosa) in China[J].Plant Disease, 2018, 102(2):443-443.
[28] LI L, PAN H, CHEN M Y, et al.Isolation and identification of pathogenic fungi causing postharvest fruit rot of kiwifruit (Actinidia chinensis) in China[J].Journal of Phytopathology, 2017, 165(11-12):782-790.
[29] 贵州省气象局. 中国气象网[EB/OL].2021-10-10.http://gz.cma.gov.cn/.
Guizhou Meteorological.China Meteorological Administration[EB/OL].2021-10-10.http://gz.cma.gov.cn/.
[30] 李黎, 潘慧, 邓蕾, 等.猕猴桃真菌性软腐病的发生规律及综合防治技术[J].中国果树, 2020(6):1-5.
LI L, PAN H, DENG L, et al.Occurrence rule and comprehends control of kiwifruit rot disease[J].China Fruits, 2020(6):1-5.
[31] 赵英杰. 猕猴桃园秋季病虫害的防治[J].落叶果树, 2009, 41(5):40-40.
ZHAO Y J. Control of diseases and pests in kiwifruit orchard in autumn[J]. Deciduous Fruits, 2009, 41(5):40-40.