橄榄是我国珍贵的药食两用资源,具有较高的营养价值和药用价值,橄榄中含有丰富的裂环烯醚萜类化合物[1],当暴露在光照、高温、碱性和酸性环境中时,很容易分解为黄酮[2]。橄榄黄酮具有防治肝病[3]、抗炎症[4]、抗氧化[5]、抗病毒[6]和解毒[7]等药理功效,在现代生物化学、日用化学品、制药行业、食品行业以及精细化工等领域都有广泛的应用。目前,尚未有对橄榄仁红皮中的黄酮类化合物的研究。
提取黄酮类化合物的常见方法包括有机溶剂萃取法、超声辅助提取法、微波辅助提取法以及酶法辅助提取法[8]等。酶法辅助提取中使用的酶脆弱且易失活导致提取成本较高[9]。刘玉红[10]采用超声和微波2种技术分别提取橄榄总黄酮,其得率均不足2%。CHENG等[11]采用75%(体积分数)乙醇-水溶液提取甘草中的黄酮类化合物,并对其结构进行鉴定,研究表明了乙醇-水溶液提取的黄酮类化合物活性较高。
本文以橄榄仁红皮为研究对象,采用乙醇-水溶液进行萃取,在单因素的基础上通过响应面分析方法得到橄榄仁红皮黄酮类化合物(flavonoid from red skin of olive kernel, FRSOK)最佳提取工艺,采用液相色谱-质谱联用(liquid chromatograph-mass spectrometer,LC-MS)技术对最优条件下提取液中黄酮类化合物进行分析,从DPPH自由基清除率、羟自由基清除率以及超氧阴离子自由基清除率三方面测定黄酮类化合物的抗氧化活性,以提高FRSOK得率,为进一步开展植物黄酮的研究和开发应用打下基础。
1 材料与方法
1.1 材料与试剂
油橄榄仁红皮,广东省云浮市郁南县;芦丁(分析纯),阿拉丁试剂有限公司;无水乙醇(分析纯),上海沃凯生物技术有限公司;磷酸二氢钠、磷酸氢二钠、硫酸亚铁(分析纯),上海凌峰化学试剂有限公司;氯化铝·六水、30%过氧化氢、福林酚试剂、去离子水(H2O)、氢氧化钠、硫酸亚铁、三羟甲基氨基甲烷(Tris)、水杨酸、邻苯三酚、DPPH、抗坏血酸、邻二氮菲(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
721 N可见光分光光度计,上海仪电分析仪器有限公司;MDF-U5412低温冰箱,三洋电机株式会社;SHB-ⅢA环水式真空泵,上海聚昆仪器设备有限公司;100~1 000 mL移液枪,Shanghai jiaan Analyzer Factory;DF-Ⅱ数显集热式磁力搅拌器,金坛市杰瑞尔电器有限公司;UV-3600紫外可见近红外分光光度计,岛津企业管理(中国)有限公司;ATY224精密电子天平,常州万泰天平仪器有限公司;Tissuelyser-48高通量组织破碎仪,上海净信;Q Exactive质谱仪、Reacti-thermo氮气吹扫仪,Thermo;Acquity UPLC,Waters;XH-T漩涡混合器,新宝仪器。
1.3 实验方法
1.3.1 提取试验
具体操作参考文献[12],修改如下:
通过粉碎机将橄榄仁红皮破碎成粉,过80目筛备用。称取5.00 g红皮粉于烧杯中,加入乙醇-水溶液,保鲜膜封口,放入恒温磁力搅拌机中,按不同提取要求进行单因素试验和响应面实验。浸提完毕后进行抽滤,抽滤得到上清液即为提取液。将提取液在温度55 ℃,转速50 r/min下进行旋转蒸发,去除多余的乙醇后得到浓缩液,冻干保存得到粗橄榄仁红皮提取物粉末。
1.3.2 单因素试验
对FRSOK提取的影响因素:料液比(g∶mL)为m(橄榄仁红皮)∶V(乙醇)=1∶5~1∶25、提取时间5~35 min、乙醇体积分数0%~100%、提取温度25~65 ℃进行单因素试验,称取5.0 g FRSOK粉末,采用控制变量法,对总黄酮类化合物进行提取并计算得率,如公式(1)所示:
橄榄仁红皮黄酮类化合物得率![]()
(1)
式中:m1,提取液中黄酮含量,g;m2,橄榄仁红皮质量,g。
1.3.3 响应面优化测试
根据“1.3.2节”单因素试验结果,选择提取时间、提取温度、乙醇体积分数以及料液比为因子,以黄酮提取量为响应值,利用Design-Expret8.0.6软件分别对橄榄仁红皮进行曲面响应试验,得到二元多项式回归方程,进行重复试验。
1.3.4 检测方法
1.3.4.1 橄榄仁红皮总黄酮含量的测定
FRSOK含量的测定方法参考文献[13],修改如下:取10 mg芦丁标准品配制50 mg/mL对照液,稀释成0.0~50.0 mg/mL不同质量浓度梯度,再加入5 mL 10 g/L AlCl3溶液,摇匀后静置10 min,以吸光度值(y)为纵坐标,芦丁含量(x)为横坐标在415 nm处测定吸光度并绘制标准曲线图。取200 mL样品溶液加30%(体积分数)乙醇-水溶液定容至5 mL再加入5 mL 10 g/L AlCl3溶液,摇匀后静置10 min,在415 nm 处测定吸光度,可计算出样品液中总黄酮含量。
1.3.4.2 超声辅助实验对比
根据单因素试验结果设计超声辅助实验:称取5.00 g橄榄仁红皮粉于烧杯中,加入25 mL蒸馏水,分别超声5、10、15、20、25、30 min后,加入25 mL的无水乙醇,转入恒温磁力搅拌器中浸提30 min,均在恒温55 ℃下浸提。在分别按照“1.3.4.1节”的检测方法进行检测,做3组平行实验,取平均值。此基础上比较超声辅助时间对FRSOK提取量影响。
1.3.5 抗氧化能力测定
1.3.5.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定试验参照文献[14],稍作改进。样品为2 mL FRSOK溶液(0.02、0.03、0.04、0.05、0.06、0.12、0.24 mg/mL)和2 mL 0.1 mmol/L DPPH自由基溶液(95%乙醇溶解)。空白为95%乙醇2 mL+0.1 mmol/L DPPH自由基2 mL。室温下,避光反应30 min,用分光光度计在517 nm处测定。DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A样、A0分别代表样品和空白的吸光度。
1.3.5.2 羟自由基(·OH)清除能力测定
·OH清除能力测定试验方法参照文献[15],稍作改进。混合物由4 mL 1,10-菲啰啉(5 mmol/L)和4 mL FeSO4(5 mmol/L)组成,然后加入3 mL磷酸盐缓冲液(16 mL 0.2 mol/mL磷酸二氢钠+84 mL 0.2 mol/mL磷酸氢二钠配制,pH=7.4),再加入3 mL H2O2(0.01%)和4 mL FRSOK样品液,将混合液摇匀后静置1 h,在536 nm处测量吸光度。对照:用蒸馏水代替FRSOK溶液,其他试剂与样品相同。空白:用蒸馏水代替H2O2,其他试剂与样品相同。·OH清除率计算如公式(3)所示:
羟自由基清除率![]()
(3)
式中:A样、A损和A0分别代表样品、对照和空白的吸光度。
1.3.5.3 超氧阴离子自由基清除
参考文献[16],修改如下,取1.5 mL样品液,再分别按顺序加入0.5 mL 0.30 mmol/L氯化硝基四氮唑蓝(pH 8.0 Tris-HCl配制)、0.5 mL 0.468 mmol/L NADH(pH 8.0 Tris-HCl配制)和0.5 mL 0.060 mmol/L吩嗪硫酸甲酯(pH 8.0 Tris-HCl配制),混合均匀后在25 ℃水浴5 min。测定其波长在560 nm处的吸光度,超氧阴离子自由基清除率计算如公式(4)所示:
超氧阴离子自由基清除率![]()
(4)
式中:A样和A0分别代表样品和空白的吸光度。
1.3.5.4 半抑制浓度(IC50)计算
按公式(5)计算IC50值:
(5)
式中:Xm代表样品最大浓度的对数,I代表样品最大浓度与样品相邻浓度之比的对数,P、Pm和Pn分别代表样品浓度之和、样品最大浓度和样品最小浓度。
1.3.6 组成分析
基于LC-MS非靶向的方式进行检测[17],重复3次,所得到的数据供生物信息学分析,最终得出代谢物。代谢物的鉴定首先根据精确分子质量进行确认(分子质量误差为≤30 ppm),后续根据MS/MS碎片模式对Human Metabolome Database、METLIN、Massbank、mzClound以及帕诺米克自建的标准品数据库进行确认注释获得代谢物。
采用Thermo超高效液相系统(Vanquish,USA),根据化合物的性质,采用Waters HSS T3(100 mm×2.1 mm,1.8 mm)液相色谱柱,进样量2 mL,柱温40 ℃;流动相A(0.1%甲酸-乙腈,体积分数),流动相B(0.1%甲酸-水,体积分数)。流动相梯度如表1所示。
表1 流动相梯度表
Table 1 Mobile phase gradient
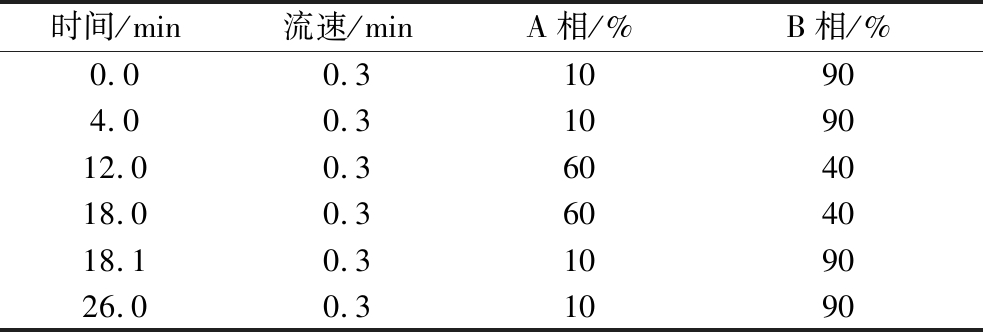
时间/min流速/minA相/%B相/%0.00.310904.00.3109012.00.3604018.00.3604018.10.3109026.00.31090
质谱采用的是美国Thermo公司的Qexactive高分辨质谱检测系统,配有电喷雾离子源(ESI)和Xcalibur工作站。采用ESI分析物在正离子同时扫描下以Full-scan-ms2模式进行分析。优化的质谱分析条件如下:鞘气40;辅助气10;离子喷雾电压+3 000 V;温度350 ℃;离子传输管温度320 ℃。
1.4 数据处理
提取试验和单因素试验采用Microsoft Excel进行数据处理;响应面优化测试利用Design-Expret 8.0.6对数据进行分析。
2 结果与分析
2.1 总黄酮标准曲线的绘制
根据“1.3.4.1节”给出的FRSOK标准曲线的绘制方法进行绘制,取3 mL置于10 mm比色皿中于415 nm处进行检测,绘制芦丁标准曲线如图1。
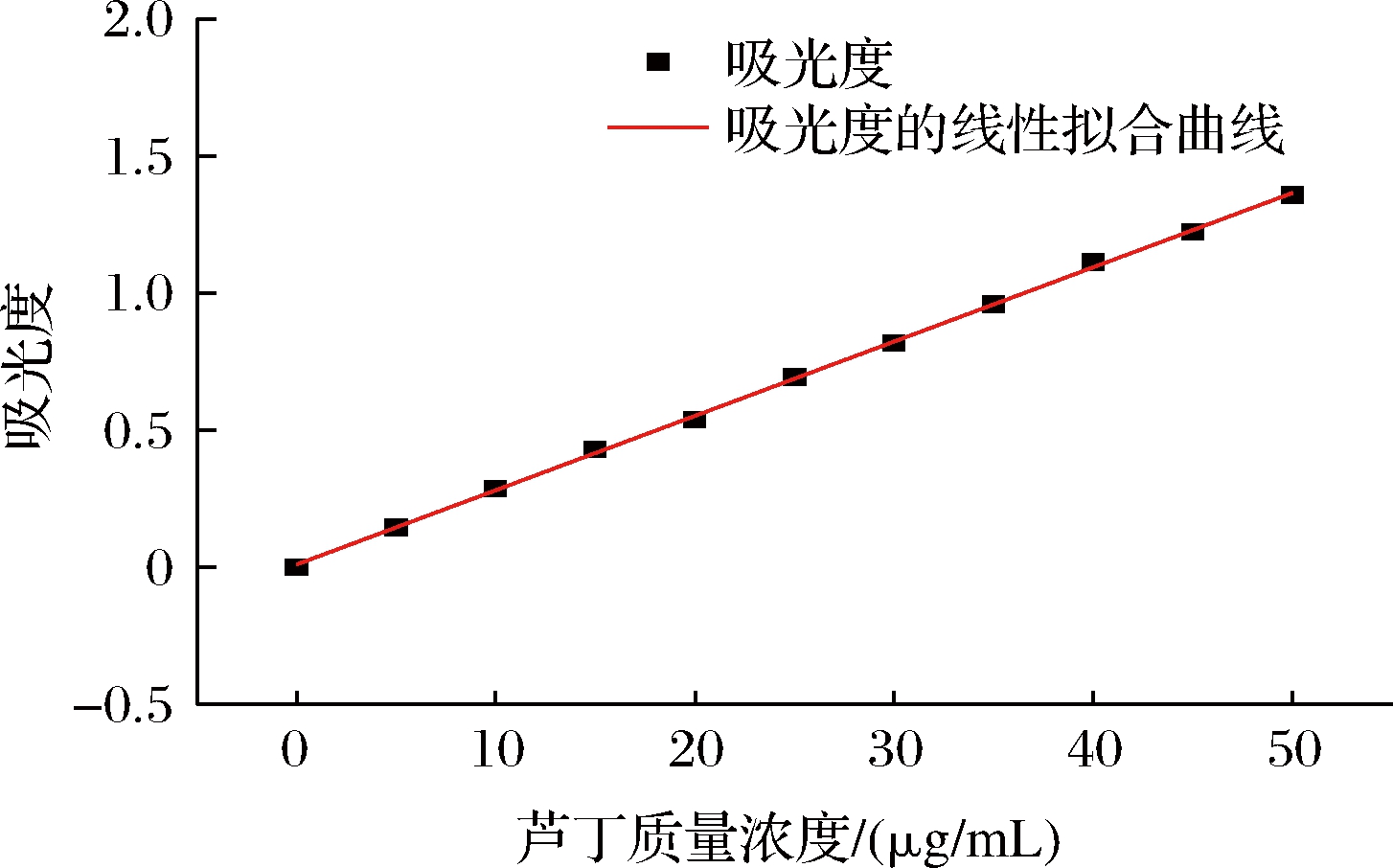
图1 芦丁标准曲线
Fig.1 Rutin standard curve
由总黄酮标准曲线图可知,芦丁对照品溶液在0.00~50.00 mg/mL内,吸光度值与质量浓度呈良好的线性关系,回归方程为:y=(0.027 1±0.000 20)x+(0.010 39±0.005 96),调整后R2=0.999 45。
2.2 单因素试验结果
FRSOK含量的提取受到料液比、乙醇体积分数、提取温度以及提取时间的影响,各因素对其影响关系通过单因素试验表明。取5.0 g橄榄仁红皮粉末于100 mL烧杯中,分别按照“1.3.2节”中条件进行实验,结果如图2所示。
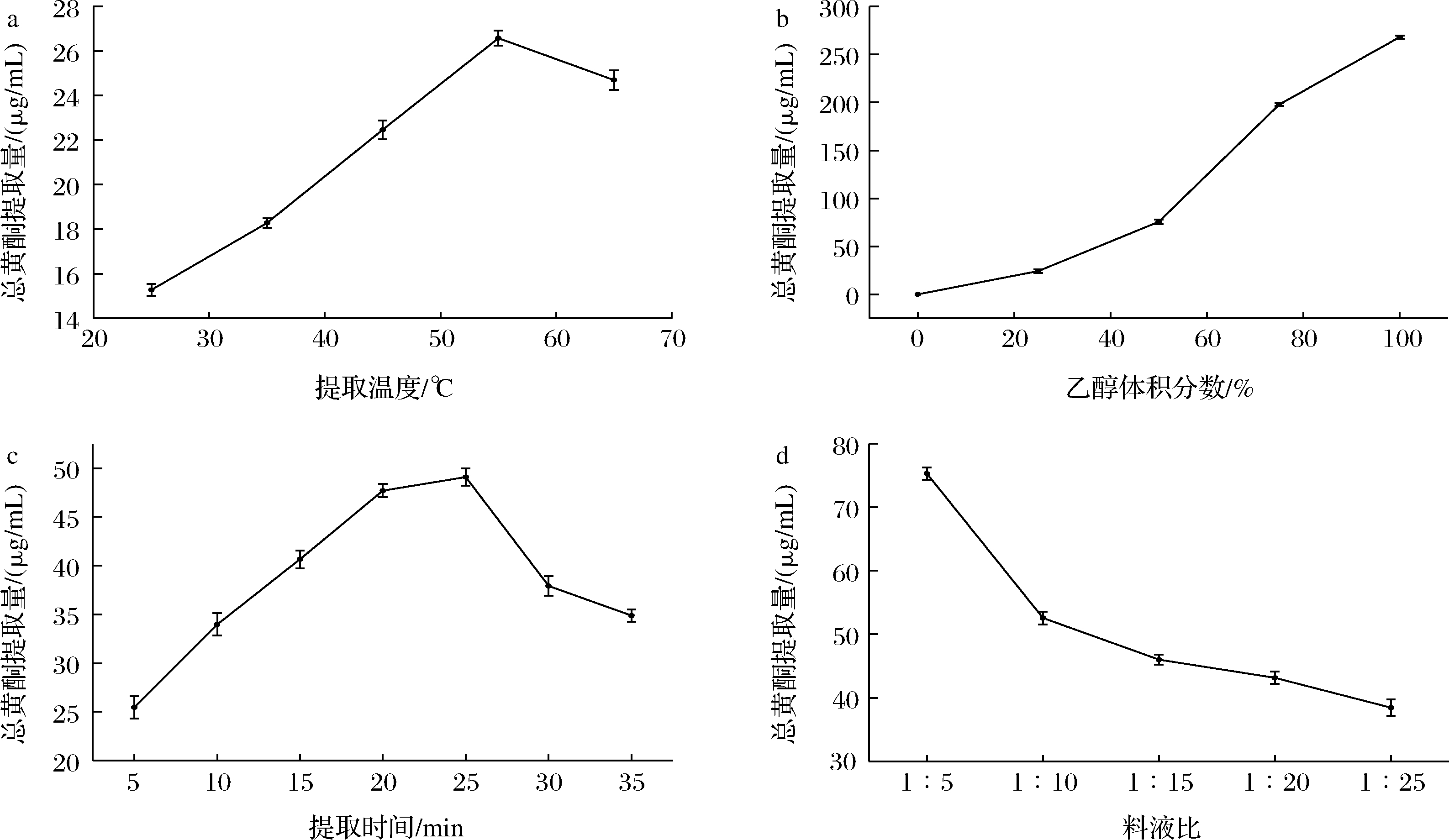
a-提取温度;b-乙醇体积分数;c-提取时间;d-料液比
图2 提取温度、乙醇体积分数、提取时间和料液比对总黄酮提取含量的影响
Fig.2 Effects of extraction temperature, ethanol volume fraction, extraction time, and solid-liquid ratio on the extraction content of total flavonoids
如图2-a所示,由于黄酮类化合物中含有酚羟基结构,适当的温度可以激活·OH,但过高的温度会使其氧化分解,55 ℃后黄酮类化学物的结构遭到破坏,导致含量降低。最终提取温度选择55 ℃。
如图2-b所示,黄酮类物质为典型的有机化合物,易溶于有机试剂,因而提高乙醇体积分数,总黄酮的提取量也会随之升高。黄酮类化合物的抗氧化活性受乙醇的影响,如图3所示,当乙醇体积分数达到75%时,·OH清除率达到最大值,过高的乙醇体积分数导致大量有机杂质被溶出并挤占黄酮分子的溶出空间,从而导致活性有所下降[18]。最终萃取剂选择为75%乙醇-水溶液。
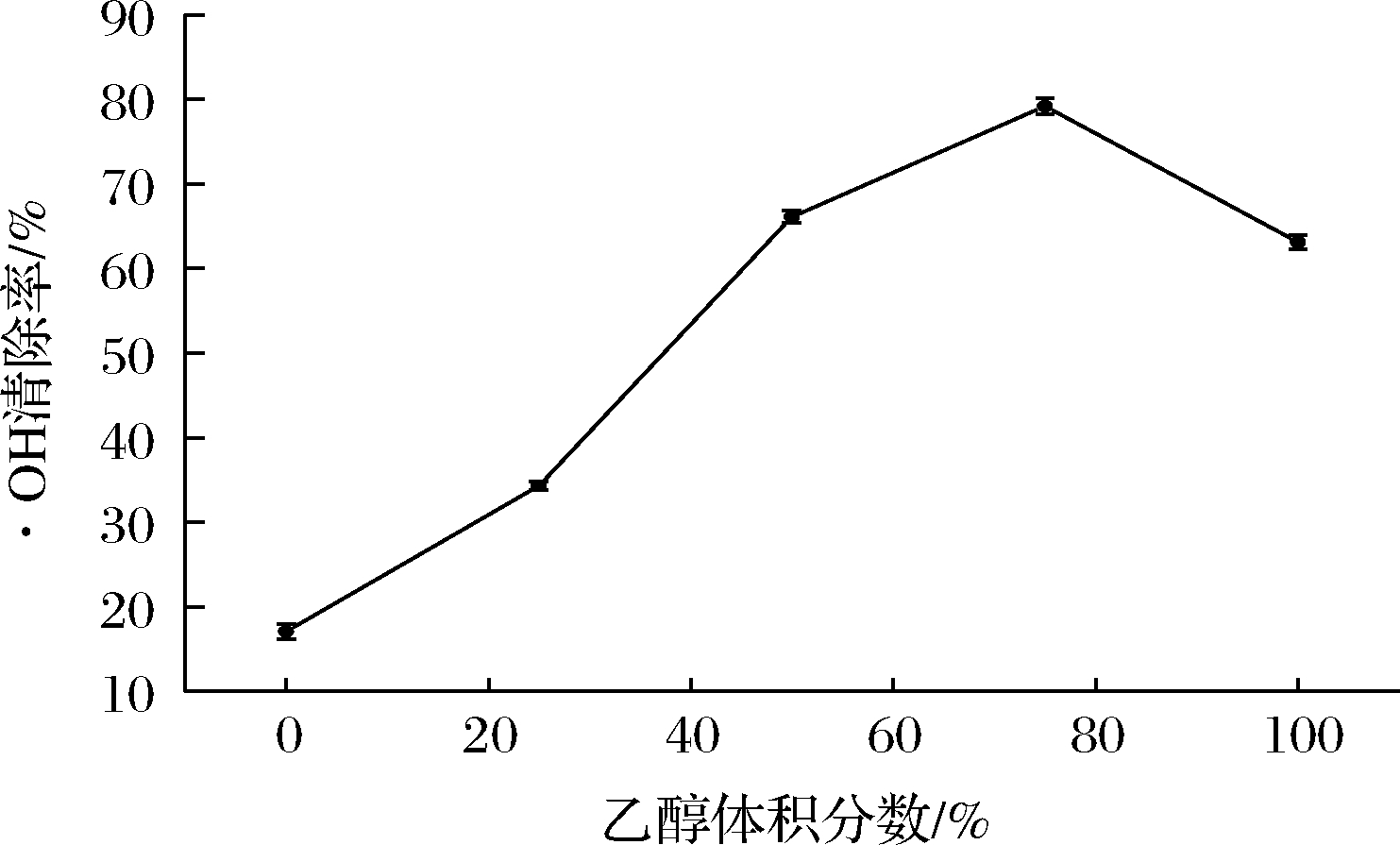
图3 ·OH清除率与乙醇体积分数的关系图
Fig.3 Relationship between ·OH radical scavenging rate and ethanol volume fraction
如图2-c所示,提取时间在30 min时,提取率达到峰值,超过30 min有所下降,可能是由于时间的延长,黄酮类化合物中酚羟基结构遭到破坏分解为杂质,提取率下降[19],乙醇溶剂的挥发也会导致黄酮分子与乙醇接触变得不充分,因此提取率随着温度升高有所下降[20]。最终选择提取时间为30 min。
如图2-d所示,提取量随着浸提溶剂量的增加而减少。由于FRSOK具有易溶于乙醇的性质,所以在料液比较小的时候,溶液中的黄酮类化合物很快溶出达到饱和。考虑到随着浸提溶剂体积的增加,也会增大浓缩工艺的难度,因此浸提溶剂量不宜过大,采用料液比(g∶mL)为1∶10最为合适。
2.3 响应面实验结果
响应面试验的因素水平取值由单因素试验得出,选择FRSOK的提取时间,提取温度和乙醇体积分数为因子,以FRSOK提取量为响应值,建立3因素3水平的响应面设计试验,共17个试验点(表2)。
表2 响应面实验因素水平表
Table 2 Level of response surface experimental factors

水平因素A(提取温度)/℃B(乙醇体积分数)/%C(提取时间)/min-145252505550301657535
利用Design-Expret 8.0.6软件分别对橄榄仁红皮进行曲面响应试验,得到二元多项式回归方程,探索FRSOK提取的最优条件每次试验重复3次,结果见表3。
表3 响应面实验设计
Table 3 Response surface experimental design
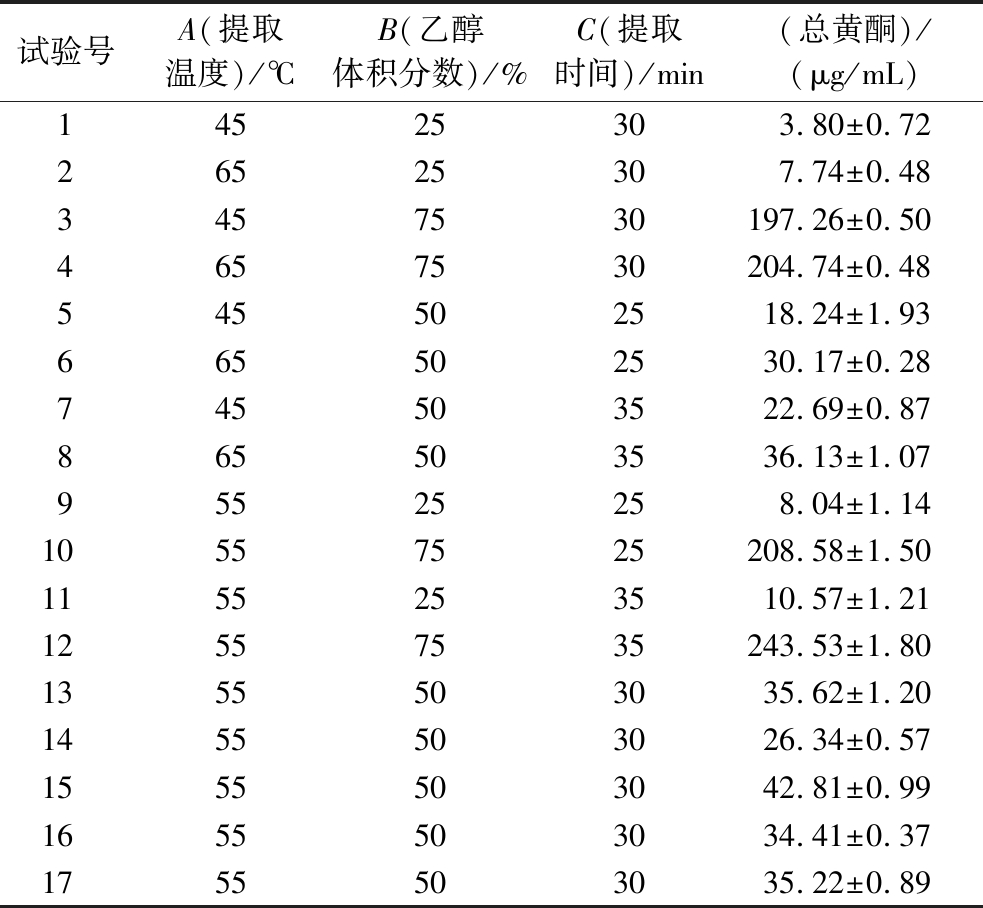
试验号A(提取温度)/℃B(乙醇体积分数)/%C(提取时间)/min(总黄酮)/(μg/mL)14525303.80±0.7226525307.74±0.483457530197.26±0.504657530204.74±0.48545502518.24±1.93665502530.17±0.28745503522.69±0.87865503536.13±1.0795525258.04±1.1410557525208.58±1.501155253510.57±1.2112557535243.53±1.801355503035.62±1.201455503026.34±0.571555503042.81±0.991655503034.41±0.371755503035.22±0.89
利用 Design-Expert 软件进行多元次拟合分析,得出总黄酮提取量与浸提温度、乙醇体积分数以及提取时间为变量的相关回归方程为:
Y(总黄酮提取量)=34.88+4.60×A+103.00×B+5.99×C+0.38×A×C+8.10×B×C-11.18×A2+79.69×B2+3.11×C2
由表4可知,模型的 F=231.33,P<0.000 1,表明该模型具有极显著性,失拟差为2.56,说明有19.19%可能会因为各种因素影响导致模型不吻合,因而该模型拟合程度较好,实验误差小,可用此模型对FRSOK进行预测和分析。二次项中B2的“P>F”值小于0.01,A2的“P>F”值小于0.05,C2的“P>F”值大于0.05,所以二次项对总黄酮提取率的影响大小依次为B2>A2>C2。
表4 回归模型的方差分析及显著性结果
Table 4 Analysis of variance and significance results of regression model
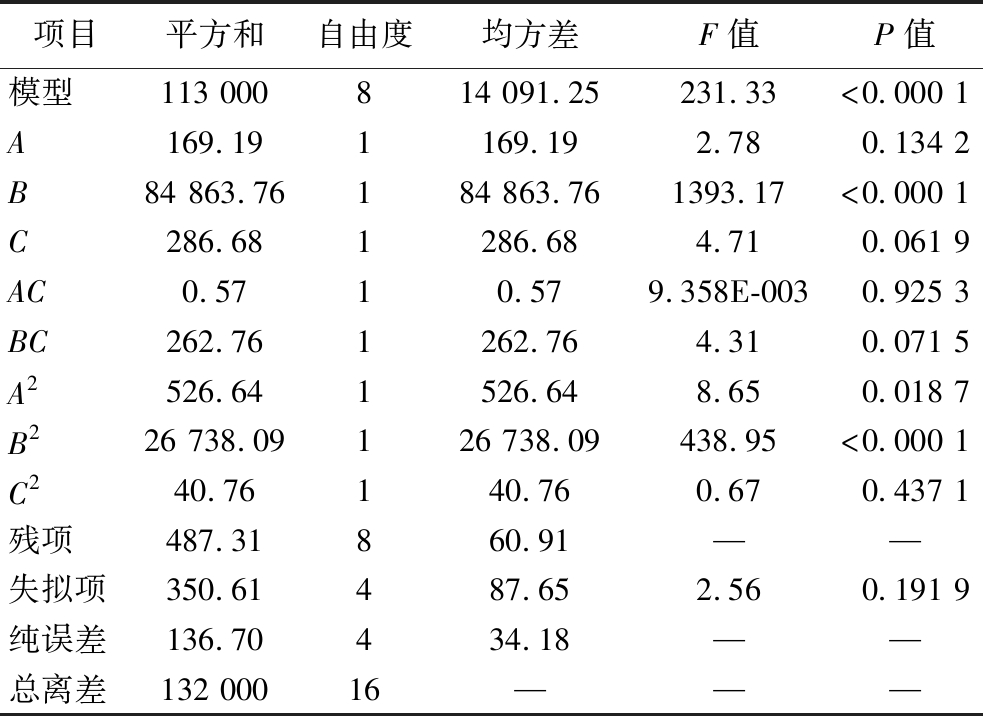
注:—表示无数据。
项目平方和自由度均方差F值P值模型113 000814 091.25231.33<0.000 1A169.191169.192.780.134 2B84 863.76184 863.761393.17<0.000 1C286.681286.684.710.061 9AC0.5710.579.358E-0030.925 3BC262.761262.764.310.071 5A2526.641526.648.650.018 7B226 738.09126 738.09438.95<0.000 1C240.76140.760.670.437 1残项487.31860.91——失拟项350.61487.652.560.191 9纯误差136.70434.18——总离差132 00016———
2.4 超声辅助实验对比结果
超声辅助实验根据单因素实验的最佳条件确定,如图4所示,可能在超声过程中溶液挥发,带走部分溶出的黄酮提取物,从而导致总提取量减少,结果显示超声辅助并不能很好的提高提取量。
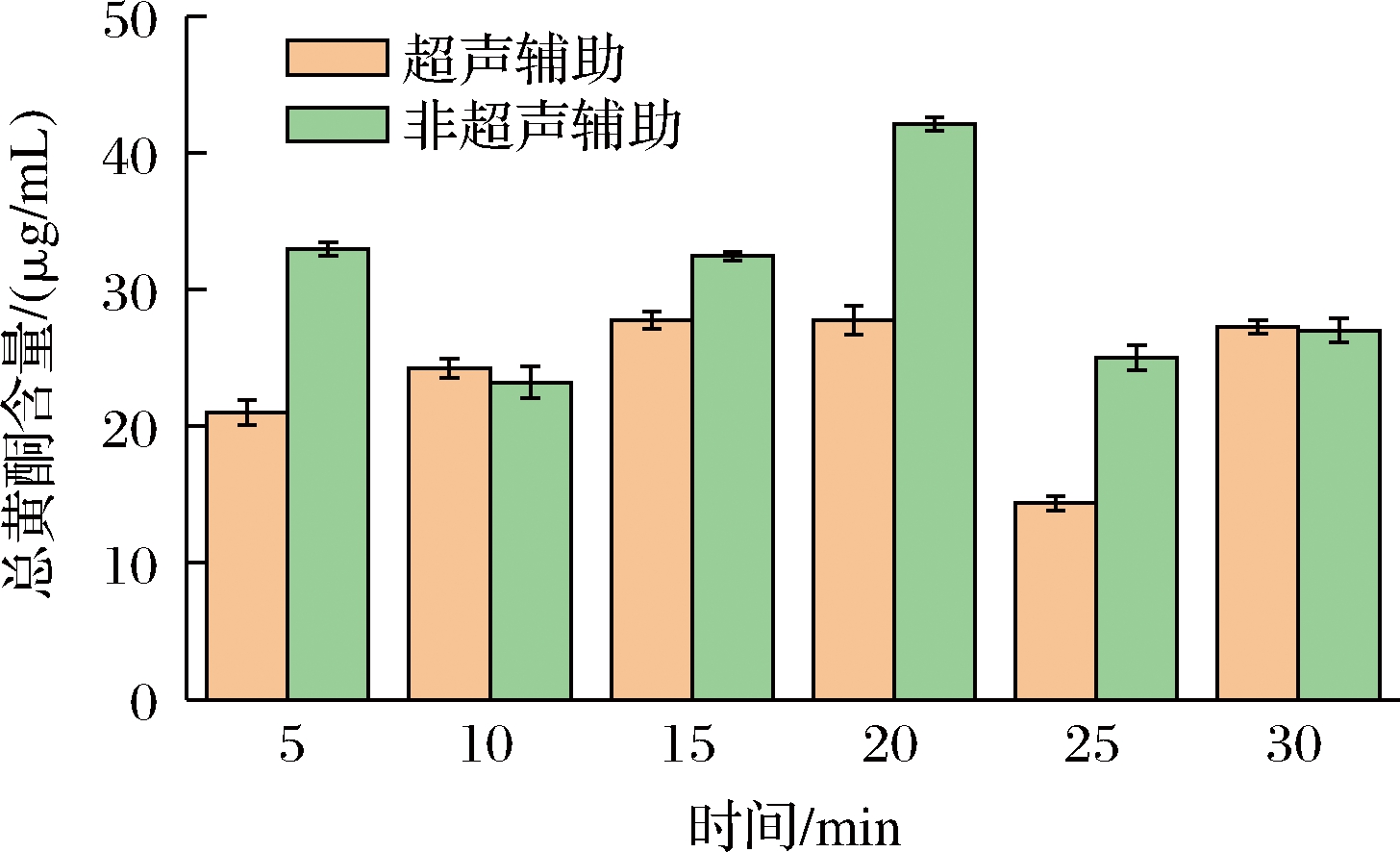
图4 超声辅助与非超声辅助对比图
Fig.4 Comparison between ultrasound assisted and non ultrasound assisted
2.5 抗氧化活性测试结果
由图5-a可知,在所测定质量浓度范围内,维生素C对·OH始终保持很高的清除能力,当质量浓度大于0.07 mg/mL时,清除率几乎接近100%[21]。FRSOK在对·OH的清除率随黄酮含量的增加而提高,样品溶液质量浓度达到0.25 mg/mL时,清除率达到84.88%。采用公式计算分析,测定结果用IC50表示。如表5所示,维生素C清除·OH的IC50为7.2×10-7 mg/mL,如表6所示,FRSOK清除·OH的IC50为0.035 1 mg/mL,说明FRSOK对·OH有较强的清除能力。

a-·OH清除率;b-DPPH清除率;c-超氧阴离子自由基清除率
图5 抗氧化活性测试示意图
Fig.5 Schematic diagram of antioxidant activity test
表5 维生素C清除不同自由基的IC50值
Table 5 IC50 values of vitamin C scavenging different free radicals

自由基趋势线方程相关系数IC50/(mg/mL)·OH(79.72±1.60)+(96.96±17.59)x+(-137.33±31.69)x20.926 667.2×10-7DPPH自由基(99.50±0.19)×(1-e^[-(44.79±0.98)x])0.982 820.004 21超氧阴离子自由基(61.87±0.16)+(13.66±1.63)x+(-17.70±2.84)x20.991 020.002 78
表6 FRSOK清除不同自由基的IC50值
Table 6 IC50 values of olive red skin extract for scavenging different free radicals

自由基趋势线方程相关系数IC50/(mg/mL)·OH(16.27±2.24)+(360.33±24.69)x+(-452.92±44.48)x20.993 140.035 1DPPH自由基(86.63±0.70)×(1-e^[-(45.04±4.10)x])0.778 260.043 52超氧阴离子自由基(90.52±0.38)+(21.19±4.18)x+(-19.93±7.53)x20.984 250.015 28
由图5-b可知,维生素C的DPPH自由基清除能力随质量浓度增加而升高,当质量浓度为0.12 mg/mL时,清除率达到96.11%,继续增大质量浓度清除率无明显变化。FRSOK清除DPPH自由基能力随质量浓度的增加而提高,当质量浓度为0.12 mg/mL时,清除率达到81.52%,此后随着质量浓度的增加,清除率稳定在80%左右。如表5所示,维生素C的IC50=0.004,如表6所示,FRSOK的IC50=0.044,IC50低于10 mg/mL说明该物质具有抗氧化能力,数值越小说明其清除(或还原)能力越强[22],因此说明FRSOK对DPPH自由基有较强的清除能力[23]。
由图5-c可知,在所测定质量浓度范围内,维生素C对超氧阴离子自由基始终保持很高的清除能力,当质量浓度大于0.03 mg/mL时,清除率为91.76%。此后随着抗坏血酸浓度的增加,清除率一直保持较高水平。FRSOK质量浓度含量达到0.03 mg/mL时清除率达到了60%,此后随着黄酮含量的提高,清除率略有上升,含量为0.25 mg/mL时,达到了64.35%,此时达到了最大值。采用公式计算分析,测定结果用IC50表示。如表5所示,维生素C清除超氧阴离子自由基的IC50为0.002 78 mg/mL,如表6所示,FRSOK清除超氧阴离子的IC50为0.015 28 mg/mL。说明FRSOK对超氧阴离子自由基有清除效果。
综上,FRSOK具有较好的清除自由基的能力,具备一定的抗氧化活性。在实验中除超氧阴离子自由基外,其余试剂抗氧化能力随浓度升高而增大,最终趋近于抗坏血酸的抗氧化能力,FRSOK对超氧阴离子自由基的清除还有较大的提升空间。选用市售的A800295 L-抗坏血酸, AR>99.99%(T),售价28元/25 g,FRSOK是将果核表皮回收后进行提取其中的天然黄酮类化合物,提高了资源再利用,且具有较强的清除·OH和DPPH自由基的能力,并均呈一定的量效关系,FRSOK在经济效益方面的优势弥补了其抗氧化活性略低的不足。
2.6 化学组成分析结果
基于LC-MS非靶向的方式进行检测,所得到的数据供生物信息学分析[24],为了有效进行组分分离,采用负离子模式和正离子模式分别进行扫描提取物,最终识别出21种化合物。其鉴定原理如图6所示,其组成分析结果如表7所示(按照含量从高到低排列)。

图6 FRSOK成分分析图
Fig.6 FRSOK component analysis
表7 FRSOK成分组成表
Table 7 Flavonoids in olive red peel
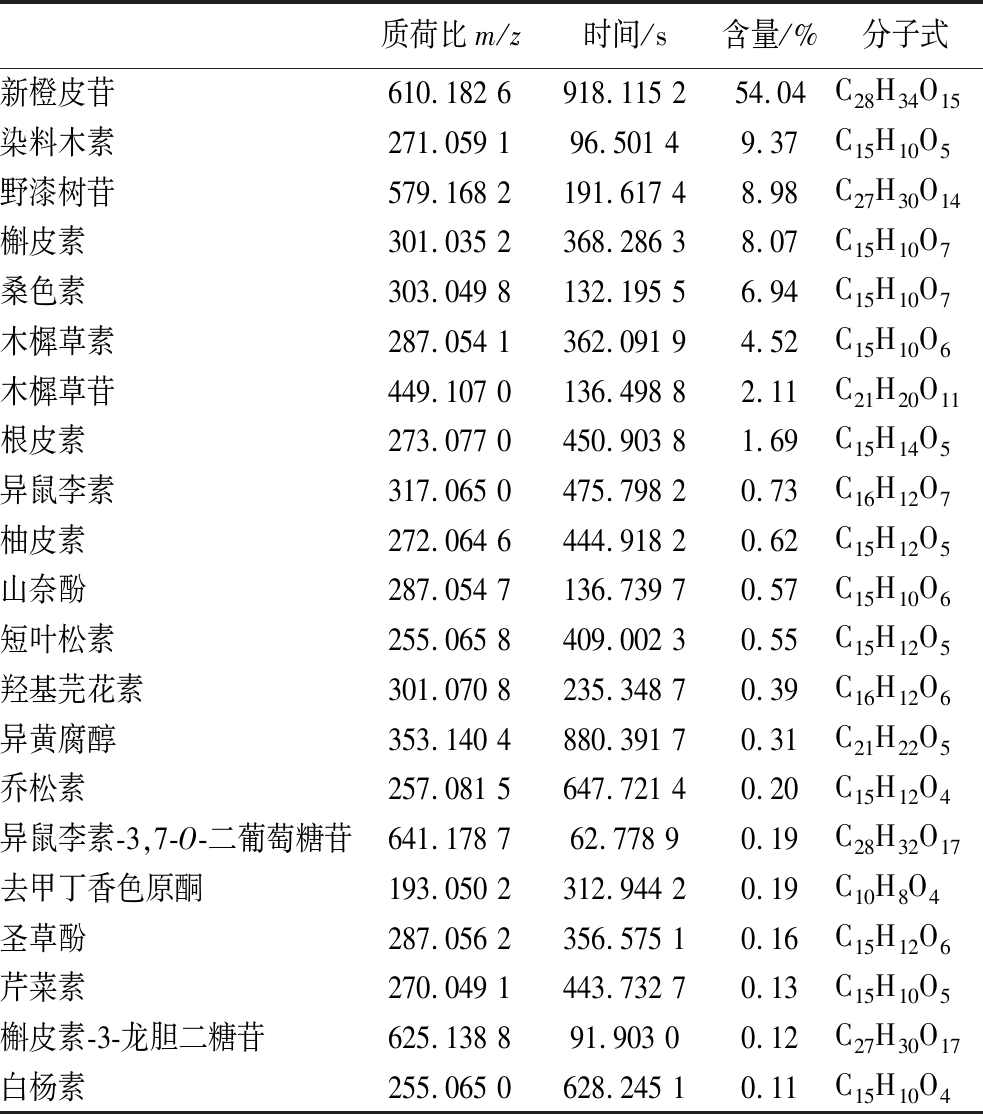
质荷比m/z时间/s含量/%分子式新橙皮苷610.182 6918.115 254.04C28H34O15染料木素271.059 196.501 49.37C15H10O5野漆树苷579.168 2191.617 48.98C27H30O14槲皮素301.035 2368.286 38.07C15H10O7桑色素303.049 8132.195 56.94C15H10O7木樨草素287.054 1362.091 94.52C15H10O6木樨草苷449.107 0136.498 82.11C21H20O11根皮素273.077 0450.903 81.69C15H14O5异鼠李素317.065 0475.798 20.73C16H12O7柚皮素272.064 6444.918 20.62C15H12O5山奈酚287.054 7136.739 70.57C15H10O6短叶松素255.065 8409.002 30.55C15H12O5羟基芫花素301.070 8235.348 70.39C16H12O6异黄腐醇353.140 4880.391 70.31C21H22O5乔松素257.081 5647.721 40.20C15H12O4异鼠李素-3,7-O-二葡萄糖苷641.178 762.778 90.19C28H32O17去甲丁香色原酮193.050 2312.944 20.19C10H8O4圣草酚287.056 2356.575 10.16C15H12O6芹菜素270.049 1443.732 70.13C15H10O5槲皮素-3-龙胆二糖苷625.138 891.903 00.12C27H30O17白杨素255.065 0628.245 10.11C15H10O4
其中,新橙皮苷含量最高为54.04%,分子式为C28H34O15,保留时间为918.115 2 s;其次为染木料素,含量为9.37%,分子式为C15H10O5,保留时间为96.501 4 s。
以含量最多的新橙皮苷为例,新橙皮苷保留时间为918.12 s,理论质荷比m/z为610.18,经过测定其分子式为C28H34O15,其鉴定图如图7所示。新橙皮苷是一种天然的类黄酮化合物,具有抗氧化和抗炎作用,新橙皮苷在人乳腺癌MDA-MB-231细胞中诱导细胞凋亡,在DPPH自由基清除试验中表现出抗氧化活性[25]。新橙皮苷可降低胃分泌和胃酸输出量,使口服葡萄糖耐量和胰岛素敏感性显著提高,同时使糖尿病小鼠的胰岛素抵抗降低,血清甘油三酯、总胆固醇、瘦素水平和肝脏指数显著降低[26]。FRSOK中含有大量的新橙皮苷,在消炎、提高免疫力、抗癌抗氧化方面有良好的作用,提高了橄榄仁红皮的开发利用价值。
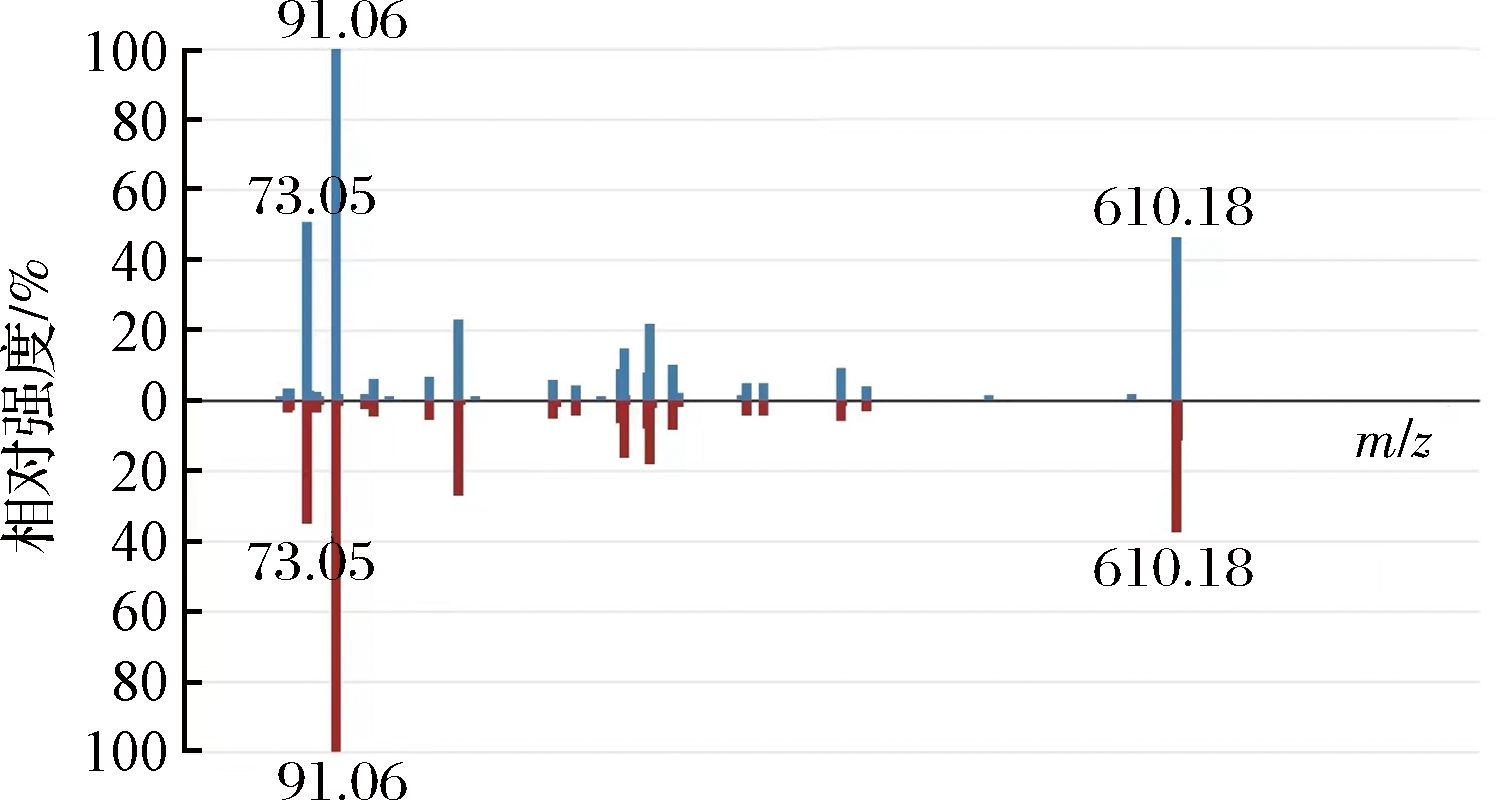
图7 新橙皮苷鉴定分析图
Fig.7 Identification and analysis of neohesperidin
3 结论
本研究以总黄酮提取量为参考指标,以乙醇溶液为提取剂,经过响应面优化得出最佳的提取条件为浸提温度57.61 ℃,乙醇体积分数为75%,浸提时间为35 min,预测总黄酮含量243.53 μg/mL。影响FRSOK得率的因素按照影响大小排序:乙醇体积分数>提取温度>提取时间。采用LC-MS技术分析FRSOK共有21种,其中新橙皮苷含量最高。本研究首次对橄榄仁红皮中的活性成分进行分析,结果表明FRSOK是一种新型的植物黄酮资源,组成丰富,具有一定的研究空间。目前,对橄榄仁红皮的研究较少,尤其是在分离提纯和活性探究的空间还很大,例如单一黄酮类化合物的提纯以及对提纯后提取物的抑菌活性、抗氧化、抗癌等方面的分析还有待深入研究。
[1] GOULAS V, PAPOTI V T, EXARCHOU V, et al.Contribution of flavonoids to the overall radical scavenging activity of olive (Olea europaea L.) leaf polar extracts[J].Journal of Agricultural and Food Chemistry, 2010, 58(6):3303-3308.
[2] UMENO A, TAKASHIMA M, MUROTOMI K, et al.Radical-scavenging activity and antioxidative effects of olive leaf components oleuropein and hydroxytyrosol in comparison with homovanillic alcohol[J].Journal of Oleo Science, 2015, 64(7):793-800.
[3] 张怡, 李玲望, 曾红亮, 等.橄榄汁保肝作用及其功效成分的研究[J].营养学报, 2012, 34(4):379-383.
ZHANG Y, LI L W, ZENG H L, et al.Studies on the effect of olive juice on protection of liver and its functional components[J].Acta Nutrimenta Sinica, 2012, 34(4):379-383.
[4] AHMAD GANAI S, AHMAD SHEIKH F, AHMAD BABA Z.Plant flavone Chrysin as an emerging histone deacetylase inhibitor for prosperous epigenetic-based anticancer therapy[J].Phytotherapy Research, 2021, 35(2):823-834.
[5] RUBEL S A, YU Z N, MURSHED H M, et al.Addition of olive (Olea europaea) leaf extract as a source of natural antioxidant in mutton meatball stored at refrigeration temperature[J].Journal of Food Science and Technology, 2021, 58(10):4002-4010.
[6] XIANG Z B, MO H Q, QU Z T, et al.Ellagic acid from the dried fruits of Canarium album with antihepatitis B activity[J].Asian Journal of Chemistry, 2011, 23(8):3759.
[7] ORTEGA-VIDAL J, COBO A, ORTEGA-MORENTE E, et al.Antimicrobial and antioxidant activities of flavonoids isolated from wood of sweet cherry tree (Prunus avium L.)[J].Journal of Wood Chemistry and Technology, 2021, 41(2-3):104-117.
[8] 包佳微, 刘婷婷, 张东杰, 等.黑小豆种皮中多酚的超声-微波协同萃取工艺及抗氧化活性研究[J].粮食与油脂, 2021, 34(6):59-63;67.
BAO J W, LIU T T, ZHANG D J, et al.Study on the extraction and antioxidant activity of polyphenols from black adzuki bean seed coat by ultrasonic-microwave synergistic technology[J].Cereals &Oils, 2021, 34(6):59-63;67.
[9] 徐赫, 李荣华, 夏岩石, 等.黄酮类化合物提取、分离纯化方法研究现状及展望[J].应用化工, 2021, 50(6):1677-1682.
XU H, LI R H, XIA Y S, et al.Research status and prospect of extraction and purification methods of flavonoids[J].Applied Chemical Industry, 2021, 50(6):1677-1682.
[10] 刘玉红. 超声强化提取橄榄叶中药用有效成分的研究[J].食品工程, 2015(3):21-24.
LIU Y H.Research of using ultrasound to intensify extraction officinal components from olive leaves[J].Food Engineering, 2015(3):21-24.
[11] CHENG M, DING L Q, KAN H F, et al.Isolation, structural elucidation and in vitro hepatoprotective activity of flavonoids from Glycyrrhiza uralensis [J].Journal of Natural Medicines, 2019, 73(4):847-854.
[12] 魏永生, 武讨龙, 徐思敏, 等.黄精植物多酚类物质的测定与提取工艺[J].咸阳师范学院学报, 2021, 36(4):37-40.
WEI Y S, WU T L, XU S M, et al.Determination and extraction of polyphenols from Polygonatum sibiricum red[J].Journal of Xianyang Normal University, 2021, 36(4):37-40.
[13] 张展适. 辣木叶中总黄酮超声提取工艺优化[J].广州化工, 2021, 49(15):93-95;173.
ZHANG Z S.Optimization of ultrasonic extraction technology of total flavonoids from leaves of moringaoleifera[J].Guangzhou Chemical Industry, 2021, 49(15):93-95;173.
[14] ![]() D,
D, ![]() H.Antioxidant activity of flavone C-glucosides determined by updated analytical strategies[J].Food Chemistry, 2011, 124(2):672-678.
H.Antioxidant activity of flavone C-glucosides determined by updated analytical strategies[J].Food Chemistry, 2011, 124(2):672-678.
[15] 李学玲, 许苑南, 龙佳敏, 等.黄果茄总黄酮的提取工艺优化与体外抗氧化活性研究[J].食品研究与开发, 2020, 41(23):143-149.
LI X L, XU Y N, LONG J M, et al.Study on optimization of extraction process and antioxidant activity of total flavonoids from Solanum xanthocarpum[J].Food Research and Development, 2020, 41(23):143-149.
[16] LIU F, OOI V E C, CHANG S T.Free radical scavenging activities of mushroom polysaccharide extracts[J].Life Sciences, 1997, 60(10):763-771.
[17] SMITH C A, WANT E J, O'MAILLE G, et al.XCMS:Processing mass spectrometry data for metabolite profiling using nonlinear peak alignment, matching, and identification[J].Analytical Chemistry, 2006, 78(3):779-787.
[18] 冼丽清, 李珊, 梁俭, 等.凌云白毫总黄酮提取工艺优化及其理化性质的初步探讨[J].粮食与油脂, 2021, 34(8):119-124;128.
XIAN L Q, LI S, LIANG J, et al.Optimization of extraction process and preliminary study on physicochemical properties of total flavonoids from Lingyun pekoe[J].Cereals &Oils, 2021,34(8):119-124;128.
[19] 刘文宇, 赵雨晴, 徐汉, 等.响应面法优化提取拳参黄酮的工艺研究[J].哈尔滨商业大学学报(自然科学版), 2021, 37(4):408-414.
LIU W Y,ZHAO Y Q,XU H, et al.Optimization of extraction process of Polygonum bistorta L.flavonoids by responsesurface methodology[J].Journal of Harbin University of Commerce(Natural Sciences Edition), 2021, 37(4):408-414.
[20] LIU L M, WANG Y T, ZHANG J C, et al.Advances in the chemical constituents and chemical analysis of Ginkgo biloba leaf, extract, and phytopharmaceuticals[J].Journal of Pharmaceutical and Biomedical Analysis, 2021, 193:113704.
[21] 许远, 魏和平, 吴彦, 等.响应面优化襄荷总黄酮提取及抗氧化研究[J].食品工业科技, 2015, 36(5):233-239.
XU Y, WEI H P, WU Y, et al.Study on optimization of extraction of total flavonoids from Zingiber strioatum by response surface methodology and its antioxidant activity[J].Science and Technology of Food Industry, 2015, 36(5):233-239.
[22] 周海玲, 马麟, 易智彪.基于三种体外抗氧化方法对白木香种子抗氧化能力的研究[J].中国医药导报, 2016, 13(22):12-15.
ZHOU H L, MA L, YI Z B.Study on antioxidant capacity of Aquilaria sinensis seeds by three antioxidant methods in vitro[J].China Medical Herald, 2016, 13(22):12-15.
[23] 田蜜, 李敦禧, 钱军, 等.响应面法优化提取腺叶桂樱叶的成分研究——总酚、总黄酮及DPPH自由基的清除活性[J].华中师范大学学报(自然科学版), 2018, 52(5):661-667.
TIAN M, LI D X, QIAN J, et al.Optimization of extraction for composition from Laurocerasus phaeosticta leaf by response surface methodology—total polyphenols, total flavonoids and DPPH radical scavenging activity[J].Journal of Central China Normal University (Natural Sciences), 2018, 52(5):661-667.
[24] SON N T, MAI THANH D T, VAN TRANG N.Flavone norartocarpetin and isoflavone 2’-hydroxygenistein:A spectroscopic study for structure, electronic property and antioxidant potential using DFT (Density functional theory)[J].Journal of Molecular Structure, 2019, 1193:76-88.
[25] XU F, ZANG J A, CHEN D Z, et al.Neohesperidin induces cellular apoptosis in human breast adenocarcinoma MDA-MB-231 cells via activating the Bcl-2/Bax-mediated signaling pathway[J].Natural Product Communications, 2012, 7(11):1475-1478.
[26] JIA S, HU X Y, ZHANG W N, et al.Hypoglycemic and hypolipidemic effects of neohesperidin derived from Citrus aurantium L.in diabetic KK-a(y) mice[J].Food &Function, 2015, 6(3):878-886.